
Wyznaczanie parametrów kinetyki reakcji enzymatycznej
za pomocą metod polarymetrycznych
Wprowadzenie
Inwertaza (sacharaza, β–fruktofuranozydaza) należy do hydrolaz i rozszczepia
wiązania β–glikozydowe w sacharozie tworząc glukozę i fruktozę. W trakcie hydrolizy
następuje zmiana kąta skręcenia roztworu. Wynika to stąd, że sacharoza jest prawoskrętna, a
mieszanina równych ilości glukozy i fruktozy lewoskrętna, gdyż wytworzona D–frukoza
silniej skręca w lewo niż D–fruktoza w prawo. Ponieważ następuje więc zmiana kąta
skręcenia płaszczyzny polaryzacji światła na przeciwny, hydrolizę sacharozy nazwano
inwersją, a enzym katalizujący tę reakcję inwertazą.
Szybkość reakcji i aktywność inwertazy określać można przez oznaczenie
wzrastającego stężenia cukrów redukujących (glukoza i fruktoza), ale wygodniejsze w użyciu
jest polarymetryczne określanie zmian stężenia substratów (sacharozy). Chcąc określić ilość
rozłożonej w danej chwili sacharozy, dokonuje się pomiarów kąta skręcalności badanego
roztworu. Zmierzony kąt α będzie wynikiem skręcenia płaszczyzny polaryzacji przez
wszystkie znajdujące się w tej chwili w roztworze związki optycznie czynne:
α = α
1
+ α
2
+ α
3
1.
natomiast:
α
= α
s
·l·C
s
/100
2.
α
2
= α
g
·l·C
g
/100
3.
α
3
= α
f
·l·C
f
/100
4.
gdzie:
αs, αg, αf - skręcalność właściwa sacharozy, glukozy i fruktozy;
l - długość rurki polarymetrycznej (grubość warstwy cieczy) w dm;
Cs, Cg, Cf - stężenia sacharozy, glukozy i fruktozy w g/100 ml.
Wzór (1) przyjmuje więc postać:
100
C
l
100
C
l
100
C
l
f
f
g
g
s
⋅
⋅
+
⋅
⋅
+
⋅
⋅
=
α
α
α
α
s
5.
W trakcie hydrolizy z określonej ilości sacharozy powstają równoważne wagowo (w sumie)
ilości glukozy i fruktozy, oznaczając więc przez C
0
stężenie wagowe sacharozy na początku
pomiarów, mamy:
C
0
= C
s
+ C
g
+ C
f
,
6.
a ponieważ C
g
= C
f
, więc:
C
0
= C
s
+ 2·C
g,
7.
wyliczając stąd Cg otrzymujemy:
C
C
C
2
g
0
s
=
−
Uwzględniając równość (7), równanie (5) przyjmie postać:
100
1
2
C
2
C
)
(
100
C
l
s
0
f
g
s
⋅
−
⋅
+
+
⋅
⋅
=
α
α
α
α
s
8.
Po przekształceniach otrzymujemy:
f
g
f
g
α
α
α
α
α
α
−
−
+
−
=
s
0
2
)
(
C
l
200
C
Ponieważ αs = +66,5º, αg = +52,7º a αf = -92,4º, wzór na zawartość sacharozy w dowolnej
chwili trwania hydrolizy ma postać:
C
s
= 1,16*(α/l)+0,23*C
0
Dla określonych warunków pomiarów, wartości l i C
0
są stałe, więc stężenie sacharozy będzie
zawsze proporcjonalne do wykazanego przez polarymetr kąta skręcenia. Pamiętać jednak
należy, iż przy wyprowadzaniu wzoru pomięto zupełnie mutarotację powstających
cukrowców.
Inwertaza (sacharaza, β–fruktofuranozydaza) należy do hydrolaz i rozszczepia
wiązania β–glikozydowe w sacharozie tworząc glukozę i fruktozę. W trakcie hydrolizy
następuje zmiana kąta skręcenia roztworu. Wynika to stąd, że sacharoza jest prawoskrętna, a
mieszanina równych ilości glukozy i fruktozy lewoskrętna, gdyż wytworzona D–frukoza
silniej skręca w lewo niż D–fruktoza w prawo. Ponieważ następuje więc zmiana kąta
skręcenia płaszczyzny polaryzacji światła na przeciwny, hydrolizę sacharozy nazwano
inwersją, a enzym katalizujący tę reakcję inwertazą.
Szybkość reakcji i aktywność inwertazy określać można przez oznaczenie
wzrastającego stężenia cukrów redukujących (glukoza i fruktoza), ale wygodniejsze w użyciu
jest polarymetryczne określanie zmian stężenia substratów (sacharozy). Korzysta się przy tym
z zależności wyprowadzonej w ćw. poprzednim.
Dokonując pomiarów początkowych szybkości reakcji dla różnych stężeń substratu,
można wyznaczyć stałą Michaelisa z wykresu Lineweavera-Burka. Stosowany zakres stężeń
substratów musi być oczywiście taki, aby szybkość reakcji wzrastała wraz ze wzrostem
stężenia (reakcja I rzędu). Przy nadmiarze substratu szybkość reakcji będzie stała (reakcja
zerowego rzędu), zależna tylko od niezmiennego w warunkach doświadczenia stężenia
enzymu.
Wykonanie doświadczenia
Przygotować 100 ml świeżego 10% roztworu sacharozy w buforze octanowym i do
50 ml roztworu dodać 0,1 ml roztworu inwertazy, wymieszać i szybko zmierzyć kąt
skręcenia. Pomiary powtarzać w 3, 6, 9 minucie doświadczenia.
Z pozostałej ilości świeżego 10% roztworu sacharozy sporządzić przez rozcieńczanie
5, 2,5 i 1,25% roztwory oraz przeprowadzić hydrolizę wobec takiej samej ilości enzymu.
Zanotować wyniki.
Opracowanie wyników
1. Wypełnić tabelę wyników dla każdego początkowego stężenia substratu:
Czas Skręcalność
α
Stężenie substratu C
s
Odchylenie
standardowe s
Współczynnik
zmienności W
Stężenie
produktu C
0
-C
s
Pomiar 1
Pomiar 2
średnia
0,5
3
6
9
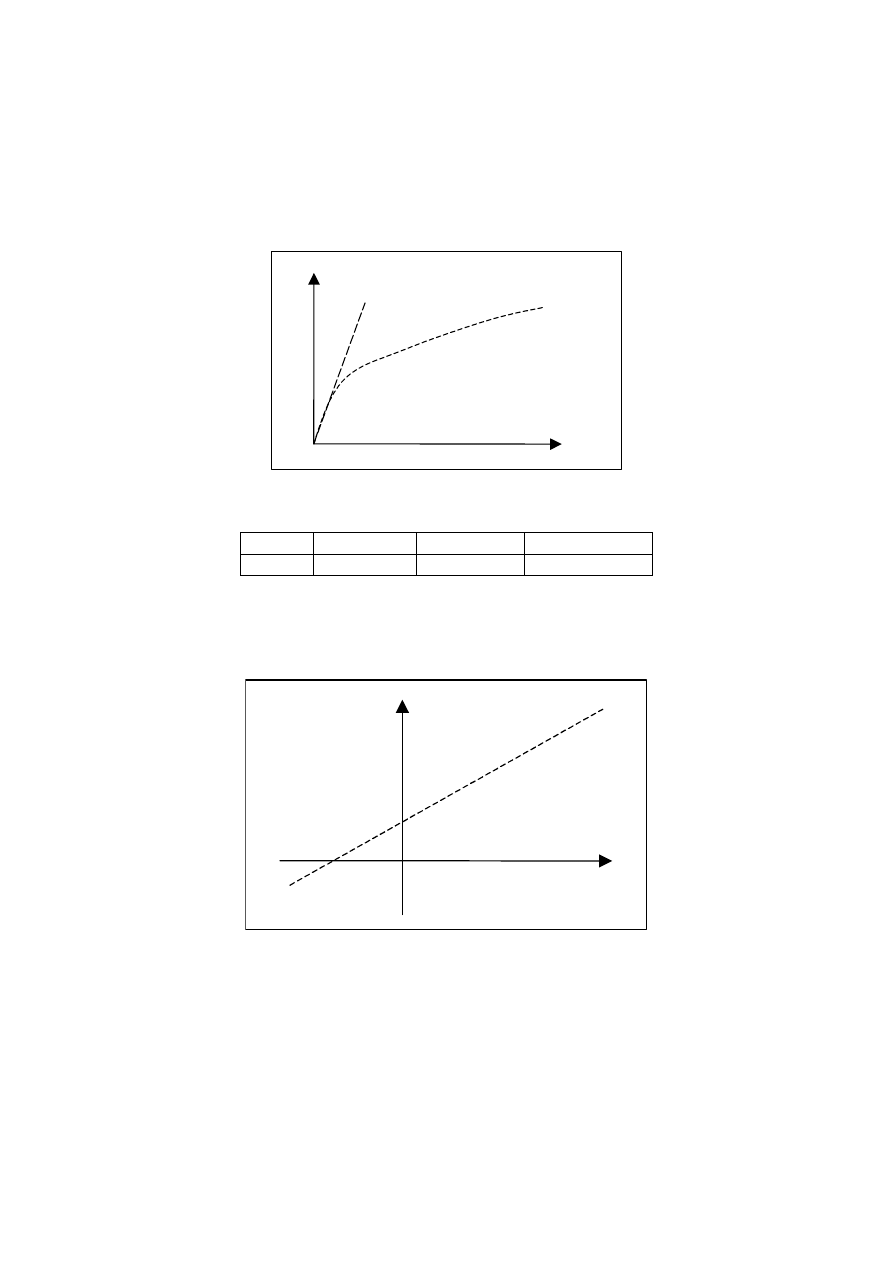
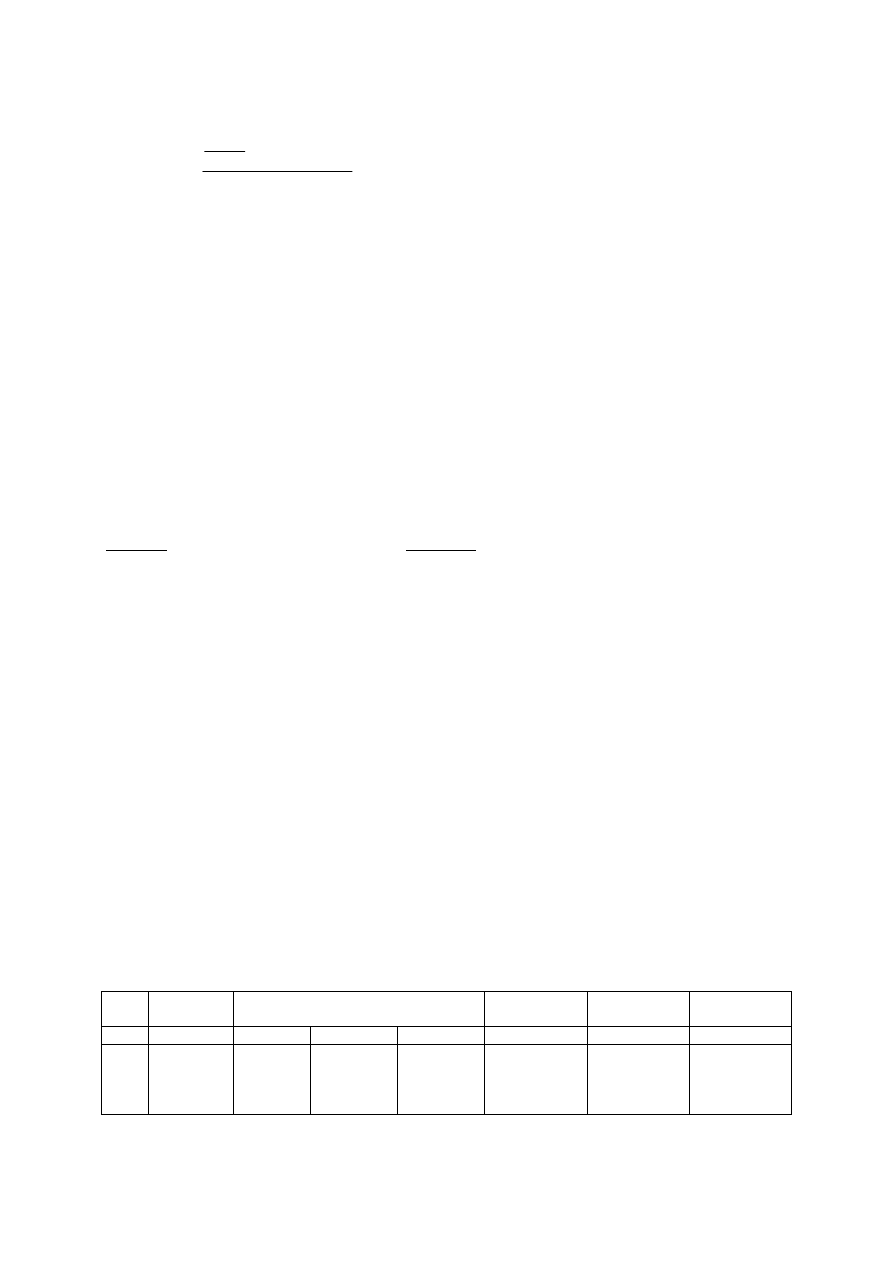
2. Dla każdego roztworu sacharozy wykreślić zależność ilości wytworzonego produktu (Co–
Cs) od czasu.
3. Na każdym wykresie poprowadzić styczną do krzywej w pkt. t = 0 i wyznaczyć szybkość
początkową reakcji równą tg α.
C
0
- C
S
t
C
0
- C
S
= f(t)
4. Wypełnić tabelę wyników dla każdego początkowego stężenia substratu:
Co
1/v
1/C
o
v
5. Wykreślić wykres zależności 1/v od 1/C
s
dla równania Lineweavera-Burka. Jako szybkość
reakcji należy wziąć szybkości początkowe wyznaczone wg pkt. 3.
1/v
1/C
S
-1/K
m
1/v
max
6. Na podstawie współczynników regresji liniowej wyznaczyć stałą Michaelisa K
m.
i
maksymalną szybkość reakcji v
max
.
5. Na podstawie wyznaczonych parametrów K
m.
i v
max
wyliczyć wartości szybkości reakcji
enzymatycznej v dla badanych stężeń początkowych sacharozy Co i sporządzić wykres
Michaelisa-Menten. Zaznaczyć na wykresie wartości K
m.
i v
max
.
6. We wnioskach przedstawić wyniki końcowe: wyznaczone K
m.
i v
max
oraz przedstawić
swoje uwagi i spostrzeżenia dotyczące otrzymanych wyników i wykonania oznaczenia.
Wyszukiwarka
Podobne podstrony:
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznej m poteraj
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
Oznaczanie aktywności katalazy i wyznaczanie szybkości początkowej reakcji enzymatycznejx
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
więcej podobnych podstron