
Kinetyka reakcji
enzymatycznej

V
0
– prędkość początkowa
• Szybkość reakcji zmierzona w najkrótszym czasie
po zmieszaniu enzymu z substratem.
• W tym czasie akumulują się zaledwie śladowe
ilości produktu.
• Szybkość początkowa jest więc szybkością reakcji
rozpatrywaną w określonym kierunku.
• Pomiar szybkości początkowej pozwala ocenić
ilość enzymu zawartego w próbce biologicznej.
• Miarą szybkości reakcji jest stosunek przyrostu
produktu do czasu, jest to tangens kąta α

V
max
– szybkość maksymalna reakcji
enzymatycznej
• Przy dużym stężeniu substratu
następuje
całkowite wysycenie enzymu
substratem.
• Szybkość reakcji jest wówczas
maksymalna
• Tylko ona może być miarą ilości
enzymu.
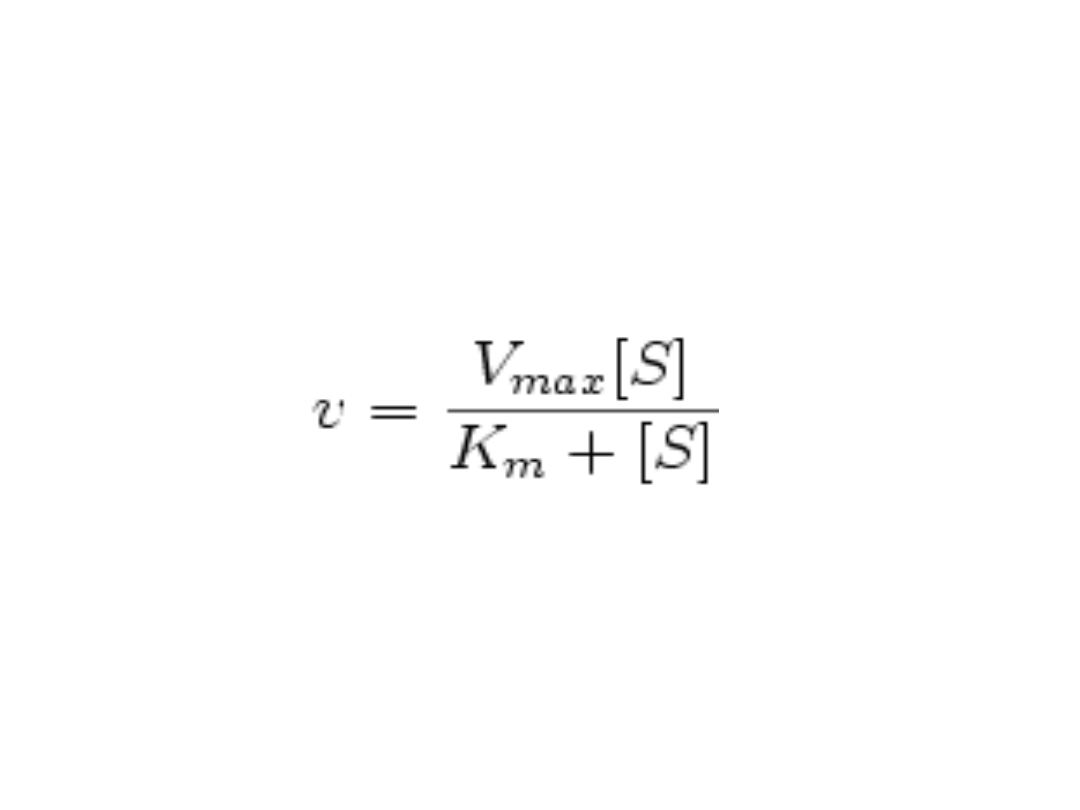
Równanie Michaelisa-
Menten
Wyraża matematyczną zależność pomiędzy
szybkością początkową reakcji V
0
i stężeniami
substratu [S]
Można je również napisać w postaci:
(Vmax-V0)(Km+[S])=Vmax*Km
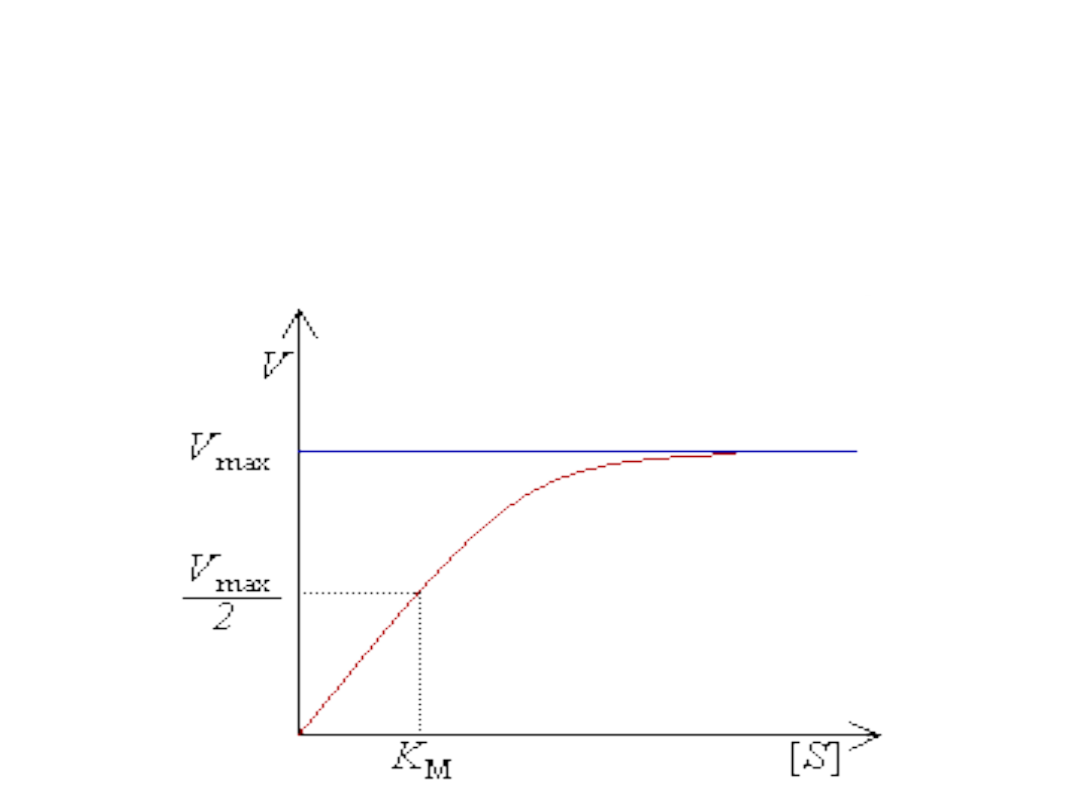
Wykres Michaelisa-Menten
Równanie M-M jest równaniem hiperboli i krzywa
zależności szybkości reakcji v od stężenia substratu
S wykreślona na podstawie tego równania przybiera
postać hiperboli.

Stała Michaelisa - K
m
• Jeżeli wartość [S]=Km, równanie M-M przybierze
postać v=v
max
/2, reakcja osiągnie połowę
szybkości maksymalnej.
• Można ją wyznaczyć graficznie z wykresu.
• Odpowiada stężeniu substratu przy jakim V
0
stanowi połowę szybkości maksymalnej
V
max
/2 osiągalnej przy danym stężeniu
enzymu => ma wymiar stężenia substratu.
• Wartości stałej Michaelisa wahają się w granicach
10
-2
do 10
-8
M (przeważnie 10
-3
-10
-5
)
• Charakteryzują one enzym w odniesieniu do
danego substratu określając liczbowo
powinowactwo enzymu do substratu.
• Małe wartości K
m
– duże powinowactwo
• Duże wartości K
m
– małe powinowactwo

• Oprócz graficznego wyznaczenia Km, do wyznaczenia tej
wartości można dojść także na drodze matematycznej
wychodząc z równania:
• W stanie równowagi szybkość tworzenia kompleksu ES
równoważy się z szybkością jego rozpadu:
V1=V2+V3

Wykres Lineweavera - Burka
• Bezpośredni pomiar wartości liczbowej V
max
i obliczenie Km często wymaga stosowania
bardzo stężonych roztworów substratu aby
uzyskać stan nasycenia, co w praktyce jest
niewygodne.
• Wykres L-B to LINIOWE przekształcenie
równania Michaelisa-Menten
.
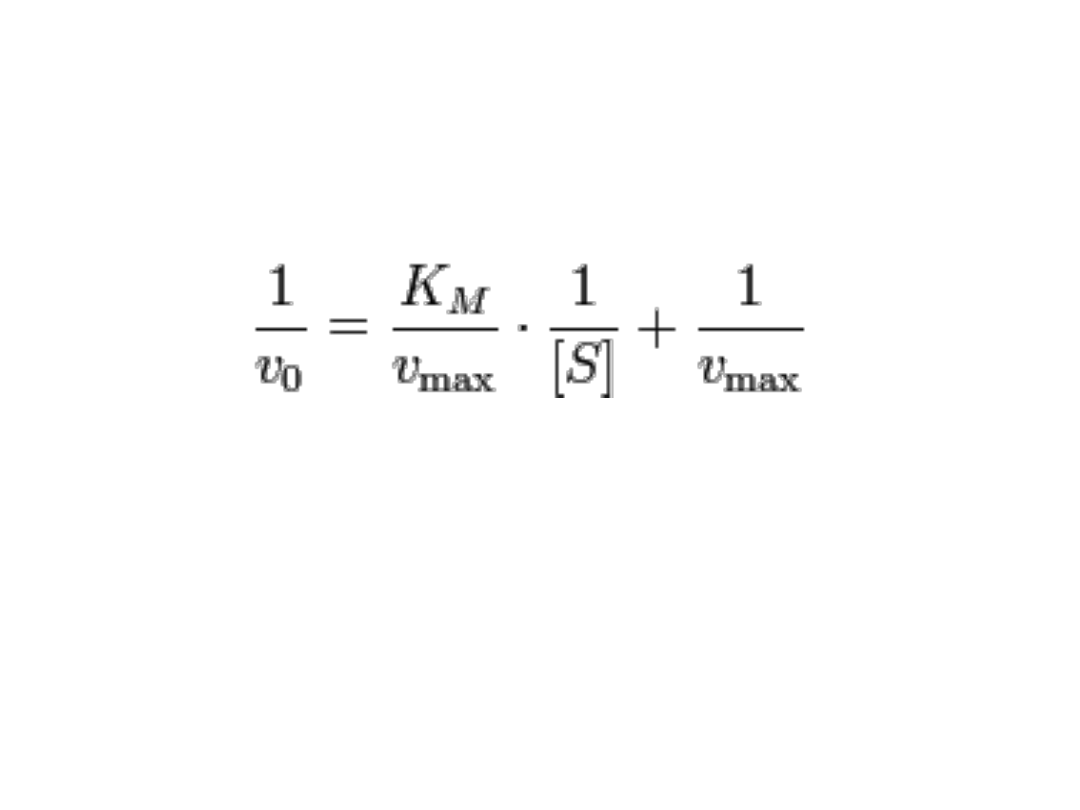
Przekształcenie ma na celu uzyskanie linii
prostej (y=ax+b). Wartości Km/Vmax i
1/Vmax są wielkościami stałymi stąd
zależność 1/Vo i 1/[S] jest linią prostą.
1/Vo = 1+(Km/[S])/Vmax
1/Vo= (1+ Km/[S])+1/Vmax
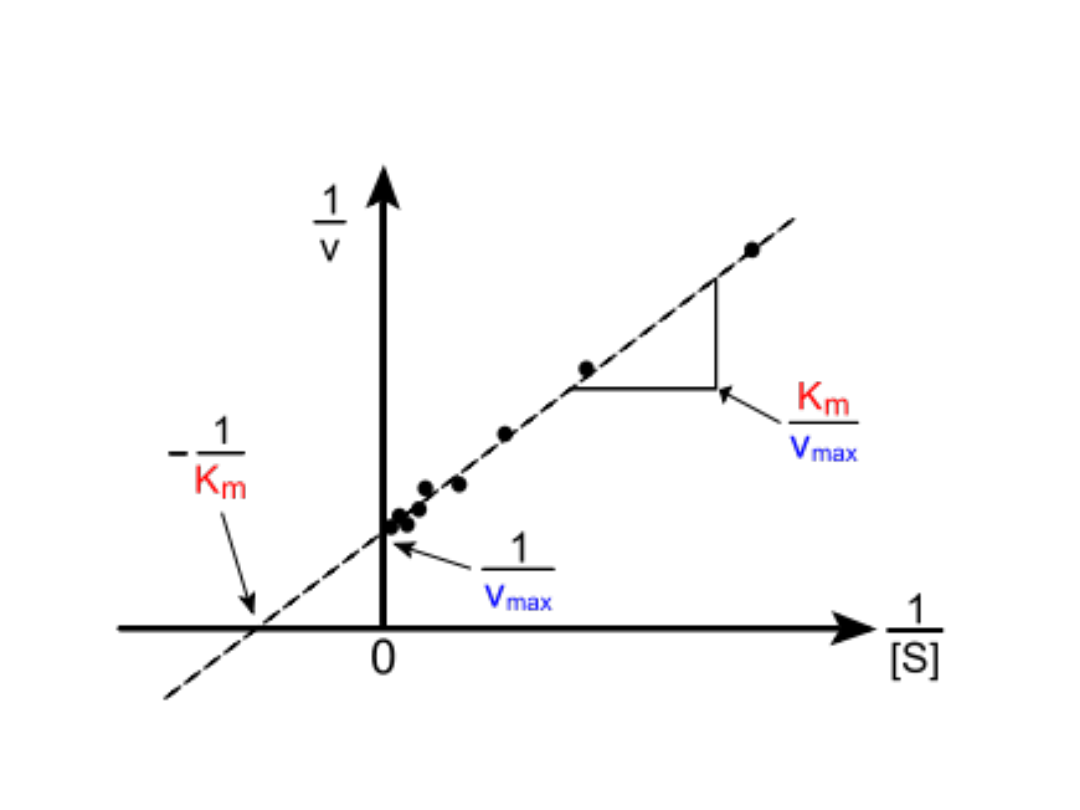
Rys. Wykres Lineweavera-
Burka
Document Outline
Wyszukiwarka
Podobne podstrony:
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
Kinetyka reakcji enzymatycznych
I Wyznaczanie parametrow kinetyki reakcji enzymatycznej polarymetr
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
rybiak,biologia i ekologia, Kinetyka reakcji enzymatycznych
więcej podobnych podstron