
Kinetyka reakcji
enzymatycznych

Budowa
• enzymy to głównie białka.
• masa cząsteczkowa pojedynczego łańcucha waha się od
9000 – 155000, kompleksu nawet do 6 ·10
6
.
W budowie wyróżniamy:
Apoenzym – część białkowa enzymu
Koenzym – grupa prostetyczna związana w sposób odwracalny
z częścią białkową (np. polisacharyd, lipid, kation metalu).
1. ENZYMY
1. ENZYMY
Enzymy są katalizatorami reakcji chemicznych
zachodzących w układach biologicznych.

•Oksydoreduktazy – enzymy biologicznego utleniania i redukcji
•Transferazy – enzymy przenoszące grupy
•Hydrolazy – enzymy katalizujące rozkład hydrolityczny
•Liazy – enzymy katalizujące reakcje eliminacji z
utworzeniem podwójnego wiązania, a także przyłączania
do podwójnego wiązania
•Izomerazy – enzymy katalizujące przekształcenia wewnątrz
cząsteczki
•Ligazy – enzymy tworzące wiązania z jednoczesnym
odszczepieniem ATP
KLASY
KLASY
ENZYMÓW
ENZYMÓW

Specyficzność enzymów – dotyczy zarówno substratu jak i
katalizowanej reakcji. Mówi nam o tym, która z kilku potencjalnie
możliwych reakcji chemicznych zostanie zrealizowana.
Centrum wiążące – określony rejon powierzchni enzymu, które
chemiczną budową, wielkością i kształtem jest komplementarne
do cząsteczki substratu.
Centrum aktywne – enzymu to obszar, który wiąże substraty
(i grupę prostetyczną jeżeli taka występuje) oraz
dostarcza reszt aminokwasowych tzw. grup katalitycznych
enzymu, biorących bezpośredni udział w tworzeniu
i zrywaniu wiązań.
Efektor
–
regulator aktywności enzymu.
Centrum allosteryczne - miejsce wiążące.

G
RT
G
e
v
k
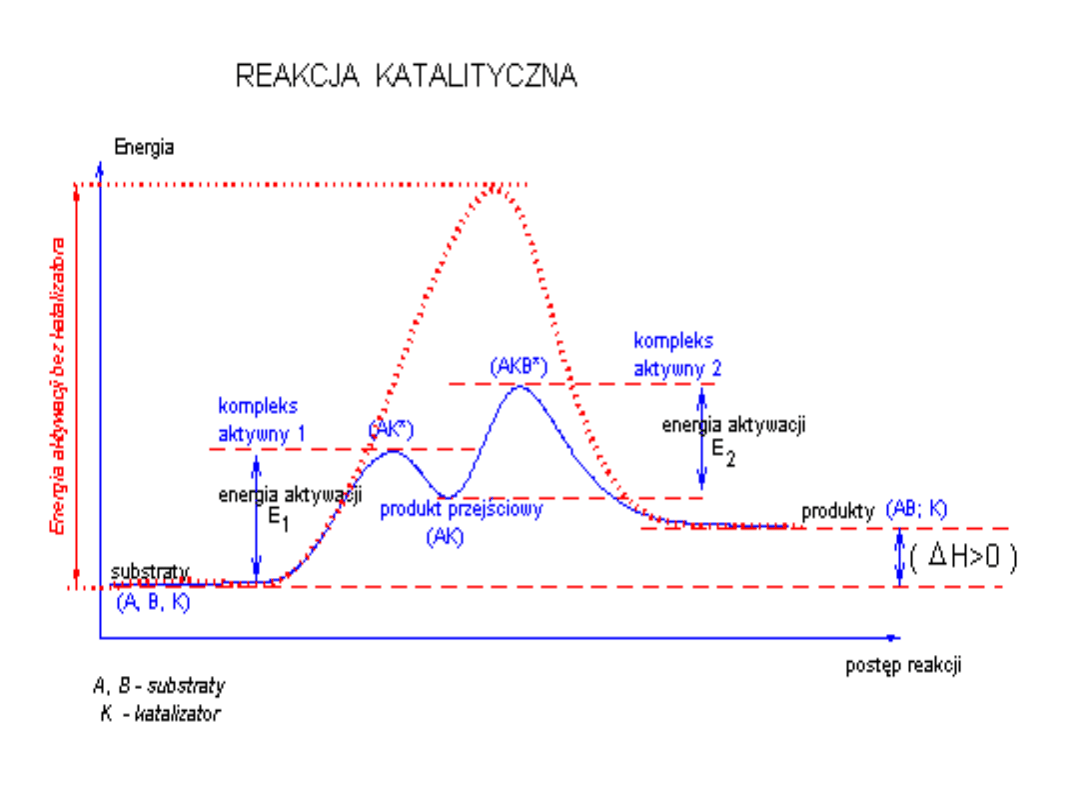
Energia aktywacji
- to różnica energii swobodnej
między stanem przejściowym a substratem. Minimalna
energia jaką musi posiadać substrat, aby mógł przereagować.
Stan przejściowy – stan o maksymalnej energii na wykresie
postępu reakcji. Dla reakcji enzymatycznych stanem
przejściowym jest kompleks enzym-substrat ES.
Stałą szybkości opisujemy wówczas równaniem:

2. KINETYKA
2. KINETYKA
Szybkość reakcji jest miara ilości zużywanych
substratów lub powstających produktów w jednostce
czasu. Opisujemy ją wzorem:
• Gdzie: - współczynniki stechiometryczne
reagentów
A- substraty
B- produkty
Doświadczalnie wyznaczone równanie tego typu nosi
nazwę równania kinetycznego, przyjmuje ono postać:
Współczynnik k nosi nazwę stałej szybkości reakcji.
dt
v
dc
dt
v
dc
r
B
B
A
A
B
A
v
v ,
...
b
a
B
A
k
v
Rząd reakcji względem danego składnika, to
wykładnik potęgi, do której podniesione jest
stężenie reagenta w równaniu kinetycznym.
Całkowity rząd reakcji to suma poszczególnych
rzędów
a + b +... w równaniu kinetycznym.
k
dt
dx
dt
da
v
x
kt
Reakcje rzędu zerowego
możemy opisać wzorem:
Postać całkową :

ka
dt
da
)
(
x
a
k
dt
dx
o
a
a
kt
o
ln
x
a
a
kt
o
o
ln
Reakcje pierwszego rzędu
możemy opisać wzorem:
lub
Postaci równań scałkowanych:
lub
)
)(
(
2
1
x
a
x
a
k
dt
dx
r
x
a
a
x
a
a
a
a
kt
2
1
1
2
2
1
ln
1
2
ka
dt
da
2
)
(
x
a
k
dt
dx
o
o
a
a
kt
1
1
x
a
a
x
kt
o
o
Reakcje drugiego rzędu
możemy opisać wzorem:
Postać całkowa:
Gdy a
1
= a
2
równanie przybiera postać:
lub
A postacie scałkowane:
lub
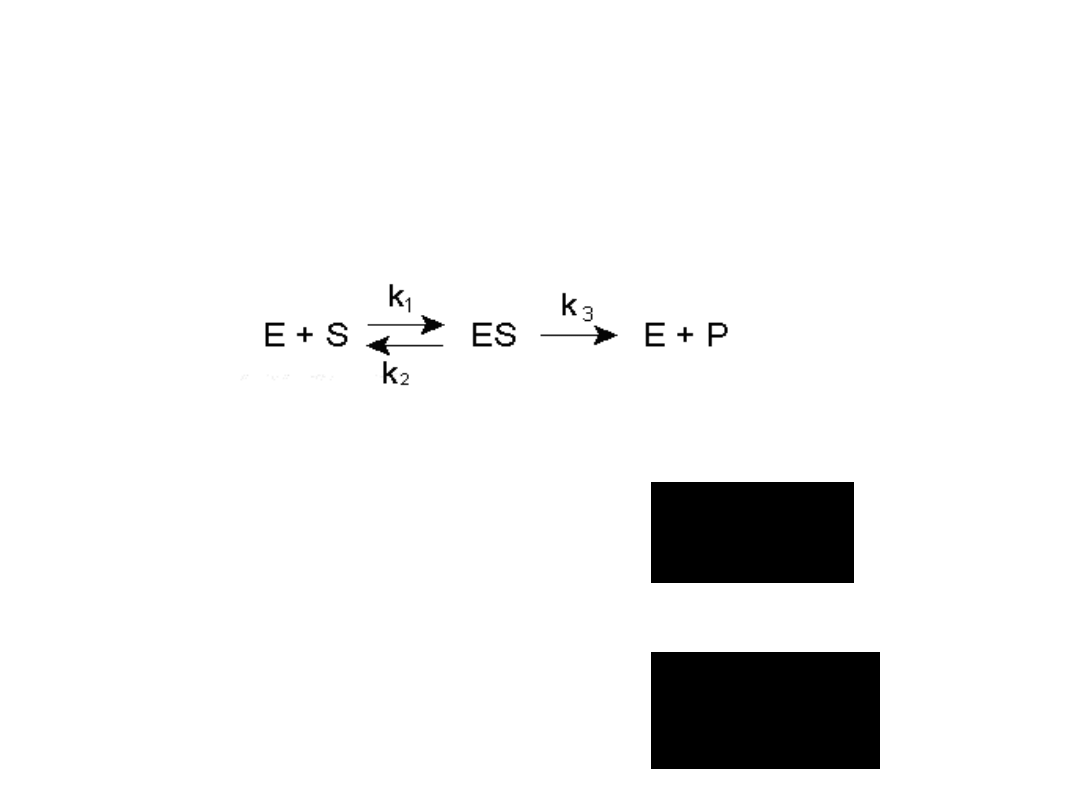
Teoria Michaelisa – Mentena
Zasadniczym jej założeniem jest konieczność
wytworzenia odwracalnego kompleksu między
enzymem a substratem
• równaniem Michaelisa – Menten
• stałą Michaelisa Km
]
[
]
[
max
0
S
K
S
V
V
m
1
3
2
k
k
k
K
m

k
3
E
S
k
1
k
2
ES
E
P
+
+
V = k
3
[ ES ]
ES
k
1
[ E ] [ S ]
=
(k
2
+ k
3
) [ ES ]
ES =
k
1
[ E ] [ S ]
(k
2
+ k
3
) [ ES ]
=
[ ES ] =
k
1
[ E ] [ S ]
(k
2
+ k
3
)

K
M
=
(k
2
+ k
3
)
k
1
[ ES ] =
[ E ] [ S ]
K
M
[ S ]
+K
M
V = V
max
[ S ]
RÓWNANIE MICHAELISA - MENTEN
RÓWNANIE MICHAELISA - MENTEN
ZNACZENIE WARTOŚCI K
ZNACZENIE WARTOŚCI K
M
M
ORAZ V
ORAZ V
MAX
MAX
1. Dla większości enzymów K
M
mieści się w przedziale od10
-1
do 10
-7
M
2. K
M
zależy od substratu, a także warunków zewnętrznych takich jak:
temperatura i siła jonowa
3. K
M
oznacza takie stężenie substratu, w którym połowa miejsc
aktywnych jest obsadzona. Kiedy znamy wartość K
M
możemy
obliczyć ułamek obsadzonych miejsc dla każdego stężenia
substratu
M
MAX
ES
K
S
S
V
V
f
]
[
]
[
MODEL MICHAELIS’A-MENTEN
MODEL MICHAELIS’A-MENTEN

Znaczenie parametru K
m
• K
m
(stała Michaelisa) opisuje
tworzenie i rozpad kompleksu ES
• jest miarą powinowactwa enzymu do
substratu
• niska wartość K
m
– silne
powinowactwo enzymu do substratu
• wysoka wartość K
m
– słabe
powinowactwo enzymu do substratu
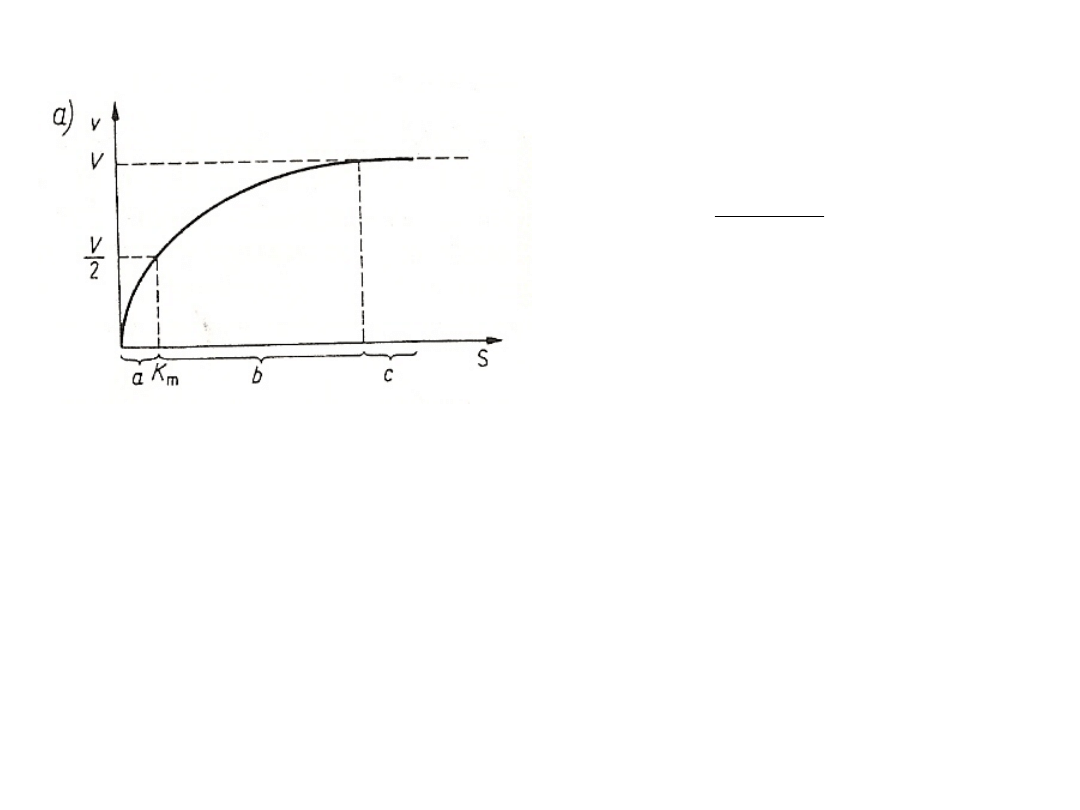
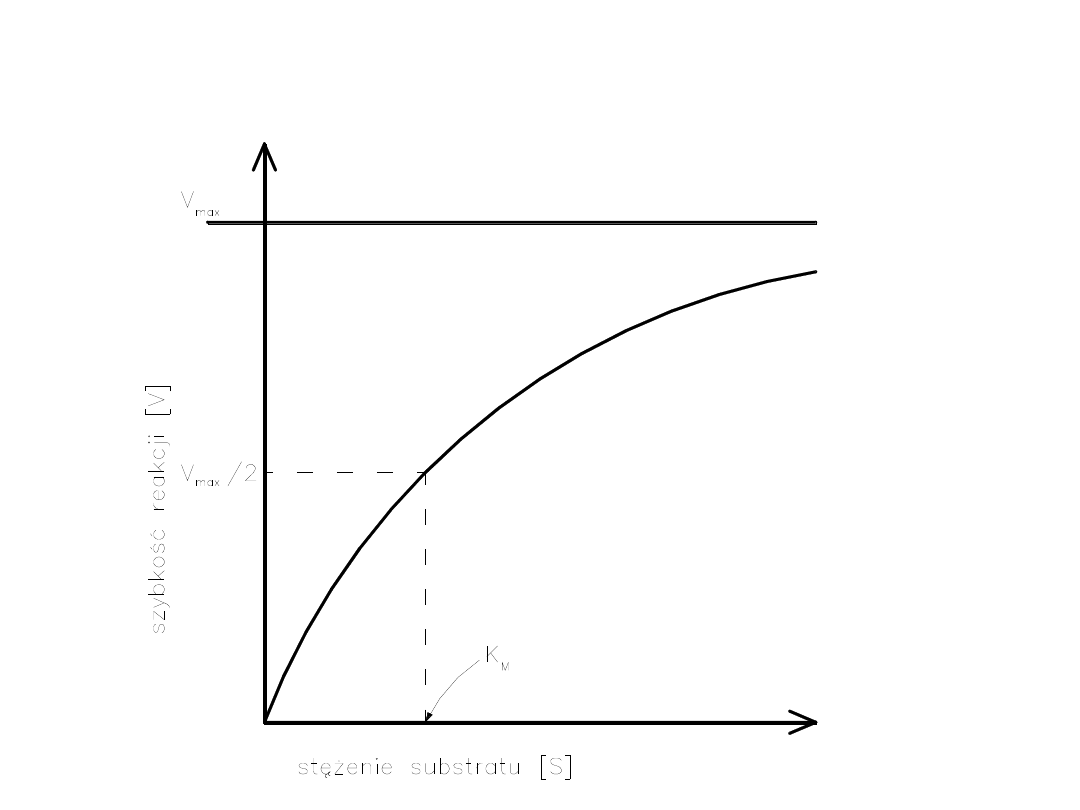
Kinetyka pierwszego rzędu Kinetyka
zerowego rzędu
v- szybkość reakcji, k' - jednocząsteczkowa stała szybkości.
Wpływ stężenia substratu na
szybkość reakcji przy stałym
stężeniu enzymu - krzywa wg
Michaelisa-Menten.
V- szybkość maksymalna, S - stężenie
substratu, Km - stała Michaelisa-Menten,
a - reakcja pierwszego rzędu, b - reakcja
o mieszanej kinetyce, c - reakcja
zerowego rzędu .
B
A
]
[
' A
k
v
'
max
k
V
v
]
[
]
[
max
S
K
S
V
v
M
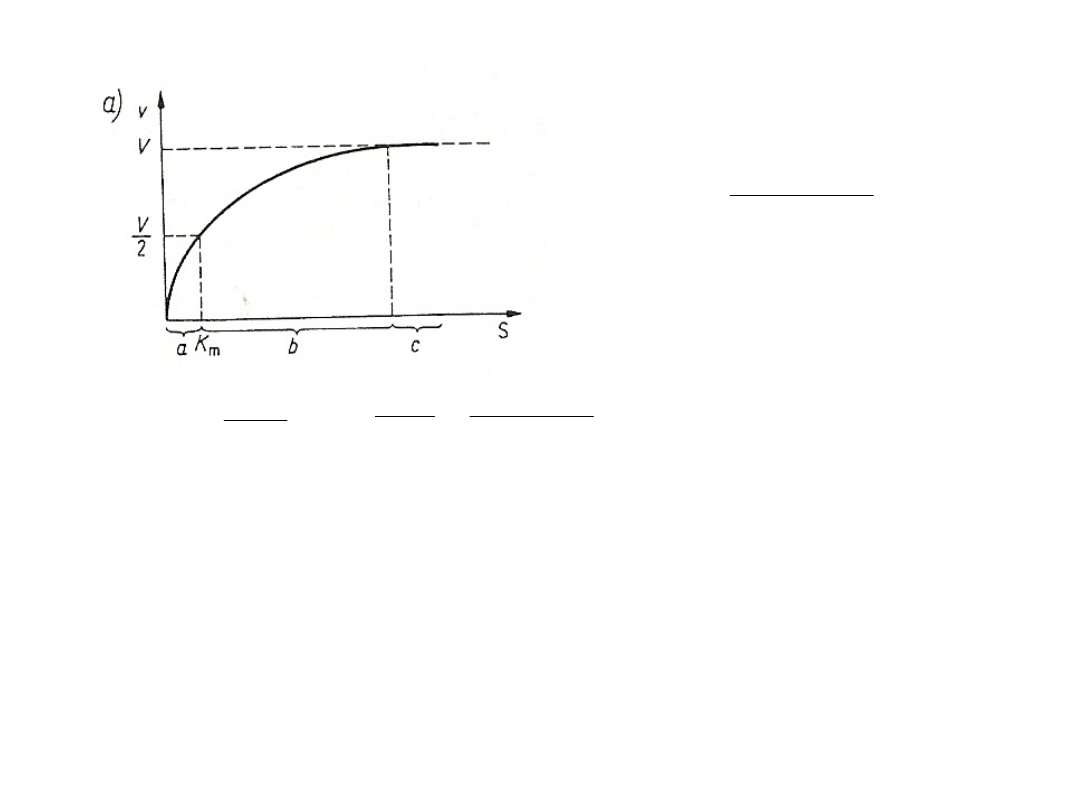
Gdy to:
więc:
Stała Michaelisa-Menten
jest to stężenie substratu (mol/dm3), przy którym
szybkość reakcji enzymatycznej jest równa połowie jej
szybkości maksymalnej.
]
[
]
[
max
S
K
S
V
v
M
2
max
V
v
]
[
]
[
2
max
max
S
K
S
V
V
M
]
[S
K
M
M
K
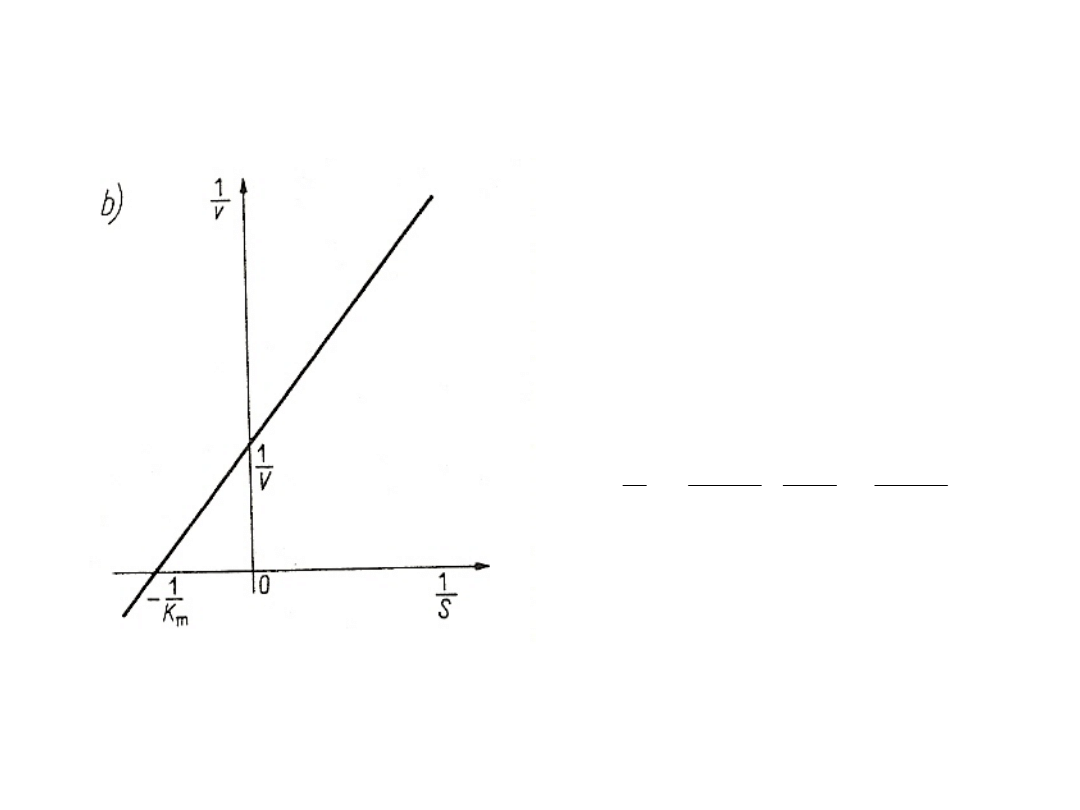
Wpływ stężenia substratu
na szybkość reakcji przy
stałym stężeniu enzymu -
krzywa wg Lineweavera-
Burka.
max
max
1
]
[
1
1
V
S
V
K
v
M
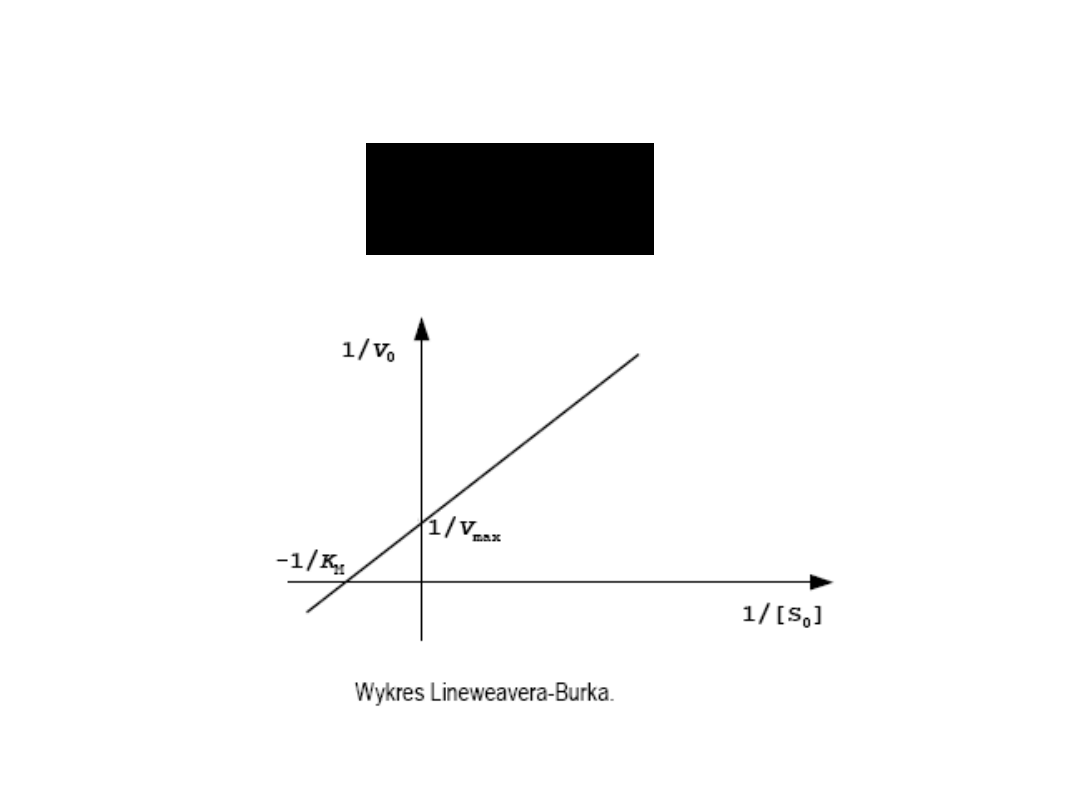
Teoria Lineweavera – Burka
V
S
V
K
v
m
1
]
[
1
1

Pomiar aktywności enzymu – polega na określeniu
albo zaniku substratu, albo powstania produktu w
zależności od czasu. Aby wyznaczyć aktywność
enzymu należy więc zmierzyć szybkość reakcji.
Jednostka aktywności enzymatycznej – katal; 1
katal (kat) wywołuje w określonych warunkach reakcji
przemianę 1 mola substancji w ciągu jednej sekundy.
Liczba obrotów – określa liczbę cząstek substratu,
które w jednostce czasu (minuta lub sekunda) ulegają
przekształceniu przez jedną cząstkę enzymu.
KINETYKA REAKCJI ENZYMATYCZNEJ - POJĘCIA
KINETYKA REAKCJI ENZYMATYCZNEJ - POJĘCIA

Jednostki enzymatyczne
• jednostka enzymatyczna U
• Katal [kat]
nanokat
U
mol
67
,
16
1
min
1
1

EA KJ/mol
T1/2
62,7
0,07 s
83,6
14 s
104,5
19 godz
124,5
38 godz
sacharoza = D-glukoza + D-fruktoza
a) HCl 0,1 N, 300C, EA 109 kJ/mol, 24 godziny
b) Inwertaza, 10U, 300C, EA 46 kJ/mol, 3 minuty
Enzymy Kinetyka reakcji
Wpływ temperatury
Współczynnik temp.
Reakcje chemiczne, katalizatory
Q
10
= 2-3
biokatalizatory Q
10
= 1-2
0
2
4
6
8
10
12
1. Kw
2. Kw 3. Kw 4. Kw
30 C
40 C
80 C
1kw 1min; 2 kw 2 min; 3 kw 4 min; 4 kw 8 min
Enzym Lipaza
Substrat octan fenylowy
Produkt kwas octowy i fenol
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznej m poteraj
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
Kinetyka reakcji enzymatycznych
I Wyznaczanie parametrow kinetyki reakcji enzymatycznej polarymetr
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
rybiak,biologia i ekologia, Kinetyka reakcji enzymatycznych
06 Kinetyka reakcji enzymatycznych
więcej podobnych podstron