
Chemia - w3
Rozpuszczalność substancji
i
rodzaje roztworów

Roztwory
Roztwór
– jednorodny, jednofazowy
układ dwu - lub więcej składnikowy,
w którym substancja rozpuszczona
występuje w dyspersji (rozdrobnieniu)
molekularnej.

Roztwory
●
Ze względu na stan skupienia rozróżnia się
roztwory:
–
gazowe,
–
ciekłe,
–
stałe

Roztwory
Składnik roztworu będący w przewadze
ilościowej nosi nazwę
rozpuszczalnika
,
pozostałe składniki są rozpatrywane jako
substancje rozpuszczone
.

Roztwory - przykłady
ciało stałe w cieczy: sól kuchenna w wodzie
ciecz – ciecz: metanol w wodzie

Roztwory
Jako rozpuszczalniki ciekłe stosowane są
najczęściej:
1) ciecze nieorganiczne: woda, ciekły amoniak
(rozpuszczalnik elektrolitów),
2) ciecze organiczne np. alkohol, eter, estry
(rozpuszczalnik polarnych związków
organicznych).
3) ciecze organiczne np. benzen, ksylen
(rozpuszczalnik substancji niepolarnych).
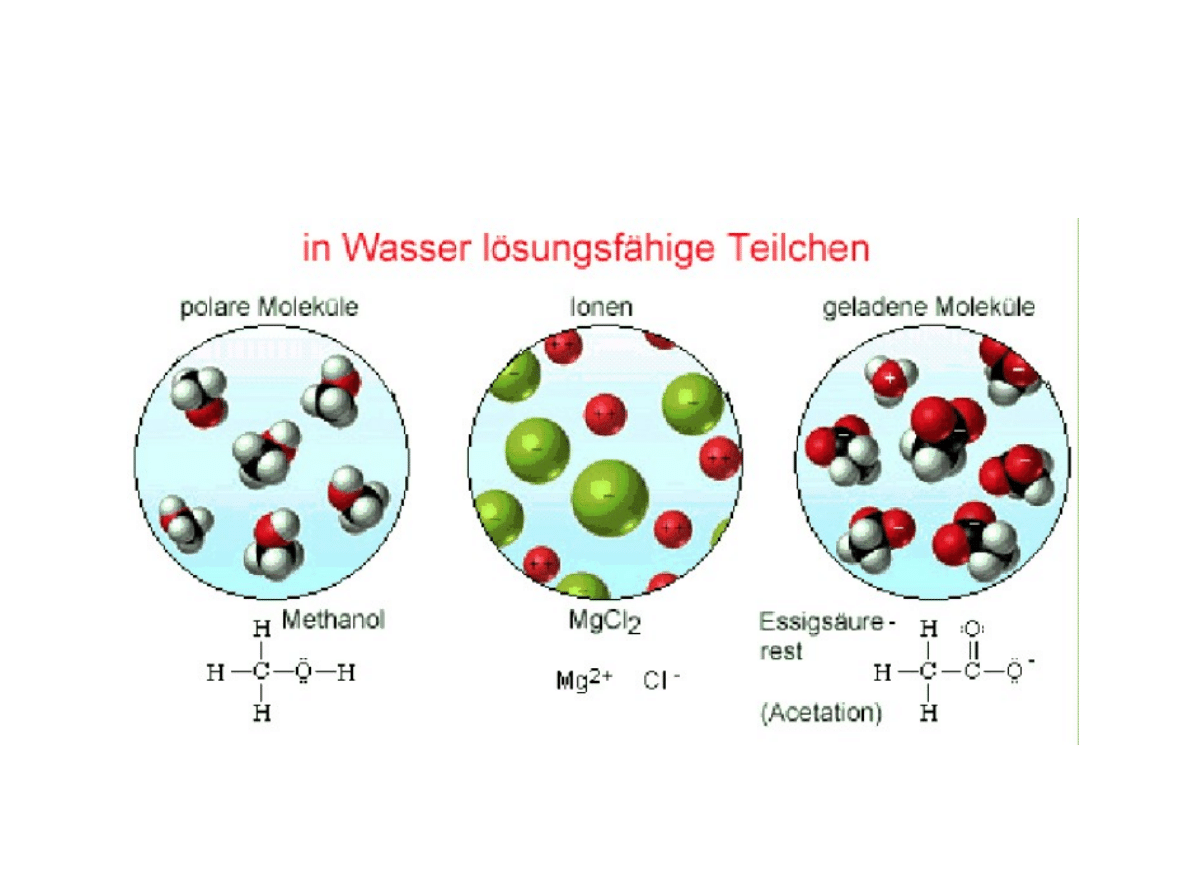
Roztwory

Roztwory
●
W zależności od charakteru związku (wiązań
między atomami) występują różne
oddziaływania między wodą
(rozpuszczalnikiem) i substancją rozpuszczoną:
–
w przypadku elektrolitów: oddziaływania
elektrostatyczne, tworzenie jonów na skutek
dysocjacji elektrolitycznej, np. MgCl
2
–
w przypadku nieelektrolitów:
„rozproszenie”substancji w rozpuszczalniku,
np. metanol, cukier
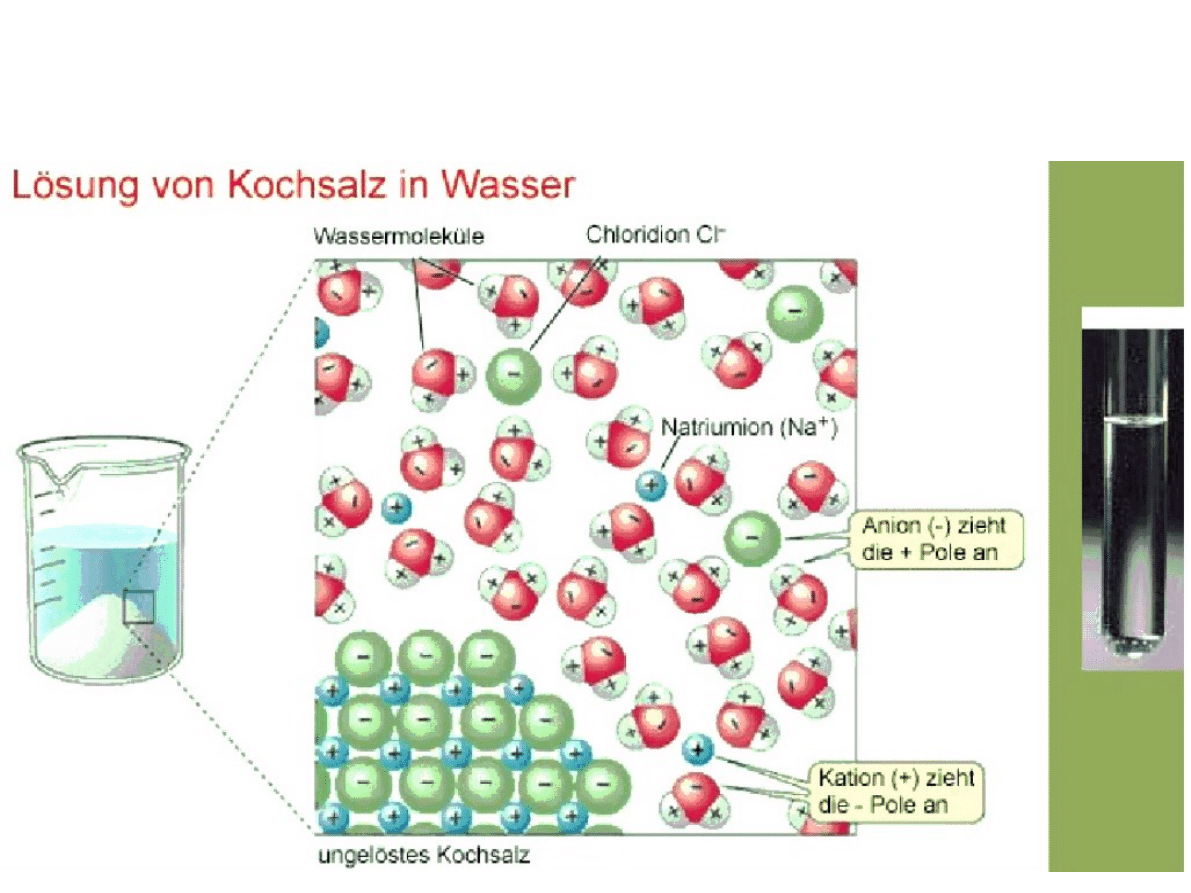
Roztwory

Roztwory

Roztwory
Roztwór nasycony
– roztwór substancji
pozostający w równowadze z osadem tej
substancji.

Roztwory
Rozpuszczalność (substancji)
– ilość gramów
danej substancji, która w danej temperaturze
może rozpuścić się w 100 g rozpuszczalnika,
dając roztwór nasycony

Roztwory
Stężenie roztworu – ilość substancji
rozpuszczonej w określonej ilości
(najczęściej objętości) roztworu.

Roztwory
Roztwór mianowany
– titrant, roztwór
odczynnika chemicznego o znanym stężeniu.
Dokładne ustalenie stężenia roztworu
mianowanego (tzw. nastawianie miana, czyli
inaczej mianowanie roztworu) odbywa się za
pomocą substancji podstawowych lub innych
roztworów mianowanych.

Roztwory
Istnieje wiele sposobów wyrażania stężenia
roztworów. Różnią się one między sobą tylko
jednostkami, w których podaje się ilości
substancji rozpuszczonej, rozpuszczalnika lub
roztworu.

Roztwory
W praktyce chemicznej stężenia roztworów
wyraża się najczęściej:
●
w procentach (%) - wagowych, objętościowych
●
w molach na 1 dm
3
roztworu (stężenie molowe,
mol/dm
3
, M)
●
w jednostkach masy/objętość: kg/l; g/ml

jednostki
1 litr (1 l) = 1 dm
3
1 mililitr (1 ml) = 1 cm
3

Stężenie procentowe
Stężenie procentowe - wyraża procentową
zawartość substancji rozpuszczonej w
stosunku do
roztworu
. W sposób
uproszczony określa się ją jako ilość gramów
substancji rozpuszczonej w 100 g roztworu.
Cp = M
subst.
/ M
roztw.
* 100 [%]

Stężenie procentowe
Ze względów praktycznych stosuje się
czasem określenie stężenia procentowego
wagowo/objętościowego, jako stosunku
masy substancji rozpuszczonej do objętości
roztworu
(ilość gramów substancji w 100 ml
roztworu) lub stężenia
objętościowo/objętościowego, czyli ilości
mililitrów substancji rozpuszczonej w 100ml
roztworu.
Cp = M
subst.
/ V
roztw.
* 100 [%]

Stężenie procentowe
Stężenie procentowe roztworu Cp jest określane
liczbą jednostek wagowych (mg, g, kg, Mg)
substancji rozpuszczonej zawartych w 100
jednostkach wagowych (mg, g, kg, Mg) roztworu.

Stężenie procentowe
Przykład:
roztwór 20%-owy jest to roztwór zawierający 20 jednostek
wagowych (mg, g, kg, Mg) substancji rozpuszczonej w 100
jednostkach wagowych (mg, g, kg, Mg)
roztworu
, czyli jest to
roztwór powstały ze zmieszania 20 jednostek wagowych (mg, g,
kg, Mg) substancji z 80 jednostkami wagowymi (mg, g, kg, Mg)
rozpuszczalnika

Stężenie procentowe
Związek między stężeniem procentowym roztworu Cp, liczbą
jednostek wagowych substancji rozpuszczonej a oraz liczbą
jednostek rozpuszczalnika b wyprowadza się w następujący
sposób: jeżeli w a + b jednostek wagowych roztworu znajduje
się a jednostek wagowych substancji rozpuszczonej, to w 100
jednostkach wagowych roztworu znajduje się Cp jednostek
wagowych substancji rozpuszczonej, czyli;
a + b j.wag. roztworu - a j. wag. substancji
100 j.wag.roztworu - Cp j. wag. substancji
Z powyższego otrzymujemy wzór na stężenie procentowe
Cp = a * 100 % / (a+b)

Stężenie procentowe
Przykład 1
Oblicz stężenie procentowe roztworu otrzymanego ze zmieszania
20 g soli NaCl i 140 g wody.
Rozwiązanie:
Masa roztworu jest sumą masy substancji rozpuszczonej i masy
rozpuszczalnika:
20 g + 140 g = 160 g
Stąd możemy zapisać że:
w 160 g roztworu znajduje się 20 g NaCl
a w 100 g roztworu znajduje się x g cukru
x = 20*100 / 160 = 12,5 g
W 100 g otrzymanego roztworu znajduje się 12,5 g NaCl, a więc
roztwór jest 12,5% - owy

Stężenie procentowe
Przykład 2
Do 30 g 60%-owego roztworu dodano 50 g wody. Oblicz stężenie
procentowe otrzymanego roztworu.
Rozwiązanie:
Po dodaniu do roztworu wody jego stężenie zmniejszy się, ale
masa substancji rozpuszczonej pozostanie bez zmiany.
Należy więc obliczyć masę substancji znajdującej się w 30 g 60%
-owego roztworu:
100 g roztworu zawiera 60 g substancji
30 g roztworu zawiera x g substancji
x = 30*60 / 100 = 18 g
Masa roztworu po dodaniu wody wynosi: 30 g + 50 g = 80 g.
Po rozcieńczeniu:
80 g roztworu zawiera 18 g substancji
100 g roztworu zawiera x g substancji
x = 18*100 / 80 = 22,5 g
Otrzymany roztwór jest 22,5%-owy

Stężenie molowe
●
Stężenie molowe – określa ilość moli substancji
rozpuszczonej w 1 l roztworu.
●
Obliczamy je dzieląc masę substancji rozpuszczonej,
zawartej w 1 l roztworu, przez jej masę cząsteczkową.

Stężenie molowe
●
Mol
– jest to liczebność materii występująca,
gdy liczba cząstek (elementów) układu jest
równa liczbie atomów zawartych w masie 12 g
węgla
12
C (równa liczbie Avogadro - 6,023·10
23
elem
entów).

Stężenie molowe
●
Masa atomowa
– średnia masa atomowa danego
pierwiastka; uwzględnia występujące naturalnie
izotopy (ich masy i procentowy udział w pierwiastku).
Suma mas atomowych wszystkich atomów tworzących
cząsteczkę stanowi jej masę cząsteczkową. Jednostką
masy atomowej (cząsteczkowej) jest 1 dalton, czyli
masa 1/12 atomu izotopu węgla
12
C.

Stężenie molowe
●
Masa molowa (cząsteczkowa)
= suma mas
atomowych poszczególnych pierwiastków tworzących
cząsteczkę, np.
–
M
NaCl
= M
Na
+ M
Cl
–
M
Na
= 23; M
Cl
= 35,5
–
M
NaCl
= 23 + 35,5 = 58,5

Stężenie molowe
●
Najczęściej spotykany sposób wyrażenia stężenia.
Ponieważ w każdym molu jest taka sama ilość
cząsteczek (liczba Avogadro), substancje reagują ze
sobą w takich proporcjach (jeśli ich ilości wyrazimy w
molach) w jakich występują cząsteczki reagujących
związków w zapisie stechiometrycznym reakcji, np.:
2 NaHCO
3
——> Na
2
CO
3
+ H
2
O + CO
2

Stężenie molowe
•
2 NaHCO
3
——> Na
2
CO
3
+ H
2
O + CO
2
• Z zapisu reakcji wynika, że z każdych dwóch cząsteczek
kwaśnego węglanu sodu powstaje (pod wpływem
ogrzewania) cząsteczka węglanu sodu, cząsteczka wody i
cząsteczka ditlenku węgla.
●
Oznacza to równocześnie, że z dwóch moli kwaśnego
węglanu sodu (168 g) powstanie 1 mol węglanu sodu (106 g),
jeden mol wody (18 g) i jeden mol ditlenku węgla (44 g; 22,4 l
w warunkach normalnych)

Stężenie molowe
Stężenie molowe roztworu (Cm) jest liczbą moli
substancji rozpuszczonej w
1 dm
3
roztworu

Stężenie molowe
Przykład
Roztwór 1 molowy jest to roztwór, który w 1 dm
3
roztworu zawiera
1 mol substancji (definicja mola).
Stężenie molowe możemy wyrazić wzorem
Cm = n / V
gdzie; n - ilość moli składnika, V - objętość roztworu
Ilość moli składnika n możemy obliczyć z wzoru
n = m / M
gdzie: m - masa substancji, M - masa molowa substancji

Stężenie molowe
Przykład c.d.
Wstawiając wyrażenie na n do wzoru na Cm otrzymamy
Cm = m / (M * V)
Przy obliczaniu stężeń molowych możemy korzystać z wzorów na
stężenie molowe Cm lub z równań na proporcję

Stężenie molowe
Przykład 1
Ile gramów NaOH znajduje się w 300 cm
3
0,1 molowego roztworu?
Rozwiązanie
Obliczamy masę molową M
NaOH
- wynosi ona 40 g/mol. Ponieważ
roztwór jest 0,1 molowy, to 0,1 mola NaOH ma masę: 0,1 mola x
40 g/mol = 4 g. To oznacza, że
w 1 dm
3
roztworu znajduje się 4 g NaOH.
Układając równania na proporcję możemy napisać
w 1000 cm
3
0,1 molowego znajduje się 4 g NaOH
a w 300 cm 3 0,1 molowego roztworu zawiera x g NaOH
x = 4 x 300 / 1000 = 1,2 g NaOH

Stężenie molowe
Rozwiązanie z wykorzystaniem wzoru
W celu obliczenia masy NaOH wzór na Cm przekształcamy i
otrzymujemy postać, która pozwala nam obliczenie masy NaOH.
m = Cm*M*V
stąd wstawiając do wzoru dane otrzymamy.
m
NaOH
= 0,1 mol/dm
3
* 40 g/mol * 0,3 dm
3
= 1,2 g NaOH
W 300 dm
3
0,1 molowego roztworu NaOH znajduje się 1,2 g NaOH
Uwaga:
Korzystając z równań na proporcję jak i z wzoru należy
pamiętać o zastosowaniu właściwych jednostek. Jeżeli nie są
zgodne, dokonujemy przeliczeń.
Wyszukiwarka
Podobne podstrony:
(CHEMIA WYKLAD 3)id 1241 Nieznany
(CHEMIA WYKLAD 6)id 1242 Nieznany (2)
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
Chemia Wyklad 4c id 111678
Chemia Wyklad 4b id 111677
Chemia wyklady 2007 2008(1) id Nieznany
CHEMIA SA,,DOWA WYKLAD 4 id 11 Nieznany
chemia zywnosci wyklady id 1130 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
Badania operacyjne wyklad 2 id Nieznany
historia gospodarcza wyklady id Nieznany
chemia zadania 2 id 113035 Nieznany
Metodologia nauk spolecznych wyklad id 294758
Chemia Wykład 6
AF wyklad1 id 52504 Nieznany (2)
więcej podobnych podstron