
Grupa 1
1) Wyjaśnić teorie twardych/miękkich kwasów/zasad.
Moc danego kwasu Lewisa zależy nie tylko od jego indywidualnych własności lecz także od zasady
z którą ten kwas reaguje. Oznacza to że stałe równowagi reakcji:
A + :B <=> A:B
K=cA:B/cA. c:B
zależą od własności obu parametrów A i :B. Podjęto więc próby określenia w sposób empiryczny
tych cech kwasów i zasad Lewisa, na podstawie których można by sądzić czy dany kwas lub
zasada okażą się mocniejsze lub słabsze w danej reakcji kwasowo-zasadowej. Okazało się, że
można wyróżnić dwie grupy, z punktu widzenia wzajemnego powinowactwa, kwasów i dwie
grupy zasad. w roku 1963 Pearson nazwał je kwasami lub zasadami twardymi i kwasami lub
zasadami miękkimi i określił regułę według której twarde kwasy łączą się najchętniej z twardymi
zasadami i odwrotnie. Granica pomiędzy miękkimi i twardymi kwasami czy zasadami nie jest
ściśle określona dlatego też wyróżnia się też grupę kwasów/zasad o charakterze pośrednim.
Ogólnie twarde kwasy czy zasady charakteryzują się małą polaryzowalnością i małymi rozmiarami
atomów stanowiących w cząsteczce kwasu akceptory pary elektronowej a w zasadzie jej donory.
Twarde kwasy redukują się trudno, a twarde zasady trudno utleniają. Różnica elektroujemności
atomu akceptorowego i atomu donorowego jest dużą. W przypadku miękkich kwasów i zasad
polaryzowalność jest znaczna, rozmiary atomów duże. Kwasy łatwo się redukują a zasady łatwo
utleniają. Różnica elektroujemności pomiędzy atomami donorowymi i akceptorowymi jest
niewielka.
Kwasy twarde: H+, Li+, K+, Be2+, Mg2+, Ca2+, Sr2+
Kwasy miękkie: CO(CN)63-, Pd2+, Pt2+, Pt4+, Cu+, Ag+, Cd2+, Hg+
Zasady twarde: NH3, RNH2, N2H4, H2O, OH-, CH3COO-, CO32-, NO3-, PO43-, SO42-
Zasady miękkie: H-, etylen, benzen, CN-, RNC, CO, SCN , S2O32-, I-
Zastosowanie zasady miękkich i twardych kwasów i zasad pozwala przewidywać kierunek niektórych reakcji chemicznych. Dalej na tej
podstawie można wyjaśnić dlaczego wapń i magnez występują w przyrodzie jako węglany a metale jak miedź, rtęć, kadm najczęściej
jako siarczki. Otóż w pierwszym przypadku mamy do czynienia z twardymi kwasami Ca2+ i Mg2+ i twardą zasadą jak CO32-. W drugim
zaś z adduktami miękkich kwasów i zasad. Następnie opierając się na polaryzowalności i różnicy elektroujemności miękkich i twardych
kwasów i zasad można twierdzić że addukt twardy kwas-twarda zasada tworzy wiązanie z dużym udziałem charakteru jonowego.
Połączenia miękkich kwasów i zasad charakteryzuje raczej charakter kowalencyjny.
2) Właściwości i podstawowe informacje o węglowcach.

3) Określić stopnie utlenienia CH4, HCOOH, CH3OH,BaS i H2O2
CH4 – C – IV; HCOOH - C- II; CH3OH – C - -II; BaS –(II),(-II); H2O2 – (I), (-I).
4) Co to jest liczba masowa i atomowa?
Liczba masowa (A) – wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w jądrze
atomu (nuklidzie) danego izotopu danego pierwiastka.
Liczba atomowa ( Z ) (liczba porządkowa) określa, ile protonów znajduje się w jądrze danego
atomu. Jest także równa liczbie elektronów niezjonizowanego atomu
5) Przyczyna amfoteryczności bloku p, podać przykłady i reakcje .
Amfoteryczność pierwiastków bloku p wynika z ich elektroujemności i położenia w układzie
okresowym. Elektroujemności te są pośrednie miedzy elektroujemnościami metali z grup 1,2, a
tymi właściwymi dla niemetali. Elektroujemność wpływa na polaryzowalność wiązania
chemicznego. Dla oksokwasów w układzie R-O-H, gdzie R to symbol niemetalu, para elektronowa
wspólna dla atomu centralnego R oraz dla atomu O jest tym silniej przyciagana przez atom
centralny im wyższa jest jego elektroujemność. Wówczas następuje także przesunięcie pary
elektronowej tworzącej wiązanie O-H ku atomowi tlenu. Wiązanie to zostaje osłabione, co
ułatwia odczepienie jonu H+. W sytuacji, gdy elektroujemność atomu centralnego jest mała,
przesunięcie par elektronowych następuje w kierunky przeciwnym- od atomu centralnego do
atomu tlenu oraz od atomu tlenu do atomu wodoru. W rezultacie wiązanie O-H staje się
mocniejsze, a osłabieniu ulega wiązanie O-R. W takim wypadku następuje odczepienie jonu OH
-
.
Przy elektroujemnościach pośrednich pary elektronowe tworzące wiązania O-R i O-H są
rozmieszczone w ten sposób, że może zostać odczepiony zarówno kation H+, jak i anion OH-.
Związki takie zachowują się w stosunku do mocnych zasad jak słabe kwasy, a w stosunku do
mocnych kwasów jak słabe zasady. Metalami amfoterycznymi w bloku p są między innymi Al, Ge,
Sn.
Al(OH)3 + 3NaOH Na3[Al(OH)6]
Al(OH)3 + 3HCl AlCl3 + 3H2O
6) Opisać rodzaje wiązań w cząsteczce N2 ( można sobie było narysować).
Jedno sigma i 2 Pi
W cząsteczce azotu występuje wiązanie kowalencyjne niespolaryzowane. Pomiędzy identycznymi atomami
różnica elektroujemności wynosi 0. Azot znajduje się w 15 grupie układu okresowego, z czego wynika, że
atom azotu posiada 5 elektronów walencyjnych. W tym przypadku powstanie oktet, gdy wytworzą się 3
wspólne pary elektronowe- powstanie wiązanie potrójne. W cząsteczce azotu na każdym atomie znajduje
się wolna para elektronowa.
7) Wymienić 5 związków tworzących sieci jonowe.
NaCl, AgCl, LiF, KCl, CsCl, KI,
CsCl, ZnS, CaF
2,

8) Opisać teorie kwasów i zasad Lewisa.

Grupa 2
1) Opisz właściwości kwasowo-zasadowe tlenków pierwiastków (blokowo).
Metale bloku s
Z tlenem tworzą tlenki i nadtlenki, które mają charakter zasadowy. Jedynie BeO jest
amfoteryczny.
Litowce ulegają wielu reakcjom, np. z tlenem. Znane są tlenki M
2
O, nadtlenki M
2
O
2
(zawierające
w krysztale jon nadtlenkowy O
2
-
) i ponadtlenki M
2
O
2
(zawierające jon ponadtlenkowy O
2
-
). W
reakcji z tlenem atmosferycznym tylko lit tworzy tlenek, a pozostałe metale – nadtlenki lub
mieszaniny ponadtlenków. Wszystkie te związki reagują z wodą i dają odpowiednie wodorotlenki.
Berylowce utleniają się w powietrzu, tworząc tlenki MO
2
, jedynie bar przechodzi w nadtlenek
BaO
2
. Tlenek berylu nie rozpuszcza się w wodzie, jest tlenkiem amfoterycznym, reaguje z
kwasami przechodząc w kation berylu i z zasadami tworząc w roztworze wodnym anion
[Be(OH)
4
]
2-
i w niewielkich ilościach w BeO
2
2-
. Pozostałe tlenki berylowców są zasadowe i reagują
z wodą.
Metale bloku p
Z tlenem fluorowce łączą się stosunkowo trudno. Chociaż znanych jest wiele ich tlenków, to
większość z nich to substancje nietrwałe, otrzymywane w sposób pośredni, wszystkie o
charakterze kwasowym.
[ Większość tlenków metali ma strukturę jonową i zawiera jon O
2-
. Tlenki metali ciężkich
wykazują znaczną trwałość sieci krystalicznej i z tego powodu nie reagują z wodą (np. FeO ). ]
Tlenowce spalają się dając ditlenki (SO
2
, SeO
2
), które można utlenić do odpowiednich tritlenków
w obecności katalizatorów
.
Ditlenki i tritlenki 16. Grupy są w większości tlenkami kwasowymi.
Ditlenek azotu rozpuszcza się w wodze, przy czym reagując z nią daje kwas azotowy i tlenek
azotu. Tlenek diazotu i tlenek NO należą do tlenków obojętnych. Tritlenek jest bezwodnikiem
nietrwałego kwasu azotowego (III).
Oba tlenki fosforu są bezwodnikami kwasowymi.
Charakter tlenków azotowców oraz odpowiadających im związków z układem wiązać Z-O-H
zmienia się ze wzrostem liczby atomowej – od kwasowych poprzez amfoteryczne (tlenek
arsenu, antymonu) do zasadowych (B
2
O
3
).
[ W szeregu związków na stopniu utlenienia +V dominują właściwości kwasowe, które stopniowo
słabną ze wzrostem liczby atomowej azotowca. ]
Podobnie jak węgiel również pozostałe węglowce tworzą tlenki EO i EO
2
, których właściwości
kwasowe maleją w miarę wzrostu liczby Z : CO, SiO – obojętne, GeO – kwasowy, SnO, PbO –
amfoteryczne.

Charakter tlenków borowców: B
2
O
3
– kwasowy, Al
2
O
3
, Ga
2
O
3
, In
2
O
3
– amfoteryczne, Tl
2
O
3
–
zasadowy.
Pierwiastki takie jak Al, Ga, In, posiadają tlenki o właściwościach amfoterycznych na wyższych
stopniach utlenienia, natomiast pierwiastki takie jak Ge, Sn, Pb, As, Sb, Bi posiadają tlenki o
właściwościach amfoterycznych na niższych stopniach utlenienia.
Pierwiastki bloków d i f
Znane są tlenki wszystkich metali bloku d, zwykle jest ich kilka. Jedne metale łączą się z tlenem
łatwo, inne dopiero po ogrzaniu, a jeszcze inne nie reagują z tlenem w ogóle, a ich tlenki
otrzymuje się w innych reakcjach. Charakter tlenków zmienia się ze wzrostem stopnia utlenienia
– od zasadowego poprzez amfoteryczny, aż do kwasowego. Analogiczne prawidłowości
obserwuje się w związkach z ugrupowaniem M-O-H, które na niskich stopniach utlenienia są
wodorotlenkami zasadowymi M(OH)
n
na średnich stopniach utlenienia są wodorotlenkami
amfoterycznymi, M(OH)
n
≡ H
n
MO
n
, a na wysokich – kwasami.
Właściwości zasadowe tlenków wzrastają w szeregu : ZnO (amf.) < CdO (amf.) < HgO (zasadowy).
2) Wodorotlenki - ich charakter chemiczny (z uwzględnieniem elektroujemności).
Charakter kwasowo-zasadowy wodorotlenków jest zależny od charakteru i energii wiązania M–O
(metal–tlen). Jeżeli metal ma niską elektroujemność (litowce, berylowce) to wiązanie określa się
jako jonowe, wodorotlenek ma charakter zasadowy i w pełni dysocjuje na jony OH−. Jeżeli
wiązanie ma charakter kowalencyjny wodorotlenek może mieć właściwości amfoteryczne z
przewagą zasadowych (np. Zn(OH)2), a nawet kwasowych (np. Ti(OH)4).
o wodorotlenki metali alkalicznych (pierwsza grupa układu okresowego pierwiastków): LiOH,
NaOH, KOH, RbOH, CsOH. Silne oraz bardzo silne zasady, bardzo dobrze rozpuszczalne w
wodzie, aktywne chemicznie, dysocjujące na jednododatni jon (kation) metalu oraz anion
OH−
o wodorotlenki metali ziem alkalicznych (druga grupa układu okresowego pierwiastków), bez
amfoterycznego wodorotlenku berylu: Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2 i Ra(OH)2; dość
mocne zasady, jednak niezbyt dobrze rozpuszczalne w wodzie; dysocjują na dwudodatni
kation metalu oraz dwa aniony OH−.
o wodorotlenki amfoteryczne: Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Sb(OH)3; słabo
rozpuszczalne w wodzie związki amfoteryczne; W środowisku kwaśnym dysocjują na kation
metalu oraz aniony OH−; w wodnym środowisku zasadowym na ogół na anion MOnn− oraz
kationy H3O+.
Budowa tlenku krzemu, kwasu krzemowego, krzemianów.
SiO
2
– występuje w licznych odmianach polimorficznych (kwarc, krystobalit) i
bezpostaciowych ( krzemionka, ziemia okrzemkowa). We wszystkich odmianach di tlenek
krzemu jest cząsteczką gigantem (podobnie jak diament), a nie zbiorem drobin o składzie
SiO
2
, jak w przypadku CO
2
. W każdej z wielu możliwych sieci krystalicznych liczba
koordynacyjna wynosi 4 i jest on otoczony czterema atomami tlenu wyznaczającymi naroża

tetraedru, W poszczególnych odmianach SiO
2
, tetraedry SiO
4
są połączone mostkiem Si-O-Si i
każdy atom tlenu należy równocześnie do dwóch czworościanów. Kąt w mostkach waha się w
granicach 144-176°. Dzięki podatności kąta Si-O-Si na deformacje powstają liczne wersje
przestrzennych usytuowań grup SiO
4
względem siebie. Np. w kwarcu atomy trzech
sąsiadujących tetraedrów SiO
4
, tworzą sześcioczłonowe pierścienie Si
3
O
3
.
Krzemiany – sole licznych kwasów krzemowych, z których najważniejsze to:
trioksokrzemowy(kwas meta krzemowy), tetraoksokrzemowy(kwas ortokrzemowy). Są to
kwasy słabe. Kwas tetraoksokrzemowy ma tendencję do odszczepiania wody i
kondensowania z utworzeniem kwasów polikrzemowych. Kwasy polikrzemowe można
przedstawić w postaci wzoru ogólnego nSiO
2
* mH
2
O, gdzie n i m odpowiadają odpowiednio
liczbie moli SiO
2
i liczbę moli H
2
O powstających w wyniku rozkładu jednego mola kwasu.
Kwasy ulegają natychmiastowemu rozkładowi na SiO
2
i H
2
O. Natomiast sole (krzemiany) są
trwałe i obficie występują w skorupie ziemskiej. Krzemiany: Głównym motywem
strukturalnym krzemianów jest czworościan z jednym atomem krzemu w centrum i czterema
atomami tlenu na wierzchołkach. Czworościany mogą występować pojedynczo lub łączą się
ze sobą, mając wspólny jeden lub więcej atomów tlenu.
Krzemiany szkieletowe (krzemiany przestrzenne) - krzemiany o trójwymiarowych
połączeniach czworościanów krzemowo-tlenowych. Charakteryzują się najwyższym stopniem
kondensacji anionów [SiO
4
]
4-
, która prowadzi do utworzenia trójwymiarowych anionów
przestrzennych.
Jest to struktura bardzo trwała; siła wiązań o dużym ładunku elektrycznym jest
zneutralizowana.
3) Grupa czwarta układu okresowego - jakie są właściwości i stopnie utlenienia.
Tytanowce - pierwiastki 4 grupy układu okresowego. Są to: tytan (Ti), cyrkon (Zr), hafn (Hf) i
rutherford (Rf). Tytanowce leżą w bloku d układu okresowego. Są typowymi pierwiastkami
przejściowymi. Ogólna konfiguracja elektronowa tej grupy to [GS](n-1)d2ns2, gdzie [GS] to
konfiguracja poprzedzającego gazu szlachetnego.
Tytan, cyrkon i hafn są metalami srebrzystobiałymi, wytrzymałymi mechanicznie i trudno
topliwymi. Właściwości rutherfordu obecnie nie są jeszcze bliżej znane. Tytanowce na powietrzu
ulegają pasywacji. Tlenki tytanowców na IV stopniu utlenienia są trudno topliwe, a tlenek
cyrkonu ZrO2 jest jednym z najbardziej ogniotrwałych materiałów jakie dotychczas poznano.
Są reaktywne w wysokich temperaturach. W związkach występują najczęściej na IV stopniu
utlenienia, rzadziej na II czy III. Tlenki są amfoteryczne z przewagą cech kwasowych. Halogenki
nie mają charakteru soli, łatwo ulegają hydrolizie, sublimują i są lotne.
4) Czym się różni liczba masowa od masy atomowej?
Liczba masowa (A) – wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w jądrze
atomu (nuklidzie) danego izotopu danego pierwiastka.
Masa atomowa - liczba określająca ile razy masa jednego reprezentatywnego atomu danego
pierwiastka chemicznego jest większa od masy 1/12 izotopu
12
C, przy czym pod pojęciem
reprezentatywnego atomu rozumie się atom o średniej masie wyliczonej proporcjonalnie ze

wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich rozpowszechnienie na
Ziemi.
Zatem, liczby masowej nie należy mylić z masą atomową pierwiastka, która wyznaczana jest
metodami chemicznymi, ani też z masą pojedynczego jądra.
5) Chromatografia- co to jest i jej zastosowanie.
Chromatografia (gr. chromatos = barwa + grapho = pisze) to technika analityczna lub
preparatywna służąca do rozdzielania lub badania składu mieszanin związków chemicznych.
W każdej technice chromatograficznej najpierw rozdziela się badaną mieszaninę, a następnie
przeprowadza się detekcję poszczególnych składników. Rozdział substancji następuje w wyniku
przepuszczenia roztworu badanej mieszaniny przez specjalnie spreparowaną fazę rozdzielczą
(złoże), zwaną też fazą stacjonarną. Fazą rozdzielczą są substancje wykazujące zdolności
sorpcyjne lub zdolne do innych oddziaływań na substancje przepływające. Podczas przepływu
eluentu (fazy ruchomej) przez fazę rozdzielczą następuje proces wymywania zaadsorbowanych
(lub związanych) substancji. Intensywność tego procesu jest różna dla poszczególnych składników
mieszaniny. Jedne składniki są więc zatrzymywane w fazie dłużej, a inne krócej, dzięki czemu
może następować ich separacja. Czas przebywania danego składnika w kolumnie określany jest
mianem czasu retencji.
W zależności od rodzaju eluentu czyli substancji w której rozpuszcza się badaną mieszaninę
rozróżnia się następujące techniki chromatograficzne:
chromatografia cieczowa - w której eluentem jest ciekły rozpuszczalnik lub mieszanina
rozpuszczalników
chromatografia gazowa - w której eluentem jest gaz (zwykle hel, argon lub wodór, czasem
azot).
chromatografia nadkrytyczna - w której eluentem jest gaz w stanie nadkrytycznym.
W zależności od rodzaju i sposobu przygotowania fazy rozdzielczej:
TLC - thin layer chromatography, chromatografia cienkowarstwowa - w której fazę
rozdzielczą stanowi cienka warstwa fazy stałej naniesiona na sztywną płytkę. Na tak
spreparowaną płytkę nanosi się próbkę roztworu, po czym na skutek działania sił kapilarnych,
grawitacji lub pola elektrycznego następuje przepływ i rozdział mieszaniny;
chromatografia bibułowa - w której fazę rozdzielczą stanowi pasek lub arkusz bibuły
filtracyjnej lub specjalnego typu bibuły chromatograficznej;
chromatografia kolumnowa - w której faza rozdzielcza jest umieszczona w specjalnej
kolumnie, przez którą przepuszcza się następnie roztwór badanej mieszaniny. Przepływ
roztworu przez kolumnę można wymuszać grawitacyjnie lub stosując różnicę ciśnień na
wlocie i wylocie kolumny;
chromatografia powinowactwa - w której odpowiednio spreparowana faza rozdzielcza jest
zdolna do oddziaływań chemicznych o zmiennym powinowactwie wobec rozdzielanych
substancji;
chromatografia jonowymienna - w której substancje oddziałują ze złożem za pomocą
oddziaływań jonowych.
W zależności od parametrów procesu:

HPLC - high performance/pressure liquid chromatography, wysokosprawna/ciśnieniowa
chromatografia cieczowa - odmiana cieczowej chromatografii kolumnowej z użyciem eluentu
pod wysokim ciśnieniem;
FPLC - fast protein/performance liquid chromatography - szybka, białkowa/szybkosprawna
chromatografia cieczowa - odmiana HPLC działająca na niższych ciśnieniach, stosująca prócz
złóż sorpcyjnych, także zwykłe złoża typu sit molekularnych, służąca głównie do rozdziału
białek i polipeptydów. Opatentowana i wyłączna nazwa dla firmy Pharmacia;
UPLC - ultra performance liquid chromatography, ultrasprawna chromatografia cieczowa -
odmiana cieczowej chromatografii kolumnowej. Działa na wyższych ciśnieniach i mniejszych
przepływach, a kolumny mają mniejsze ziarno (1,7 - 1,8 μm). Pozwala uzyskiwać krótsze czasy
retencji i wyższe rozdzielczości. Opatentowana i wyłączna nazwa dla firmy Waters.
GPC - Gel Permeation Chromatography - chromatografia żelowa - odmiana kolumnowej
chromatografii cieczowej. Polega na rozdziale składników mieszaniny na sitach
molekularnych ze względu na ich wielkość (masę). Stosowana m.in. do określania średnich
mas cząsteczkowych polimerów
Zastosowanie: Rozdzielanie miesznain w zalezności na ich własciwości (powinowactwo to fazy
stacjonarnej/rozdzielczej, wielkość itd.)
6) Podaj stopnie utlenienia pierwiastków w danych związkach- benzen, nadtlenek potasu, metan,
etan, tlenek sodu.
Benzen C
6
H
6
– C – (-I); nadtlenek potasu K
2
O
2
– K(I), O(-I); metan CH
4
– C (-IV), etan C
2
H
6
– C (-III),
tlenek sodu Na
2
O Na (I), O(-II)
7) Podaj definicje kwasu.
Kwasy – związki chemiczne wykazujące charakter kwasowy, co w zależności od definicji może
oznaczać zdolność do
zakwaszania środowiska (definicja Arrheniusa)
dostarczania kationów wodorowych (definicja Brønsteda-Lowry’ego)
przyjmowania pary elektronowej (definicja Lewisa).
Nazwą Teoria Arrheniusa określa się dwa postulaty z zakresu chemii:
1. Popularna nazwa postulatu Arrheniusa, że niektóre związki chemiczne posiadają zdolność do
rozkładania się na jony - czyli ulegają dysocjacji elektrolitycznej.
2. Teoria Arrheniusa kwasów i zasad – jedna z teorii kwasów i zasad, postulująca, że kwasem
jest związek który dysocjuje się z wytworzeniem jonu wodorowego (H
+
), a zasadą związek,
który dysocjuje z wytworzeniem jonu hydroksylowego (OH
-
). W myśl tej teorii woda jest
jednocześnie kwasem i zasadą.
Przykłady
kwas solny
HCl -> H
+
+ Cl
-
zasada sodowa
NaOH -> Na
+
+ OH
-
Teoria Brønsteda (Także teoria Brondsteta-Lowriego, teoria kwasów i zasad Brønsteda) -
sformułowana przez Johannesa Brønsteda w 1923 teoria, w myśl której kwasem jest substancja
mogąca odłączać ze swojej cząsteczki jony wodoru (protony), natomiast zasadą substancja, która

protony przyłącza. Stąd kwas jest donorem protonu (protonodonorem), a zasada akceptorem
protonu (protonoakceptorem). Kwas po odłączeniu protonu przechodzi w sprzężoną zasadę, tak
samo zasada pobierając proton przechodzi w sprzężony kwas:
kwas + zasada -> sprzężona zasada + sprzężony kwas
Ogólny zapis równowagi kwasowo-zasadowej wg teorii Brønsteda można przedstawić
następująco:
HA + B -> A
-
+ HB
+
gdzie:
HA - kwas
B - zasada
A
-
- sprzężona zasada
HB
+
- sprzężony kwas
Przykłady:
HF + H
2
O -> F
-
+ H
3
O
+
- woda zachowuje się jak zasada.
NH
3
+ H
2
O -> NH
4
+
+ OH
-
- woda zachowuje się jak kwas.
HSO
3
-
+ H
2
O -> H
2
SO
3
+ OH
-
- woda zachowuje się jak kwas.
CH
3
COOH + H
2
O-> CH3COO
-
+ H
3
O
+
- woda zachowuje się jak zasada.
Ponadto zgodnie z teorią Brønsteda podczas reakcji dwóch cząsteczek wody każda z nich może
być zarówno donorem, jak i akceptorem protonu:
H
2
O + H
2
O -> H
3
O
+
+ OH
-
- woda zachowuje się zarówno jak kwas, jak i zasada, czyli jest
związkiem amfoterycznym (dokładniej - amfiprotycznym).
Teoria kwasów i zasad Lewisa - teoria określająca właściwości kwasowe i zasadowe
substancji chemicznej na podstawie jej zdolności akceptorowo-donorowych. Kwas Lewisa to
związek chemiczny (oznaczany zazwyczaj symbolem "A"), który może przyjąć parę
elektronową od zasady Lewisa ("B"), będącej donorem pary elektronowej. W ten sposób
powstaje tzw. addukt AB:
A + :B → A—B
Wg definicji Lewisa kwasami są natomiast związki chemiczne mające silny deficyt elektronów,
mimo że w ogóle nie posiadają w swojej strukturze atomu wodoru (np. chlorek glinu AlCl
3
,
bromek cynku, ZnBr
2
).

Grupa 3
1) Kwas i zasada – przykłady, teorie, definicje
Odpowiedź – Grupa 2 Pytanie 8
2) Właściwości litowców. Jak się zmieniają?
Litowce (metale alkaliczne, potasowce) – grupa pierwiastków 1 (dawn. IA lub I głównej) grupy
układu okresowego (bez wodoru) o silnych własnościach metalicznych, tworzących z wodą silnie
zasadowe (alkaliczne) wodorotlenki. Do metali alkalicznych zalicza się lit, sód, potas, rubid, cez i
frans.
Właściwości fizyczne:
Litowce to ciała stałe o najmniejszej spośród pierwiastków gęstości, z których lit, sód i potas mają
mniejszą gęstość od wody. Wraz ze wzrostem liczby atomowej wzrasta ich gęstość i promień
atomowy. Maleje zaś twardość, temperatura wrzenia i topnienia oraz potencjał jonizacyjny.
Związki litowców barwią płomienie na charakterystyczne dla każdego metalu kolory: lit - na
czerwono, sód - na żółto, zaś potas na kolor różowo-fioletowy.
Właściwości chemiczne:
Własności metaliczne litowców, ich zasadowość oraz ogólna reaktywność z wodą i powietrzem
wzrastają ze wzrostem ich liczby atomowej (w dół układu okresowego), co związane jest z
malejącą elektroujemnością. Wszystkie te metale, oprócz najmniej reaktywnego litu (reaguje
spokojnie), reagują gwałtownie z wodą z wytworzeniem gazowego wodoru i wodorotlenku
danego pierwiastka. W przypadku potasu, rubidu i cezu powyższa reakcja przebiega zazwyczaj
wybuchowo, natomiast sód wybucha jedynie w sprzyjających warunkach. Rubid i cez samorzutnie
zapalają się w kontakcie z powietrzem.
Przechowuje się je w nafcie lub w parafinie, ponieważ na powietrzu ulegają reakcji w zawartym w
powietrzu tlenem bądź parą wodną.
3) Definicja masy atomowej i cząsteczkowej.
Masa atomowa - liczba określająca ile razy masa jednego reprezentatywnego atomu danego
pierwiastka chemicznego jest większa od masy 1/12 izotopu
12
C, przy czym pod pojęciem
reprezentatywnego atomu rozumie się atom o średniej masie wyliczonej proporcjonalnie ze
wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich rozpowszechnienie na
Ziemi.
Masa cząsteczkowa - często mylona z masą molową, to masa:
jednej cząsteczki związku (np. O
2
, H
2
O),
formalnej jednostki danego związku (np. NaCl o budowie jonowej, a nie cząsteczkowej),
jednego innego indywiduum chemicznego (np. jonu CH
3
COO
-
).
4) Wzory strukturalne kwasu siarkowego, fosforowego, azotowego, amoniaku, wodorku berylu,
wodorku sodu.
H---Be---H Na---H

5) Tlen – wolne rodniki, reaktywność.
****** Reaktywne formy tlenu
substancje chemiczne
, będące produktami jedno-, dwu- lub
trójelektronowej redukcji cząsteczki tlenu, oraz formy im pokrewne. Wykazują większą aktywność chemiczną aniżeli
cząsteczka tlenu w podstawowym stanie trypletowym.
Wytwarzane są w układach nieożywionych oraz komórkach organizmów żywych jako produkty reakcji fizjologicznych,
takich jak np.: utlenianie
kwasów tłuszczowych i alkoholi z udziałem enzymów flawinowych, hydroksylowanie cząsteczek
kseno
biotyków, przemiany kwasu arachidonowego, synteza tyroksyny, fagocytoza.
Przykłady reaktywnych tlenowych substancji chemicznych:
1) wolne rodniki: wodorotlenowy (
•
OH), alkoksylowy (RO
•
), nadtlenkowy (ROO
•
), tlenek azotu (NO
•
), rodnik
wodoronadtlenkowy HO
2
•
, anionorodnik ponadtlenkowy O
2
•-
.
2) nadtlenki: nadtlenek wodoru (H
2
O
2
), nadtlenki organiczne (ROOR).
3) tlen singletowy (O
2
)
6) Napisz wszystkie stopnie utlenienia chromu.
II, III, IV, V, VI (II, IV, V – nietrwałe)
7) Amfoteryczność.
Amfoteryczność – zdolność związku chemicznego do reakcji z kwasami i zarazem zasadami.
Inaczej, jest to zdolność związków chemicznych do bycia w jednych reakcjach kwasami a w innych
zasadami. Związki wykazujące amfoteryczność nazywa się czasami amfolitami.
Niemal każdy związek chemiczny jest w jakimś stopniu amfoteryczny. Ze związków
nieorganicznych największą amfoteryczność przejawiają połączenia pierwiastków ze środkowych
grup układu okresowego. Jest to typowe zachowanie dla wodorotlenków metali o średniej
elektroujemności, np. glinu i cynku oraz półmetali, np. arsenu i antymonu. Skłonność
pierwiastków do tworzenia związków amfoterycznych jest związana ze zdolnością tworzenia
przez jego związki w roztworze wodnym zarówno kationów jak i anionów.
Np. jon glinu Al3+ w silnie kwaśnych roztworach tworzy sole, np. AlCl3 (przy nadmiarze chlorków
tworzy kompleksy), w środowisku słabo kwaśnym i obojętnym strąca się słabo rozpuszczalny

wodorotlenek Al(OH)3, który w alkalicznym środowisku roztwarza się z wytworzeniem jonów
glinianowych, np. [Al(OH)4]−.
W przypadku związków pierwiastków o skłonnościach amfoterycznych, a występujących na kilku
stopniach utlenienia, kwasowość takich związków rośnie wraz ze stopniem utlenienia:
o tlenki arsenu(III) i antymonu(III) roztwarzają się w silnie kwaśnym środowisku z wytworzeniem
kationów Me3+, w alkalicznym środowisku tworzą się jony arsenianowe i antymonianowe o
ogólnym wzorze MeO3
−3
lub MeO2
–
aniony reszt kwasu arsenowego(III) i antymonowego(III). W
przypadku arsenu(V) i antymonu(V) ich związki mają właściwości znacznie bardziej kwasowe – ich
wolne kationy Me5+ w roztworze praktycznie nie występują – hydrolizują z utworzeniem jonów
arsenianowych(V) i antymonianowych (V), czyli anionów odpowiednich kwasów tlenowych,
MeO3
−4
i MeO
−3
podobnych do reszt kwasu fosforowego(V).
o jony manganu na różnych stopniach utlenienia:
Mn(II) i Mn(III) występują praktycznie tylko jako kationy
Mn(IV) w silnie kwaśnym środowisku może być obecny jako kation (szybko hydrolizuje), tworzy
manganiany(IV) MnO2−3
Mn(VI) i Mn(VII) nie występują jako wolne kationy, ale tworzą odpowiednie kwasy tlenowe,
manganiany(VI) MnO2−4 i manganiany(VII) MnO−4 (np. nadmanganian potasu, KMnO4).
8) Porównaj pod względem chemicznym glin i bor.
GDYBY TO JEDNAK BYŁ BAR – JEGO WŁAŚCIWOŚCI:
Bar jest metalem, bardziej miękkim niż cynk, lecz twardszym niż ołów. Wolny metal jest bardzo
aktywny chemicznie. Na powietrzu szybko utlenia się do tlenku BaO i nadtlenku BaO2. W związkach
występuje na +II stopniu utlenienia. Reaguje z wodą, z wydzieleniem wodoru, tworząc wodorotlenek
baru (Ba(OH)2), który jest mocną zasadą; nasycony roztwór tego wodorotlenku zwany jest wodą
barytową.
Sole baru są bezbarwne, zawierają kation Ba2+, który należy do IV grupy analitycznej, barwią płomień
na zielony kolor. Rozpuszczalne sole baru są toksyczne.
9) Kwasy i zasady Lewisa.
Grupa I pytanie 8
10) Co to jest mol? Jak dużą funkcję pełni?
Mol – (skrót od molekuła) podstawowa w układzie SI jednostka liczności materii, o symbolu
(oznaczeniu) mol
Jeden mol jest to liczność materii układu, zawierającego liczbę cząstek (np. atomów, cząsteczek,
jonów, elektronów i innych indywiduów chemicznych, a także fotonów, w tym ostatnim
przypadku nosi nazwę ajnsztajn) równą liczbie atomów zawartych w dokładnie 0,012 kilograma
izotopu węgla 12C (przy założeniu, że węgiel jest w stanie niezwiązanym chemicznie, w

spoczynku, a jego atomy nie znajdują się w stanie wzbudzenia). W jednym molu znajduje się
(6,02214129 ± 0,00000027) ×1023 cząstek. Liczba ta jest nazywana liczbą Avogadra[2].
Mol jest jednostką bezwymiarową, podobnie jak inne jednostki miary liczności jak np. tuzin,
mendel, kopa czy gros. Jednak, w przeciwieństwie do jednostek typu „tuzin”, użycie mola, ze
względu na jego wielkość, jest ograniczone do zliczania obiektów mikroskopowych.

Grupa 4
1) Budowa układu okresowego
Rozwój chemii jako dyscypliny naukowej w drugiej połowie XIX wieku oraz poznanie wielu
nowych pierwiastków skłoniło chemików do podjęcia prób ich klasyfikacji. Używany przez nas
współczesny układ okresowy jest zmodyfikowaną wersją układu opracowanego przez Rosjanina
Dymitra Mendelejewa. Jego klasyfikacja oparta jest na dokonanym przez tego chemika
spostrzeżeniu, sformułowanym jako prawo okresowości według którego: właściwości
pierwiastków i ich związków znajdują się w okresowej zależności od masy atomowej.
Mendelejew ułożył pierwiastki według rosnącej masy atomowej, nadając im kolejne numery,
które nazwał liczbami porządkowymi. Dziś te kolejne liczby nazywamy liczbami atomowymi (są
one związane z budową atomu, określają bowiem liczbę protonów w jądrze atomowym).
Pierwiastki w układzie okresowym są uporządkowane w grupy- kolumny pionowe, i okresy-
szeregi poziome. Każdej grupie i okresowi przypisano odpowiedni numer. Mamy więc 18 grup (8
głównych i 10 pobocznych) oraz 7 okresów.
2) Obieg azotu i węgla w przyrodzie,
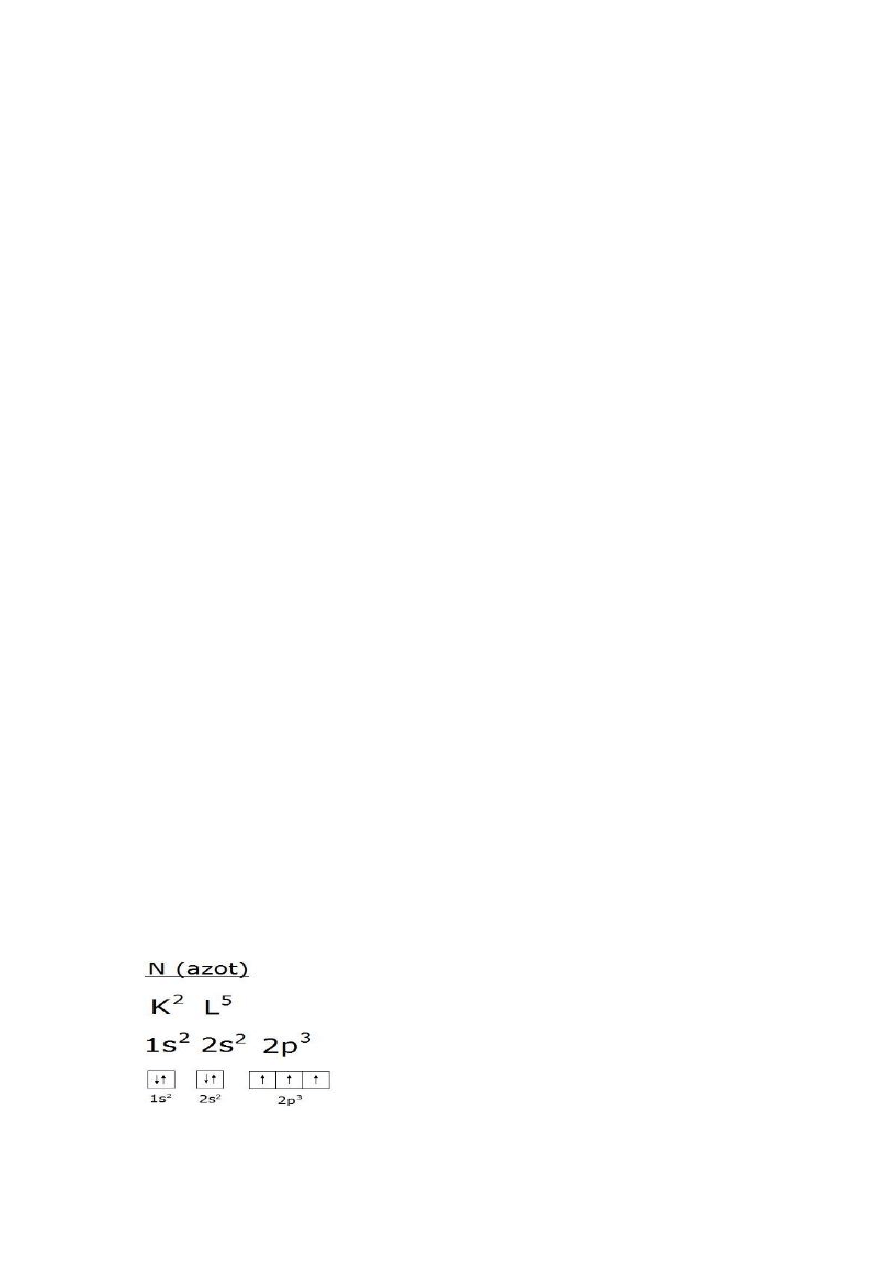
Obieg węgla w przyrodzie - biologiczne, chemiczne i fizyczne procesy zachodzące na Ziemi,
w wyniku których następuje ciągły cykl wymiany węgla znajdującego się w atmosferze, w
wodzie, organizmach żywych ich szczątkach oraz w skorupie ziemskiej.
Węgiel w postaci dwutlenku węgla (CO
2
) jest asymilowany przez rośliny samożywne (przez
rośliny zielone w procesie fotosyntezy, przez bakterie samożywne w procesie
chemosyntezy) i włączany następnie w cząsteczki glukozy.
Część glukozy zostaje z kolei zużyta do budowy komórek i tkanek, a część zużyta jako
materiał energetyczny. Zwierzęta zjadając rośliny lub zwierzęta wykorzystują zawarty w
związkach organicznych węgiel do budowy swojego ciała, a także w celach energetycznych.
Martwa materia organiczna ulega procesom rozkładu,
Podczas procesów energetycznych węgiel zawarty w związkach chemicznych jest utleniany i
w postaci dwutlenku węgla w procesie oddychania jest wydalany do atmosfery lub wody.
Źródła węgla w przyrodzie:
atmosfera,
przemysł,
środki transportu,
procesy rozkładu,
oddychanie organizmów.
Zawartość węgla w biosferze podlega wahaniom w skali milionów lat w wyniku dwóch cykli:
cyklu węglanowo-krzemianowego
cyklu organicznego
Cykl węglanowo-krzemianowy polega na wiązaniu gazowego CO
2
przez krzemiany wapnia i
magnezu do postaci mineralnej węglanu wapnia, węglanu magnezu oraz krzemionki.
Związany węgiel może być następnie uwalniany z węglanów w następujących procesach:
rozkład skał w skorupie ziemskiej w wyniku działania temperatury i ciśnienia
(diageneza, metamorfoza, wulkanizm)
roztwarzanie węglanów podczas procesów rozkładu tkanek roślinnych i zwierzęcych
w wyniku działania powstających wówczas kwasów organicznych
roztwarzanie węglanów przez systemy korzeniowe roślin przy pomocy kwasów
organicznych w celu uzyskania węgla dla fotosyntezy
3) Wzór klatkowy azotu i tlenu.
tlen 1s2 2s2 2p4.
4) Co to są metale?
5) Przedstawić schemat blokowy układu okresowego i zaznaczyć jak sie zmienia elektroujemność.
6) Który kwas jest najmocniejszy (hclo, hclo2, hclo3, hclo4) i dlaczego?
Moc kwasów tlenowych rośnie ze wzrostem elektroujemności atomu centralnego reszty
kwasowej oraz ze wzrostem liczby atomów tlenu w stosunku do liczby atomów wodoru:
HClO < HClO2 < HClO3 < HClO4
7) Właściwości fluorowców.
1.WŁAŚCIWOŚCI FIZYCZNE
Wszystkie fluorowce są niemetalami. Fluor i chlor są w zwykłych warunkach żółto zielonymi
gazami o charakterystycznej, ostrej woni; brom jest ciemnobrunarną lotną cieczą, a jod ciałem
stałym o metalicznym połysku. Astat nie występuje w przyrodzie; jest pierwiastkiem
promieniotwórczym o krótkim okresie półtrwania.
2.WŁAŚCIWOŚCI CHEMICZNE
Fluorowce są grupą typowych, bardzo reaktywnych niemetali o dużej elektroujemności. Ich
atomy mają siedem elektronów walencyjnych i- zgodnie z regułą helowca- każdy z nich stara się
pozyskać jeden elektron, żeby mieć oktet. Atomy fluorowców( oznaczone dalej ogólnym
symbolem X ) łatwo pobierają elektron i przechodzą w proste aniony:
X + e- = X- .

W miarę wzrostu liczby atomowej fluorowca zwiększa się liczba powłok elektronowych, maleje
energia uwalniania przy pobieraniu elektronu, zmniejsza się więc elektroujemność i w
konsekwencji reaktywność.
Jednoujemne jony fluorowców (F-, Cl-, Br- i I- ) mają konfigurację walencyjną helowca
zamykającego okres, w którym znajduje się dany pierwiastek. Aniony te są składnikami wielu
związków jonowych, powstających z fluorowca i metalu o małej elektroujemności. Jeżeli zbyt
mała różnica elektroujemności między fluorowcem a drugim reagentem nie pozwala na
utworzenie wiązania jonowego, to fluorowiec może uwspólnić elektrony i powstaje wiązanie
kowalencyjne. Taką możliwość stwarza tez przyłączenie dwóch jednakowych atomów, dlatego
wszystkie fluorowce tworzą cząsteczki dwuatomowe ( F2, Cl2, Br2, I2, ) z wiązaniem
pojedynczym.
Wszystkie fluorowce są utleniaczami, a jednoujemne aniony X- reduktorami. Właściwości
utleniające fluorowców ( X2 ) maleje w szeregu od fluoru do jodu, właściwości redukujące
wzrastają od F- do I-.
8) Wyjaśnić co to jest równowaga reakcji, zakaz Pauliego.
Zakaz Pauliego, według którego dwa elektrony (i generalnie fermiony) nie mogą znajdować
się w tym samym stanie kwantowym. Zakaz Pauliego tłumaczy między innymi systematykę
widm oraz budowę układu okresowego pierwiastków.
Grupa 5
Pyt.1 Narysuj wzory klatkowe azotu tlenu i boru
Azot (N):
Tlen (O): 1s
2
2s
2
2p
4
Bor (B): 1s
2
2s
2
2p
1
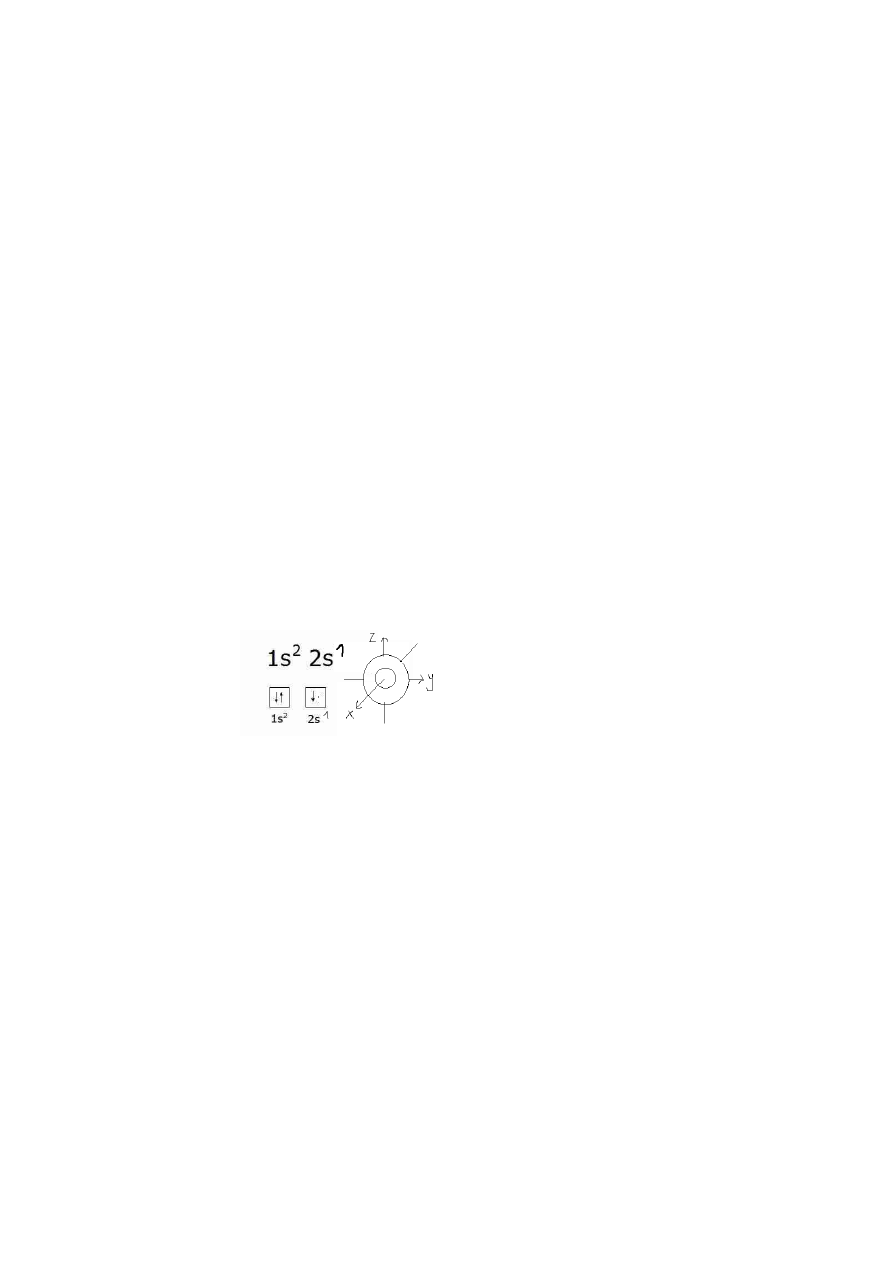
Pyt.2 co to sa orbitale, jakei zasady ich obsadzania i narysuj orbitale czastki litu i berylu
Orbital- funkcja falowa będącą rozwiązaniem równania Schrödingera dla szczególnego przypadku
układu jednego elektronu znajdującego się na jednej z powłok atomowych lub tworzących wiązanie
chemiczne .Zakaz Pauliego – orbital może być obsadzony przez najwyżej 2 elektrony o przeciwnych
spinach. Czyli elektrony obsadzające ten sam orbital muszą być sparowane – Reguła Hunda –
maksymalizacja liczby niesparowanych elektronów o tej samej energii – czyli jeśli w podpowłoce
dostępnych jest kilka orbitali, elektrony obsadzają pojedynczo puste orbitale zanim utworzą parę w
jednym z orbitali – reguła minimum energii – najpierw zapełniane są orbitale o najniższej energii
Zatem jeśli chodzi o kolejność obsadzania orbitali to są one zapełniane w miarę wzrostu ich energii
Dla litu Li o konfiguracj elektronowej 1s22s1, gdy dwa atomy litu spotkają sie, to zewnętrzny elektron
2s każdego atomu litu wchodzi w skład orbitalu cząsteczkowego.
W przypadku berylu Be (Z = 4, 1s22s2) mamy sytuacje podobną jak w He. Efekt antywiążący będzie
większy jak efekt wiążący. Uniemożliwia to powstanie trwałej cząsteczki Be2.
Zasady obsadzania: elektrony zawsze zajmują w pierwszej kolejności powłokę o najniższej energii.
Orbital s posiada najmniejszą energię, na nim mogą być osadzone jedynie 2 elektrony. Kształtem
orbitalu s jest sfera. Orbital p Wyróżniamy trzy orbitale p zorientowane wzdłuż osi trójwymiarowego
układu współrzędnych (x, y, z). Każdy z trzech orbitali może pomieścić dwa elektrony(łącznie więc
jest maksymalnie 6). Trzy orbitale p można zapisać jako px, py i pz. Orbital p ma kształt sztangielka.
Są to najczęściej występujące orbitale. Wyróżniamy także orbitale d i f. Orbital d występuje w
metalach przejściowych. Siarka i fosfor posiadają puste orbitale d. Orbitale f występują u
lantanowców i aktynowców. Maksymalna ilość elektronów to 10.
Orbital cząstki litu:
Orbital cząstki berylu: (chyba tak samo)
Pyt.3 liczba atomowa masa atomowa itp.
Masa atomowa - liczba określająca ile razy masa jednego reprezentatywnego atomu danego
pierwiastka chemicznego jest większa od masy 1/12 izotopu
12
C, przy czym pod pojęciem
reprezentatywnego atomu rozumie się atom o średniej masie wyliczonej proporcjonalnie ze
wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich rozpowszechnienie na Ziemi.
Masa cząsteczkowa - często mylona z masą molową, to masa:
jednej cząsteczki związku (np. O
2
, H
2
O),
formalnej jednostki danego związku (np. NaCl o budowie jonowej, a nie cząsteczkowej),
jednego innego indywiduum chemicznego (np. jonu CH
3
COO
-
).
Liczba masowa - wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w jądrze atomu
(nuklidzie) danego izotopu danego pierwiastka.
Liczba atomowa/porządkowa - (liczba porządkowa) określa, ile protonów znajduje się w jądrze
danego atomu. Jest także równa liczbie elektronów niezjonizowanego atomu.

Izotopy – odmiany pierwiastka chemicznego różniące się liczbą neutronów w jądrze atomu (z definicji
atomy tego samego pierwiastka mają tę samą liczbę protonów w jądrze). Izotopy tego samego
pierwiastka różnią się liczbą masową (łączną liczbą neutronów i protonów w jądrze), ale mają tę samą
liczbę atomową (liczbę protonów w jądrze).
Pyt. 4 dlaczego niektóre tlenki w połączeniu z wodą dają kwas a inne zasadę?
Tlenki są to nieorganiczne związki chemiczne, zbudowane z tlenu i innego pierwiastka chemicznego.
Powstają w wyniku reakcji pierwiastków z tlenem (utlenianie, spalanie) oraz rozkładu związków
zawierających tlen. Tlenki mają bardzo różne własności fizyczne, które zależą od pierwiastka
łączącego z tlenem. Mają też bardzo różne własności chemiczne w zależności od elektroujemności i
stopnia utlenienia pierwiastka, z którym tlen tworzy wiązanie, np. właściwości kwasowo-zasadowe.
-tlenki zasadowe: reagują z kwasami dając sole, zazwyczaj alkalizują wodą (podwyższają odczyn pH)
-tlenki kwasowe: reagują z zasadami dając sole, zazwyczaj zakwaszają wodą
-tlenki amfoteryczne: reagują zarówno z kwasami, jak i z zasadami; są to głównie tlenki pierwiastków
grup przejściowych i tlenki metali z grup 13–15 + berylu.
-tlenki obojętne: nie reagują z kwasami ani z zasadami z wytworzeniem soli; należą do nich niektóre -
-tlenki niemetali na niskich stopniach utlenienia, np. NO i CO oraz tlenki gazów szlachetnych
Pyt. 5 spektroskopia, podzial wykorzystanie.
Spektrometria mas (MS, Mass Spectrometry) – uniwersalna technika analityczna, zaliczana do
metod spektroskopowych, której podstawą jest pomiar stosunku masy do jej ładunku elektrycznego
(m/z). Wszystkie te techniki są jednak oparte na jonizacji cząsteczek lub atomów, a następnie detekcji
liczby i stosunku masy do ładunku (m/z) powstających jonów. Wyniki działania spektrometru mas są
przedstawiane w postaci tzw. widma masowego.
Spektrometria mas służy do:
identyfikacji związków chemicznych i ich mieszanin,
ustalania struktury związków chemicznych,
ustalania ich składu pierwiastkowego,
ustalania składu izotopowego analizowanych substancji, co m.in. umożliwia określenie ich
źródła pochodzenia
precyzyjnego ustalania składu złożonych mieszanin związków o wysokich masach molowych
w proteomice, badaniach materiałowych i chemii polimerów.
NMR – Jądrowy Rezonans Magnetyczny
Materia pierwiastki których jądra posiadają spinowy moment pędu (p) i wykazują moment
magnetyczny (m).
Promieniowanie elektromagnetyczne - zakres częstości radiowych.
W nieobecności zewnętrznego pola magnetycznego spinowe poziomy energii jądrowej są
zdegenerowane, a orientacja wektorów momentu magnetycznego (m.m.) nieuporządkowana.
Spektroskopia NMR, Spektroskopia Magnetycznego Rezonansu Jądrowego (ang. Nuclear Magnetic
Resonance) – jedna z najczęściej stosowanych obecnie technik spektroskopowych w chemii i
medycynie.
Spektroskopia ta polega na wzbudzaniu spinów jądrowych znajdujących się w zewnętrznym polu
magnetycznym poprzez szybkie zmiany pola magnetycznego, a następnie rejestrację promieniowania
elektromagnetycznego powstającego na skutek zjawisk relaksacji, gdzie przez relaksację rozumiemy

powrót układu spinów jądrowych do stanu równowag termodynamicznej. NMR jest zatem jedną ze
spektroskopii emisyjnych.
Zastosowania:
Technika ta jest użyteczna w badaniach strukturalnych i identyfikacyjnych cząsteczek.
Spektroskopia EPR czyli Spektroskopia Elektronowego Rezonansu Paramagnetycznego jest techniką
pozwalającą na wykrycie związków posiadających niesparowane elektrony, czyli będące wolnymi
rodnikami. Z powodu tego, iż większość stabilnych cząsteczek nie posiada wolnych elektronów,
technika ta jest rzadziej używana niż spektroskopia NMR.
Podstawowe fizyczne założenia techniki są analogiczne do tych wykorzystywanych w spektroskopii
NMR, ale badane są spiny elektronów, a nie spiny jąder atomowych. Z powodu różnic w masie
pomiędzy jądrami a elektronami, w technice EPR używane są słabsze pola magnetyczne i wyższe
częstotliwości promieniowania mikrofalowego niż w spektroskopii NMR. Dla elektronów, rezonans
paramagnetyczny w polu magnetycznym o wartości ok. 0,3 tesli zachodzi przy częstotliwości ok. 10
GHz.
Spektroskopia EPR jest wykorzystywana m.in. w fizyce ciała stałego do identyfikacji wolnych
rodników, w chemii do badań przebiegu reakcji oraz w biologii i medycynie do śledzenia znaczników
spinowych.
Ponieważ wolne rodniki są bardzo reaktywne, nie występują one w układach biologicznych w
wysokich stężeniach. Aby badać układy biologiczne zaprojektowano małoreaktywne molekuły
mogące wiązać się do specyficznych miejsc w komórce czy białku, pozwala to na otrzymanie
informacji o otoczeniu danej próbki spinowej.
Obrazowanie rezonansu magnetycznego (ang. MRI – magnetic resonance imaging) – nieinwazyjna
metoda uzyskiwania obrazów odpowiadających przekrojowi przez określoną strukturę ciała żyjącego
człowieka. Ma ogromne zastosowanie w medycynie, gdzie jest jedną z technik tomografii, która służy
diagnostyce i ukazaniu prawidłowości, bądź nieprawidłowości w zakresie tkanek i narządów. Metoda
ta jest również z powodzeniem wykorzystywana w badaniach naukowych wszędzie tam, gdzie istnieje
potrzeba uzyskania danych anatomicznych żyjącego człowieka.
Obrazowanie rezonansem magnetycznym opiera się na zjawisku jądrowego rezonansu
magnetycznego, który był wcześniej i jest nadal z powodzeniem stosowany w spektroskopii
jądrowego rezonansu magnetycznego w laboratoriach fizycznych i chemicznych. W istocie
obrazowanie rezonansem magnetycznym jest tomografią z zastosowaniem spektroskopii rezonansu
magnetycznego dla jąder atomów wodoru zawartych w cząsteczkach wody. Woda znajduje się we
wszystkich miękkich tkankach ludzkich, jednak w różnych proporcjach w stosunku do innych
związków chemicznych. Powoduje to dające się zarejestrować zmiany sygnału emisji rezonansowej
pochodzących z atomów wodoru obecnych w cząsteczkach wody, zawartych w tych tkankach.

Pyt. 6 fotosynteza w ujeciu chemicznych i fizycznym
6H2O + 6CO2 + (energia świetlna) → C6H12O6 + 6O2; ΔE –2872 kJ/mol (–687 kcal/mol)
Fotosynteza zachodzi w dwóch etapach – faza jasna (określana jako faza przemiany energii), w której
światło jest absorbowane, a jego energia jest zamieniana na energię wiązań chemicznych, a jako
produkt uboczny wydzielany jest tlen, oraz faza ciemna (określana jako faza przemiany substancji), w
której energia wiązań chemicznych, związków powstałych w fazie świetlnej, jest wykorzystywana do
syntezy związków organicznych. Obie fazy zachodzą jednocześnie i na świetle.
Najczęściej substratami fotosyntezy są dwutlenek węgla i woda, produktem – węglowodan i tlen
(jako produkt uboczny), a źródłem światła – słońce. Zarówno bezpośrednie produkty fotosyntezy, jak
i niektóre ich pochodne (np. skrobia i sacharoza) określane są jako asymilaty.
Faza jasna :
-Fosforylacja niecykliczna- cząst. Chlorofilu ściśle do siebie przylegają co umożliwia przekazywanie
wzbudzonych światłem elektronów. Po drodze z PSII do PSI jeden z przenośników transportuje
elektron w poprzek błony tylakoidy zabierając ze sobą proton ze stromy do wnętrza tylakoidy. W
rezultacie stęż. Protonów wew. Tylakoidy jest większe niż w Stromie.
-Fosforylacja cykliczna- Bierze w niej udział tylko PSI. Powstaje ATP.
Faza ciemna :
-Faza karboksylacji- CO2 do rybulozo 1-5 bifosforanu
-Faza redukcji-z wykorzystaniem siły asymilacyjnej- kwas fosfoglicerynowy do aldehydu
-Faza regeneracji- odtworzenie akceptora CO2
Pyt. 7 co to jest rownowaga chemiczna
Równowaga reakcji chemicznych – stan, gdy reakcja chemiczna zachodzi z jednakową szybkością w
obu kierunkach, a więc stężenia reagentów nie zmieniają się w czasie. Potencjały termodynamiczne
układu, jakim jest środowisko reakcji, osiągają wartości minimalne (charakterystyczne dla
określonych warunków). Minimum osiągają też odpowiednie funkcje termodynamiczne reakcji.
Stężenia reagentów w stanie równowagi nie zależą od mechanizmu jej przebiegu, np. rodzaj użytego
katalizatora nie ma wpływu na stężenia reagentów w stanie równowagi (ma duży wpływ na czas
ustalenia się tego stanu; zobacz kinetyka chemiczna). Stężenia równowagowe zależą tylko od
termodynamicznych warunków w stanie końcowym, takich jak temperatura i ciśnienie. Takie
zależności są przedmiotem badań termodynamiki chemicznej.
Gr. 6
Pyt.1 . Opisać jak zapełniane są powłoki elektronowe i jakie wynikają z tego konsekwencje, jak to
wpływa na właściwości chemiczny atomu.
Elektrony w atomach są umiejscowione na kolejnych powłokach, które mają określoną pojemność
czyli maksymalną liczbę elektronów jaka może się zmieścić na powłoce. Kolejne powłoki są
zajmowane przez elektrony dopiero po całkowitym zapełnieniu powłok leżących poniżej (o mniejszej
energii). Zjawisko "zapełniania" powłok wynika z zakazu Pauliego, który w stosunku do atomów
stwierdza, że na jednym orbitalu mogą znajdować się najwyżej dwa elektrony różniące się spinem.
Elektrony na ostatniej, najbardziej zewnętrznej powłoce nazywanej powłoką walencyjną są najsłabiej
związane z atomem i mogą odrywać się od atomu podczas tworzenia wiązań chemicznych. Powłoka
ta może przyjmować też dodatkowe elektrony, a energia wiązania tych dodatkowych elektronów ma
kluczowe znaczenie przy powstawaniu związków chemicznych. Elektrony niżej leżące rzadziej
uczestniczą w reakcjach chemicznych.
W obrębie jednego okresu powłoka walencyjna jest zajmowana przez kolejne elektrony. Po
zapełnieniu całej powłoki następuje przejście do nowego okresu i powstanie kolejnej powłoki
elektronowej.
konfiguracja elektronów ma wpływ przede wszystkim na właściwości fizyko-chemiczne pierwiastka.

Pyt.2 Było rozpisane koło 20 związków i trzeba było ustalić stopnie utlenienia danego atomu w
związku (nie było to wcale takie łatwe bo dużo było związków odbiegających od ogólnej normy)
Pyt.3 Scharakteryzować wiązanie wodorowe i podać przykłady jego występowania w środowisku.
Wiązanie wodorowe – oddziaływania wodorowe w związkach takich jak H2O, NH3, HF, powodują
znaczne podniesienie temp wrzenia tych zwiazków przez co w warunkach normalnych są one
cieczami a nie gazami pomimo stosunkowo małej masy molowej. Cząsteczki tych zwiazków wykazuja
niezwykle silne oddziaływania przyciagające pomiędzy sobą.
Pyt.4 Scharakteryzować azotowce i podać najważniejsze stopnie utlenienia ? Napisać odpowiednie
reakcje chemiczne. (nie wiem czy podanie stopni utlenienia i reakcji wystarczyło, zależy od formy
pytania).
W skład azotowców wchodzą
Wiadomości ogólne
Wolny azot (N2) stanowi około 79% objętościowych powietrza. Do najważniejszych minerałów
zawierających azot należą saletry (azotany): chilijska NaNO3, indyjska KNO3 i wapniowa Ca(NO3)2.
Azot jest również składnikiem substancji organicznych (białek, aminokwasów itp.). Fosfor nie
występuje w stanie wolnym, lecz w związkach (fosforytach i apatytach), zawierających ortofosforan
wapnia Ca3(PO4)2jako główny składnik. Arsen, antymon i bizmut to pierwiastki mało
rozpowszechnione; występują w minimalnych ilościach w stanie wolnym oraz w postaci tlenków i
siarczków. Wraz ze wzrostem liczby atomowej maleje elektroujemny (niemetaliczny) charakter
azotowców, a równocześnie wzrasta charakter metaliczny. Azot i fosfor są niemetalami, arsen i
antymon - półmetalami, natomiast bizmut jest już typowym metalem. Atomy wszystkich azotowców
mają pięć elektronów w ostatniej powłoce (s2p3). Duże co do wartości bezwzględnej energie jonizacji
i powinowactwa elektronowe utrudniają tworzenie prostych kationów bądź anionów. Wiązania
chemiczne azotowców mają więc charakter kowalencyjny. Azotowce występują na stopniu utlenienia

-III w związkach z wodorem i metalami oraz na stopniach +III i +V w związkach z niemetalami. W
przypadku
azotu
możliwe
są
wszystkie
stopnie
utlenienia,
od
-III
do
+V
Pyt.5 Jaki jest najpowszechniejszy pierwiastek w kosmosie i na Ziemi oraz najpowszechniejszy
metal w kosmosie i na Ziemi.
Kosmos :Wodór - występuje w gwiazdach i obłokach międzygwiazdowych Hel - tworzy tak jakby
'atmosfere' w kosmosie Metal-?
tlen- na Ziemi żelazo, glin
Pyt.6 . Znając położenie Tantalu w układzie okresowym opisać ten pierwiastek, jakie można
wnioski wyciągnąć patrząc na jego położenie w układzie okresowym
TANTAL- pierwiastek chemiczny z grupy metali przejściowych w układzie okresowym. Grupa, okres,
blok
5, 6, d. Elektroujemnoś w skali Paulinga 1,5. Konfiguracja elektronowa [Xe]4f145d36s2
Pyt.7 Co to jest stała równowagi reakcji i od czego jest zależna.
Pyt.7 grupa 5.
Pyt.8 Czy tlenek i dwutlenek węgla są reaktywne, podać właściwości (odpowiednie reakcje
chemiczne).
CO
Tlenek węgla ma właściwości redukujące, co wykorzystywane jest w hutnictwie:
Fe2O3 + 3CO → 2Fe + 3CO2
Z zasadami tworzy mrówczany (nie jest jednak bezwodnikiem kwasowym), a z amoniakiem –
formamid:
CO + NaOH → HCOONa
CO + NH3 → HCONH2
Przyłącza chlor tworząc fosgen:
CO + Cl2 → COCl2 CO2
FIZYCZNE: bezbarwny, bezwonny i niepalny gaz, cięższy od powietrza
CHEMICZNE: powoduje mętnienie wody wapiennej, dobrze rozpuszczalny w wodzie, można go
otrzymać np. poprzez spalanie węgla
CO2 + H20 ↔ H2CO3 ↔ H+ + HCO3- ↔ 2H + CO32-
Pyt.9 Obieg siarki w przyrodzie.

Gr. 7
1. metal/niemetal własnosci
2. stopnie utlenienia węglowców
W miarę przechodzenia w dół grupy stopień utlenienia +4 staje się
coraz mniej trwały a zwiększa się trwałość stopnia utlenienia +2, ponieważ para elektronowa ns2 w
miarę wzrostu liczby atomowej staje się coraz bardziej bierną parą elektronową, nie biorącą udziału w
tworzeniu wiązań chemicznych.
9.
3.Napisać podstawowe reakcje termodynamiki chemicznej – związek miedzy zmianami entalpii
i entropii układu reagującego ze stałą równowagi reakcji oraz potencjałem utleniająco –
redukującym.
4. porównac siarke i tlen,
5. co to jest liczba Avogadro
6. pojecia liczby masowej, atomowej, masy atmowoej i cząsteczkowej
Liczba atomowa (liczba porządkowa) określa ile protonów znajduje się
w jądrze danego atomu (nie jonu!). Jest także równa liczbie elektronów atomu. Atomy posiadające tę
samą liczbę atomową, ale różną liczbę neutronów nazywa się izotopami.
Masa cząsteczkowa, często mylona z masą molową – masa:

jednej cząsteczki związku (np. O2, H2O),
formalnej jednostki danego związku (np. NaCl o budowie jonowej, a nie cząsteczkowej),
jednego innego indywiduum chemicznego (np. jonu CH3COO-).
Jednostką masy cząsteczkowej w układzie SI jest kg. Jednakże, znacznie powszechniej masa
cząsteczkowa wyrażana jest w atomowych jednostkach masy „u” (ang. unit równej 1/12 masy atomu
izotopu węgla 12C) lub „Da” (dalton).
Masę cząsteczkową nazywano dawniej ciężarem cząsteczkowym (nie jest to obecnie polecane).
W praktyce, w związku z trudnościami technicznymi w wyrażaniu rzeczywistych mas cząsteczkowych,
stosuje się tzw. względne masy cząsteczkowe - które oblicza się jako sumę względnych mas
atomowych tworzących ją atomów. Względna masa cząsteczkowa jest wielkością bezwymiarową,
którą należy rozumieć jako wielokrotność 1/12 masy atomu izotopu węgla 12C.
7. o wiązaniach sigma i pi
8. czy SiO2 jest bezwodnikiem i dlaczego
jakie są konsekwencje polaryzowalności cząsteczki,
opisać podstawy i zasotosowanie najważniejszych dla chemii analit. technik spektroskopowych
albo wyjaśnić podobieństwa
różnice pomiędzy węglem i krzemem
Wegiel często występują podwojne wiazaniaC:C, C:O u Si
wiazanie Si:Si oraz Si:O występują zadko. CO2 to gaz a dwutlenek krzemu to mineal-piasek. Zawiazki
krzemu z pojedynczym wiazaniem mogą działać jako kwasy Lewisa zw wegla działają jak kw Lawisa
gdy wegiel tworzy podwojne wiazanie, AT wegla jest mnieszy od AT krzemu, wegiel jest niemetalem,
krzem jest polmetalem. W przeciwieństwie do C Si dysponuje nie tylko orbitalami s i p ale także d co

umożliwo tworzenie zw koordynacyjnych. Wegiel wystepuje na stopniu uleniena _4 a krzem+4
Definicje: entalpia, entropia,
funkcja Gibbsa.
Entalpia swobodna – potencjał termodynamiczny zwany funkcją Gibbsa lub energią
swobodną Gibbsa, oznaczany przez , a zdefiniowany następująco:
co jest równoważne:
gdzie
– energia wewnętrzna układu,
– entropia układu,
, – ciśnienie i objętość układu,
– temperatura bezwzględna układu,
Jak zmieniają się właściwości Berylowców
charakterystyka 13 gr układu okresowego
Do grupy glinowców zalicza się następujące pierwiastki: glin (Al), gal(Ga), ind(In), tal(Tl).Do grupy 13
należy również bor, który jest niemetalem, a ściślej półmetalem. Pierwiastki 13 grupy mają trzy
elektrony wartościowości, dwa sparowane w orbitalu s i jeden niesparowany w orbitalu p - (s2p).
Jednym z najbardziej rozpowszechnionych w przyrodzie metali 13 grupy jest glin.
Stanowi on 7,5% ogólnej masy pierwiastków wchodzących w skład skorupy ziemskiej zajmując trzecie

miejsce po tlenie i krzemie, a pierwsze spośród metali. Glin występuje w przyrodzie jedynie w postaci
różnych połączeń z innymi pierwiastkami, głównie jako składnik glinokrzemianów i tlenku glinowego.
Wyglądem swoim przypomina srebro. Czysty glin jest bardziej miękki od żelaza, ma znaczną
wytrzymałość na zrywanie, zginanie i nie wykazuje przy tym kruchości. Rozpuszcza się dobrze w
kwasie solnym dając chlorek glinowy AlCl3, słabiej w rozcieńczonym kwasie siarkowym, tworząc
siarczan(VI) glinu Al2(SO4)3.
2. charak. wiązań wodorowych, jonowych, kowalencyjnych
Wiązanie wodorowe – oddziaływania wodorowe w związkach takich jak H2O, NH3, HF,
powodują znaczne podniesienie temp wrzenia tych zwiazków przez co w warunkach
normalnych są one cieczami a nie gazami pomimo stosunkowo małej masy molowej.
Cząsteczki tych zwiazków wykazuja niezwykle silne oddziaływania przyciagające pomiędzy
sobą.
Wiazania kowalencyjne
-miedzy atomami tego samego pierwiastka o duzej elektro ujemnosci
powyzej(2)Polega na powstaniu wspolnej pary elektronowej.
Wiazania kowalencyjne spolaryzowane-powstaje miedzy pierwiastkami o duzje elektroujemności ale
nieznacznie różniącej się polega na tworzeniu wspolnej pary elektronowej przesuniętej w kierunku
pierwiastka bardziej elektroujemnego. Powstala czasteczka ma budowe biegunowa.
Wiazanie jonowe
-powstaje miedzy pierwiastkami o dużej roznicy elektroujemności(1,7).Polega na
tym ze pierwiastki o niskiej elektroujemnosci oddaja elektron pierwiastku o wysokiej
elektroujemności. Powstaja czasteczki obdarzone ładunkiem elektrycznym Czasteczki obdarzone
ładunkiem elektronowym to jony
- jon dodatni to kation+
- jon ujemny to anion-
oddziaływanie miedzy dodatnim kationem a ujemnym anionem nazywamy wiazaniem jonowym.
Przyklady:
H2S-kowalencyjne spolaryzowane
H2-kowalencyjne spolaryzowane
KO- wiazanie jonowe
CuO- wiazanie jonowe
SO3- kowalencyjne spolaryzowane
O2- kowalencyjne spolaryzowane
3. charak. Lantanowców

4. zasady twarde i miękkie co to jest
Moc danego kwasu Lewisa zależy nie tylko od jego indywidualnych własności lecz także od
zasady z którą ten kwas reaguje. Oznacza to że stałe równowagi reakcji: A + :B <=> A:B
K=cA:B/cA. c:B zależą od własności obu parametrów A i :B. Podjęto więc próby określenia
w sposób empiryczny tych cech kwasów i zasad Lewisa, na podstawie których można by
sądzić czy dany kwas lub zasada okażą się mocniejsze lub słabsze w danej reakcji kwasowo-
zasadowej. Okazało się, że można wyróżnić dwie grupy, z punktu widzenia wzajemnego
powinowactwa, kwasów i dwie grupy zasad. w roku 1963 Pearson nazwał je kwasami lub
zasadami twardymi i kwasami lub zasadami miękkimi i określił regułę według której twarde
kwasy łączą się najchętniej z twardymi zasadami i odwrotnie. Granica pomiędzy miękkimi i
twardymi kwasami czy zasadami nie jest ściśle określona dlatego też wyróżnia się też grupę
kwasów/zasad o charakterze pośrednim. Ogólnie twarde kwasy czy zasady charakteryzują się
małą polaryzowalnością i małymi rozmiarami atomów stanowiących w cząsteczce kwasu
akceptory pary elektronowej a w zasadzie jej donory. Twarde kwasy redukują się trudno, a
twarde zasady trudno utleniają. Różnica elektroujemności atomu akceptorowego i atomu
donorowego jest dużą. W przypadku miękkich kwasów i zasad polaryzowalność jest znaczna,
rozmiary atomów duże. Kwasy łatwo się redukują a zasady łatwo utleniają. Różnica
elektroujemności pomiędzy atomami donorowymi i akceptorowymi jest niewielka.
Niektóre z kwasów i zasad w tej teorii podane są
w poniższej tabeli: Kwasy
Zasady
twarde
H+, Li+, K+ Be2+,
Mg2+, Ca2+, Sr2+
Sc3+, La3+, Ce4+,
Gd3+, Lu3+, Th4+,
U4+, UO22+ Ti4+,
Zr4+, Hf4+, VO2+,
Cr3+, Cr6+, MnO3+,
WO4+, Mn2+, Mn7+,
Fe3+, Co3+ BF3,
BCl3, BF3, Al3+,
AlCl3, AlH3, Ga3+,
In3+ CO2, NC+, Si4+,
N3+, As3+, SO3, Cl3+,
Cl7+, I5+, I7+, HX
tworzące wiązania
wodorowe
twarde
NH3, RNH2, N2H4,
H2O, OH-, O2-, ROH,
RO-, R2O, CH3COO-,
CO32-, NO3-, PO43-,
SO42-, ClO4-, F-, Cl-
pośrednie
Fe2+, Co2+, Ni2+,
Cu2+, Zn2+, Rh3+,
Ir3+, Ru3+, Os2+,
GaH3, Sn2+, Pb2+,
NO+, Sb3+, Bi3+, SO2
pośrednie
aminobenzen,
pirydyna, N2, N3-,
NO2-, SO32-, Br-
miękkie
CO(CN)63-, Pd2+,
Pt2+, Pt4+, Cu+, Ag+,
Cd2+, Hg+, Hg22+,
BH3, GaCl3, GaBr3,
Tl+, CH2, Br2, Br+, I2,
I+, ICN, metale
miękkie
H-, etylen, benzen,
CN-, RNC, CO, SCN-,
R3P, R3As, R2S, RSH,
RS-, S2O32-, I-

5. Teoria kwasów i zasad
Lewisa –określająca właściwości kwasowe i zasadowe substancji
chemicznej na podstawie jej zdolności akceptorowo-donorowych. Kwas Lewisa to związek chemiczny
(oznaczany zazwyczaj symbolem "A"), który może przyjąć parę elektronową od zasady Lewisa ("B"),
będącej donorem pary elektronowej
kwasy:
HCl, HBr, H
2
SO
4
, etanol, kwas karboksylowy, H
2
O
kwasy:
AlCl
3
, zasady: H2O
ZnBr
2
Cl
-
HCl F –
CH3COOH NH3
SO3 CO
3
2-
6. 5 przykładów reakcji dysproporcjonowania
4ClO
3
-
→ 3ClO
4
-
+ Cl
-
Hg
2
Cl
2
2 → HgCl
2
+ Hg
4KClO3 --> 3KClO4 + KCl
Cl2 + 2OH- --> ClO- + H2O + Cl-
3MnO42- + 4H+ --> 2MnO4- + MnO2 + 2H2O
TLEN
tlen rozpoczyna grupę pierwiastków określanych mianem tlenowce. Jego masa atomowa
wynosi 15,9994 g/mol. Liczba atomowa tlenu to 8. Oznacza to, iż tlen posiada 8 protonów i 8
neutronów, wchodzących w skład jądra atomowego. Wokół elektrycznie obojętnego jądra
znajduję się 8 elektronów, z czego 6 tzw. elektronów walencyjnych.
W przyrodzie , w stanie wolnym tlen występuje w dwóch odmianach alotropowych: w postaci
cząsteczek dwuatomowych oraz cząsteczek trójatomowych (ozonu).
Cząsteczkowy tlen dwuatomowy, to tlen, jaki występuje w niższych warstwach atmosfery.
Jest niezbędną substancją dla organizmów żywych. Dzięki niemu możliwe jest
przeprowadzanie procesu oddychania komórkowego. To gaz słabo rozpuszczalny w wodzie,
bezbarwny, bez smaku oraz pozbawiony zapachu. Skroplony jest niebieska cieczą. Nie
przewodzi ciepła ani elektryczności. Jego gęstość wynosi 1,429 [g/dm
3
] (jest cięższy od
powietrza). Temperatura topnienia dla tlenu wynosi - 218 ºC, zaś temperatura parowania -
182 ºC. Wykazuje właściwości paramagnetyczne. Naturalnie występujący tlen jest mieszaniną
dwóch stabilnych izotopów: tlenu
16
O i tlenu
18
O.

Ozon jest nazywany inaczej trójtlenem lub tritlenem. Występuje on w dużych ilościach w
górnych warstwach atmosfery - stratosferze, która położona jest ok. 11 do 30 km nad ziemią.
Warstwę tą inaczej nazywa się ozonosferą. Powstaje na skutek wyładowań elektrycznych.
Często po burzy czuć charakterystyczny zapach pochodzący od ozonu. Otrzymuje się go
także w wyniku reakcji fotochemicznych. W procesach tych najpierw ulegają rozpadowi
cząsteczki dwuatomowe tlenu, na atomy które następnie łączą się z innymi dwuatomowymi
cząsteczkami.
Dzięki nieustannemu zachodzeniu reakcji syntezy i rozkładu ozonu molwa jest ochrona życia
na ziemi przed szkodliwym promieniowaniem nadfioletowym, które powoduje mutacje
(zmienia DNA), a nawet śmierć organizmów, gdyż rozkłada cząsteczki białek. Niestety, ta
cenne warstwa ozonu jest zagrożona przez zanieczyszczenia środowiska i substancje
emitowane przez przemysł. Niektóre z nich powodują przyspieszony rozkład ozonu, a tym
samym pozbawienie tej warstwy atmosfery jej funkcji ochronnej. Do substancji szczególnie
zagrażających ozonowi zalicza się freony oraz tlenek azotu (II)..
Tlen należy najbardziej rozpowszechnionych pierwiastków na kuli ziemskiej. Jego
procentowa zawartość w litosferze (najbardziej zewnętrznej części kuli ziemskiej) oraz w
atmosferze wynosi aż 48,6 %. Zawartość tlenu w powietrzu wynosi ok. 21 %. Oprócz tego, że
tlen licznie występuje w postaci wolnej, jest on także zawarty w postaci związanej: wodzie
(stanowi 89 % masy wody) oraz w wielu minerałach, głównie w krzemianach,
glinokrzemianach, krzemionce i skałach węglanowych, które budują skorupę ziemską. Nie
wolno zapomnieć, iż tlen należy do tzw. makropierwiastków, a więc pierwiastków
podstawowych, budujących organizmy żywe.
Tlen należy do pierwiastków silnie elektroujemnych oraz bardzo reaktywnym. Reaguje z
niemal wszystkimi pierwiastkami chemicznymi, z większością jednak dopiero w
podwyższonej temperaturze. .
Do najbardziej popularnych związków tlenu należą tlenki. W nich tlen związany jest jedynie z
Tlenki ze względu na charakter chemiczny można podzielić na kilka grup:
SIARKA.
Jego masa atomowa wynosi 32,066 g/mol. W skład naturalnej siarki wchodzi kilka jej
izotopów. Najczęściej występującymi i stabilnymi izotopami są cztery:
32
S,
33
S,
34
S oraz
36
S.
Liczba atomowa siarki to 16. Oznacza to, iż siarka posiada 16 protonów i 16 neutronów,
wchodzących w skład jądra atomowego. Wokół elektrycznie obojętnego jądra znajduję się 16
elektronów, z czego 6 to tzw. elektrony walencyjne.
Siarka jest zaliczana do typowych pierwiastków niemetalicznych, związku z tym nie
przewodzi elektryczności ani ciepła. Nie ma charakterystycznego dla metali połysku.
W przyrodzie występuje w kilku odmianach Wśród odmian alotropowych siarki znane są
dwie postaci krystaliczne: siarka rombowa (S
α
) oraz siarka jednoskośna (S
β
).
Siarka rombowa zbudowana jest z ośmioatomowych, pierścieniowych cząsteczek. Występuje
ona w postaci żółtych kryształków, które są nierozpuszczalne w wodzie, trudno rozpuszczalne
w benzynie i alkoholu, natomiast bardzo dobrze w siarczku węgla (CS
2
). Wśród innych

odmian siarki można wyróżnić: siarkę żółta , katena- polisiarkę, siarkę plastyczną oraz pary
siarki. Poszczególne postaci przechodzą w kolejne odmiany pod działaniem temperatury.
Siarka należy do bardzo rozpowszechnionych we wszechświecie pierwiastków, umiejscawia
się na 10. miejscu. Nieco mniej jest jej na ziemi, stanowi jedynie 0,048 % masy litosfery, Na
ziemi istnieją złoża podziemne siarki elementarnej (inaczej: rodzimej), z których wydobywa
się ją na skalę przemysłową.. Do ważniejszych minerałów siarczanowych należą: gips).
Rozpuszczalne sole siarczanowe występują także w wodzie morskiej w formie jonów
siarczanowych. W stanie gazowym jest składnikiem zanieczyszczającym gaz ziemny (H
2
S)
oraz jako siarkowodór i tlenek siarki (IV) jest głównym składnikiem gazów wulkanicznych.
Spotkać ją można również w związkach organicznych (buduje kilka aminokwasów), stanowi
zanieczyszczenie ropy naftowej oraz gazu ziemnego (jako siarkowodór).
Siarka Tworzy wiele różnych związków chemicznych, zarówno nieorganicznych, jak i
organicznych. Poniżej zostały przedstawione najważniejsze z nich, stanowiące podstawę do
otrzymywania innych.
Bardzo ważną grupą związków siarki są jej połączenia z tlenem. Do podstawowych związków
siarki z tlenem należy zaliczyć tlenek siarki (IV) oraz tlenek siarki (VI).
Dwutlenek siarki to bezbarwny, trujący gaz o nieprzyjemnym zapachu. Ciekły tlenek siarki
(IV) jest bardzo dobrym rozpuszczalnikiem dla wielu związków organicznych oraz
nieorganicznych. Wykazuje właściwości redukcyjne, co znajduje zastosowanie w analizie
chemicznej.
Siarkowodór to bezbarwny, palny gazem o ostrym, duszącym zapachu (często określanym
zapachem zgniłych jaj, gdyż wytwarza się w zepsutych jajkach, w procesie beztlenowego
rozkładu białek). Jest substancją silnie toksyczną. Bardzo słabo rozpuszcza się w wodzie z
Siarczki wykorzystuje się w produkcji barwników (głównie farb), przy wyrobie zapałek oraz
w kosmetyce, w której siarka jest substratem w produkcji depilatorów.
8. uogólnic prawa chemiczne typu stałości składu zachowania masy, energii jednym prawem
chem.
1. Prawo zachowania masy – suma masy substratów użytych w reakcji jest równa sumie masy
produktów otrzymanych w reakcji.
2. Prawo stałości składu – reakcje chemiczne przebiegają jedynie przy zachowaniu ściśle określonej
proporcji substratów, a w związku chemicznym, który powstaje, stosunki masowe składników są
stałe.
3. Prawo wielokrotnych stosunków wagowych i objętościowych – (Gay-Lussaca) objętości reagentów
gazowych w tych samych warunkach ciśnienia i temperatury oraz ilości reagentów w stanie ciekłym
lub stałym pozostają do siebie w stosunku niewielkich liczb
Prawo działania mas – prawo Guldberga i Waagera; prawo równowagi chemicznej – miarą szybkości
reakcji chemicznych jest zanikająca liczba moli cząsteczek w jednostce czasu lub zwiększająca się
liczba moli produktów. A w stanie równowagi chemicznej – iloczyn stężenia produktów (
podniesionych do potęgi) reakcji jest wielkością stałą, charakterystyczna dla danej reakcji i
temperatury. zb całkowitych.

W stanie równowagi chemicznej, w stałej temperaturze, stosunek iloczynu stężeń molowych
produktów do iloczynu stężeń molowych substratów, podniesionych do odpowiednich potęg
odpowiadających współczynnikom stechiometrycznym reagujących substancji, jest
wielkością stałą, charakterystyczną dla reakcji i określonej temperatury.
Duża wartość stałej równowagi K świadczy o tym, że w stanie równowagi w danym układzie
jest znaczne więcej produktów niż substratów, czyli reakcja przebiega z dużą wydajnością
produktów.
Równowaga chemiczna, w odróżnieniu od statycznego charakteru równowagi mechanicznej,
jest równowagą dynamiczną – tyle, ile powstaje w jednostce czasu produktów, tyle samo
produktów, w tym samym czasie przekształca się w substraty.

Grupa:
1. Własności chemiczne tlenowców wynikajace z konfiguracji elektronowej (tlen, siarka, selen,
Tellur, Polon)
Wszystkie tlenowce w związkach chemicznych występują na stopniach utlenienia od −2 do +6. Tlen z
powodu dużej liczby elektronów przy małej liczbie powłok ma bardzo mały promień atomowy i
posiada właściwości nieco odmienne niż reszta pierwiastków tej grupy, a jego stopnień utlenienia w
związkach wynosi zazwyczaj −2 lub −1 (dodatnie stopnie utlenienia +1 i +2 osiąga jedynie w
związkach z fluorem). Atomy pierwiastków tej grupy mają na zewnętrznej powłoce 6 elektronów o
konfiguracji s2p4. W reakcjach chemicznych tlenowce uzupełniają zatem walencyjną powłokę
elektronową do oktetu przyjmując dwa elektrony "uwspólniają" z atomami innych pierwiastków
własne elektrony, tworząc spolaryzowane wiązania atomowe.
2. co to sa wodorki i jakie wiazanie chem jest dla nich charakterystyczne?
z innymi pierwiastkami. Występują we wszystkich stanach skupienia.
1) wodorki typu soli, w których wodór tworzy anion H-. Wodorki litowców i berylowców, posiadają
wiązania jonowe (z wyj. wodorków magnezu i berylu). Są to substancje białe, krystaliczne, aktywne
chemicznie. Reagują z
, z wydzieleniem wodoru Np. NaH, CaH2.
LiH + H2O → LiOH + H
2) wodorki metaliczne – substancje stałe. Tworzą je metale bloku d i f. Odznaczają się połyskiem i
własnościami metalicznymi, często niestechiometryczne, np.: PdH0,6, CeH2,8, TiH2.
3) wodorki kowalencyjne – gazy lub lotne ciecze. Tworzą je węglowce, azotowce, tlenowce i
fluorowce oraz beryl, magnez i bor. Posiadają bardzo zróżnicowane własności chemiczne, np. H2O,
węgla wodory, NH3, SnH4, HF, H2S, LiAlH4 (stosowany jako reduktor).
3. Jakie stopnie utlenienia sa charakterystyczne dla wanadu?

podać definicję pH
5. Podac najwazniejsze prawa gazowe
6. Opisac najwazniejsze teorie kwasowo-zasadowe
7. Liczba masowa i atomowa
Liczba masowa - wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w jądrze atomu
(nuklidzie) danego izotopu danego pierwiastka.
Liczba atomowa/porządkowa - (liczba porządkowa) określa, ile protonów znajduje się w jądrze
danego atomu. Jest także równa liczbie elektronów niezjonizowanego atomu
8.zakaz pauliego - co to i jego znaczenie w chemii
9.czy cząsteczka N2 jest reaktywna? odpowiedz uzasadnic.
Azot jest zbudowany z bardzo trwałych dwuatomowych cząsteczek N2 o dużej energii wiązania, co
jest przyczyną bierności chemicznej tego pierwiastka. Spośród pospolitych cząsteczek gazowych
trwalsze są jedynie cząsteczki dwutlenku węgla. Azot występuje w przyrodzie w postaci cząsteczek
dwuatomowych N
2
.
Wysoka wartość entalpii dysocjacji N
2
→ 2N (ΔH = 944,7 kJ/mol) świadczy o dużej trwałości wiązania
N=N, co warunkuje bierność chemiczną azotu.
W temperaturze pokojowej azot reaguje tylko z metalicznym litem tworząc azotek litu Li
3
N.

W wyższych temperaturach azot staje się bardziej reaktywny, zwłaszcza w obecności katalizatorów,
które umożliwiają przebieg następujących reakcji:
N
2
+ 3H
2
→ 2NH
3
N
2
+ O
2
→ 2NO
N
2
+ 3Mg → Mg
3
N
2
.
Grupa 8
1) Na czym polega hybrydyzacja węgla i jakie niesie skutki?
Skutki:
-różnica elektroujemności: mogą przez to powstać wiązania atomowe (kowalencyjne) oraz spolaryzowane o
częściowo jonowym charakterze
-powstają trwalsze cząstki (minimalna wartość energii wewnętrznej)
2) Aktywacja i utylizacja N2. Dlaczego jest to problem natury chemicznej i biologicznej?
Wiązanie azotu cząsteczkowego (N
2
) polega na aktywacji N
2
, a następnie redukcji do NH
3
, który jest
przekształcany do organicznej formy azotu. Aktywacja N
2
wymaga zużycia dużej ilości energii – jedna
cząsteczka N
2
(1 para elektronów) wymaga 4 cząsteczek ATP.
Większość
roślin
pobiera
azot
poprzez
w formie jonów azotynowych
NO
2
-
4
+
.
Związki te pojawiają się w ziemi w efekcie
padania
oraz procesów
. Ziemię,
która zawiera odpowiednio wysokie stężenie tych
związków nazywa się "bogatą" w azot. Przy zbyt
małym stężeniu tych związków ziemię trzeba albo
nawozić, albo okresowo uprawiać na niej rośliny
żyjące w
z bakteriami nitryfikacyjnymi i
azotowymi.
Cały azot występujący w związkach chemicznych, z
których są zbudowane zwierzęta pochodzi od roślin.
Zwierzęta nie potrafią przekształcać azotu z
atmosfery w związki potrzebne im do życia,

generują natomiast amoniak, który jest uwalniany do otoczenia i utylizowany przez bakterie nitryfikacyjne, lub
przekształcany w gazowy azot w procesie "Anammox".
Tak więc, aktywację azotu rozważać można tak na poziomie chemicznym, kiedy dokładnie pragniemy opisać
proces aktywacji azotu, redukcji i utylizacji azotu w do formy cząsteczkowej, jak również efekt tych procesów
dla sfery biologicznej.
Wpływ azotu na organizm:
Azot atmosferyczny
Azot pod normalnym ciśnieniem jest obojętny dla organizmów żywych. Może jednak wywołać
objawy zatrucia u osób przebywających w powietrzu o zwiększonym ciśnieniu. W takich
warunkach azot lepiej rozpuszcza się w płynach ustrojowych i tkankach bogatych w lipidy (np. w
mózgu), co prowadzi do pojawienia się objawów zatrucia, takich jak:
przy ciśnieniu 4 atm
euforia, skłonność do śmiechu, gadulstwo
spowolnienie reakcji na bodźce
przy ciśnieniu 10 atm
ostre zaburzenia pracy mięśni, koordynacji ruchów
zawroty głowy
zaburzenia świadomości
przy ciśnieniu powyżej 10 atm
po kilku minutach następuje utrata świadomości i śpiączka
Jeszcze bardziej niebezpieczne od rozpuszczania się azotu w tkankach jest jego wytrącanie się w
postaci pęcherzyków gazu, podczas zmniejszania ciśnienia. Szybkie zmniejszanie ciśnienia
powoduje chorobę kesonową.
Związki azotu w pożywieniu i wodzie pitnej[edytuj]
Woda zawierająca więcej niż 45 ppm jest uznawana za szkodliwą dla dzieci. Dużo bardziej
toksyczne są związki zawierające azot – azotyny. Ich obecność w glebie i wodzie pitnej jest jednak
znikoma. Dość niebezpieczne dla środowiska jest składowanie związku azotu np. nawozów w
zbiornikach z blachy ocynkowanej ze strony wewnętrznej, gdyż związki azotu wchodzą w reakcje
z związkami cynku i żelaza. A po wysypaniu tego nawozu do gleby związki te przedostają się do
wód gruntowych[10].
Azot w glebie
Przy niedoborze azotu rośliny rosną wolno są słabe, bledsze. Kolor ten jest związany z deficytem
chlorofilu, który bierze udział w procesie fotosyntezy. Skrajny niedobór azotu może powodować
żółtawobrązowe zabarwienie fragmentów liści[12] Niedobór azotu w glebie może zostać
uzupełniony przez nawożenie nawozami azotowymi lub poprzez zmianę uprawy na potrzebującą
mniej azotu.
Nadmiar azotu nie jest w zasadzie szkodliwy dla rośliny, gdyż rośliny mogą sobie go akumulować,
jednakże nadmiar związków azotu może powodować nadmierny wzrost rośliny i brak możliwości
przyjmowania innych pierwiastków niezbędnych roślinie. Groźny jest za to nadmiar azotu
połączony z niedoborem fosforu, potasu lub wody. Nadmiar azotu może szkodzić jakości i
wielkości plonów[12]. Nadmiar azotu jest szkodliwy dla drzew w przypadku mrozów[10]. Rośliny
mające za dużo azotu są ciemnozielone, wyglądają aż nazbyt dorodnie[12]. Gleba posiadająca za

dużo azotu powinna być nawożona nawozami zawierającymi potas i fosfor[10].
3) Uzupełnić reakcje miedzi z kwasem siarkowym, kwasem azotowym i kwasem solnym.
Cu + 2H2SO4 → CuSO4 +SO2↑ +H2O
Cu + 4HNO3(stężony) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(rozcieńczony) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2HCl → BRAK REAKCJI
4) Podać na jakich stopniach utlenienia występuje siarka w przyrodzie (przykłady).
−II, −I, I, II, III, IV, V, VI
H2S, SO, S2O3, SO2, H2SO4 (CO NA –I, I i V?)
-II H
2
S
-I FeS
2
I S
2
O
II SO
III S
2
O
3
2-
IV SO
4
V S
4
O
6
2-
VI H
2
SO
4
VII S
2
O
8
2-
5) Co to jest polaryzacja cząsteczki, jakie są jej skutki. A MOŻE WIĄZANIA?
Polaryzacja cząsteczek, deformacja cząsteczek wywołana oddziaływaniem z zewnętrznym polem
elektrycznym.
Wyróżnia się trzy rodzaje polaryzacji cząsteczek spowodowanej: przemieszczeniem powłok
elektronowych (polaryzacja elektronowa), przemieszczeniem atomów (polaryzacja atomowa) i
zmianą orientacji cząstek polarnych (polaryzacja orientacyjna).
6) Co to jest przekątna amfoteryczności w układzie okresowym. SZKIC.
W układzie okresowym przeprowadzamy przekątną, czyli linię od wodoru H do radonu Rn.
Przekątna ta dzieli pierwiastki grup głównych na trzy kategorie:
- nad przekątną znajdują się niemetale;
- pod przekątną leżą metale;

- na przekątnej znajdują się pierwiastki amfoteryczne, np.: beryl Be, glin Al, selen Se, arsen As.
7) Opisz lantanowce w oparciu o ich położenie w układzie okresowym.
8) Co to jest związek kowalencyjny, podać 3 przykłady z opisem.
Związki kowalencyjne, związki z przeważającym udziałem wiązania kowalencyjnego (wiązanie
chemiczne). Tworzą kryształy cząsteczkowe (molekularne) o niskich temperaturach topnienia np.
siarka, lub kowalencyjne o wysokich temperaturach topnienia np. diament. Są słabo
rozpuszczalne w rozpuszczalnikach polarnych. Cechy:
-budują odrębne cząsteczki, charakteryzujące się bardzo słabym oddziaływaniem między sobą
-nie przewodzą prądu elektrycznego w stanie stałym
-w stanie stałym związki kowalencyjne tworzą Cząsteczkowa sieć krystaliczna
-cząsteczki budujące związki kowalencyjne są jako całość obojętne elektrycznie
Kowalencyjne niepolarne
-nie przewodzą prądu nawet po stopieniu
-rozpuszczają się w rozpuszczalnikach niepolarnych lub słabo polarnych
-po rozpuszczeniu nie przewodzą prądu
-wiele z nich jest w war. normalnych gazami(tlen metan wodór)
-niskie temperatury topnienie i wrzenia
Kowalencyjne polarne
-ulegają dysocjacji w roztworach
-są rozpuszczalnikami powodującymi dysocjację

Przykłady: P2O5, CO, CF
2,
(kryształ)
(kryształ)
9) Co to jest entalpia.
Entalpia(H)
, będąca
. Entalpia jest równa sumie energii wewnętrznej, czyli energii jaka jest
potrzebna do utworzenia układu gdy jest on tworzony w otoczeniu próżni oraz iloczynu pV, który jest
równy pracy jaką należy wykonać nad otoczeniem by w danych warunkach uzyskać miejsce na układ.
H = U + pV
U-energia wewnętrzna układu
Entalpia standardowa to entalpia danej substancji w jej czystej postaci w
, to jest
przy ciśnieniu 1 bar i temperaturze 298 K. Określa się też entalpię standardową w określonej temperaturze.
Zmianę entalpii standardowej oznacza się symbolem
. Oznaczając entalpie jak i entalpie
standardowe
wprowadza
się
do
symbolu
entalpii
oznaczenie
przemiany
,
gdzie przem oznacza przemianę, stosowany jest też zapis
.
Entalpie standardowe tworzenia 1 mola substancji są podawane w tabelach własności fizycznych substancji.
Przyjmuje się, że pierwiastki w ich podstawowym stanie w warunkach standardowych mają entalpię równą
0.
W termodynamice nie jest istotna wartość całkowitej entalpii, lecz jej przyrost lub spadek w danym
procesie. Przyrost entalpii występuje w
) obliczana jest jako iloczyn wewnętrznego spadku (bądź
rozprężanego (lub sprężanego) czynnika.
Wyszukiwarka
Podobne podstrony:
Egzamin z chemii 11 odpowiedzi
Egzamin z chemii 2009 odpowiedzi, Chemia, kolosy i egzamin
Egzamin z chemii 2010 + odpowiedzi, banki chemia
Egzamin z chemii 2009 + odpowiedzi, banki chemia
egzamin z chemii pytania plus odpowiedzi
Pytania egzaminacyjne z chemii fizycznej (niepoważne z odpowiedziami), Chemia, Chemia fizyczna
Odpowiedzi do pytań egzaminacyjnych z chemii ogólnej i fizycznej
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
EGZAMIN Z CHEMII 2008, górnictwo i geologia agh, Od JMK na egzamin z chemii
egzamin z chemii, Zootechnika, 1 rok, Chemia, Egzamin
Pytania egzaminacyjne z Chemii
egzamin sos odpowiedzi
egzamin 11 odpowiedzi
Egzamin Pytania i Odpowiedzi 2
Finanse Egzamin oraz odpowiedzi4 (str
egzamin 2005 2 + odpowiedzi
Egzamin pytania odpowiedzi I
Finanse Egzamin oraz odpowiedzi3 (str
więcej podobnych podstron