
Immunologia
– prelekcja 29.10.2007
Zastosowanie metod immunodiagnostycznych to:
Diagnostyka chorób zakaźnych i inwazyjnych
Ustalanie grup krwi
Określanie antygenów zgodności tkankowej HLA
Ocena stanu czynnościowego ukł. odpornościowego
Oznaczanie poziomu wielu białek w płynach ustrojowych
Techniki immunodiagnostyczne dzielimy na:
Oparte o reakcje antygen-przeciwciało
o Aglutynacja
o Precypitacja
o Neutralizacja
o
Z zastosowaniem znaczników
o Immunomorfologiczne
o
Z udziałem dopełniacza
Immunologii komórkowej
o Ocena poszczególnych subpopulacji komórkowych
Uwarunkowania wyboru testu – zależy on od:
1. Rodzaju materiału:
Płyn ustrojowy (krew, mocz, limfa, płyn z jam surowiczych, PMR)
Zawiesina komórek (limfocyty z krwi obwodowej, granulocyty z krwi obwodowej,
homogenat tkankowy)
2. Poszukiwanego składnika (antygen, przeciwciało, kompleks immunologiczny) oraz jego
występowania (w postaci wolnej lub związanej z komórką lub tkanką)
3. Celu badania – czy określamy obecność poszukiwanego elementu w badanym materiale
(metody jakościowe) czy też jego stężenie (metody ilościowe)
4. Spodziewanego stężenia poszukiwanego składnika (od tego zależy czułość metody)
5. Wiarygodności danego testu i jego wartości diagnostycznej
Zasady pobierania materiału
Materiał pobierać należy zgodnie z zasadami aseptyki, czyli przyrządy – w tym nasze ręce - i
pojemnki winny być jałowe ;), powinniśmy także pobrać materiał w wystarczającej do badania ilości.
Pobieramy go w odpowiednim czasie np. kilka dni po rozpoczęciu infekcji, kiedy zostanie
wytworzone odpowiednie miano przeciwciał. Przed wysłaniem do laboratorium powinniśmy również
odpowiednio opisać materiał, poprzez dołączenie do niego skierowania.
Pobieranie krwi żylnej
W przypadku pobierania krwi żylnej jednorazowo najczęściej nakłuwa się żyły kończyny
górnej, w okolicy zgięcia łokciowego, rzadziej grzbietu dłoni lub przedramienia. Skórę w miejscu
planowanego wkłucia badający odkaża np. roztworem alkoholu etylowego. Igła zużyta do nakłucia
może być osadzona na strzykawce, wówczas badający pobiera krew przez powolne pociąganie tłoka
strzykawki.
Coraz powszechniej stosuje się do pobierania krwi specjalny rodzaj igieł i próbówek
próżniowych. Po uzyskaniu potrzebnej ilości krwi (zwykle od kilku do kilkunastu ml), badający
uciska miejsce wkłucia wacikiem i szybkim ruchem usuwa igłę z żyły.

Badanie surowicy
Próbówka do której pobieramy krew powinna przez 1-2 godziny przebywać w temperaturze
otoczenia. Po wprowadzeniu do niej krwi, odstawiamy próbówkę na 12 godzin do 4 st. C w pionowej
pozycji, pozwalając krwi skrzepnąć. Skrzep od ścianek oddzielamy jałową bagietką. Teraz możemy
odciągnąć pipetą surowicę.
Jeśli zachodzi taka potrzeba, możemy odwirować próbówkę przy 1-3000 g przez 10 min. a
czystą surowicę odciągnąć. Możemy także zamrozić próbkę do temperatury -20 st. C aby zachować ją
do późniejszej analizy. Próbki plazmy mogą być również używane do badań serologicznych – w tym
celu należy schłodzić krew w kąpieli z lodem i odwirować jak najszybciej. Następnie natychmiast po
odwirowaniu oddzielamy plazmę.
W chorobach zakaźnych pobieramy 1 lub 2 próbki krwi (z fazy ostrej i ozdrowieńczej),
zarówno do wykonania odczynów klasycznych jak i nowoczesnych.
Badanie krwi pełnej
Krew powinna być pobierana do próbówek z antykoagulantem. Najpopularniejsze środki tego typu to
EDTA (sól wapniowo-disodowa kwasu etylenodiaminotetraoctowego, wersenian) oraz heparyna.
Wybór zależy od charakteru badania, ale najczęściej stosowany jest pierwszy z w/w środków. Krew
ostrożnie przenosimy z vacutainer’a lub strzykawki do próbówki z antykoagulantem i mieszamy
delikatnie 2-3 razy, mieszając antykoagulant z krwią.
Izolacja limfocytów z krwi obwodowej w gradiencie Ficoll-Uropolina i test „E” rozetkowy
Limfocyty z krwi obwodowej możemy izolować z krwi obwodowej w gradiencie mieszaniny
Ficollu z Uropoliną o ciężarze właściwym 1077 poprzez odwirowanie:
Do próbówki wirowniczej dodajemy 2 mg gradientu Ficoll-Uropolina o c.w. 1077
Nawarstwiamy heparynizowaną krew w objętości 1-3x większej niż gradient
Wirujemy przez 20 min. z szybkością 2800 obr/min.
Po zebraniu osocza ostrożnie odciągamy kożuszek komórek z interfazy i
umieszczamy w próbówce z 1 ml płynu Hanksa
2x po 5 min przepłukuje się w wirówce komórki płynem Hanksa w obj. ok. 3 ml z
szybkością 1000 obr/min.
Test rozetkowy wykorzystuje fakt, że limfocyty T posiadają na swojej powierzchni receptory
dla erytrocytów barana CD2. Tymocyty tworzą trwałe rozety w temperaturze 4 st. C jak i 37 st. C,
natomiast limfocyty T krwi obwodowej – tylko w 37 st. C. Po inkubacji obu typów komórek dochodzi
do połączeń między nimi, w wyniku czego tworzą się tzw. rozetki. Prawidłowa ilość limfocytów we
krwi obwodowej wynosi 60-80% w teście odczytywanym po 18 godz. Obniżone wartości (38±10%)
obserwujemy w chorobie nowotworowej, chorobach wirusowych, chorobach wątroby, stanach
pooperacyjnych, zawale serca.
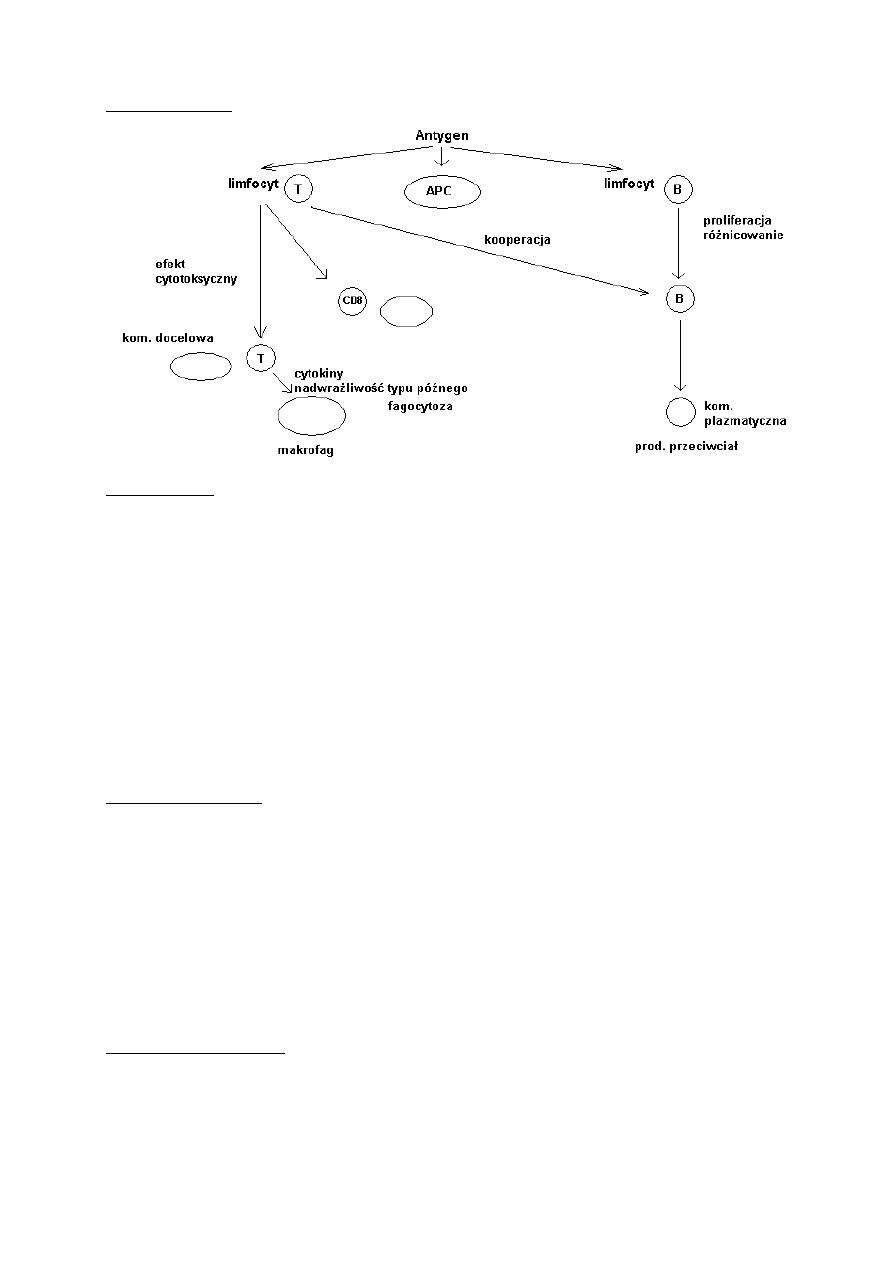
Odporność swoista
Typ odpowiedzi
Każda odpowiedź swoista indukuje powstanie obu typów odpowiedzi – zarówno humoralnej
jak i komórkowej (CMI), jednak decydującą rolę w skutecznej eliminacji antygenu odgrywa
najczęściej tylko jedna z nich. Np. w przypadku prątków, Riketsji czy Chlamydii efektywna jest tylko
CMI, odpowiedź humoralna pozostaje bez znaczenia. To, który typ odpowiedzi odegra większą rolę
zależy od:
Typu Ag
Obecności cytokin podczas stymulacji Ag
Genetycznego uwarunkowania układu odpornościowego
Czynników środowiskowych
I tak stymulacja endogennym antygenem i/lub obecność interleukin IL-12, IL-18 lub IFN gamma
powoduje stymulację Th1 i wywołanie odpowiedzi komórkowej CMI, natomiast stymulacja
egzogennym antygenem i/lub obecność IL-4 czy IL-10 powoduje stymulację Th2 i wywołanie
odpowiedzi humoralnej.
Odporność komórkowa
Skierowana jest głównie przeciw antygenom położonym w błonach komórkowych. Jest ona
szczególnie efektywna w usuwaniu komórek zakażonych wirusami lub bakteriami wymagającymi w
swym cyklu życiowym obecności komórki gospodarza (wewnątrzkomórkowymi), a także niektórymi
grzybami i pierwotniakami, oraz niszczeniu komórek nowotworowych. Odgrywa także ważną rolę w
procesie odrzucania przeszczepu. Odporność komórkowa nabyta jest rodzajem odpowiedzi nie
angażującej przeciwciał. Odporność komórkowa chroni organizm poprzez:
Aktywację antygenowo swoistych cytotoksycznych limfocytów T (CTLs)
Aktywację makrofagów i komórek NK (LGL)
Stymulację komórek do wydzielania licznych cytokin, które nie wpływają na funkcje innych
komórek zaangażowanych w procesy odporności wrodzonej i nabytej.
Dojrzewanie limfocytów T
Dzieli się ono na cztery fazy, w zależności od eksponowanych przez tymocyty markerów.
Wyjściowymi komórkami są zlokalizowane w korze grasicy tymocyty potrójnie ujemne CD4-CD8-
TCR-. Po kontakcie z grasiczymi APC zaczynają one eksponować receptor TCR oraz markery CD4 i
CD8, po czym przechodzą selekcję pozytywną: nadal ujemne komórki zostają zabite, a do rdzenia

grasicy. przechodzą już komórki podwójnie dodatnie CD4+CD8+. Zbyt łatwe wiązanie limfocyta T z
komórką mogłoby jednak doprowadzić do autoimmunizacji, tak więc podwójnie dodatnie komórki
podlegają selekcji negatywnej, która pozostawia już dwa różne typy komórek: CD4+ lub CD8+. Te
zaś przekształcają się w „naiwne” (nie mające za sobą kontaktu z antygenem) limfocyty dojrzałe
CD4CD45RA oraz CD8CD45RA.
Dojrzałe limfocyty T charakteryzują się markerami TCR, CD2 (złożonym z 4
transmembranowych peptydów γ, δ, ε i δ,), CD3 oraz CD4 lub CD8. Dwa rodzaje TCR: TCR αβ i
TCR γδ dzielą tą pulę na limfocyty T αβ i T γδ. Te ostatnie stanową ok. 5% limfocytów krwi
obwodowej.
W przeciwieństwie do receptorów komórek B, które mogą wiązać się bezpośrednio z
epitopami antygenów, TCR większości limfocytów T może rozpoznawać jedynie epitopy
prezentowane przez własne komórki gospodarza za pomocą cząsteczek MHC. Limfocyty CD4
rozpoznają MHCII, natomiast limfocyty CD8 – MHCI.
Limfocyty CD4 pełnią funkcje pomocnicze. Th2 omagają limfocytom B przekształcić się w
komórki plazmatyczne oraz w procesie przestrajania klas. Th1 pomagają limfocytom CD8
przekształcić się w aktywowane cytotoksyczne T limfocyty, a także aktywują makrofagi,
odpowiedzialne m. in. za likwidację zakażeń prątkami.
Aktywacja limfocyta T4:
Jest to proces wymagający dwóch sygnałów. Pierwszy z nich to połączenie się TCR z
epitopem, i CD4 z MHCII komórki APC. Drugi natomiast to połączenie się cząsteczek
kostymulujących
CD40
i
B7
na APC z odpowiadającymi im ligandami
CD154
i
CD28
na limfocycie
T. Cząstki kostymulujące syntetyzowane są jedynie wówczas, gdy receptory typu Toll na APC
połączą się z cząstkami strukturalnymi drobnoustrojów (PAMP). Jest to dodatkowy mechanizm
zabezpieczający TCR limfocyta T przed rozpoznawaniem peptydu „swojego” zamiast „obcego” na
MHC II komórki APC. Bez interakcji cząsteczek kostymulujących limfocyt T4 nie będzie
aktywowany i będzie podlegał apoptozie.
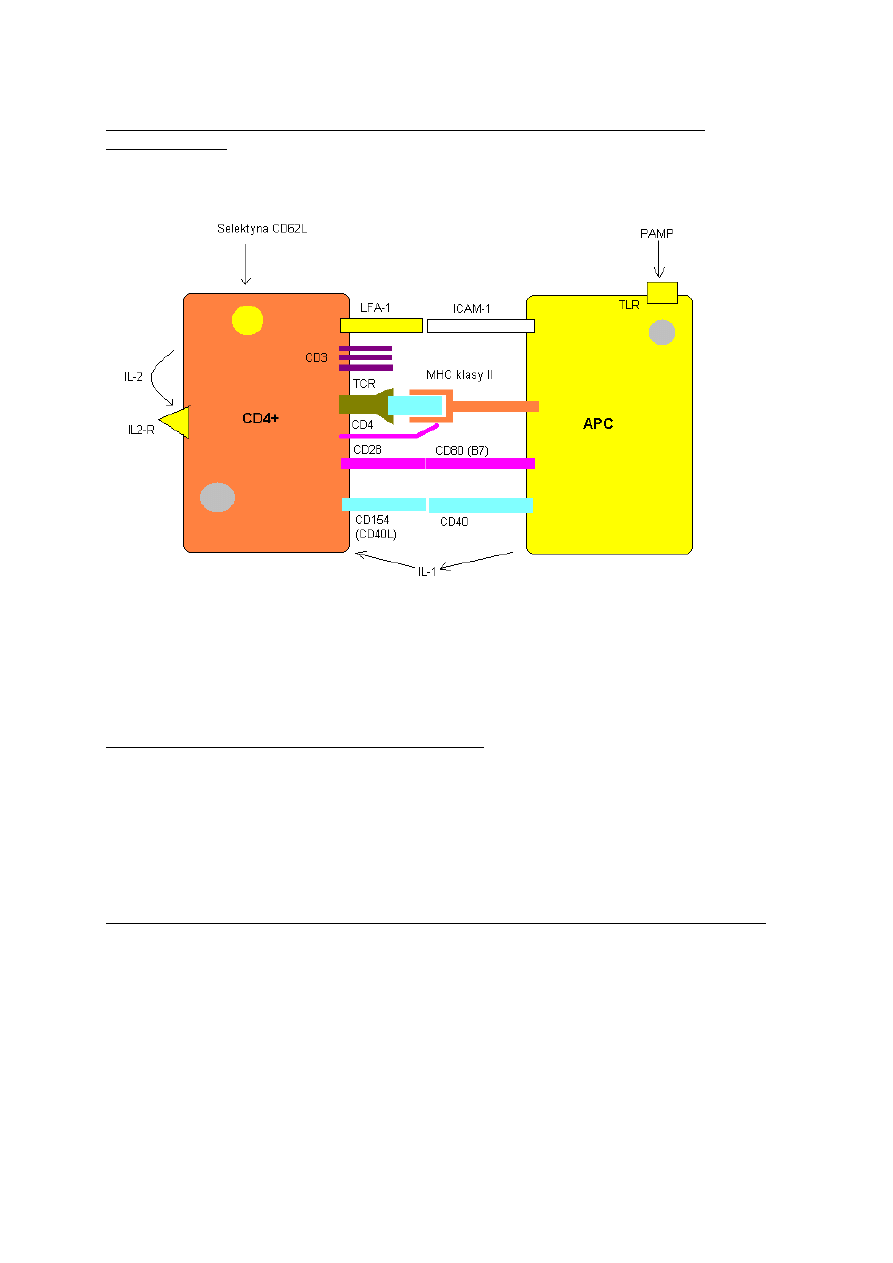
Powierzchniowe molekuły zaangażowane w interakcję komórek CD4 i APC (tzw. synapsa
immulonogiczna):
Po aktywacji limfocyty T4 muszą mnożyć się tworząc duże klony identycznych komórek dla
dostarczenia wystarczająco dużej ilości limfocytów niezbędnych do skutecznej odpowiedzi
odpornościowej przeciw antygenowi. Aktywowane limfocyty pomocnicze T4 (helper) produkują
interleukinę IL-2 i odpowiadający jej receptor IL-2R. IL-2 wiąże się z IL-2R na pomocniczym
limfocycie T4 umożliwiając mu proliferację i tworzenie dużego klonu pomocniczych limfocytów T4.
Aktywne limfocyty T4 podlegają zależnemu od antygenu różnicowaniu do komórek Th1 lub Th2.
Komórki prezentujące antygen APC - zaliczamy do nich:
Komórki dendrytyczne DC, dzielące się na
o DC1 – mieloidalne – należą do monocytów, prezentują antygeny limfocytom Th1
o DC2 – plasmacytoidalne – prezentują antygen limfocytom Th2
Komórki Langerhansa skóry (myeloidalne)
Makrofagi
Limfocyty B
Jak komórki dendrytyczne DC wpływają na limfocyty T, i jak te ostatnie dogadują się między sobą.
Stymulacja antygenami i/lub cytokinami powoduje, że z komórki DC0 powstają dwie klasy
komórek dendrytycznych, DC1 i DC2. Obydwie klasy stymulują limfocyty pre-Th poprzez
prezentację im antygenu, powodując powstanie odpowiednio Th-1 i Th-2. Na różnicowanie pre-Th w
kierunku Th1 wpływają także IL-12, IFN gamma, IL-18 oraz IFN alfa/beta, natomiast na
różnicowanie w kierunku Th2 – IL-4. Obie klasy limfocytów pomocniczych produkują cytokiny; w
przypadku Th1są to IL-2, IFN gamma i TNF beta, hamujące różnicowanie się pre-Th w kierunku Th2.
Th2 zaś produkują IL-4, IL-5, IL-10 oraz IL-13, z czego IL-4 i IL-10 hamują różnicowanie się pre-Th
do Th2.
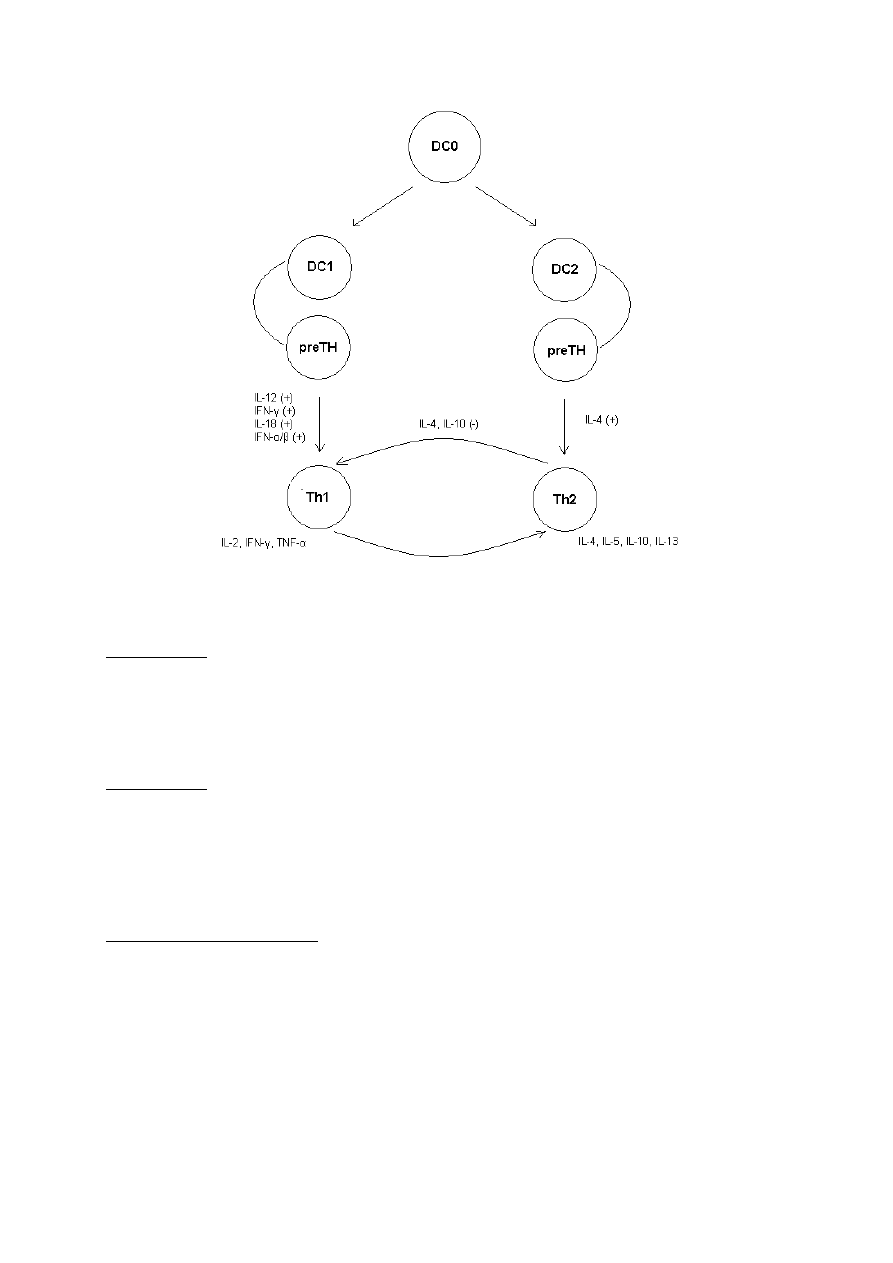
Podstawą różnicowania Th1 i Th2 jest wzorzec wydzielanych przez nie cytokin, różny dla obu
typów limfocytów.
Limfocyty Th1
Rozpoznają antygeny prezentowane przez makrofagi. Rozpoczynają i nasilają odporność
komórkową poprzez wydzielanie w/w cytokin (IL-2, IFN gamma, TNF alfa). Wydzielana przez nie
IL-2 łączy się także ze swoistym receptorem na aktywowanych limfocytach T8, co umożliwia im
proliferację i utworzenie dużego klonu identycznych limfocytów T8.
Limfocyty Th2
Rozpoznają antygeny prezentowane przez limfocyty B. Produkują takie cytokiny jak IL-4, 5,
9, 10 i 13, które promują produkcję przeciwciał, jak również umożliwiają aktywowanym limfocytom
B mnożenie się, różnicowanie do komórek plazmatycznych, wydzielanie i przełączanie klas
przeciwciał. Produkowana przez komórki Th2 IL-4 hamuje również wydzielanie IL-2 i INF gamma
przez komórki Th1, natomiast IL-10 blokuje produkcję chemokin przez limfocyty T8.
Różnicowanie się limfocytów T
Po stymulacji antygenem i/lub chemokinami limfocyty T proliferują, a powstałe komórki
potomne opuszczają obwodowe narządy limfatyczne i migrują do tkanek, gdzie kontynuują
odpowiedź przeciw antygenowi tak długo, jak długo jest on obecny w zaatakowanym organizmie.
Niektóre limfocyty różnicują się do krążących komórek pamięci T4 i T8, a także do
supresorowych komórek T8. Krążące komórki pamięci T4 i T8 pozwalają na znacznie szybszą i
silniejszą produkcję limfocytów T cytotoksycznych i cytokin podczas zetknięcia się z tym samym
antygenem. Supresorowe komórki T8 mogą pomagać w wyłączeniu zarówno komórkowej jak i
humoralnej odporności, prawdopodobnie niszcząc aktywowane komórki T i B poprzez
zaprogramowaną śmierć – apoptozę. Proces ten może być indukowany tak przez interakcję FasL/Fas
(opis w dalszej części), jak i przez pozbawienie limfocytów T koniecznej cytokiny – interleukiny 2
(IL-2).
Limfocyty T8
Posiadają na swojej powierzchni cząsteczkę CD8 oraz receptory TCR o unikalnej swoistości.
Receptory te we współpracy z cząsteczkami CD8 rozpoznają epitopy peptydów, zwykle 8-9
aminokwasowych, pochodzące z antygenów endogennych. Przyłączone są one do cząsteczek MHC I
wytwarzanych przez wszystkie komórki jądrzaste. Antygeny endogenne utworzone w obrębie
ludzkich komórek to:
Białka wirusowe wyprodukowane podczas replikacji
Białka bakterii namnażających się wewnątrzkomórkowo, takich jak Rickettsia i Chlamydia
Antygeny komórek nowotworowych
W uaktywnianiu limfocytów CD8 szczególnie skuteczne są komórki dendrytyczne. Aktywacja
limfocytów CD8 prowadzi do wytworzenia na nich receptora dla IL-2. Jest ona produkowana przez
limfocyty pomocnicze T4 (Th1) i jest konieczna do namnażania i różnicowania się limfocytów T8.
CD8 biorą udział w zabijaniu komórek zakażonych wirusami i nowotworowych, a także
alloprzeszczepów komórek. Mogą one także hamować produkcję Ig przez limfocyty B, opóźnioną
nadwrażliwość (DTH, typ IV) oraz odpowiedź komórkową CMI.
Limfocyty CD8 posiadają także na swojej powierzchni receptor CTLA4, który może wiązać się z
cząsteczką CD80/86 na powierzchni komórki APC, wyzwalając mechanizm aktywacji negatywnej,
czyli apoptozy klonu komórek CD8.
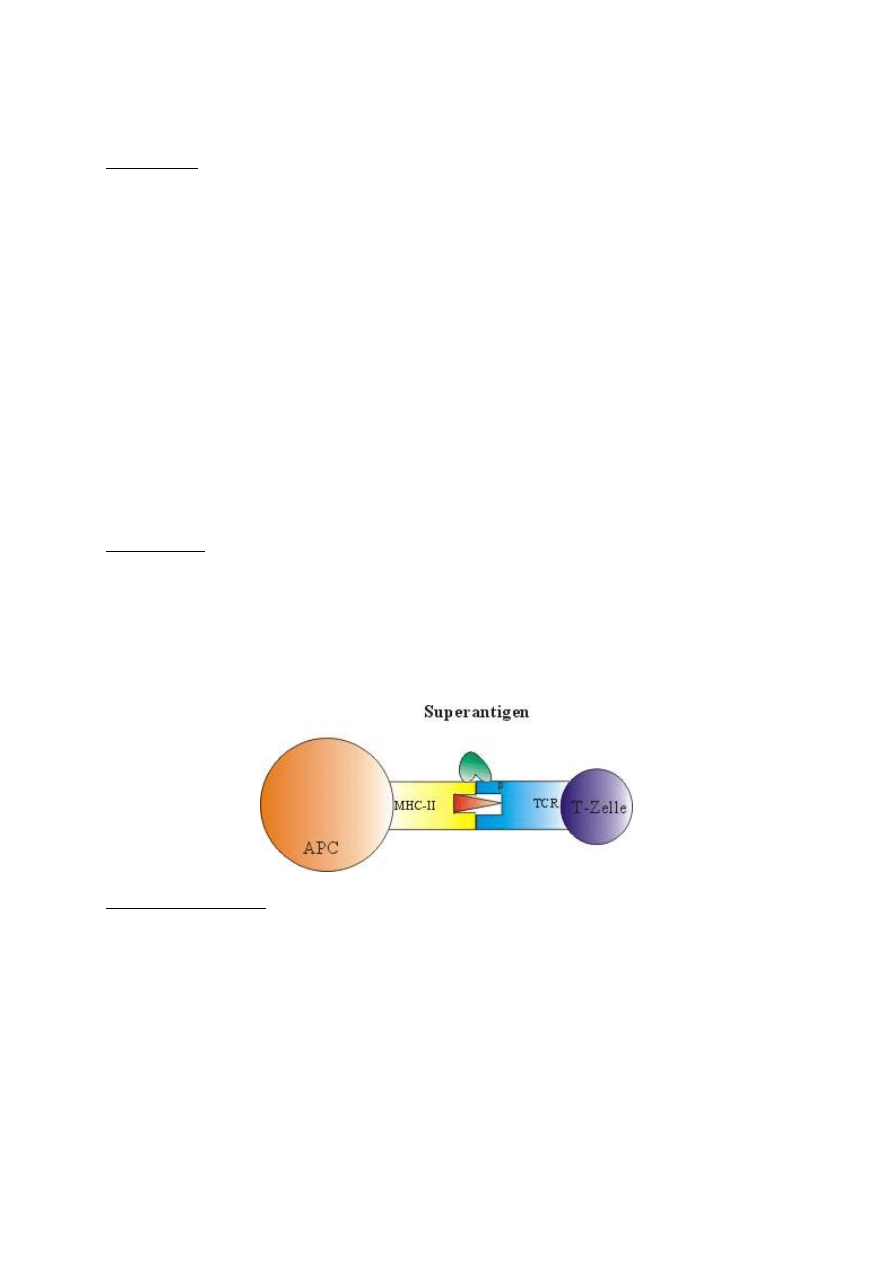
Superantygeny
Enterotoksyny gronkowca złocistego oraz toksyny paciorkowcowe łączą się z częścią zmienną
łańcucha beta receptora TCR oraz zewnętrzną częścią cząsteczki MHC-II, przez co powodują
niekontrolowaną produkcję cytokin, przede wszystkim IL-1, IL-2 oraz IL-6, co prowadzi do wstrząsu
septycznego.
Zwykle aktywacja obejmuje 0,0001 - 0,1% całej populacji limfocytów T, podczas gdy przy
aktywacji superantygenem wartość ta może sięgać nawet 20%.
Efektorowe T limfocyty
Efektorowe CD4 Th1 wpływając na makrofagi biorą udział w DTH i stymulują fagocytozę
endogennych antygenów, podczas gdy Th2 wpływając na limfocyty B stymulują produkcję
przeciwciał. Efektorowe CD8 zabijają zakażone lub zmienione nowotworowo komórki, po czym
oddysocjowują i atakują kolejną komórkę.
Mechanizmy działania odporności komórkowej – zalicza się do nich:
1. Aktywacja swoistych antygenowo cytotoksycznych komórek T (CTL) zdolnych do niszczenia
komórek organizmu posiadających na swojej powierzchni epitopy obcych antygenów bądź
nieprawidłowe. Proces ten może zachodzić dzięki degranulacji ziarnistości
wewnątrzkomórkowych zawierajacych perforyny, granzymy i chemokiny, jak również przez
mechanizm FasL/Fas.

2. Aktywacja makrofagów i komórek NK, umożliwiająca im niszczenie patogenów
wewnątrzkomórkowych.
3. Stymulacja komórek do wydzielania szerokiego wachlarza cytokin, wpływających na
funkcjonowanie innych komórek zaangażowanych w procesy wrodzonej i nabytej odpowiedzi
odpornościowej
Ad. 1 CTL
Ziarnistości wewnątrzkomórkowe
TCR i CD8 komórek CTL łączy się z kompleksem MHC-I / epitop na powierzchni komórki
zakażonej wirusem, następuje przekazanie sygnału przez cząsteczkę CD3, co powoduje uwalnianie
mediatorów - perforyn wzmagających przepuszczalność błon zakażonej komórki. Prowadzi to do jej
obumarcia. Granzymy zaś aktywują kaspazy – enzymy kierujące apoptozą zakażonej komórki.
Kaspazy są proteazami niszczącymi cytoszkielet i rozpuszczającymi komórkowe nukleoproteiny.
FasL/Fas
Komórki CTL posiadają na swej powierzchni cząsteczkę FasL (Fas ligand) która może
oddziaływać na receptory Fas znajdujące się na powierzchni wielu rodzajów komórek. Połączenie
FasL/Fas wyzwala wewnątrzkomórkową transdukcję, prowadzącą do zniszczenia białek cytoszkieletu
zakażonej komórki oraz rozbicia jej chromatyny.
Śmierć poprzez apoptozę nie powoduje uwalniania zawartości zakażonych komórek takich jak
mediatory zapalenia lub wirusy, co ma miejsce w przypadku lizy. Zamiast tego komórka rozpada się
na fragmenty - ciałka apoptotyczne posiadające ligandy dla receptorów fagocytów - usuwane później
w procesie fagocytozy. Redukuje to odpowiedź zapalną i zapobiega uwalnianiu wirusów, które
zgromadzone w obrębie zakażonej komórki mogą po uwolnieniu się z niej infekować zdrowe
komórki. Ponieważ CTL nie ulegają zniszczeniu w tym procesie, mogą one niszczyć kolejne zakażone
komórki.
Ad. 2
Makrofagi
Interleukina IL-2 oraz IFN gamma wytwarzane przez limfocyty Th1 aktywują makrofagi,
umożliwiając im niszczenie wewnątrzkomórkowych patogenów. Aktywowane makrofagi wydzielają
szereg cytokin, z których najważniejsze to:
IL-1 – działanie lokalne: aktywuje śródbłonek, aktywuje limfocyty, prowadzi do lokalnego
zniszczenia tkanki, zwiększając dostęp komórek efektorowych do niej, działanie ogólne:
gorączka, produkcja IL-6
TNF alfa – działanie lokalne: aktywuje śródbłonek, zwiększa przepuszczalność naczyń co
zwiększa przenikanie IgG, dopełniacza oraz komórek efektorowych, a także wzmaga drenaż
limfatyczny tkanki, działanie ogólne: gorączka, mobilizacja metabolitów, wstrząs
IL-6 - działanie lokalne: aktywuje limfocyty do zwiększonej produkcji przeciwciał, działanie
ogólne: gorączka, zwiększenie produkcji białek ostrej fazy
IL-8 – lokalny czynnik chemotaktyczny przyciągający neutrofile, bazofile i komórki T do
miejsca infekcji
IL-12 – aktywuje komórki NK, wzmaga przekształcanie się T limfocytów CD4 do komórek
Th1.
Komórki NK
Ich aktywacja zachodzi dzięki IL-2 wytwarzanej przez Th1, IL-12, 15, 18, 21 oraz
interferonom alfa i beta. Komórki NK posiadają dwa receptory: receptor aktywujący zabijanie (killer-
activating receptor) umożliwiający NK zabicie komórki do której przylega, oraz receptor hamujący

zabijanie (killer-inhibitory receptor). Ten ostatni rozpoznaje cząsteczki MHC-I obecne na
prawidłowych jądrzastych komórkach ludzkich. Po rozpoznaniu MHC-I przez receptor powstaje
ujemny sygnał, silniejszy od sygnału zabijania i zapobiegający zabiciu komórki przez NK.
Komórki NK prowadzą do lizy nieprawidłowych komórek poprzez wbudowanie do ich błony
perforyn - cząsteczek tworzących szczeliny w sposób podobny do obserwowanego w przypadku
komórek CTL i dopełniacza oraz wstrzyknięcie cytotoksycznych granzymów. Oprócz takiej
spontanicznej aktywności komórki NK są również zdolne do uczestniczenia w cytotoksyczności
zależnej od przeciwciał ADCC.
Wyszukiwarka
Podobne podstrony:
03 Immunologia prelekcja 10 15 2007id 4167 (2)
01 Immunologia prelekcja 10 01 2007id 2618 (2)
02 Immunologia prelekcja 10 08 2007id 3412 (2)
04 Immunologia prelekcja 10 22 2007id 4837 (2)
Immunologia - prelekcja 10.29.2007, immunologia
03 Immunologia prelekcja 10 15 2007id 4167 (2)
10 Immunologia prelekcja 12 02 2007id 10554 (2)
08 Immunologia prelekcja 11 19 2007id 7260 (2)
Immunologia - prelekcja 10.08.2007(1), 1.Lekarski, II rok, Immunologia, Prelekcje
09 Immunologia prelekcja 11 26 2007id 7759 (2)
Immunologia - prelekcja01 1.10.2007, IMMUNOLOGIA
13 Immunologia prelekcja 12 17 2007id 14455 (2)
07 Immunologia prelekcja 11 12 2007id 6717 (2)
Immunologia - prelekcja11 10.12.2007, IMMUNOLOGIA
Immunologia - prelekcja 10.15.2007, nauki BIOLOGiczne, medycyna, IMMUNOLOGIA
więcej podobnych podstron