
Elektyw:
T
OWAROZNAWCZA ANALIZA MIODÓW
Specjalność:
Towaroznawstwo żywności
STUDIA DZIENNE
Katedra Technologii Węglowodanów
Wydział Technologii Żywności
Uniwersytet Rolniczy w Krakowie
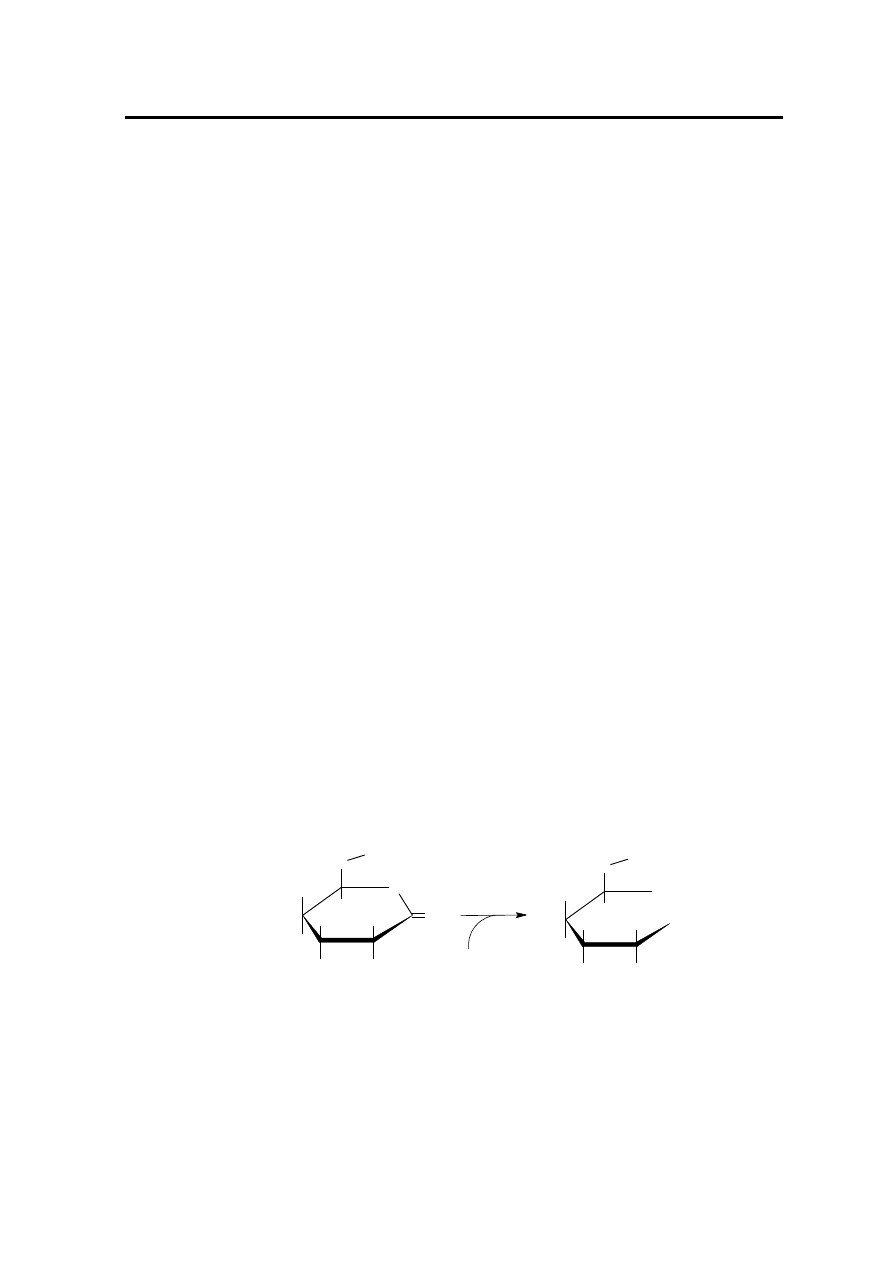
A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
2
1) O
ZNACZANIE KWASOWOŚCI MIODU PRZY UŻYCIU P
H-
METRU
[AOAC
O
FFICIAL
M
ETHOD
962.19
A
CIDITY
(F
REE
,
L
ACTONE
,
AND
T
OTAL
)
OF
H
ONEY
]
Oznaczenie kwasowości miodu wykonuje się metodą AOAC [AOAC Official Method 962.19
Acidity (Free, Lactone, and Total) of Honey]. Analizę przeprowadzić dla miodu nektarowego
i spadziowego. Każdy pomiar wykonać w co najmniej dwóch powtórzeniach. Jako wynik
analizy podać wartości cząstkowe, średnią oraz odchylenie standardowe.
W przypadku produktów takich jak miód wyróżnić można różne rodzaje kwasowości:
i.
Wolna kwasowość jest to kwasowość miareczkowa. Pod pojęciem tym rozumie się
sumę kwasów zdysocjowanych i niezdysocjowanych w roztworze i możliwych do
oznaczenia poprzez zobojętnienie równoważną im ilościowo objętością wodnego
roztworu NaOH.
ii.
Kwasowość laktonowa jest to kwasowość niemożliwa do bezpośredniego oznaczenia
poprzez miareczkowanie i wynikająca z występowania w miodzie kw. glukonowego
w formie laktonowej. Pierścień laktonowy będący wewnętrznym estrem kwasu
glukonowego rozerwać można przy podwyższonym pH, poprzez zastosowanie
nadmiaru roztworu ługu (NaOH) zgodnie z Rysunkiem 1. Określenie kwasowości
laktonowej polega na miareczkowaniu odwrotnym nadmiaru NaOH przy pomocy
mianowanego roztworu HCl.
O
H
H
H
O
H
OH
H
OH
H
2
C
OH
O
lakton
kwasu glukonowego
OH
COOH
H
H
H
O
H
OH
H
OH
H
2
C
OH
kwas glukonowy
H
2
O
Rysunek 1. Hydroliza laktonu kwasu glukonowego
iii.
Całkowita kwasowość to suma kwasowości wolnej i laktonowej.

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
3
W ramach ćwiczenia określić kwasowość laktonową, wolna i całkowitą dla handlowego
miodu nektarowego i spadziowego.
Wykonanie
W zlewce na 250 ml rozpuścić 10g próbki miodu w 75 ml wolnej od CO
2
wody. Mieszać za
pomocą mieszadła magnetycznego, zanurzyć elektrodę pH-metru i zanotować pH.
Miareczkować 0,05 M NaOH w tempie ok. 5,0 ml/min. Zakończyć miareczkowanie przy pH
8,5. Natychmiast dodać pipetą 10 ml 0,05 M NaOH i niezwłocznie miareczkować 0,05 M
HCl do pH 8,30. Wynik podać w milimolach/kg:
2) L
ICZBA DIASTAZOWA MIODU
[AOAC
O
FFICIAL
M
ETHOD
958.09
D
IASTATIC
A
CTIVITY OF
H
ONEY
/
H
ARMONISED
M
ETHOF OF
T
HE
I
NTERNATIONAL
H
ONEY
C
OMMISSION
]
Wstęp
Jedna jednostka aktywności diastatycznej to taka aktywność enzymów (z grupy amylaz)
zawartych w 100 g miodu, która pozwala na hydrolizę 1 g skrobi w ciągu 1 h w 37-40°C.
Liczbę diastazową (DN) wyraża się w stopniach Schade (lub Gothe).
Oznaczanie DN polega na rozkładzie określonej ilości skrobi przez α-amylazę, znajdującą się
w miodzie i wywołaniu zabarwienia roztworem jodu.
Założenia
Buforowany roztwór miodu wraz z roztworem skrobi inkubuje się aż do osiągnięcia
charakterystycznego punktu końcowego wyznaczanego fotometrycznie. Wynik jest wyrażany
jako ilość ml 1% r-ru skrobi zhydrolizowanego w ciągu 1 godziny, przez enzymy zawarte w 1
g miodu w temperaturze 40 ± 0,2
o
C.
Odczynniki
a. Bazowy roztwór jodu – W kolbie miarowej na 500ml rozpuścić 11 g
resublimowanego I
2
w 30 – 40 ml H
2
O zawierającego 22,0 g KI dopełnić do kreski
wodą.
b. Roboczy roztwór jodu – Rozpuścić 20 g KI oraz 2 ml r-ru I
2
przygotowanego w pkt
(a), w H
2
O i dopełnić do 500 ml. Przygotowywać świeży.

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
4
c. Bufor octanowy o pH 5,3 (1,59M). Rozpuścić 43,5 g NaCH
3
COO·3H
2
O w 200 ml
H
2
O, dodać około 5 ml CH
3
COOH (lodowatego) i dopełnić do 250 ml. W razie
potrzeby ustalić pH na 5,30 przy pomocy CH
3
COONa lub CH
3
COOH.
d. Roztwór chlorku sodu – 0,5M. W kolbie miarowej na 100ml rozpuścić 2,9 g NaCl w
H
2
O i dopełnić do kreski.
e. Roztwór skrobi – Odważyć 2,000 g s.m. skrobi rozpuszczalnej i zmieszać z 90 ml
H
2
O w kolbie stożkowej na 250 ml. Natychmiast doprowadzić do wrzenia, mieszając
(potrząsając) intensywnie. Zmniejszyć grzanie i ogrzewać na łagodnym ogniu przez 3
min, przykryć i odczekać aż ostygnie do temperatury pokojowej. Przenieść do kolby
miarowej na 100 ml i dopełnić do kreski.
Standaryzacja
Procedurę przeprowadza się dla ustalenia ilości wody potrzebnej do dodania do mieszaniny
reakcyjnej dla uzyskania absorbancji A 0,745 – 0,770.
do 6 kolbek wlać odpowiednio 10, 11, 12, 13, 14, 15 ml wody oraz 5 ml roztworu jodu.
Rozpoczynając od pierwszej kolbki dodać 0,5 ml rozcieńczonego roztworu skrobi (10 ml
wody i 5 ml r-ru skrobi), zmieszać dokładnie i odczytać absorbancję przy długości fali 660
nm wobec wody.
Postępować tak z następnymi kolbkami, ilość wody w kolbce dla której absorbancja wyniesie
0,745 – 0,770 jest rozcieńczeniem standardowym stosowanym dla skrobi.
Oznaczenie
Odważyć 10 g próbki do 20 ml zlewki, rozpuścić w 10-15 ml H
2
O i 5 ml r-ru buforowego a
następnie przenieść ilościowo do 50 ml kolby miarowej zawierającej 3 ml r-ru NaCl.
Dopełnić do kreski.
R-r skrobi (około 10 ml) oraz r-r miodu ( dokładnie 10 ml) w 50 ml kolbkach umieścić w
łaźni wodnej o temp. 40 ± 0,2
o
C na 15 minut. Po 15 minutach pipetą odmierzyć do kolbki
reakcyjnej (z r-rem miodu) 5 ml r-ru skrobi, zmieszać. Rozpocząć odmierzanie czasu. Po 5
minutach pobrać do probówki 0,5 ml r-ru przy pomocy 0,5 ml pipety jednomiarowej i dodać
do 5 ml rozcieńczonego r-ru I
2
. Zmieszać, rozcieńczyć (dodać wyznaczoną przy standaryzacji

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
5
roztworu skrobi objętość wody) i wyznaczyć A przy pomocy spektrofotometru względem
wody. Oznaczyć czas od zmieszania r-ru skrobi z r-rem miodu do dodania mieszaniny do I
2
jako czas reakcji. Kontynuować pobieranie r-ru aż do osiągnięcia wartości A<0,235.
Obliczenie wyniku
Sporządzić wykres zależności A od czasu (min). Z wykresu odczytać czas w którym badany r-
r osiąga A = 0,235. Aby otrzymać liczbę diastazową (DN) należy podzielić 300 przez czas
odczytany z wykresu.
3) O
ZNACZANIE ZAWARTOŚCI WODY METODĄ REFRAKTOMETRYCZNĄ
[AOAC
O
FFICIAL
M
ETOD
969.38
M
OISTURE
I
N
H
ONEY
]
Wstęp
Oznaczanie zawartości wody należy do rutynowych analiz przeprowadzanych w celu
ustalenia podstawowego składu chemicznego produktów spożywczych. Pozwala ono również
kontrolować przebieg procesów technologicznych.
W wielu produktach zawartość wody oznacza się metodą refraktometryczną. Metody
refraktometryczne polegają na pomiarze współczynnika załamania.
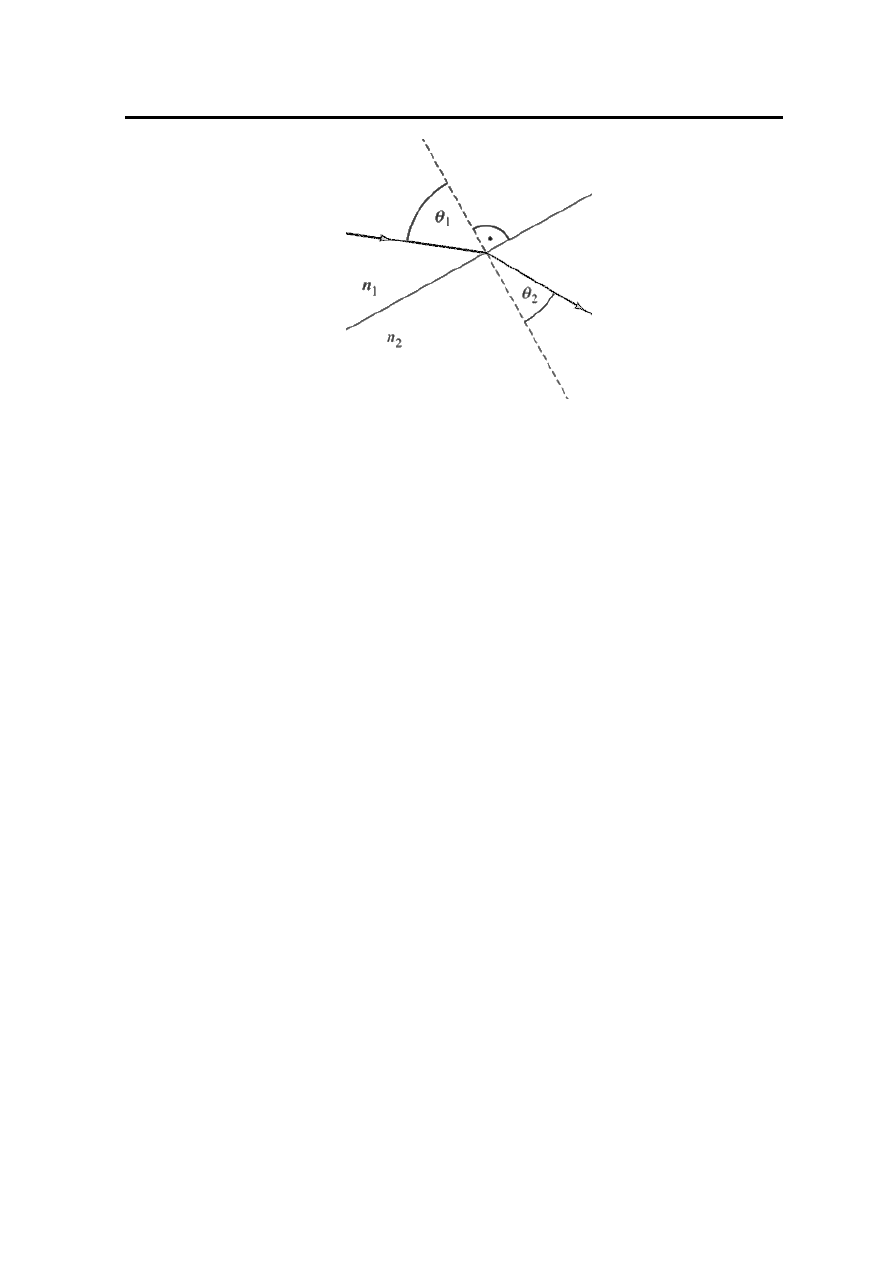
Światło przechodząc z jednego ośrodka do drugiego, na granicy tych ośrodków zmienia
gwałtownie kierunek biegu – Rysunek 2.
Zjawisko to nazywamy zjawiskiem załamania światła. Jego przyczyną jest różna prędkość
światła w ośrodkach. Biorąc pod uwagę fakt, iż częstotliwość fali świetlnej nie zmienia się
przy zmianie ośrodka, można wykazać, że zjawiskiem załamania rządzi prawo załamania lub
inaczej prawo Snelliusa:
A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
6
Rysunek 2. Zjawisko załamania światła
n
1
— współczynnik załamania światła ośrodka pierwszego,
n
2
— współczynnik załamania światła ośrodka drugiego,
θ
1
— kąt padania, kąt między promieniem padającym a normalną do powierzchni
granicznej ośrodków,
θ
2
— kąt załamania, kąt między promieniem załamanym a normalną.
Stąd, przy założeniu, że znamy współczynnik załamania ośrodka gęstszego, (dla którego kąt
θ
2
= 90
o
a więc
sinθ
2
= 1 można wyznaczyć współczynnik załamania interesującej nas
substancji (lub roztworu). Znając (na podstawie roztworów wzorcowych) zależność
współczynnika załamania światła od stężenia roztworu tłuszczu można określić jego
zawartość w produkcie.
Współczynnik załamania światła mierzy się najczęściej przy pomocy refraktometru Abbego –
rysunek 3. Wiązka światła białego pada na układ pryzmatów P1/P2. Po wyjściu z pryzmatu
P2 zostaje skierowana przez pryzmat kierujący P3 do układu pryzmatów P4 i P5. Następnie
promienie świetlne przechodzą przez obiektyw, który ogniskuje je w górnym oknie pola
widzenia okularu. Patrząc przez ten okular widzimy oświetloną część pola widzenia i część
ciemną. Obracając (znajdujące się po lewej stronie przyrządu) pokrętło pryzmatu P3 dokonuje
się dokładnego ustawienia linii rozgraniczającej jasne i ciemne pole nie bezpośrednio na tle
skali, ale (ze względu na wygodę obserwacji) na skrzyżowaniu nici pajęczych okularu. Z
ruchem pryzmatu P3 sprzężony jest przesuw ruchomej skali K widocznej w obiektywie w
odrębnym oknie. Dzięki skali możemy bezpośrednio odczytać wartość współczynnika
załamania z dokładnością do 0,0005. Podziałka układu odczytowego K oświetlona jest
światłem skierowanym przez zwierciadło Z2 zamocowane w uchylno-obrotowej oprawie po
A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
7
lewej stronie przyrządu.
Przygotowanie próbki
W przypadku miodu skrystalizowanego próbki miodu zamknąć szczelnie w probówkach i
ogrzewać w łaźni wodnej w temperaturze 50 (±0,2)˚C do momentu rozpuszczenia wszystkich
kryształów. Schłodzić do temperatury pokojowej i ponownie zamieszać.
Analiza
Przy pomocy refraktometru Abbego wyznaczyć współczynnik refrakcji. Z tabeli 1 odczytać
zawartość wody odpowiadającą wyznaczonemu współczynnikowi refrakcji, uwzględniając
poprawki temperaturowe. W temperaturze powyżej (poniżej) 20˚C dodać (odjąć) 0,00023 na
każdy stopień różnicy.
Tabela 1. Zawartość wody w zależności od współczynnika refrakcji*
%H
2
O
n
%H
2
O
n
%H
2
O
n
%H
2
O
n
13,0
1,5044
16,0
1,4966
19,0
1,4890
22,0
1,4815
13,2
1,5038
16,2
1,4961
19,2
1,4885
22,2
1,4810
13,4
1,5033
16,4
1,4956
19,4
1,4880
22,4
1,4805
13,6
1,5028
16,6
1,4951
19,6
1,4875
22,6
1,4800
13,8
1,5023
16,8
1,4946
19,8
1,4870
22,8
1,4795
14,0
1,5018
17,0
1,4940
20,0
1,4865
23,0
1,4790
14,2
1,5012
17,2
1,4935
20,2
1,4860
23,2
1,4785
14,4
1,5007
17,4
1,4930
20,4
1,4855
23,4
1,4780
14,6
1,5002
17,6
1,4925
20,6
1,4850
23,6
1,4775
14,8
1,4997
17,8
1,4920
20,8
1,4845
23,8
1,4770
15,0
1,4992
18,0
1,4915
21,0
1,4840
24,0
1,4765
15,2
1,4987
18,2
1,4910
21,2
1,4835
24,2
1,4760
15,4
1,4982
18,4
1,4905
21,4
1,4830
24,4
1,4755
15,6
1,4976
18,6
1,4900
21,6
1,4825
24,6
1,4750
15,8
1,4971
18,8
1,4895
21,8
1,4820
24,8
1,4745
25,0
1,4740
*International Honey Commission [2002]
4) O
ZNACZENIE PRZEWODNOŚCI WŁAŚCIWEJ
[H
ARMONISED METHODS OF THE
I
NTERNATIONAL
H
ONEY
C
OMMISSION
2002]
Substancje mineralne to najczęściej związki nieorganiczne o charakterze soli,
wodorotlenków lub kwasów. Wszystkie te połączenia należą do grupy elektrolitów (mocnych
lub słabych). W związku z tym roztwory zawierające te związki będą wykazywały
przewodnictwo elektryczne o charakterze jonowym. Stwierdzono, że przewodnictwo

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
8
właściwe roztworów elektrolitów jest wprost proporcjonalne do zawartości substancji
mineralnych. Na tej podstawie oszacować można, więc zawartość składników mineralnych
produktu, które są rozpuszczalne w wodzie i tworzą z nią roztwory właściwe.
Zasada pomiaru polega na wyznaczeniu wartości przewodności właściwej 20% roztwo-
ru suchej masy miodu za pomocą konduktometru. Oznaczenie opiera się na pomiarze
oporności elektrycznej roztworu, która jest odwrotnością przewodności właściwej.
Przygotowanie próbek
Rozpuścić 20 g miodu w przeliczeniu na suchą masę, przenieść ilościowo do kolby
miarowej o pojemności 100 cm
3
i dopełnić do kreski wodą destylowaną.
Oznaczenie
W przygotowanym roztworze zanurzyć elektrodę konduktometru i odczytać wartość
przewodności właściwej, wyrażoną w milisiemensach na centymetr.

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
9
WYCIĄG Z KART CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNYCH UŻYWANYCH W
TRAKCIE ĆWICZEŃ
Roztwór jodu w KI
O
ZNAKOWANIE ZGODNE Z
D
YREKTYWAMI
UE
Produkt nie wymaga oznakowania zgodnie z dyrektywami UE lub odpowiadającymi im przepisami
krajowymi.
W
SKAZANIA RYZYKA DLA LUDZI I ŚRODOWISKA
Substancja lub mieszanina nie stwarza zagrożenia zgodnie z dyrektywami 67/548/EWG lub 1999/45/WE
P
IERWSZA POMOC
W przypadku wdychania
Jeżeli osoba poszkodowana oddycha, przenieść na świeże powietrze. Jeśli poszkodowany nie oddycha,
zastosować sztuczne oddychanie
W przypadku kontaktu ze skórą
Zmyć mydłem i dużą ilością wody.
W przypadku połknięcia
Nieprzytomnej osobie nigdy nie podawać nic doustnie. Wypłukać usta wodą.
Roztwór NaOH i HCl
O
ZNAKOWANIE ZGODNE Z
D
YREKTYWAMI
UE
Znaki ostrzegawcze:
C Produkt żrący
Klasyfikacja:
R35 Powoduje poważne oparzenia.
W
SKAZANIA RYZYKA DLA LUDZI I ŚRODOWISKA
Działa szkodliwie po połknięciu. Działa drażniąco na oczy i skórę.
P
IERWSZA POMOC
W przypadku kontaktu ze skórą
Zmyć dużą ilością wody. Zasięgnąć porady medycznej.
W przypadku kontaktu z oczami
Przemywać dokładnie dużą ilością wody przynajmniej przez 15 minut i skonsultować się z lekarzem.
Można przepłukać oczy roztworem kwasu bornego.
W przypadku połknięcia
Wypłukać usta wodą. Zasięgnąć porady medycznej.

A
NALIZA
T
OWAROZNAWCZA MIODÓW
–
T
OWAROZNAWSTWO
Ż
YWNOŚCI
____________________________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
W
ĘGLOWODANÓW
–
WTŻ
–
UR
K
RAKÓW
10
Ver. 1.1.06.09.2010
Wyszukiwarka
Podobne podstrony:
cwiczenie 3 towar anal miod towz
cwiczenie 3 towar anal miod towz
cwiczenie 2 towar anal miod towz
cwiczenie 2 towar anal miod tow Nieznany
Kalend.-Ćwiczeń-z-Now.-Met.-Anal.-Żywn.-13-14, Nowoczesne metody analizy żywności
Anal Zespolony ćwiczenia, MS1
Anal Zespolony ćwiczenia, MS5
Anal Zespolony ćwiczenia, MS6
Anal Zespolony ćwiczenia, MS4
Anal Zespolony ćwiczenia, MS2
Anal Zespolony ćwiczenia, MS3
Kalend.-Ćwiczeń-z-Now.-Met.-Anal.-Żywn.-13-14, Nowoczesne metody analizy żywności
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
więcej podobnych podstron