
Elektrochemia
Korozja
Dr inż. Katarzyna Kozłowska
Korozja
Korozja jest to proces niszczenia metali w wyniku reakcji
elektrochemicznych i chemicznych zachodzących
podczas zetknięcia się metali z otaczającym je
środowiskiem gazowym albo ciekłym
Proces zaczyna się na powierzchni metalu

Podział
Kryterium - przyczyny zjawiska:
o Korozja elektrochemiczna
o Korozja chemiczna
Kryterium - skutki zniszczenia fazy metalicznej:
Korozja równomierna
Korozja miejscowa
Korozja międzykrystaliczna

Korozja elektrochemiczna
Wynik działania lokalnych ogniw galwanicznych tworzących
się na powierzchni metalu
Istotny składnik ogniw - roztwór elektrolitu
Korozja atmosferyczna
– elektrolit to skondensowana wilgoć
i woda opadowa zawierająca zawsze niewielką ilość
rozpuszczonych substancji: tlen, dwutlenek węgla,
dwutlenek siarki, tlenki azotu

Proces anodowy
Właściwy proces korozyjny wywołany przez działanie
ogniw korozyjnych to
proces anodowy
Przejście atomów metalu M do roztworu w postaci jonów
dodatnich M
Z+
M --> M
Z+
+ Z * e
(Z – ładunek)
Proces katodowy
Uwolnione w procesie anodowym elektrony - zużywane są w
równolegle przebiegającym procesie katodowym
Wydzielanie wodoru - kwaśny roztwór elektrolitu
-
depolaryzacja wodorowa
2H
+
+ 2e --> H
2
Lub - redukcja rozpuszczonego w obojętnym roztworze
elektrolitu tlenu
(depolaryzacja tlenowa)
1/2 O
2
+ 2e + H
2
O --> 2 OH
-
Proces anodowy i katodowy - biegną w różnych miejscach
powierzchni metalu

Podział lokalnych ogniw
korozyjnych
ogniwa powstałe wskutek zetknięcia dwóch różnych metali
ogniwa powstałe w wyniku zetknięcia metalu z wtrąceniami
niematalicznymi
ogniwa wytworzone wskutek częściowej pasywacji metalu, tj.
częściowego pokrycia go tlenkami
ogniwa powstałe w rezultacie napięć mechanicznych -
występujących w niejednorodnym chemicznie metalu czy
stopie
ogniwa stężeniowe - tworzą się gdy kawałek metalu styka się
z roztworami o różnych stężeniach soli lub tlenu
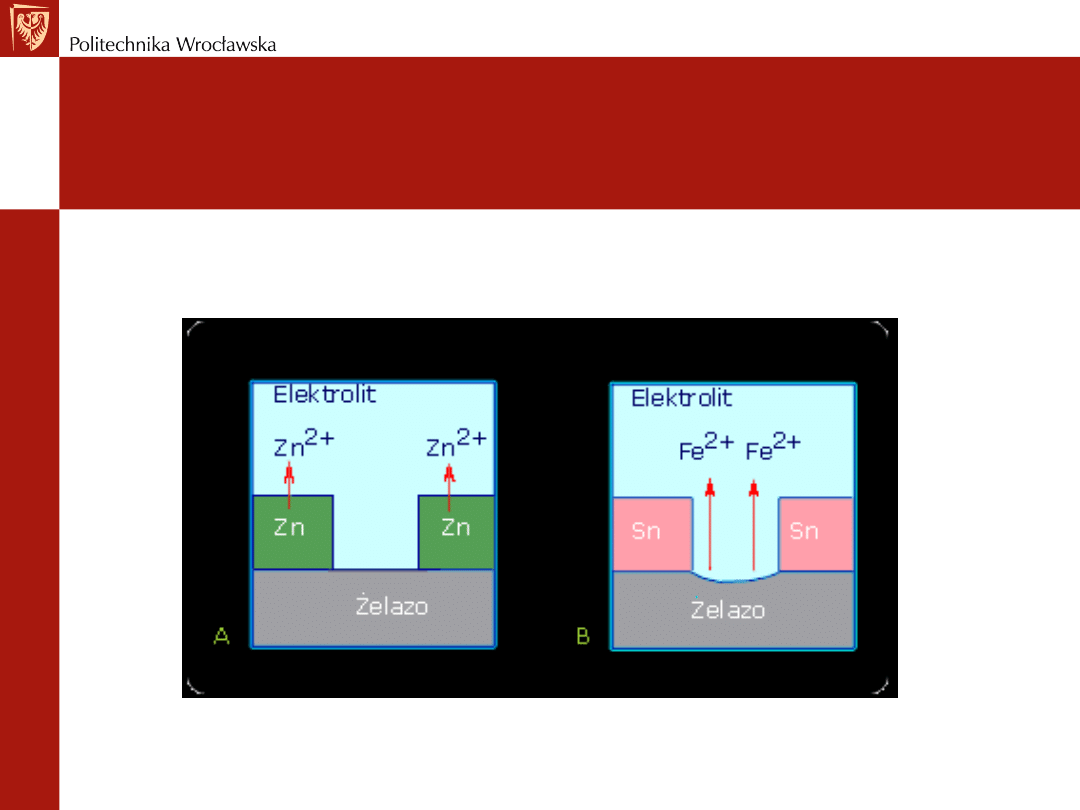
Korozja żelaza
Przykład ogniwa powstałego wskutek zetknięcia się dwóch różnych
metali - blacha pocynowana i pocynkowana
Korozja żelaza w miejscu ubytku ochronnej
powłoki
a) cynkowej b) cynowej

Korozja żelaza
Pokrycie blachy żelaznej cyną – metal o większym potencjale
normalnym - powłoka cyny chroni żelazo - dopóki nie
powstanie na niej rysa
W miejscach powierzchni odsłoniętych przez rysy – i
pokrytych wilgocią - rozpoczyna działanie ogniwo
Fe|elektrolit|Sn
Wynik działania tego ogniwa - odkryta powierzchnia to
obszar anodowy – nastąpi tu rozpuszczanie żelaza
Fe --> Fe
2+
+ 2e
Uwolnione elektrony są zużywane w procesie katodowym
(depolaryzacja wodorowa - gdy roztwór kwaśny, tlenowa –
gdy obojętny)

Korozja żelaza
Blachy żelazna ocynkowana
Gdy powłoka ochronna -uszkodzona
W utworzonym ogniwie lokalnym Zn|elektrolit|Fe
Anoda - elektroujemny cynk
Nastąpi rozpuszczanie cynku i ochrona żelaza
Zn --> Zn
2+
+ 2e

Przyczyny korozji – lokalne
mikroogniwa
Metale, stopy
W nich - pewne ilości wtrąceń niemetalicznych - tlenków,
siarczków
Przy zetknięciu metalu z roztworem elektrolitu
Tworzy się wiele
lokalnych mikroogniw
Ich działanie prowadzi do korozji
Przyczyny korozji – pasywacja
metalu
Częściowa pasywacja metalu
Na powierzchni metalu -cienka lecz dobrze kryjąca
metal warstwa tlenkowa
Tlenki metali mają wyższy potencjał od metali
Zatem - przy zetknięciu metalu z tlenkiem w obecności
elektrolitu - powstają
ogniwa lokalne
W ogniwach lokalnych - metal to anodą i ulega korozji

• 4. Czynnikami mechanicznymi
wpływającymi na pojawienie się
korozji są także naprężenia istniejące
w metalu lub powstające pod
działaniem sił zewnętrznych. Wskutek
tego między odkształconą a
nieodkształconą częścią powierzchni
metalu powstaje różnica potencjałów,
co w obecności elektrolitu prowadzi do
korozji elektrochemicznej.

Przyczyny korozji – mikroogniwa
korozyjne
Mikroogniwa korozyjne
Powstają także - jako ogniwa stężeniowe
Poprzez różne napowietrzenie elektrolitu
Rozpuszczony w elektrolicie tlen w miejscach o dużym stężeniu
tworzy elektrodę tlenową
Jej potencjał jest dodatni
Inne obszary jej powierzchni mają niższy potencjał -
i są obszarem anodowym
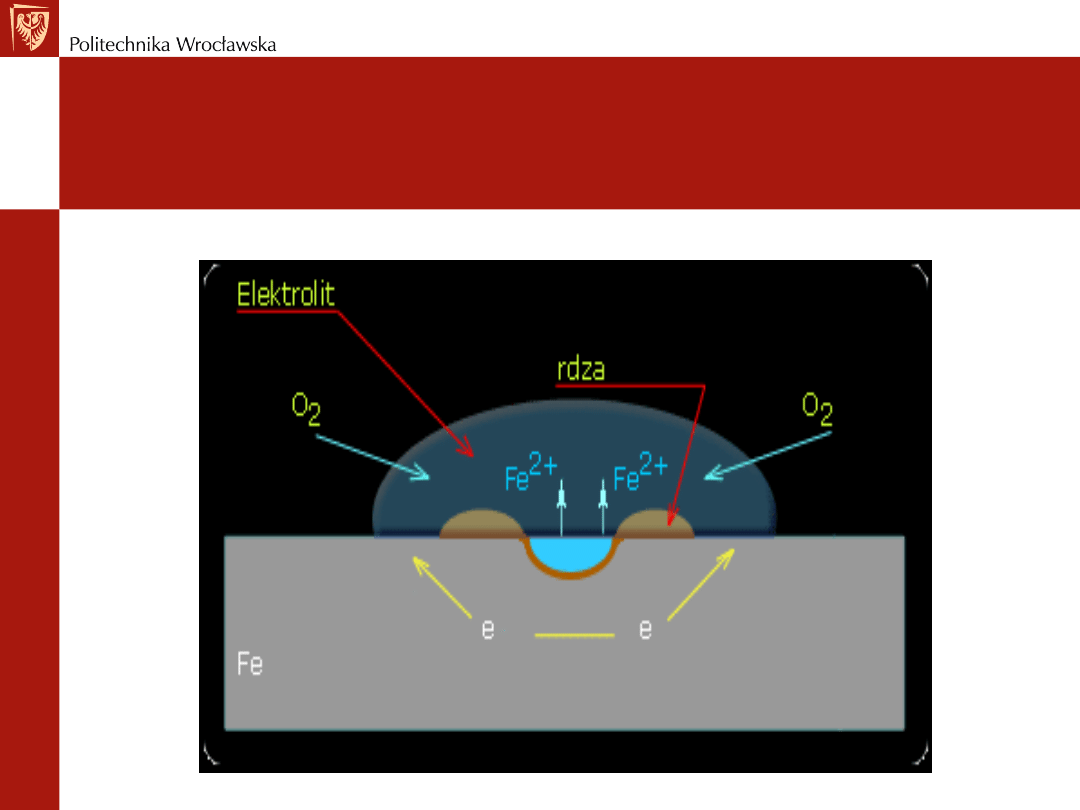
Korozja żelaza w kropli elektrolitu
wskutek różnego napowietrzenia
roztworu

Korozja żelaza w kropli elektrolitu
wskutek różnego napowietrzenia
roztworu
Części powierzchni metalu - w miejscach o mniejszym
stężeniu tlenu - to obszar anodowy
W obszarze anodowym
- następuje rozpuszczanie metalu
Obszar katodowy
- miejsca o lepszym dostępie tlenu –
biegnie tu redukcja rozpuszczonego tlenu (depolaryzacja
tlenowa)
Korozja żelaza w kropli elektrolitu
wskutek różnego napowietrzenia
roztworu
Płytka z żelaza
Powstające w reakcji katodowej jony OH
-
spotykają się z
dyfundującymi od obszarów anodowych jonami Fe
2+
dając
nierozpuszczalny Fe(OH)
2
Pod wpływem rozpuszczonego w wodzie tlenu Fe(OH)
2
ulega
powolnemu utlenieniu do Fe(OH)
3
2Fe(OH)
2
+ H
2
O + 1/2O
2
--> 2Fe(OH)
3
Mieszanina wodorotlenków Fe(OH)
2
i Fe(OH)
3
- po czasie - na skutek
reakcji częściowo przechodzi w tlenki żelaza (III) o różnym
stopniu uwodnienia lub w węglany –
Jest to tzw. rdza
Korozja chemiczna
Korozja chemiczna polega na bezpośrednim ataku
czynnika korozyjnego na metal lub stopy
Korozja chemiczna charakteryzuje się tym, że przez metal
podczas reakcji z czynnikiem korozyjnym (utleniaczem) nie
przepływa prąd elektryczny
Wymiana elektronów między metalem a utleniaczem
przebiega w środowisku nie wykazującym przewodnictwa
jonowego
Reakcję korozji
m
M +
n
U --> M
m
U
n
gdzie: M - metal, U - utleniacz

Korozja chemiczna
Najpospolitszym przykładem - korozja w gazach w podwyższonej
temperaturze – szczególnie tzw.
zendrowanie żelaza
Żelazo (stal) ogrzewane w powietrzu lub w atmosferze utleniającej
- powleka się warstewką tlenków żelaza głównie: Fe
3
O
4
- powstają
także pewne ilości Fe
2
O
3
i FeO – na skutek bezpośredniej reakcji
między żelazem a tlenem czy też innym czynnikiem utleniającym
Korozja chemiczna atakuje równocześnie całą powierzchnię
metalu narażoną na zetknięcie z czynnikiem korozyjnym
Prowadzi do wytworzenia szczelnie przylegającej ochronnej
warstwy produktów korozji
Lub w jej daje w wyniku powstaje warstwa porowata, nie
chroniącą metalu - korozja trwa aż do zupełnego zniszczenia
metalu lub do wyczerpania czynnika korozyjnego
Pasywność
Pasywność metalu to stan jego wysokiej odporności
chemicznej w ściśle określonych warunkach
Elektrochemiczne przejście metalu w stan pasywny związane
jest ze wzrostem jego potencjału elektrodowego
Związana z istnieniem warstewki ochronnej na powierzchni
metalu odpornej na działanie środowiska w określonych
warunkach
Warstewka ochronna - wytworzona przez utlenienie
powierzchni przez tlen gazowy lub jako wynik procesu
elektrochemicznego

Skutki procesów korozyjnych
Określa się jakościowo na podstawie obserwowanych
zniszczeń faz metalicznych w zależności od rozmieszczenia
zniszczeń
Korozja równomierna -rozprzestrzenia się równomiernie
na całej powierzchni przedmiotu metalowego -
nie wpływa
bezpośrednio na zmianę własności wytrzymałościowych
materiału - lecz pośrednio przez zmniejszenie przekroju
poprzecznego przedmiotu
Korozja miejscowa - zniszczenie obejmuje tylko pewne
miejsca powierzchni przedmiotu metalowego zaznaczone w
postaci plam, punktów i wżerów (bardzo niebezpieczne dla
materiału) -
wpływa silnie na zmniejszenie własności
wytrzymałościowych materiału i konstrukcji

Korozja międzykrystaliczna
Zniszczenie występuje na granicach ziaren postępując w głąb
materiału
Powoduje silny spadek własności wytrzymałościowych - często
trudny do zauważenia na powierzchni metalu
Podatne - stopy glinu, aurteniczne stale żaroodporne wskutek
wydzielania się nowej fazy z roztworów stałych i powstawania
związanych z tym naprężeń wewnętrznych w materiale
Ilościowe oznaczanie zniszczenia jest możliwe tylko w
badaniach laboratoryjnych
Ocena odporności materiału - określenie zmian zachodzących
w materiale w odniesieniu do czasu trwania procesu korozji
Miara odporności –
średnia szybkość korozji wyznaczona na podstawie ubytku
ciężaru, ubytku przekroju próbek lub procentowych zmian
własności fizycznych metalu lub stopu

Ochrona przed korozją
Dobór odpowiedniego metalu lub stopu
Osłabienie agresywności środowiska – stosuje się:
– zmniejszenie depolaryzacji tlenowej przez usuwanie tlenu i
elektrolitów o odczynie obojętnym np. odpowietrzanie wody
kotłowej
– inhibitory (opóźniacze) - substancje organiczne lub
nieorganiczne, które dodane do środowiska agresywnego,
zmniejszają wybitnie szybkość procesów korozyjnych
– ochrona katodowa - do konstrukcji chronionej dołącza się
zewnętrzną anodę w postaci metalu o potencjale
elektrodowym niższym niż materiał chronionej konstrukcji –
protektor (np. Cynk)
– połączenie protektora z konstrukcją chronioną wykonuje się
przez bezpośredni styk lub za pomocą przewodnika -
materiał chronionej konstrukcji staje się katodą i nie
koroduje

Ochrona przed korozją
Powłoki ochronne metaliczne –
– na podstawie działania rozróżnia się: powłoki katodowe i
anodowe
– powłoki katodowe
- utworzone z metalu o potencjale
elektrodowym bardziej elektrododatnim niż metal
chroniony w danych warunkach oddziaływania środowiska
– działanie powłoki ochronnej katodowej - czysto
mechaniczne
– powłoki katodowe na stali to: nikiel, miedź, cyna, ołów
– Powłoki anodowe - utworzone z metalu o bardziej
elektroujemnym potencjale elektrodowym niż metal
chroniony
– Powłoki anodowe
-chronią metal elektrochemicznie
– Dla stopów żelaza – powłoka anodowa - cynk i kadm

Ochrona przed korozją
Powłoki ochronne niemetaliczne
- otrzymuje się przez
wytworzenie na powierzchni metalu chronionego jego
związku chemicznego - tlenku, fosforanu itp. na drodze
reakcji chemicznej lub elektrochemicznej
– powłoki ochronne niemetaliczne nakładane dzielą się na:
a)
nieorganiczne -
emalie, powłoki cementowe
b)
organiczne
- lakiery, smoły, asfalty, smary i
farby
– główne zadaniem powłok - mechaniczna izolacja
powierzchni metalicznej od środowiska agresywnego
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
wyklad 12nowy procesy elektrodowe i korozja
PROCESY ELEKTROCHEMICZNE I KOROZJA
w10 elektrochemia korozja
wykład 5 elektroliza i korozja
wyklad 12nowy procesy elektrodowe i korozja
w10 elektrochemia korozja
korozja elektrochemiczna metali tom
KOROZJA ELEKTROCHEMICZNA
korozja elektrochemiczna i ochr Nieznany
elektrochemia-skrypt, cw-KOROZJA, KOROZJA
Chemia labolatorium, Korozja, Korozja - szkodliwe działanie chemiczne lub elektrochemiczne na powier
korozja chemiczna i elektrochemiczna metali, Studia, Chemia, chemia od Ines(1)
Korozja elektrochemiczna, Energetyka, I rok, chemia
KOROZJA I PROCESY ELEKTROCHEMIC Nieznany
Korozja elektrochemiczna
więcej podobnych podstron