
WŁAŚCIWOŚCI
BIAŁEK
MIOFIBRYLARNYCH

BIAŁKA MIĘŚNIOWE
Białka występujące w tkance mięśniowej są pod względem
zawartości drugim składnikiem, po wodzie i stanowią
około 16-24%, w zależności od zawartości tłuszczu.
Białka mięśniowe tworzą trzy duże grupy białek różniące
się:
• lokalizacją w mięśniu,
• właściwościami fizyko-chemicznymi
• właściwościami funkcjonalnymi.
Są to białka miofibryli, tkanki łącznej zwane też białkami
stromy oraz plazmy mięśniowej czyli sarkoplazmy.

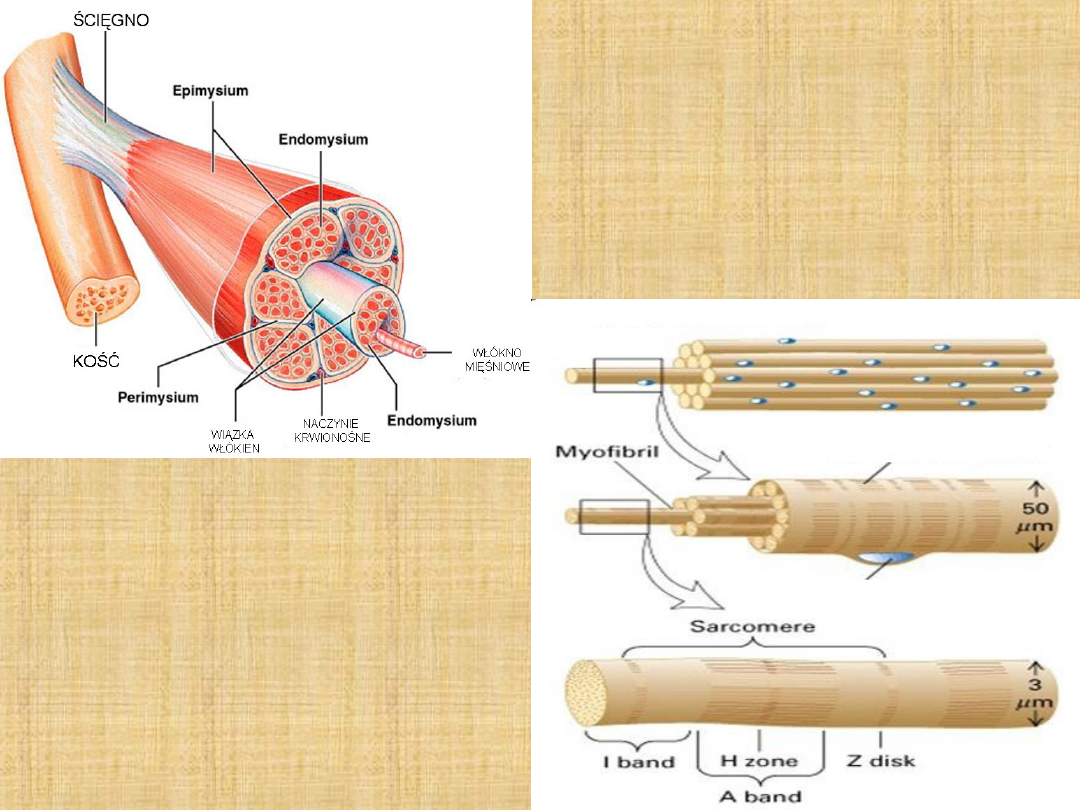
BIAŁKA MIOFIBRYLI
Białka włókna mięśniowego zwane też białkami miofibryli
tworzą strukturę włókna mięśniowego. Białka
miofibryli tworzą największą grupę białek i stanowią
55-60 % ogólnej ilości białek mięśniowych. Miofibryle
zajmują około 80 % objętości włókna. Wśród białek
miofibryli można wyróżnić trzy grupy:
• białka kurczliwe
• białka regulujące skurcz
• białka cytoszkieletowe
Białka miofibrylarne można wyizolować z tkanki mięsnej
roztworami soli o sile jonowej 0,6

Białka kurczliwe
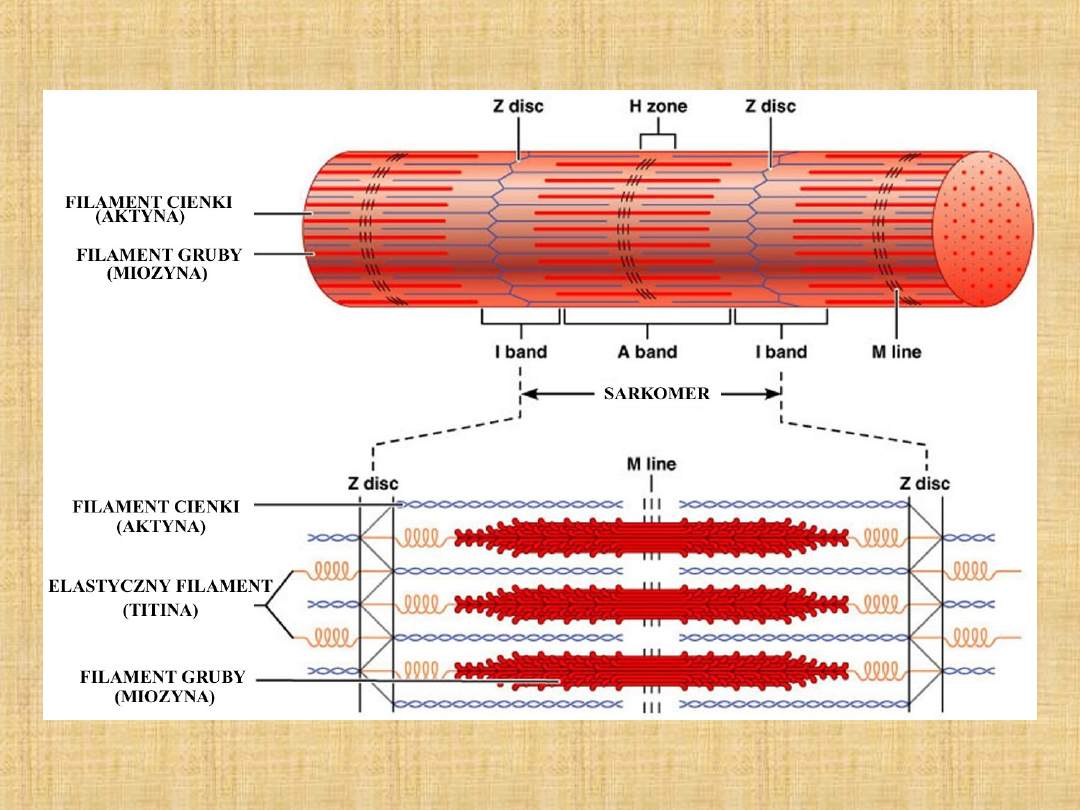
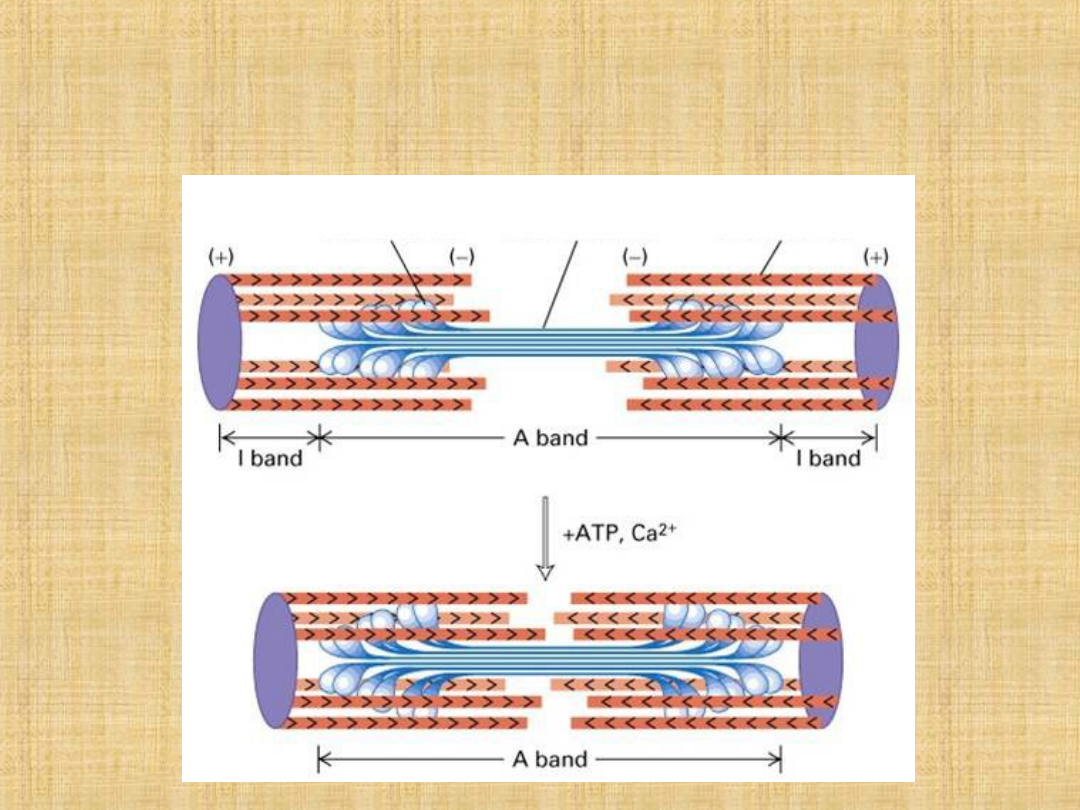
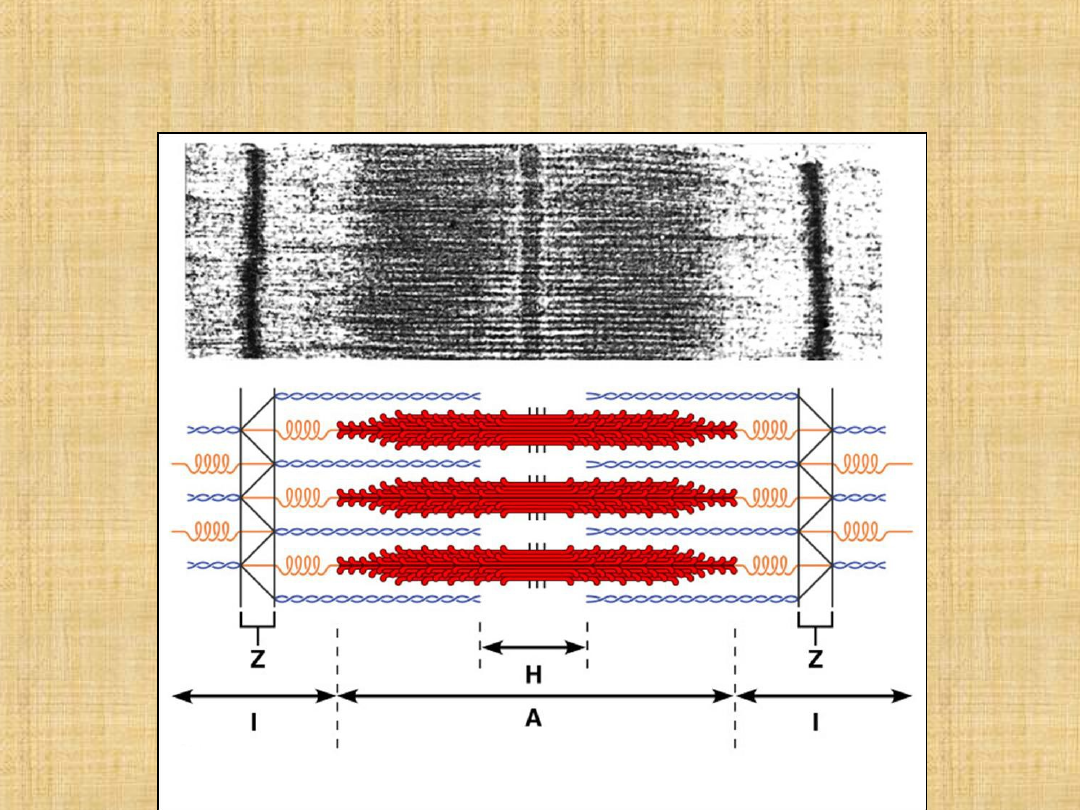
Miozyna jest zlokalizowana w strukturze filamentów grubych
miofibryli
• stanowi 45% białek miofibryli
• białko o masie 500 kDa w 60 – 70% posiadającym strukturę
-helisy
Miozyna posiada trzy ważne właściwości biologiczne:
• jest enzymem o aktywności ATP-azy
• tworzy naturalne kompleksy z aktyną (aktomiozyna)
• cząsteczki miozyny reagują ze sobą tworząc filamenty.
Cząsteczka miozyny zawiera duże ilości reszt kwasu asparaginowego
i glutaminowego, co wskazuje, że w fizjologicznym pH jest
cząsteczką naładowaną ujemnie. Punkt izoelektryczny dla miozyny
(pI) wynosi 5,3 i ma znaczący wpływ na pI mięsa (5,4 – 6,2)
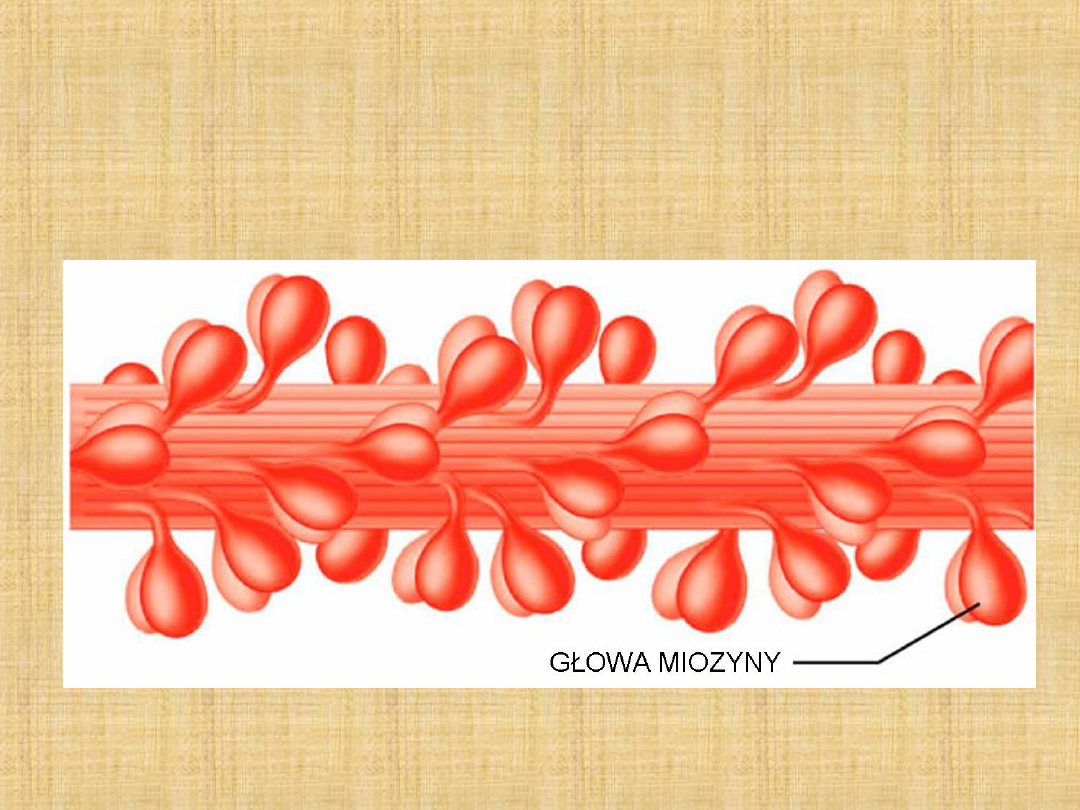
Cała cząsteczka miozyny zawiera dwugłowy globularny
region, który związany jest z długim helikalnym ogonem.
Zbudowany on jest z dwóch skręconych wzajemnie
superhelis, które uczestniczą w tworzeniu filamentów
grubych.
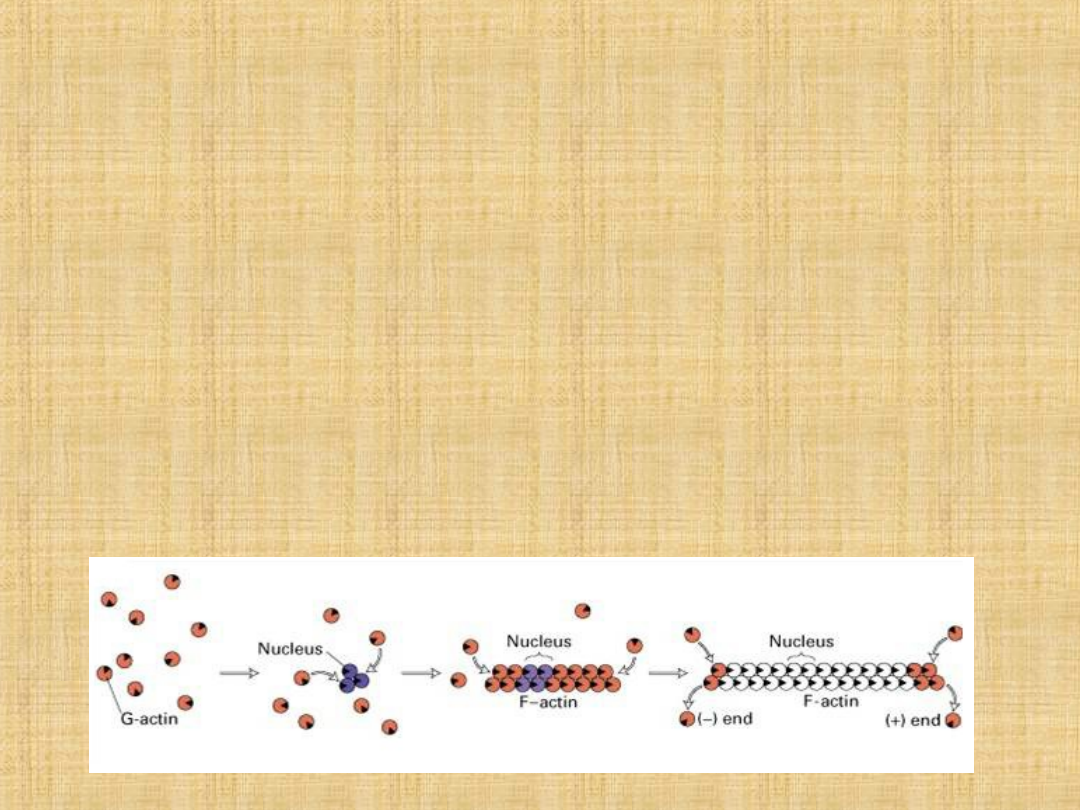
Aktyna
Aktyna jest drugim co do zawartości białkiem miofibryli, i stanowi
ponad 20% ich masy.
Należy do białek kurczliwych włókna mięśniowego.
Aktyna jest składnikiem cienkich filamentów. W mięśniu występuje w
formie spolimeryzowanej w postaci F-aktyny, formy fibrylarnej. W
roztworach o niskiej sile jonowej- aktyna występuje jako monomer
o masie 42 kDa, w tzw. formie globularnej G- aktyna. Aktyna jest
też ATP-azą lecz nie wywołuje skurczu mięśnia, lecz bierze udział w
polimeryzacji i depolimeryzacji filamentu.

Cząsteczka G-aktyny tworzy pojedynczy łańcuch
peptydowy o masie 42 kDa. Filament cienki w mięśniu
składa się z ok. 400 cząsteczek aktyny. Spolimeryzowana
aktyna (F-aktyna) tworzy dwa łańcuchy superhelisy o
masie kilkunastu MDa. Cząsteczka aktyny zawiera 376
reszt aminokwasowych o wysokim udziale proliny i
glicyny. Wysoki udział tych dwóch aminokwasów jest
przypuszczalnie odpowiedzialny za strukturę -helisy i
globularnego kształtu cząsteczki. Punkt izoelektryczny
białka wynosi 4,8.

BIAŁKA REGULUJĄCE
SKURCZ
Głównymi białkami regulującymi skurcz mięśnia są
tropomiozyna i troponina, których ilość wynosi średnio 5%.
Dodatkowo miofibryle zawierają inne białka występujące
w mniejszej ilości w strukturze miofibryli (pasmo A i I oraz
dysk Z) są to:
--γ-aktynina,
• Białko C-, M-, H- i X-
• Paratropomiozyna
Ich funkcja w żywej tkance nie zawsze jest sprecyzowana a
tym bardziej ich rola w jakości i funkcjonalności
technologicznej mięsa jako żywności.

Tropomiozyna
Białko to jest cząsteczką o budowie asymetrycznej składającej się z
dwóch podjednostek i o masie cząsteczkowej 34 i 36 kDa i o
strukturze -helikalnej skręconej w superhelisę o długości ok. 42 nm.
Tropomiozyna:
• wiąże się z F-aktyną w stosunku stechiometrycznym 1:7
• troponiną T w stosunku 1:1
• reguluje aktywność ATP-azy miozynowej
wiązania lub uwalniania jonów wapnia przez troponinę powoduje
maskowanie lub odsłanianie aktywnego centrum aktyny
uczestniczącego w wiązaniu miozyny. Przy maskowaniu centrum
utworzenie kompleksu aktomiozyny jest niemożliwe. Tropomiozyna
ma tendencje do polimeryzowania. Charakteryzuje ją wysoka
oporność na denaturację.
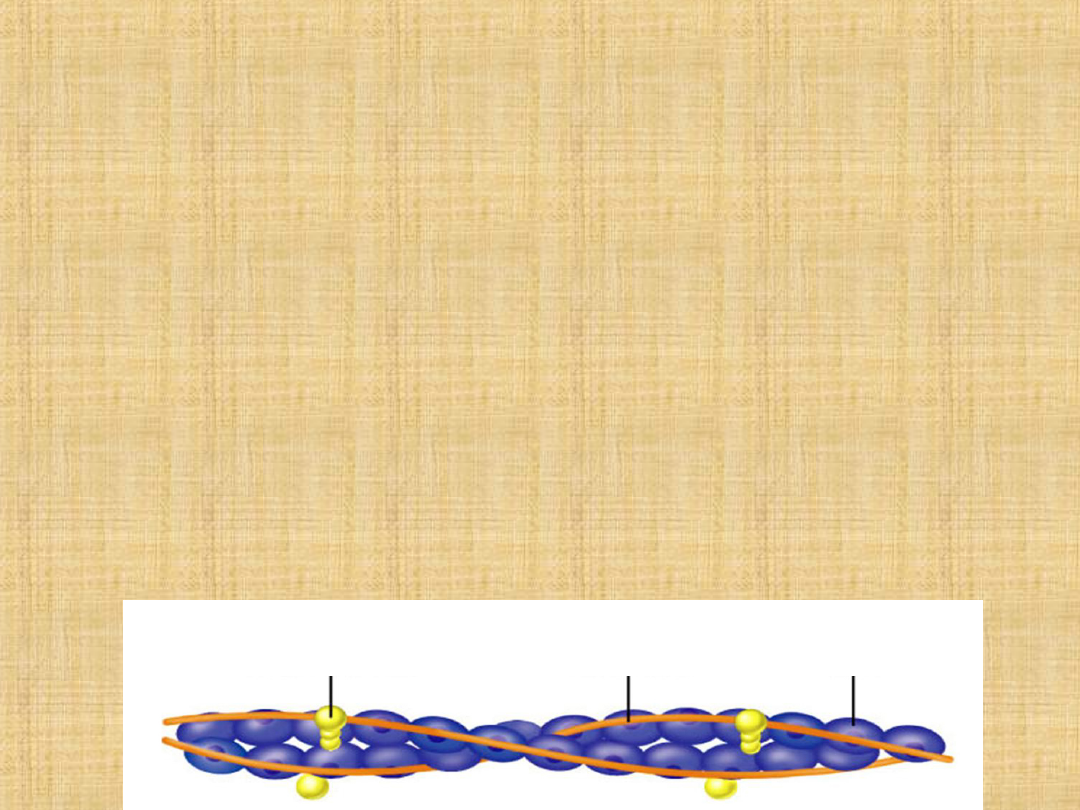
Troponina
Podobnie jak tropomiozyna występuje regularnie w bruzdach
filamentów aktynowych.
Troponina jest białkiem kompleksowym składającym się z trzech
podjednostek nazwanych:
• C zdolne do wiązania jonów wapnia
• I właściwości inhibowania kontrakcji miozyny z aktyną
• T ze zdolnością do wiązania się z tropomiozyną
Tropomina C zawierająca dużą ilość reszt kwaśnych aminokwasów,
zawiera 159 aminokwasów i ma masę cząsteczkową 17-18 kDa. Ma
ona cztery miejsca wiązania jonów wapnia i zdolność wiązania z
innymi podjednostkami w obecności tych jonów. Przyłączenie jonów
wapnia wywołuje konformacyjne zmiany w tropominie C, co z kolei
inicjuje regulacyjne działanie kompleksu troponina-tropomiozyna w
skurczu mięśnia.
KOMPLEKS TROPONINY TROPOMIOZYNA AKTYNA

BIAŁKA REGULUJĄCE
• W środku pasma A występuje białko M. Główną funkcją białek linii M jest
utrzymanie grubego filamentu w linii.
• Białko C występuje w grubych filamentach. Cząsteczki tego białka spinają
cząsteczki miozyny w gruby filament. Na jeden filament przypada ok. 37
cząsteczek białka C. Jeden pierścień białka C zawiera 3-5 cząsteczek. Białko
C:
• zawiera dużo (97,1%) proliny co powoduje, że posiada strukturę
-helisy
• masa cząsteczkowa od 135 do 150 kDa.
Dekompozycja tego białka rozluźnia strukturę filamentu i ułatwia
uwalnianie cząsteczek miozyny.
-Aktynina jest głównym białkiem linii Z, stanowi około 2 % masy białek
miofibryli o masie 95 kDa.
Białko to mocuje cienkie filamenty sąsiadujących sarkomerów w linii Z.
Poubojowe uwalnianie się -aktyniny związane jest z dekompozycją linii Z
oraz wzrostem kruchości mięsa.

BIAŁKA CYTOSZKIELETOWE
Cytoszkielet komórki mięśniowej tworzą filamenty:
• titinowe
• nebulinowe
• filamenty pośrednie
• struktury podbłonowe tzw. kostamery
Ze względu na lokalizację w stosunku do miofibryli białka
cytoszkieletowe można podzielić na wewnętrzne i zewnętrzne.
Titina i nebulina tworzą szkielet wewnętrzny podporowy dla
miozyny i aktyny. Szkielet zewnętrzny tworzą filamenty
pośrednie, które zlokalizowane są na zewnątrz miofibryli i
zbudowane są z takich białek jak: desmina, synemina i
wimentyna.

TITINA
Titina od greckiego słowa „titan”, które oznacza ogromny,
olbrzymi.
Stanowi 7-10% masy białek miofibrylarnych (masa ok.
2800- 3000 kDa)
Filamenty titiny posiadają zdolność wiązania się z
filamentem miozyny, a także z białkiem C i
prawdopodobnie z białkami linii M.
W obszarze prążka I, titina występuje w postaci
niezwiązanej, stąd jej duża elastyczność w tym miejscu
Titina jest bardzo podatna na działanie proteaz mięsa i
charakteryzuje się bardzo długą cząsteczką ok. 1 μm

NEBULINA
Nebulina tworzy filamenty nierozciągliwe zakotwiczone w lini Z
przebiegającej wzdłuż filamentów aktynowych o masie
cząsteczkowej w zakresie 600-900 kDa. Długość filamentu
nebulinowego wynosi podobnie jak dla titiny ok.1 m, a jego
średnica 1 nm. Tworzy ona filament nierozciągliwy i jest
najtrudniej rozpuszczalnym białkiem mięśniowym.
Główną funkcją nebuliny:
• stabilizacja i regulacja długości filamentów aktynowych
• wiąże się z -aktyniną i F-aktyną
• pośredniczy w umocowywaniu filamentu cienkiego do linii Z
• odgrywa rolę w utrzymywaniu integralności sarkomeru
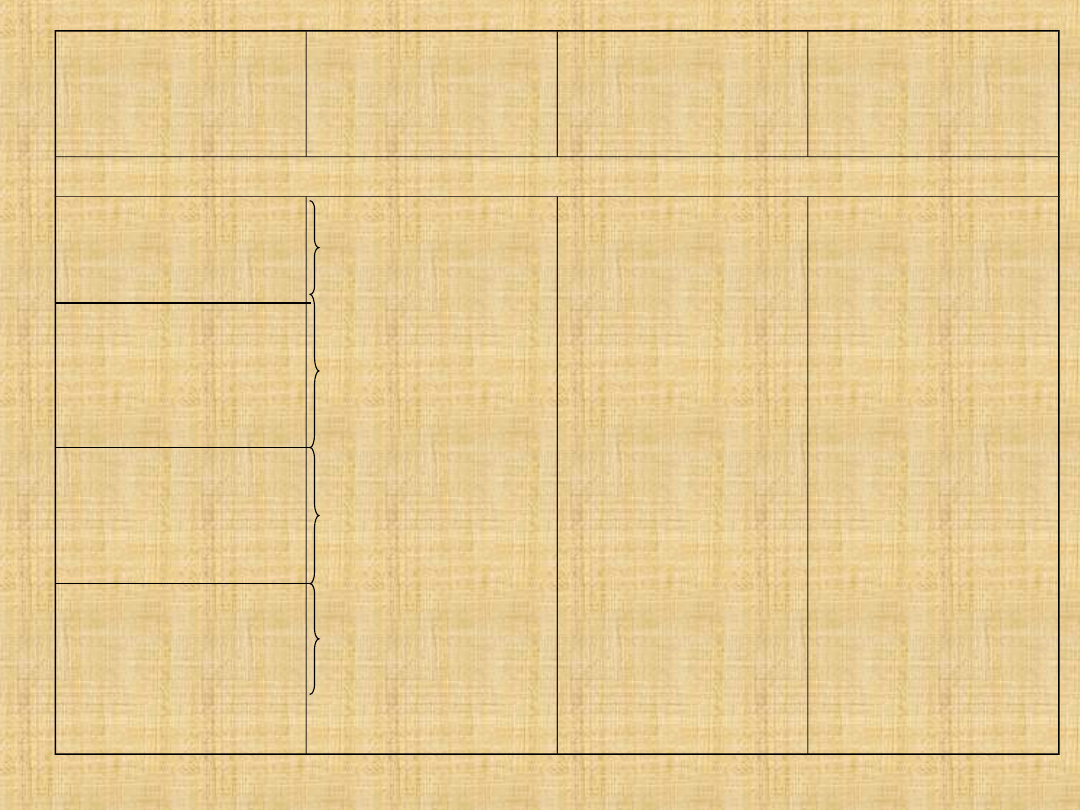
Białko
Lokalizacja w
sarkomerze
Udział w białkach
miofibrylarnych[%]
Przybliżona masa
cząsteczkowa
[kDa] (liczba
podjednostek)
BIAŁKA MIOFIBRYLARNE
Miozyna
Białko C
Białko H
Aktyna
Tropomiozyna
Troponina
Tropomodulina
Miomezyna
Białko M
Kinaza kreatyny
Skelemina
-aktynina
-aktynina
Zeugmatyna
45
2
<1
20
5
5
<1
1
2
<1
<1
2
<1
<1
520 (6)
130 (1)
74 (1)
42 (1)
66 (2)
69 (3)
41 (1)
185 (1)
165 (1)
80 (2)
195 (1)
204 (2)
66 (2)
2000 (2)
FILAMENT
GRUBY
FILAMENT
CIENKI
LINIA M
LINIA Z

Białko
Lokalizacja w
sarkomerze
Udział w białkach
miofibrylarnych[%
]
Przybliżona masa
cząsteczkowa
[kDa] (liczba
podjednostek)
BIAŁKA CYTOSZKIELETOWE
Titina
(konektyna)
Nebulina
Desmina
Synemina
Winkulina
Wimentyna
Wzdłuż filamentu
grubego i
cienkiego
(od linii Z do M)
Wzdłuż filamentu
cienkiego
Filamenty
pośrednie przy
linii Z i kostamery
Kostamery i
Filamenty
pośrednie przy
linii Z
10
4
<1
<1
<1
1
2800 (1)
800 (1)
212 (4)
460 (2)
130
55

WŁAŚCIWOŚCI FUNKCJONALNE
Właściwości które wpływają na zachowanie białek podczas
przetwarzania i przechowywania żywności oraz na
kształtowanie jej cech jakościowych i organoleptycznych.
Właściwości funkcjonalne:
• wodochłonność
• zdolność do żelowania (miofibryle> sarkoplazmatyczne)
• zdolność do emulgowania tłuszczu
wg malejącej zdolności emulgującej miozyna> aktomiozyna>
aktyna
• zdolność do stabilizowania emulsji (aktyna> miozyna)
• rozpuszczalność
• lepkość
• kohezyjność (aglomeracja)
• adhezyjność (siły wiązania się różnych składników mięsa)
SKÓRCZ
RELAKSACJA
SKÓRCZ
GŁOWA MIOZYNY GRUBY FILAMENT CIENKI FILAMENT
RELAKSACJA
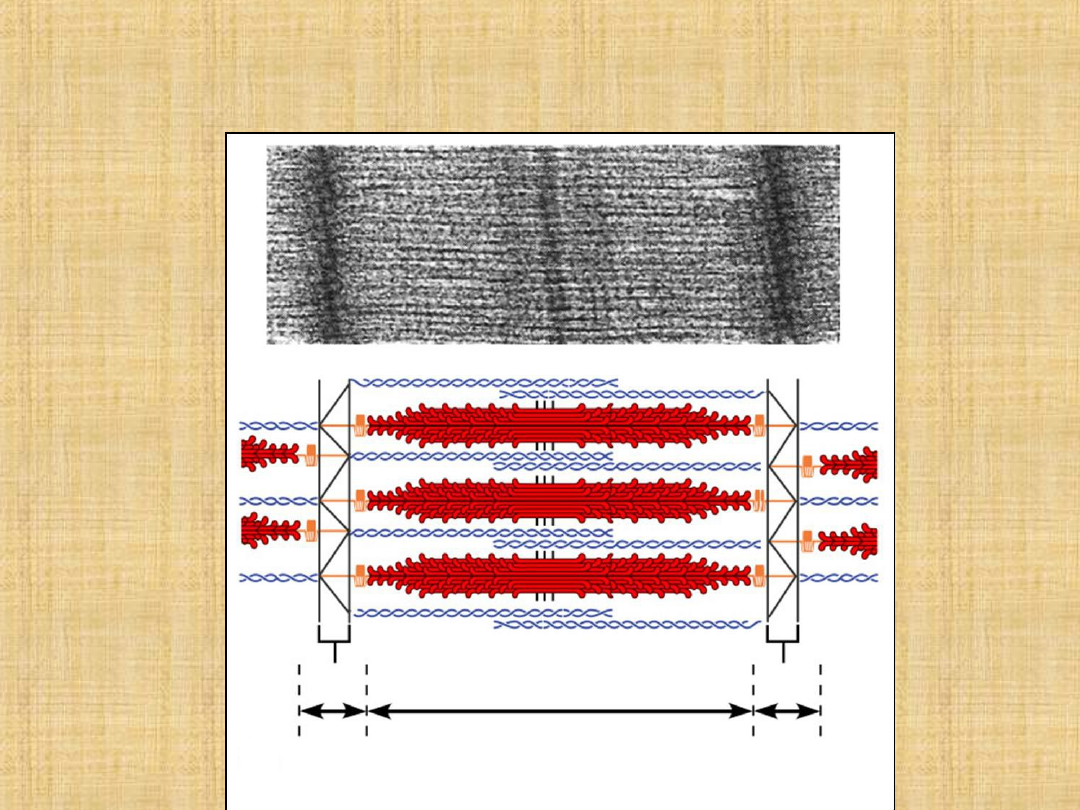
SKÓRCZ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
budowa i właściwości białek
sprawozdanie 3, Właściwości białek i kwasów nukleinowych
WŁAŚCIWOŚCI FIZJOLOGICZNE MIĘŚNIA SERCA, ZDROWIE, Kardiologia
,biologia L, właściwości białek, cukrów i tłuszczy
WŁAŚCIWOŚCI FIZJOLOGICZNE MIĘŚNIA SERCOWEGO(1), BILOGIA, FIZJOLOGIA CZŁOWIEKA
Fizykochemiczne właściwości białek i aminokwasów sprawozdanie
Biomechanika i właściwości fizyczne mięśni Rodzaje pracy mięśniowej, Biomechanika, biomechanika calo
Właściwości białek i kwasów nukleinowych Reakcje charakterystyczne
Biotechnologiczna modyfikacja biologicznych wlasciwosci bialek zboz
Właściwości fizykochemiczne białek
Projektowanie nowych białek o zadanych właściwościach katalitycznych
Wybrane zagadnienia z fizjologii mięśni i fizyczne właściwości mięśni, Biomechanika
wykład 2 Struktura, funkcje i właściwości mięśni szkieletowych
Chemia żywnosci Cwiczenie laboratoryjne nr 1 wyodrebnianie i badanie własciwosci fizykochemicznych b
ćwiczenia 2, bio2, Temat zajęć: Właściwości aminokwasów i białek
Sprawozdanie Właściwości fizykochemiczne białek
zwiekszenie siły i ciezar właściwy miesni, FIZJOTERAPIA, Różne, Trening
więcej podobnych podstron