Wiązania chemiczne
Teorie wiązań chemicznych
TWORZENIE
WIĄZAŃ CHEMICZNYCH
Elektronowa teoria
wiązania chemicznego
Kwantowa teoria wiązania
chemicznego
Pionierem rozwoju teorii wiązania
chemicznego był R. Abegg, który
sformułował teorię oktetu.
W 1916 r. W. Kassel opisał wiązanie
jonowe, a G. Lewis wiązanie
kowalencyjne.
Jednym z podstawowych założeń obu
tych
teorii było przyjęcie, że w przypadku
gazów szlachetnych ilość ich
elektronów walencyjnych zapewnia
szczególną trwałość atomom tych
pierwiastków.
Kwantowa teoria wiązania
chemicznego
w odróżnieniu od teorii
elektronowej
stosowana jest w chemii
kwantowej
do opisu wiązań chemicznych.
Stosuje się tutaj dwa sposoby
opisu
elektronów w cząsteczce, tj.
metodą orbitali
molekularnych
metodą wiązań
walencyjnych

Elektronowa teoria wiązania chemicznego
Teoria ta zakłada, że atomy dążą do uzyskania
konfiguracji
helowca
położonego najbliżej w układzie
okresowym, czyli do uzyskania
oktetu lub dubletu
elektronów walencyjnych.
Atomy mogą to uczynić na kilka sposobów:
oddać nadmiarowe elektrony innemu pierwiastkowi
(atom metalu tworzy kation)
przyjąć brakujące elektrony od innego pierwiastka
(atom niemetalu tworzy anion)
podzielić się elektronami (uwspólnić je), w ten sposób
obydwa łączące się atomy uzyskają oktet lub dublet.
Teoria zakłada, że podczas powstawania wiązania chemicznego
chmury elektronowe orbitali (
zawierających niesparowany
elektron
) każdego z wiążących się atomów przenikają się lub
nakładają nawzajem i powstają w ten sposób tzw.
orbitale
molekularne
.
Orbitale atomowe, które opisując elektrony walencyjne
atomów wchodzących w skład cząsteczki, spełniają
następujące warunki:
mają porównywalne energie,
wzajemnie się nakładają,
wykazują jednakową symetrię w stosunku do prostej łączącej
jądra atomów.
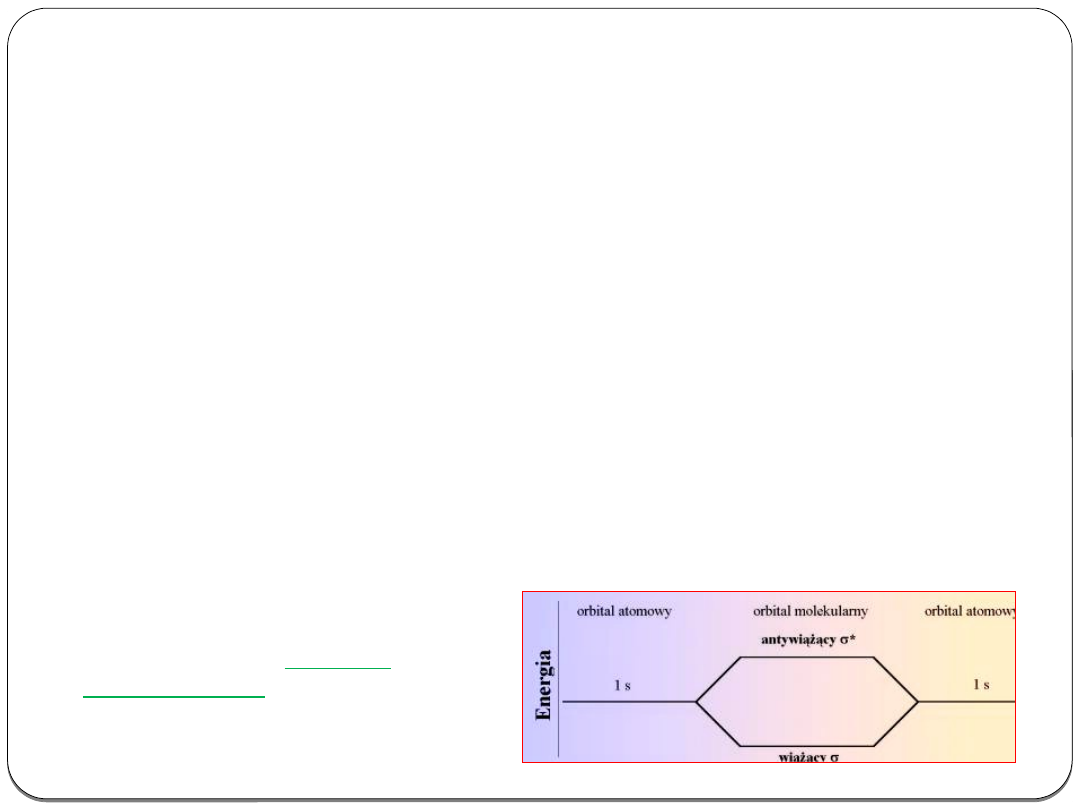
Przy kombinacji dwu orbitali atomowych tworzą się dwa
energetycznie różne orbitale cząsteczkowe, jeden (nisko
energetyczny) wiążący i jeden (wysoko energetyczny)
antywiążący.
Energia orbitali atomowych i
molekularnych
Kwantowa teoria wiązania
chemicznego
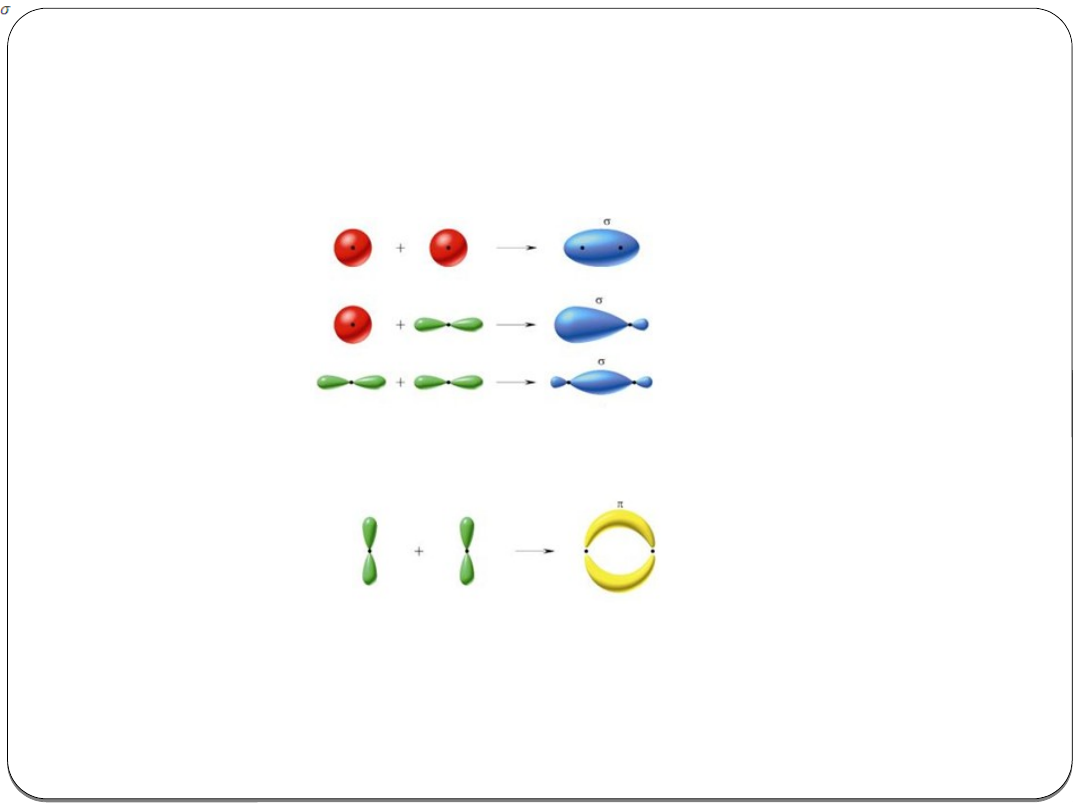
Typy wiązań ze względu na typ orbitali molekularnych
Orbital typu σ (sigma)
powstaje przy czołowym nakładaniu się orbitali
atomowych; gęstość elektronowa największa wzdłuż osi wiązania.
s-s
s-p
p-p
Orbital typu π (pi)
powstaje przy bocznym nakładaniu się orbitali
atomowych; gęstość elektronowa największa nad i pod osią wiązania.
Gdy w cząsteczce występuje wiązanie wielokrotne, zawsze 1 z tych wiązań
to wiązanie
σ
, a pozostałe
π
.
Wiązania łączące oba atomy sąsiadujące ze sobą to
wiązania zlokalizowane
(dwucentrowe). Wiązania obejmujące kilka atomów noszą nazwę
zdelokalizowanych
(wielocentowych) – np. sekstet elektronowy w benzenie.

Rodzaje wiązań ze względu na różnicę elektroujemności
wiązanie kowalencyjne niespolaryzowane , dla 0 ≤ ΔΕ < 0,4
wiązanie kowalencyjne spolaryzowane, dla 0,4 ≤ ΔΕ ≤ 1,7
wyjątki:
w halogenowodorach HX zawsze jest wiązanie
spolaryzowane nawet wtedy, gdy różnica elektroujemności wskazuje
na jonowe (np. HF)
wiązanie jonowe
dla ΔΕ > 1,7
wyjątki:
niezależnie od wartości ΔΕ występuje ono w tlenkach,
wodorkach, wodorotlenkach i solach metali aktywnych (litowce,
berylowce bez berylu)
wiązanie metaliczne – elektrony walencyjne wszystkich atomów
metalu tworzą gaz elektronowy – luźno związane elektrony.
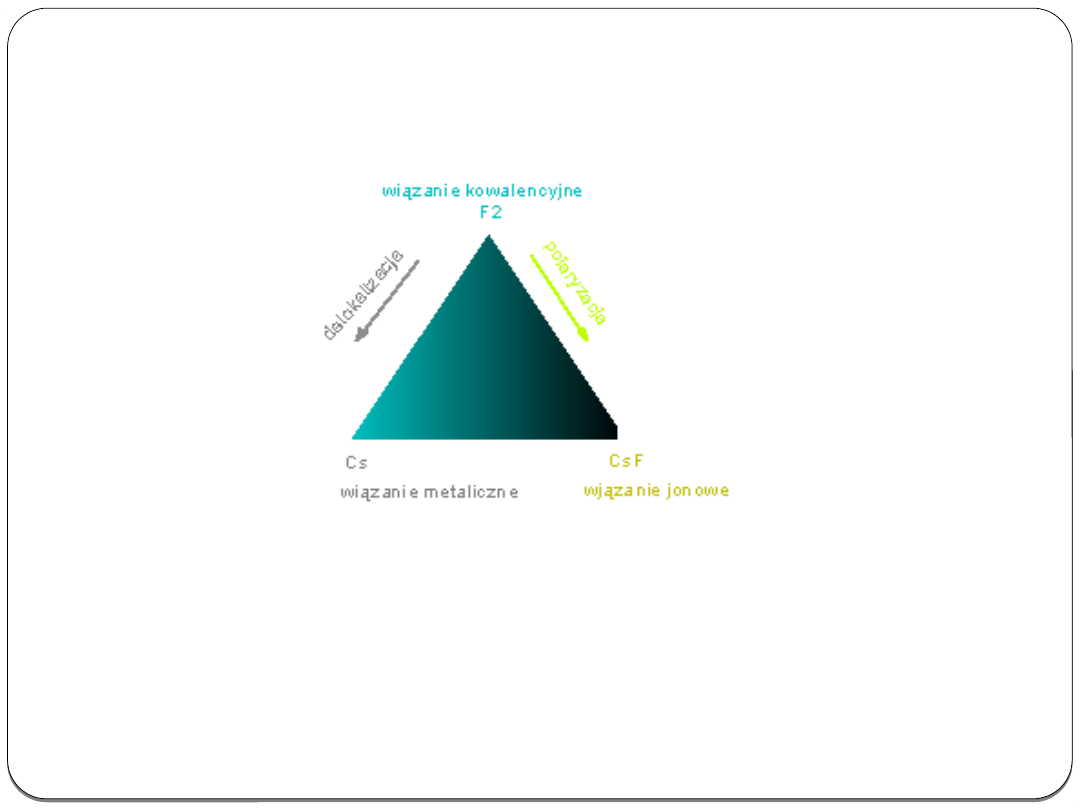
Trójkąt wiązań chemicznych
Rodzaje wiązań często przedstawia się w postaci trójkąta wiązań:
W rzeczywistości nie istnieje czyste wiązanie jonowe. Można
mówić jedynie o udziale wiązania jonowego. Wiązanie kowalencyjne
przy przejściu od fluoru do pierwiastków wykazujących coraz większy
charakter metaliczny, stopniowo przechodzi w wiązanie metaliczne,
natomiast gdy jeden z atomów fluoru będziemy stopniowo zamieniać
pierwiastkiem o charakterze coraz bardziej metalicznym, wiązanie
stopniowo przechodzi w wiązanie o dużym udziale jonowym.
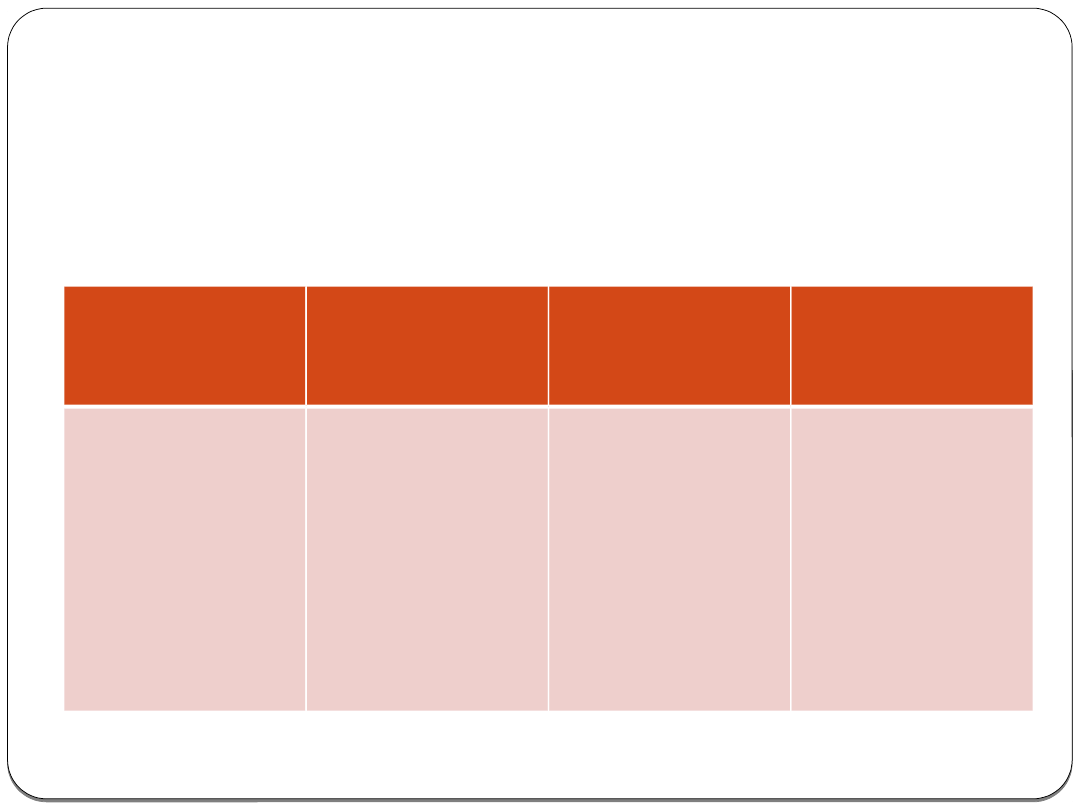
Procentowy udział wiązania jonowego w zależności
od różnicy elektroujemności
Różnica
elektroujemno
ści
% udział
wiązania
jonowego
Różnica
elektroujemno
ści
% udział
wiązania
jonowego
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1
4
9
15
22
30
39
47
1,8
2,0
2,2
2,4
2,6
2,8
3,0
3,2
55
63
70
76
82
86
89
92
Znany jest przybliżony związek między elektroujemnością a udziałem
charakteru jonowego pojedynczego wiązania między atomami A i B.
Związek taki przedstawiono w tablicy poniżej.
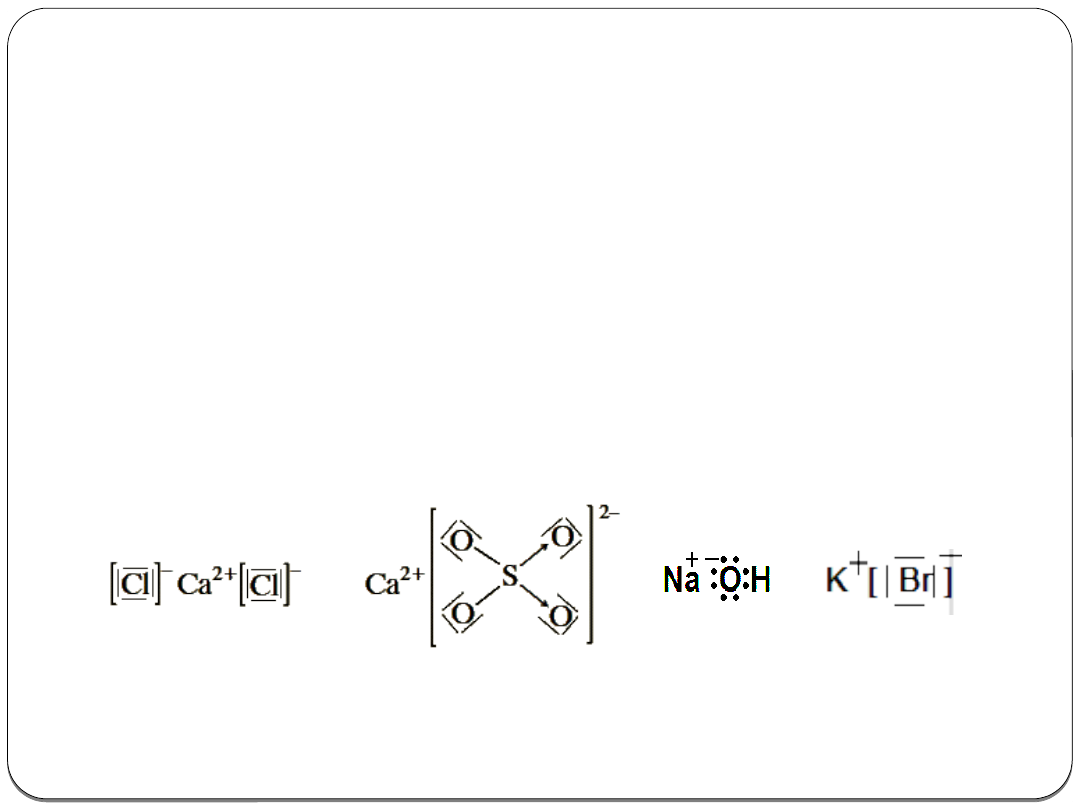
Wiązanie jonowe
Polega na wzajemnym elektrostatycznym oddziaływaniu
przeciwnie naładowanych jonów, powstałych w wyniku
przejścia jednego lub kilku elektronów z danego atomu na
drugi, bardziej elektroujemny.
Nie tworzą się osobne cząsteczki, lecz powstaje
sieć
krystaliczna
naprzemiennie ułożonych jonów o przeciwnych
ładunkach .
Wiązania jonowe występują w związkach: wodorki, tlenki,
wodorotlenki metali aktywnych, sole.
Przykłady związków o budowie jonowej:
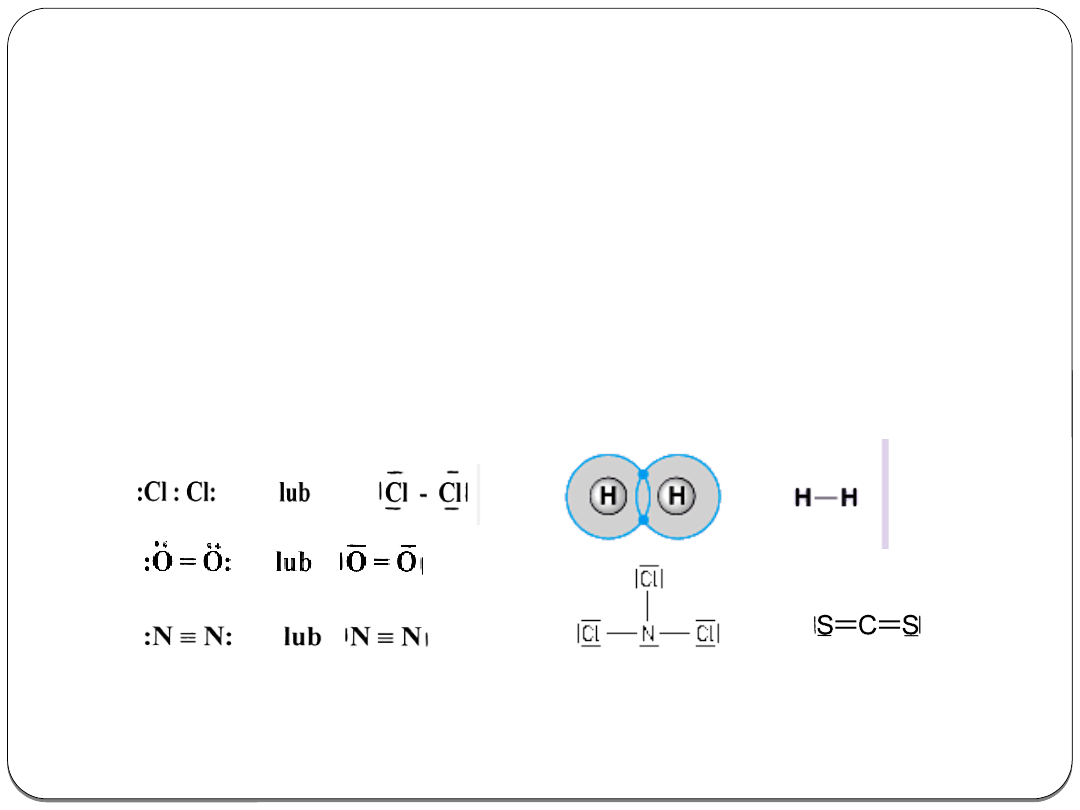
Wiązanie kowalencyjne niespolaryzowane (atomowe)
Polega na
uwspólnieniu pary lub par niesparowanych
elektronów
przez atomy o identycznych lub zbliżonych
wartościach elektroujemności.
Obecne jest w cząsteczkach homoatomowych niemetali i
heteroatomowych niektórych niemetali oraz łańcuchach
węglowych związków organicznych.
Przykłady:
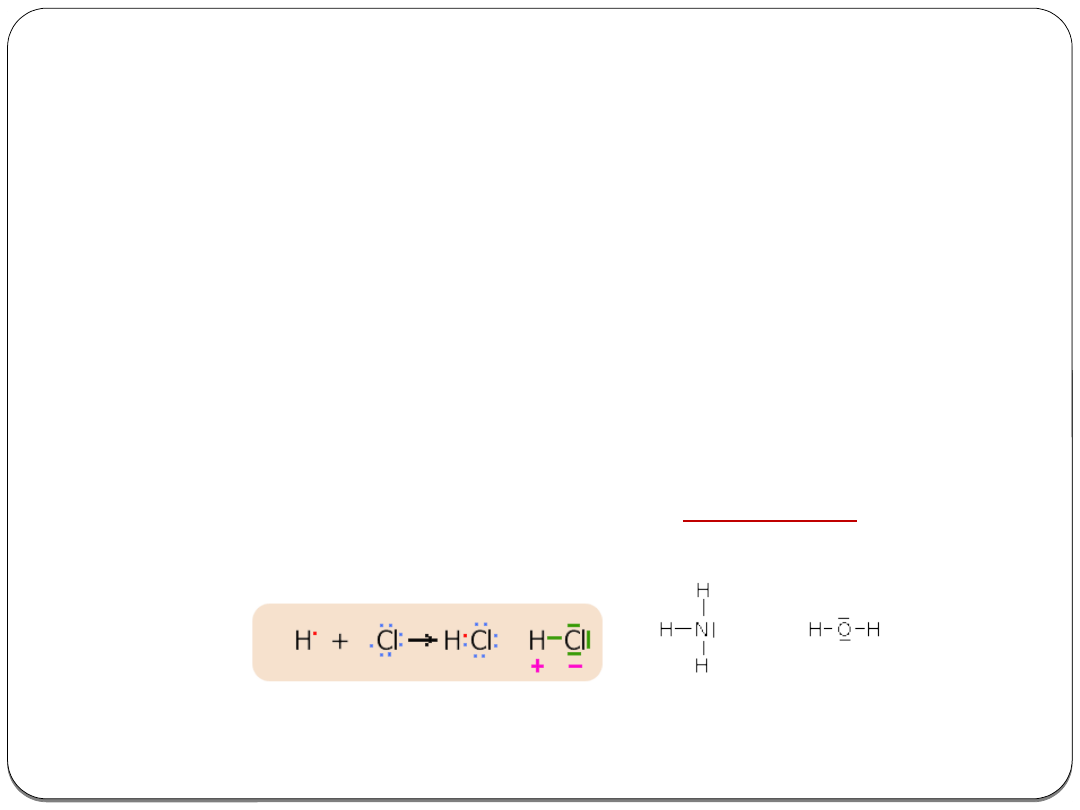
Wiązanie kowalencyjne spolaryzowane
Wiązanie kowalencyjne spolaryzowane powstaje na skutek
silniejszego przyciągania wspólnej pary lub par elektronów
przez bardziej elektroujemny atom.
Występuje w cząsteczkach tlenków, wodorków niemetali oraz
kwasów nieorganicznych.
Pojawia się
moment dipolowy μ
wiązania, czyli miara
przesunięcia elektronów tworzących wiązanie chemiczne w
kierunku jądra pierwiastka bardziej elektroujemnego w
heterocząsteczkach.
Moment dipolowy wiązania oblicza się:
μ = q · l
(q – cząstkowy ładunek elektryczny [C],l- odległość miedzy
środkami ciężkości ładunków elektrycznych [m])
Przykłady:
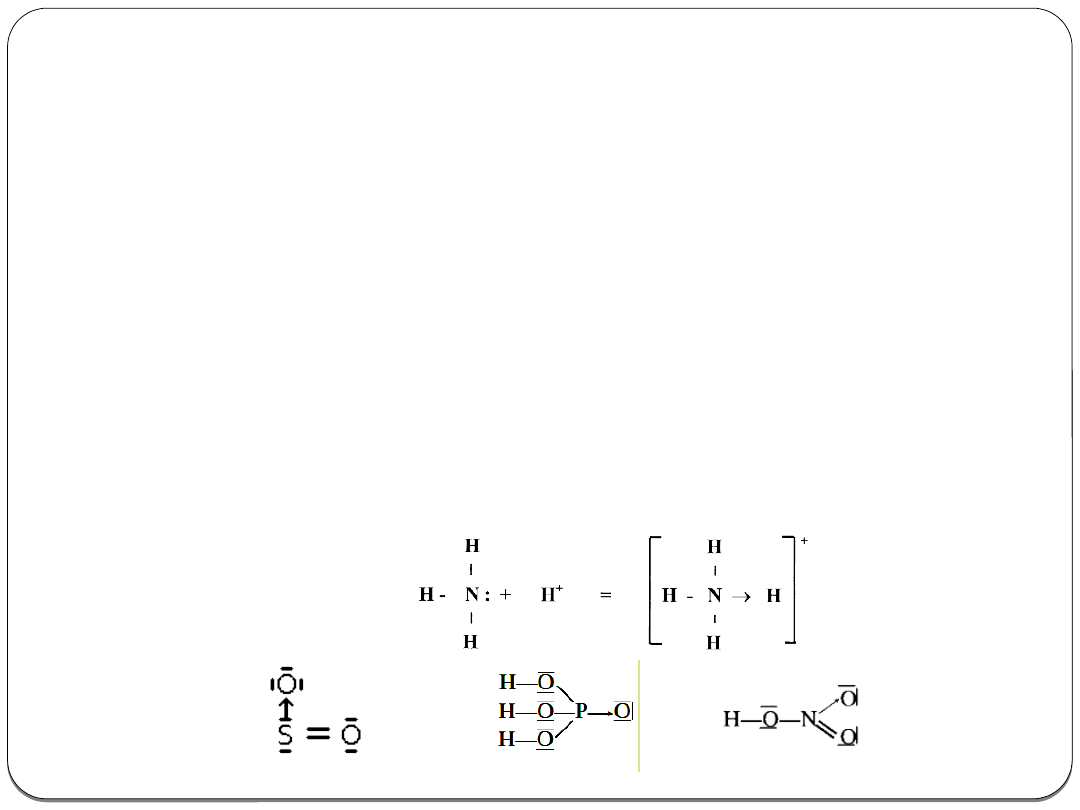
Wiązanie koordynacyjne
Wiązanie koordynacyjne to wiązanie, w którym
jedna lub
kilka wspólnych par elektronów pochodzi od jednego
atomu
, a drugi daje tylko dla tych par niewypełnioną
przestrzeń orbitalną (lukę elektronową).
Inna nazwa to
wiązanie akceptorowo-donorowe
(donor –
atom dający parę elektronów, akceptor – atom
przyjmujący tę parę).
Występuje w wielu wyższych tlenkach niemetali, kwasach
tlenowych i związkach koordynacyjnych – kompleksowych
(np. w hemoglobinie, witaminie B
12
, chlorofilu).
Wiązanie koordynacyjne stanowi szczególny przypadek
wiązania kowalencyjnego.
Przykłady:
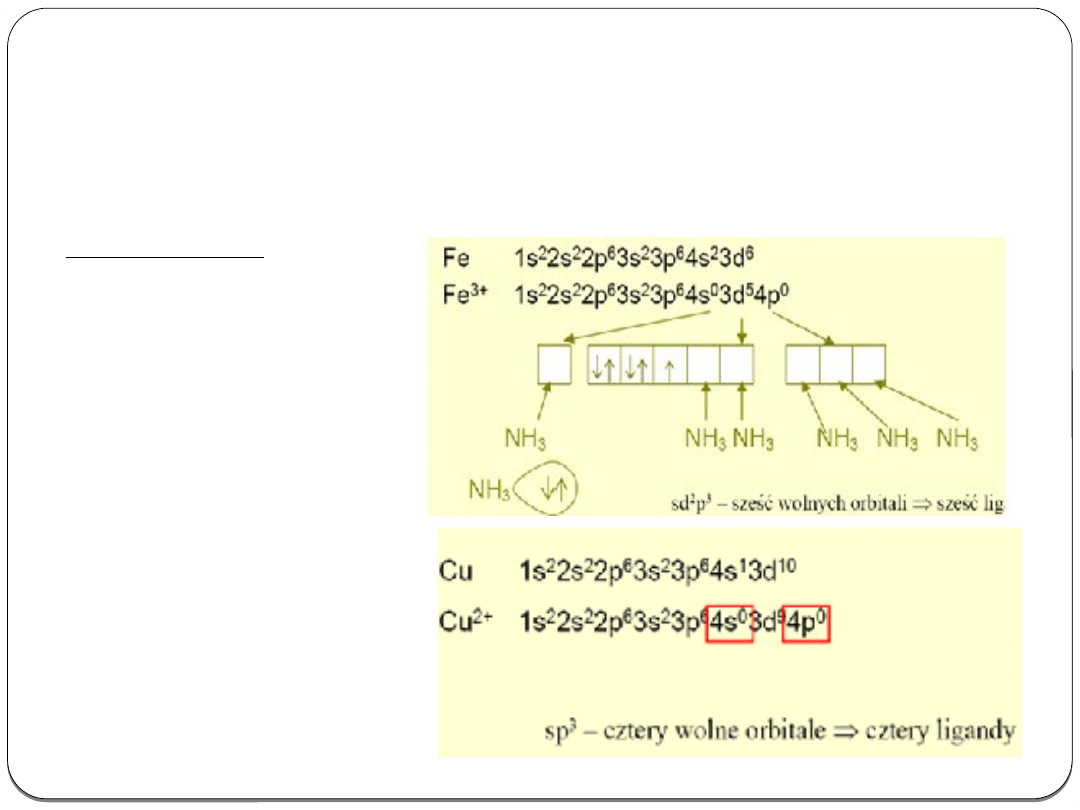
Wiązanie koordynacyjne w związkach kompleksowych
Występuje tu wiązanie koordynacyjne jon metalu - ligand
W jonach po wzbudzeniu tworzą się wolne orbitale, które mogą
„przyjąć” parę elektronową ligandu - donora tej pary.
Przykłady:
[Fe(NH
3
)
6
]
3+
Cu[(NH
3
)
4
]
2+
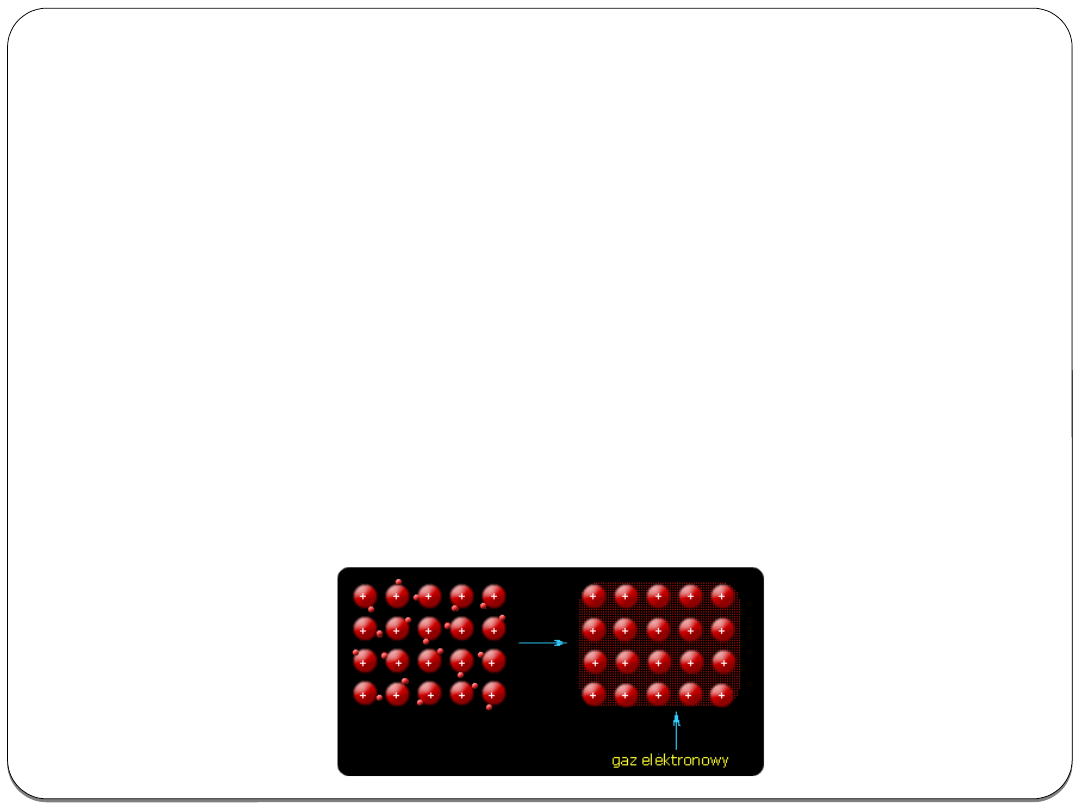
Wiązanie metaliczne
Polega na przekształceniu atomów tego samego metalu lub
atomów różnych metali
w sieć krystaliczną kationów
i
swobodnie poruszających się między nimi elektronów –
zwanych
„gazem elektronowym”.
Wiązanie metaliczne może istnieć w stanie stałym lub
ciekłym.
Kationy stanowiące rdzenie atomowe utrzymują się w
swoich położeniach dzięki przyciąganiu elektrostatycznemu
elektronów.
Model budowy wewnętrznej metalu:

Właściwości związków jonowych i kowalencyjnych
Cechy substancji
Substancje jonowe
Substancje kowalencyjne
Rodzaj wiązań
jonowe
kowalencyjne
niespolaryzowane lub
słabo spolaryzowane
Budowa wewnętrzna
tworzą jonową sieć
krystaliczną
czasami tworzą kryształy
(np. C jako diament i
grafit, siarka jako S
8
,
fosfor jako P
4
)
Stan skupienia
stały
stały, ciekły lub gazowy
Przewodnictwo prądu
przewodzą prąd po
stopieniu lub
rozpuszczeniu w wodzie
zwykle nie przewodzą
prądu
Rozpuszczalność
dobrze rozpuszczalne w
rozpuszczalnikach
polarnych np. w wodzie
dobrze rozpuszczalne w
rozpuszczalnikach
niepolarnych np.
acetonie.
Dysocjacja jonowa
zachodzi
zwykle nie zachodzi
Szybkość reagowania
szybko reagują
reagują wolno
Temperatury wrzenia i
topnienia
wysokie
niskie (z wyjątkami)
Rodzaje substancji tego
typu
tlenki metali
wodorotlenki
sole
pierwiastki niemetaliczne
tlenki niemetali
kwasy

Oddziaływania międzycząsteczkowe
Wiązania wodorowe
tworzą się pomiędzy atomem wodoru
związanym z atomem o dużej elektroujemności (F,O,N) a
atomem z wolnymi parami elektronowymi. Wiązania te
występują w wodzie w stanie ciekłymi, stałym oraz w wielu
innych substancjach. Mogą występować między różnymi
częściami jednej dużej cząsteczki, stabilizując jej strukturę
(np. w kwasach nukleinowych, białkach).
Oddziaływania dipol–dipol
występują między polarnymi
cząsteczkami (jednakowymi lub różnymi), które przyciągają
się wzajemnie różnoimiennymi biegunami.
Siły van der Waalsa
występują między blisko położonymi
grupami chemicznymi, są to oddziaływania między
niepolarnymi cząsteczkami lub atomami, powstające w
wyniku deformacji ich chmur elektronowych.
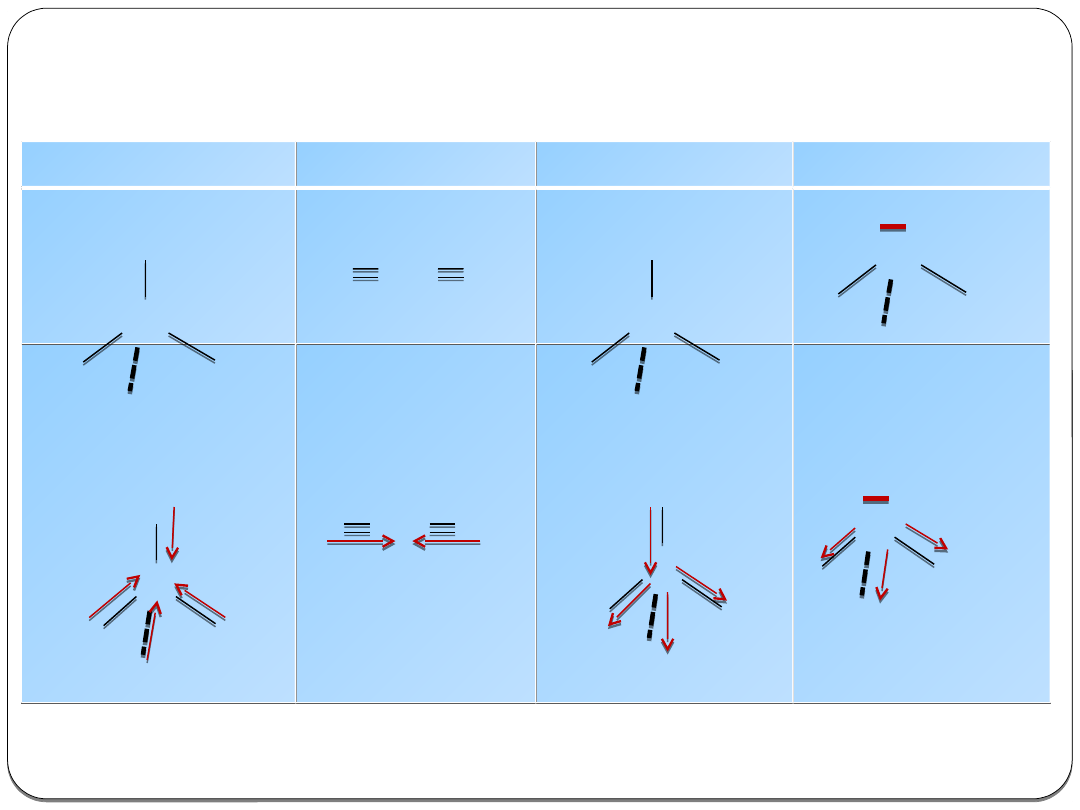
Hybrydyzacja
To proces, który jest matematycznym przekształceniem funkcji
falowych, opisujących elektrony różnych podpowłok w funkcje
falowe opisujące elektrony równocenne energetycznie i
zajmujące orbitale równoważne geometrycznie (molekularne).
Uzyskane nowe orbitale
(hybrydy) mają taki sam kształt
konturu i energię.
Reguły hybrydyzacji orbitali pierwiastków grup głównych:
•
podczas powstawania wiązań chemicznych następuje
hybrydyzacja nie tylko orbitali uczestniczących w
powstawaniu wiązań, ale również wszystkich orbitali
walencyjnych zawierających
elektrony niewiążące (pary).
•
nie ulegają hybrydyzacji
orbitale tworzące wiązanie π
•
ilość orbitali
hybrydyzowanych równa jest ilości wyjściowych
orbitali atomowych o różnych energiach i kształtach.
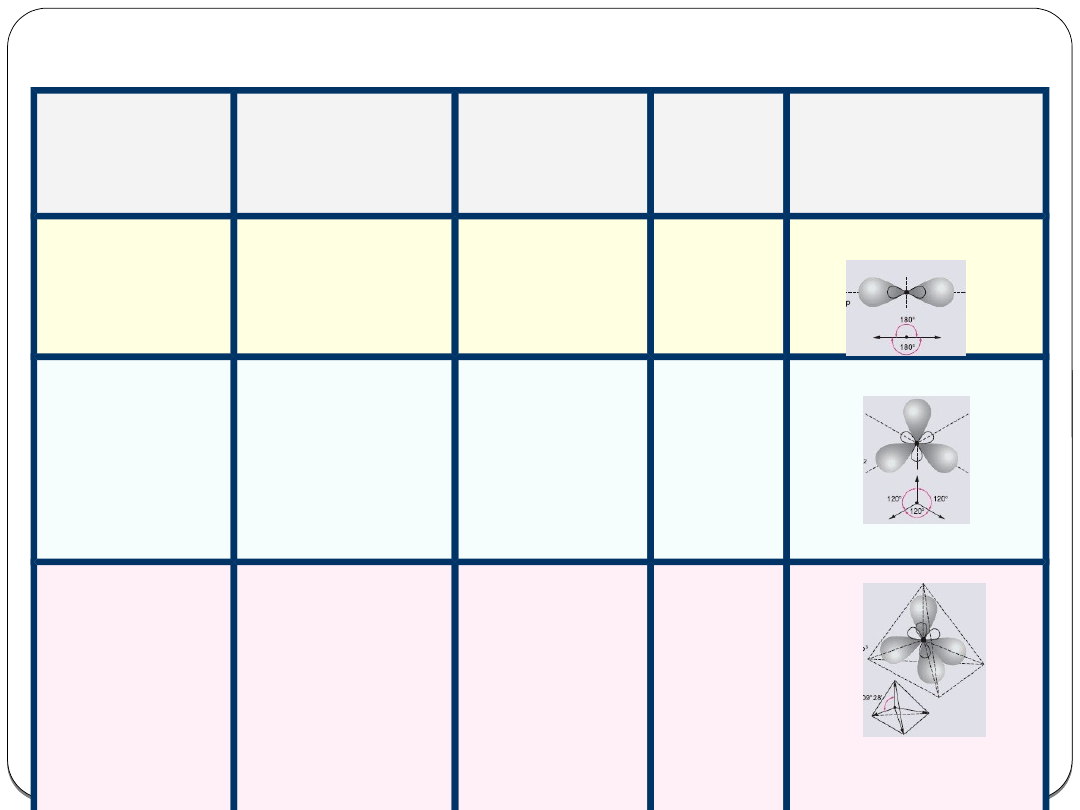
Typy hybrydyzacji
Typ
hybrydyzacji
Ilość orbitali
tworzących
hybrydę
Układ
przestrzenn
y
Kąty
między
wiąza-
niami
Ilość orbitali
zhybrydyzowany
ch
Hybrydyzacj
a digonalna
sp
1 orbital typu
s
1 orbital typu
p
liniowy
180
o
2 orbitale typu
sp
Hybrydyzacj
a
trygonalna
sp
2
1 orbital typu
s
2 orbitale typu
p
orbitale
skierowane
ku
wierzchołko
m ∆
foremnego
120
o
3 orbitale typu
sp
2
Hybrydyzacj
a
tetraedrycz
na
sp
3
1 orbital typu
s
3 orbitale typu
p
4 orbitale
ustawione
są w
kierunku
wierzchołkó
w
czworościan
u foremnego
109
o
28
`
4 orbitale typu
sp
3

Metoda VSEPR (Vallence Shall Electron Pair
Repulsion)
Metoda pozwala na ustalenie kształtu cząsteczki na podstawie
odpychania się par elektronowych powłoki walencyjnej.
Zakłada ona, że część elektronów bierze udział w tworzeniu wiązań
(
elektrony wiążące
), a część - nie (
elektrony niewiążące
– wolne
pary elektronowe).
Pary elektronów obu typów odpychając się wzajemnie zajmują w
przestrzeni położenia najbardziej oddalone od siebie.
Znając całkowitą liczbę par elektronowych można przewidzieć ich
ustawienie, czyli kąty między wiązaniami w cząsteczce.
odpychanie par e
-
wiązania < odpychanie para e
-
wiązania i wolna para e
-
<
odpychanie 2 wolnych par e
-
W celu określenia budowy przestrzennej należy ustalić łączną
liczbę par elektronowych decydujących o geometrii czyli
Lp –
liczbę przestrzenną
(zgodną z ilością hybryd atomu centralnego):
Lp = Lpσ+ Lwpe

Wzory do określania kształtu cząsteczki
Dla związku o wzorze ogólnym :
A
B n H m ,
gdzie :
A-
atom centralny, B - pierwiastek grupy głównej, H- atom
wodoru
n – liczba atomów B , m – liczba atomów H w cząsteczce
Liczba przestrzenna: L
p
= L
wpe
+ n + m,
gdzie:
Liczba wolnych par e
-
: L
wpe
= ½ L
wal
– 4n – m,
gdzie:
L
wal
to suma e
-
walencyjnych wszystkich atomów pomniejszona
(dla kationu) lub powiększona (dla anionu) o ładunek jonu
Kolejność obliczeń: L
wal
,
L
wpe
, L
p
Ilość wiązań σ = m+ n ;
Ilość wiązań π = 4 – Lp (dla
A
z grup 14-18)
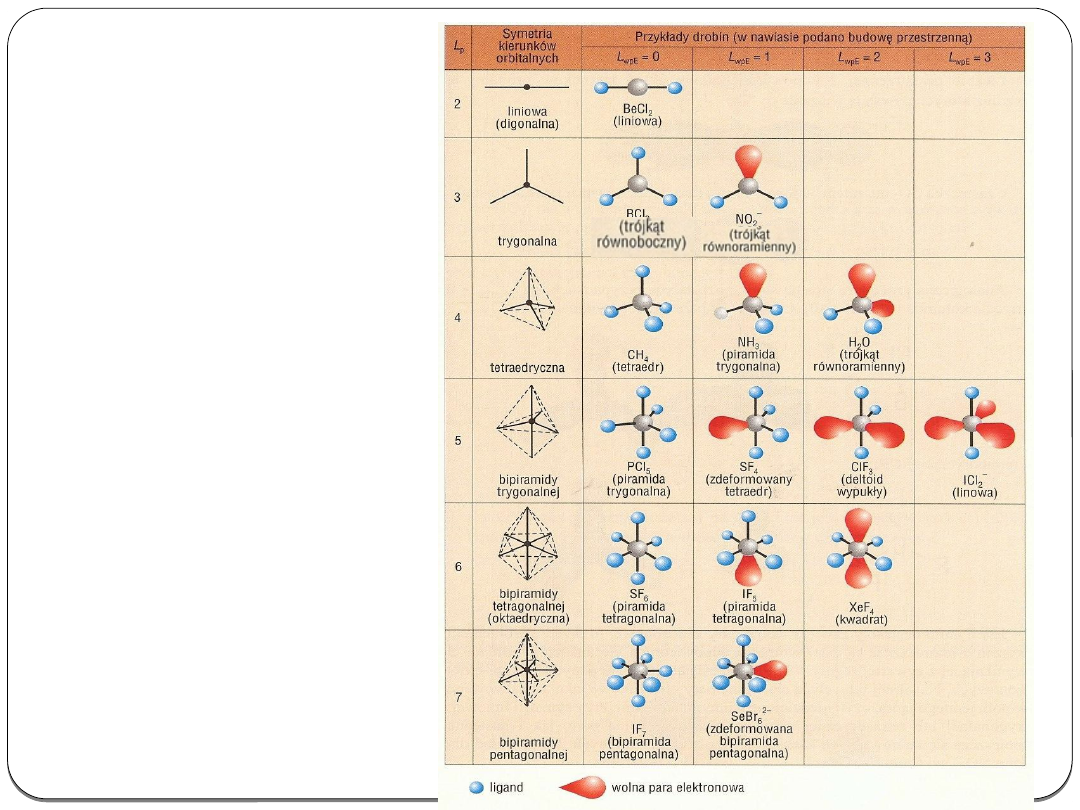
Kształty cząsteczek
dla poszczególnych
typów hybrydyzacji

Moment dipolowy cząsteczki μ
cz
Moment dipolowy cząsteczki to
suma wektorowa
momentów dipolowych poszczególnych wiązań
.
Cząsteczka jest polarna, gdy μ
cz
≠ 0, momenty dipolowe
wiązań nie znoszą się , cząsteczka ma
niesymetryczny
rozkład ładunków elektrycznych są dipolami.
Przykłady:
H
2
O, H
2
S , HF, HCl, HBr, HI, NH
3
Cząsteczka jest niepolarna, gdy μ
cz
= 0, momenty
dipolowe wiązań są przeciwnie skierowane
„symetryczne” i
znoszą się
lub brak w cząsteczce wiązań kowalencyjnych
spolaryzowanych.
Przykłady:
CO
2
, SO
3
, CH
4
, CCl
4
są niepolarne, chociaż
momenty dipolowe wiązań są różne od zera, jednak rozkład
ładunku elektrycznego jest symetryczny;
H
2
, O
2
, N
2
, SiH
4
, bo brak wiązań kowalencyjnych
spolaryzowanych.
Sposób określania momentu dipolowego
wybranych cząsteczek
CCl
4
CO
2
CH
3
Cl
NH
3
μ = O
niepolarna
μ = O
niepolarna
μ ≠ O
polarna
μ ≠ O
polarna
C
δ+
Cl
δ
-
Cl
δ
-
Cl
δ
-
Cl
δ
-
C
Cl
Cl
C
l
Cl
C
δ+
H
δ
+
H
δ
+
H
δ
+
Cl
δ
-
C
H
H
H
Cl
N
δ-
H
δ
+
H
δ
+
H
δ
+
N
H
H
H
C
δ+
O
δ
-
O
δ
-
C
O
O
Document Outline
- Slide 1
- Slide 2
- Elektronowa teoria wiązania chemicznego
- Slide 4
- Typy wiązań ze względu na typ orbitali molekularnych
- Rodzaje wiązań ze względu na różnicę elektroujemności
- Trójkąt wiązań chemicznych
- Slide 8
- Wiązanie jonowe
- Wiązanie kowalencyjne niespolaryzowane (atomowe)
- Wiązanie kowalencyjne spolaryzowane
- Wiązanie koordynacyjne
- Wiązanie koordynacyjne w związkach kompleksowych
- Wiązanie metaliczne
- Właściwości związków jonowych i kowalencyjnych
- Oddziaływania międzycząsteczkowe
- Hybrydyzacja
- Slide 18
- Metoda VSEPR (Vallence Shall Electron Pair Repulsion)
- Wzory do określania kształtu cząsteczki
- Kształty cząsteczek
- Moment dipolowy cząsteczki μcz
- Sposób określania momentu dipolowego wybranych cząsteczek
Wyszukiwarka
Podobne podstrony:
Chemia wiązania chemiczne
Chemia wiązania chemiczne
Chemia V Wiązania chemiczne
5 Wiazania chemiczne, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
Wiązania chemiczne, chemia(2)
Chemia Atom, cząsteczka, wiązanie chemiczne
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
6 Zależność właściwości substancji od rodzaju wiązania chemicznego, Budownictwo PK, Chemia, Chemia n
wiazania chemiczne, Studia, I rok, I rok, I semestr, Chemia I
Chemia, Chemia - Budowa atomu i wiązania chemiczne, LICZBA ATOMOWA(liczba porządkowa):wielkość chara
Walkowiak, chemia ogólna, wiązania chemiczne
chemia zaleznosc wlasciwosci substancji od rodzaju wiazania chemicznego
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Chemia R cje chemiczne
Wykład 1, budowa atomu, wiązania chemiczne
2 Atom i cząstka Wiązania chemiczne klucz
więcej podobnych podstron