Reakcje w roztworach wodnych c.d.
Analiza wagowa i objętościowa
Analiza wagowa
Zasadą analizy wagowej jest wytrącenie z roztworu osadu zawierającego oznaczany składnik. Po obróbce osadu (mycie, suszenie, prażenie), znając jego wzór a więc i skład chemiczny, można wyliczyć zawartość oznaczanego składnika w próbce. Dla ułatwienia tych obliczeń stosuje się tzw. mnożniki analityczne (stechiometryczne). Poniżej przedstawiono sposób obliczania mnożnika analitycznego dla wagowego oznaczania żelaza.
Przykład 1
Wagowe oznaczanie żelaza polega najczęściej na wytrącaniu z próbki osadu wodorotlenku żelaza(III):
![]()
Osad wodorotlenku po odsączeniu oraz przemyciu praży się, w wyniku czego otrzymuje się trwały chemicznie osad tlenku żelaza(III), który po zważeniu umożliwia wyliczenie zawartości żelaza w uzyskanym trwałym osadzie. Wyliczenie zawartości żelaza (x) polega na rozwiązaniu proporcji:
2 Fe : ![]()
gdzie: m - masa zważonego osadu
x - poszukiwana masa żelaza
Fe - masa molowa żelaza 56 g/mol
![]()
- masa molowa tlenku żelaza(III) 160 g/mol
![]()
wartość ilorazu 2Fe/![]()
nosi nazwę mnożnika analitycznego; dla tego sposobu wyliczenia ilości żelaza wynosi przykładowo 0,6994.
W trakcie wykonywania oznaczenia można korzystać z mnożników analitycznych zebranych w tablicach analitycznych, lub też wyliczać je na podstawie odpowiednich równań reakcji czy też znajomości wzorów chemicznych związków tworzących osad. Ilość składnika oznaczanego oblicza się z iloczynu mnożnika analitycznego i masy osadu. Jeżeli przykładowo w wyniku analizy wagowej na zawartość żelaza uzyskano osad tlenku żelaza(III) o masie 0,1258 g, to ilość zawartego w nim żelaza wynosi: x= 0,6994 · 0,1258 g = 0,0880 g żelaza
Znając masę analizowanej próbki, można dalej obliczyć zawartość procentową żelaza w badanym materiale lub też wykonać inne obliczenie.
Przykład 2
Ile 2-molowego roztworu amoniaku należy użyć do całkowitego wytrącenia z próbki około 0,1 g żelaza, jeżeli zaleca się stosowanie 3-krotnego nadmiaru molowego amoniaku względem żelaza.
![]()
![]()
![]()
Ilość amoniaku można wyliczyć z proporcji:
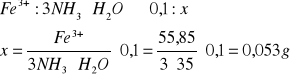
Uwzględniając trzykrotny nadmiar 3·0,053 = 0,159 g amoniaku, co po przeliczeniu na objętość 2-molowego roztworu daje:
1000 ![]()
2-molowego roztworu zawiera 50 g amoniaku
x ![]()
2-molowego roztworu zawiera 0,159 g amoniaku,
x = 2,3 ![]()
roztworu amoniaku
Przykład 3
Przy wykonywaniu analizy wagowej niezbędne jest określenie wielkości masy próbki analitycznej w celu otrzymania optymalnej ilości osadu. W przykładzie tym należy określić wielkość odważki rudy żelaza zawierającej około 40% żelaza, tak aby uzyskać około 0,15 g tlenku żelaza(III)
Ilość żelaza (x) w zakładanej ilości osadu wynosi:
X= 0,6994 · 0,15 g = 0,10 g żelaza
Co po uwzględnieniu zawartości procentowej żelaza pozwala obliczyć wielkość odważki rudy:
Z informacji o zawartości procentowej żelaza wynika, że:
100 g rudy zawiera 40 g żelaza
y g rudy zawiera 0,1 g żelaza,
y = 0,25 g rudy żelaza
Przykład 4
Wyprażono 0,4729 g mieszaniny węglanów wapnia i magnezu, otrzymując 0,2472 g mieszaniny odpowiednich tlenków. Wyliczyć skład procentowy mieszaniny węglanów.
Przyjmujemy następujące oznaczenia:
x - ilość gramów węglanu wapnia
y - ilość gramów węglanu magnezu
przyjęte ilości węglanów można z zastosowaniem mnożników analitycznych przeliczyć na ilości tlenków:
![]()
Przyjęte wartości umożliwiają ułożenie i rozwiązanie układu równań:
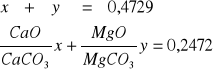
Podstawiając odpowiednie wartości mas molowych rozwiązuje się układ równań uzyskując następujące wartości: x = 0,2163 y = 0,2566
Co odpowiada 45,75% węglanu magnezu oraz 54,3% węglanu wapnia
Analiza objętościowa (miareczkowa)
Analiza miareczkowa, zwana również analizą objętościową, jest działem analizy chemicznej, której podstawą jest miareczkowanie. Oznaczanie substancji przeprowadza się na podstawie mierzenia objętości titranta, czyli roztworu mianowanego a więc posiadającego ściśle określone stężenie molowe. Analiza miareczkowa zależnie od charakteru chemicznego stosowanego titranta dzieli się następująco:
alkacymetria (wykorzystanie reakcji zobojętniania)
redoksymetria (wykorzystanie reakcji redox)
kompleksometria (wykorzystanie tworzenia związków kompleksowych np. za pomocą EDTANa)
precypitometria (wykorzystanie reakcji strącania osadu)
Dokładne stężenia titrantów, czyli roztworów do miareczkowania, ustala się za pomocą tzw. nastawiania miana na roztwory wzorcowe. W alkacymetrii do tego celu stosuje się najczęściej roztwór węglanu sodu, boraks [![]()
] lub kwas benzoesowy. Substancje takie, specjalnie oczyszczone i osuszone odważa się w ilości stechiometrycznej i przeprowadza do roztworu w kolbie miarowej. Stężenie tak otrzymanego roztworu przyjmuje się za wzorcowe. Obecnie najczęściej stosuje się tzw. fixanale, czyli odważki analityczne sporządzone fabrycznie w zatopionych fiolkach szklanych lub pojemniczkach z tworzywa. Ilość substancji oraz jej jakość gwarantuje w tym wypadku producent fixanali np fabryka odczynników chemicznych POCH w Gliwicach. Z równania reakcji sody z kwasem solnym: ![]()
wynika, że jeden mol węglanu sodu reaguje z dwoma molami kwasu solnego. W obliczeniach, przy tego typu oznaczeniach, wygodnie jest posłużyć się stężeniem molowym. Należy jednak pamiętać, że substancje te reagują w stosunku molowym 1:2 .
Oto przykład obliczenia:
Do zmiareczkowania 20 ![]()
roztworu kwasu solnego o nieznanym stężeniu zużyto 10,5 ![]()
0,1-molowego roztworu węglanu sodu. 10,5 ![]()
0,1-molowego roztworu węglanu sodu odpowiada więc 21 ![]()
kwasu solnego o takim samym stężeniu molowym. Zawartość kwasu w próbce można obliczyć z wzoru: ![]()
Gdzie:
m - masa oznaczanego składnika
V - objętość titranta (![]()
) - r-ru Na2CO3
![]()
- stężenie molowe
M - masa molowa oznaczanego składnika. Tak więc dla omawianego przykładu podstawia się następujące wartości:![]()
Przykład 1
Odważono 1,0155 g węglanu sodu i rozpuszczono w wodzie, wprowadzono do kolby miarowej na 200 ![]()
uzupełniono wodą destylowaną do nominalnej objętości. Obliczyć stężenie molowe otrzymanego roztworu. Następnie pobrano trzy równoległe próbki po 20 ![]()
kwasu siarkowego(VI) o nieznanym stężeniu i miareczkowano otrzymanym wcześniej roztworem węglanu sodu. Zużyto kolejno: 20,7![]()
, 20,6![]()
, 20,6![]()
roztworu mianowanego sody (węglanu sodu). Oblicz stężenie molowe roztworu kwasu siarkowego(VI) oraz jego zawartość w 1![]()
roztworu.
Rozwiązanie:
W pierwszej kolejności oblicza się stężenie molowe roztworu mianowanego węglanu sodu, którego masa molowa wynosi 106 g
1000![]()
roztworu 1 molowego zawiera 206 g węglanu sodu
200 ![]()
roztworu 1 molowego zawiera x g węglanu sodu
x = 21,2 g węglanu sodu
200 ![]()
roztworu zawierającego 21,2 g węglanu posiada stężenie 1mol/![]()
200 ![]()
roztworu zawierającego 1,0155 g węglanu posiada stężenie x moli/dm![]()
x = 0,0479 mol/![]()
Średnia objętość titranta z trzech równoległych pomiarów wynosi V= 20,63![]()
Jako, że kwas siarkowy(VI) z węglanem sodu reaguje w stosunku molowym 1:1, dla obliczenia stężenia kwasu można skorzystać z następującej proporcji: ![]()
czyli 20,63·0,1=20,0·x
Stężenie molowe kwasu siarkowego(VI) jest równe 0,1 ![]()
Zawartość kwasu siarkowego(VI) w badanej próbce wynosi: ![]()
![]()
Zaś w 1000![]()
znajduje się 50 razy więcej kwasu, czyli 10,11 g kwasu siarkowego(VI)
Przykład 2
Ile należy odważyć kwasu szczawiowego ![]()
, aby otrzymać 250![]()
0,5 molowego roztworu do zmianowania 0,05 molowego roztworu manganianu(VII) potasu.
![]()
W reakcjach redoks wygodne jest przeliczanie uwzględniające ilości wymienionych w reakcji redoks elektronów. I tak w powyższym równaniu masa odpowiadająca połowie masy molowej kwasu szczawiowego reaguje z piątą częścią masy molowej manganianu(VII) potasu (bowiem mol manganianu(VII) potasu oddaje pięć elektronów). Ta ilość manganianu przereaguje zaś z ilością kwasu szczawiowego równą połowie masy molowej kwasu szczawiowego (mol kwasu szczawiowego wymienia dwa elektrony). Tak więc dla przygotowania 250![]()
roztworu o stężeniu 0,05 molowego kwasu szczawiowego potrzeba
![]()
Przykładowe zadania
Grawimetria (Analiza wagowa)
1/ Wyliczyć mnożniki analityczne dla analiz wagowych umożliwiających przeliczenie masy osadu na wybrany składnik:
Al z masy
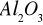
S z masy
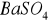
Ca z masy
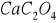
P z masy
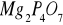
2/ Wyliczyć zawartość procentową cynku w odważkach rud, jeżeli uzyskano następujące ilości siarczku i pirofosforanu cynku:
z 0,7856 g rudy otrzymano 0,1176 g ZnS
z 0,9786 g rudy otrzymano 0,1238 g ZnS
z 0,1118 g rudy otrzymano 0,1118 g
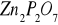
z 0,4916 g rudy otrzymano 0,5201 g
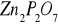
3/ Próbkę stałą poddano analizie na zawartość wody, substancji nierozpuszczalnych w wodzie oraz jonów siarczanowych. Jako kation zidentyfikowano jedynie jon sodu. Obliczyć skład procentowy badanej substancji
0,9823 g próbki: 0,0937 g ubytku masy po osuszeniu; 0,1107 g części nierozpuszczalnych; 0,1883 g osadu siarczanu(VI) baru
1,0739 g próbki; 0,0883 g ubytek masy po osuszeniu; 0,1226 g części nierozpuszczalnych w wodzie; 0,1883 g siarczanu(VI) baru
4/ Oblicz wilgotność węgla brunatnego, którego próbka równa 0,9976 g w wyniku suszenia w temperaturze 105ºC zmniejszyła masę o 0,1702 g.
5/ Ile cząsteczek wody hydratacyjnej posiada uwodniony siarczan magnezu, jeżeli w wyniku osuszenia 2,7645 g tej soli, masa odważki zmalała do 1,7410 g.
Analiza objętościowa (miareczkowa)
Oblicz objętość 1 molowego roztworu chlorku baru, którą należy wprowadzić do roztworu w celu całkowitego wytrącenia 0,15 g jonów siarczanowych(VI)
Jaką objętość kwasu siarkowego(VI) o stężeniu 0,1 mol/dm³ potrzeba do zobojętnienia 4 g 20% roztworu wodorotlenku sodu.
Ile
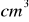
roztworu zasady sodowej o stężeniu 1 mol/dm³ potrzeba do zobojętnienia 10 g 15% roztworu kwasu siarkowego(VI)Na 20
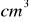
14% roztworu kwasu siarkowego(VI) o gęstości d=1,095 g/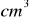
podziałano 37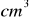
roztworu zasady sodowej o stężeniu 2 mol/dm³. Jaki jest odczyn otrzymanej mieszaniny?Odmierzono pipetą trzy próbki po 20
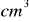
roztworu kwasu solnego o stężeniu 0,1152 mol/dm³. Każdą próbkę miareczkowano roztworem wodorotlenku sodu zużywając kolejno: 24,70; 24,85; 24,75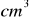
. Obliczyć srednie stężenie molowe miareczkowanego roztworu wodorotlenku sodu.Roztwór chromianu(VI) sodu jest ściśle 2 molowy. Ile
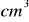
tego roztworu należy wziąć aby otrzymać 250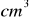
0,1 molowego roztworu, który stosuje się w miareczkowaniu redoksowymOdważono 2,9980 g technicznego wodorotlenku potasu, do jego zobojętnienia zużyto 48,4
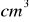
roztworu kwasu solnego o stężeniu 0,0994 mol/dm³ . Oblicz zawartość procentową wodorotlenku potasu w produkcie technicznym.Jaka jest zawartość procentowa węglanu potasu w technicznym potażu (
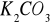
), jeżeli 3,5 g tego preparatu neutralizuje 42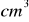
roztworu kwasu siarkowego o stężeniu 1 mol/dm³25
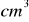
roztworu wodorotlenku sodu o gęstości d= 1,220 g/
rozcieńczono wodą destylowaną do objętości 250
. Dokładnie odmierzoną objętość 50
tak otrzymanego roztworu miareczkowano 24,88
roztworu kwasu siarkowego(VI) o stężeniu 1 mol/dm³ . Obliczyć stężenie procentowe roztworu wodorotlenku sodu przed rozcieńczeniem.25
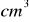
roztworu zawierającego tlenek siarki(IV) zaabsorbowany w wodzie rozcieńczono do 250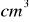
i 10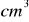
tak otrzymanego roztworu po zakwaszeniu kwasem siarkowym zmiareczkowano 26,1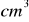
roztworu manganianu(VII) potasu o stężeniu 0,1 mol/dm³ w przeliczeniu masy na 1 wymieniony elektron, czyli na piątą część masy molowej). Oblicz stężenie tlenku siarki (IV) w roztworze wyjściowym wyrażając je w g/dm³. Biegnąca w trakcie miareczkowania reakcja ma następujące równanie:
![]()
Zadania z zestawów maturalnych
Zad. 1/ Całkowita ilość żelaza znajdująca się w 2 g próbce rudy pochodzenia meteorytowego zastała roztworzona w kwasie. Następnie roztwór zawierający jony żelaza(II) miareczkowano roztworem manganianu(VII) potasu o stężeniu 0,1 mol/dm³ w środowisku kwasu siarkowego(VI). Do miareczkowania zużyto 27,45 cm³ roztworu manganianu(VII) potasu. Oblicz procentową zawartość żelaza w próbce rudy.
Zad. 2 / Do całkowitego strącenia bromków i chlorków zawartych w 2g mieszaniny KBr i NaCl zużyto 100 cm³wodnego roztworu azotanu(V)srebra o stężeniu 0,2 mol/dm³. Oblicz zawartość bromku potasu i chlorku sodu w mieszaninie.
Zad. 3 / Do 10 cm³ wodnego roztworu chlorku wapnia dodano nadmiar roztworu węglanu sodu, Otrzymany osad odsączono i wysuszono. Po wysuszeniu masa osadu wynosiła 2,5g. Oblicz stężenie molowe roztworu chlorku wapnia(należy założyć, że wszystkie reakcje przebiegały z wydajnością 100%)
Zad. 4 / Oblicz jaką objętość, w warunkach normalnych, zajmie wodór wydzielony w reakcji magnezu z 400 cm³ kwasu octowego o stężeniu 0,2 mol/dm³ . Należy przyjąć, że reakcje przebiegają z 100% wydajnością. Oblicz, ilość cząsteczek wodoru jaka znajduje się w otrzymanej objętości wodoru.
Zad. 5 / Po dodaniu nadmiaru kwasu octowego do 10 cm³ roztworu węglanu sodu wydzieliło się 0,224 dm³ tlenku węgla(IV). Zapisz równanie reakcji i oblicz stężenie molowe roztworu węglanu sodu.
Zad. 6 / Jaka objętość 0,1 molowego roztworu azotanu(V) srebra(I) jest niezbędna do całkowitego wytrącenia w postaci osadu AgCl jonów chlorkowych z 50 cm³ 0,2-molowego roztworu chlorku glinu?
Zad. 7 /W oparciu o bilans elektronowy w poniższym równaniu reakcji:
![]()
Wskaż utleniacz i reduktor. Oblicz jaką objętość roztworu manganianu(VII) potasu o stężeniu 0,5 mol/dm³ należy użyć, aby w reakcji z acetylenem powstało 8,3 g szczawianu dipotasu.
Zad. 8 / Do 150 g 30% roztworu węglanu sodu dodano 100 cm³ 2-molowego roztworu chlorku wapnia. Wytrącony osad przesączono i przemyto wodą. Następnie na wytrącony osad podziałano kwasem solnym w nadmiarze. Napisz równania reakcji i oblicz, jaką objętość zajął wydzielony gaz w 303 K i pod ciśnieniem 1025 hPa , jeżeli wiadomo, że straty w drugiej reakcji wynosiły 10%.
Zad. 9 / Jon fosforanowy(V) można wytrącić z roztworu w postaci osadu np. ![]()
Związek ten powstaje w reakcji rozpuszczalnego fosforanu(V) z chlorkiem magnezu i chlorkiem amonu. Napisz równanie reakcji opisanej w tekście, oblicz stężenie molowe jonów fosforanowych(V), jeżeli masa osadu wytrąconego z 50 cm³ roztworu wynosi 0,0685 g.
Zad. 10 / Zdolność łatwego utleniania jonów żelaza(II) do jonów żelaza(III) znalazła praktyczne zastosowanie przy ilościowym oznaczaniu zawartości związków żelaza(II) w próbkach. Do 10 cm³ roztworu siarczanu(VI) żelaza(II) zakwaszonego kwasem siarkowym(VI) wprowadzono kroplami roztwór manganianu(VII) potasu, który ulegał odbarwianiu. W opisanym doświadczeniu użyto 25 cm³ 0,1-molowego roztworu manganianu(VII) potasu. Oblicz stężenie molowe analizowanego roztworu siarczanu(VI)żelaza(II)
Zad. 11 / Oblicz jaka objętość 0,1-molowego roztworu dichromianu(VI) potasu przereagowała z roztworem zawierającym 5,678 g siarczanu(IV) sodu.
Zad. 12 / Do zobojętnienia 20,0 cm³ 0,2-molowego roztworu kwasu solnego zużyto 18,5 cm³ roztworu zasady barowej, a do zobojętnienia 25,0 cm³ kwasu octowego zużyto 22,4 cm³ tej samej zasady barowej. Napisz równania zachodzących reakcji w formie cząsteczkowej i jonowej. Oblicz stężenie molowe kwasu octowego.
Zad. 13 / Przez 400 g roztworu bromu w wodzie przepuszczono 1,4 dm³ propenu (warunki normalne). Po przepuszczeniu tej ilości propenu roztwór uległ całkowitemu odbarwieniu. Oblicz stężenie procentowe i molowe wody bromowej, jeżeli jej gęstość d=1,08 g/cm³ . Należy założyć, że reakcje przebiegają z wydajnością 100%.
Zad. 14 / Oblicz ile cm³ 2 molowego roztworu NaOH potrzeba do zobojętnienia 50 cm³ 1-molowego roztworu kwasu octowego.
Zad. 15 / 3,06 g mieszaniny octanu sodu i siarczanu(VI) sodu rozpuszczono w wodzie destylowanej. Do otrzymanego roztworu dodano wodny roztwór chlorku baru do całkowitego strącenia osadu. Następnie wytrącony osad przemyto, odsączono i zważono. Jego masa wynosiła 2,33 g. Oblicz jaki procent masy wyjściowej mieszaniny stanowił sód.
Zad. 16 / 5,12 g kredy szkolnej przereagowało z 60 cm³ kwasu solnego o stężeniu 2 mole/dm³. Oblicz zawartość procentową CaO i CaCO3 w kredzie.
Zad. 17 / W celu oznaczenia zawartości amoniaku w zanieczyszczonej soli amonowej rozpuszczono 1 g tej soli w wodzie i dodano wodorotlenku sodu. Wydzielony amoniak pochłonięto w 50 cm³ roztworu kwasu solnego o stężeniu 0,5 mol/dm3 . Nadmiar kwasu odmiareczkowano, zużywając 4,25 cm3 roztworu zasady sodowej o stężeniu 0,5 mol/dm3. Oblicz procentową zawartość amoniaku w analizowanej soli amonowej.
Zad. 18 / Pomarańczowo zabarwione w roztworze jony dichromianowe(VI) utleniają 2 - propanol do acetonu, redukując się do zabarwionych na zielono kationów. Oblicz objętość 5% roztworu dichromianu(VI) potasu o gęstości 1,1 g/cm3, który przereaguje z 3 g 2 - propanolu w środowisku kwaśnym.
Zad. 19 / Stężenie jonów octanowych CH3COO- w roztworze kwasu octowego można oznaczyć, miareczkując roztwór kwasu roztworem zasady sodowej wobec wskaźnika. Oblicz stężenie molowe jonów octanowych w roztworze kwasu octowego, jeżeli zmiana zabarwienia wskaźnika nastąpiła po dodaniu do 0,1 dm3 roztworu kwasu 5 cm3 0,02-molowego roztworu zasady sodowej.
Rozwiązania zadań
Rozwiązania zadań przykładowych
Zad 1. Dotyczy obliczania tzw. mnożników analitycznych, czyli współczynników umożliwiających wyliczenie ilości interesującego składnika z masy osadu, w którym się znajduje np. po wytrąceniu z analizowanego roztworu. Wzór chemiczny osadu stanowi podstawę wyliczenia takiego współczynnika. Zapis Al z Al2O3 oznacza, że metoda wagowego oznaczania glinu polega na ilościowym wydzieleniu osadu Al(OH)3 , który następnie, przez prażenie, przeprowadza się w trwały osad tlenku glinu. Ze znajomości masy oraz wzoru osadu można wyliczyć masę zawartego w nim glinu.
Przykład: Al z masy Al2O3
Obliczmy masy molowe: MAl=27g/mol; MTlenku=2x27g + 3x16g=48g
2 mole czyli 54 g Al znajdują się w 1 molu Al2O3 czyli 102 g tlenku
x g Al znajduje się w m g osadu tlenku
![]()
xgAl = 0,5294· ![]()
![]()
Mnożnik analityczny dla obliczenia ilości glinu z masy osadu tlenku glinu wynosi x = 0,5294
Uwaga: mnożnik podaje się z dokładnością do czwartego miejsca po przecinku, to znaczy z dokładnością ważenia osadu na wadze analitycznej.
Mnożniki dla pozostałych przykładów wynoszą:
siarka z masy BaSO4 x =
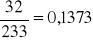
wapnia z masy Ca2C2O4 x =
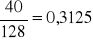
fosforu z masy Mg2P4O7
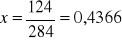
Zad. 2 W pierwszej kolejności obliczamy mnożniki analityczne dla :Zn → ZnS(1) oraz Zn →Zn2P2O7 (2)
![]()
1. m Zn = 0,1176⋅0,6701 = 0,0788g cpZn=![]()
% = 10% Zn
2. mZn = 0,0829 g ![]()
3. mZn = 0,0478 g ![]()
Zn
4. mZn = 0,2224 g ![]()
Zn
Zad.3
Przykład 1
mpróbki =0,9823 g mwody= 0,1107 g m nierozp= 0,1107 g
Jako, że jedynym stwierdzonym jonem jest jon sodu należy sądzić, że solą jest siarczan(VI) sodu, którego ilość wyliczymy, wytrącony osad to siarczan(VI) baru.
Z 1 mola Na2SO4 powstaje 1 mol BaSO4, uwzględniając masy molowe można powiedzieć, że:
142 g Na2SO4 w wyniku reakcji daje 233 g BaSO4 x g Na2SO4 w wyniku reakcji daje 0,1883 g BaSO4
![]()
Obliczenie składu procentowego:
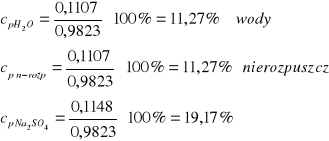
Przykład 2![]()

Zad.4
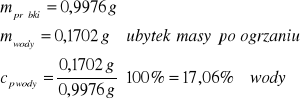
Zad.5
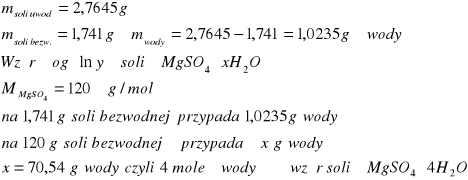
Analiza objętościowa
Zad.1
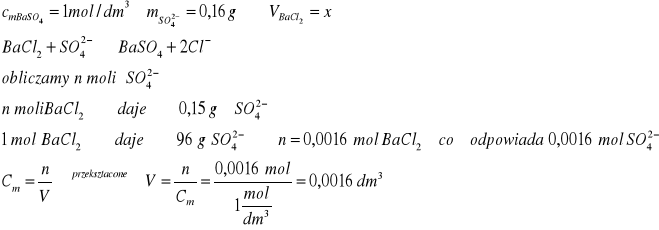
Do wytrącenia 0,15 gramów jonów siarczanowych(VI) potrzeba 1,6 cm3 1 molowego roztwory BaCl2
Zad.2
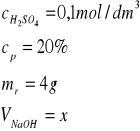
H2SO4 +2NaOH→Na2SO4 + 2H2O
Ilość wodorotlenku sodu w 4 g 20% wynosi mNaOH = 0,8 g
Z równania reakcji obliczmy niezbędną do zobojętnienia tej ilości wodorotlenku ilość moli kwasu siarkowego(VI)
1 mol H2SO4 zobojętnia 2 mole NaOH czyli 80 g NaOH
n moli H2SO4 zobojętnia 0,8 g NaOH
n = 0,01 mol H2SO4
z wzoru na stężenie molowe cm = n/V obliczamy objętość V=n/cm=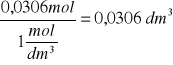
Zad.3
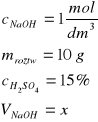
Równanie przebiegającej reakcji: H2SO4 +2NaOH→Na2SO4 + 2H2O
Obliczmy ilość kwasu siarkowego(VI) w 10g 15% roztworu mkwasu= 1,5 g kwasu. Jako, że ilość NaOH podana jest w postaci stężenia molowego, również ilość zasady wyrazimy w molach: Na podstawie równania reakcji:
1 mol kwasu czyli 98 g H2SO4 reaguje z 2 molami NaOH
1,5 g H2SO4 reaguje z x molami NaOH x=0,0306
Z wzoru na stężenie molowe: cm=x/V ⇒ V=x/cm V=0,0306/1=0,0306 dm3
Odpowiedź: Do zobojętnienia roztworu kwasu potrzeba 30,6 cm3 roztworu NaOH
Zad.4
Roztwór kwasu: V=2 cm3 cp=14% d=1,095 g/cm3
Roztwór zasady: V=37 cm3 cm=2 mol/dm3
Obliczenia na podstawie biegnącej, według następującego równania, reakcji:
H2SO4 +2NaOH→Na2SO4 + 2H2O
Z równania wynika, że kwas reaguje z zasadą w stosunku molowym 1:2
Obliczamy ilości moli:
Kwasu siarkowego(VI): mkwasu = 2 cm3⋅ 1,095 g/cm3⋅0,14 =0,307 g
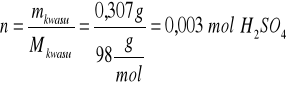
Zasady sodowej:
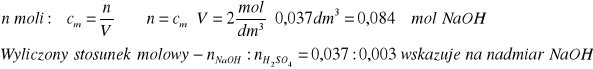
Roztwór po reakcji będzie więc miał odczyn zasadowy (pH>7)
Zad.5
VHCl = 20 cm3 ; cHCl = 0,1152 mol/dm3; VNaOH po uśrednieniu trzech wyników: 24,77 cm3 Obliczyć stężenie molowe roztworu NaOH cNaOH
Z równania reakcji: NaOH + HCl = NaCl + H2O wynika, że kwas solny reaguje z zasadą sodową w stosunku molowym 1:1, czyli nNaOH = nHCl a z tego wynika, że: VNaOH⋅cNaOH=VHCl⋅cHCl
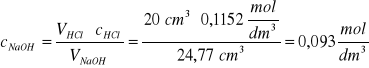
Zad. 6
c1= 2 mol/dm3
V1 = x cm3
c2 = 0,1 mol/dm3
V2 =200 cm3
Ilość substancji rozpuszczonej nie uległa zmianie, więc w roztworze znajduje się ta sama ilość moli substancji rozpuszczonej, czyli:
n1= n2 => V1⋅c1 = V2⋅c2
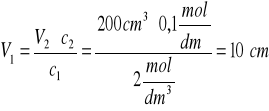
Należy rozcieńczyć 10 cm3 roztworu o stężeniu 2mol/dm3
Zad.7
mNaOH = 2,9980 g
VHCl = 48,4 cm3
CHCl = 0,0994 mol/dm3
Cp NaOH = x
Sytuację opisaną w zadaniu przedstawia równanie: NaOH + HCl = NaCl + H2O
zasada sodowa z kwasem solnym reaguje w stosunku molowym 1:1 tak więc:
nNaOH=nHCl →![]()
![]()
1 mol NaOH - 40 g NaOH
0,0048 mol NaOH - x g NaOH
x = 0,1924 g NaOH
Obliczenie zawartości procentowej NaOH w produkcie technicznym:
2,998 g technicznego NaOH - 100%
0,1924 g NaOH - x%
x% = 6,42 % NaOH
Zawartość NaOH w produkcie technicznym wynosi 6,42%
Zad. 8
m = 8,5g technicznego K2CO3
Vkwasu = 42 cm3 = 0,042 dm3
Ckwasu = 1 mol/dm3
Sytuację zadania opisuje równanie reakcji:
K2CO3 + H2SO4 = K2SO4 + H2O + CO2(↑)
Obliczamy masę węglanu potasu, która przereagowała z kwasem siarkowym(VI)
nkwasu= 0,042 dm3∙1 mol/dm3=0,042 mol H2SO4 ![]()
Z równania reakcji wynika, że 1 mol węglanu, czyli 138 g reagują z 1 mol kwasu
X g reagują z 0,042 mol kwasu
X = 5,796 g węglanu potasu; obliczamy zawartość procentową:
8,5 g technicznego odpowiada 100%
5,796 g węglanu odpowiada x%
x = 68,19 % K2CO3
Zad. 9
VNaOH = 25 cm3; d = 1,22 g/cm3; V1= 250 cm3; V2= 50 cm3; Vkwasu=24,88 cm3; cm= x mol/dm3
Równanie reakcji: H2SO4 + 2NaOH = Na2SO4 + 2H2O
Obliczmy objętość roztworu kwasu, niezbędną do zobojętnienia całego roztworu zasady:
50 cm3 zasady trzeba 0,248 dm3 kwasu
250 cm3zasady potrzeba x dm3 kwasu, czyli Vkwasu= 0,124 dm3
Z objętości i stężenia roztworu kwasu obliczamy ilość moli kwasu siarkowego(VI)
n = 0,124 dm3∙ 1 mol/dm3 = 0,124 mola kwasu siarkowego, na podstawie równania reakcji obliczymy masę wodorotlenku sodu (mNaOH)
2 mole NaOH czyli 80 g NaOH reaguje z 1 molem kwasu siarkowego(VI)
x g NaOH reaguje z 0,124 molami kwasu
mNaOH = 9,92 g NaOH
Obliczamy masę wyjściową roztworu: mr =V[cm3]∙d[g/cm3] = 25 cm3∙1,220 g/cm3 = 30,5 g
Na podstawie wyliczonych wielkości możemy wyliczyć stężenie procentowe roztworu:
30,5 g roztworu stanowi 100%
9,42 g wodorotlenku sodu stanowi cp roztworu
cp = 32,5%
Zad. 10
W reakcjach można stosować wygodne przeliczenie ilości substnacji przypadającej na jeden wymieniony w reakcji redoks elektron (mol elektronów):
n =V ∙ cm= 0,0261∙0,1 = 0,00261
Podobnie wyliczamy ilość tlenku siarki(IV) przypadająca na 1 mol elektronów 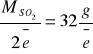
Z równania reakcji redoks wynika więc, że 32 g SO2 przypada na 0,4 mol/e KMnO4
x g SO2 przypada na 0,0026 mol/e KMnO4
x = 0,21 g SO2
Uwzględniając rozcieńczenie całkowita ilość tlenku siarki(IV) wynosi m = 25∙0,21 g SO2 = 5,22 g SO2
Zadania z zestawów maturalnych - rozwiązania
Zad. 1
mrudy = 2 g
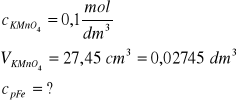
W trakcie miareczkowania biegnie następująca reakcja redoks:
![]()
Z informacji o roztworze manganianu(VII) potasu obliczymy ilość moli tego związku, która jest równa ilości moli jonów manganowych(VII):
![]()
Z równania reakcji obliczmy masę żelaza, które weszło w reakcję:
5 moli żelaza czyli 280 g reaguje z 1 molem KMnO4
mFe reaguje z 0,002745 mol KMnO4
mFe = 0,77 g Fe
Obliczamy zawartość procentową żelaza w rudzie:
2 g rudy stanowią 100%
0,77 g Fe stanowi x% x = 38,5% Fe
Zad. 2
mmieszaniny = 2g
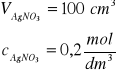
do obliczenia skład procentowy mieszaniny soli
Równania reakcji:
KBr + AgNO3 =KNO3 + AgBr(↓)
NaCl + AgNO3 = NaNO3 +AgCl(↓)
Na podstawie powyższych równań reakcji można ułożyć układ równań matematycznych z dwiema niewiadomymi, które będą odpowiednio oznaczały x ilość moli KBr oraz y ilość moli NaCl, po uwzględnieniu mas molowych można oznaczyć masy składników w formie ilorazu ilości moli i mas molowych: MKBr = 119g/mol; MNaCl = 58g/mol
Suma ilości moli ( x + y) bromku potasu i chlorku sodu będzie równa ilości moli azotanu(V) srebra użytego do strącenia osadu czyli n = c ∙V[dm3] = 0,02 mol
Układ równań:
Suma mas 119 x + 58 y = 2
Suma moli x + y = 0,02
Wyliczone wartości niewiadomych wynoszą odpowiednio: x = 0,014; y = 0,006
Masy odpowiednich soli wynoszą:
mKBr = 119g/mol∙0,014 = 1,72 g;
mNaCl = 58 g/mol∙0,006 = 0,35 g
Uwaga: Suma mas nieco przewyższa podaną wartość, wynika to z przyjętej dokładności obliczeń i zastosowanych zaokrągleń.
Zad. 3
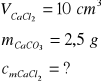
Równanie reakcji opisanej w zadaniu:
CaCl2 + Na2CO3 = CaCO3(↓) + 2 NaCl
Jako, że w zadaniu chodzi o wyliczenie stężenia molowego, ilość chlorku wapnia wyrazimy w molach.
1 mol CaCl2 da w wyniku reakcji 1 mol CaCO3 czyli 100 g (Mwęglanu wapnia) = 100 g/mol
x moli CaCl2 do w wyniku reakcji 2,5 g CaCO3
x = 0,025 mola CaCl2
Obliczamy stężenie molowe roztworu chlorku wapnia:
![]()
Zad. 4
Vkw = 400 cm3 = 0,4 dm3
cm kw = 0,2 mol/dm3
n - ilość cząsteczek wodoru
Równanie zachodzącej reakcji: Mg + 2CH3COOH = Mg(CH3COO)2 + H2(↑)
Obliczmy ilość moli kwasu octowego: ![]()
Korzystając z równania reakcji układamy proporcję:
2 mole kwasu dają 22,4 dm3 wodoru
0,08 mola kwas daje x dm3 wodoru
x = 0,896 dm3 wodoru
Do obliczenia ilości cząsteczek skorzystamy z mola jako miary liczności substancji:
1 mol czyli 22,4 dm3 wodoru to 6,03∙1023 cząsteczek wodoru(liczba Avogadra)
0,896 dm3 wodoru zawiera x cząsteczek wodoru
x = 0,24∙1023 cząsteczek wodoru
Zad. 5
Vr =10 cm3
![]()
= 0,224 dm3
![]()
= ?
Równanie reakcji: Na2CO3 + 2CH3COOH → 2CH3COONa + H2O + CO2
Obliczamy ilość moli węglanu sodu niezbędną do otrzymania 0,224 dm3 CO2
Z równania reakcji wynika, że 1 mol Na2CO3 daje 22,4 dm3CO2 n mol Na2CO3 daje 0,224 dm3CO2
n = 0,01 mol
Obliczamy stężenie molowe roztworu:
Zad. 6
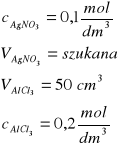
Równanie reakcji: AlCl3 +3AgNO3 =3AgCl + Al(NO3)3
Obliczamy ilość moli AlCl3 n = V∙c = 0,05 dm3∙0,2![]()
=0,01 mol AlCl3
Z równania reakcji obliczamy ilość moli AgNO3
1 mol AlCl3 reaguje z 3 molami AgNO3
0,01 mola AlCl3 reaguje z 0,03 molami AgNO3
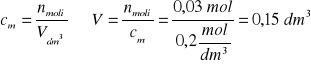
Zad. 7
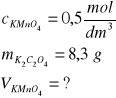
Z równania reakcji: 2KMnO4+5K2C2O4+8H2SO4=6K2SO4+2MnSO4+10CO2+8H2O wynika że:
2 mole KMnO4 reagują z 5 molami szczawianu, czyli 830 g ![]()
n moli KMnO4 reaguje z 8,3 g
n = 0,02 mola KMnO4
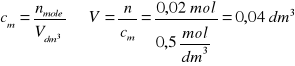
Zad. 8
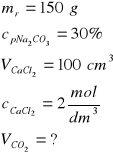
Równanie reakcji: Na2CO3 +CaCl2 = 2NaCl + CaCO3(↓)
Obliczamy masy substratów reakcji:
a/ masa węglanu sodu 150g roztworu to 100%
x g węglanu to 30% x = 45 g
b/ masa chlorku wapnia
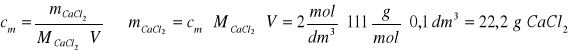
W celu ustalenie, który z substratów był wzięty w nadmiarze, z równania reakcji obliczamy ilości węglanu wapnia przy użyciu każdego z substratów. Właściwy będzie wynik mniejszy, gdyż wyższy odpowiada ilości substratu wziętego w nadmiarze
1 mol Na2CO3 czyli 106 g daje 1 mol CaCO3 czyli 100 g
45 g daje x1 g x1 = 42,5 g CaCO3
1 mol CaCl2 czyli 111 g daje 1 mol CaCO3 czyli 100g
22,2 g daje x2 g x2= 20 g CaCO3
Otrzymano więc 20 g węglanu wapnia (decyduje o tym ilość wziętego z niedomiarem chlorku wapnia). Objętość wydzielonego CO2 (warunki normalne)
Z 1 mola CaCO3 czyli z 100g powstaje 1 mol CO2 czyli 22,4 dm3
z 20g powstaje x dm3
Wyliczona objętość, w warunkach normalnych, wynosi 4,48 dm3, przeliczamy ją na warunki opisane w zadaniu zgodnie z równaniem:
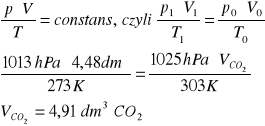
Zad. 9
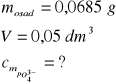
Równanie reakcji: Na3PO4+MgCl2+NH4Cl → NH4MgPO4 +3NaCl
1 mol ![]()
daje mol osadu, czyli 137 g osadu
x moli daje 0,0685 g osadu x=0,005 mol![]()
Obliczamy stężenie molowe:
![]()
Zad. 10

Zad. 11
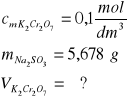
Równanie przebiegającej reakcji:
3Na2SO3 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3Na2SO4 + K2SO4 +4H2O
3 mole Na2SO3 czyli 318g reaguje z 1 molem K2Cr2O7
5,6 g reaguje z x molami; x=0,018mol K2Cr2O7
Objętość roztworu dichromianu(VI) będzie wynosiła:
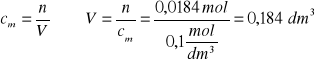
Zad 12.
VHCl = 20 cm3
cHCl = 0,2 mol/dm3
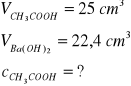
Ba(OH)2 + 2HCl → BaCl2 + 2H2O;
Ba(OH)2 + 2CH3COOH →Ba(CH3COO)2 + 2H2O
Obliczamy stężenie molowe Ba(OH)2
nHCl = 0,02 dm3∙0,2 mol/dm3 = 0,0004mol HCl ≡ 0,0002 mole Ba(OH)2
![]()
więc ilość moli kwasu octowego dwukrotnie większa, czyli n = 0,000448; ilość ta znajdowała się w 25 cm3 roztworu, czyli stężenie tego roztworu wyniesie: ![]()
Zad. 13
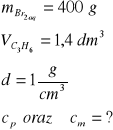
Równanie reakcji: C3H6 + Br2 = C3H6Br2
Na podstawie równania reakcji obliczymy masę bromu w roztworze:
1 mol czyli 22,4 dm3 C3H6 reaguje z 1 molem czyli 160 g Br2
1,4 dm3 C3H6 reaguje z x g Br2
x = 10 g Br2
Obliczamy stężenie procentowe: 400 g roztworu odpowiada 100%
10g Br2 odpowiada cp= 2,5%
Obliczamy stężenie molowe:
Jako, że gęstość roztworu d = 1g/cm3; objętość V = 0,4 dm3; Mbromu = 160 g/mol
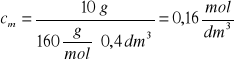
Zad. 14
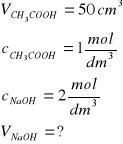
Z równania reakcji: NaOH + CH3COOH = CH3COONa + H2O wynika, że:
Kwas reaguje z zasadą w stosunku molowym 1:1, tak więc:
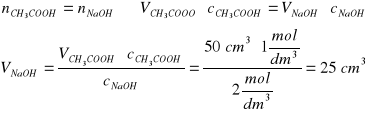
Zad. 15
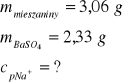
Z równania reakcji obliczamy ilość siarczanu(VI) sodu
Na2SO4+ BaCl2 → BaSO4(↓) + 2NaCl
1 mol czyli 142 g Na2SO4 dają 1 mol czyli 233 g BaSO4
x g Na2SO4 dają 2,33 g BaSO4
x = 1,42 g Na2SO4
Mieszanina składa się więc z 1,42 g siarczanu(VI) sodu oraz (3,06g - 1,42g) 1,64 g octanu sodu.
Obliczamy ilość sodu w składnikach mieszaniny:
1 mol siarczanu(VI) sodu czyli 142 g zawiera 46 g sodu
1,42 g zawiera 0,46 g sodu
1 mol octanu sodu czyli 82 g zawierają 23 g sodu
1,64 g zawiera x g sodu; x = 0,46 g Na
Łączna ilość jonów sodu mNa= 0,92 g w 3,06 g mieszaniny
![]()
Zad. 16
mmiesz = 5,12 g
VHCl = 60 cm3 = 0,06 dm3
CHCl = 2 mol/dm3
CpCaO = ?
Równania przeprowadzonych reakcji:
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Zakładamy, że mieszanina zawiera x moli CaO oraz y moli CaCO3
mCaO = x moli∙ MCaO = 56x; m = y moli∙ Mwęglanu = 100y
suma mas: 56x + 100y = 5,12
ilość moli HCl 2x + 2y = 0,06 dm3∙ 2 mol/dm3 = 0,12 mol
ostateczny układ równań: 56x + 100y = 5,12
2x + 2y = 0,12
Wynik: x = 0,02; y= 0,04 Ilość tlenku mCaO = 56x = 1,12 g
5,12 g kredy odpowiada 100%
1,12 g CaO odpowiada cpCaO cpCaO = 21,9%
Zad. 17
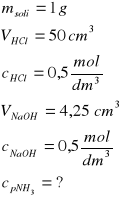
Ilość moli HCl przed pochłanianiem:
nHCl = V[dm3]∙c[mol/dm3] = 0,05 dm3∙0,5mol/dm3 = 0,025 moli HCl
Ilość moli HCl, która przereagowała z amoniakiem (reagują w stos. mol.=1:1
nNaOH = 0,00425 dm3∙ 0,5 mol/dm3) = 0,002 mol NaOH i tyle samo HCl
Ilość moli HCl, która przereagowała z amoniakiem
nHCl = nog - nNaOH = 0,025 - 0,002 = 0,023 mole HCl
Równanie reakcji pochłaniania amoniaku:
NH3 + HCl = NH4Cl
1 mol amoniaku czyli 17 g NH3 reaguje z 1 molem kwasu
x g NH3 reaguje z 0,023 molami kwasu
x = 0,0723 g NH3
Obliczenie zawartości procentowej: 1 g soli - 100%
0,0723 g NH3 - ![]()
![]()
Zad. 18
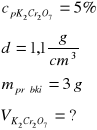
Równanie zachodzącej reakcji redoks:
3C3H7OH + K2Cr2O7 + 4H2SO4 = 3C3H6O + K2SO4 + Cr2(SO4)3 + 7H2O
1 mol K2Cr2O7 czyli 294 g reaguje z 3 molami C3H7OH czyli 162 g
x g reaguje z 3 g;
x = 5,44 g dichromianu(VI) potasu
Obliczamy masę 5% roztworu:
5,44 g K2Cr2O7 stanowi 5%
mroztw. stanowi 100%
mroztw. = 108,9 g roztworu; V= m/d 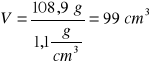
Zad. 19
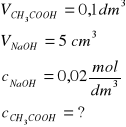
Z równania reakcji wynika, że kwas octowy reaguje z zasadą sodową w stosunku molowym 1:1, czyli można to wyrazić:
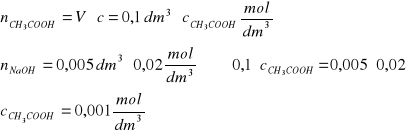
Reakcje w roztworach wodnych
Część II - Iloczyn rozpuszczalności
Wśród zadań maturalnych w zestawie roku 2005 znalazło się również takie, które wymagało od ucznia precyzyjnego określenia a właściwie rachunkowego uzasadnienia, czy w podanych warunkach nastąpi wytrącenie osadu. Chodziło w tym wypadku o przewidywanie wytrącenia osadu nie na podstawie tzw. tablicy rozpuszczalności a jedynie podanych stężeń mieszanych roztworów, czyli mówiąc inaczej znajomości tzw. iloczynu rozpuszczalności. Mimo, że uczniowie przygotowani są teoretycznie do zrozumienia tego pojęcia gdyż dosyć szczegółowo mówi się o reakcjach nieodwracalnych i warunkach ich przebiegu, o prawie działania mas i regule przekory iloczyn rozpuszczalności omawia się pobieżnie lub wręcz pomija. Tak więc pozostaje jeden krok do zrozumienia pojęcia iloczynu rozpuszczalności, gdyż pojęcie to jest w pewnym sensie przybliżone już przy omawianiu pH oraz iloczynu jonowego wody. Wynika on również naturalnie z faktu, że w tabelach rozpuszczalności np. w zbiorze zadań Krzysztofa Pazdry i innych podręcznikach określa się substancji jako rozpuszczalne, nierozpuszczalne oraz słabo rozpuszczalne. W tej sytuacji rodzą się wątpliwości myślących uczniów - co to znaczy słabo rozpuszczalny ? - wytrąci się wówczas osad czy też nie ? Jak to przewidzieć ? Tak więc korzystając ze znanych pojęć stałej równowagi i reguły przekory spróbujmy przybliżyć to zagadnienie.
W każdym nasyconym roztworze trudno rozpuszczalnego elektrolitu istnieje stan równowagi pomiędzy jonami elektrolitu w roztworze a nadmiarem fazy stałej (osadem) pozostającej z nim w równowadze. Ponieważ elektrolit taki jest w wodzie trudnorozpuszczalny, zatem jego nasycony roztwór jest bardzo rozcieńczony. W takim roztworze znajdują się wyłącznie jony elektrolitu, natomiast nie są w nim obecne cząsteczki niezdysocjowane (α = 100%). Równowaga w takim układzie jest tzw. równowagą dynamiczną, to znaczy w jednostce czasu taka sama ilość cząsteczek przechodzi do roztworu i jednocześnie ulega wytrąceniu z niego. Stan równowagi pomiędzy trudno rozpuszczalnym elektrolitem a jego nasyconym roztworem odpowiada przemianie:
(KtAn)stały ↔ Kt+ + An-
osad roztwór nasycony
a wyrażenie na stałą równowagi tego procesu, zgodnie z prawem działania mas, posiada postać:
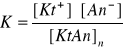
Wartość tej stałej równowagi jest niezmienna w stałej temperaturze, zgodnie z prawem działania mas. Ponieważ ilość substancji w fazie stałej, ze względu na duży nadmiar (w osadzie) jest również niezmienna w niezmiennej temperaturze, wyrażenie [KtAt]st posiada wartość stałą. Iloczyn dwóch stałych wartości jest również stałą nazywaną iloczynem rozpuszczalności i oznaczaną najczęściej literą L.
K∙[KtAn]st = L = [Kt+]∙[An-]
Iloczyn rozp. Iloczyn jonowy
Iloczyn stężeń jonowych [Kt+]∙[An-] nosi nazwę iloczynu jonowego
Iloczyn jonowy trudno rozpuszczalnego elektrolitu w roztworze nasyconym - pozostającym w równowadze z nadmiarem fazy stałej - jest równy iloczynowi rozpuszczalności, wartości stałej w stałej temperaturze.
W obliczeniach rozpuszczalności sprawą podstawową jest poprawne wstawienie wartości stężeń jonowych do wyrażeń na iloczyn rozpuszczalności odpowiednich elektrolitów. Wartości stężeń jonowych wynikają z równania dysocjacji trudno rozpuszczalnej soli. Niechaj przykładowo rozpuszczalność chlorku srebra wynosi x : [AgCl] = x. Z każdej cząsteczki AgCl powstaje 1 jon srebra i 1 jon chlorkowy, zatem [Ag+] = [Cl-] Po wstawieniu stężeń do iloczynu jonowego otrzymuje się: LAgCl = [Ag+]∙[Cl-] = x∙ x = x2, stad ![]()
Jeżeli stężenie [MgNH4PO4] = x, a każda cząsteczka dysocjuje na 1 jon magnezu, jeden jon amonowy i jeden jon ortofosforanowy(V), to ich stężenia wynoszą: [Mg2+] = x ; [NH4+] = x ; [PO43-] = x
L = [Mg2+]∙[NH4+]∙[PO43+] = x∙x∙x =x3
Stąd ![]()
Jeżeli stężenie CaF2 oznaczy się przez x: [CaF2] = x, a każda cząsteczka tej soli dysocjuje na 1 jon wapnia i 2 jony fluorkowe, zatem [Ca2+] =x i [F-] =2x to:
![]()
Przykładowe zadanie umożliwiające precyzyjne określenie, czy nastąpi wytrącenie osadu.
Do 500 cm30,008 molowego roztworu chlorku wapnia dodano 500 cm3 0,01 molowego roztworu siarczanu sodu. Wskazać, czy w podanych warunkach wytrąci się osad węglanu wapnia. Wartość iloczynu rozpuszczalności wynosi L= 2,4∙10-5.
Rozwiązanie. Po zmieszaniu roztworów podwoi się objętość a stężenia soli zmniejszą się do połowy i wyniosą: [CaCl2] = [Ca2+] = 0,008∙0,5= 0,004 mola/dm3; [Na2SO4] = [SO42-] = 0,01∙ 0,5 = 0,005 mol/dm3
Iloczyn jonowy siarczanu(VI) wapnia jest równy:
L = [Ca2+]∙[SO42-]=0,004∙0,005= 2,0∙10-5
I jest mniejszy iloczynu rozpuszczalności CaSO4 2,0∙10-5 < 2,4∙ 10-5, taki roztwór jest więc nienasycony i osad nie wytrąci się.
Można również na podstawie takich obliczeń precyzyjnie określić, który z przykładowych związków jest lepiej rozpuszczalny.
Przykładowe zadanie Który elektrolit jest lepiej rozpuszczalny w wodzie: węglan kadmy czy wodorotlenek kadmu ? Wartości iloczynów rozpuszczalności wynoszą dla węglanu L = 5,2∙10-12 zaś dla wodorotlenku L = 2,8∙10-14 Rozpuszczalność podać w gramach na 1 dm3 roztworu nasyconego.
Rozwiązania: Wyrażenia na iloczyny rozpuszczalności związków mają postać:
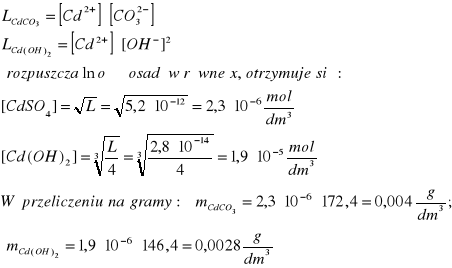
Elektrolitem lepiej rozpuszczalnym i to siedem razy jest wodorotlenek kadmu, mimo mniejszej wartości iloczynu rozpuszczalności. Wynika to z różnej postaci wyrażeń określających zależność między rozpuszczalnością i iloczynem rozpuszczalności obu tych elektrolitów.
Propozycje zadań do rozwiązania
Ile gramów węglanu wapnia rozpuszcza się w 2,5 dm3 wody. Iloczyn rozpuszczalności węglanu wapnia wynosi L = 4,7∙10-9
Ile gramów chlorku ołowiu(II) rozpuszcza się w 250 cm3 wody. Iloczyn rozpuszczalności (L) PbCl2 wynosi 1,6∙10-5
Rozpuszczalność węglanu kadmu(II) wynosi 3,93 ∙10-4 g/dm3 Obliczyć wartość iloczynu rozpuszczalności tej soli
W 1793 cm3 wody rozpuszcza się dokładnie 1 gram jodku ołowiu(II). Oblicz wartość iloczynu rozpuszczalności tej soli
Czy wytrąci się osad węglanu wapnia jeżeli zmieszano równe objętości0,01 molowych roztworów chlorku wapnia i węglanu sodu. Obliczyć ile gramów jonów wapniowych pozostanie w roztworze nasyconym. Stopień dysocjacji soli wynosi 80% a iloczyn rozpuszczalności węglanu wapnia wynosi L = 4,7∙10-9
Ułożyć jonowe równania reakcji roztwarzania się w kwasie solnym następujących trudno rozpuszczalnych związków: CaCO3; Mg(OH)2; FeS; Al(OH)3; Dlaczego rozpuszczają się w kwasie solnym?
Ile gramów siarczanu strontu rozpuści się w 10 dm3 wody. Iloczyn rozpuszczalności siarczanu(VI) strontu wynosi L = 7,6∙10-7
Ile gramów jonów srebra pozostanie w 100 cm3 nasyconego roztworu: AgCl; AgBr; AgI. Odpowiednie wartości iloczynów rozpuszczalności wynoszą LAgCl = 1,1∙10-10, LAgBr=5,2∙10-14; LAgI = 8,3∙10-17
Czy wytrąci się osad chlorku ołowiu(II) jeżeli do 150 cm3 0,01 molowego roztworu azotanu(V) ołowiu(II) dodano 350 cm3 0,02 molowego roztworu chlorku sodowego. Założyć całkowitą dysocjację soli. Iloczyn rozpuszczalności chlorku ołowiu(II) wynosi L = 1,6∙10-5
Obliczyć wartość iloczynu rozpuszczalności Mg(OH)2 jeżeli jego rozpuszczalność w temperaturze pokojowej wynosi 1,40∙10-4 mol/dm3
Rozwiązanie zadań na iloczyn rozpuszczalności
Zad.1
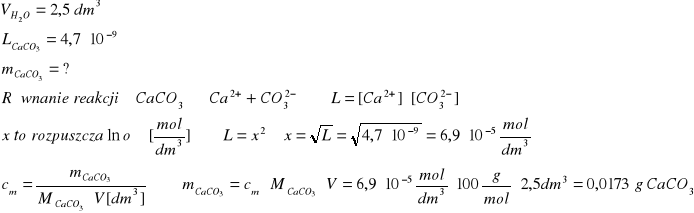
Zad.2
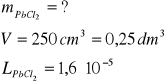
Jeżeli stężenie PbCl2 = x wówczas [Pb2+] = x, zaś [Cl-] = 2x iloczyn rozpuszczalności L będzie wynosił L = x∙(2x)2 = 4x3
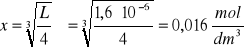
podobnie jak w zadaniu 1 obliczamy masę rozpuszczonej soli PbCl2
![]()
Zad. 3
Rozp. (x) = 3,93∙10-4 g/dm3
L = ?
Na podstawie podanej rozpuszczalności i masy molowej węglanu kadmu (M = 172 g/mol) obliczymy stężenie molowe (cm) nasyconego roztworu
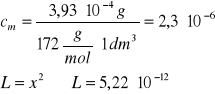
Zad. 4

Z równania reakcji dysocjacji wynika, że jeżeli stężenie jodku ołowiu(II) wynosi x to stężenie [Pb2+]= x, zaś stężenie [I-] = 2x, iloczyn rozpuszczalności PbI2 wynosi L = x ∙ (2x)2 = 4x3 = 4(3,6∙10-3)3 = 1,9∙10-7
Zad. 5
![]()
po wzajemnym rozcieńczeniu się roztworów w stosunku objętościowym 1 : 1 stężenia jonów wapniowego i węglanowego zmaleją o połowę i będą wynosiły [Ca2+] = [CO32-] = 0,005 mol/dm3 iloczyn stężeń tych jonów w roztworze wynosi więc:
0,25 ∙10-4 i jest większy od iloczynu rozpuszczalności wynoszącego 4,7∙10-9 Nastąpi więc wytrącenie osadu. Powstaje nasycony roztwór węglanu wapnia, którego iloczyn wynosi L = 4,7∙10-9 , zaś rozpuszczalność x będzie równa pierwiastkowi z L. Tak więc x = 6,84∙10-5 mola CaCO3 , z tego dysocjacji uległo 80%
gdyby dysocjowało w 100% to dysocjowałoby 6,84∙10-5 mola
80% x moli
Dysocjacji ulega więc 5,47∙10-5 mola węglanu, dając taką samą ilość moli jonów wapnia czyli 5,47∙10-5mol∙40g/mol = 2,2∙10-3g Ca2+
Zad. 6
Zapisy cząsteczkowe i jonowe równań reakcji
CaCO3 + 2HCl = CaCl2 + H2O + CO2(↑)
CO32- + 2H+ = H2O + CO2
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
OH- + H+ = H2O
FeS + 2 HCl = H2S + FeCl2
S2- + 2H+ = H2S(↑)
Al(OH)3 + 3HCl = AlCl3 + 3H2O
OH- + H+ = H2O
Zad.7
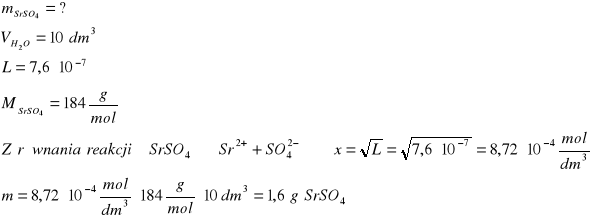
Zad.8
Dla każdej z wymienionych soli z racji analogii wzorów (typ AB)
![]()
Kolejno obliczenia dla wymienionych soli srebra
AgCl 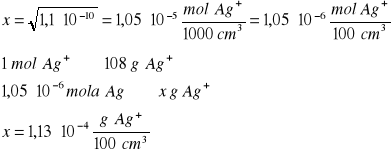
AgBr
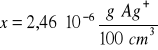
AgI
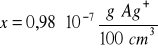
Zad. 9
Obliczamy stężenia jonów po wzajemnym rozcieńczeniu
Pb2+ 150 cm3 stężenie 0,01 mol/dm3
500 cm3 stężenie x mol/dm3
[Pb2+] = 0,033 mol/dm3
Cl- 350 cm3 stężenie 0,02 mol/dm3
500 cm3 stężenie y mol/dm3
[Cl-] = 0,029 mol/dm3
iloczyn stężeń jonów po zmieszaniu roztworów wynosi
L = 0,033 ∙ (0,029)2 = 2,69∙10-5 i ma wartość większą od literaturowej wartości iloczynu rozpuszczalności dla tej soli (1,6∙10-5) a więc osad się wytrącił.
Zad.10
![]()
uwzględniając równanie reakcji dysocjacji Mg(OH)2↔Mg2++2OH-
[Mg2+] = x zaś [OH-] = 2x czyli L = x·(2x)2= 4x3
tak więc L = 4·(1,4·10-4)3 = 1,1·10-11
1
Wyszukiwarka
Podobne podstrony:
analiza chem i rozpuszczxalnosc, 1 semestr wiś iś
ISE powtorka z chemii, ISE p 1 analiza elementarna, P
ISE powtorka z chemii, ISE metale i elektrochemia, Propozycje tematyki do strony internetowej CEŚ
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
ISE powtorka z chemii, ISE ZADANIA Przeliczanie stezen roztworow, Przeliczanie stężeń roztworów
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
ISE powtorka z chemii, ISE wlasnosci chemiczne pierwiastkow calosc, Właściwości chemiczne pierwiastk
ISE powtorka z chemii, ISE alkohole i fenole, P
ISE powtorka z chemii, ISE a.a. slowo wstepne, Słowo wstępne
ISE powtorka z chemii, ISE fluorowce, M Fluorowce
ISE powtorka z chemii, ISE otrzymywanie i wlasciwosci najwazniejszych kwasow, O
ścoąga analiza chem
Praca powtórzeniowa z chemii 3
ANALIZA CHEM st
analiza chem 2 id 59885 Nieznany (2)
Praca powtórzeniowa z chemii nr 1
Kafarski, podstawy chemii organicznej, ANALIZA WIDM SPEKTROSKOPOWYCH
więcej podobnych podstron