Grupa |
Zespół |
Ćwiczenie |
Data |
Ocena |
22
|
6
|
4
|
16.05.2011
|
|
Imię i nazwisko |
Temat ćwiczenia |
|||
Wojciech Trębacz
|
DESTYLACJA
|
|||
1. Wstęp teoretyczny
Prężność pary nad ciekłym roztworem przedstawia się w układzie p = f(x), gdzie na osi odciętych znajduje się ułamek molowy składnika drugiego, a na osi rzędnych - sumaryczna prężność pary nad cieczą. Jeżeli roztwór jest doskonały, to spełnia prawo Raoulta. W takim przypadku wykres zależności p (x) jest linią prostą. W przypadku roztworów innych niż doskonałe sumaryczna prężność pary nad roztworem jest większa (dodatnie odchylenia od prawa Raoulta) lub mniejsza (ujemne odchylenia) niż wynikało by to z prawa Raoulta. Czasami odchylenia te są tak duże, że krzywa prężności pary jako funkcja składu wykazuje ekstremum (roztwory takie nazywane są azeotropami).
Destylacja jest to proces fizykochemiczny, który polega na ogrzewaniu roztworu wieloskładnikowego, w celu jego rozdzielenia, do jego temperatury wrzenia pod stałym ciśnieniem i skraplaniu par pozostających w równowadze z wrzącą cieczą. Destylację można stosować do rozdzielania składników jeżeli skład pary różni się od składu cieczy. W trakcie destylacji skraplana para wzbogaca się w składnik bardziej lotny, a pozostała ciecz w składnik mniej lotny.
W celu wyznaczenia krzywych równowagowych ciecz - para dla roztworów doskonałych w układzie dwuskładnikowym, należy w odpowiednim aparacie destylacyjnym doprowadzić do ustalenia się równowagi ciecz - para i pobrać, w stanie równowagi, próbki cieczy i destylatu (który posiada skład pary charakterystyczny dla danej temperaturze). Skład fazy ciekłej i fazy gazowej wyznacza się przez pomiar współczynnika załamania światła na refraktometrze i odczytanie odpowiadającego mu składu na odpowiedniej krzywej.
2. Cel ćwiczenia
Wyznaczenie krzywej równowagowej ciecz - para w układzie heksan - toluen.
3. Zadane parametry
roztwór I - 40 cm3 mieszaniny heksan - toluen o nieznanym składzie
roztwór II - 35 cm3 roztworu I + 5 cm3 heksanu
ciśnienie zewnętrzne pz = 754 mmHg
temperatura wrzenia toluenu (760 mmHg) = 110,6°C
temperatura wrzenia heksanu (760mmHg) = 68,7 °C
4. Wyniki pomiarów
roztwór |
temperatura wrzenia [°C] |
nd pary |
nd cieczy |
yt w parze |
yh w parze |
xt w cieczy |
xh w cieczy |
|
|
yt = |
I |
90° |
1,421 |
1,1471 |
0,375 |
0,635 |
0,425 |
0,575 |
485 |
269 |
0,643 |
II |
88° |
1,414 |
1,414 |
0,32 |
0,68 |
0,425 |
0,575 |
480 |
274 |
0,637 |
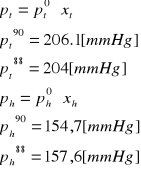
![]()
![]()
![]()
![]()
temperatura wrzenia toluenu (754mmHg) = 110,3°C
temperatura wrzenia heksanu (754 mmHg) = 68,4°C
Na podstawie dołączonego do sprawozdania wykresu równowagowego ciecz - para dla układu toluen - heksan można stwierdzić, że heksan ma niższą niż toluen temperaturę wrzenia, czyli w badanym układzie jest substancją bardziej lotną, w destylacie jest go zatem więcej w stosunku do roztworu wyjściowego. Rzeczywista temperatura wrzenia roztworu jest bardzo przybliżona do teoretycznej
2
Wyszukiwarka
Podobne podstrony:
Gr, xBURDEL gł 2rok;)
aaaaaaaa, xBURDEL gł 2rok;)
lista na fizyczna, xBURDEL gł 2rok;)
sprawozdanie-wzorcowanie przyrządów, xBURDEL gł 2rok;)
laborka11, xBURDEL gł 2rok;)
PEHA, xBURDEL gł 2rok;)
chromatografia poprwiona, xBURDEL gł 2rok;)
wyswietlacz, xBURDEL gł 2rok;)
FIZYCZ~5, xBURDEL gł 2rok;)
Obiegi termod, xBURDEL gł 2rok;)
Elementy technologii chemicznej B8, xBURDEL gł 2rok;)
ćw3, xBURDEL gł 2rok;)
ustny maszyny, xBURDEL gł 2rok;)
sacharoza obliczenia, xBURDEL gł 2rok;)
więcej podobnych podstron