Imię Nazwisko |
Temat |
Data wykonania |
Ocena |
Grupa 23, zespół 6 |
Równowaga pH w układach buforowych |
|
|
Magdalena Klimek Marcelina Mądro Iwona Brandys Wojciech Trębacz |
|
21.03.11 |
|
Wstęp teoretyczny.
Stała dysocjacji słabego jednozasadowego kwasu RH jest równa:
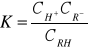
Dysocjację słabego kwasu możemy cofnąć wprowadzając do roztworu jego sól zawierającą kation mocnej zasady. Do ułatwienia obliczeń możemy przyjąć, ze stężenie anionów pochodzących z dysocjacji soli, jest całkowitą liczbą tych jonów w roztworze, ponieważ jest ono w porównaniu od ilości jonów pochodzących z dysocjacji kwasu wiele razy większe, zatem :
![]()
Natomiast stężenie wprowadzanego kwasu ze względu na bardzo mały stopień dysocjacji możemy przyjąć ze jest równe stężeniu kwasu w roztworze:
![]()
Stałą dysocjacji kwasu otrzymamy natomiast ze wzoru:
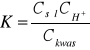
Po przekształceniu otrzymujemy:
![]()
Jak możemy zauważyć, wzór powyżej bez problemu umożliwia nam obliczenie stałej K przy znanym pH buforu i uwzględnionym stosunku![]()
ponieważ wartość ![]()
wynosi wtedy 0 co upraszcza nasze obliczenia. Po dodaniu do buforu mocnego kwasu o stężeniu CHCl , pH roztworu wyniesie:
![]()
Możemy zauważyć, ze przy niewielkim dodatku kwasu, pH buforu zmieni się w bardzo małym stopniu. Zawdzięczamy to cofnięciu się dysocjacji anionów kwasu, powstałych z dobrze rozpuszczalnej soli:
R- + H+ = RH + H2O
Zmianę pH po dodaniu HCl obliczymy z równania:
![]()
,
Roztwory buforowe w których stężenia Csól=Ckwas mają najlepsze właściwości buforujące.
Wykonanie ćwiczenia.
1. Sporządzamy bufor octanowy korzystając z 0.1m CH3COOH
i 0.1m CH3COONa wg następującego przepisu:
Nr roztworu |
CH3COOH [cm3] |
CH3COONa [cm3] |
1 |
1 |
19 |
2 |
2 |
18 |
3 |
3 |
17 |
4 |
5 |
15 |
5 |
7 |
13 |
6 |
9 |
11 |
7 |
10 |
10 |
8 |
11 |
9 |
9 |
13 |
7 |
10 |
15 |
5 |
11 |
17 |
3 |
12 |
18 |
2 |
13 |
19 |
1 |
2. Kalibrujemy pH - metr za wzorcowego roztworu buforowego o pH=7
3. Mierzymy pH sporządzonych roztworów buforowych.
Nr roztworu |
zmierzone pH |
1 |
3,16 |
2 |
3,39 |
3 |
3,59 |
4 |
3,98 |
5 |
4,25 |
6 |
4,49 |
7 |
4,61 |
8 |
4,71 |
9 |
4,90 |
10 |
5,16 |
11 |
5,44 |
12 |
5,63 |
13 |
5,94 |
Do każdego buforu dodajemy po 0,5ml 0,1 molowego roztworu kwasu solnego i mierzymy pH otrzymanych roztworów:
Nr roztworu |
zmierzone pH |
1 |
2,92 |
2 |
3,25 |
3 |
3,52 |
4 |
3,93 |
5 |
4,2 |
6 |
4,46 |
7 |
4,55 |
8 |
4,64 |
9 |
4,85 |
10 |
5,09 |
11 |
5,31 |
12 |
5,52 |
13 |
5,67 |
Opracowanie wyników.
Z równania linii trendu na wykresie odczytujemy wartość -lgK z którego obliczamy stała dysocjacji słabego elektrolitu CH3COOH:
-lgK = 4,5577
K = 2,77*10-5
Obliczamy teoretyczne pH roztworów buforowych po dodaniu HCl i porównujemy z wartościami zmierzonymi oraz wykreślamy zależność pHteor.=f(pHdośw.).
Nr roztworu |
pH teoretyczne z HCl |
pH zmierzone z HCl |
1 |
3,026841 |
2,92 |
2 |
3,522251 |
3,25 |
3 |
3,767322 |
3,52 |
4 |
4,07471 |
3,93 |
5 |
4,294205 |
4,2 |
6 |
4,480266 |
4,46 |
7 |
4,568065 |
4,55 |
8 |
4,654996 |
4,64 |
9 |
4,833424 |
4,85 |
10 |
5,032711 |
5,09 |
11 |
5,285454 |
5,31 |
12 |
5,457522 |
5,52 |
13 |
5,704425 |
5,67 |
Obliczamy ΔpHteor. i wykreślamy ΔpH = f(-lgx)
Nr roztworu |
ΔpH |
1 |
-0,30524 |
2 |
-0,13434 |
3 |
-0,09018 |
4 |
-0,059 |
5 |
-0,04778 |
6 |
-0,04342 |
7 |
-0,04277 |
8 |
-0,04299 |
9 |
-0,04626 |
10 |
-0,05524 |
11 |
-0,07871 |
12 |
-0,10755 |
13 |
-0,18516 |
Wykreślamy zależność β=f(pH), gdzie ![]()
Nr roztworu |
pH czystego buforu |
Wartość β |
1 |
3,16 |
0,00000803 |
2 |
3,39 |
0,000182 |
3 |
3,59 |
0,000272 |
4 |
3,98 |
0,000415 |
5 |
4,25 |
0,000513 |
6 |
4,49 |
0,000564 |
7 |
4,61 |
0,000573 |
8 |
4,71 |
0,00057 |
9 |
4,90 |
0,00053 |
10 |
5,16 |
0,000443 |
11 |
5,44 |
0,000311 |
12 |
5,63 |
0,000228 |
13 |
5,94 |
0,000132 |
Wnioski:
„Zdolność buforowania roztworu może być określona za pomocą wielkości zwanej
pojemnością buforową oznaczaną symbolem β. Pojemność buforowa jest to liczba moli
mocnej zasady lub kwasu, która musi być dodana do 1 litra roztworu, aby spowodować
zmianę pH o jednostkę. Pojemność buforowa wyraża się wzorem: β = ΔB/ΔpH”1
Na podstawie doświadczenia możemy zauważyć, że największą pojemność buforową ma roztwór o równych stężeniach molowych kwasu i zasady, jest zatem on najlepszym buforem.
Różnice w warności pH teoretycznego a pH doświadczalnego, mogą wynikać z różnicy temperatur dla których były obliczane te wartości.
1„MECHANIZM DZIAŁANIA ROZTWORÓW BUFOROWYCH”, Opracowała: mgr inż. Renata Gawron, Częstochowa 2005
Wyszukiwarka
Podobne podstrony:
Gr, xBURDEL gł 2rok;)
aaaaaaaa, xBURDEL gł 2rok;)
lista na fizyczna, xBURDEL gł 2rok;)
sprawozdanie-wzorcowanie przyrządów, xBURDEL gł 2rok;)
laborka11, xBURDEL gł 2rok;)
chromatografia poprwiona, xBURDEL gł 2rok;)
wyswietlacz, xBURDEL gł 2rok;)
FIZYCZ~5, xBURDEL gł 2rok;)
destylacja, xBURDEL gł 2rok;)
Obiegi termod, xBURDEL gł 2rok;)
Elementy technologii chemicznej B8, xBURDEL gł 2rok;)
ćw3, xBURDEL gł 2rok;)
ustny maszyny, xBURDEL gł 2rok;)
sacharoza obliczenia, xBURDEL gł 2rok;)
więcej podobnych podstron