285 [1024x768]

294 ROZTWORY 1 RÓWNOWAGI FAZOWE
gdzie: L, — ciepło sublimacji, a Lm —ciepło parowania. Odejmując powyższe równania stronami, otrzymamy
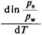
U-L.
RT2 " RT2
(4.43)
gdzie L* jest ciepłem topnienia.
W równowadze, //'. dla roztworu nasyconego, prężność pary nad składnikiem w fazie stałej jest równa prężności pary tego składnika nad roztworem. Jeżeli więc mamy do czynienia z roztworem doskonałym, to możemy zastosować Drawo Raoułta i podstawić p% = p*x2. Równanie (4.43) przyjmie postać
dln-Cj Lfc
~ dT = RT2
(4.44)
a po scałkowaniu
lnx2
(4.45)
gdzie T0 jest temperaturą topnienia substancji rozpuszczonej.
Równanie (4.45) wyraża „doskonałą” krzywą rozpuszczalności (zwykle obserwuje się znaczne odstępstwa, zwłaszcza dla roztworów elektrolitów).
W przypadku rozpuszczalności gazu w cieczy równowaga osiągnięta jest po wyrównaniu potencjałów chemicznych gazu w obu fazach
(4.46)
/i2(ciecz) + R7'lnfl2 (ciecz) = pi(gaz) +RT\np2
Zakładamy tu oczywiście, że gaz zachowuje się jak doskonały. Konsekwencją równania (4.46) jest wyrażenie
K
Pj_
ai
(4.47)
gdzie p2 jest prężnością cząstkową danego gazu nad cieczą, a a2 — jego aktywnością w roztworze. Dla małych stężeń w roztworze aktywność można zastąpić stężeniem i otrzymujemy znane równanie wyrażające prawo Henry'ego (1803):
ct = kr Pi (4.48)
Prawo
Henry‘ego
Stężenie gazu w roztworze jest proporcjonalne do jego prężności cząstkowej nad roztworem.
Istnienie takiej zależności wykorzystywane jest często w zagadnieniach fizjologicznych (np. obecność gazów we krwi). Prawo Henry’ego jest prawem
Wyszukiwarka
Podobne podstrony:
283 [1024x768] 292 ROZTWORY I RÓWNOWAGI FAZOWE (4.37) gdzie //(r„c„, — ciśnienie osmotyczne rzeczywi
271 [1024x768] 280 ROZTWORY I RÓWNOWAGI FAZOWE jeżeli nie takie same, to w każdym razie bardzo podob
275 [1024x768] 284 ROZTWORY I RÓWNOWAGI FAZOWE czystego rozpuszczalnika i roztworu. Punkt krzepnięci
277 [1024x768] 286 ROZTWORY I RÓWNOWAGI FAZOWE — Iń jc, =A//. f dr r !rł A Hw / 1 r r,a//* / r-r,
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
293 [1024x768] 302 ROZTWORY I RÓWNOWAGI FAZOWEDestylacja Przeanalizujmy dokładniej prosty diagram wr
295 [1024x768] 304 ROZTWORY I RÓWNOWAGI FAZOWE mniej lub bardziej trwałych związków pomiędzy składni
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
300 [1024x768] 308 ROZTWORY I RÓWNOWAGI FAZOWE podwójnych. Obszar H20aeb obejmuje nienasycone roztwo
302 [1024x768] 310 ROZTWORY I RÓWNOWAGI FAZOWE12• Obniżenie temp. krzepnięcia dla 0,1 m roztworu kwa
65435 skan0153 (2) 156 Roztwory i równowagi fazowe gdzie wyrażenie w pierwszym nawiasie jest entalpi
263 [1024x768] 272 ROZTWORY I RÓWNOWAGI FAZOWE Ścisła definicja fazy jest więc następująca: Fazą naz
265 [1024x768] 274 ROZTWORY 1 RÓWNOWAGI FAZOWE Ponieważ dG = Vdp — SdTyoydp-Si^dT - y^dp-S^dT (4.6)
267 [1024x768] 276 ROZTWORY 1 RÓWNOWAGI FAZOWE px jest tu szukanym ciśnieniem pary w temp. 33°C, nat
269 [1024x768] 278 ROZTWORY I RÓWNOWAGI FAZOWE wyżej temp. 374°C, tj. powyżej temperatury krytycznej
279 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE niż nad roztworem, wobec tego zachodzić będzie proces sta
287 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE %wag. fenolu *wag.
więcej podobnych podstron