300 [1024x768]

308
ROZTWORY I RÓWNOWAGI FAZOWE
podwójnych. Obszar H20aeb obejmuje nienasycone roztwory A i B w wodzie.
Punkt Krzywe ae i eb określają roztwory nasycone odpowiednio w sól A i B. eutoniczny Punkt e, który nosi nazwę eutonicznego, podaje skład roztworu nasyconego w obie sole. Pole A ae obejmuje układy, w których mamy w równowadze sól A z roztworami nasyconymi w tę sól, a pole Beb układy, w których występuje równowaga między solą B i roztworami nasyconymi w tę sól. Pole A Be to pole równowag dwóch soli A i B z roztworem nasyconym w obie sole.
Aby lepiej zrozumieć znaczenie diagramu, rozpatrzmy proces izotermicz-nego odparowywania roztworu o początkowym składzie P. Podczas odparo-
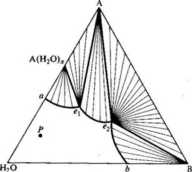
Rys. 4.20. Diagram fazowy rozpuszczalności dwóch soli w wodzie, gdy jedna z nich tworzy hydrat wywania zmiana składu odbywa się po prostej przecinającej ten punkt z wierzchołkiem odpowiadającym czystej wodzie, gdyż w procesie tym nie zmienia się stosunek zawartości obu soli. Po osiągnięciu punktu R leżącego na krzywej nasycenia w sól A wydzielają się pierwsze kryształy tej soli. Skład roztworu ulega zmianom, staje się on bogatszy w sól B; Zmiany podczas krystalizacji zachodzą wzdłuż krzywej ae. Skład całkowity układu zmienia się oczywiście wciąż wzdłuż zakreślonej prostej. Gdy skład roztworu osiągnie punkt eutoniczny, stanie się nasycony w obie sole. Skład sumaryczny jednocześnie osiąga punkt S. Od tego momentu odparowywanie prowadzi do krystalizacji równocześnie obu soli A i B. Skład ciała stałego zmienia się wzdłuż odcinka Ak. Punkt k jest końcowym punktem odparowywania. Proste na polach równowag poszczególnych faz są liniami koniugacji. Łączą one składy faz będących w równowadze, a stosunki ciężarów tych faz mogą być każdorazowo określone na podstawie reguły dźwigni.
Wyszukiwarka
Podobne podstrony:
271 [1024x768] 280 ROZTWORY I RÓWNOWAGI FAZOWE jeżeli nie takie same, to w każdym razie bardzo podob
275 [1024x768] 284 ROZTWORY I RÓWNOWAGI FAZOWE czystego rozpuszczalnika i roztworu. Punkt krzepnięci
277 [1024x768] 286 ROZTWORY I RÓWNOWAGI FAZOWE — Iń jc, =A//. f dr r !rł A Hw / 1 r r,a//* / r-r,
279 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE niż nad roztworem, wobec tego zachodzić będzie proces sta
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
283 [1024x768] 292 ROZTWORY I RÓWNOWAGI FAZOWE (4.37) gdzie //(r„c„, — ciśnienie osmotyczne rzeczywi
285 [1024x768] 294 ROZTWORY 1 RÓWNOWAGI FAZOWE gdzie: L, — ciepło sublimacji, a Lm —ciepło parowania
287 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE %wag. fenolu *wag.
292 [1024x768] 301 RÓWNOWAGI FAZOWE W UKŁADACH WIELOSKŁADNIKOWYCH z danym roztworem musi być obliczo
293 [1024x768] 302 ROZTWORY I RÓWNOWAGI FAZOWEDestylacja Przeanalizujmy dokładniej prosty diagram wr
295 [1024x768] 304 ROZTWORY I RÓWNOWAGI FAZOWE mniej lub bardziej trwałych związków pomiędzy składni
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
302 [1024x768] 310 ROZTWORY I RÓWNOWAGI FAZOWE12• Obniżenie temp. krzepnięcia dla 0,1 m roztworu kwa
261 [1024x768] część czwarta roztwory i równowagi fazowe
263 [1024x768] 272 ROZTWORY I RÓWNOWAGI FAZOWE Ścisła definicja fazy jest więc następująca: Fazą naz
265 [1024x768] 274 ROZTWORY 1 RÓWNOWAGI FAZOWE Ponieważ dG = Vdp — SdTyoydp-Si^dT - y^dp-S^dT (4.6)
267 [1024x768] 276 ROZTWORY 1 RÓWNOWAGI FAZOWE px jest tu szukanym ciśnieniem pary w temp. 33°C, nat
269 [1024x768] 278 ROZTWORY I RÓWNOWAGI FAZOWE wyżej temp. 374°C, tj. powyżej temperatury krytycznej
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
więcej podobnych podstron