Wyznaczanie ciepła właściwego soli KCl.
Celem doświadczenia jest wyznaczenie ciepła właściwego cieczy metodą porównawczą.. Cieczą wzorcową jest woda destylowana.
Aby obliczyć ciepło właściwe cieczy badanej, wyznaczamy dwukrotnie pojemność cieplną kalorymetru, napełnionego wodą lub napełnionego cieczą badaną o tej samej objętości.
Pojemność cieplną wyznaczamy elektrycznie, tzn. mierzymy przyrost temperatury cieczy w kalorymetrze spowodowany przepływem prądu o natężeniu I przez umieszczoną wewnątrz kalorymetru grzałkę o oporności Rg w czasie τ. Ciepło wydzielone podczas przepływu prądu jest równe iloczynowi pojemności cieplnej kalorymetru wraz z zawartą w nim cieczą razy przyrost temperatury kalorymetru
masa termosu |
236,18 |
g |
|
masa termosu |
235,01 |
||
masa termosu i wody |
436,13 |
g |
|
masa termosu i KCl |
441,25 |
||
Pomiar |
T (˚C) |
czas(s) |
masawody |
199,95 |
Pomiar |
T (˚C) |
czas(s) |
T1 |
25,994 |
0 |
|
|
T1 |
25,068 |
0 |
T2 |
25,994 |
30 |
|
|
T2 |
25,069 |
30 |
T3 |
25,994 |
60 |
|
|
T3 |
25,07 |
60 |
T4 |
25,994 |
90 |
|
|
T4 |
25,07 |
90 |
T5 |
25,994 |
120 |
|
|
T5 |
25,07 |
120 |
T6 |
25,994 |
150 |
|
|
T6 |
25,071 |
150 |
T7 |
25,994 |
180 |
|
|
T7 |
25,072 |
180 |
T8 |
25,995 |
210 |
|
|
T8 |
25,072 |
210 |
T9 |
25,995 |
240 |
|
|
T9 |
25,073 |
240 |
T10 |
25,996 |
270 |
|
|
T10 |
25,073 |
270 |
T11 |
25,996 |
300 |
|
|
T11 |
25,074 |
300 |
T12 |
25,996 |
330 |
|
|
T12 |
25,074 |
330 |
T13 |
25,996 |
360 |
|
|
T13 |
25,075 |
360 |
T14 |
25,997 |
390 |
|
|
T14 |
25,075 |
390 |
T15 |
25,997 |
420 |
|
|
T15 |
25,076 |
420 |
T16 |
25,997 |
450 |
|
|
T16 |
25,076 |
450 |
T17 |
25,998 |
480 |
|
|
T17 |
25,076 |
480 |
T18 |
25,998 |
510 |
|
|
T18 |
25,077 |
510 |
T19 |
25,999 |
540 |
|
|
T19 |
25,078 |
540 |
T20 |
25,999 |
570 |
|
|
T20 |
25,078 |
570 |
T21 |
26,198 |
600 |
tkalibracji= |
|
T21 |
25,14 |
600 |
T22 |
26,317 |
630 |
|
|
T22 |
25,264 |
630 |
T23 |
26,4 |
660 |
3 minuty |
3 minuty |
T23 |
25,336 |
660 |
T24 |
26,52 |
690 |
32 sek |
28,4 sek. |
T24 |
25,448 |
690 |
T25 |
26,603 |
720 |
|
|
T25 |
25,548 |
720 |
T26 |
26,677 |
750 |
|
|
T26 |
25,642 |
750 |
T27 |
26,582 |
780 |
|
|
T27 |
25,665 |
780 |
T28 |
26,562 |
810 |
|
|
T28 |
25,665 |
810 |
T29 |
26,561 |
840 |
|
|
T29 |
25,667 |
840 |
T30 |
26,561 |
870 |
|
|
T30 |
25,668 |
870 |
T31 |
26,562 |
900 |
|
|
T31 |
25,668 |
900 |
T32 |
26,563 |
930 |
|
|
T32 |
25,669 |
930 |
T33 |
26,563 |
960 |
|
|
T33 |
25,669 |
960 |
T34 |
26,564 |
990 |
|
|
T34 |
25,669 |
990 |
T35 |
26,564 |
1020 |
|
|
T35 |
25,67 |
1020 |
T36 |
26,565 |
1050 |
|
|
T36 |
25,671 |
1050 |
T37 |
26,566 |
1080 |
|
|
T37 |
25,671 |
1080 |
T38 |
26,567 |
1110 |
|
|
T38 |
25,671 |
1110 |
T39 |
26,568 |
1140 |
|
|
T39 |
25,672 |
1140 |
T40 |
26,569 |
1170 |
|
|
T40 |
25,672 |
1170 |
T41 |
26,569 |
1200 |
|
|
T41 |
25,672 |
1200 |
T42 |
26,569 |
1230 |
|
|
T42 |
25,673 |
1230 |
T43 |
26,571 |
1260 |
|
|
T43 |
25,674 |
1260 |
T44 |
26,571 |
1290 |
|
|
T44 |
25,674 |
1290 |
T45 |
26,572 |
1320 |
|
|
T45 |
25,674 |
1320 |
T46 |
26,573 |
1350 |
|
|
T46 |
25,675 |
1350 |
T47 |
26,573 |
1380 |
|
|
T47 |
25,675 |
1380 |
T48 |
26,575 |
1410 |
|
|
T48 |
25,675 |
1410 |
T49 |
26,576 |
1440 |
|
|
T49 |
25,675 |
1440 |
T50 |
26,576 |
1470 |
|
|
T50 |
25,676 |
1470 |
T51 |
26,577 |
1500 |
|
|
T51 |
25,677 |
1500 |
T52 |
26,578 |
1530 |
|
|
T52 |
25,677 |
1530 |
T53 |
26,579 |
1560 |
|
|
T53 |
25,678 |
1560 |
T54 |
26,58 |
1590 |
|
|
T54 |
25,678 |
1590 |
T55 |
26,581 |
1620 |
|
|
T55 |
25,678 |
1620 |
T56 |
26,582 |
1650 |
|
|
T56 |
25,679 |
1650 |
T57 |
26,582 |
1680 |
|
|
T57 |
25,679 |
1680 |
T58 |
26,583 |
1710 |
|
|
T58 |
25,68 |
1710 |
T59 |
26,584 |
1740 |
|
|
T59 |
25,681 |
1740 |
T60 |
26,585 |
1770 |
|
|
T60 |
25,681 |
1770 |
T61 |
26,585 |
1800 |
|
|
T61 |
25,681 |
1800 |
T62 |
26,592 |
1830 |
|
|
|
|
|
T63 |
26,593 |
1860 |
|
|
|
|
|
T64 |
26,594 |
1890 |
|
|
|
|
|
T65 |
26,595 |
1920 |
|
|
|
|
|
T66 |
26,597 |
1950 |
|
|
|
|
|
T67 |
26,597 |
1980 |
|
|
|
|
|
T68 |
26,599 |
2010 |
|
|
|
|
|
T69 |
26,6 |
2040 |
|
|
|
|
|
T70 |
26,601 |
2070 |
|
|
|
|
|
T71 |
26,602 |
2100 |
|
|
|
|
|
T72 |
26,603 |
2130 |
|
|
|
|
|
T73 |
26,604 |
2160 |
|
|
|
|
|
T74 |
26,605 |
2190 |
|
|
|
|
|
T75 |
26,606 |
2220 |
|
|
|
|
|
T76 |
26,606 |
2250 |
|
|
|
|
|
T77 |
26,608 |
2280 |
|
|
|
|
|
T78 |
26,609 |
2310 |
|
|
|
|
|
T79 |
26,61 |
2340 |
|
|
|
|
|
T80 |
26,612 |
2370 |
|
|
|
|
|
T81 |
26,613 |
2400 |
|
|
|
|
|
T82 |
26,811 |
2430 |
tkalibracji= |
|
|
|
|
T83 |
26,935 |
2460 |
|
|
|
|
|
T84 |
27,027 |
2490 |
3 minuty |
|
|
|
|
T85 |
27,107 |
2520 |
|
|
|
|
|
T86 |
27,177 |
2550 |
|
|
|
|
|
T87 |
27,275 |
2580 |
|
|
|
|
|
T88 |
27,198 |
2610 |
|
|
|
|
|
T89 |
27,185 |
2640 |
|
|
|
|
|
T90 |
27,183 |
2670 |
|
|
|
|
|
T91 |
27,184 |
2700 |
|
|
|
|
|
T92 |
27,186 |
2730 |
|
|
|
|
|
T93 |
27,187 |
2760 |
|
|
|
|
|
T94 |
27,189 |
2790 |
|
|
|
|
|
T95 |
27,189 |
2820 |
|
|
|
|
|
T96 |
27,191 |
2850 |
|
|
|
|
|
T97 |
27,192 |
2880 |
|
|
|
|
|
T98 |
27,194 |
2910 |
|
|
|
|
|
T99 |
27,195 |
2940 |
|
|
|
|
|
T100 |
27,197 |
2970 |
|
|
|
|
|
T101 |
27,198 |
3000 |
|
|
|
|
|
T102 |
27,199 |
3030 |
|
|
|
|
|
T103 |
27,201 |
3060 |
|
|
|
|
|
T104 |
27,202 |
3090 |
|
|
|
|
|
T105 |
27,203 |
3120 |
|
|
|
|
|
T106 |
27,204 |
3150 |
|
|
|
|
|
T107 |
27,206 |
3180 |
|
|
|
|
|
T108 |
27,207 |
3210 |
|
|
|
|
|
T109 |
27,209 |
3240 |
|
|
|
|
|
T110 |
27,21 |
3270 |
|
|
|
|
|
T111 |
27,211 |
3300 |
|
|
|
|
|
T112 |
27,212 |
3330 |
|
|
|
|
|
T113 |
27,214 |
3360 |
|
|
|
|
|
T114 |
27,216 |
3390 |
|
|
|
|
|
T115 |
27,217 |
3420 |
|
|
|
|
|
T116 |
27,218 |
3450 |
|
|
|
|
|
T117 |
27,219 |
3480 |
|
|
|
|
|
T118 |
27,22 |
3510 |
|
|
|
|
|
T119 |
27,222 |
3540 |
|
|
|
|
|
T120 |
27,223 |
3570 |
|
|
|
|
|
T121 |
27,224 |
3600 |
|
|
|
|
|
T122 |
27,226 |
3630 |
|
|
|
|
|
Iw=0,1804 A Ic=0,1815 A
Rg=103,08 Ω Rg=103,51 Ω
τw=196 s τc=208,4 s
mw=199,95 g mc=206,24g
cw= 4,1796 [J*g-1*K-1] (źródło: ,,Poradnik fizykochemiczny”, Warszawa 1974 r. str.168)
Obliczenia:
I) Na podstawie otrzymanych eksperymentalnie danych otrzymano dwa wykresy:
Wykres zależności T=f(t) dla wody destylowanej wykres (1)
Oraz wykres zależności T=f(t) dla badanej cieczy KCl wykres (2) (wykresy umieszczone zostały na końcu sprawozdania)
Na podstawie wykresów zostały odczytane wartości ∆T podczas kalibrowania kalorymeru wypełnionego wodą destylowana oraz NH4NO3:
∆Tw1=0,68 [K]
∆Tw2=0,652 [K]
∆Tc1= 0,605 [K]
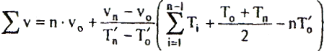
II) Obliczanie pojemności cieplnej części stałych kalorymetru
Do obliczanie pojemności części stałych kalorymetru wykorzystano wzór:
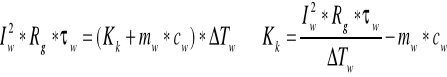
Kk1=137,972,
Kk2= 179,7866
skąd uśredniona wartość Kk=158,8793 [J/K]
III)Obliczanie ciepła właściwego KCl:
Do obliczania ciepła właściwego zostały wykorzystane dwie zależności:
a)
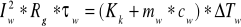
b)
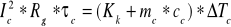
z wzorów tych po odpowiednich przekształceniach otrzymujemy wzór na ciepło właściwe badanej cieczy odpowiednio dla ∆Tc1=0,68[K] oraz dla ∆Tc2=0,652 [K] po czym z obydwu wartości wyciągamy średnią arytmetyczną :
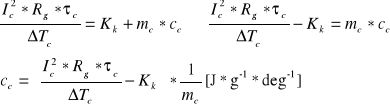
c1=5,317, [J*g-1*deg-1]
IV) Dane literaturowe dla KCl 1 mol/ 50 moli H2O
Zgodnie z danymi ,,Poradnik fizykochemiczny”, Warszawa 1974 r. str. A 168 ciepło właściwe roztworu KCl wynosi gdy:
na 50 moli H2O przypada 1 mol soli to cc= 3,7849[kJ/kg×K]
V)Błędy pomiarowe
Bezwzględny błąd pomiaru ciepła właściwego azotanu (V) amonu:
∆cc=∆cc obl - ∆cc lit= 5,317- 3,7849 = 1,532 [kJ/kg×K]
Względny błąd pomiaru ciepła właściwego badanej cieczy:
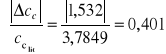
Na błąd pomiaru wpływa:
- błąd odczytu temperatury,
- błąd pomiaru i odczytu czasu przepływu prądu przez grzałkę,
- błąd wyznaczenia oporności grzałki,
- błąd odczytu masy wody i cieczy badanej.
1
Wyszukiwarka
Podobne podstrony:
02 Kalorymetria, Kalorymetria 8, Monika Wiśniewska, grupa 1
02 Kalorymetria, Kalorymetria 8, Monika Wiśniewska, grupa 1
02 Kalorymetria, Kalorymetria 1, ĆWICZENIE NR 1
lab3 kalorymetria
Kalorymetr COWiG1
KALORYFERY
Wartość kaloryczna, dietetyka materiały
tabele i miary kaloryczne, DOBRE I ZŁE KALORIE, DOBRE I ZŁE KALORIE
Sprawka Lab, Bomba Kalorymetryczna - spr, Ćwiczenie nr:
sprawozdania-biofizyka, kalorymetria2, Sprawozdanie z fizyki medycznej
sprawozdania-biofizyka, kalorymetryczne, Przyrządy:
cw 3 ŚCIEKI Oznaczanie ogólnej zawartości żelaza kalorymetryczną metodą rodankową
Kalorymetr
wysiłek fizyczny a kaloryczność, Prywatne, endokrynolog
więcej podobnych podstron