Ćwiczenie nr 2- „Kalorymetria”
Obliczenia
W naczyniu Dewara umieściłyśmy 200 cm3 NaOH (0,1M), zaś w probówce 5cm3 HCl (0,5M)
Masa pustego naczynie Dewara: 219,38g
Masa naczynia Dewara z NaOH: 416,56g
pomiar biegu kalorymetru- wykonywałyśmy przez 28min (gdzie 15min to okres początkowy reakcji, 3min okres główny i 10 min to okres końcowy)
Lp. |
Czas[s] |
U [mV] |
|||
1 |
0 |
0,5 |
30 |
870 |
3,41 |
2 |
30 |
0,6 |
31 |
900 |
4,79 |
3 |
60 |
0,7 |
32 |
930 |
6,34 |
4 |
90 |
0,82 |
33 |
960 |
7,04 |
5 |
120 |
0,91 |
34 |
990 |
7,78 |
6 |
150 |
1,02 |
35 |
1020 |
8,29 |
7 |
180 |
1,12 |
36 |
1050 |
8,62 |
8 |
210 |
1,22 |
37 |
1080 |
8,8 |
9 |
240 |
1,33 |
38 |
1110 |
8,96 |
10 |
270 |
1,44 |
39 |
1140 |
9,08 |
11 |
300 |
1,55 |
40 |
1170 |
9,19 |
12 |
330 |
1,69 |
41 |
1200 |
9,25 |
13 |
360 |
1,79 |
42 |
1230 |
9,37 |
14 |
390 |
1,89 |
43 |
1260 |
9,48 |
15 |
420 |
1,98 |
44 |
1290 |
9,59 |
16 |
450 |
2,08 |
45 |
1320 |
9,68 |
17 |
480 |
2,15 |
46 |
1350 |
9,77 |
18 |
510 |
2,26 |
47 |
1380 |
9,87 |
19 |
540 |
2,35 |
48 |
1410 |
9,94 |
20 |
570 |
2,43 |
49 |
1440 |
10,02 |
21 |
600 |
2,52 |
50 |
1470 |
10,11 |
22 |
630 |
2,62 |
51 |
1500 |
10,2 |
23 |
660 |
2,72 |
52 |
1530 |
10,3 |
24 |
690 |
2,82 |
53 |
1560 |
10,37 |
25 |
720 |
2,92 |
54 |
1590 |
10,47 |
26 |
750 |
3,03 |
55 |
1620 |
10,56 |
27 |
780 |
3,12 |
56 |
1650 |
10,63 |
28 |
810 |
3,22 |
57 |
1680 |
10,72 |
29 |
840 |
3,31 |
Na podstawie danych zawartych w tabeli, można sporządzić wykres U(t) dla przebiegu reakcji chemicznej.
Po sporządzeniu wykresu możemy odczytać wartość ![]()
Ur, która pozwoli nam na obliczenie ciepła wydzielonego podczas reakcji.
Obliczenie ilości ciepła wydzielonego podczas reakcji
Ilość ciepła wydzielonego podczas reakcji obliczamy ze wzoru:
q = -k![]()
Ur
gdzie: q- ilość ciepła wydzielonego podczas reakcji
k- pojemność cieplna kalorymetru
![]()
Ur- różnica między napięciem po skończonej reakcji, a napięciem przed reakcją
![]()
Ur możemy odczytać z wykresu, tak więc:
![]()
Ur= 8,29[mV]- 3,14[mV]= 5,15[mV]= 5,15*10-3[V]= 0,00515[V]
Wartość pojemności cieplnej została nam podana(w związku z tym, że podczas naszych pomiarów grzałka była popsuta), tak więc k= 26835![]()
Tak więc ciepło wydzielone podczas reakcji wynosi:
q= - 26835 ![]()
* 0,00515 V = - 138,2 J
q= - 138,2 J
obliczenie molowego ciepła reakcji
Aby obliczyć molowe ciepło reakcji korzystamy ze wzoru:
Q= ![]()
gdzie:
Q- molowe ciepło reakcji
q- ilośc ciepła wydzielonego podczas reakcji
n- ilość moli HCl
Ilość moli HCl możemy obliczyć ze wzoru:
CM= ![]()
gdzie: CM- stężenie molowe
n- liczba moli
V- objętość
Tak więc mając daną objętość równą 5cm3(0,005 dm3) oraz stężenie molowe równe: 0,5 ![]()
, możemy obliczyć liczbę moli:
n = CM*V= 0,5![]()
* 0,005 dm3= 0,0025 mola.
Tak więc:
Q= ![]()
= ![]()
= - 55280 ![]()
= -55,28 ![]()
Obliczenie ciepła neutralizacji
Ciepło neutralizacji obliczamy ze wzoru:
Qn= Q- Q1
gdzie:
Qn- ciepło neutralizacji
Q- ciepło molowe reakcji
Q1- ciepło rozcieńczania wyjściowego roztworu kwasu wodą zawartą w wyjściowym roztworze zasady.
Wartość ciepła Q1 można odczytać z wykresu entalpii rozpuszczania kwasu solnego, który sporządzamy na podstawie danych literaturowych, z poradnika fizykochemicznego tj.:
|
Cn [ |
-72,59 |
1,85 |
-73,02 |
1,39 |
-73,28 |
1,11 |
-73,65 |
0,74 |
-73,85 |
0,5 |
-74,52 |
0,11 |
-74,61 |
0,079 |
-75,14 |
1/ |
Z wykresu możemy odczytać wartość Q1, jeżeli znamy stężenie początkowe i końcowe kwasu solnego. Stężenie początkowe wynosiło 0.5 ![]()
, zaś końcowe 0,012 ![]()
, co można obliczyć z zależności:
Ckoń= 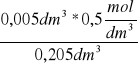
= 0,012 ![]()
, tak więc Q1 wynosi:
Q1= -75,14 ![]()
-(-73,85 ![]()
) = -1,29 ![]()
mając Q1 możemy obliczyć ciepło neutralizacji:
Qn= Q- Q1= - 55,28![]()
- (- 1,29 ![]()
)= -53,99 ![]()
Qn= -53,99 ![]()
Błąd pomiaru
Aby wyliczyć błąd pomiaru korzystamy ze wzoru:
Błąd względny =![]()
* 100%
Entalpia rozpuszczania HCl w wodzie według literatury równa jest -75,14 ![]()
, tak więc:
Błąd względny=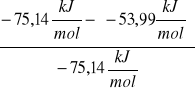
* 100%= 28,15%
Jak widać błąd pomiaru jest stosunkowo duży, co może wynikać z faktu niedokładnego odczytu napięcia podczas pomiaru, ponieważ szczególnie w czasie okresu głównego reakcji zmiany są napięcia są bardzo duże.
Wyszukiwarka
Podobne podstrony:
02 Kalorymetria, Kalorymetria 4, Marchewicz Tomasz
02 Kalorymetria, Kalorymetria 1, ĆWICZENIE NR 1
lab3 kalorymetria
Kalorymetr COWiG1
grupa 2 (22 02 2014)
KALORYFERY
Wartość kaloryczna, dietetyka materiały
02 Grupa B XVII popr
tabele i miary kaloryczne, DOBRE I ZŁE KALORIE, DOBRE I ZŁE KALORIE
Sprawka Lab, Bomba Kalorymetryczna - spr, Ćwiczenie nr:
sprawozdania-biofizyka, kalorymetria2, Sprawozdanie z fizyki medycznej
sprawozdania-biofizyka, kalorymetryczne, Przyrządy:
cw 3 ŚCIEKI Oznaczanie ogólnej zawartości żelaza kalorymetryczną metodą rodankową
więcej podobnych podstron