UKŁADY INTEGRUJĄCE
układ hormonalny i układ nerwowy autonomiczny (wegetatywny)
działają poza naszą świadomością
zapewniają ścisłą kontrolę homeostazy (stałości środowiska wewnętrznego)
RÓŻNICE:
|
UKŁAD AUTONOMICZNY |
UKŁAD HORMONALNY |
stała czasowa odpowiedzi |
krótsza |
dłuższa |
czas trwania wywołanego efektu |
krótszy |
dłuższy |
rodzaj efektu |
zlokalizowany |
rozproszony (działanie na cały organizm, np. insulina) |
nośnik informacji |
impuls bioelektryczny w obrębie komórki nerwowej |
substancja chemiczna |
PODOBIEŃSTWA:
oba układy odbierają bodźce
występują receptory - miejsca pobudzenia (następuje ono podczas odebrania bodźca przez receptor)
przeniesienie informacji (impulsu / substancji chemicznej) daje określony efekt
SYNAPSA układu nerwowego wykazuje podobieństwo do układu hormonalnego informacje nie jest przenoszona drogą elektryczną - korzystamy z neurotransmiterów (substancji chemicznych, także tych o charakterze hormonalnym)
UKŁAD HORMONALNY
HORMON - chemiczny nośnik informacji, krążący między komórkami organizmu wielokomórkowego.
wydzielany przez komórki gruczołowe do otaczającego środowiska;
transportowany do komórek docelowych (wrażliwych), z którymi reaguje za pośrednictwem swoistych receptorów (wyspecjalizowanych struktur białkowych na błonie komórkowej);
działa na komórki docelowe wywołując reakcje fizjologiczne, morfologiczne i biochemiczne;
nie podlega zużyciu ani jako źródło energii, ani jako produkt metabolizmu.
Podział hormonów ze względu na budowę:
pochodne tyrozyny (katecholaminy, hormony tarczycy) - przechodzą przez błonę komórkową łączą się z receptorami cytozolowymi i jądrowymi
pochodne peptydowe (peptydy, np. gonadoliberyny oraz białka, np. insulina, glukagon) - nie przechodzą przez błonę komórkową łączą się z receptorami błonowymi
pochodne steroidowe (pochodne cholesterolu, np. estrogeny) - przechodzą przez błonę komórkową łączą się z receptorami cytozolowymi i jądrowymi
3. Kaskada zmian zachodzących w komórce pod wpływem hormonu:
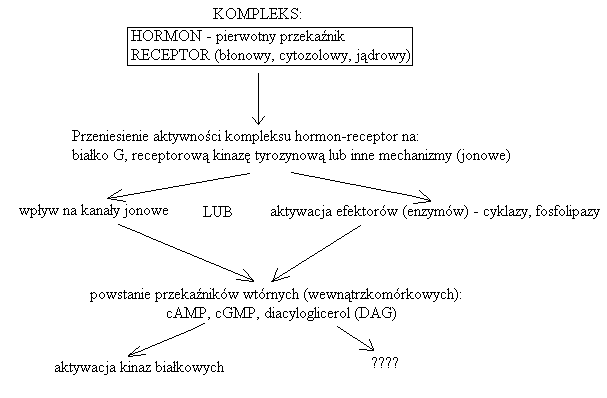
Jeden hormon może aktywować kilka receptorów
Kompleks hormon-receptor aktywuje różne kompleksy białkowe, które działają na różne efektory.
Odpowiedź komórki docelowej nie podlega prawu „wszystko albo nic” i jest odpowiedzią stopniowaną
W skrócie: hormon receptor białko pośredniczące receptor
Typy wydzielania dokrewnego:
endokrynne
hormony wydzielany przez gruczoły
wydzielane do krwioobiegu (dokrewne, ogólnoustrojowe)
neurokrynne
uwalnianie hormonu z elementu presynaptycznego (neurotransmitery)
wydzielanie miejscowe
neuroendokrynne
rolę gruczoły przejmuje komórka nerwowa (przysadka)
wydzielanie dokrewne (np. wazopresyna)
autokrynne
hormon działa na komórkę, która go wydzieliła
wydzielanie miejscowe (do płynu zewnątrzkomórkowego bez udziału krwioobiegu)
parakrynne
jedna komórka wydziela hormon działający na sąsiednie komórki
wydzielanie miejscowe (do płynu zewnątrzkomórkowego)
Regulacja wydzielania hormonów:
nerwowa - wpływ układu wegetatywnego na czynność endokrynną:
wydzielanie hormonów z gruczołów endokrynnych
wytwarzanie i uwalnianie hormonów z zakończeń neuronów (np. wazopresyny lub oksytocyny)
metaboliczna - bezpośredni wpływ substratów lub produktów metabolizmu, np. stężenie glukozy reguluje wydzielanie insuliny, a jony Ca2+ regulują wydzielanie parahormonu
hormonalna - układ samoregulujący oparty na działaniu sprzężeń zwrotnych:
DODATNICH - sygnał powoduje odpowiedź, która zwiększa wielkość sygnału (np. wydzielanie oksytocyny)
UJEMNYCH - sygnał powoduje odpowiedź, która zmniejsza wielkość sygnału (hamuje go), np. układ liberyny - hormony tropowe przysadki
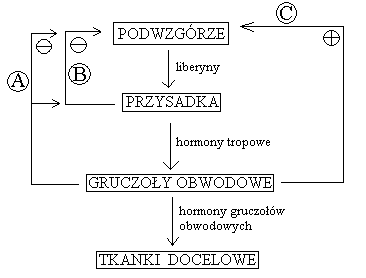
A - pętla długa sprzężenia zwrotnego ujemnego (gruczoły obwodowe - przysadka oraz gruczoły obwodowe - podwzgórze)
B - pętla krótka sprzężenia zwrotnego ujemnego (przysadka - podwzgórze)
C - sprzężenie zwrotne dodatnie
Pętla ultrakrótka - hormon wpływa na ten sam gruczoł, który go wydziela (zazwyczaj hamuje wydzielanie)
inhibicja - wytwarzane są specjalne czynniki (inhibiny, statyny), które hamują wydzielanie niektórych hormonów (prolaktyny, hormonu wzrostu); zahamowanie uwalniania statyn prowadzi do wzrostu uwalniania hormonów
PODWZGÓRZE
Rola podwzgórza: ogólnie ma ono utrzymać organizm przy życiu i zapewnić przetrwanie gatunku. Dokładniej rzecz ujmując kontroluje:
czynność układu krążenia
motorykę przewodu pokarmowego
równowagę wodno-elektrolityczną
rytmy biologiczne
emocje
temperaturę ciała
czynność hormonalną
zachowania seksualne
głód i pragnienie
Hormony podwzgórza:
hormony tylnego płata przysadki (są tam magazynowane, ale wytwarzane w podwzgórzu):
oksytocyna
wazopresyna argininowa (ADH, hormon antydiuretyczny)
hormony hipofizotropowe - regulują funkcję przysadki, występują w małych ilościach i działają dzięki krążeniu zwrotnemu między podwzgórzem a przysadką
LIBERYNY stymulują uwalnianie hormonów przysadki |
STATYNY hamują uwalnianie hormonów przysadki |
tyreoliberyna (TRH):
|
|
gonadoliberyna (Gn-RH) - uwalnia gonadotropiny |
|
kortykoliberyna (CRH) |
|
somatoliberyna (GHRH) |
somatostatyna (SMS):
|
melanoliberyna (MRH) |
melanostatyna (MIH) |
|
prolaktostatyna (PRIH) - jej funkcję spełnia dopamina |
Statyn jest mniej niż liberyn, ponieważ ich rolę pełni czasem sprzężenie zwrotne ujemne.
PRZYSADKA MÓZGOWA
Podział hormonów przysadki ze względu na budowę:
grupa kortykotropin - pochodzą od wspólnego preprohormonu: pre-proopiomelanokortyny
ACTH (kortykotropina)
hormony lipotropowe
endorfiny
hormony glikoproteinowe - składają się z podjednostki α (identycznej dla wszystkich hormonów) oraz podjednostki β (odróżniającej poszczególne hormony)
LH (lutropina)
FSH (folitropina)
TSH (tyreotropina)
somatomammotropiny - pochodzą od wspólnego preprohormonu:
GH (hormon wzrostu)
PRL (prolaktyna)
GONADOTROPINY (LH i FSH)
regulacja wydzielania:
stymulacja: gonadoliberyna z podwzgórza stymuluje przysadkę do wydzielania obu gonadotropin
hamowanie: testosteron (zawsze), estrogeny (zazwyczaj) oraz inhibina (u mężczyzn i u kobiet) hamują wydzielanie gonadotropin i gonadoliberyn
sprzężenie zwrotne dodatnie: estrogeny w okresie okołoowulacyjnym zamiast hamować wydzielanie LH i FSH stymulują je: estradiol nasila odpowiedź przysadki na pobudzenie jej przez Gn-RH (gonadoliberynę)
działanie biologiczne: każda płeć posiada obie gonadotropiny, ale u każdej z płci spełniają one inne funkcje:
MĘŻCZYZNA |
KOBIETA |
|
Konieczne jest współdziałanie obu hormonów:
|
wzory wydzielania gonadotropin:
podstawowe (toniczne) - dominuje u mężczyzn (wpływ podwzgórza i sterydów płciowych omówiony wyżej)
pulsacyjne (epizodyczne) - charakterystyczne dla organizmów dojrzałych, nie występuje po menopauzie (regulowane czynnikami wewnątrzkomórkowymi)
cykliczne - charakterystyczne dla kobiet (efekt sprzężenia zwrotnego dodatniego omówionego wyżej, ośrodek regulujący ten cykl to generator pulsów)
PROLAKTYNA:
Główny mechanizm regulujący wydzielanie prolaktyny:
przykład odruchu nerwowego hamującego (nie sprzężenie zwrotne!)
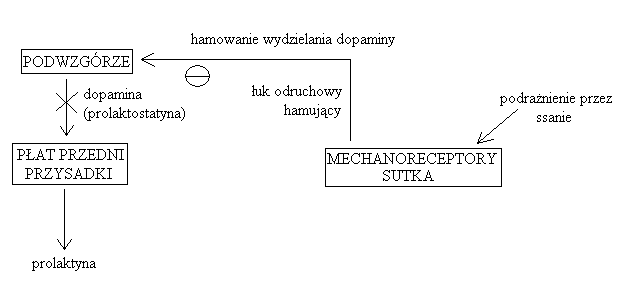
polega na zahamowaniu wydzielania dopaminy przez podwzgórze, dzięki czemu może dojść do wydzielania prolaktyny (dopamina jest statyną dla prolaktyny)
Inne mechanizmy regulujące wydzielanie prolaktyny:
rytm dobowy (więcej prolaktyny wydziela się w nocy)
nieswoiście TRH (tyreoliberyna)
regulacja neurohormonalna (prolaktostatyna, TSH - tyreotropina)
hamująco:
GABA (kwas γ-aminomasłowy),
GAP (peptyd związany z gonadliberyną),
prolaktyna
stymulacja:
bodźce psychiczne i fizyczne powodujące wydzielanie β-endorfin (stres, wysiłek fizyczny, stosunek płciowy),
VIP,
serotonina,
neurotensyna,
angiotensyna II
Działanie prolaktyny:
główne funkcje:
pobudzenie rozwoju gruczołu piersiowego
utrzymanie laktacji
ponadto prolaktyna działa na:
leukocyty - regulacja wydzielania (?)
nerkę, owodnię, splot naczyniówkowy osmoregulacja
jajnik utrzymanie / regresja ciałka żółtego
jądro wytwarzanie sterydów jądrowych
wątroba zmiany w syntezie RNA i DNA
trzustka wiemy że działa, nie wiemy jak działa :D
c) hiperprolaktynemia jest głównym czynnikiem niepłodności u kobiet i mężczyzn
OKSYTOCYNA - syntetyzowana w podwzgórzu, obrębie jąder: nadwzrokowego i trzykomorowego; magazynowana w tylnym płacie przysadki
Regulacja wydzielania:
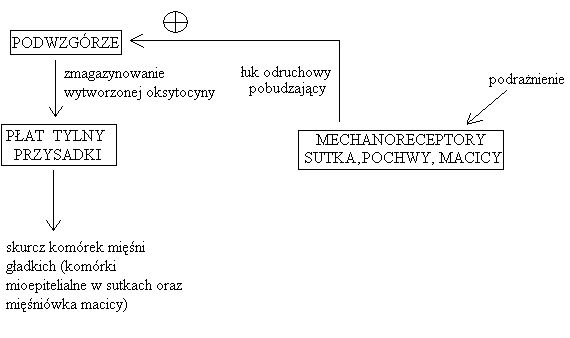
mechanizm łuku odruchowego pobudzającego
Inne mechanizmy regulacji wydzielania:
pobudzenie:
agoniści α-adrenergiczni
estrogeny
hamowanie:
agoniści β-adrenergiczni
opioidy
progesteron
Działanie:
główne funkcje:
stymulacja skurczów podczas porodu (oksytocyna jest rozkładana przez oksytocynazę, z którą normalnie jest w równowadze; podczas ciąży poziom oksytocynazy jest podniesiony nie ma oksytocyny brak skurczy; podczas porodu oksytocynazy jest mniej rośnie stężenie oksytocyny skurcze i poród)
ułatwienie wypływania mleka
ułatwienie transportu nasienia z tylnego odcinka pochwy do ujść brzusznych jajowodów (po stosunku wydziela się oksytocyna, która stymuluje skurcze mięśni pochwy)
wpływ na:
wydalanie sodu
neuromodulację (zaciera ślady pamięci)
długość cyklu miesiączkowego
wydzielanie estrogenów i progesteronu
SOMATOTROPINA (GH, ludzki hormon wzrostu)
swoistość gatunkowa;
wytwarzany przez komórki somatotropowe
krąży we krwi w kompleksach z białkiem (prawdopodobnie jest to odszczepiony proteolitycznie pozakomórkowy fragment receptora)
Białka wiążące hormon wzrostu:
o wysokim powinowactwie (fragment receptora hormonu wzrostu)
chętnie łączą się z GH, ale nie z innymi związkami
stężenie tych białek jest wskaźnikiem liczby receptorów GH w organizmie
niewielka pojemność (białko jako związek hormonalnie czynny może związać niewielką ilość cząsteczek związku chemicznego - tu: GH)
o niskim powinowactwie
niechętnie łączą się z wieloma związkami chemicznymi (najlepiej się łączą gdy jest ich dużo)
np. układ albumin
ogromna pojemność
reagują na krytyczne sytuacje zagrażające życiu, np. przełom tarczycowy (podajemy albuminy, które wiążą hormony tarczycy)
Regulacja wydzielania GH:
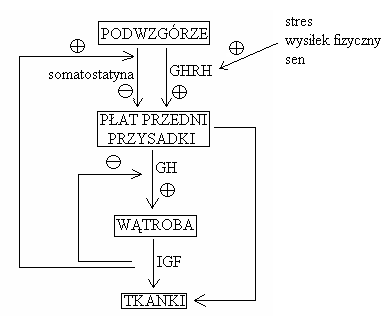
IGF = insulinopodobne czynniki wzrostu (somatomedyny)
IGH I (insulinopodobny czynnik wzrostu I, somatostatyna C)
tożsamy z GH
jego wydzielanie jest pobudzane przez GH
wyraźnie pobudza wzrost
IGH II (insulinopodobny czynnik wzrostu II)
obecny w mózgowiu
wpływ na rozwój płodu
dokładna rola nieznana
Pozostałe czynniki regulujące uwalnianie GH:
|
stymulujące |
hamujące |
metaboliczne |
glukoza aminokwasy |
wolne kwasy tłuszczowe (WKT) |
hormonalne |
estrogeny hormony tarczycy |
glukokortykosteroidy |
Rola hormonu wzrostu (ogólnie: hormon anaboliczny stymulujący procesy wzrostu)
regulacja gospodarki węglowodanowej:
hamowanie transportu glukozy
zmniejszenie metabolizmu glukozy (zmniejszenie liczby receptorów insulinowych, np. w wątrobie)
wzrost poziomu glukozy we krwi (dzięki nasileniu glukoneogenezy i zmniejszonej utylizacji monocukrów w komórkach)
regulacja gospodarki lipidowej - nasilenie lipolizy
regulacja gospodarki białkowej:
wzrost przezbłonowego transportu aminokwasów
nasilenie syntezy białek
nasilenie produkcji fibroblastów
zwiększanie produkcji IGF (przez to pośrednio stymuluje wzrost organizmu i wpływ endokrynny)
regulacja prawidłowego składu ciała (masa mięśni, procentowa zawartość tłuszczu, gęstość mineralna kości)
regulacja czynności mięśnia sercowego (przez IGF-1):
przerost miocytów
poprawa czynności i kurczliwości serca
poprawa stanu psychicznego (poprawa wydolności CUN)
Działanie GH na układ kostny (GH działa wspólnie z IGF-1):
u dzieci:
przekształcenie komórek prekursorowych płytki wzrostowej nasady w chondrocyty
pobudzenie rozmnażania się zróżnicowanych chondrocytów wzrost długości kości
u dorosłych:
stymulacja tworzenia i resorpcji kości
wpływ na obrót kostny:
zwiększenie dostępności wapnia i fosforu
zwiększenie absorpcji składników mineralnych (wzrost wytwarzania 1,25-OH D3 oraz wzrost wrażliwości nabłonka jelitowego na jej działanie)
bezpośrednie pobudzenie osteoblastów (GH i IGF-1)
proliferacja (tylko GH)
Czynniki wpływające na wzrost:
czynniki dziedziczne;
wiek fizjologiczny (zwłaszcza przy pokwitaniu)
podaż żywności
ćwiczenia fizyczne
Czynniki powodujące nieprawidłowy wzrost:
niekorzystne czynniki przed urodzeniem;
nieprawidłowe geny i odziedziczone patologie;
niewłaściwe odżywianie (jakościowe i ilościowe);
zaburzenia wchłaniania i trawienia;
przewlekłe schorzenia;
niekorzystne czynniki psychospołeczne;
niewłaściwe poziomy hormonów (tarczycy, wzrostu, glukokortykosteroidów, hormonów płciowych)
Nadmiar GH:
w okresie wzrastania gigantyzm (wysoki wzrost przy zachowanych odpowiednich proporcjach ciała)
po okresie wzrastania akromegalia (przerost tkanek miękkich - dłonie jak pochen chleba, twarz, małżowiny, język wypycha usta)
ADRENOKORTYKOTROPINA (ACTH):
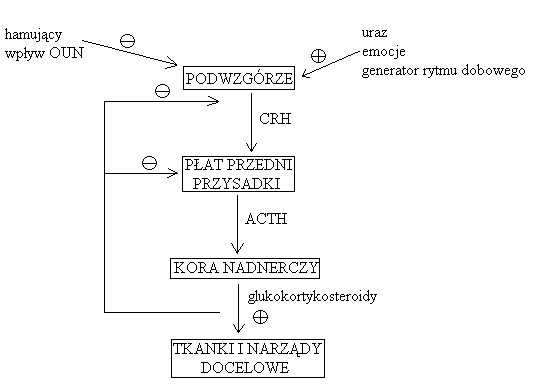
Regulacja wydzielania:
kortykoliberyna jest związana sprzężeniem zwrotnym ujemnym z kortyzolem
szczyt wydzielania ACTH = rano
Inne czynniki pobudzające wydzielanie:
ból
urazy
strach
intensywny wysiłek
zimno
hipoglikemia
Działanie:
wzrost przepływu krwi w nadnerczach
wzrost komórek kory nadnerczy
nasilenie syntezy białek
nasilenie przemiany cholesterolu
działanie ochronne na krążący we krwi kortyzol
Nadmiar ilości ACTH = zespół Cushinga
księżycowata twarz (otyła, z czerwonawymi przebarwieniami);
byczy kark
charakterystyczna skóra i sylwetka
rozstępy
skłonności do otyłości brzusznej
wychudzone nogi
WAZOPRESYNA (ADH, hormon antydiuretyczny)
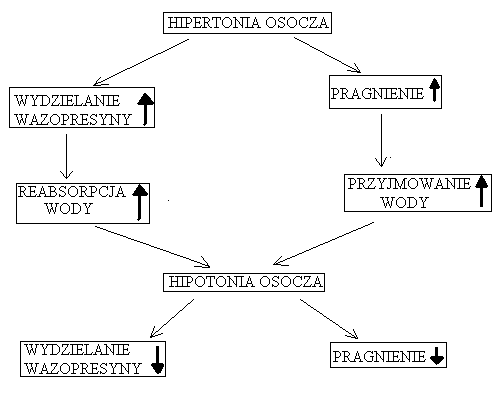
Regulacja wydzielania:
Stymulacja wydzielania ADH: |
Hamowanie wydzielania ADH: |
- zmniejszenie objętości krwi - wzrost molarności płynów ustrojowych - zmniejszenie ciśnienia krwi - angiotensyna II, kortyzol, steroidy płciowe - ból, stres, wymioty - temperatura otoczenia |
- spadek osmolarności płynów ustrojowych - wzrost objętości krwi - wzrost ciśnienia krwi - przedsionkowy peptyd natriuretyczny (ANP) - alkohol |
Działanie wazopresyny:
w połączeniu z receptorami V2 obecnymi w cewkach krętych dalszych i cewkach zbiorczych zwiększenie wchłaniania zwrotnego wody obniżenie osmolalności surowicy
w połączeniu z receptorami V1 obecnymi w mięśniach gładkich kurczenie się naczyń krwionośnych
w obrębie OUN - rola neuromodulatora (procesy zapamiętywania i zachowań seksualnych)
CZĘŚĆ POŚREDNIA PRZYSADKI - miejsce syntezy pochodnych proopiomelanokortyny
hormony α, β i γ-melanotropowe (α_MSH, β-MSH i γ-MSH)
CLIP (peptyd kortykotropowo podobny części pośredniej przysadki)
γ-LPH (γ-lipotropowelipotropina)
β-endorfiny
met-enkefalina
Hormony melanotropowe:
nasilenie syntezy melaniny
ciemnienie skóry
Endorfiny i enkefaliny (opioidy endogenne):
uśmierzenie bólu;
utrzymanie psychicznej homeostazy organizmu;
nasilenie odpowiedzi komórek immunokometentnych;
pobudzanie wydzielania prolaktyny i hormonu wzrostu;
hamowanie wydzielania gonadotropin, tyreotropin, wazopresyny i oksytocyny
SZYSZYNKA
Szyszynka jest częścią nadwzgórza i narządem fotoneuroendokrynnym - brak światła pobudza szyszynkę do wydzielania hormonów - bodźce przewodzone są na drodze nerwowej, a w odpowiedzi na nie wydzielany jest odpowiedni hormon.
Hormony szyszynkowe dzielimy na:
indole szyszynkowe (np. melanina)
peptydy szyszynkowe (np. 8-arginino-wazotocyna)
Rola melatoniny w organizmie człowieka:
wpływ na zegar biologiczny:
regulacja rytmu snu i czuwania;
wzrost wydzielania w ciemności, obniżenie wydzielania za dnia;
działanie nasenne;
hamuje wydzielanie hormonów płciowych;
wydłużenie okresu życia;
poprawa jakości życia;
zmniejszenie objawów dezorientacji czasowej;
poprawa samopoczucia i odzyskanie sprawności po długiej podróży;
przyspieszenie adaptacji do nowej strefy czasowej
wpływ na układ odpornościowy:
wzrost stężenie IgA
wzrost wytwarzania limfocytów-killerów;
aktywacja limfocytów pomocniczych T (wspomagająco przy AIDS)
wpływ na wydzielanie hormonów:
wysoki poziom ograniczenie wydzielania innych hormonów;
niski poziom pobudzenie wydzielania innych hormonów
wpływ na procesy dojrzewania płciowego (może być także czynnikiem powodującym niepłodność, może być stosowana w antykoncepcji)
Melatonina jako antyoksydant:
tworzenie obojętnych związków z wolnymi rodnikami;
ochrona przed szkodliwym działaniem promieniowania X;
postulowane działanie przeciwnowotworowe
Działania uboczne długotrwałego stosowania melatoniny:
uszkodzenia szpiku
uszkodzenia siatkówki
pojawienie się zmian nowotworowych
TARCZYCA
Hormonem tropowym przysadki wpływającym na czynność tarczycy jest tyreotropina (TSH):
Regulacja wydzielania TSH:
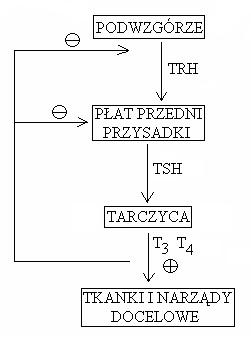
mechanizm hamowania uwalniania TRH może być związany z redukcją receptorów dla TRH w obrębie przysadki
somatostatyna hamuje uwalnianie TSH
Działanie TSH zwiększenie syntezy i wydzielania hormonów tarczycy
powiększenie komórek gruczołu tarczowego
nasilenie ukrwienia tarczycy
zwiększenie wchłaniania jodu
nasilenie syntezy białek - m.in. tyreoglobuliny
nasilenie jodowania tyreoglobuliny
Metabolizm jodu:
jod jest przyswajany:
przez układ pokarmowy (najwięcej)
przez układ oddechowy
przez skórę (niewielkie ilości)
we krwi występuje w postaci jodków
pula pozatarczycowa jodu (tam jod może się dostać z krwioobiegu, jeżeli nie dostanie się wcześniej do tarczycy):
ślinianki,
ciałko rzęskowe oka,
śluzówka żołądka,
łożysko u kobiet w ciąży
gruczoł sutkowy.
skóra
Metabolizm tarczycowy jodu:
pompa jodkowa - pozwala wychwytywać jod z krwioobiegu wbrew gradientowi stężeń i elektrycznemu (dzięki temu w tarczycy jest 50-100 razy więcej jodu niż w surowicy)
przemiany jodu w tarczycy:
utlenienie jodków
jodowanie - pod wpływem peroksydazy z tyreoglobuliny powstaje MIT (3-monojonotyrozyna) oraz DIT (3,5-dijodotyrozyna)
sprzęganie (MIT + DIT T3 - trójjodotyrozyna; DIT + DIT T4 - tyroksyna)
Uwalnianie hormonów tarczycy:
na zasadzie pinocytozy
mała pompa jodkowa - umożliwia odzyskiwanie cząsteczek jodu, które odłączają się od kompleksu (cząsteczka tyreoglobuliny, do której przyłączone są MIT, DIT, T3 i T4) dzięki proteolizie jako MIT i DIT; cząsteczki te ulegają następnie odjodowaniu do I- pod wpływem dejodynazy
reszty tyrozylowe - ulegają odjodowaniu
reszty tyroninowe - po odjodowaniu są uwalniane do krążenia i łączą się z nośnikami białkowymi
Nośniki dla hormonów tarczycy:
TBG - nośnik specyficzny z frakcji globulinowej (główny nośnik we krwi)
TBPA - nośnik specyficzny z frakcji prealbuminowej (główny nośnik w płynie mózgowo-rdzeniowym)
albuminy - nośnik niespecyficzny
Hormony związane z białkami są nieaktywne - biologiczne działanie wykazuje tylko frakcja wolnych hormonów tarczycy, wśród których przeważa trójjodotyronina (T3)
Przełom tarczycowy - sytuacja zagrożenia życia:
następuje przy nadczynności tarczycy (na tarczycy występują tzw. „gorące guzki”, które produkują dużo hormonów)
podaje się albuminy, aby związać te hormony i dać pacjentowi czas na operację
Degradacja hormonów tarczycy:
dejodacja
estryfikacja
degradacja reszt alaninowych
rozrywanie wiązań estrowych
usunięcie metabolitów i jodu z moczem, kałem i wydychanym powietrzem
Działanie metaboliczne hormonów tarczycy (główny katalizator reakcji utleniania - regulator metabolizmu ustroju)
węglowodany:
wzrost wchłaniania glukozy i galaktozy
glikogenoliza
stymulacja utylizacji glukozy
lipidy:
wzrost hydrolizy triacylogliceroli (powstające WKT są zużywane do produkcji energii w komórkach)
obniżenie ilości tłuszczów we krwi i w wątrobie (stymulacja wychwytu cholesterolu)
białka:
wzrost syntezy białek (u osób młodych i w małych dawkach)
rozpad białek (u osób starszych i w dużych dawkach)
gospodarka wodno-elektrolityczna:
stymulacja eliminacji wody z ustroju
Działanie pozametaboliczne hormonów tarczycy:
efekty wewnątrzkomórkowe:
aktywność pompy sodowo-potasowej;
zwiększenie liczby i wielkości mitochondriów;
zwiększenie aktywności enzymów łańcucha oddechowego;
zwiększenie aktywności innych enzymów;
zwiększenie zużycia CO2 i metabolizmu
wzrost syntezy RNA
wzrost aktywności enzymów oksydacyjnych
efekt ogólnoustrojowy:
wzrost przepływu krwi przez wszystkie obszary naczyniowe, szczególnie przez skórę;
wzrost objętości wyrzutowej serca;
wzrost częstości pracy serca oraz jego kurczliwości
przyspieszenie częstości oddechów
wpływ na układ nerwowy:
mielinizacja (trwa do 3. roku życia)
intensywna proliferacja dendrytów, aksonów i komórek glejowych
skrócenie stałej czasowej odpowiedzi odruchowej (czyli czasu od zadziałania bodźca do odpowiedzi)
podział neuroblastów szczególnie w móżdżku
wpływ na serce:
wzrost liczby powinowactwa receptorów β-adrenergicznych wzrost efektów ino- i chronotropowych dodatnich
wpływ na rodzaj miozyny (wzrost ilości izoformy α ciężkiego łańcucha miozyny)
wpływ na układ kostny (ogólnie resorpcja przeważa nad tworzeniem - taki „recycling”)
wzrost zużycia witamin grupy B oraz witamin C i D
przemiana karotenu w witaminę A
nasilenie resorpcji i tworzenia się kości
wzrost poziomu wapnia w osoczu i w moczu
wzrost poziomu fosforanów w osoczu
Niedobór hormonów tarczycy:
uszkodzenie mózgu, móżdżku, zawiązków zębowych;
opóźnienie dojrzewania kośćca;
zmniejszenie ruchliwości;
ochrypły głos;
brak łaknienia, zaparcia;
senność;
powiększenie języka;
dłuższa żółtaczka;
przepuklina pępkowa
obniżenie siły mięśniowej;
nagromadzenie mas mucyny w tkance podskórnej;
wiotkość niektórych mięśni poprzecznie prążkowanych, mięśnia sercowego, mięśni przewodu pokarmowego
obniżenie objętości wyrzutowej serca
obniżenie ciśnienia tętniczego krwi
zmiany w układzie kostnym
Nadczynność tarczycy:
zbyt krótki czas odpowiedzi odruchowej
tachykardia
choroba Gravesa-Basedowa
wytrzeszcz gałek ocznych
przyspieszona wentylacja
podwyższona podstawowa ciepłota ciała
biegunki
nadmierna wilgotność dłoni
kłębkowata synteza i wydzielanie mineralokortykosteroidów
pasmowata synteza i wydzielanie glukokortykosteroidów
siatkowata synteza i wydzielanie androgenów
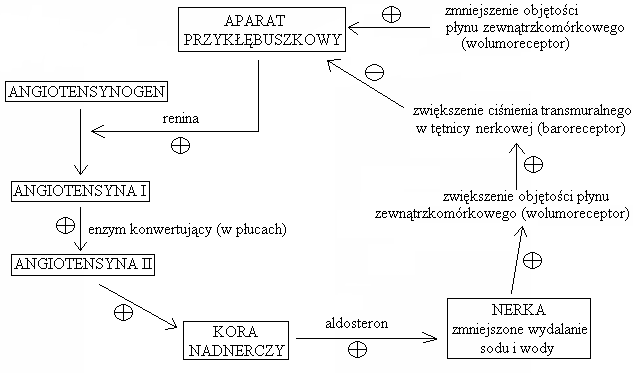
Regulacja sekrecji aldosteronu = w największym stopniu układ RAA (renina-angiotensyna-aldosteron):poziom potasu w osoczu
somatostatyna
przedsionkowy peptyd natriuretyczny
ACTH (tylko duże stężenia, w warunkach fizjologicznych w zasadzie bez znaczenia)
ładunek sodowy (chemoreceptor)
stymulacja adrenergiczna (stymulacja zakończeń adrenergicznych należących do układu współczulnego)
Regulacja wydzielania reniny (enzym syntetyzowany w obrębie plamki gęstej aparatu przykłębuszkowego, w pobliżu nefronu):
stymulacja wydzielania:
obniżenie ciśnienia tętniczego krwi w tętniczce doprowadzającej
niedobór sodu
hamowanie wydzielania:
nadmiar sodu
zwiększenie ciśnienia tętniczego w tętnicze doprowadzającej
angiotensyna II
Działanie aldosteronu:
retencja H2O i Na+
stymulowanie syntezy AIP (białko indukowane przez aldosteron)
reabsorpcja sodu z potu, śliny, soku żołądkowego i moczu
wzrost wydzielania K+ i H+
wzrost objętości krwi
wzrost ciśnienia tętniczego krwi
wzrost objętości krwi krążącej
uczulające działanie aldosteronu na naczynia krwionośne (uwrażliwienie ich na endogenne aminy wazopresyjne)
wzrost zawartości sodu i wody w komórkach tętniczek śródbłonkowych powoduje zmniejszenie się ich światła a przez to wzrost oporu obwodowego.
węglowodany (działanie kataboliczne, antyinsulinowe)
neoglikogeneza;
glikogeneza wątrobowa;
glikogenoliza pozawątrobowa;
upośledzenie utylizacji glukozy;
tłuszcze (lipoliza)
upośledzenie reestryfikacji
aktywacja lipazy triacyloglicerolowej
białka (katabolizm):
mobilizacja aminokwasów,
neoglikogeneza,
hamowanie syntezy białek,
wzrost syntezy białek wątrobowych
efekt przyzwalający (podtrzymujący) - m.in. nasilają wpływ katecholamin na procesy liolizy i ciśnienie krwi
działanie przeciwzapalne - jest krótkotrwałe (po odstawieniu następuje gwałtowne pogorszenie się stanu chorego)
hamowanie przechodzenia białek osocza przez naczynia włosowate (nie powstają obrzęki)
hamowanie uwalniania pirogenów z granulocytów (pirogeny powodują wzrost temperatury ciała)
hamowanie powstawania nacieku zapalnego (dążenie do jak najmniejszego nacieku)
hamowanie powstawania blizn (spowolnienie gojenia się ran)
stabilizacja błon lizosomalnych (kiedy błony nie pękają nie mogą uwalniać się lizosomy odpowiedzialne za niszczenie m.in. drobnoustrojów)
zmniejszenie wydzielania bradykinin (odpowiadających za odczuwanie bólu) oraz prostaglandyn
hamowanie pełzakowatego ruchu leukocytów
ograniczenie liczby leukocytów i produkcji przeciwciał
hamowanie uwalniania histaminy
wpływ na szpik kostny:
wzrost ilości erytrocytów, płytek krwi i neutrofili
zmniejszenie wytwarzania limfocytów, eozynofili i bazofili
wpływ na przewód pokarmowy:
wzrost wydzielania kwasu solnego (faza hormonalna)
zmniejszenie zawartości mukopolisacharydów w żołądku (chronią one ściany żołądka przed działaniem HCl - zbyt mała ilość może prowadzić do choroby wrzodowej)
wpływ na układ kostny:
upośledzenie rozwoju chrząstek nasadowych (może skutkować brakiem wzrostu)
działanie kataboliczne na macierz kostną
upośledzenie wchłaniania wapnia z przewodu pokarmowego
przywracają reaktywność naczyń krwionośnych na katecholaminy
wpływ na układ nerwowy:
małe dawki pobudzenie
duże dawki niepokój
wpływ na wielkość filtracji kłębuszkowej
transkortyną (80% kortyzolu)
albuminą (15% kortyzolu)
DHEA - dehydroepiandrosteron
androstendion
testosteron (niewielkie ilości)
kontrolowana przez ACTH'
nie podlega wpływowi gonadotropin
u mężczyzn rozwój drugorzędnych cech płciowych
u kobiet rozwój warg sromowych, łechtaczki, pochwy i sutków
anabolizm białek i wzrost organizmu
ANDROSTENDION TESTOSTERON ESTROGENY - źródło estrogenów u mężczyzn i kobiet po menopauzie
W obrębie rdzenia wydzielane są:
katecholaminy (adrenalina - 80%, noradrenalina - 20% i dopamina) powstające z tyrozyny
peptydy opiatowe (met-enkefalina i leu-enkefalina)
Regulacja wydzielania = pobudzenie układu współczulnego (wydzielanie niezwiązane z osią podwzgórze-przysadka!) pod wpływem
hipoglikemii
stresu
głodu
hipoksji
bólu
wstrząsu (zbyt mało płynów krążących w łożysku naczyniowym)
angiotensyny II, prostaglandyn, serotoniny, ACTH, glikokortykoidów
pionizacji ciała
wysiłku fizycznego
Pozametaboliczne działanie katecholamin:
adrenalina:
wzrost ciśnienia skurczowego
spadek ciśnienia rozkurczowego
dodatnie efekty tropowe (ino-, chrono- i dromotropowy)
wzrost pojemności minutowej
zmniejszenie oporu obwodowego
tachykardia
zmniejszenie perystaltyki jelit
rozszerzenie drzewa oskrzelowego
noradrenalina:
wzrost ciśnienia skurczowego i rozkurczowego
wzrost całkowitego oporu obwodowego
zwężenie naczyń żylnych
bradykardia
zmniejszenie perystaltyki jelit (słabiej niż adrenalina)
dopamina:
wzrost pojemności minutowej (dodatni efekt inotropowy)
zmniejszenie oporu obwodowego
Efekty metaboliczne działania katecholamin:
pobudzenie glikogenolizy w wątrobie (tym różni się od glikokortykosteroidów)
wzrost lipolizy
pobudzenie glukoneogenezy
wzrost wydzielania glukagonu (ponieważ tak jak katecholaminy jest on hormonem katabolicznym)
zahamowanie wydzielania insuliny
Trzustka jest gruczołem spełniającym funkcje:
endokrynną (wewnątrzwydzielniczą) - niezwiązaną z trawieniem; spełniają ją wyspy Langerhansa (komórki rozrzucone w obrębie trzustki)
komórki α wytwarzanie i wydzielanie glukagonu
komórki β wytwarzanie i wydzielanie insuliny
komórki Δ wytwarzanie i wydzielanie somatostatyny
komórki F (PP) uwalnianie polipeptydu trzustkowego
egzokrynną (wewnątrzwydzielniczą) - związana z aktywnością pęcherzyków trzustkowych
produkcja soku trzustkowego (czynnika odpowiedzialnego za procesy trawienia i zawierającego m.in. amylazę trzustkową), który dostaje się do dwunastnicy
Synteza insuliny (enzym nieswoisty gatunkowo, składa się z łańcucha α i łańcucha β połączonych ze sobą mostkiem siarczkowym, wpływa na ekspresję czynników wzrostowych)
preproinsulina
proinsulina
proinsulina insulina + wolny peptyd C (pod wpływem endopeptydaz)
wolny peptyd C to tzw. związek sygnalny - na podstawie jego oznaczenia można dowiedzieć się o ilości syntetyzowanego hormonu (insulina szybko łączy się z tkankami docelowymi i trudno zmierzyć jej poziom a wolny peptyd C nie ma właściwości biologicznych, więc tego nie robi)
przyłączenie insuliny do receptora insulinowego (składającego się z podjednostki α i β)
zmiana konformacji przestrzennej i aktywacja kompleksu hormon-receptor
uczynnienie kompleksu IRS-1 (pierwotny substrat dla insuliny) oraz RAS (szlaki RAS i MAPK, czyli MAP kinaz - czynniki wzrostowe)
MAP kinazy wpływają na metabolizm białek, lipidów lub węglowodanów (funkcja metaboliczna insuliny)
wpływ na GLUT (transportery glukozy - najczęściej wykorzystywane 4 i 6) wpływ na przezbłonowy transport glukozy
Regulacja biosyntezy i wydzielania hormonów trzustkowych:
szczyt I - w momencie wchłonięcia węglowodanów i związany z osią entero-insulinarną, która stymuluje wydzielanie nowej insuliny. Do tego czasu zużywana jest insulina zmagazynowana.
szczyt II - nowo zsyntetyzowane cząsteczki insuliny
wraz z insuliną z komórek β wydziela się kwas γ-aminomasłowy (GABA)
GABA działa na komórki α hamując wydzielanie glukagonu przez aktywację receptorów GABA
receptory GABA otwierają kanały jonowe dla Cl-
napływ jonów Cl- do komórek α
hiperpolaryzacja komórek α
Metaboliczne efekty działania insuliny i glukagonu:
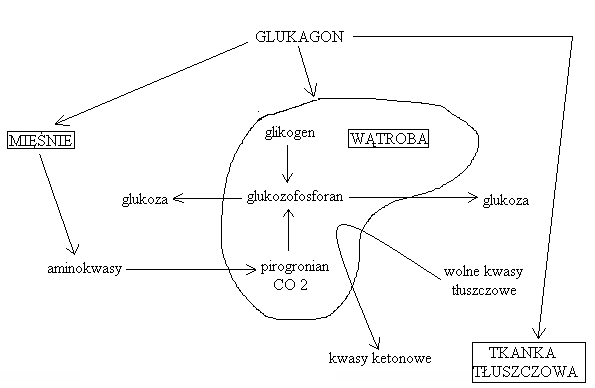
Narządowe działanie glukagonu:
na układ hormonalny:
nasilenie sekrecji insuliny, kalcytoniny, katecholamin, hormonu wzrostu
na serce:
dodatnie efekty tropowe (ino-, chrono-, batmo-)
lepsza kurczliwość mięśnia sercowego i efektywność działania układu bodźco-przewodzącego wzrost objętości wyrzutowej
na przewód pokarmowy
hamowanie motoryki (jedzenie dłużej znajduje się w przewodzie bardziej efektywne wchłanianie, trawienie)
na układ moczowy:
wzrost diurezy
Działanie somatostatyny = hamowanie:
sekrecji hormonów:
insuliny
glukagonu
gastryny
motylicy
GIP (żołądkowego peptydu hamującego)
enzymów trzustkowych
HCl
motoryki żołądka i pęcherzyka żółciowego
wchłanianie glukozy i triacylogliceroli
Działanie polipeptydu trzustkowego (PP) = magazynowanie enzymów trawiennych i żółci
Schemat metabolicznego działania glukagonu:
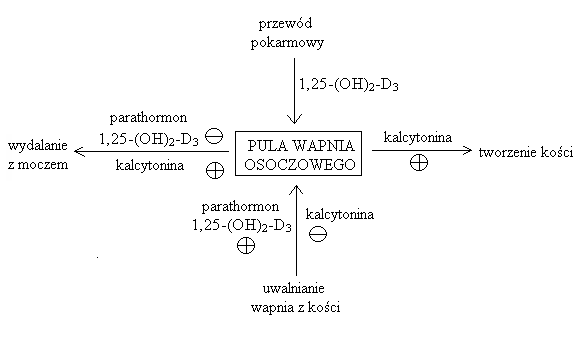
Parathormon (PTH) (syntetyzowany w przytarczycach) - główne działanie fizjologiczne to regulacja stężenia wapnia w płynie zewnątrzkomórkowym. Po podaniu parathormonu dochodzi do:
zwiększenia stężenia jonów Ca2+ w osoczu krwi
zmniejszenia stężenia fosforanów w osoczu krwi
zmniejszenia wydalania Ca2+ z moczem
zwiększenie wydalania fosforanów z moczem
wzrost resorpcji (uwalniania) Ca2+ z kości
zwiększenie stężenia fosfatazy alkalicznej we krwi (jest to enzym, który bierze udział w w/w procesach)
kontrola wytwarzania hormonalnej postaci witaminy D3 (powoduje to wzrost wchłaniania wapnia z przewodu pokarmowego)
Regulacja wydzielania parathormonu:
Kalcytonina (syntetyzowana głównie w komórkach C tarczycy, a także w przytarczycy, przysadce, grasicy, płucach, wątrobie i jelitach) obniżenie stężenia Ca2+ i fosforanów w osoczu:
wpływ na gospodarkę wapniowo-fosforanową
zmniejszenie resorpcji kości
wzrost aktywności osteoblastów (komórek kościotwórczych)
hamowanie aktywności osteoklastów (komórek kościogubnych)
hamowanie powstawania aktywnej witaminy D3 w nerkach
wzrost stężenia fosforanów nieorganicznych, wapnia, sodu, magnezu i chlorków w moczu
pozostałe efekty działania:
zmniejszenie wydzielania soku żołądkowego i trzustkowego
działanie przeciwbólowe
hamowanie łaknienia
hamowanie syntezy prostaglandyn i insuliny
pobudzenie wydzielania endorfin i 1,25-(OH)2-D3
regulacja wydzielania:
nie podlega wpływowi osi podwzgórze-przysadka
wzrost stężenia Ca2+ kalcytonina
niski poziom Ca2+ gastryna kalcytonina (hamująca wydzielanie gastryny)
Niedobór wapnia skurcze mięśni (może dojść do zaciśnięcia głośni i tym samym problemów z oddychaniem)
Hormonalna kontrola stężenia wapnia w osoczu:Grupa witamin D:
witamina D1 - kalcyferol (w tranie)
witamina D2 - ergokalcyferol (powstaje w roślinach z ergosterolu pod wpływem promieni UV)
witamina D3 - cholekalcyferol - produkowany głównie w skórze pod wpływem światła słonecznego (fizjologicznie najbardziej odpowiednia dla człowieka)
Naturalna witamina D:
powstaje w skórze z 7-hydroksycholesterolu lub jest absorbowana z przewodu pokarmowego
odpowiednie warunki do syntezy w skórze panują w Polsce od połowy czerwca do połowy września
znaczenie biologiczne mają metabolity - głównie 1,25-(OH)2D3 oraz 24,25-(OH)2D3
działanie 1,25-(OH)2D3:
zwiększenie wchłaniania wapnia i fosforanów w jelicie (przez stymulację syntezy CBP - białka wiążącego wapń)
nasilenie osteolizy osteoklastycznej
nasilenie wbudowywania siarczanów do komórek chrzęstnych
zwiększenie syntezy osteokalcyny
nasilenie syntezy interleukiny 1 i 3
wpływ na uwalnianie parathormonu
regulacja wydzielania 1,25-(OH)2D3:
Czynniki ograniczające syntezę witaminy D:
ciemna skóra
zanieczyszczenie powietrza
szyby okienne
ubrania
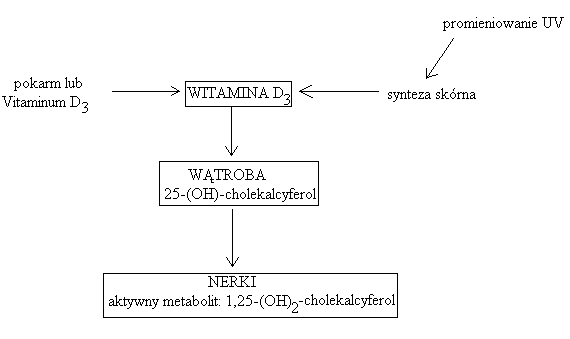
starzenie siękremy ochronne z filtrem (faktor 8 blokada 98% syntezy)
Krzywica - choroba, której przyczyną jest niedobór wapnia i witaminy D3. Przyczynami niedoboru tej witaminy mogą być:
za mało witaminy w diecie
niedostateczna ekspozycja na słońce
złe wchłanianie w jelitach
zaburzenia metabolizmu witaminy D3
struktury limbiczne mózgowia
nadwzgórze
twór siatkowaty śródmózgowia
ośrodki pnia mózgu
szyszynka
sieci połączeń neuronalnych
przestrzeniom płynowym, w których dochodzi do przenikania peptydów przez barierę krew-mózg
Kształtowanie płci zachodzi w kilku etapach od zapłodnienia do zakończenia dojrzewania płciowego:
determinacja płci - zależy od obecności chromosomów XY (mężczyzna) lub XX (kobieta).
różnicowanie płci - związany z działaniem induktorów różnicowania płci w okresie zarodkowym:
testosteron - decyduje o męskim kierunku różnicowania mózgu. We wnętrzu neuronów jest metabolizowany do estradiolu przez co nasila się synteza cholecystokininy, serotoniny, endorfin i amin biogennych (odpowiedzialnych za zachowania płciowe i cykliczne wydzielanie gonadotropin)
substancja anty-Mullerowska
dojrzewanie płciowe - związane z obecności produkowanych przez gonady sterydów płciowych
kryteria płci:
chromosomalne (zależność od genotypu)
chromatynowe (obecność ciałka Barra)
gonadalne
hormonalne
zewnętrznych narządów płciowych
wewnętrznych narządów płciowych
metrykalne
psychiczne
Czynność jajników (rozrodcza i hormonalna) ma charakter cykliczny:
I faza: pęcherzykowa - wzrost pęcherzyków i dojrzewanie komórek ziarnistych
II faza: owulacyjna - wyrzut komórki jajowej z pęcherzyka
III faza: lutealna - rozwój ciała żółtego
Faza pęcherzykowa:
zapoczątkowanie wzrostu pęcherzyka:
niezależne od GnRH
zależne od katecholamin i neurotrofin
dojrzewanie pęcherzyka:
zależne od GnRH i prolaktyny (w mniejszym stopniu)
komórki tekalne - początkowo tylko tu są receptory dla LH synteza androgenów
komórki ziarniste - specyficznie wiązana FSH pobudza konwersję androgenów do 17β-estradiolu
atrezja znacznej części pęcherzyków pierwotnych spowodowana:
nadmiarem androgenów
niskim stężeniem E-2 w płynie pęcherzykowym
stadium pęcherzyka Graffa owulacja
Faza owulacyjna:
szczyt wydzielania LH w środku cyklu:
intensywna synteza progesteronu
zahamowanie produkcji estradiolu i androgenów
mechanizm owulacji wg Motty:
gwałtowny wyrzut obu gonadotropin
podwyższone ciśnienie wewnątrzpęcherzykowe pod wpływem noradrenaliny
dysocjacja komórek ziarnistych
wzrost przepuszczalności (lub perforacja) naczyń włosowatych
rozkład wzgórka jajonośnego
Faza lutealna:
luteinizacja komórek ziarnistych pod wpływem LH:
konieczna stała stymulacja niskimi dawkami LH
po luteinizacji komórki produkują progesteron, 17α-OH-P (17α-hydroksyprogesteron) i E-2
możliwość luteinizacji istnieje dla dojrzałych, niepękniętych pęcherzyków
hCG również wykazuje działanie luteotropowe:
podtrzymuje funkcje zanikającego ciałka żółtego
odpowiada za przekształcenie: ciałko żółte ciałko ciążowe
luteoliza - regresja ciałka żółtego - podstawową rolę pełnią prostaglandyny:
hamują syntezę progesteronu
mogą być syntetyzowane przez ciałko żółte
na ciałku żółtym są odpowiednie dla nich receptor
wzrost ich aktywności nasila luteolizę
Czynność hormonalna jajnika = synteza:
hormonów sterydowych (estrogenów, progestagenów i androgenów)
peptydów jajnikowych (inhibiny, relaksyny, aktywny i folistyny)
W organizmie człowieka krążą w postaci związanej z białkami nośnikowymi surowicy:
albuminą
globuliną wiążącą sterydy płciowe (SHGB)
transkortyną (CBG)
Estrogeny:
GESTAGENY - sterydy zdolne do podtrzymywania ciąży
główny przedstawiciel: progesteron
źródło: jajniki (podczas ciąży: łożysko)
zwiększona synteza w II fazie cyklu (owulacyjnej) - ciałko żółte produkuje dużo progesteronu
ANDROGENY - podstawowe ogniwo w syntezie estrogenów
odpowiedzialne za zmiany atretyczne (eliminację nieuprzywilejowane pęcherzyki)
niewielkie wahania podczas cyklu (najwięcej w okresie okołoowulacyjnym)
działanie anaboliczne
rozwój II- i III-rzędowych cech płciowych
prekursory estrogenów
nasilenie libido u kobiet
Dojrzewanie (pokwitanie) - przestawienie się organizmu na inny, wyższy poziom równowagi hormonalnej, bez zmian sterowania procesami rozwojowymi.
zwiększenie czynności podwzgórza i przysadki nie może być zahamowane przez niski poziom sterydów płciowych, co prowadzi do zwiększenia wydzielania gonadotropin:
rozwój pęcherzyków jajnikowych
zwiększona sekrecja sterydów
rozwój charakterystycznych cech płciowych
skok pokwitaniowy - zależny od androgenów nadnerczowych, polega na:
przyroście wzrostu i ciężaru ciała;
powiększeniu narządów wewnętrznych
zmiany fizjologiczne:
wzrost ciśnienia krwi,
stabilizacja i zwolnienie tętna,
ustalenie ciepłoty ciała
nasilenie procesów biochemicznych (wzrost poziomu glukozy, sekrecji, kwasów żołądkowych itd.)
kolejność rozwoju cech płciowych:
pojawienie się wydzieliny pochwowej,
rozwój sutków,
owłosienie na wzgórzu łonowym i pod pachami,
miesiączka (po osiągnięciu krytycznej masy ciała - 48 kg)
Ciąża - następuje przełom hormonalny - stwierdza się hormonalną czynność trofoblastu, kosmówki oraz łożyska, które produkują:
gonadotropinę kosmórkową (HCG)
hormon białkowy (strukturą i funkcją przypomina hormony przysadkowe)
podtrzymuje funkcje ciałka żółtego podczas pierwszych tygodni ciąży
laktogen łożyskowy
hormon białkowy
wzrost stężenia WKT
obniżenie wrażliwości na insulinę
wzrost transportu aminokwasów (potrzebnych do rozwoju płodu)
progesteron
hamuje odpowiedź immunologiczną matki
substrat dla mineralo- i glukokortykosteroidów
chroni myometrium przed skurczami
estrogeny
estriol (produkowany w jednostce płodowo-łożyskowej)
estetrol (produkowany w wątrobie płodu)
Poród - zwiększenie aktywności skurczowej mięśnia macicy na skutek:
zmniejszenia się poziomu progesteronu
zwiększania poziomu estrogenów
działalności prostaglandyn
Laktacja - czynność gruczołów sutkowych prowadząca do wydzielania mleka.
laktogeneza - rozpoczęcie wydzielania mleka
laktopoeza - kontynuacja wydzielania mleka
rozwój sutka - zależny od estrogenów, prolaktyny, także insuliny i kortykosteroidów
inicjacja i podtrzymanie laktacji:
synteza białek w gruczołach sutkowych dzięki aktynie i laktogenie łożyskowym
w ciąży brak laktacji z powodu hamującego wpływu sterydów płciowych (po wydaleniu łożyska spadek poziomu estrogenów i progesteronu umożliwienie laktacji)
stymulacja wydzielania mleka - drażnienie mechanoreceptorów sutka w trakcie ssania powoduje wydzielanie prolaktyny i oksytocyny
Przekwitanie (klimakterium) - okres od pełnej dojrzałości do starości (46 - 52 rok życia)
dwa etapy:
przedmenopauzalny - 6 lat poprzedzających menopauzę (ostatnia w życiu miesiączka po której następuje trwająca 6 miesięcy przerwa)
pomenopauzalny - 6 lat po ostatniej miesiączce
fizjologiczna niedoczynność jajników (zmniejszenie się ilości tkanki czynnościowej)
zmniejszenie poziomu sterydów płciowych - uwzględniając wydzielanie hormonów klimakterium dzielimy na:
okres hipo- lub alutealny
okres hipoestrogenny
objawy kliniczne:
niepłodność
krwawienia czynnościowe
uderzenia krwi do głowy
przyśpieszenie czynności serca i czynności oddechowej
nadmierne pocenie się
zawroty głowy
depresja
osłabienia pamięci
labilność emocjonalna
drażliwość
związana z osią podwzgórze-przysadka-jądro
nie występuje cykliczne uwalnianie gonadotropin
pulsacyjne uwalnianie GnRH
stały obraz wydzielania LH i FSH
istnieje dobowy rytm wydzielania np. folitropiny
Oś LH - komórki Leydiga - LH powoduję:
syntezę androgenów w komórkach Leydiga
syntezę cholesterolu
konwersję 17α-hydroksypregnenolonu do testosteronu (który jest następnie uwalniany do krwioobiegu)
syntezę androstendionu (prekursor estrogenów) większość syntezy estrogenów zachodzi w komórkach Leydiga (głównie estron i estradiol pochodzące z przemian testosteronu)
Oś FSH - kanaliki nasienne - FSH stymuluje cykl spermatogenny (proces sekwencyjnych zmian w komórkach rozrodczych mężczyzn)
6 stadiów (od spermatogonii do spermatyd)
spermogeneza - dojrzewanie spermatyd i wykształcenie plemników
komórki Sertoliego obecne w obrębie kanalików:
fagocytoza uszkodzonych komórek
wytwarzanie ABP (białek wiążących androgeny)
synteza androgenów potrzebnych do spermatogenezy
Dojrzewanie chłopców (6-16 lat)
stężenie LH rośnie gwałtowniej, zaczyna się i kończy szybciej:
wzrost poziomu testosteronu dopiero po 13. roku życia + więcej estrogenów jądrowych i androgenów nadnerczowych
inicjacja pokwitania:
DHA (dehydroepiandrosteron)
prolaktyna (rola pomocnicza)
oznaki dojrzewania:
wzrost kośćca
zwiększenie masy ciała
rozwój narządów płciowych, owłosienia
mutacja
niezbędne warunki do rozpoczęcia dojrzewania:
mała zawartość SHGB
odpowiednie stężenie testosteronu
uruchomienie wytwarzania estradiolu
uruchomienie sekrecji LH
zwiększenie wrażliwości gonadotropów przysadkowych na GnRH
Przekwitanie
przyczyna - wygasanie czynności hormonalnej jąder (nie fizjologicznej jak u kobiet)
po 50. roku życia
zachowana czynność plemnikotwórcza
w mięśniu szkieletowym: - 90 mV
w mięśniach gładkich: od -35 do -65 mV
w komórkach nerwowych od -70 do -80 mV
najczęściej zbliżony wartością do potencjału równowagi dla jonów potasu
wewnątrz komórki w przewadze występują aniony organiczne oraz jony K+, natomiast w płynie zewnątrzkomórkowym głównie Na+ i Cl-. Aniony białczanowi nie mogą przemieszczać się przez błonę komórkową bez naruszania jej struktury. Dzięki temu ich obecność warunkuje elektroujemność środowiska wewnętrznego (mimo sąsiedztwa kationów):
jony Cl- oraz K+ mogą natomiast swobodnie dyfundować
gradient elektryczny stworzony przez aniony białczanowi wypycha Cl- na zewnątrz komórki i wciąga K+ do wnętrza komórki
niesymetryczne rozłożenie Na+ oraz K+ wywołane obecnością w błonie komórkowej transportu aktywnego, tzw. pompy sodowo-potasowej (Na/K-ATP-azy)
obecność w błonie komórkowej kanałów jonowych, dzięki którym błona komórkowa może zmieniać swoją przepuszczalność
mechanoenzym o właściwościach ATP-azy umieszczony w błonie komórkowej
przykład transportu aktywnego - niezbędna jest cząsteczka nośnika oraz nakład energii pochodzącej z rozpadu ATP
na każdy mol hydrolizowanego ATP przenoszone są:
3 jony Na+ na zewnątrz komórki
2 jony K+ do środka komórki
transport aktywny w niektórych komórkach nerwowych pochłania nawet 90% całkowitej energii wytwarzanej przez komórkę (neurocyt)
dla prawidłowej czynności pompy sodowo-potasowej niezbędne są:
jony Mg2+
dostarczanie tlenu i składników energetycznych
usuwanie CO2
inaktywacja zachodzi w warunkach:
niedotlenienia
hipotermii
w obecności inhibitorów (ouabaina, glikozydy nasercowe)
zależne od napięcia (bramkowane elektrycznie) - aktualny potencjał elektryczny jest sprawdzany przez czujnik
zależne od ligandu (bramkowane chemicznie) - w pobliżu kanału znajduje się receptor, który wiąże odpowiedni neurotransmiter powodując otwarcie kanału
aktywowane mechanicznie (tylko w komórkach mięśniowych) - naprężenie lub relaksacja mięśnia otwiera lub zamyka kanał
szybkie i wolne
odkomórkowe i dokomórkowe
w przypadku, gdy na błonę komórkową działa seria bodźców podprogowych jeden po drugim, każdy z nich podnosi potencjał błonowy, aż kolejny staje się bodźcem progowym, nazywany to sumowaniem w czasie
w przypadku, gdy na błonę komórkową działa jednocześnie duża liczba bodźców podprogowych, zjawisko to nazywamy sumowaniem w przestrzeni
gdy bodziec podprogowy zadziała na błonę komórki będącej w fazie hipopolaryzacji
bodziec elektryczny doprowadza do otwarcia szybkich kanałów sodowych przy wartości potencjału błonowego równej potencjałowi progowemu (potencjał aktywacji sodowej: -65 mV w komórkach nerwowych)
„wszystko albo nic” - osiągnięcie przez komórkę potencjału progowego powoduje, że dalej wszystko przebiega zawsze dokładnie tak samo bez względu na to o ile został przekroczony próg pobudliwości
depolaryzacja - napływ jonów sodowych do wnętrza komórki przez otwarte kanały jonowe; kanały ten zaczynają się zamykać gdy potencjał osiągnie wartość -55mV (potencjał inaktywacji sodowej). Potencjał narasta do osiągnięcia wartości +20 - +35 mV (trwa ok. 1/3 całkowitego czasu trwania potencjału)
repolaryzacja - wypływ jonów K+ na zewnątrz komórki; rozpoczyna się już w fazie depolaryzacji, ale napływ jonów sodowych jest bardziej dynamiczny, więc efekty wypływu jonów potasowych widać dopiero po inaktywacji sodowej
hiperpolaryzacja = potencjał następczy ujemny - wartość potencjału spada nieco poniżej potencjału spoczynkowego (-70 mV)
potencjał następczy dodatni = ten hopek za hiperpolaryzacją
charakter lokalny (nie rozprzestrzenia się)
wywołany napływem jonów dodatnich do komórki
amplituda potencjału wprost proporcjonalna do siły bodźca
potencjał generujący generuje serię potencjałów czynnościowych spełniających zasadę „wszystko albo nic”
częstotliwość potencjałów wprost proporcjonalna do amplitudy potencjału generującego - kodowanie informacji częstotliwością
od depolaryzacji do osiągnięcia potencjału inaktywacji sodowej w fazie repolaryzacji
niepobudliwość totalna (komórka nie reaguje nawet na bodźce nocyceptywne)
w fazie repolaryzacji - między potencjałem inaktywacji sodowej a potencjałem progowym
bardzo silny bodziec progowy jest w stanie ją przełamać (nie ma zastosowania zasada „wszystko albo nic”)
grubości włókna nerwowego - im większa średnica włókna tym mniejszy opór przewodzenia (szybszy transport informacji)
obecności osłonki mielinowej:
we włóknach osłonowych ma miejsce przewodzenie skokowe od jednego przewężenia Ranviera do drugiego (depolaryzacja jest tylko w przewężeniach)
we włóknach bez osłonki zachodzi przewodzenie ciągłe (bardzo czasochłonne, ale mniej błędów w transmisji)
przewodzenie ortodromowe - od ciała komórki na obwód (kolbka synaptyczna) - fizjologiczne
przewodzenie antydromowe - z obwodu (kolbki synaptycznej) do ciała komórki - fizjologicznie występuje rzadko (np. zaczerwienienie skóry po podrapaniu lub w synapsach akso-aksonalnych, gdzie błoną postsynaptyczną jest akson)
ilości synaps występujących na drodze nerwowej
GRUPA A - grube neurony z osłonką mielinową
α - czucie proprioceptywne, neurony somatyczne i ruchowe (70-120 m/s)
β - czucie dotyku i ucisku (30-70 m/s)
γ - krótkie neurony ruchowe do wrzecionek mięśniowych (15-30 m/s)
σ - czucie bólu, zimna i dotyku (12-30 m/s)
GRUPA B - włókna przedzwojowe układu autonomicznego (3-15 m/s)
GRUPA C - włókna korzeni grzbietowych rdzenia kręgowego (0,5 - 2 m/s) oraz włókna współczulne (0,7 - 2,3 m/s)
Podział strukturalny:
akso-aksonalne
akso-somatyczne
akso-dendrytyczne
dendrytyczno-dendrytyczne
somatyczno-somatyczne
Podział czynnościowy:
chemiczne - pod wpływem pobudzenia jonowo-elektrycznego (sprzężenie elektro-wydzielnicze) uwalniają się na drodze egzocytozy substancje chemiczne, tzw. neurotransmitery, które są sygnałem odbieranym przez receptory błony komórki postsynaptycznej, dzięki czemu następuje sprzężenie chemiczno-elektryczne
elektryczne - zawierają dużo połączeń jonowo-metabolicznych. Połączenia te umożliwiają dwukierunkowy, bezpośredni przepływ jonów z jednej komórki nerwowej na drugą.
W części presynaptycznej może zajść:
sprzężenie elektrowydzielnicze - zmiana polaryzacji prowadzi do uwolnienia transmiterów
sprzężenie elektromechaniczne - zmiana polaryzacji prowadzi do skurczu mięśni
Mechanizm sprzężenia elektrowydzielniczego:
zmiana polaryzacji błony w części presynaptycznej
otwarcie kanałów wapniowych
napływ jonów Ca2+ do aksoplazmy
połączenia Ca2+ z kalmoduliną w kompleks aktywujący enzymy lizosomalne (synaptynę)
pęcherzyk z neurotransmiterem zespala się z błoną presynaptyczną, a neurotransmitery zostają wydzielone na drodze egzocytozy do szczeliny
Sprzężenie chemiczno-elektryczne - zachodzi w elemencie postsynaptycznym i polega na powstaniu potencjału postsynaptycznego pod wpływem transmitera:
EPSP - postsynaptyczny potencjał pobudzający
szybki
modulowany przez inne potencjały
powoduje depolaryzację i jej dalsze rozprzestrzenianie
IPSP - postsynaptyczny potencjał hamujący
powoduje hiperpolaryzację i zahamowanie przekazywania informacji)
spowodowane przez glicynę oraz GABA (kwas γ-aminomasłowy)
sEPSP - wolny postsynaptyczny potencjał pobudzający - ma charakter odpowiedzi miejscowej
ssEPSP - bardzo wolny postsynaptyczny potencjał pobudzający - związany z funkcją neuromodulatorów
Neurotransmitery synaptyczne:
produkowane w ciele neuronu presynaptycznego
magazynowane w pęcherzykach w kolbce aksonu
pod wpływem depolaryzacji zakończenia aksonu następuje ich uwolnienie na sposób kwantowy, tj. stanowią krotność ilości zawartej w jednym pęcherzyku
wydzielony transmiter łączy się na błonie postsynaptycznej ze specyficznym receptorem i wywołuje typowy dla siebie efekt (EPSP lub IPSP)
musi istnieć skuteczny mechanizm inaktywujący transmiter (rozkład enzymatyczny, resorpcja zwrotna do elementu presynaptycznego, dyfuzja przez synapsę) w przeciwnym wypadku cały czas będzie EPSP i stracimy przekaźnik
dla transmitera musi istnieć substancja, która podana z zewnątrz wywoła taki sam efekt (agonista) i taka, która posana z zewnątrz zablokuje synapsę (antagonista, bloker)
większość leków to agoniści neurotransmiterów
przykłady neurotransmiterów:
hamujące - GABA, glicyna
pobudzające - ACh (acetylocholina), NA (noradrenalina), A (adrenalina), serotonina, histamina, asparganiany
Cechy neuromodulatorów:
nie przenoszę informacji, ale modyfikują jej transmisję
syntetyzowany w ciele neuronu
magazynowany w dużych pęcherzykach presynaptycznych
budowa peptydowa
hamuje lub pobudza działanie synapsy - powoduje powstawanie potencjału lokalnego (odpowiedzi miejscowej), który ma tendencje do zanikania zanim zmiana polaryzacji osiągnie wartość progową (ułatwienie) lub zanim osiągnie stan hiperpolaryzacji (utrudnienie)
uwalniany pod wpływem długotrwałego lub bardzo silnego bodźca
długotrwały efekt działania (brak sprawnego mechanizmu inaktywacji)
Typowe neuromodulatory:
hormony podwzgórzowe:
luliberyna (LH-RH)
kortykoliberyna (CRF)
tyreoliberyna (TRH)
wazopresyna (AVP)
oksytocyna (OXY)
hormony przewodu pokarmowego:
gastryna
cholecystokinina (CCK)
sekretyna
wazoaktywny peptyd jelitowy (VIP)
hormony opiatowe:
enkefaliny
endorfiny
kininy
prostaglandyny
neuropeptyd Y (NPY)
substancja P
Hamowanie presynaptyczne - zachodzi przy udziale synapsy akso-aksonalnej:
na bazie synapsy pobudzającej:
refrakcja wygasza część potencjałów
ilość wydzielanego transmitera jest mniejsza
hamowanie nie jest całkowite
na bazie synapsy hamującej:
wydzielenie neutotransmitera hamującego
hiperpolaryzacja błony
całkowite zablokowanie przewodzenia
Integracja komórki nerwowej - na jedną komórkę nerwową może przypadać do 1000 synaps, dlatego informacja przekazywana z jednego neuronu na następny ulega permanentnym zmianom (uśrednianiu) - powoduje to ogromną plastyczność reakcji ośrodkowego układu nerwowego nawet na takie same bodźce.
receptor
droga dośrodkowa (wypustka komórki nerwowej)
ośrodek (skupisko komórek nerwowych w OUN)
droga odśrodkowa (wypustka komórki nerwowej)
efektor
monosynaptyczne (jedna synapsa - 2 neurony - jeden spełnia rolę dośrodkową, a drugi odśrodkową)
polisynaptyczne (zazwyczaj u ludzi)
bezwarunkowe:
odpowiedzialne za podstawowe funkcje mające na celu utrzymanie przy życiu osobnika, podtrzymanie gatunku
filogenetycznie starsze, zamykane na poziomie rdzenia kręgowego, pnia mózgu, nie przekraczają jąder wzgórza
niezmienne
takie same u wszystkich osobników danego gatunku
nie musimy się tych odruchów uczyć, nie zapominamy ich
czasowe, czynnościowe połączenia różnych ośrodków nerwowych
plastyczne
powstają na podłożu istniejących w OUN włókien asocjacyjnych (kojarzeniowych)
warunkiem powstania łuku odruchowego (zgodnie z hipotezą Gastaut'a) jest zamknięcie jego na 3 poziomach jednocześnie (rdzeń kręgowy, jądra wzgórza i wyższe ośrodki nerwowe, np. kora mózgowa)
doświadczenie Pawłowa (warunkowanie klasyczne): zwierzę wydziela ślinę i soki żołądkowe podczas jedzenia, Pawłow skojarzył bodziec warunkowy (np. dźwięk, światło) z bezwarunkowym, wywołanym przez jedzenie. Po pewnym czasie na określony dźwięk zwierzę wydzielało sok żołądkowy. Powstało czynnościowe, czasowe połączenie między ośrodkiem odpowiedzialnym za odbieranie bodźca bezwarunkowego z ośrodkiem analizującym bodziec warunkowy (istota warunkowania)
warunkowanie instrumentalne (układ kary i nagrody wg Konorskiego i Thorndike'a) - zwierzę znajduje się w klatce z dwoma dźwigniami. Po naciśnięciu jednej z nich (reakcji na bodziec) następuje nagroda lub kara (wzmocnienie reakcji):
odruchy możemy podzielić także wg ich znaczenia biologicznego:
postawne
krążeniowe
pokarmowe
płciowe itp.
zewnętrzne - razem z bodźcem warunkowym działają inne silne bodźce obojętne
wewnętrzne:
przez wygasanie - jeżeli nie ma skojarzenia z bodźcem bezwarunkowym lub nie wzmacniano reakcji (po jakimś czasie)
warunkowe - zbyt różne bodźce warunkowe lub ich zbyt duża ilość organizm się gubi
różnicowe - zmieniamy bodziec warunkowy na inny
opóźniające - coraz dłuższy odstęp czasu między bodźcem bezwarunkowym a warunkowym lub między reakcją a nagrodą/karą
podwójne, antagonistyczne unerwienie efektora
obecność zwojów w drogach eferentnych co powoduje podział na włókna przedzwojowe i zazwojowe dróg eferentnych układu autonomicznego
bardzo dużo synaps w zwojach
duża plastyczność odpowiedzi duża ilość synaps, które oprócz transmiterów wydzielają także kotransmitery i/lub modulatory
duża latencja w porównaniu z układem somatycznym (AUN jest wolniejszy) liczne synapsy oraz włókna bezosłonkowe
reakcje zachodzą tylko w pewnym obszarze AUN, proste odruchy mogą zachodzić w obrębie jednego narządu
funkcja fazowa - główna funkcja AUN, polegająca na jego reakcjach na bodźce wprowadzane przez receptory sensoryczne
funkcja toniczna - sterowanie rytmami biologicznymi podtrzymującymi homeostazę (pobudliwość komórek, czynność pracy serca, ciśnienie krwi) - wtedy gdy nic się nie dzieje; jest to czynność nieustająca
funkcja troficzna - modyfikacja procesu biosyntezy białek (strukturalnych, enzymatycznych lub receptorowych) co pozwala na regulację metabolizmu i stanu energetycznego organizmu
część współczulna (układ adrenergiczny)
część przywspółczulna (układ cholinergiczny)
część jelitowa
część trzewno-czuciowa
dominacja części współczulnej - dzień
dominacja części przywspółczulnej - noc + sjesta
wyjątkowo może dojść do KOAKTYWACJI, np. odruch sercowy na niedotlenienie
neurony splotów śródściennych (mięśniowego i podśluzowego)
wzbudzanie i wygaszanie fali perystaltycznej
koordynacja ruchów jelit splot Awerbacha w błonie mięśniowej
wydzielanie jelitowe splot Meissnera w warstwie podśluzówkowej
regulacja czynności bez udziału OUN
często nazywany „lokalnym mózgiem”
neuroprzekaźniki: cholecystokinina, somatostatyna, endorfiny, enkefaliny, VIP, ADP, ATP, serotonina
przewodzenie informacji z narządów wewnętrznych do OUN
na zakończeniach nerwowych wydzielają peptydy z grupy tachykin:
neurokinina A - obniżenie ciśnienia krwi, zmniejszenie częstości pracy serca (omdlenie z bólu), obkurczenie oskrzeli
neurokinina B - obniżenie ciśnienia krwi
neuropeptyd K - obniżenie ciśnienia krwi, obkurczenie oskrzeli
substancja P - rozszerzenie naczyń, uwolnienie histaminy, zwiększona przepuszczalność naczyń włosowatych
naczynia krwionośne mięśniówki gładkiej mózgu (migreny)
naczynia krwionośne skóry
przyłączenie acetylocholiny do receptorów nikotynowych
wzrost przepuszczalności błony dla kationów wzrost potencjału
otwarcie elektrycznie bramkowanych szybkich kanałów sodowych depolaryzacja
przyłączenie acetylocholiny do receptorów muskarynowych wewnątrz zwojowych komórek dopaminergiczych (SIF)
wydzielenie dopaminy
wzrost przepuszczalności błony dla Cl- i K+ hiperpolaryzacja
przyłączenie acetylocholiny do receptorów muskarynowych
uwolnienie przekaźników II rzędu i zamknięcie kanałów potasowych
depolaryzacja i powolny wzrost potencjału
kotransmiter LH-RH przyłącza się do komórki zwojowej
powolne zamykanie się kanału potasowego (odkomórkowego)
powolna depolaryzacja
kompleks R+T+Gs+GTP amplifikacja (wzmocnienie) - ilość cząsteczek II przekaźnika jest większa niż ilość cząsteczek neuroprzekaźnika
kompleks R+T+Gi+GTP zahamowanie przenoszenia informacji, cykl II przekaźnika nie zostaje uruchomiony
Receptory cholinergiczne - ich mediatorem jest acetylocholina
droga Ach w synapsie:
synteza z acetylokoenyzmu-A i choliny przy pomocy acetylotransferazy cholinowej
wydzielenie do szczeliny
przyłączenie się do receptora lub rozkład na cholinę i kwas octowy pod wpływem acetycholinoesterazy
Receptory adrenergiczne
inaktywacja noradrenaliny:
wychwyt neuroanalny (80%) tj. wchłanianie zwrotne - blokowane przez kokainę i rezerpinę
wychwyt tkankowy w tkankach docelowych rozkład przez MAO typu A (bloker: amfetamina, glikokortykoidy) oraz oksymetylotransferazę katecholową)
dyfuzja NA z przestrzeni synaptycznej do krwi
synteza noradrenaliny:
tyrozyna do DOPA (hydroksylaza tyrozyny)
DOPA do DA (dekarboksylacja)
DA do NA (hydroksylaza dopaminy)
Receptory cyklu fosfatydylo-inozytolowego:
enzym T+R+Gs+GTP aktywuje fosfolipazę C
pod wpływem fosfolipazy C następuje hydroliza PIP2 (difosforofosfatydylo-inozutolu) do IP3 (trifosforoinozytolu) i DG (diacyloglicerolu)
resynteza DG i IP3 do PIP2
Mechanizm działania IP3:
uwalnianie Ca2+ wewnątrz komórki
Ca2+ łączy się z kalmoduliną
aktywacja enzymów i białek
mechanizm działania DG:
aktywacja pompy protonowej (aktywna wymiana H+ na Na+ - sód do środka) nasilenie biosyntezy i podziału białek
aktywacja kinazy białkowej C - fosforylacja białek
należą tu receptory α1 i M1 i M3 a także receptory dla angiotensyny II, dopaminy, histaminy,luliberyny, tromboksanu i trombiny.
Receptory cAMP:
mechanizm działania:
aktywacja cyklazy adenylowej
przemiana ATP w cAMP
aktywacja kinazy białkowej A (przez cAMP)
działanie na komórkę:
napływ jonów Ca2+ do serca zwiększenie częstości i siły skurczu
aktywacja lipazy hydroliza triglicerydów
aktywacja procesu glikogenolizy w wątrobie
receptory:
β-adrenergiczne (działanie ergotropowe - mobilizują energetykę)
dla wazopresyny (V2) w cewkach nerek,
dla glukagonu,
prostaglandyn,
presynaptyczne dla ATP i adenozyny
α2 - ale hamowany przez Gi (mniej cAMP)
Receptory jonotropowe:
np. cholinergiczny (nikotynowy)
zmiany jonowe, np. napływ jonów, otwarcie kanału itd.
Receptory metabotropowe:
α1, β, M, D1, H1, LH-RH, α2
mechanizm działania - zmiana metabolizmu wewnątrzkomórkowego
dynamiczna równowaga typu sprzężenia ujemnego
nadmierna ilość transmitera = nad syntezą i eksponowaniem przeważa internalizacja down regulation przyzwyczajenie się do leków
mało transmitera = zwiększenie ilości receptorów up regulation
acetylocholina działa na M2 zakończenia współczulnego hamowanie wydzielania noradrenaliny przewaga przywspółczulnego
noradrenalina pobudza α2 na zakończeniach przywspółczulnych hamowanie wydzielania acetylocholiny przewaga współczulnego
trzewno-trzewne (autonomiczno-autonomiczne): interoreceptory włókna trzewno-czuciowerdzeń kręgowy i przedłużony układ krążenia i narządy wewnętrzne (np. omdlenie z bólu, dermografizm)
trzewno-somatyczne (autonomiczno-somatyczne): receptory w układzie somatycznym dalej jak wyżej (np. „twardy brzuch”, ból odniesiony)
somatyczno-trzewne: eksteroreceptory i narządy zmysłów narządy wewnętrzne (np. akupunktura, akupresura, masaż, bańki - zabiegi pobudzają receptory somatyczne przez co zmienia się funkcja narządów wewnętrznych)
Lęk paradoksalny - paraliżuje, kiedy nie ma drogi ucieczki albo sposobu na wygranie. Następuje masywna stymulacja układu przywspółczulnego oraz utrata kontroli nad oddawaniem moczu i stolca.
Choroba Raynauda - charakteryzuje się skurczem naczyń krwionośnych wybranych części ciała prowokowanym przez stany emocjonalne lub ekspozycję na niskie temperatury.
Nadciśnienie tętnicze - może być wynikiem nadmiernej aktywności układu współczulnego wywołującej skurcz naczyń tętniczych krążenia dużego.
Achalazja - spowodowana brakiem lub niewydolnością komórek splotu Awerbacha w dolnej części przełyku (brak rozkurczania się zwieracza przełyku w okolicy wpustu żołądka przed przejściem pokarmu). Objawy:
utrudnione połykanie
silne bóle zamostkowe i w nadbrzuszu (czasem promieniujące do szyi, ramion, klatki piersiowej)
zgaga
ulewanie pokarmu
utrata wagi
Ból odniesiony - odczuwany w innym miejscu niż miejsce uszkodzenia
Ból przenoszony - przenoszony z trzewi na struktury somatyczne
wg teorii konwergencji na II neuronie czuciowym w rogach tylnych rdzenia kręgowego zbiegają się drogi czucia trzewnego i somatycznego. Impulsy przenoszone są do kory mózgowej, która nie umie odróżnić miejsca powstania wrażeń bólowych i następuje rzutowanie tych wrażeń zarówno do trzewi, jak i do skóry (mózg kieruje się doświadczeniem - ból odczuwany najczęściej ze skóry)
wg teorii torowania impulsy podprogowe z receptorów czucia trzewnego uwrażliwia II neuron czuciowy i różne bodźce pojawiające się na drodze wstępującej mogą wywołać powstanie wrażenia bólowego. (torowanie - utrzymanie gotowości komórki nerwowej do reakcji)
Mózg w liczbach:
u niemowlęcia mózg waży średnio 350 g (12% masy ciała)
u dorosłego - 1375 g (u kobiet o 150 g mniej) - ok. 2% masy ciała
objętość 1,4 l
zużycie energii: ok. 20 % energii całkowitej
moc elektryczna: 25 W (już w trzecim roku życia)
Ewolucja mózgu:
ssaki w okresie jurajskim miały większe mózgi z bardziej rozbudowanym układem limbicznym
CUN powstał z 5 pęcherzyków: kresomózgowia, międzymózgowia, rdzeniomózgowia, tyłomózgowia i śródmózgowia
pierwsze neurony pojawiają się w 4-5 tygodniu ciąży z ektodermy dzięki czynnikom neurotroficznym (zwłaszcza NGF - neuron growth factor)
neurony dzielą się ok. 70-100 razy w ciągu życia
w 12 tygodniu powstają zawiązki móżdżku
szlaki nerwowe powstają przed receptorami (rola czynników wzrostu)
maksymalne tempo wzrostu - 5 miesiąc do 1 roku po urodzeniu
Aktywność mózgu rośnie:
w wieku 2 lat osiąga poziom dorosłego
w wieku 3 lat - przewyższa ten poziom dwukrotnie; stan ten utrzymuje się do 9-10 roku życia, po czym powoli się zmniejsza i stabilizuje ok. 18 roku życia
rok po urodzeniu kora ruchowa łączy się czynnościowo z lędźwiową częścią rdzenia kręgowego - zanika odruch Babińskiego
2 lata - masowa reorganizacja kory mózgu, amnezja dziecięca
6 lat - mózg jest trzykrotnie większy niż w momencie narodzin
ok. 12 lat - stabilizacja płata czołowego
ok. 20 lat - koniec reorganizacji, niewielkie zmiany przez całe życie
mechanizm zdobywania - wyzwalana jest aktywność w kierunku zdobywania, podejmowania działań przynoszących korzyści
mechanizm unikania - hamuje aktywność w kierunku zdobywania a w skrajnych przypadkach wyzwala reakcję ucieczki (chroni przed działaniem czynników szkodliwych) - ucieczka z egzaminu :D
ośrodek pokarmowy (głodu i sytości)
ośrodek pragnienia
ośrodek rozrodczy
ośrodek agresji i ucieczki
krótkotrwale działające czynniki pobudzające:
wzrost stężenia glukozy (następuje po jedzeniu)
pobudzenie mechanoreceptorów żołądka (rozciągnięcie ścian przez pokarm) - jeszcze nie strawił ostatniego posiłku
wzrost ciśnienia osmotycznego ECF
pobudzenie ośrodka termoregulacji (gorąco - mniej jedzenia; zimno - więcej jedzenia, czyli substratów energetycznych)
wzrost stężenia serotoniny (w okresach poposiłkowych): hormony żołądkowo-jelitowe (cholecystokinina, peptyd uwalniający gastrynę - GRP, insulina) - są sygnałem hiperglikemii poposiłkowej, więc nie potrzebujemy wtedy więcej jedzenia
antagonista ośrodka sytości
pobudzenie - peptydy opioidowe, kora mózgu i jądra podkorowe
hamowanie ośrodka głodu - układ limbiczny, kora mózgu i jądra podkorowe
leptyna (czynnik sytości) - jest to hormon białkowy wydzielany przez adipocyty.
pobudzenie wydzielania: składniki pokarmowe jak monosacharydy, WKT, aminokwasy
pobudza ośrodek sytości i hamuje wydzielanie NPY (hormon głodu), który pobudza ośrodek głodu („czynnik głodu”)
grelina - powoduje wzrost ilości spożywanego pokarmu, hamuje wydzielanie serotoniny (hormon szczęścia).
wywołują aktywność somatyczną organizmu polegającą na poszukiwaniu i przyjmowaniu wody (dipsja)
powodują uwalnianie ADH
wzrost ciśnienia osmotycznego ECF
angiotensyna II
peptydy opioidowe
zbudowany z:
hipokampa
zakrętu hipokampa
zakrętu obręczy (rola w utrzymaniu homeostazy zbiera bodźce z mięśni i trzewi)
ciała migdałowatego
przegrody przezroczystej
zadania hipokampa:
kontrola podwzgórza
udział w zapamiętywaniu (potencjalizacja)
udział w regulowaniu popędu płciowego i wydzielaniu hormonów płciowych
pamięć świeża (elektryczna) - związana z aktywnością sieci neuronalnych i z krążącymi potencjałami; krótkotrwała
pamięć trwała (strukturalna, białka) - związana z powstaniem specyficznym substancji białkowych, w których kodowane są zdarzenia (np. białko S - chyba)
czołowo-oczodołowa - pamięć świeża
skroniowa przednia - pamięć trwała
potyliczno-skroniowo-ciemieniowa - może przejąć funkcję struktury uszkodzonej (jeżeli chodzi o struktury kojarzeniowe, gorzej z ruchowymi)
afazję ruchową - niezdolność artykułowania mowy
afazję czuciową - niezdolność rozumienia mowy
dysgrafię (agrafię) - niezdolność do pisania
dysleksję (aleksję) - niezdolność do czytania
zbudowany z:
układu siatkowatego pnia mózgu
układu siatkowatego wzgórza
funkcje:
odbiór informacji z wszystkich receptorów ciała
przekazanie informacji do pól kory mózgowej (w drugą stronę działa układ zstępujący)
informacje do kory przekazywane są dwiema drogami :
swoistą do wszystkich pól kory mózgu
nieswoistą - biegnącą przez jądro brzuszno tylno-boczne wzgórza do pól czuciowych (omija twór siatkowaty)
synchronizacja:
mniej informacji dopływa do kory mózgowej (np. we śnie)
maleje czynność bioelektryczna mózgu
zwolnienie rytmu fal mózgowych i zwiększenie ich amplitudy
większy dopływ informacji do mózgu (w stanie aktywności)
fale elektryczne zderzają się ze sobą
fale o dużej częstotliwości i niskiej amplitudzie
intensywny metabolizm, związany z intensywnymi procesami bioelektrycznymi i metabolicznymi podczas procesów zapamiętywania
przeciwieństwo snów patologicznych gdzie obserwuje się zmniejszenie metabolizmu
fazy REM (rapid eye movement - 20-25% czasu snu)
marzenia senne (85% marzeń w tej fazie)
szybkie ruchy gałek ocznych,
atonia mięśni szkieletowych,
spowolnienie częstości pracy serca i wentylacji płuc,
przekrwienie narządów miednicy małej,
fale w EEG jak w stanie czuwania (fale alfa)
najlepszy wypoczynek
Faza nREM (non rapid eye movement) - 4 stadia
nREM1 - zasypianie, zanik fal alfa, mieszanina fal szybkich i wolnych, obniżenie potencjałów mięśniowych (5-10% czasu snu)
nREM2 - sen wolnofalowy, rytm fal theta, wrzeciona senne, zespoły K (niskonapięciowy, ujemny potencjał fali ostrej)
nREM 3 i 4 - sen wolnofalowy, głęboki (20%). W fazie 3 dominuje fale theta i delta, a w fazie 4 - rytm delta
Sen narkotyczny - zablokowanie informacji na poziomie tworu siatkowatego:
utrata przytomności pod wpływem:
wysokich dawek leków nasennych, uspokajających
narkotyków
alkoholu
innych związków chemicznych
może wystąpić niedrożność oddechowa i ośrodkowa niewydolność oddechowa
Somnambulizm (lunatyzm) - zjawisko chodzenia czasie snu, które wiąże się z niedojrzałością centralnego układu nerwowego.
dosyć często występuje u dzieci (niegroźne)
występujące regularnie u dorosłych jest chorobą
śpiący nagle wstaje i zaczyna chodzić lub wykonywać inne czynności (np. jeść, ubierać się)
Katalepsja - specyficzne zesztywnienie mięśni, połączone z zastyganiem postawy ciała oraz położeniu kończyn i wygięciu szyi, także w nienaturalnych pozycjach
wzmożona aktywność układu pozapiramidowego, czyli jąder podstawy mózgu
wzmożone napięcie mięśniowe, przy jednoczesnym upośledzeniu lub nawet całkowitym zablokowaniu czynności ruchowych
zesztywnienie jest elastyczne - można chorego poruszyć
Letarg - wyłączona czynność mózgowa (ośrodki korowe i podkorowe) z zachowaniem czynności w obszarze pnia mózgu.
nie ma typowych oznak śmierci: rozpadu gnilnego i plam opadowych
śmierć pozorna, chorobowy stan senności,
brak reakcji na bodźce
osłabienie czynności życiowych organizmu
spotykany w śpiączce afrykańskiej, niektórych zatruciach (barbiturany) i chorobach mózgu (poza tym występuje niezwykle rzadko)
WRODZONY |
NABYTY |
KORA NADNERCZY
Zbudowana z trzech warstw:
MINERALOKORTYKOSTEROIDY - najważniejszy przedstawiciel = aldosteron
Jak również:
GLUKOKORTYKOSTEROIDY - najważniejsze związki = kortyzol i kortykosteron
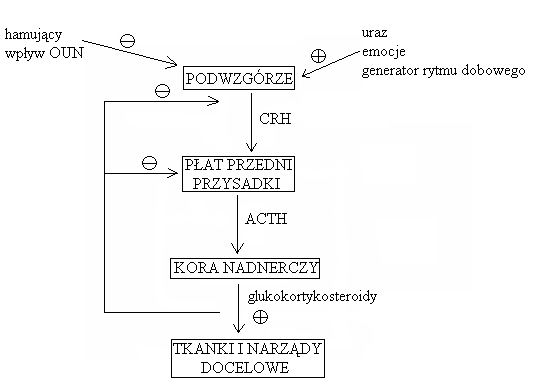
Regulacja wydzielania:
Efekty metaboliczne glukokortykosteroidów:
Pozametaboliczne efekty glukokortykosteroidów:
Glukokortykosteroidy są związane z nośnikami białkowymi:
ANDROGENY NADNERCZOWE:
Regulacja wydzielania:
Działanie:
RDZEŃ NADNERCZY
TRZUSTKA
|
metaboliczna |
hormonalna |
nerwowa |
INSULINA |
- glukoza - aminokwasy - produkty glikolizy - ciała ketonowe - elektrolity (Ca2+, K+, Na+) |
+ |
pobudzenie: - układ adrenergiczny przez receptory α - układ cholinergiczny przez receptory muskarynowe
hamowanie: - układ adrenergiczny przez receptory β2 |
|
|
- glukagon - sekretyna - gastryna - cholecystokinina (CKK) - oś entero-insulinarna - katecholaminy działające na receptor α |
|
|
|
- |
|
|
|
- katecholaminy (działające na receptor α - w stanie fizjologicznym przeważają) - insulina - somatostatyna |
|
GLUKAGON |
+ |
+ |
pobudzenie: - układ adrenergiczny przez receptory β - układ cholinergiczny przez receptory muskarynowe hamowanie: - układ adrenergiczny przez receptory α |
|
aminokwasy cukrotwórcze |
- cholesystokinina - katecholaminy - glukokortykosteroidy - hormon wzrostu |
|
|
- |
- |
|
|
- glukoza - wolne kwasy tłuszczowe - ciała ketonowe |
- insulina - sekretyna - somatostatyna |
|
SOMATOSTATYNA |
wzrasta w okresie po posiłkowym wpływ na wydzielanie ma również pH dwunastnicy |
||
POLIPEPTYD TRZUSTKOWY |
- białka - lipidy i węglowodany (w mniejszym stopniu) |
cholecystokinina |
pobudzenie receptorów muskarynowych |
Oś entero-insulinarna (jelitowo-trzustkowa) - podczas hiperglikemii zachodzi nieenzymatyczna autooksydacja glukozy (brakuje enzymów) powstają związki o charakterze wolnorodnikowym co pobudza trzustkę do tworzenia insuliny
Dwufazowe wydzielanie insuliny:
Mechanizm hamowania wydzielania glukagonu:
|
INSULINA |
GLUKAGON |
węglowodany |
- wzrost dokomórkowego transportu glukozy do komórek mięśniowych i tłuszczowych (przez rekrutację GLU-T4) - aktywacja glikolizy - zahamowanie neoglukogenezy (zużycie białek) i glikogenolizy - aktywacja glikoneogenezy (synteza glikogenu - najwięcej w wątrobie i mięśniach) |
- wzrost glikogenolizy w wątrobie - hamowanie syntezy glikogenu - wzrost glukoneogenezy |
lipidy |
NASILENIE LIPOGENEZY: - aktywacja syntezy kwasów tłuszczowych - aktywacja estryfikacji i reestryfikacji kwasów tłuszczowych HAMOWANIE LIPOLIZY: - hamowanie lipazy triacyloglicerolowej - aktywacja lipazy lipoproteinowej (rozpad triacylogliceroli) |
- aktywacja lipazy triacyloglicerowej (nasilenie lipolizy i uwalniania WKT)
|
białka |
- aktywacja dokomórkowego transportu aminokwasów - nasilenie wewnątrzkomórkowej syntezy białek - hamowanie enzymów neoglukogenezy |
- wzrost glukoneogenezy |
gospodarka mineralna |
aktywacja dokomórkowego transportu fosforanów i potasu |
|
PRZYTARCZYCE
HAMOWANIE |
POBUDZENIE |
- wzrost stężenie Ca2+ oraz Mg2+ - 1,25-(OH)2D3 (hamuje wytwarzanie mRNA dla pre-pro-PTH) |
- wzrost stężenia fosforanów |
HAMOWANIE |
STYMULACJA |
- nadmiar wapnia (powstaje 24,25-(OH)2D3 o mniejszej aktywności metabolicznej) - nadmiar fosforanów (hamowanie aktywności 1-α-hydroksylazy - enzymu potrzebnego do syntezy) |
- prolaktyna (zwiększenie aktywności 1-α-hydroksylazy) - estrogeny (podwyższenie poziomu witaminy D) |
FIZJOLOGIA ROZRODU
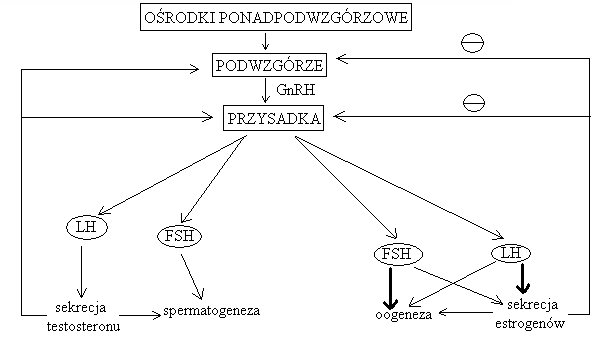
Szczegółowy opis funkcji wyżej wymienionych hormonów w rozdziale o przysadce
Ośrodki ponadpodwzgórzowe:
Łączą się one z podwzgórzem dzięki:
JAJNIK
STERYDY PŁCIOWE
|
CHARAKTERYSTYKA: |
||
estron (E1) |
- mniej aktywny niż E2 (około 8-10 razy) - niewielkie ilości wytwarzane od podstaw w jajniku - podstawowe źródło: konwersja z androsteronu i metabolizm innych estrogenów (np. E2 w wątrobie) |
||
17β-estradiol (E2) |
- główny hormon wieku rozrodczego - pochodzi z komórek ziarnistych (95%) - produkcja wzrasta w okresie owulacyjnym z 2-40 mg/ dobę do 1000 mg/dobę - niewielkie ilości powstają z przekształcenia E1 w tkankach docelowych oraz z aromatyzacjo dehydroizoandrosteronu i testosteronu (poza jajnikiem) |
||
estriol (E3) |
- najsłabszy biologicznie - produkt wątrobowego metabolizmu E1 i E2 - działa cytotropowo w stosunku do zewnętrznych narządów płciowych - nie antyproliferująco (blokuje receptory E1 i E2 w endometrium i sutkach) - jest go znacznie mniej niż E1 i E2 razem wziętych (jak będzie zbyt dużo w stosunku do tych dwóch to jest rak endometrium i sutka) |
||
estetrol |
produkowany w ciąży |
||
DZIAŁANIE ESTROGENÓW |
|||
w obrębie narządów płciowych |
ogólnoustrojowe |
||
- kształtowanie II i III-rzędowych cech płciowych - nasilenie mitoz w endometrium - przyrost masy macicy - zmiany nabłonka pochwy - zwiększenie wydzielania śluzu szyjkowego - pobudzenie wzrostu i kurczliwości nabłonka jajowodu - proliferacja pęcherzyków sutka |
- działanie kościotwórcze (hamowanie IL-6 i nasilenie wydzielania kalcytoniny) - zwiększenie syntezy białek wątrobowych - obniżenie poziomu cholesterolu i frakcji LDL - wpływ na układ krążenia (przez NO, endoteliny i prostaglandyny) |
||
DZIAŁANIE GESTAGENÓW |
|
w obrębie narządu rodnego |
ogólnoustrojowe |
- pobudzenie rozrostu podścieliska i wydzielania gruczołów macicznych - relaksacja, przekrwienie i rozpulchnienie mięśnia macicy - gęsty, nierozciągliwy śluz (nieprzenikalny dla plemników, zwiększający napięcie mięśni szyjki) - zmiany nabłonka pochwy - hamowanie działania prostaglandyn w jajowodzie - zwiększenie czynności wydzielniczej jajowodu - wzrost pęcherzyków gruczołowych w sutku |
- blokowanie aldosteronu (działanie diuretyczne) - obniżenie stężenia aminokwasów - obniżenie działania insuliny - zwiększenie poziomu glikogenu w tkankach - obniżenie napięcia mięśni gładkich układu moczowego i pokarmowego - zwiększenie wydalania wapnia i fosforu - podwyższenie temperatury ciała - działanie antyandrogenne w obrębie skóry |
PEPTYD JAJNIKOWY |
CHARAKTERYSTYKA |
Inhibina |
- produkcja: komórki ziarniste - uwolnienie z pękniętego pęcherzyka Graffa - razem z estrogenami hamuje wydzielanie FSH |
Relaksyna |
- największe stężenie przed miesiączką - zmiękczenie wiązadeł przygotowanie szyjki do porodu - rozwój gruczołu mlekowego - znoszenie czynności skurczowej macicy |
Aktywna |
- działanie parakrynne i autokrynne (p. strona 2) - promocja folikuligenezy - zapobieganie luteinizacji i atrezji pęcherzyków |
Folistyna |
- działanie podobne do inhibiny - nośnik białkowy dla aktywiny |
PRZEŁOMY HORMONALNE W ŻYCIU KOBIETY
REGULACJA ROZRODU U MĘŻCZYZN
FSH = czynność rozrodcza
LH = czynność hormonalna
Testosteron i jego metabolity kontrolują wydzielanie LH
DZIAŁANIE ANDROGENÓW U MĘŻCZYZN |
|
w obrębie narządów płciowych |
ogólnoustrojowo (anabolicznie) |
- różnicowanie przewodów Wolffa - maskulinizacja podwzgórza - dojrzewanie zewnętrznych narządów płciowych - stymulacja wzrostu ciała - powiększenie gardzieli - pogrubienie strun głosowych - powstawanie zarostu i owłosienia - wzmaganie pociągu płciowego i potencji - zachowania agresywne |
- zwiększenie aktywności anabolicznej - stymulacja wzrostu kości - pobudzenie erytropoezy (stymulacja wydzielania erytropoetyny) - zwiększenie stężenia cholesterolu i lipoproteid β - zmniejszenie stężenia lipoproteid α - zwiększenie aktywności gruczołów łojowych |
ELEKTROFIZJOLOGIA KOMÓRKI NERWOWEJ
Pobudliwość - zdolność komórki (nerwowej, mięśniowej) do odpowiedzi na bodziec zmianą elektryczną, czyli własnym potencjałem czynnościowym.
Bodziec - każda zmiana zachodząca w środowisku zewnętrznym lub wewnętrznym ustroju, która wywołuje zmianę właściwości błony komórkowej lub metabolizmu wewnątrzkomórkowego.
Potencjał spoczynkowy - spowodowany nierównomiernym rozmieszczeniem jonów po obu stronach błony komórkowej
Za stan nierównowagi jonowej odpowiadają 3 czynniki:
ad. 2)
POMPA SODOWO-POTASOWA:
ad. 3)
KANAŁY JONOWE możemy podzielić ze względu na rodzaj czynnika otwierającego (aktywizującego) dany kanał:
Ponadto kanały jonowe możemy podzielić na:
Najbardziej typowe kanały jonowe:
Przenoszony jon |
SZYBKI / WOLNY |
Kierunek transportu |
Bramkowanie |
Na+ |
szybki |
dokomórkowy |
elektryczne (faza depolaryzacji)
|
Ca2+ |
wolny |
|
|
K+
|
szybki |
odkomórkowy |
|
|
wolny |
dokomórkowy |
elektryczne |
|
wolny |
dokomórkowy |
elektryczne |
|
|
odkomórkowy |
elektryczne i chemiczne (cytoplazma-tyczny Ca2+ |
Cl - |
|
|
elektryczne (faza hiperpolaryzacji) |
|
|
|
chemiczne (cytoplazmatyczny Ca2+) |
Depolaryzacja komórki przez bodźce podprogowe jest możliwa:
Powstanie potencjału czynnościowego (trwa 3 - 7 ms)
Potencjał w receptorze zmysłowym:
Cechy potencjału czynnościowego:
Potencjał błonowy |
Potencjał postsynaptyczny |
,,wszystko albo nic” - niezależny od siły bodźca |
Zależny od siły bodźca (ilości wydzielonego transmitera) - nie obowiązuje „wszystko albo nic” sumujący się w czasie i w przestrzeni |
Następująca po sobie aktywacja sodowa i potem potasowa |
Jednoczesny wzrost przepuszczalności dla obu jonów |
Zdolność do rozprzestrzeniania się bez dekrementu (bez strat, zmiany wielkości) |
Rozprzestrzenienie lokalne, z dekrementem |
Refrakcja - niepobudliwość komórki nerwowej na działające na nią bodźce, niezależnie od ich wielkości wywołane przez inaktywację sodową, a w konsekwencji niemożność napływu jonów Na+ do wnętrza komórki (nie może zajść depolaryzacja)
Refrakcja bezwzględna
Refrakcja względna
Szybkość przenoszenia informacji w układzie nerwowym zależy od:
ad. a)
Grupy aksonów:
SYNAPSY
ODRUCHY
Odruch - podstawowa forma działania układu nerwowego, reakcja efektora na pobudzenie receptora zachodząca za pośrednictwem OUN
Łuk odruchowy - strukturalne podłoże odruchu, droga, którą musi pokonać bodziec:
Odruchy włókienkowe - w obrębie 1 neuronu; neuron spełnia rolę ośrodka 1 włókno - stanowi drogę dośrodkową, a kolejne - drogę odśrodkową
Rodzaje odruchów:
d) warunkowe:
Bodziec wzmocnienie reakcja (wzmacniamy bodziec)
Bodziec reakcja wzmocnienie (wzmacniamy reakcję)
ODRUCHY BEZWARUNKOWE |
ODRUCHY WARUNKOWE |
Wrodzone, właściwe dla danego gatunku |
Nabyte, są podstawą procesów uczenia się |
Ich łuki odruchowe zamykają się w trakcie życia płodowego |
Łuki odruchowe powstają w trakcie rozwoju osobniczego w procesie warunkowania |
Niezmienne |
Zmienne, plastyczne |
Łuki odruchowe zamykają się na poziomie: - rdzenia kręgowego - pnia mózgu |
Łuki odruchowe zamykają się na poziomie: - tworu siatkowatego - jąder nieswoistych wzgórza - pól kojarzeniowych kory mózgowej |
Hamowanie (wygasanie) odruchów warunkowych:
UKŁAD AUTONOMICZNY
Cecha porównywana |
układ somatyczny |
układ autonomiczny |
pochodzenie bodźców |
środowisko zewnętrzne |
środowisko wewnętrzne |
kierunek reakcji na bodziec |
na zewnątrz |
do wewnątrz |
kontrola |
świadoma |
nieświadoma (OUN) |
funkcje |
kierowanie ruchem utrzymywanie postawy ciała |
- utrzymywanie homeostazy (integralna część osi psycho-neuro-immunohormonalnej) - adaptacja układu do odchyleń - wyrażanie emocji |
efektory |
mięśnie szkieletowe |
- mięśnie gładkie - mięsień serca i układ krążenia - gruczoły - tkanka nerwowa - tkanka tłuszczowa |
Ośrodkowa kontrola AUN (integracja na poziomie kory i podwzgórza):
NARZĄD |
ZAKRES KONTROLI |
rdzeń kręgowy |
reakcje lokalne (np. perystaltyka układu pokarmowego, temperatura, wydzielanie potu, wydalanie) - działa na zasadzie krótkich łuków odruchowych |
pień mózgu |
funkcje życiowe w chwili obecnej (ciśnienie krwi, przewód pokarmowy: połykanie, wymioty, wydzielanie śliny; częstość oddechów itd.) |
podwzgórze |
termoregulacja (przednia część odpowiedzialna jest za przegrzanie np. pocenie się, tylna za zbyt niską temperaturę np. drżenie) spadek ciśnienia krwi |
kora mózgowa |
stany emocjonalne - wyrażanie emocji - wpływa na czynności układu oddechowego (przyspieszony oddech), krążeniowego (bladość, rumieniec) |
Cechy charakterystyczne AUN:
Czynność AUN:
Struktury AUN:
Cecha porównywana |
Część współczulna |
Część przywspółczulna |
położenie neuronów |
słupy pośrednioboczne istoty szarej rdzenia kręgowego (Th1 - L3) |
odcinek głowowy rdzenia (jądra nerwów czaszkowych: III, VII, IX i X) oraz odcinek krzyżowy (S1 - S3) - w pniu mózgu i moście |
włókna przedzwojowe |
krótkie, zmielinizowane, cienkie, transmiter: Ach |
długie i grube; transmiter: Ach |
włókna zazwojowe |
cienkie, bez osłonek, długie, transmitery: - Ach (tylko gruczoły potowe bez rąk i naczynia krwionośne mięśni szkieletowych), - NA, A, - histamina (żołądek, jelita) - dopamina (nerka) |
krótkie, grube, niezmielinizowane transmiter: Ach (głównie), NO (odpowiedź NANC - non-adrenergic, non-cholinergic) CO |
kotransmitery |
NPY (neuropeptyd Y) ATP |
VIP, PHI (peptyd histydyno-leucynowy) w przewodzie pokarmowym: gastryna, enkefaliny, ATP, substancja P, CCK w odcinku krzyżowym: serotonina, VIP, ATP, enkefaliny
|
położenie zwojów |
przy rdzeniu kręgowym |
blisko unerwianego narządu a nawet w jego wnętrzu |
stosunek włókien |
1:20 (przedzwojowy : zazwojowy) |
1:1 |
odpowiedź |
powolna, długotrwała (ze względu na transmisję pojemnościową = dyfuzję transmitera na dużym obszarze) mało precyzyjna |
względnie szybka, precyzyjna |
splot podstawny i żylakowatości |
są (splot jest wytwarzany przez akson w pobliżu efektora) |
nie ma |
funkcja |
rola ergotropowa - pobudzenie układów krążenia i oddechowego - mobilizacja zapasów energetycznych (zwiększenie stężenia WKT i glukozy) - dominacja katabolizmu i wzmożonego wydatku energii (podczas stresu, wysiłku) - wzmożona aktywność podczas stresu i wysiłku |
rola trofotropowa - hamowanie czynności układu krążenia - pobudzenie trawienia, wchłaniania i wydalania - ułatwienie depozytu substratów energetycznych - dominacja anabolizmu - ułatwienie podtrzymania gatunku (NO odpowiedzialny za erekcję) - pobudzenie po posiłku (mechanizm sjesty) |
Część współczulna i przywspółczulna działają naprzemiennie zgodnie z rytmem dobowym:
Organ / narząd |
Część współczulna |
Część przywspółczulna |
źrenica |
rozszerzenie |
zwężenie (z mózgu) |
ślinianki |
hamowanie wydzielania śliny |
pobudzenie wydzielania śliny (rdzeń przedłużony) |
serce |
przyspieszenie czynności |
spowolnienie czynności (nerw błędny) |
oskrzela |
rozkurcz |
skurcz (nerw błędny) |
układ pokarmowy |
hamowanie perystaltyki i wydzielania (splot słoneczny) |
pobudzenie perystaltyki i wydzielania (nerw błędny) |
wątroba |
przemiana glikogenu do glukozy (splot słoneczny) |
pobudzenie wydzielania żółci (nerw błędny) |
pęcherz moczowy |
rozkurcz mięśni gładkich |
skurcz mięśni gładkich (część krzyżowa RK) |
nerka |
wydzielanie A i NA |
--------- |
CZĘŚĆ JELITOWA
WŁÓKNA TRZEWNO-CZUCIOWE
KOTRANSMISJA - ten sam neuron może produkować i uwalniać więcej niż 1 neuroprzekaźnik. Obok głównego neurotrasmitera wydzielane są kotransmitery (z pęcherzyków małych) i/lub neuromodulatory (z pęcherzyków dużych)
Część przywspółczulna |
obok Ach |
VIP (wazoaktywny peptyd jelitowy) NO PHI (peptyd histydyno-leucynowy) |
|
w przewodzie pokarmowym |
ATP, enkefaliny, substancja P, gastryna, CCK (cholecystokinina), GRP (peptyd uwalniający gastrynę) |
|
w części krzyżowej |
serotonina, VIP, ATP, enkefaliny |
Część współczulna |
obok NA, Ach i histaminy |
ATP (wytrysk nasienia), NPY (neuropeptyd Y - przebudowa ścian naczyń) |
|
obok Ach w włóknach przedzwojowych |
dopamina, substancja P, ENK-L (enkefalina leucynowa), peptyd podobny do LH-RH |
Histamina również jest przekaźnikiem w układzie współczulnym
CZYNNOŚĆ ZWOJÓW AUTONOMICZNYCH
I FAZA - szybka (fEPSP)
II FAZA - hamowanie (IPSP)
III FAZA - wolna (sEPSP)
IV FAZA - bardzo wolna (ssEPSP)
PRZENIESIENIE INFORMACJI DO WNĘTRZA KOMÓRKI:
I FAZA - neurotransmiter T przyłącza się do receptora R na zewnętrz błony komórkowej (kompleks T+R)
II FAZA - transdukcja - przeniesienie informacji do wnętrza komórki; do kompleksu T+R przyłącza się Gi (białko regulatorowe hamujące) lub Gs (białko pobudzające). Do kompleksy T+R+G przyłącza się GTP
III FAZA - uruchomienie cyklu II przekaźnika przez kompleks T+R+G+GTP
PODZIAŁ RECEPTORÓW BŁONOWYCH ze względu na rodzaj transmitera
Receptor |
Transmiter |
Agonista |
Antagonista |
II przekaźnik |
Lokalizacja |
N |
Ach |
nikotyna |
atropina heksametonium (w AUN) kurara (w płytce motorycznej) |
brak |
zwoje autonomiczne, płytki motoryczne, rdzeń nadnerczy |
M1 |
|
muskaryna i oksytremo-ryna (dla M2) |
pirenzepina, telenzepina, atropina |
cykl fosfatydylo-inozytolu |
komórki błony śluzowej żołądka, mózg, bł. postsynaptyczna |
M2 |
|
|
skopolamina, atropina |
układ cAMP (hamowany przez Gi) |
drzewo oskrzelowe i serce, bł presynaptyczna |
M3 |
|
|
|
cykl fosfaty |
gruczoły łzowe |
M4 |
|
|
|
układ cAMP |
OUN, trzustka |
Receptor |
Transmiter |
Agonista |
Antagonista |
II przekaźnik |
Lokalizacja |
α1 |
noradrenalina > adrenalina > izoprenalina |
fenylefryna |
doksazosyna prazosyna fentoamina |
układ fosfaty |
błony postsynaptyczne |
α2 |
|
klonidyna lofekrydyna |
prazosyna johimbina |
układ cAMP (hamuje) |
błony presynapt. (i post. w komórkach tucznych) |
β1 |
izoprenalina > adrenalina = noradrenalina (nie do β2) |
ksamoterol |
propanolol praktolol |
układ cAMP |
serce (pobudzenie) |
β2 |
|
prokaterol |
propanolol atenolol |
układ cAMP |
oskrzela (rozszerzenie) |
Dopamina łączy się z receptorami dopaminergicznymi (D1 - D5) oraz α1 i β1. Działa na zwoje autonomiczne i OUN
PODZIAŁ RECEPTORÓW ze względu na układ drugiego przekaźnika
A) mechanizm działania receptoru:
PODZIAŁ RECEPTORÓW ze względu na efekty wywołane w komórce:
INTERNALIZACJA - proces wymiany receptorów - jeden zapada się do wnętrza komórki na drodze endocytozy, a na jego miejscu powstaje (jest eksponowany) nowy.
NADWRAŻLIWOŚĆ WCZESNA - po 2-3 dniach od przerwania włókna - niesprawne zakończenia nerwowe nie mogą wychwycić transmitera (brak wychwytu neuronalnego) wydziela się mniej transmitera, ale nie ma jego degradacji i stężenie obok komórki jest wysokie
NADWRAŻLIWOŚĆ PÓŹNA - po 2-3 tygodniach od przerwania włókna - wynika ze zwiększenia się liczby receptorów (bo było mało transmitera - up regulation)
ANTAGONIZM WSPÓŁCZULNY vs. PRZYWSPÓŁCZULNY:
ODRUCHY AUTONOMICZNE:
ZABURZENIA FUNKCJI AUN:
OŚRODKOWY UKŁAD NERWOWY
WYŻSZE FUNKCJE OUN
ZACHOWANIE SIĘ CZŁOWIEKA:
U zwierząt na wysokim poziomie rozwoju filogenetycznego (także u człowieka wykształciły się 2 mechanizmy kierujące ich aktywnością somatyczną, czyli zachowaniem:
Ośrodki motywacyjne podwzgórza - bezpośrednio kontrolowane przez układ limbiczny i twór siatkowaty wstępujący (RAS).
Nadrzędna kontrola należy do kory mózgu (kora nowa) - kora się stara ale nie zawsze jej wychodzi.
Pierwsze 3 mają zapewnić przeżycie organizmu.
Ośrodek sytości - jądra brzuszno-przyśrodkowe podwzgórza - zniszczenie tych jąder wywołuje wzrost łaknienia.
Ośrodek głodu - jądra boczne podwzgórza, zniszczenie powoduje zanik łaknienia.
Długotrwała regulacja ośrodka pokarmowego:
OŚRODEK PRAGNIENIA - skupisko neuronów w podwzgórzu, które pobudzone:
Czynnikiem pobudzającym jest:
Ośrodek pragnienia sprzężony jest z ośrodkami termoregulacji oraz sytości i głodu.
Pobudzony ośrodek termoregulacji pobudza ośrodek pragnienia, hamuje ośrodek głodu.
OŚRODEK ROZRODCZY (męski i żeński) - różnicowanie następuje w okresie życia płodowego.
Ośrodek męski - wykształca się pod wpływem testosteronu produkowanego przez jądra płodu, w efekcie od okresu dojrzewania płciowego, acyklicznie (tonicznie) pobudzane jest podwzgórze do wydzielania GnRH, a w konsekwencji LH oraz FSH. Wyzwala także popęd płciowy skierowany ku płci żeńskiej.
Ośrodek żeński - powstaje pod nieobecność testosteronu - wyzwala popęd skierowany ku płci męskiej. Działa cyklicznie - powoduje periodyczne wydzielanie GnRH pod którego wpływem skokowo rośnie wydzielanie („pik”) LH i występuje owulacja.
OŚRODEK AGRESJI I UCIECZKI
Nieznana dokładna lokalizacja ośrodka.
Zniszczenie jądra migdałowatego znosi reakcję agresji. Ciało migdałowate działa na ośrodki podwzgórza:
a) zwiększając wydzielanie ADH, GH
b) hamuje wydzielanie gonadotropin (pokwitanie)
Warunkiem agresji lub ucieczki jest zachowanie łączności podwzgórza z pniem mózgu
UKŁAD LIMBICZNY (filogenetycznie bardzo stary)
PAMIĘĆ - w procesie uczenia się biorą udział dwa podstawowe mechanizmy zapamiętywania:
Pola kojarzeniowe kory mózgu - przeważający obszar kory mózgu, nie ma ściśle przypisanych funkcji dlatego są określane miałem pól kojarzeniowych (asocjacyjnych). Wyróżniamy 3 okolice:
Okolica potyliczno-ciemieniowo-skroniowa
Okolica ta ma liczne połączenia z poduszką wzgórza z którą łączą się korowe pola czuciowe, wzrokowe (ośrodek Broca) i słuchowe, pola ruchowe dla mięśni biorących udział w artykulacji dźwięków oraz mięśni wykonujących ruchy pisarskie, ośrodki słuchowy, wzrokowy i mowy.
Uszkodzenie poduszki wzgórza wywołuje:
UKŁAD SIATKOWATY WSTĘPUJĄCY:
Przewodzenie informacji przez drogi swoiste jest zachowane we śnie a nawet w narkozie. Środki narkotyczne znoszą przewodzenie drogami nieswoistymi. W konsekwencji znoszone jest czucie, na tym polega działanie przeciwbólowe znieczulenia ogólnego.
Zablokowanie lub zniszczenie układu siatkowatego prowadzi do trwałej utraty przytomności (śpiączka).
Procesy synchronizacji i desynchronizacji w OUN
b) desynchronizacja:
Elektroencefalografia (EEG) - polega na rejestrowaniu fal elektrycznych mózgu.
Rodzaje fal elektrycznych mózgu:
Rodzaj fal |
Występowanie |
Częstotliwość |
Amplituda |
α |
okolica ciemieniowo-potyliczna u czuwającego pacjenta z zamkniętymi oczami |
8 - 3 Hz |
30-100 μV |
β |
okolica czołowa u czuwającego pacjenta z otwartymi oczami |
14-60 Hz |
> 30 μV |
θ |
sen głęboki (fizjologiczny lub patologiczny) |
4 - 7 Hz |
do 100 μV |
δ |
|
0,5 - 4 Hz |
do 200 μV |
Sen fizjologiczny (dobowy)
Sen fizjologiczny dzielimy na dwie fazy:
Jeden cykl snu trwa około 90 minut średnio. Potrzebujemy od 4-6 cykli (6-9 godzin)
Sny patologiczne - znaczna redukcja metabolizmu mózgu:
Wyszukiwarka
Podobne podstrony:
fizjo - wyk+éady, Leśnictwo UP POZNAŃ 2013, Fizjologia roślin drzewiastych
fizjo - wyk+éady, Leśnictwo UP POZNAŃ 2013, Fizjologia roślin drzewiastych
wyk ady z etyki 1 5 internet
ZPKB wyk ady AK
DI Wyk ady (prof K Marcinek) [2006 2007]
Analiza i przetwarzanie obraz w W.1, !!!Uczelnia, wsti, materialy, III SEM, Wyk ady
biologia wyk-ady sem 3, Ochrona środowiska, OŚ POLSL, INŻ, SEM. 3, Biologia, Wykłady
egz wyk+éady, Filozofia, Rok IV, polityczna, Materiał
GiH wyk ady
WYK ADY Z C, WYK AD7, GRAFIKA
WYK ADY Z C, WYK AD6, PLIKI:
Fizjologia wyk-ad 4-5, Turystyka i rekreacja wykłady, Fizjologia pracy i wypoczynku
Fizjologia wyk-ad 1-3, Turystyka i rekreacja wykłady, Fizjologia pracy i wypoczynku
PM wyk ady 4 rok JM choroby odtytoniowe
WYK ADY FILOZOFIA, INNE KIERUNKI, filozofia
więcej podobnych podstron