SPEKTROFOTOMETRIA ABSORPCYJNA W ŚWIETLE WIDZIALNYM (VIS) I W NADFIOLECIE (UV)
Ćwiczenie S-3
Oznaczanie kwasu pikrynowego
Kwas pikrynowy wykazuje różne pasma absorpcji w zakresie UV, o zmiennych intensywnościach i położeniach, zależnych od użytego rozpuszczalnika.
W cząsteczce kwasu pikrynowego występują trzy chromofory w postaci grup nitrowych i chromofor benzenowy. Absorpcja tych ugrupowań i ich oddziaływanie z grupą hydroksylową składają się na ostateczny kształt widma U V kwasu pikrynowego.
OH
NO2
O2N
NO2
Odczynniki i aparatura
Roztwór podstawowy kwasu pikrynowego o stężeniu 0,1 mg/cm3:
0,0100 g kwasu pikrynowego rozpuścić w 50 cm3 etanolu i uzupełnić wodą w kolbie
miarowej do objętości 100 cm3.
Roztwory wzorcowe. Do kolbek o pojemności 50 cm3 przeniosłem kolejno następujące ilości roztworu podstawowego: 0,1; l; 5; 10; 12; 15 cm3, uzupełniłem wodą do 50 cm3 i wymieszać. Tak przygotowane roztwory zawierają 0,01; 0,1; 0,5; 1,0; 1,2; 1,5 mg kwasu pikrynowego w 50 cm3.
Spektrofotometr SPEKOL 11.
Wykonanie ćwiczenia
Zmierzyłem absorbancję roztworu wzorcowego zawierającego 1,0 mg kwasu w 50 cm3 w zakresie 330—380 nm co 5 nm (wyznaczanie λmax). Następnie zmierzyłem absorbancję roztworów wzorcowych przy λmax stosując jako odnośnik wodę oraz zmierzyłem analogicznie absorbancję otrzymanej do analizy próbki.
Wyniki pomiarów
Wyniki pomiarów absorbancji roztworu wzorcowego zawierającego 1 mg kwasu w 50 cm3 w zakresie 330-380 nm:
λ [nm] |
A |
|
|
330 |
0,561 |
335 |
0,739 |
340 |
0,853 |
345 |
0,930 |
350 |
0,972 |
355 |
0,986 |
360 |
0,976 |
365 |
0,948 |
370 |
0,907 |
375 |
0,860 |
380 |
0,816 |
Z powyższych pomiarów wynika i skutecznie potwierdza wykres, że największa absorbancja występuje przy długości fali 335 nm, dlatego przy takim λ dokonano pozostałych pomiarów.
Wyniki pomiarów absorbancji roztworów wzorcowych przy długości fali 355 nm:
C [mg/50cm3] |
A |
|
|
0,01 |
0,002 |
0,10 |
0,082 |
0,50 |
0,470 |
1,00 |
0,956 |
1,20 |
1,158 |
1,50 |
1,415 |
Próba nr 1 |
0,261 |
Z równania prostej wyliczam
stężenie próby nr 1:
A= 0,9592C - 0,0085
Wyniki oznaczenia:
A= 0,261
C= 0,281 [mg/ 50cm3]
Wnioski
Przeprowadzone doświadczenie pozwoliło na wyznaczenie stężenia kwasu pikrynowego na podstawie krzywej wzorcowej A=f(C) i wynosi 0,281 mg/50 cm3. Na wykresie praktycznie nie występuje odchylenie wyników pomiarów, co wskazuję, że wyniki są niemal idealne, potwierdza to również liniowa funkcja regresji, która jest zbliżona do 1 i wynosi 0,9997.
Ćwiczenie S-8
Oznaczanie Fe2+ w postaci kompleksu z O-fenantroliną (1,10-fenantrolina)
O-fenantrolina jest zasadą organiczną, która z jonami Fe2+ w szerokim zakresie pH tworzy barwny pomarańczowo-czerwony elektrododatni kompleks, stanowiący podstawę do oznaczania żelaza w roztworze wodnym.
Wzór kompleksu Fe2+z o-fenantroliną ma następującą postać:
2+
Za pomocą o-fenantroliny można oznaczać Fe2+, a także Fe3+ po redukcji do Fe2+ za pomocą kwasu askorbinowego w środowisku o pH=1 lub za pomocą hydroksyloaminy w środowisku o pH=3-4. Reakcję kompleksowania przeprowadza się w środowisku buforu octanowego lub cytrynianowego.
Odczynniki i aparatura
Roztwór podstawowy Fe3+: odważkę 0,8635 g ałunu żelazowo-amonowego NH4Fe(SO4)2·12 H2O rozpuścić w wodzie z dodatkiem 5 cm3 stężonego kwasu siarkowego i rozcieńczyć wodą destylowaną do kreski w kolbie miarowej o pojemności 1 dm3. W 1 cm3 tego roztworu znajduje się 0,1 mg Fe3+.
0,25% roztwór o-fenantroliny w HCl o stężeniu 0,1 mol/dm3.
10% roztwór wodny cytrynianu sodowego.
10% roztwór wodny chlorowodorku hydroksyloaminy, świeżo przygotowany.
Spektrofotometr SPEKOL 11.
Wykonanie ćwiczenia
Roztwory wzorcowe przygotowałem w następujący sposób: do ośmiu kolb miarowych o pojemności 50 cm3 odmierzyłempipetą miarową 0,00 (ślepa próba- roztwór odniesienia) 0,20; 0,40; 0,60; 0,80; 1,00; 1,50; 2,00 cm3 podstawowego roztworu żelaza o zawartości 0,1 mg/cm3 Fe3+. Do wszystkich kolb dodać po 2 cm3 10% roztworu chlorowodorku hydroksyloaminy, po 5 cm3 10% roztworu cytrynianu sodu i po 5 cm3 0,25% roztworu o-fenantroliny, uzupełniłem wodą do kreski. Tak przygotowane roztwory zawierają 0,0; 0,4; 0,8; 1,2; 1,6; 2,0; 3,0; 4,0 μg/cm3 Fe2+/cm3.
Ustalenie analitycznej długości fali wykonano sporządzając wykres zależności A=f(λ). W tym celu dokonano pomiaru absorbancji dowolnego roztworu wzorcowego w zakresie 440-600 nm, zmieniając długość fali co 10nm. Odnośnikiem w pomiarach jest roztwór „zerowy” (ślepa próba), a pomiary wykonuje się po 10 minutach od dodania wszystkich odczynników. Jako analityczną długość fali przyjęto maksimum krzywej absorpcji.
Pomiar absorbancji roztworów wzorcowych wykonano przy λmax i przy zastosowaniu ślepej próby jako roztworu odniesienia czyli wody.
Oznaczanie stężenia Fe2+ w wodzie. Z otrzymanej do analizy próbki wody pobrano sześć równych prób o objętości 2 cm3 każda i przeniesiono do kolbek miarowych o pojemności 50 cm3. Następnie dodano do tych próbek wszystkie odczynniki, w ilościach i kolejności jak podczas przygotowania roztworów wzorcowych. Zmierzyono absorbancję roztworów badanych, w tych samych warunkach jak roztworów wzorcowych.
Wyniki pomiarów
Korzystając z wydruku komputerowego odczytałem największą absorbancję, która występuje przy długości fali 512 nm, zmierzoną dla dowolnego roztworu wzorcowego i odnośnika, którym był roztwór zerowy (krzywa adsorpcji jest dołączona).
Wyniki pomiarów absorbancji roztworów wzorcowych przy długości fali 512 nm:
C [μg/cm3] |
A |
|
|
0,4 |
0,145 |
0,8 |
0,292 |
1,2 |
0,415 |
1,6 |
0,563 |
2,0 |
0,711 |
3,0 |
0,954 |
4,0 |
1,292 |
Z równania prostej wyliczam
stężenia prób:
A= 0,313C + 0,0432
Lp |
A |
C |
|
|
|
1 |
0,538 |
1,581 |
2 |
0,506 |
1,478 |
3 |
0,536 |
1,574 |
4 |
0,521 |
1,526 |
5 |
0,530 |
1,555 |
6 |
0,520 |
1,523 |
|
Cśr= |
1,540 |
H
Wariancja V: 1,46E-03
Odchylenie standardowe S: 3,83E-02
Odchylenie standardowe średniej Sx: 1,56E-02
Względne odchylenie średniej Sr: 1,01E-02
Przedział ufności: 1,540+/-0,0401 [μg/cm3]
Dyskusja błędów
Średnia arytmetyczna zbiorowości próbnej
![]()
![]()
Wariancja zbiorowości próbnej
; n -1= k - liczba stopni swobody
![]()
=(1,581-1,54)2+(1,478-1,54)2+(1,574-1,54)2+(1,526-1,54)2+(1,555-1,54)2+(1,523-1,54)2/5=![]()
Odchylenie standardowe pojedynczego wyniku
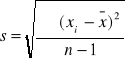
![]()
Odchylenie standardowe średniej arytmetycznej
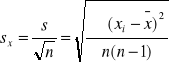
![]()
Względne odchylenie standardowe
![]()
![]()
- Wynik sprzeczny z wydrukiem komputerowym.
Nie wiadomo, czym jest spowodowana ta zmienność.
Przedział ufności:
95% dla k = 5 tstudenta = 2,571
![]()
[ ]
![]()
[μg/cm3]
Wnioski
Przeprowadzone doświadczenie pozwoliło na określenie zawartości jonów Fe2+ w badanej wodzie na podstawie krzywej wzorcowej A=f(C) i wynosi 1,540+/-0,0401 [μg/cm3]. Na wykresie praktycznie nie występuje odchylenie wyników pomiarów, co wskazuję, że wyniki są niemal idealne, potwierdza to również liniowa funkcja regresji, która jest zbliżona do 1 i wynosi 0,9997.
Wyszukiwarka
Podobne podstrony:
konduktometria, SPEKTROFOTOMETRIA ABSORPCYJNA W ŚWIETLE WIDZIALNYM (VIS) I W NADFIOLECIE (UV)
SPEKTROFOTOMETRIA ABSORPCYJNA W ŚWIETLE WIDZIALNYMpat, Chemia 1
1 Absorpcjometria w świetle widzialnym
Spektrofotometria w swietle widzialnym
Sprawozdania, Spektrofotometria absorpcyjna, Spektrofotometria absorpcyjna
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
UV-vis, ZAKRESY UV- PRÓŻNIOWY (DALEKI) 100-200 nm 100000-50000 CM-1 UV-KWARCOWY (WŁAŚCIWY) 200-380 n
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
UV-vis, ZAKRESY UV- PRÓŻNIOWY (DALEKI) 100-200 nm 100000-50000 CM-1 UV-KWARCOWY (WŁAŚCIWY) 200-380 n
biofizyka-PROMIENIOWANIE NADFIOLETOWE UV, PROMIENIOWANIE NADFIOLETOWE UV (ultrafioletowe)
05 Spektrofotometria absorpcyjna (kolorymetria)
sprawozdanie Spektroskopia absorpcyjna w podczerwieni, spektroskopia
PROMIENIOWANIE NADFIOLETOWE UV, fizykoterapia(2)
CW2 3, POMIAR EFEKTÓW PODSTAWNIKOWYCH METODĄ SPEKTROSKOPII ABSORPCYJNEJ W PODCZERWIENI
testy chemia, pat sciąga chemia zerówka, II Spektrofotometria absorpcyjna
ATOMOWA SPEKTROFOTOMETRIA ABSORPCYJNA, Analiza Instrumentalna
Spektroskopia absorpcyjna
więcej podobnych podstron