Wanat Karol
I ED
Ćwiczenie nr 23
Sprawdzanie praw elektrolizy Faradaya
I. Zagadnienia do samodzielnego opracowania:
Przepływ prądu przez elektrolity.
Pierwsze i drugie prawo Faradaya.
Podstawy teoretyczne.
Atomy niektórych pierwiastków mają takie właściwości, że przy zbliżaniu się do atomów innego pierwiastka mogą mu oddać jeden lub kilka elektronów. Wskutek tego z obojętnych elektrycznie atomów powstają jony, przy czym jedne z nich, a mianowicie te, które oddały elektron lub elektrony i pozostały z nadmiarem ładunku dodatniego są naładowane elektrycznie dodatnio, a te które je przejęły, są naładowane ujemnie. Równocześnie między jonami wystąpi przyciąganie elektryczne, wiążące je w cząsteczkę związku.
W roztworach wodnych dysocjacji elektrolityczne ulegają: kwasy, zasady i sole, przy czym tworzące się jony wodoru i metali są dodatnie (kationy), jony zaś grupy wodorotlenowej OH lub reszty kwasowej (np. Cl-, NO3-) - ujemne (aniony).
Stosunek liczby cząstek ulegających dysocjacji, do całkowitej liczby cząstek zawartych w roztworze nazywamy stopniem dysocjacji elektrolitu, przy czym jego wartość wzrasta ze stopniem temperatury i maleje ze wzrostem stężenia roztworu. Zjawisko dysocjacji występuje również po stopieniu związku jonowego.
Po wprowadzeniu do elektrolitu CuSO4 płyt metalowych (elektrod) i podłączeniu ich ze źródłem napięcia rozpoczyna się, pod wpływem wytworzonego pola elektrycznego, uporządkowany ruch jonów. Jony ujemne (SO4- -) poruszają się z niewielką prędkością w kierunku dodatnio naładowanej elektrody, zwanej anodą A, dodatnie zaś (Cu- -) w kierunku ujemnie naładowanej elektrody, zwanej katodą K. Ponieważ jony są - podobnie jak elektrony w metalach - nośnikami ładunków elementarnych, zatem ich uporządkowany ruch jest równoznaczny z przepływem prądu elektrycznego.
II. Wykonanie ćwiczenia.
Przyrządy: analityczna waga laboratoryjna, elektrody miedziowe z zamocowaniem, amperomierz, zasilacz, sekundomierz.
Połączyłem obwód według schematu:
Sprawdziłem poprawność obwodu elektrycznego zamykając obwód na krótki czas. Równocześnie regulowałem natężenie prądu w obwodzie, tak by nie przekraczał 0,5A/dm2. Natężenie prądu wyznaczyłem w oparciu o powierzchnię elektrody.
Wyjąłem katodę, oczyściłem starannie papierem ściernym, wypłukałem wodą. Wyznaczyłem masę m1 katody korzystając z analitycznej wagi laboratoryjnej.
Umieściłem ponownie katodę w elektrolicie, włączyłem prąd uruchamiając jednocześnie zegar. Utrzymałem stałą wartość natężenia prądu przez czas t = 30 minut.
Po upływie tego czasu przerwałem przepływ prądu. Opłukałem katodę wodą, osuszyłem i wyznaczyłem masę m2 katody. Masę wydzielonej miedzi obliczyłem ze wzoru m = m2 - m1. Przekształcając wzór m = k I t obliczyłem równoważnik elektrochemiczny miedzi.
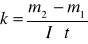
Z układu okresowego pierwiastków odczytałem masę atomową miedzi mCu, wartościowość miedzi w = 2 i ze wzoru wyrażającego II prawo Faradaya obliczyłem stałą Faradaya:
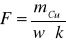
Wyniki umieściłem w tabelce:
I |
m1 |
t |
m2 |
m. |
k |
k±Δk |
F |
F±ΔF |
[ mA ] |
[ kg ] |
[ s ] |
[ kg ] |
[ kg ] |
|
|
[ C ] |
[ C ] |
200 |
0,050499 |
1800 |
0,050627 |
0,000128 |
0,0355•10-5 |
0,0355 ± 0,26664•10-5 |
89296875 |
89296875 ± 716475,5 |
Δm = Δm1 = Δm2 = 0,000001kg
ΔI = ± 1,5 mA (zakres - 300; klasa - 0,5)
Δt = ± 2s
mCu =63,5
![]()
![]()
![]()
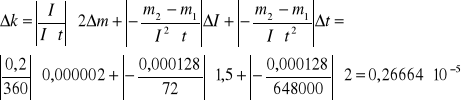
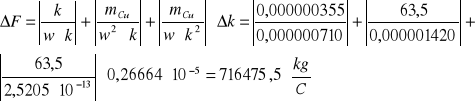
![]()
%![]()
%![]()
%
![]()
%![]()
%![]()
%
Wanat Karol.
CuSO4
CuSO4
CuSO4
Cu
SO4
SO4
Cu
Cu
SO4
K
A
CuSO4
A
B
mA
+
-
mA
Wyszukiwarka
Podobne podstrony:
Badanie praw elektrolizy Faraday’a, Akademia Morska, Fizyka lab
Badanie wzmacniacza szerokopasmowego, Ćwiczenie nr 23: -Badanie tranzystora bipolarnego -
ĆWICZENIE23, ĆWICZENIE NR 23
Podstaw wzm tranzyst, Ćwiczenie nr 23: -Badanie tranzystora bipolarnego -
Ćwiczenie nr 23(1)
23, Sprawozdanie z ćwiczenia nr 23
instrukcja do cwiczenia nr 23 i Nieznany
Ćwiczenie nr 23
0105 23 03 2009, cwiczenia nr 5 , Jąderko, budowa, funkcja, upakowanie DNA w chromosomy, metody bad
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
Ćwiczenie nr 1. Badanie diody część 1, Semestr 4, Elektronika, Laboratorium
InstrukcjeĆw.2009 2010, Cw.1.E-01. Badanie właściwości elektrycznych kondensatora płaskiego, Laborat
sprawko 9 elektronika sem4, Sprawozdanie z przeprowadzonego ćwiczenia nr 9 -
sprawdzone, Fiz 04a, ĆWICZENIE NR 4
sprawko 9 elektronika sem4, Sprawozdanie z przeprowadzonego ćwiczenia nr 9 -
sprawdzone, Fiz 04a, ĆWICZENIE NR 4
Cwiczenie NR 3 Sprawdziany 2015
więcej podobnych podstron