
Katedra Chemii Nieorganicznej, Wydział Chemiczny, Politechnika Gdańska
REAKCJE UTLENIANIA - REDUKCJI
Materiały dodatkowe do Ćwiczeń rachunkowych z Chemii Nieorganicznej
przygotowała: Anna Kropidłowska
Reakcjami utlenienia i redukcji (oksydacyjno-redukcyjnymi), inaczej mówiąc reakcjami
red-oks, nazywamy reakcje chemiczne, które przebiegają ze zmianą stopnia utlenienia
reagujących indywiduów chemicznych (jonów, atomów). Zmiana stopnia utlenienia wiąże się
z pobraniem lub oddaniem elektronów przez atom. Ze względu, że atom musi pobrać elektrony
od innego atomu, lub oddać elektrony innemu atomowi, proces utlenienia nieodłącznie wiąże
się z procesem redukcji, czyli obydwie te reakcje są zawsze ze sobą sprzężone. Reakcje
redoks mogą zachodzić na elektrodach, które dostarczają elektronów (katoda) lub je pobierają
(anoda), bądź tez poprzez bezpośrednie interakcje pomiędzy indywiduami chemicznymi
połączone z bezpośrednim przekazywaniem elektronów.
W procesie utleniania (dezelektronacji) następuje utrata lub oddanie elektronów w danym
atomie/jonie na skutek czego wzrasta jego liczba (stopień) utlenienia.
W procesie redukcji (elektronacji) następuje przyłączenia lub zbliżenie elektronów w
wiązaniu kowalencyjnym spolaryzowanym, przez co następuje zmniejszenie liczby (stopnia)
utlenienia.
Przez liczbę (stopień) utlenienia, czyli ładunek formalny, rozumie się liczbę ładunków
elementarnych, jakie byłyby związane z danym atomem, gdyby wszystkie wiązania w
cząsteczce byłyby jonowe.
Substancje zawierające atom lub jon zdolny do pobierania elektronów (do ulegania redukcji,
do zmniejszania swej liczby utlenienia) nazywa się utleniaczami.
Substancje z atomem lub jonem zdolnym do oddawania elektronów (do ulegania utlenieniu,
pozwiększania swej liczby utlenienia) nazywa się reduktorami.
Utleniacz pobierając elektrony od reduktora ulega redukcji, a reduktor oddając elektrony na
korzyść utleniacza sam ulega utlenieniu. Procesowi utleniania jednej substancji musi zawsze
towarzyszyć redukcja innej substancji i odwrotnie. Stad reakcje utleniania i redukcji stanowią
układ sprzężony, nazywany układem redoks, przy czym liczba elektronów przyłączanych przez
utleniacz równa się liczbie elektronów oddawanych przez reduktor.
e
n
utleniacz
reduktor
⋅
+
⇔
1
1
2
2
reduktor
e
n
utleniacz
⇔
⋅
+
2
1
2
1
reduktor
utleniacz
utleniacz
reduktor
+
⇔
+

Substancje zawierające pierwiastki na pośrednich stopniach utlenienia mogą w obecności
silniejszego reduktora wykazywać właściwości utleniające, a w obecności silniejszego
utleniacza właściwości redukujące. Zatem właściwości redoks zależą nie tylko od charakteru
samej substancji, ale też od środowiska i obskości w nim innych substancji w właściwościach
oksydo-redukcyjnych.
Istnieją proste reguły, które pozwalają wyznaczyć stopnie utlenienia poszczególnych
atomów w każdym związku:
1.
Fluor we wszystkich związkach posiada stopień utlenienia -1
2.
Wodór posiada stopień utlenienia +1, z wyjątkiem połączeń z metalami, w których
wodór ma stopień utlenienia -1
3. Stopień utlenienia tlenu wynosi -2, z wyjątkiem połączeń nadtlenkowych, w których tlen
jest na -1 stopniu utlenienia, oraz fluorku tlenu OF
2
, w którym tlen jest na +2 stopniu
utlenienia
4. Stopień utlenienia litowców wynosi +1, a berylowców +2
5. Stopień utlenienia pierwiastków w stanie wolnym wynosi 0
Dodatkowo należy mieć na względzie, ze:
•
Całkowita liczba utlenienia jest to jednostkowa liczba utlenienia pomnożona przez liczbę
atomów pierwiastka w cząsteczce lub złożonym jonie
• Suma algebraiczna całkowitych liczb utlenienia atomów związanych w cząsteczce równa
się zeru, a atomów związanych w jonie jest równa ładunkowi jonu
Czasem uwzględnia się dodatkowe założenie, a mianowicie nie bierze się pod uwagę wkładu
w stopień utlenienia pomiędzy atomami tego samego pierwiastka
Wyznaczanie stopni utlenienia w przykładowych związkach:
3
1
3
+
−
H
N
4
2
7
1
−
+
+
O
Cl
H
−
−
+
2
2
7
6
2
O
Cr
−
−
+
2
2
8
7
2
O
S
Należy pamiętać, że stopnie utlenienia są wielkościami umownymi i zależą od sposobu
jak i reguł według których się je oblicza. Służą one jedynie do ″księgowania″ elektronów i nie
zawsze musza one przyjmować wartości całkowitych –
np.
- atom siarki na ułamkowym stopniu utlenienia
−
−
+
2
2
6
5
.
2
4
O
S
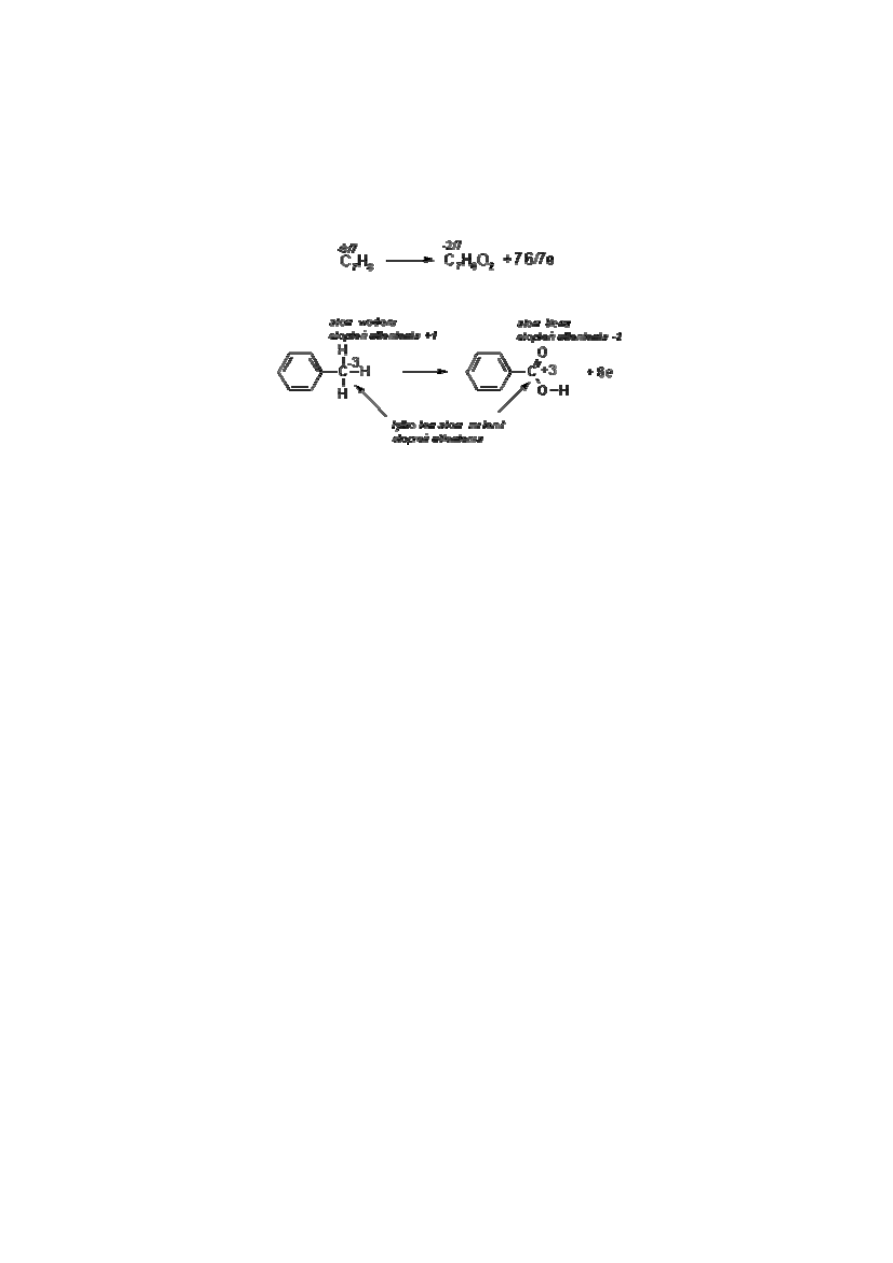
Ułamkowe (i „nietypowe”) stopnie utlenienia w niczym nie przeszkadzają przy dobieraniu
współczynników równania reakcji, co najwyżej utrudniają rachunki (bilans elektronów).
W przypadku reakcji utlenienia toluenu do kwasu benzoesowego można przypisać stopnie
utlenienia na różny sposób, przy czym nie ma to oczywiście żadnego wpływu na wymienianą
liczbę elektronów!
W przypadku związków organicznych najczęściej we wzorze konstytucyjnym najczęściej
rozpatruje się tylko ten atom, który zmienił stopień utlenienia. Przy czym w przypadku
obliczania stopni utlenienia atomów w związkach zapisanych wzorem strukturalnym
obowiązuję te same reguły co przy obliczaniu stopni utlenienia atomów w związkach
zapisanych wzorem sumarycznym. Jeżeli atom dla którego liczony jest stopień utlenienia
(atom centralny) połączony jest wiązaniem pojedynczym z atomem mniej elektroujemnym, to
atom centralny zabiera od niego jeden elektron (stopień utlenienia zmniejsza się o jednostkę).
Przy wiązaniu podwójnym atom bardziej elektroujemny zabiera dwa elektrony (stopień
utlenienia zmniejsza się o dwie jednostki), a przy wiązaniu potrójnym atom bardziej
elektroujemny zabiera trzy elektrony i jego stopień utlenienia zmniejsza się o trzy jednostki.
Odwrotnie jest przy rozpatrywaniu atomów mniej elektroujemnych. Ich stopień utlenienia
zwiększa się o jedną, dwie, lub trzy jednostki.
BILANSOWANIE REAKCJI REDOKS
Na przykładzie reakcji jonami jodkowymi a żelaza (III)
• Zapis reakcji połówkowych:
2 I
-
- 2ē
⎯→ I
2
red
1
– n
1
ē
⎯→ utl
1
Pierwsza rekcja, otrzymanie jodu cząsteczkowego, jest to reakcja utleniania
(oddaniu elektronów przez jony I
-
). Jony jodkowe oddają elektrony – zatem są reduktorem

Fe
3+
+ ē
⎯→ Fe
2+
utl
2
+ n
2
ē
⎯→ red
2
Druga reakcja to redukcja jonów żelaza (III) do jonów żelaza (II) i polega na pobraniu
elektronów przez Fe
3+
. Jony żelaza (III) przyjmują elektrony pełnią zatem rolę utleniacza.
• Zapis reakcji redoks powstaje na skutek dodania reakcji cząstkowych stronami
2I
-
- 2ē + Fe
3+
+ ē
⎯→ I
2
+ Fe
2+
Ogólny zapis reakcji redoks
red
1
– nē + utl
2
+ nē
⎯→ utl
1
+ red
2
• Bilansowanie
reakcji redoks.
Jeżeli każda z reakcji cząstkowych przebiega z oddaniem/pobraniem innej liczy elektronów
(n
1
≠n
2
) to przed dodaniem stronami należy uwzględnić odpowiednie mnożniki, tak aby liczba
elektronów oddanych i przyjętych była równa najmniejszej wspólnej wielokrotnej n
1
i n
2
. w tym
celu pierwsze równanie cząstkowe mnożymy przez n
2
, a równanie drugie przez n
1
.
red
1
– n
1
ē
⎯→ utl
1
/
⋅n
2
utl
2
+ n
2
ē
⎯→ red
2
/
⋅n
1
otrzymujemy:
n
2
red
1
– n
1
n
2
ē
⎯→ n
2
utl
1
n
1
utl
2
+ n
1
n
2
ē
⎯→ n
1
red
2
w rozpatrywanym przypadku:
2 I
-
- 2ē
⎯→ I
2
/
.
1
Fe
3+
+ ē
⎯→ Fe
2+
/
.
2
otrzymujemy
2 I
-
- 2ē
⎯→ I
2
2Fe
3+
+ 2ē
⎯→ 2Fe
2+
• Po dodaniu zbilansowanych reakcji cząstkowych otrzymujemy stechiometryczny zapis
reakcji redoks
2I
-
+2 Fe
3+
⎯→ I
2
+ 2Fe
2+

STANDARDOWE POTENCJAŁY REDOKS
Każdemu procesowi redoks można przypisać pewien potencjał. W celuwyznaczenia
tego potencjału buduje się odpowiednie elektrody redoks – np. z platyny zanurzonej w
roztworze zarówno formy zredukowanej układu redoks, jak i w postaci utlenionej
rozpatrywanego układu. Przykładem może być ogniwo Pt, H
2
|H
+
|| Fe
3+
|Fe
2+
, Pt, przy czym
potencjał tego układu wynosi
V
Fe
Fe
77
,
0
0
/
2
3
=
+
+
π
Zgodnie z równaniem Ernsta:
[ ]
[ ]
red
utl
n
ln
059
,
0
0
⋅
+
=
π
π
, gdy stężenia postaci utlenionej i
zredukowanej są sobie równe [utl] = [red],
π
0
=
π. Potencjał ten nazywamy standardowy
potencjał redoks.
Standardowe potencjały wybranych układów redoks
Układ
π
0
[V]
K
+
+ ē
⎯→ K
-2,92
Na
+
+ ē
⎯→ Na
-2,71
2H
2
O + 2ē
⎯→ H
2
+ 2 OH
-
-0,83
Zn
2+
+ 2ē
⎯→ Zn
-0,76
S + 2ē
⎯→ S
2-
-0,51
Pb
2+
+ 2ē
⎯→ Pb
-0,13
MnO
4
-
+ 2H
2
O
+
3ē
⎯→ MnO
2
+ 4OH
-
+0,57
O
2
+ 2H
+
+ 2ē
⎯→ H
2
O
2
+0,68
MnO
2
+ 4H
+
+2ē
⎯→ Mn
2+
+ 2H
2
O
+1,28
Cr
2
O
7
2-
+ 14H
+
+ 6ē
⎯→ 2Cr
3+
+ 7H
2
O
+1,36
Pb
4+
+ 2ē
⎯→ Pb
2+
+1,69
H
2
O
2
+ 2H
+
+ 2ē
⎯→ 2 H
2
O
+1,77
F
2
+ 2ē
⎯→ 2F
-
+2,85
W półogniwie, którego potencjał jest wyższy, zachodzi proces redukcji, w półogniwie o
potencjale niższym - proces utleniania. Można też przypisać potencjały standardowe, zwane
potencjałami redoks. Wartości tych potencjałów, podobnie jak w przypadku ogniw, decydują o
przebiegu i kierunku reakcji redoks. Aby poprawnie napisać równanie reakcji redoks, należy
wybrać z tabeli potencjałów redoks dwa układy różniące się wartościami potencjałów a
następnie napisać równanie redukcji układu o potencjale wyższym i utlenienia układu o
potencjale niższym (równania połówkowe). Równania połówkowe należy pomnożyć przez
odpowiednie współczynniki wyrównujące liczbę elektronów w każdym z nich i dodać stronami,
Przykład.
V
Cr
O
Cr
36
,
1
0
2
/
3
2
7
2
=
+
−
π
V
I
I
54
,
0
0
2
/
2
=
−
π
Oczywiście niektóre związki biorące udział w reakcjach redoks mogą tworzyć kilka układów
redoks o różnych potencjałach standardowych.
Przykład:
V
O
H
O
H
77
,
1
0
2
/
2
2
2
=
π
V
O
H
O
68
.
0
0
/
2
2
2
=
π
• w reakcji z KMnO
4
nadtlenek wodoru jest reduktorem
V
Mn
MnO
52
,
1
0
/
2
4
=
+
−
π
• w reakcji z KI:
nadtlenek wodoru jest utleniaczem
V
I
I
54
,
0
0
2
/
2
=
−
π
Literatura:
[1] Z. Bądkowska, E. Koliński, M. Wojnowska, Obliczenia z Chemii Nieorganicznej, Wydawnictwo PG, Gdańsk
(1996) 156-176.
[2] W. Brzyska (red.), Ćwiczenia z chemii ogólnej, Wydawnictwo UMCS, Lublin (1997) 61-69.
[3] A. Zgirski, R. Gondko, Obliczenia biochemiczne, PWN, Warszawa 1998.
Wyszukiwarka
Podobne podstrony:
cw PAiTS 05 id 122324 Nieznany
CW 8 pytania kontrolne id 12215 Nieznany
Cw 29 szablon id 97632 Nieznany
cw PRI harmonogram id 122354 Nieznany
Cw 1 Czworniki bierne id 122391 Nieznany
cw 03 formularz id 121361 Nieznany
Cw 25 Zaklocenia id 122416 Nieznany
cw 05 instrukcja id 121376 Nieznany
cw 15 formularz id 121556 Nieznany
normy do cw I PN B 19301 id 787 Nieznany
Cw 24 cw070 id 648300 Nieznany
cad 1 I Cw 14 2013 id 107655 Nieznany
Cw 2 Biochemia OS id 121642 Nieznany
cw 05 formularz id 121375 Nieznany
Cw 29 zaliczone id 121743 Nieznany
Cw 13 szablon id 97569 Nieznany
cw jednostka ppm id 122227 Nieznany
cw PAiTS 04 id 122323 Nieznany
więcej podobnych podstron