
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jolanta Łagan
Stosowanie podstawowych zasad toksykologii
311[02].Z3.01
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Urszula Ciosk-Rawluk
dr Robert Rochel
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą
programu jednostki modułowej 311[02].Z3.01,
„Stosowanie podstawowych zasad toksykologii”, zawartego w modułowym programie
nauczania dla zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Przykładowe scenariusze zajęć
7
5.
Ćwiczenia
12
5.1. Substancje chemiczne w ujęciu toksykologicznym
12
5.1.1. Ćwiczenia
12
5.2. Zatrucia substancjami szkodliwymi
15
5.2.1. Ćwiczenia
15
5.3. Elementy toksykometrii
18
5.3.1. Ćwiczenia
18
5.4. Sposoby neutralizacji i likwidacji substancji szkodliwych
20
5.4.1. Ćwiczenia
20
6. Ewaluacja osiągnięć ucznia
23
7. Literatura
37

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela Stosowanie podstawowych zasad
toksykologii, który będzie pomocny w prowadzeniu zajęć dydaktycznych w szkole
kształcącej w zawodzie technik analityk 311[02].
W poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie uczeń powinien mieć już ukształtowane,
aby bez problemów mógł korzystać z poradnika,
−
cele kształcenia – wykaz umiejętności jakie uczeń ukształtuje podczas pracy
z poradnikiem,
−
przykładowe scenariusze zajęć,
−
ć
wiczenia, przykładowe ćwiczenia ze wskazówkami do realizacji, zalecanymi metodami
nauczania – uczenia oraz środkami dydaktycznymi,
−
ewaluację osiągnięć ucznia, przykładowe narzędzie pomiaru dydaktycznego,
−
literaturę.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem aktywizujących metod nauczania:
−
tekstu przewodniego,
−
ć
wiczeń laboratoryjnych,
−
gier dydaktycznych,
−
metody projektów,
−
dyskusji dydaktycznej.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
311[02] Z3
Podstawowe badania toksykologiczne
311[02].Z3.02
Badanie toksyn w środowisku naturalnym
i przemysłowym
311[02].Z3.01
Stosowanie podstawowych zasad
toksykologii
311[02].Z3.03
Badanie substancji toksycznych
w żywności i w środkach codziennego
użytku
311[02].Z3.04
Określanie wpływu leków i substancji
toksycznych na organizm

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
−
przestrzegać przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
przestrzegać zasad dobrej techniki laboratoryjnej,
−
przestrzegać zasad bezpieczeństwa podczas badania analitycznego,
−
posługiwać się nomenklaturą związków nieorganicznych i organicznych,
−
określać właściwości fizyko-chemiczne substancji,
−
stosować stechiometrię do obliczeń chemicznych,
−
stosować obowiązujące jednostki układu SI,
−
sporządzać wykresy i interpretować wyniki,
−
sporządzać roztwory o określonym stężeniu,
−
przygotowywać próbki materiału do analizy,
−
przygotowywać sprzęt laboratoryjny, aparaturę, odczynniki,
−
korzystać z norm, przepisów, procedur i dostępnych instrukcji,
−
określać funkcje poszczególnych układów u człowieka.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
−
zdefiniować podstawowe pojęcia stosowane w toksykologii,
−
zdefiniować substancje toksyczne oraz określić ich właściwości i pochodzenie,
−
scharakteryzować mechanizm działania trucizn na organizmy żywe,
−
scharakteryzować czynniki wpływające na toksyczność substancji,
−
scharakteryzować drogi przenikania trucizn do organizmu,
−
pogrupować substancje toksyczne ze względu na ich pochodzenie i skutki działania,
−
zaprojektować sposoby neutralizacji i likwidacji trucizn oraz środków szkodliwych,
−
skorzystać ze źródeł informacji, norm i rozporządzeń dotyczących trucizn i substancji
niebezpiecznych,
−
wykonać obliczenia chemiczne niezbędne do przeprowadzenia analitycznych badań
substancji toksycznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca:
……………………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe badania toksykologiczne 311[02].Z3.
Jednostka modułowa:
Stosowanie podstawowych zasad toksykologii
311[02].Z3.01
Temat: Monitoring substancji szkodliwych.
Cel ogólny: Kształtowanie umiejętności oceny ryzyka zawodowego i zdrowotnego
w środowisku pracy.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
określić zasady ustalania najwyższych dopuszczalnych stężeń substancji szkodliwych,
−
określić kategorie najwyższych dopuszczalnych stężeń,
−
wyjaśnić metody badań powietrza i materiału biologicznego,
−
interpretować wskaźnik ekspozycji,
−
przedstawić etapy oceny ryzyka zawodowego,
−
zaprezentować opracowania projektowe.
Metody nauczania–uczenia się:
−
dyskusja dydaktyczna,
−
ć
wiczenie praktyczne,
−
gra dydaktyczna,
−
wykład.
Środki dydaktyczne:
−
prezentacje,
−
foliogramy,
−
szablony do gry,
−
karta pracy ucznia,
−
zestawy zadań.
Formy organizacyjne pracy uczniów:
−
praca w zespole,
−
praca indywidualna.
Czas trwania:
−
180 minut.
Uczestnicy:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Przebieg zajęć:
1.
Wprowadzenie.
2.
Nawiązanie do tematu, omówienie celów zajęć.
3.
Plan zajęć:
A. Prezentacja poszczególnych projektów przygotowanych z wykorzystaniem różnych
elementów, uatrakcyjniających przez grupy uczniowskie na wcześniej zadane tematy.
Tematy prezentacji:
−
Ocena zanieczyszczenia powietrza poprzez prowadzenie monitoringu powietrza
przez okres 1 miesiąca.
−
Pyły przemysłowe na stanowisku pracy.
−
Biologiczne metody badań pracownika.
−
Metody badania powietrza w środowisku pracy.
−
Metody ograniczania zanieczyszczeń w powietrzu i na stanowisku pracy.
B. Zapoznanie uczniów przez nauczyciela z:
−
normami higienicznymi obejmującymi kategorie najwyższych dopuszczalnych
stężeń,
−
współczynnikiem ekspozycji i jego interpretacją.
C. Wykonywanie przez uczniów ćwiczeń praktycznych:
Ć
wiczenie 1 (ćwiczenie 1 punkt 3.1.1 z poradnika dla ucznia)
Ć
wiczenie 2
Mleko zawiera średnio 0,1 mg arsenu na 1 kg mleka. Dawka śmiertelna dla człowieka
wynosi 10 mg na kilogram masy ciała. Oblicz, jaką masę mleka należałoby wypić, aby
była ona zagrożeniem dla człowieka ważącego 70 kg.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
−
przeczytać i wypisać dane z zadania,
−
obliczyć masę molową As
2
O
3,
−
obliczyć dawkę śmiertelną As
2
O
3
dla 70 kg masy ciała,
−
dokonać zamiany jednostek masy,
−
obliczyć masę arsenu w dawce śmiertelnej dla 70 kg masy ciała,
−
obliczyć masę mleka potrzebną do wywołania zagrożenia u dorosłej osoby.
Wyposażenie stanowiska pracy:
−
tekst zadania,
−
przybory do pisania,
−
notatnik
D. Prezentacja przez liderów wypracowanych rozwiązań ćwiczenia 1 i 2.
E. Opracowanie etapów działań zmierzające do oceny ryzyka zawodowego.
F. Propozycje oceny przygotowania poszczególnych grup uczniowskich do zajęć.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Zakończenie zajęć
−
Podsumowanie poznanych treści zajęć.
−
Ocena projektów przez nauczyciela, omówienie prezentacji i uzasadnienie oceny.
Ocena prezentacji:
Nr grupy
Kryteria
I
II
III
IV
V
Poprawność merytoryczna projektu
……………………………… 0-4p
Sposób prezentacji, oryginalność
……………………………… 0-4p
Elementy
uatrakcyjniające
pokaz
………………………………. 0-4p
Kultura języka ……………….0-4p
Komunikacja niewerbalna …..0-4p
RAZEM
Praca domowa
Korzystając z różnych źródeł informacji odszukaj najwyższe stężenia dopuszczalne tej
samej substancji o różnym stanie skupienia. Ogranicz swoje zadanie do pięciu substancji.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
–
rozwiązanie krzyżówki i karty pracy ucznia,
–
karta ewaluacyjna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Scenariusz zajęć 2
Osoba prowadząca:
……………………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe badania toksykologiczne 311[02].Z3.
Jednostka modułowa:
Stosowanie podstawowych zasad toksykologii
311[02].Z3.01
Temat: Chemizm zatruć.
Cel ogólny: Zapoznanie uczniów z istotą zatruć na przykładzie wybranych substancji
chemicznych.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
zdefiniować podstawowe pojęcia,
−
określić rodzaj substancji chemicznych wywołujących zatrucie,
−
określić objawy zatruć,
−
określić skutki działania jonów szczawianowych na organizm człowieka,
−
zorganizować stanowisko pracy,
−
udoskonalić umiejętności pracy zespołowej,
−
skonstruować logiczne wnioski i obserwacje,
−
skorzystać z różnych źródeł informacji,
−
dostrzec powiązania chemii z innymi dziedzinami nauk.
Metody nauczania–uczenia się:
−
dyskusja dydaktyczna,
−
gra dydaktyczna,
−
ć
wiczenie laboratoryjne.
Środki dydaktyczne:
−
prezentacja multimedialna,
−
szablony do gry,
−
instrukcja do ćwiczenia,
−
szkło laboratoryjne,
−
odczynniki chemiczne i próbki herbat,
−
mikroskop,
−
preparaty mikroskopowe (kryształki szczawianu wapnia w osadzie).
Formy organizacyjne pracy uczniów:
−
praca zespołowa,
−
praca indywidualna.
Czas trwania:
−
135 minut.
Uczestnicy:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Przebieg zajęć:
1.
Faza wprowadzająca:
−
definiowanie pojęć,
−
gry dydaktyczne,
−
weryfikowanie udzielonych odpowiedzi,
−
prezentacja multimedialna.
2.
Faza realizacyjna;
−
instruktaż bezpieczeństwa i higieny pracy,
−
zasada oznaczania,
−
analiza właściwa, ćwiczenie 2 (punkt 4.2.3 z poradnika dla ucznia),
−
nadzór nad prawidłowym przebiegiem zajęć.
3.
Faza podsumowująca:
−
prezentacja wyników,
−
błędy oznaczeń,
−
obserwacja mikroskopowa,
−
komentarz metodyczny.
Zakończenie zajęć:
–
ocena metod pracy,
–
podsumowanie pracy uczniów,
–
wnioski końcowe.
Praca domowa
Korzystając z dostępnych źródeł informacji określ obraz kliniczny zatruć ostrych
i przewlekłych dla kwasu szczawiowego i szczawianów.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
Karta ewaluacyjna.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5. ĆWICZENIA
5.1. Substancje chemiczne w ujęciu toksykologicznym
5.1.1. Ćwiczenia
Ćwiczenie 1
Z podanej grupy szablonów nazw, wzorów, toksyn, grup substancji i związków
chemicznych wybierz neurotoksyny, nefrotoksyny i hematoksyny.
Nazwy związków i substancji chemicznych: metanol, bromobenzen, tellur,
tetrachlorometan, kadm.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia. Ćwiczenie wykonujemy w grupach dwuosobowych.
Nauczyciel koordynuje pracą grup. Przewidywany czas trwania ćwiczenia 15 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wybrać z kolekcji szablonów nazwy, wzory substancji chemicznych, grupy związków
chemicznych i rodzaje toksyn,
2)
przyporządkować nazwie substancji chemicznej wzór (symbol),
3)
zaliczyć związek chemiczny do grupy,
4)
zaszeregować daną substancję chemiczną do toksyny,
5)
uzupełnić tabelę,
6)
dokonać oceny poprawności wykonanego ćwiczenia.
Grupa związku
chemicznego
Nazwa chemiczna
związku
Wzór (symbol
chemiczny)
Toksyna chemiczna
Zalecane metody nauczania–uczenia się:
–
ć
wiczenie przedmiotowe,
–
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
szablony,
−
kalendarz chemiczny,
−
układ okresowy pierwiastków,
−
Karty Charakterystyk substancji niebezpiecznych,
−
tabela do uzupełnienia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Ćwiczenie 2
Wykonaj pomiar stężenia jonów fluorkowych w wodzie wodociągowej metodą
potencjometryczną za pomocą elektrody jonoselektywnej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie wykonujemy w grupach dwuosobowych. Nauczyciel koordynuje pracą grup.
Przewidywany czas trwania ćwiczenia 135 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zorganizować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić roztwór buforowy:
−
odważyć 4,6 g octanu amonu, 58 g chlorku sodu, 174 g cytrynianu sodu, do zlewki
napełnionej około 500 cm
3
wody destylowanej przenieść odważone ilości substancji
i rozpuścić,
−
doprowadzić roztwór do pH 5,9–6,0 za pomocą lodowatego kwasu octowego,
−
dopełnić wodą destylowaną roztwór do objętości 1 dm
3
,
3)
sporządzić podstawowy roztwór wzorcowy fluorku sodu NaF:
−
odważyć 0,1105 g fluorku sodu (świeżo wyprażony),
−
przenieść ilościowo odważoną substancję do kolby miarowej o pojemności 50 cm
3
i dopełnić wodą destylowaną do kreski,
−
roztwór wymieszać (cm
3
roztworu zawiera 1mg jonu fluorkowego),
4)
sporządzić roboczy roztwór wzorcowy fluorku sodu NaF:
−
odmierzyć 1 cm
3
podstawowego roztworu wzorcowego do kolby miarowej na
100 cm
3
i dopełnić wodą destylowaną do kreski,
−
roztwór wymieszać (1 cm
3
roztworu zawiera 0,01 mg jonu fluorkowego),
5)
wykonać oznaczenie:
−
przygotować roztwory do sporządzenia krzywej wzorcowej
−
pobrać do sześciu kolbek miarowych o pojemności 50 cm
3
kolejno: 0,5; 1,0; 2,5; 5,0;
10,0 i 25,0 cm
3
roboczego wzorcowego roztworu fluorku sodu NaF,
−
dopełnić kolbki wodą destylowaną do kreski i wymieszać (stężenia w kolejnych
kolbkach wynoszą 0,1; 0,2; 0,5; 1,0; 2,0; 5,0 mg/dm
3
),
−
przenieść każdy z przygotowanych roztworów do zlewki (100 cm
3
),
−
dodać do każdej zlewki po 10 cm
3
roztworu buforowego,
−
przygotować aparaturę do pomiaru,
−
wykonać pomiar pH i SEM dla kolejnych roztworów,
−
sporządzić krzywą wzorcową SEM = f(lg cF−),
−
wykonać pomiary dla roztworu o nieznanym stężeniu:
−
pobrać do trzech zlewek (100 cm
3
) 50 cm
3
próbki,
−
dodać do każdej zlewki 10 cm
3
buforu,
−
dokonać pomiaru pH i SEM dla każdej próbki,
−
obliczyć średnią arytmetyczną dla trzech wykonanych pomiarów badanej próbki,
−
określić zawartość jonów fluorkowych w mg/dm
3
i porównać z wartościami normy.
6)
dokonać neutralizacji odczynników i uporządkować stanowisko pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Zalecane metody nauczania–uczenia się:
–
przewodniego tekstu,
–
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewki (100 cm
3
), kolby miarowe (50 cm
3
), pipety (1 cm
3
, 5
cm
3
,10 cm
3
, 25 cm
3
),
−
pH – metr wraz z wyposażeniem,
−
odczynniki: roztwór buforowy, wzorcowy roztwór fluorku sodu, roboczy roztwór
wzorcowy fluorku sodu, woda destylowana pozbawiona węglanów,
−
przybory do opracowania wykresów lub program komputerowy,
−
Polska Norma PN 78/C – 04588.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.2. Zatrucia substancjami szkodliwymi
5.2.1. Ćwiczenia
Ćwiczenie 1
Korzystając z Kart Charakterystyk i krzywych alkoholowych oceń i porównaj działanie
alkoholu metylowego i etylowego na organizm człowieka.
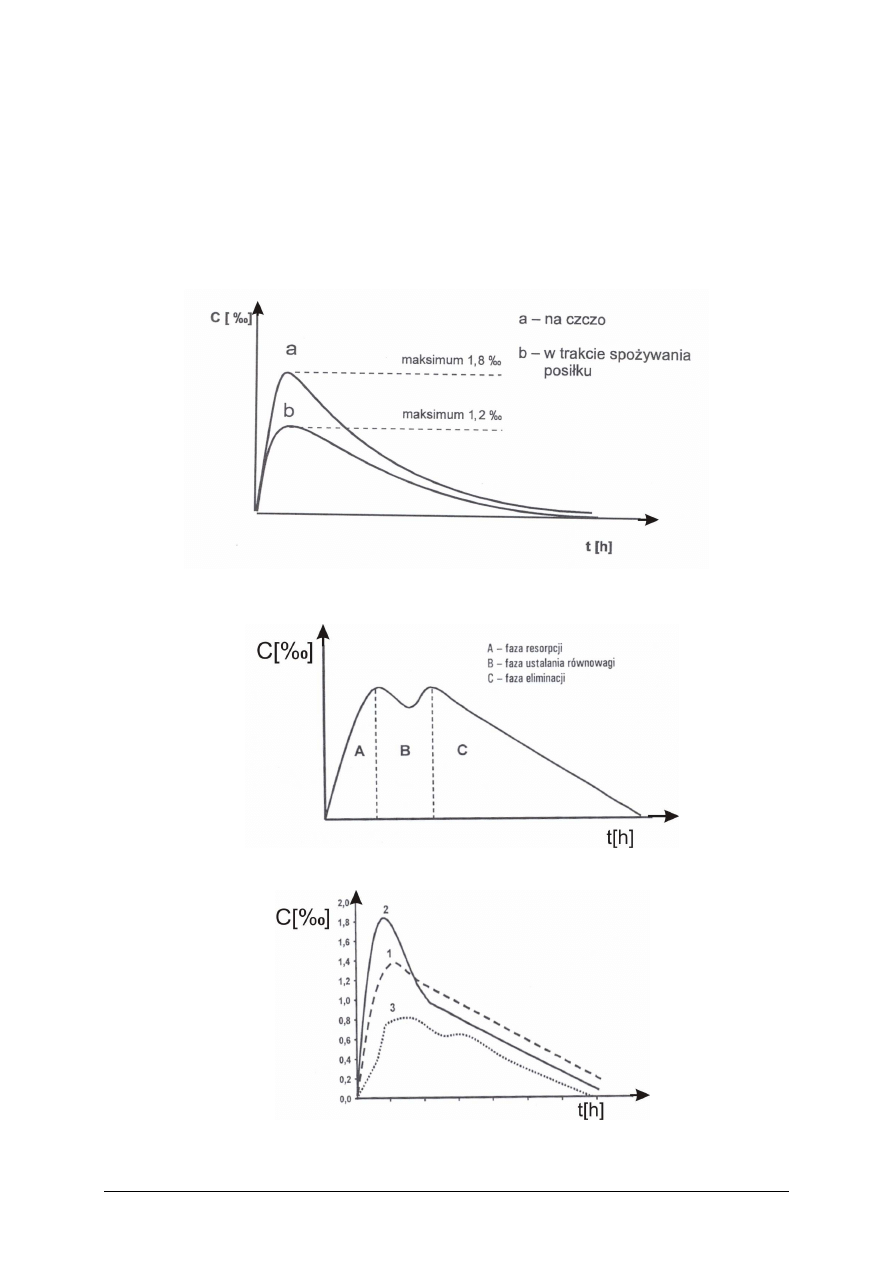
Rysunek 1 do ćwiczenia 1. Przebieg zmian stężenia etanolu we krwi
po spożyciu napojów alkoholowych [2, s. 125]
Rysunek 2 do ćwiczenia 1. Krzywa alkoholowa [2, s. 126]
Rysunek 3 do ćwiczenia 1. Podstawowe typy krzywych alkoholowych [2, s. 126]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Krzywa 1 – Przebieg zmian stężenia alkoholu we krwi przy spożyciu napojów
alkoholowych w niewielkich ilościach o niskim stężeniu gdy żołądek wypełniony jest
nieznaczną ilością pokarmu.
Krzywa 2 – Przebieg zmian stężenia alkoholu we krwi po szybkim spożyciu napoju
alkoholowego, jeżeli w żołądku brak treści pokarmowych.
Krzywa 3 – Przebieg zmian stężenia alkoholu we krwi przy spożyciu napojów
alkoholowych rozciągniętym w czasie i żołądku wypełnionym treścią pokarmową.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
zagadnień oraz technikę wykonania ćwiczenia. Ćwiczenie wykonujemy w grupach
dwuosobowych. Nauczyciel koordynuje pracą grup. Po prezentacji wniosków przez liderów
grup powinna wywiązać się dyskusja, którą podsumowuje nauczyciel. Przewidywany czas
trwania ćwiczenia 30 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wybrać spośród Kart Charakterystyk te, które dotyczą C
2
H
5
OH i CH
3
OH,
2)
odnaleźć w karcie w/w substancji wartości liczbowe dawki toksycznej,
3)
porównać wartości dawek,
4)
scharakteryzować działanie alkoholi na organizm człowieka,
5)
zinterpretować przebieg krzywych i zaprezentować otrzymane wyniki,
6)
wyciągnąć wnioski dotyczące wpływu alkoholi na organizm człowieka.
Zalecane metody nauczania–uczenia się:
–
dyskusja dydaktyczna,
–
prezentacja multimedialna.
Ś
rodki dydaktyczne:
−
Karty Charakterystyk Substancji,
−
krzywe alkoholowe.
Ćwiczenie 2
Oznacz jony szczawianowe C
2
O
4
2-
w herbacie metodą redoksymetryczną.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie wykonujemy w grupach dwuosobowych. Nauczyciel koordynuje pracą grup.
Przewidywany czas trwania ćwiczenia 135 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zorganizować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić roztwory:
−
odważyć trzy próbki herbaty po 10 g,
−
zalać porcję herbaty 100 cm
3
wrzącej wody destylowanej,
−
zaparzać przez 5 minut,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
−
zdekantować napar do kolby stożkowej,
−
pobrać po 10 cm
3
naparu do trzech kolb stożkowych,
3)
dodać do każdej kolby 5 cm
3
acetonu i 10 cm
3
CaCl
2
,
4)
wstawić kolby do lodówki,
5)
zlać płyn znad osadu po 30 minutach, a osad rozpuścić w 5 cm
3
kwasu siarkowego,
6)
ogrzewać kolbę przez 2 minuty w łaźni wodnej,
7)
miareczkować na gorąco mianowanym roztworem KMnO
4
do uzyskania barwy żółtej
utrzymującej się około 1 minuty,
8)
powtórzyć czynności dla kolejnych próbek,
9)
obliczyć zawartość rozpuszczonego kwasu szczawiowego (na 100 g suchej masy herbaty
i 25 cm
3
naparu), przy założeniu, że 1 cm
3
KMnO
4
o stężeniu c=0,0040 mol/dm
3
odpowiada 0,9 mg kwasu szczawiowego,
10)
zapisać równania zachodzących reakcji podczas wykonywanej analizy:
−
równanie reakcji powstawania szczawianu wapnia CaC
2
O
4
,
−
równanie reakcji szczawianu wapnia z kwasem siarkowym(VI),
−
równanie reakcji redoks kwasu szczawiowego z manganianem (VII) potasu
w środowisku kwasu siarkowego(VI),
11)
dokonać oceny klinicznej wpływu kwasu szczawiowego na stan zdrowia pacjenta
korzystając z dostępnej literatury,
12)
dokonać neutralizacji odczynników i uporzadkować stanowisko pracy.
Zalecane metody nauczania–uczenia się:
–
ć
wiczenie laboratoryjne,
–
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: cylinder, zlewki, kolbki stożkowe, pipeta, biureta, lejek do biurety,
−
sprzęt laboratoryjny: łapa do biurety, gruszka, tryskawka,
−
odczynniki:
aceton,
roztwór 5 % chlorek wapnia,
roztwór 0,5 mol/dm
3
,
kwas siarkowy(VI),
roztwór 0,004 mol/dm
3
manganian(VII) potasu (0,632 g KMnO
4
w 1 dm
3
roztworu),
woda destylowana bez węglanów,
próbka herbaty,
−
literatura.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
5.3. Elementy toksykometrii
5.3.1. Ćwiczenia
Ćwiczenie 1
Na stanowisku pracy hutnika dokonano pomiarów stężeń tlenku żelaza i tlenków azotu.
Dokonując obliczeń ustal, czy warunki pracy są szkodliwe.
Substancja
C
w
[mg/m
3
]
NDS [mg/m
3
]
tlenki żelaza
4,4
5,0
tlenki azotu
3,7
5,0
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
zagadnień oraz technikę wykonania ćwiczenia. Ćwiczenie wykonujemy w grupach
dwuosobowych. Nauczyciel koordynuje pracą grup. Nauczyciel podsumowuje pracę grup.
Przewidywany czas trwania ćwiczenia 15 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
odczytać wartości NDS substancji z tabeli,
C
w
2)
zapisać ilorazy stężeń NDS dla obu substancji,
3)
obliczyć ilorazy,
4)
zsumować uzyskane wyniki,
5)
ocenić warunki pracy hutnika na podstawie otrzymanej wartości.
Zalecane metody nauczania–uczenia się:
–
ć
wiczenie przedmiotowe,
–
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
tablice NDS,
−
kalkulator.
Ćwiczenie 2
Do analizy pobrano 5 cm
3
krwi i oddzielono z niej osocze. Na drodze analizy
stwierdzono, że zawierało ono 0,8 mg jonów Ca
2+
. Norma przewiduje stężenie jonów wapnia
we krwi od 2,1 do 2,6 mmol/dm
3
. Oblicz, czy stężenie jonów wapnia we krwi pacjenta
mieściło się w normie.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
zagadnień oraz technikę wykonania ćwiczenia. Uczeń wykonuje ćwiczenie samodzielnie.
Nauczyciel koordynuje pracą ucznia. Nauczyciel podsumowuje pracę klasy. Przewidywany
czas trwania ćwiczenia 15 minut.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
obliczyć liczbę mmoli Ca
2+,
2)
dokonać korekty jednostek objętości,
3)
obliczyć stężenie jonów wapnia we krwi pacjenta, korzystając z definicji stężenia
molowego,
4)
porównać uzyskany wynik z zadania z normą.
Zalecane metody nauczania–uczenia się:
–
ć
wiczenie przedmiotowe,
–
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
układ okresowy pierwiastków.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5.4. Sposoby neutralizacji i likwidacji substancji szkodliwych
5.4.1. Ćwiczenia
Ćwiczenie 1
Przeprowadź neutralizację jonów żelaza (III) za pomocą zawiesiny wodorotlenku wapnia,
zwanej mleczkiem wapiennym.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie wykonujemy w grupach dwuosobowych. Nauczyciel koordynuje pracą grup.
Przewidywany czas trwania ćwiczenia 45 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymogami bezpieczeństwa i higieny pracy,
2)
sporządzić potrzebne roztwory do ćwiczenia,
3)
nalać do pięciu probówek po 2 cm
3
roztworu 0,1 mol/dm
3
FeCl
3
,
4)
wstrząsać butelkę z zawartością 10% mleczka wapiennego,
5)
dodać do probówek; 0,5; 1,0; 1,5; 2,0 cm
3
tej zawiesiny,
6)
wymieszać zawartość probówek,
7)
dodać do probówki 3 cm
3
roztworu KSCN,
8)
ustalić, ile 10% mleczka wapiennego należy użyć do całkowitej neutralizacji,
9)
zapisać w formie jonowej (cząsteczkowej) równanie reakcji świadczące o obecności
jonów żelaza (III),
10)
zapisać w formie jonowej (cząsteczkowej) równanie reakcji neutralizowania w tym
doświadczeniu jonów żelaza (III),
11)
uporządkować stanowisko pracy.
Zalecane metody nauczania–uczenia się:
–
ć
wiczenia laboratoryjne,
–
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: probówki, kolba miarowa, kolbki miarowe, butelki szklane, bagietka,
lejek zwykły, naczyńko wagowe,
−
sprzęt laboratoryjny: waga analityczna, łyżka porcelanowa, tryskawka, etykietki do opisu
roztworów,
−
odczynniki chemiczne Ca(OH)
2
(s)
cz. d.
a.,
FeCl
3 (s)
cz. d. a., roztwór 0,5 mol/dm
3
KSCN,
woda destylowana pozbawiona węglanów,
−
układ okresowy pierwiastków,
−
kalendarz chemiczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Ćwiczenie 2
Wykorzystując ekstrakcję jako sposób usuwania substancji chemicznej z roztworu,
przeprowadź ekstrakcję jodu z roztworu CCl
4
i oblicz współczynnik Nernsta.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie wykonujemy w grupach dwuosobowych. Nauczyciel koordynuje pracą grup.
Przewidywany czas trwania ćwiczenia 135 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
sporządzić krzywą wzorcową roztworu 0,5 mol/dm
3
jodu w KI:
−
przygotować roztwór 0,5 mol/dm
3
KI,
−
1 g jodu umieścić w kolbie miarowej o pojemności 100 cm
3
i dopełnić do kreski
roztworem 0,5 mol/dm
3
KI (1 cm
3
roztworu zawiera 10 mg jodu),
−
dodać do pięciu probówek kolejno: 0,5; 1,0; 1,5; 2,0 cm
3
otrzymanego roztworu jodu
w jodku potasu (I
2
w KI),
−
dodać tyle roztworu 0,5 mol/dm
3
KI, by objętość roztworu w probówce wynosiła
10 cm
3
,
(stężenie będzie wynosić odpowiednio 0,5; 1,0; 1,5; 2,0 mg /cm
3
),
−
wyznaczyć zależność absorbancji od stężenia jodu przy długości fali = 510 nm,
3)
sporządzić krzywą wzorcową A = f(c) jodu w CCl
4
:
−
przygotować roztwór podstawowy jodu w CCl
4
o pojemności 100 cm
(0,1 g jodu
umieścić w kolbie miarowej
3
i dopełnić do kreski tym rozpuszczalnikiem),
−
dodać kolejno do pięciu probówek: 0,2; 0,4, 0,6; 1,0 cm
3
roztworu i uzupełnić Ccl
podstawowego
4
do objętości 10 cm
3
,
−
wyznaczyć zależność absorbancji każdego z otrzymanych roztworów przy długości
fali = 518nm,
−
wykreślić krzywą wzorcową A = f (c),
4)
dokonać pomiaru współczynnika podziału:
−
w trzech butelkach o pojemności 50 cm
3
umieścić po 2 cm
3
roztworu 0,5 mol/dm
3
jodu w roztworze KI po18 cm
3
roztworu 0,5 mol/dm
3
KI i po 10 cm
3
CCl4,
−
wytrząsać kolejno każdą butelkę przez 1 minutę,
−
wprowadzić wytrząśnięte ciecze do rozdzielaczy w celu rozdzielenia faz,
−
zlać fazy organiczne z rozdzielaczy do czystych probówek,
−
zmierzyć absorbancję kolejnych czterech probówek przy długości fali = 518nm,
−
sporządzić krzywą wzorcową A = f (c),
−
wyznaczyć z krzywej wzorcowej stężenia jodu w fazie organicznej,
−
odlać z każdego rozdzielacza po 2 cm
3
roztworu i go odrzucić,
−
zlać do czystych probówek fazę wodną z kolejnych rozdzielaczy,
−
zmierzyć absorbancję kolejnych probówek przy długości fali = 510 nm,
−
sporządzić krzywą wzorcową A = f (c),
−
wyliczyć na podstawie krzywej wzorcowej stężenie jodu w fazie wodnej,
5)
obliczyć z uzyskanych danych współczynnik podziału Nernsta,
6)
uporządkować stanowisko pracy i dokonać neutralizacji pozostałych odczynników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Zalecane metody nauczania–uczenia się:
–
ć
wiczenia laboratoryjne,
–
pogadanka.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: probówki, kolba miarowa, kolbki miarowe, butelki szklane, bagietka,
lejek zwykły, naczyńko wagowe, rozdzielacze,
−
sprzęt laboratoryjny: waga analityczna, łopatka lub łyżka porcelanowa, etykietki do opisu
roztworów, tryskawka,
−
odczynniki chemiczne: KI
(s)
cz. d. a., I
2
(s)
, CCl
4
(c)
cz.d.a., woda destylowana
pozbawiona węglanów,
−
spektrofotometr z wyposażeniem,
−
układ okresowy pierwiastków,
−
kalendarz chemiczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
6.
EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test 1
Test dwustopniowy do jednostki modułowej „Stosowanie podstawowych
zasad toksykologii”
Test składa się z 22 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, 4, 6, 7, 9, 10, 11, 13, 16, 17, 19, 20, 21, 22 są z poziomu podstawowego,
−
zadania 5, 8, 12, 14, 15, 18 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 12 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 20 zadań, w tym co najmniej 5 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. b, 2. c, 3. b, 4. b, 5. b, 6. c, 7. d, 8. b, 9. b, 10. a, 11.b,
12. b, 13. d, 14. c, 15. c, 16. d, 17. d, 18. b, 19. b, 20. c, 21. d, 22. d
Plan testu
Nr
zad. Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Zdefiniować pojęcie toksyn
C
P
b
2
Rozróżnić zatrucia w zależności od
czasu działania.
B
P
c
3
Określić prawidłową jednostkę dawki
A
P
b
4
Zastosować piktogramy określające
stopień zagrożenia substancją
chemiczną
C
P
b
5
Przewidzieć przynależność związków
chemicznych do odpowiedniej grupy
toksyn
D
PP
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
6
Określić działania objęte
monitoringiem
C
P
c
7
Zastosować wiadomości o substancji
w środowisku pracy
C
P
d
8
Przeanalizować dane dotyczące
prawidłowych warunków pracy
D
PP
b
9
Określić właściwości nie mające
wpływu na toksyczność substancji
C
P
b
10
Nazwać testy biologiczne stosowane
w oznaczeniach toksyn
A
P
a
11
Wyjaśnić znaczenie oznaczeń
stosowanych w toksykometrii
B
P
b
12
Zaproponować
związki
chemiczne
będące toksynami z grup pochodnych
węglowodorów
D
PP
b
13
Określić sposób prawidłowej
neutralizacji roztworu
C
P
d
14 Określić działanie niebezpieczne metali
C
PP
c
15
Przewidzieć grupę przynależności ze
względu na skuteczność działania
D
PP
c
16
Określić sposób wchłaniania kadmu do
organizmu człowieka
B
P
d
17
Określić rodzaj działania kilku
substancji szkodliwych
C
P
a
18
Ocenić wartość liczbową dawki
ś
miertelnej
D
PP
b
19
Przedstawić objaw ostrego zatrucia
alkoholem
B
P
b
20
Scharakteryzować definicję przemian
biochemicznych
C
P
c
21
Rozróżnić stopień działania
toksycznego
B
P
d
22 Określić rodzaj zatrucia
C
P
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 22 zadania o różnym stopniu trudności.
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Toksynami nazywamy
a)
substancje odżywcze wprowadzane do organizmu.
b)
substancje szkodliwe dla organizmu.
c)
związki chemiczne przechowywane w laboratorium.
d)
medykamenty lecznicze.
2.
Ze względu na mechanizm działania trucizny zatrucia dzielimy na
a)
nagłe, ukryte, nieznane.
b)
małe, średnie, duże.
c)
ostre, podostre, przewlekłe.
d)
ostre, ukryte, przewlekłe.
3.
Jednostką dawki jest
a)
mg/cm
3.
b)
mg/kg.
c)
m
2
/kg.
d)
cm
3
/g.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.
Umieszczane na opakowaniach substancji niebezpiecznych piktogramy informują o
a)
właściwościach fizycznych substancji niebezpiecznej.
b)
rodzaju zagrożenia jakie niesie ta substancja.
c)
symbolu (wzorze) substancji.
d)
zabezpieczeniu w sprzęt ochrony indywidualnej.
5.
Nefrotoksynami są
a)
alifatyczne i cykliczne węglowodory.
b)
metale ciężkie i chlorowcopochodne węglowodorów.
c)
alkohole.
d)
wielopierścieniowe węglowodory aromatyczne.
6.
Monitoring powietrza jest pojęciem, które oznacza
a)
rozprzestrzenianie się zanieczyszczeń w powietrzu.
b)
metodę badania zanieczyszczeń powietrza.
c)
system obserwacji, oceny i prognoz stanu powietrza.
d)
kontrolę najwyższych dopuszczalnych stężeń składników powietrza.
7.
Szkodliwe substancje i preparaty są potencjalnym źródłem zagrożenia zdrowia
pracownika. Prawidłowa praca z toksyną możliwa jest w wyniku znajomości
a)
właściwości fizykochemicznych substancji.
b)
instrukcji wykonywanego ćwiczenia.
c)
zasad stosowania środków ochrony indywidualnej.
d)
karty charakterystyki substancji.
8.
Na stanowisku pracy stężenie ważone amoniaku wyniosło c
w
= 45mg/m
3
. NDS
amoniaku
= 20.
Warunki pracy pracownika są
a)
w normie.
b)
szkodliwe dla zdrowia.
c)
bezpieczne dla pracownika.
d)
dopuszczalne.
9.
Na toksyczność substancji chemicznej nie ma wpływu
a)
budowa cząsteczki.
b)
nazwa substancji.
c)
rozpuszczalność substancji.
d)
stan skupienia substancji.
10.
Do oceny wyników badań biologicznych stosuje się
a)
biomarkery.
b)
bioanalizery.
c)
biochemery.
d)
biopolimery.
11.
Wykorzystywany w badaniach toksymetrycznych zapis NDSP określa
a)
najwyższe dopuszczalne stężenie procentowe.
b)
najwyższe dopuszczalne stężenie pułapowe.
c)
najniższe dopuszczalne stężenie procentowe.
d)
najniższe dopuszczalne stężenie pułapowe.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
12.
Do grupy nefrotoksyn nie należy
a)
formalina.
b)
ksylen.
c)
aceton.
d)
tetrachlorometan.
13.
Pozostały z ćwiczenia roztwór zasady sodowej uczeń unieszkodliwił przez
a)
rozcieńczenie zasady wodą i wylanie do zlewu.
b)
neutralizację kwasem solnym i wylanie do zlewu.
c)
rozcieńczenie wodą i umieszczenie zasady w pojemniku ceramicznym.
d)
rozcieńczenie zasady wodą, neutralizację kwasem i umieszczenie w pojemniku
ceramicznym.
14.
Metale i ich związki są niebezpieczne dla zdrowia człowieka ze względu na
a)
skłonności wbudowywania się w tkanki organizmu.
b)
tworzenie połączeń z substancją białkową.
c)
kumulację w organach organizmu.
d)
kierowanie katalityczne przemianami metabolicznymi.
15.
Pestycydy stosowane są do zwalczania różnorodnego zwalczania szkodników. Fungicydy
stosowane są jako substancje
a)
owadobójcze
b)
chwastobójcze.
c)
grzybobójcze.
d)
usuwające liście.
16.
Badając wodę z jeziora wykryto i określono stężenie kadmu. Najwięcej tego metalu
człowiek wchłonie
a)
kąpiąc się w jeziorze.
b)
pijąc z niego surową wodę.
c)
pijąc wodę przegotowaną.
d)
zjadając ryby pochodzące z tego jeziora.
17.
Współoddziaływanie co najmniej dwóch toksyn może być
a)
sumujące się.
b)
redukujące się.
c)
eliminujące.
d)
potęgujące.
18.
Dawka śmiertelna arsenu dla człowieka wynosi 10 mg na kilogram masy ciała. Dawka
ś
miertelna arsenu dla mężczyzny ważącego 80 kg wyniesie
a)
0,800 mg.
b)
8 · 10
2
mg.
c)
80 mg.
d)
8 · 10
-3
mg.
19.
Objawem ostrego zatrucia organizmu metanolem jest
a)
zaburzenie układu pokarmowego.
b)
ś
lepota.
c)
obniżenie ciśnienia krwi.
d)
zawroty głowy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
20.
Toksyny w organizmie ulegają różnorodnym przemianom biochemicznym, które
nazywamy
a)
adsorpcją.
b)
dystrybucją.
c)
biotransformacją.
d)
denaturacją.
21.
Działanie toksyczne występujące w krótkim czasie po podaniu substancji szkodliwej
nazywa się toksycznością
a)
podostrą.
b)
słabą.
c)
zlokalizowaną.
d)
ostrą.
22.
Przyczyną umyślnego zatrucia nie może być
a)
próba samobójstwa.
b)
wypicie dużej ilości alkoholu.
c)
przedawkowanie leków.
d)
przyjęcie niewłaściwego leku.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Stosowanie podstawowych zasad toksykologii
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
21.
a
b
c
d
22.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Test 2
Test dwustopniowy do jednostki modułowej „Stosowanie podstawowych
zasad toksykologii”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
–
zadania 1, 4, 5, 6, 7, 9, 10, 11, 13, 14, 15, 16, 18, 19 są z poziomu podstawowego,
–
zadania 2, 3, 8, 12, 17, 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. d, 2. a, 3. a, 4. c, 5. c, 6. b, 7. a, 8. b, 9. a, 10. b, 11.c, 12.
b, 13. d, 14. a, 15. d, 16. c, 17. d, 18. d, 19. b, 20. a
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Rozróżnić z grupy charakter
toksyczny tlenków
B
P
d
2
Wybrać prawidłową definicję
toksykometrii
C
PP
a
3
Przewidzieć substancje szkodliwe
przeznaczone do utylizacji
D
PP
a
4
Sklasyfikować objawy zatruć gazami
C
P
c
5
Rozróżnić z grupy związków
toksycznych substancje szkodliwe
B
P
c
6
Określić skrót nazwy
C
P
b
7
Sformułować zadania ogólne
toksykologii
A
P
a
8
Przewidzieć oddziaływanie toksyn na
organizm
D
PP
b
9
Rozróżnić metale działające na
wątrobę w organizmie
B
P
a

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
10
Wybrać sposób zwalczania
niepożądanych zmian w świecie flory
i fauny
C
P
b
11
Podać oznaczenie substancji
toksycznych dla środowiska
A
P
c
12
Wybrać
przemiany
zachodzące
w organizmie
po
dostaniu
się
substancji obcej
C
PP
b
13
Rozróżnić dawki o różnym działaniu
na organizmy
B
P
d
14
Określić sposób powstawania
produktów o słabym działaniu
toksycznym
C
P
a
15
Przedstawić objawy zatrucia gazem
B
P
d
16
Zastosować odpowiednie oznaczanie
roztworów dekontaminacyjnych do
neutralizacji
C
P
c
17
Sklasyfikować do odpowiedniej
grupy związków organicznych
substancje toksyczne
C
PP
d
18
Sklasyfikować kierunki działań
toksykologii stosowanej
C
P
d
19
Nazwać inaczej odtrutkę
A
P
b
20
Dokonać analizy chemicznej
słuszności stosowania prawa Nernsta
D
PP
a

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 20 zadań o różnym stopniu trudności.
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1. Toksycznym tlenkiem jest
a)
MgO.
b)
CaO.
c)
CO
2.
d)
N
2
O
x.
2.
Istotą toksykometrii jest
a)
pomiar dopuszczalnych stężeń substancji szkodliwych.
b)
określenie właściwości substancji szkodliwych.
c)
analiza ilościowa substancji szkodliwych.
d)
ocena szkodliwości działania toksyn na organizm.
3.
Wskaż zestaw w którym znajdują się wyłącznie substancje do utylizacji
a)
benzen, tetrachlorek węgla.
b)
kwas solny, chlorek sodu.
c)
amoniak, węglan amonu.
d)
kwas octowy, chlorek sodu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
4.
Objawami zatrucia gazami drażniącymi są
a)
omdlenia i zawroty głowy.
b)
bóle brzucha i wymioty.
c)
podrażnienie błon śluzowych i łzawienie oczu.
d)
bóle i zawroty głowy.
5.
Związkiem toksycznym jest
a)
skrobia.
b)
tlenek krzemu (IV).
c)
chlorowodór.
d)
gliceryna.
6.
Interpretacją NDS jest określenie
a)
najniższe dopuszczalne stężenie.
b)
najwyższe dopuszczalne stężenie.
c)
niedopuszczalna dawka stężenia.
d)
najwyższa dawka stężenia.
7.
Toksykologia opiera się na
a)
rozpoznaniu charakterystycznej substancji stanowiącej niebezpieczeństwo dla zdrowie
i środowiska naturalnego.
b)
rozpowszechnianiu substancji chemicznych.
c)
identyfikacji substancji szkodliwej.
d)
tworzeniu kart charakterystyki substancji chemicznych.
8.
Pojęcie teratogenne oznacza
a)
powodujące zagrożenie wybuchem.
b)
mogące działać szkodliwie na płód.
c)
działające szkodliwie na organizmy wodne.
d)
mogące się rozgrzać i zapalić w kontakcie z powietrzem.
9.
Kumulację w wątrobie wykazują
a)
Mn, Co, As.
b)
Sn, Mg, Ca.
c)
F, B, Cl
2
.
d)
Ca, Bi, Mg.
10.
Pestycydy stosowane są w celu
a)
zwalczania roślin.
b)
rozwoju drobnoustrojów.
c)
umożliwienia rozwoju organizmów roślinnych i zwierzęcych.
d)
zapobiegania rozwojowi organizmów roślinnych i zwierzęcych niszczących produkty
rolne.
11.
Substancję toksyczną dla środowiska oznaczamy literą
a)
E.
b)
O.
c)
N.
d)
T.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
12.
Zadaniem biotransformacji jest
a)
reakcja spalania tłuszczów.
b)
uleganie substancji obcej różnym przemianom biochemicznym.
c)
reakcja hydrolizy cukrów.
d)
otrzymywanie tlenku węgla (IV).
13.
Dawką, która wykazuje działanie farmakoterapeutyczne i nie wywołuje zaburzeń
procesów fizjologicznych jest
a)
toksyczna.
b)
ś
miertelna.
c)
graniczna.
d)
lecznicza.
14.
Detoksykacja pozwala na
a)
tworzenie się produktów o słabym działaniu toksycznym.
b)
narażenie czynnikami toksycznymi.
c)
zaburzenia ze strony układu moczowego.
d)
narażenie czynnikami o mocnym działaniu toksycznym.
15.
Objawem zatrucia czadem są
a)
zaburzenia pracy serca.
b)
zawroty głowy.
c)
sinica.
d)
wszystkie wymienione.
16.
W neutralizacji substancji niebezpiecznych stosowane są roztwory dekontaminacyjne
a)
RF
1
, RF
2
, RF
3
.
b)
RD
1
, RF
3
, RD
3
.
c)
RD
1
, RD
2
, RD
3
.
d)
RD
1
, RF
1
, RF
2.
17.
Do grupy wielopierścieniowych węglowodorów aromatycznych zaliczamy
a)
benzen.
b)
alkohol metylowy.
c)
acetylen.
d)
chryzen.
18.
Kierunkiem działań toksykologii stosowanej jest
a)
badanie kliniczne.
b)
badanie sądowo-lekarskie.
c)
badanie doświadczalne.
d)
wszystkie odpowiedzi są prawidłowe.
19.
Synonimem odtrutki jest
a)
specyfik.
b)
antidotum.
c)
odczynnik.
d)
likwidator.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
20.
W stanie równowagi stosunek stężenia substancji rozpuszczonej w obu fazach określa
prawo podziału Nernsta, które jest słuszne, gdy
a)
nie zachodzą reakcje chemiczne pomiędzy składnikami faz.
b)
występuje dysocjacja cząstek wydzielonej substancji z mieszaniny ciekłej.
c)
rozpuszczalnik pierwotny i wtórny są wzajemnie rozpuszczalne.
d)
zachodzi asocjacja cząstek wydzielonej substancji z mieszaniny ciekłej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Stosowanie podstawowych zasad toksykologii
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
7.
LITERATURA
1.
Bodzek D.(red.): Chemia i fizykochemia substancji toksycznych i niebezpiecznych.
Ś
AM, Katowice 2003
2.
Brandys J.(red.): Toksykologia – wybrane zagadnienia. Wyd. UJ, Kraków 1999
3. Brzyska W. (red.): Ćwiczenia z chemii ogólnej. Wyd. UMCS, Lublin 1997
4. Ciesielski W., Zakrzewski R., Skrzypek S.: Laboratorium analizy instrumentalnej. Wyd.
UŁ, 2002
5. Cygański.A.: Chemiczne metody analizy ilościowej. WNT, Warszawa 1992
6. Dreisbach R.H., Robertson W.O.: Vademecum zatruć. Wyd. Lekarskie PZWL, Warszawa
1995
7.
Łopata K.: Chemia a środowisko. WSIP, Warszawa 1994
8.
Rączkowski B.: BHP w praktyce. ODIDK, Gdańsk 2000
9.
Seńczuk W.(red.): Toksykologia. Wyd. Lekarskie PZWL, Warszawa 1999
10.
Schmid F., Latkowski B., Wasilewski B.(red.): Homotoksykologia kliniczna.Aurelia –
Verlag Baden – Baden, Warszawa 1998
11.
Zakrzewski. S.F.: Podstawy toksykologii środowiska. PWN, Warszawa 2000
12.
Zawieski MW (red.).: Ocena ryzyka zawodowego. CIOP PIB, Warszawa 2004
Literatura metodyczna:
1.
Jeruszka U., Niemierko B. (red.): Zastosowania pomiaru sprawdzającego w kształceniu
zawodowym. MEN, Warszawa 1997
2.
Szlosek F.: Wstęp do dydaktyki przedmiotów zawodowych. ITE, Radom 1998
Wyszukiwarka
Podobne podstrony:
07 Stosowanie podstawowych zasad toksykologii
07 Stosowanie podstawowych zasad toksykologii
07 Stosowanie podstawowych technik wytwarzania części
07 Stosowanie podstawowych zasa Nieznany (2)
07 Stosowanie zasad gospodarki magazynowej
03.03.07, Nauka, Podstawy Psychologii
14513-podstawowe zasad i charakterystyka krajowego rejestru sądowego, st. Administracja notatki
CHEMIA LABORATORIUM SPRAWOZDANIE Działanie podstawowych zasad i kwasów na metale wersja 2
Projektowanie baz danych Wykłady Sem 5, pbd 2006.01.07 wykład03, Podstawy projektowania
Analizowanie działania oraz stosowanie podstawowych maszyn i urządzeń elektrycznych
07 Stosowanie przepisów bezpieczeństwa i higieny pracy
Bezpieczne ferie - przypomnienie i omówienie podstawowych zasad, Pedagogiczne
07- INSTRUKCJA BHP ZASAD BEZPIECZEŃSTWA EKSPL URZĄDZEŃ I IN~2, Instrukcje BHP, VII - ELEKTRYKA
Podstawowe pojęcia toksykologi, Kosmetologia, Notatki i wyłady, Farmakologia
07 Sporządzanie podstawowego asortymentu potraw zbożowych
04 Analizowanie działania oraz stosowanie podstawowych maszyn
sprawozdanie 07, sem 3, Podstawy elektrotechniki i elektroniki, Laboratoria, sprawodzania 2011 zima
12 podstawowych zasad rachunkowości
09 Stosowanie podstawowych tech Nieznany
więcej podobnych podstron