
1
Ćwiczenie 10.
Diagnostyka pałeczek Gram-ujemnych niefermentujących glukozy.
Diagnostyka bakterii beztlenowych
I. Pałeczki niefermentujące glukozy są to pałeczki tlenowe, nie wytwarzające przetrwalników, które
charakteryzuje brak zdolności fermentacji glukozy, tzn. rozkładania glukozy bez udziału tlenu.
Klasyfikacja pałeczek Gram-ujemnych niefermentujących (wybrane rodzaje, mające znaczenie w
zakażeniach człowieka)
Rodzaj:
Pseudomonas
około 100 gatunków
Gatunek: P. aeruginosa
P. fluorescens
P. putida
Rodzaj:
Burkholderia
około 30 gatunków
Gatunek: B. mallei
B. pseudomallei
B. cepacia
B. gladioli
Rodzaj: Ralstonia
Gatunek: R. picketti
Rodzaj:
Stenotrophomonas
5 gatunków
Gatunek: S.maltophilia
Rodzaj:
Alcaligenes
4 gatunki
Gatunek: A. faecalis
Rodzaj: Achromobacter
7 gatunków
Gatunek: A. xylosoxidans
Rodzaj: Chryseobacterium
Gatunek: Ch. indologenes
Ch. meningosepticum
Rodzaj: Flavobacterium
13 gatunków
Gatunek: F. meningosepticum
Rodzaj
: Acinetobacter
16 gatunków
Gatunek: A. baumannii
A. lwoffii
A. calcoaceticus
A. haemolyticus
Pałeczki niefermentujące glukozy są obecnie częstą przyczyną zakażeń szpitalnych pacjentów z chorobami
zagrażającymi życiu i z obniżoną odpornością organizmu.
Wywołują one: - posocznice
-
zakażenia układu oddechowego
-
septyczne zapalenie stawów
-
zakażenia układu moczowego
-
pooperacyjne i pourazowe zakażenia ran
-
zapalenie spojówek i inne
Miejscem ich naturalnego występowania jest woda, gleba, ścieki i żywność. Mogą rozwijać się w ubogich w
składniki odżywcze środowiskach. Stanowią również składnik mikroflory skóry (pachy, pachwiny,
przestrzenie międzypalcowe) i są często przenoszone na rękach pacjentów i personelu szpitalnego
(Acinetobacter!).
Charakteryzują się wieloraką opornością na antybiotyki. Niektóre (np. Acinetobacter) są oporne na
wszystkie betalaktamy z grupy penicylin, inne (np. Stenotrophomonas maltophilia) na imipenem lub
(Burkholderia cepacia) na gentamycynę.
Identyfikacja
Uwzględnia się takie cechy biochemiczne jak:

2
zdolność do fermentacji i oksydacji glukozy
zdolność do wzrostu na podłożu Mac Conkeya
aktywność oksydazy cytochromowej
ruch
wytwarzanie barwnika
hydroliza mocznika
redukcja azotanów
wytwarzanie indolu
dekarboksylacja aminokwasów
hydroliza eskuliny
W praktyce wykorzystuje się gotowe zestawy umożliwiające identyfikację do gatunku np. API 20NE, ID 32
GN w ramach systemu ATB Expression firmy bioMerieux, karty GN do systemu Vitek 2 compact.
1. Pseudomonas aeruginosa
Pałeczka ropy błękitnej, tlenowa, szeroko rozpowszechniona w przyrodzie (gleba, woda, ścieki, rośliny,
owady, zwierzęta), chorobotwórcza dla roślin, owadów i zwierząt.
Zakażenia przez nią wywoływane najczęściej rozpoczynają się w miejscach wilgotnych np.
-
przy rurce tracheotomijnej
-
cewnikach
-
w miejscach oparzeń
-
uchu zewnętrznym („ucho pływaka”)
-
w ranach
-
zakażenia dróg moczowych
-
zakażenia dolnych dróg oddechowych
-
zapalenie rogówki, zakażenie wrzodu rogówki, zakażenie głębokie gałki ocznej
-
bakteriemie i posocznice
-
zapalenie wsierdzia
-
zapalenie opon mózgowo-rdzeniowych
-
ropnie mózgu
-
zakażenia kości i/lub stawów
-
endocarditis
Wytwarza barwniki fenazynowe, rozpuszczalne w wodzie i dyfundujące do podłoża:
-
fluoresceina (piowerdyna) – barwnik fluoryzujący
-
piocyjanina (barwnik niebieski)
-
piorubryna (czerwony)
-
melanina (brązowy)
Szczepy szpitalne Pseudomonas aeruginosa mogą nie wytwarzać barwników!
Czynniki, które decydują o chorobotwórczości Pseudomonas aeruginosa:
-
egzotoksyna A
-
enterotoksyna (enteritis, biegunka 5-dniowa w klimacie tropikalnym)
-
ciepłochwiejna fosfolipaza C (lecytynaza)
-
ciepłostały glikolipid wywołujący hemolizę krwinek w temp. 22-37
o
C
-
leukocydyna (uwalniana po lizie komórek – cytotoksyczne działanie na ludzkie
leukocyty)
-
enzymy proteolityczne (elastaza, kolagenaza, żelatynaza, fibrynolizyna)
- otoczka alginianowa, która jest zbudowana z polimeru kwasów mannurowego i
glukuronowego. Szczepy wydzielające ten związek mają wygląd śluzowaty (połyskujący).
Rutynowa diagnostyka Pseudomonas aeruginosa
-
posiew materiału na
podłoże wybiórcze z cetrymidem (bromek cetylotrójmetyloamonowy 0.02% i kwas
nalidyksowy 15 mg/l jako czynniki selektywne) może służyć do bezpośredniego
posiewu kału, ropy lub moczu; zalecane do wykrywania P. aeruginosa w żywności i
wodzie; używane zarówno w badaniach systematycznych w warunkach szpitalnych, jak i
w przemyśle – zanieczyszczenie powierzchni, aparatury, przyrządów, środków

3
antyseptycznych itd.) – obserwacja wytworzenia piocyjaniny i fluoresceiny (w
świetle lampy UV) po inkubacji 24-48 godzinnej w temp. 35
0
C
podłoże King B z nitrofurantoiną (zahamowanie rozwoju większości pałeczek Gram-
ujemnych) – po 24 godzinnej inkubacji w temp. 35-37
0
C obserwacja w świetle lampy
UV zielonej, niebieskiej lub zielono-żółtej fluorescencji
Pseudomonas aeruginosa wzrasta również na zwykłym podłożu agarowym i agarowym z dodatkiem 5%
krwi baraniej, tworząc duże, szarobrązowożółte kolonie (Morfologia kolonii: S-gładka, R-szorstka, M-
śluzowa). Otoczenie kolonii zazwyczaj wybarwione jest na kolor żółtozielony lub zielononiebieski.
Zapach: miodu lub jaśminu (trimetyloamina).
-
preparat barwiony metodą Grama – Pseudomonas aeruginosa to pałeczka Gram-
ujemna.
-
wzrost w temp. 42
0
C - Pseudomonas aeruginosa wzrasta w tej temp. w podłożu
bulionowym.
-
wykrywanie piocyjaniny w podłożu płynnym – warstwa chloroformu dodanego do 24h
hodowli bulionowej zabarwia się na kolor zieloniebieski; na powierzchni hodowli
widoczna jest błonka. Powyższe obserwacje charakterystyczne są dla Pseudomonas
aeruginosa.
-
wykrywanie ruchu - w półpłynnym podłożu z dodatkiem TTC (chlorek
trójfenylotetrazoliwy) – Pseudomonas aeruginosa wykazuje wzrost i zaczerwienienie w
górnej części podłoża i wzdłuż linii wkłucia. Jest urzęsiony biegunowo.
-
wykrywanie oksydazy cytochromowej – odczynnik tetrametylo-p-fenylodiamina
reaguje z cytochromem c wytwarzając składnik koloru niebieskiego
metoda probówkowa: zawiesić badany szczep, z 18-24h hodowli stałej, w jałowej wodzie destylowanej,
a następnie dodać w/w odczynnik; w ciągu 30s do 2 min. szczep wytwarzający oksydazę powoduje
powstanie intensywnego niebieskiego zabarwienia
metoda bibułowa: na krążek bibuły filtracyjnej umieszczonej w płytce Petriego nanieść 2-4 krople
odczynnika, a następnie za pomocą bagietki nanieść na bibułę z odczynnikiem badany szczep z 18-24h
hodowli stałej; w ciągu 30s do 2 min. szczep wytwarzający oksydazę powoduje powstanie intensywnego
niebieskiego zabarwienia
testy komercyjne: Bactident Oxidase (Merck)
Oxidase test
(bioMerieux)
Dry-slide oxidase (Difco)
Pseudomonas aeruginosa jest pałeczką oksydazo-dodatnią.
- rozkład glukozy (O/F) na podłożu Hugh-Leifsona zawierającym 1% glukozę oraz błękit
bromotymolowy jako wskaźnik barwny; badany szczep posiewa się do dwóch probówek z
podłożem Hugh-Leifsona, jedną z nich zalewa się jałową parafiną; inkubacja w temp. 35-37
0
C 24
godziny do 5 dni;
zdolność do fermentacji glukozy (F) – zmiana zabarwienia do żółtego występuje w obu
probówkach (z parafiną i bez parafiny);
zdolność do oksydacji glukozy (O) – zmiana zabarwienia do żółtego tylko w probówce
bez parafiny
Pseudomonas aeruginosa powoduje oksydację glukozy.
-
redukcja azotanów do azotynów - na podłożu o specjalnym składzie w obecności
odczynników:
-naftolu w lodowatym kwasie octowym i kwasu sulfanilowego w
lodowatym kwasie octowym;
zdolność redukcji azotanów do azotynów – powstanie czerwonego zabarwienia w ciągu
5 minut;

4
zdolność redukcji azotanów do wolnego azotu – brak czerwonego zabarwienia po
dodaniu sproszkowanego cynku, gdy nie wystąpiła w/w reakcja;
brak zdolności redukcji azotanów do azotynów – czerwone zabarwienie po dodaniu
sproszkowanego cynku
Pseudomonas aeruginosa redukuje azotany do wolnego azotu, ale niektóre szczepy mogą redukować
azotany do azotynów.
-
wytwarzanie dihydrolazy argininy - enzym rozkłada argininę do ornityny,
amoniaku i CO
2
, co powoduje wzrost pH (zmiana zabarwienia wskaźnika-czerwieni
fenolowej z żółtej na czerwoną). Pseudomonas aeruginosa wytwarza dihydrolazę
argininy.
-
redukcja TTC - powstaje czerwony strąt (formazon) w hodowli płynnej lub czerwono
zabarwione kolonie z metalicznym połyskiem na podłożu agarowym. Są to reakcje
charakterystyczne dla Pseudomonas aeruginosa.
-
identyfikacja do gatunku za pomocą biochemicznych mikrotestów komercyjnych: API
20 NE i ID 32 GN w ramach systemu ATB Expression, kart GN w systemie Vitek 2
compact (bioMerieux)
-
typowanie pałeczek P. aeruginosa dla celów epidemiologicznych (identyfikacja
wewnątrzgatunkowa): serologiczne, bakteriofagowe, bakteriocynowe (piocynowe),
biochemiczne, enzymatyczne, genetyczne.
Pałeczki P. aeruginosa charakteryzuje naturalna oporność na liczne leki (penicylina G, ampicylina,
amoksycylina z kwasem klawulanowym, cefalosporyny I-II generacji, tetracykliny/tigecyklina, linkozamidy,
stare chinoliny, ertapenem, chloramfenikol, kanamycyna i neomycyna, trimetoprim).
Aktywne mogą być: karbenicylina, tikarcylina, ureidopenicyliny (piperacylina), aztreonam (monobaktamy),
ceftazydym i cefoperazon (cefalosporyny III generacji), cefpirom (IV generacja cefalosporyn), imipenem i
meropenem (karbapenemy), Timentin i Tazocin (preparaty skojarzone), aminoglikozydy i fluorochinolony
(wysokie odsetki szczepów opornych).
2. Acinetobacter spp.
Gram-ujemna ziarniako-podobna-pałeczka, tlenowa, szeroko rozpowszechniona w przyrodzie (środowisko
wodne, gleba, żywność, u ludzi i zwierząt). U człowieka bytuje na skórze (pachy, pachwiny, przestrzenie
między palcami nóg), rzadziej kolonizuje przewód pokarmowy, jamę nosowo-gardłową i pochwę.
Wywołuje zakażenia u chorych o zmniejszonej odporności, po zabiegach inwazyjnych, ciężkich i
długotrwałych zabiegach chirurgicznych. Jest to drobnoustrój powodujący typowe zakażenia szpitalne. Może
wywoływać:
-
zakażenia dolnych dróg oddechowych (chorzy intubowani)
-
bakteriemie i posocznice
-
zapalenie otrzewnej (u chorych dializowanych)
-
zakażenia układu moczowego (chorzy z cewnikami założonymi na stałe)
-
zapalenie opon mózgowych (po zabiegach neurochirurgicznych)
-
zapalenie spojówek i/lub gałki ocznej
-
zapalenie wsierdzia
-
zapalenie stawów, kości i szpiku
-
zakażenia skóry i ran
Nie wytwarza barwników (obserwowano powstawanie brązowego barwnika przechodzącego do podłoża
wyłącznie na agarze z wyciągiem z serca wołowego).
Diagnostyka:
-
preparat barwiony metodą Grama – Acinetobacter to Gram-ujemna ziarniako-
podobna-pałeczka
-
wzrost na podłożach – Acinetobacter dobrze rośnie na podłożu MacConkeya (z
wyjątkiem nielicznych szczepów A. lwoffii), na zwykłym podłożu agarowym i na
podłożu agarowym z krwią

5
-
wykrywanie ruchu – Acinetobacter nie wykazuje ruchu (brak urzęsienia)
-
wykrywanie oksydazy cytochromowej – Acinetobacter to pałeczka oksydazo-ujemna
-
rozkład glukozy (O/F) – niektóre szczepy powodują
rozkład tlenowy glukozy na
podłożu Hugh-Leifsona, inne mogą być asacharolityczne.
-
redukcja azotanów do azotynów – Acinetobacter nie wykazuje zdolności redukcji
azotanów do azotynów
-
wytwarzanie dihydrolazy argininy – Acinetobacter nie wytwarza dihydrolazy argininy
W identyfikacji do gatunku wykorzystuje się testy fenotypowe, np. API 20 NE lub ID 32 GN bioMerieux.,
karty GN w systemie Vitek 2 compact.
Obecnie wyróżnia się 12 gatunków genetycznych wyodrębnionych dzięki technice hybrydyzacji DNA-DNA.
Z materiałów klinicznych najczęściej izoluje się gatunek A. baumannii, natomiast rzadziej inne gatunki: A.
lwoffii, A. johnsonii, A. junii, A. haemolyticus.
Acinetobacter baumannii charakteryzuje wieloraka oporność na antybiotyki. Oporność naturalna na:
ampicylinę, amoksycylina z kw. Klawulanowym Aktywne mogą być nieliczne leki, m.in. ampicylina z
sulbaktamem, ceftazydym, imipenem i meropenem, fluorochinolony oraz skojarzenia ceftazydymu i
cefotaksymu z aminoglikozydami lub fluorochinolonami.
6
Część praktyczna
Morfologia kolonii
Wzrost wielu drobnoustrojów na podłożach stałych jest charakterystyczny i często umożliwia wstępną
identyfikację i ukierunkowanie dalszych badań, których celem jest określenie gatunku badanego szczepu.
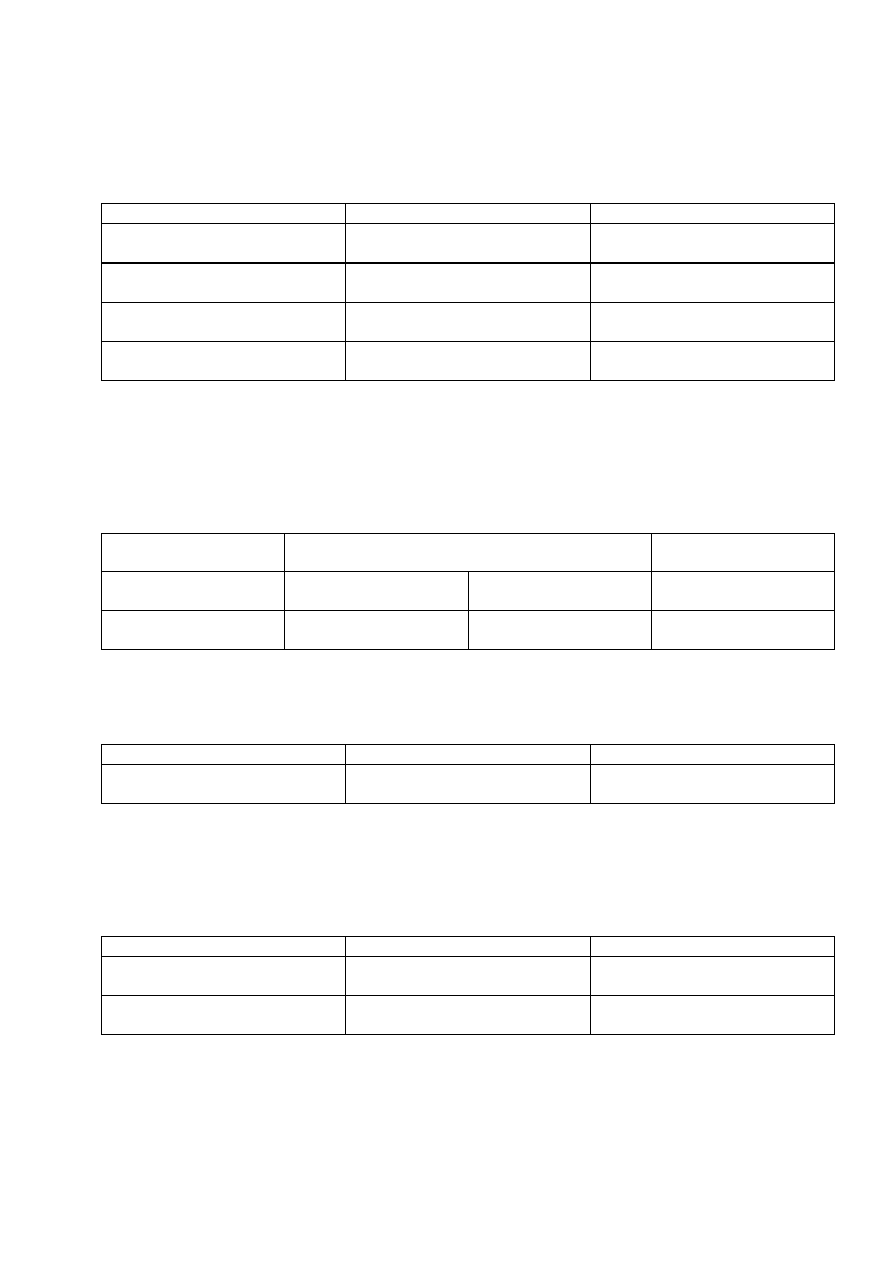
Zwróć uwagę na wygląd kolonii i zapach hodowli i wpisz swoje obserwacje do tabeli.
Podłoże
Pseudomonas aeruginosa
Acinetobacter spp.
Agarowe
(zapach
hodowli,
wytwarzanie barwnika)
Agarowe z krwią (hemoliza)
Mac Conkey’a (wzrost na podłożu
i fermentacja laktozy)
Z
cetrymidem
(piocyjanina,
fluoresceina – lampa UV)
Test utlenianie-fermentacja glukozy (OF-oxidation-fermentation)
Do różnicowania drobnoustrojów wykorzystuje się ich wybrane cechy metaboliczne. W identyfikacji wielu z
nich, także i pałeczek Gram-ujemnych, określa się zdolność do fermentacji glukozy. W teście tym
odróżniamy pałeczki Gram(-) fermentujące glukozę od pałeczek Gram(-) niefermentujących glukozy w
podłożu Hugh – Leifsona z błękitem bromotymolowym jako wskaźnikiem barwnym.
Odczytaj wynik badania i wpisz do tabeli
Podłoże
pokryte parafiną bez parafiny
Interpretacja
Pseudomonas aeruginosa
Acinetobacter spp.
„+” zmiana barwy z niebieskiej na żółtą
„-„ brak zmiany barwy
Test na wytwarzanie oksydazy
Odczytaj wynik badania i wpisz do tabeli
Pseudomonas aeruginosa
Acinetobacter spp.
Wynik
„+” intensywnie niebiesko-fioletowe zabarwienie
„-„ brak intensywnie niebiesko-fioletowego zabarwienia
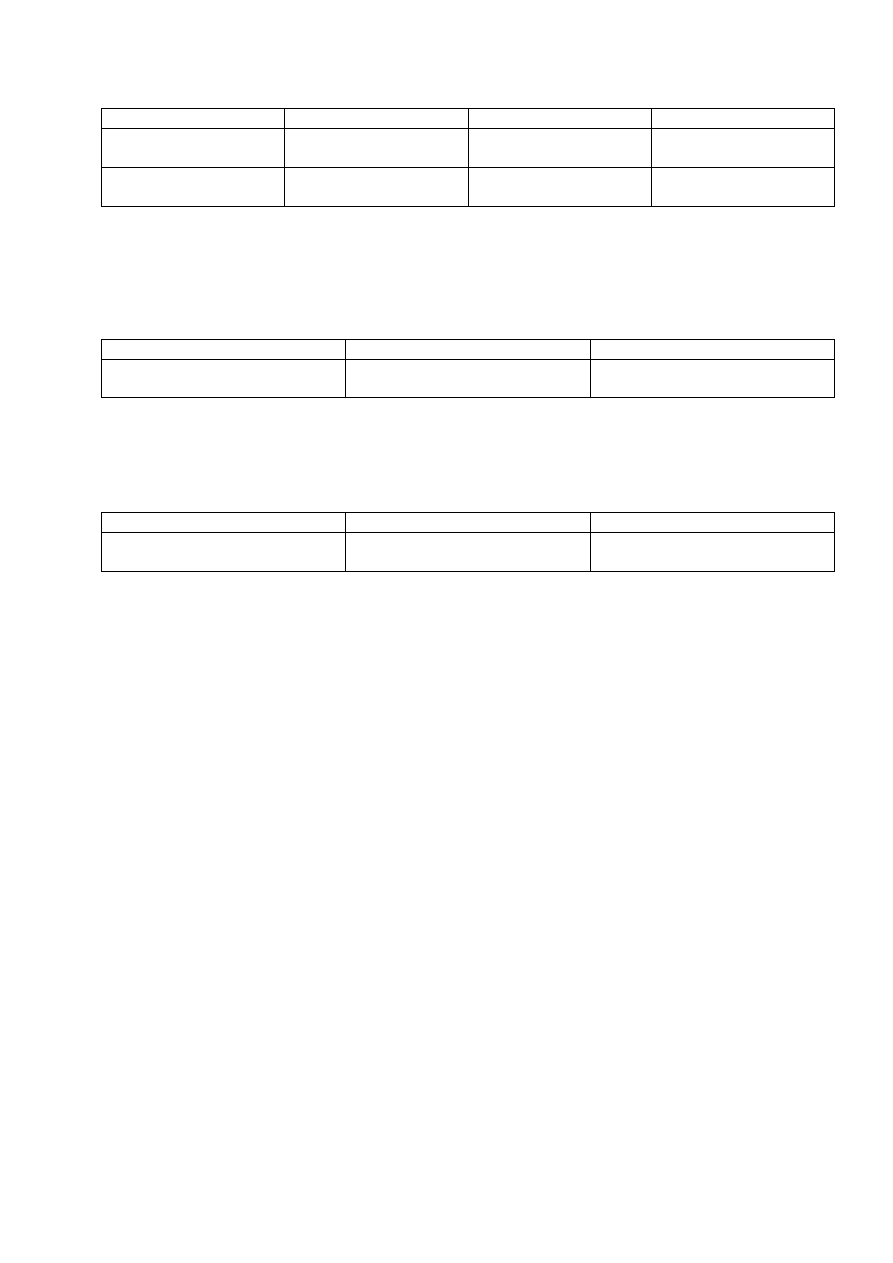
Wzrost w bulionie
Wykorzystując zdobytą już wiedzę o typach wzrostu i wpływie temperatury na wzrost drobnoustrojów w
podłożu płynnym uzupełnij tabelę. Zwróć uwagę na wytwarzanie barwnika!
Bulion inkubowany w 37
0
C
Bulion inkubowany w 42
0
C
Pseudomonas aeruginosa
Acinetobacter spp.
7
Redukcja azotanów
Odczytaj wynik badania i wpisz do tabeli
NO
3
/NO
2
NO
3
/N
2
Interpretacja
Pseudomonas aeruginosa
Acinetobacter spp.
NO
3
/NO
2
– czerwone zabarwienie po dodaniu odczynników – „+”
NO
3
/N
2
– brak zabarwienia po dodaniu odczynników i cynku – „+”
„-„brak zabarwienia po dodaniu odczynników i czerwone zabarwienie po dodaniu cynku
Redukcja TTC na podłożu stałym
Odczytaj wynik badania i wpisz do tabeli
Pseudomonas aeruginosa
Acinetobacter spp.
Wynik
„+” czerwone zabarwienie kolonii na podłożu stałym
„-„ brak czerwonego zabarwienia
Wykrywanie ruchu w półpłynnym podłożu
Odczytaj wynik badania i wpisz do tabeli
Pseudomonas aeruginosa
Acinetobacter spp.
Wynik
„+” wzrost w podłożu i czerwone wybarwienie
„-„ wzrost tylko wzdłuż linii wkłucia
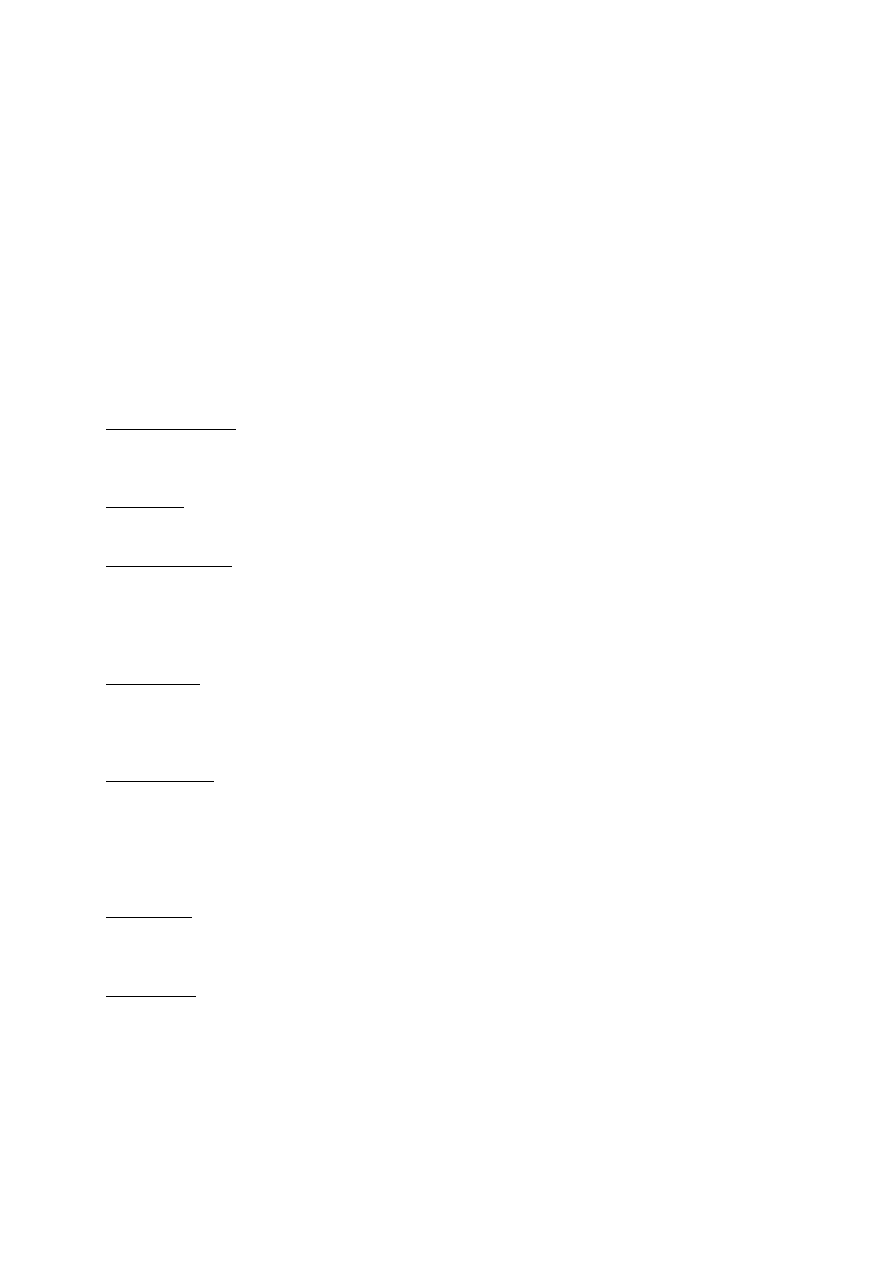
8
II. Diagnostyka bakterii beztlenowych
Bakterie beztlenowe można podzielić na przetrwalnikujące i nieprzetrwalnikujące.
Bakterie beztlenowe nieprzetrwalnikujące należą do różnych rodzajów bakterii Gram-ujemnych i
Gram-dodatnich.
Pałeczki Gram-ujemne: Grupa Bacteroides fragilis, Grupa Bacteroides ureolyticus, Wolinella,
Fusobacterium, Porphyromonas, Prevotella, Mobiluncus, Megamonas, Selenomonas, Leptotrichia,
Anaerospirillum
Pałeczki Gram-dodatnie: Propionibacterium, Eubacterium, Bifidobacterium, Actinomyces, Lactobacillus
Ziarniaki Gram-ujemne:Veillonella
Ziarniaki Gram-dodatnie: Peptostreptococcus.
Bakterie beztlenowe nieprzetrwalnikujące stanowią florę fizjologiczną, kolonizują jamę ustną, przewód
pokarmowy, pochwę, skórę. W jelicie grubym i kieszonce dziąsłowej występują w stosunku 1000:1.
Zakażenia przez nie wywoływane maja często etiologię mieszaną i dochodzi do nich po przerwaniu ciągłości
tkanek, w miejscu fizjologicznego występowania beztlenowców: operacje, ekstrakcja zęba, cukrzyca,
owrzodzenia, nowotwory. Uraz zmniejsza ukrwienie i obniża stężenie tlenu, co w efekcie powoduje
martwicę niedokrwienną, namnażanie względnych beztlenowców, następnie ścisłych beztlenowców, to
wywołuje stan zapalny, napływ granulocytów i ropień.
Peptostreptococcus:
fizjologiczne występowanie: jama ustna, jelita, pochwa
zakażenia: okołozębowe, jamy brzusznej, narządu rodnego, rany kąsane, w 80-90% zakażenia
mieszane
Veillonella:
fizjologiczne występowanie: jama ustna, pochwa
zakażenia: okołozębowe, głowy, szyi, narządu rodnego, zakażenia mieszane
Propionibacterium:P. acnes, P.granulosum, P. avidum
fizjologiczne występowanie: głębsze warstwy skóry, gruczoły potowe, gruczoły łojowe
wytwarza kwas octowy i propionowy, histaminę i tryptaminę, są oporne na wewnątrzkomórkowe
niszczenie przez granulocyty
zakażenia: nasilają zmiany trądzikowe, rzadko zakażenia oportunistyczne protez, oka, kości,
bakteriemia
Actinomyces: A. israelli, A.viscosus, A. naeslundii, A. odontolyticus
fizjologiczne występowanie: płytka nazębna (współudział w próchnicy), pochwa
zakażenia: promienica twarzowo-szyjna (po ekstrakcji zęba, urazach), promienica klatki piersiowej,
promienica brzuszna, zakażenia wewnątrzmaciczne (wkładki mechaniczne). Charakterystyczna
wydzielina krwisto-ropna z „ziarnami siarki”
Bifidobacterium
fizjologiczne występowanie: jama ustna, przewód pokarmowy, pochwa
wytwarza witaminy B
1
, B
2
, K, uwalnia kwas mlekowy, który ułatwia wchłanianie wapnia; gatunki
stanowiące naturalną mikroflorę pochwy, rozkładają glikogen ze złuszczonego nabłonka pochwy,
wytwarzając kwas mlekowy i kwas octowy – zapewnia to kwasowość środowiska pochwy i chroni
przed wtargnięciem chorobotwórczej flory bakteryjnej
zakażenia: oportunistyczne, mieszane infekcje dolnych dróg oddechowych
Eubacterium
fizjologiczne występowanie: nosogardziel, kieszonki dziąsłowe, płytka nazębna, jelito grube,
pochwa
zakażenia: oportunistyczne, zapalenia ozębnej
Lactobacillus
fizjologiczne występowanie: jama ustna, przewód pokarmowy (zwłaszcza u niemowląt karmionych
piersią), pochwa (rola ochronna w zapobieganiu kolonizacji i rozmnażaniu się drobnoustrojów
chorobotwórczych, co wynika z wytwarzania przez te pałeczki bakteriocyn, kwasów organicznych –
kwas mlekowy i nadtlenku wodoru; ze względu na te właściwości pałeczki te stosowane są jako
probiotyki w leczeniu i profilaktyce biegunek różnego pochodzenia oraz zakażeń pochwy. Pałeczki
zasiedlające pochwę nazywane są pałeczkami Doederleina: L.acidophilus, L.casei subsp.casei,
L.fermentum, L.cellobiosus)
zakażenia: oportunistyczne (u osób z dysfunkcją układu immunologicznego powstałą w wyniku
leczenia chorób nowotworowych za pomocą chemioterapii, radioterapii, stosowania immunosupresji
w zapobieganiu odrzucenia przeszczepu lub wynikająca z innych chorób: AIDS, cukrzyca) –

9
przeważnie posocznica, zapalenie wsierdzia, zapalenie płuc, ropnie narządów wewnętrznych;
udział w próchnicy zębów
Grupa Bacteroides fragilis
fizjologiczne występowanie: przewód pokarmowy, narządy moczowo-płciowe, jama ustna, gardło i
górne drogi oddechowe
zakażenia: oportunistyczne, endogenne, które przebiegają zwykle wytworzeniem ropnia; przewlekłe
zapalenie ucha środkowego, zapalenie zatok, ropnie płuc, zachłystowe zapalenie płuc, ropnie
wątroby, zapalenie dróg żółciowych, zapalenie wyrostka robaczkowego, zakażenie martwicze i
zgorzelinowe w obrębie jamy brzusznej, ropnie dróg rodnych, ostre zapalenie jajników i jajowodów,
ropnie okołoodbytnicze, pourazowe zapalenie kości i tkanek miękkich, zapalenie szpiku, bakteriemie
Porphyromonas
fizjologiczne występowanie: jama ustna
zakażenia: oportunistyczne; infekcje okołozębowe, zakażenia dróg moczowo-płciowych
Prevotella
fizjologiczne występowanie: jama ustna
zakażenia: infekcje ropne w obrębie głowy i szyi, zapalenie dziąseł, zapalenie gardła i migdałków,
zapalenie zatok, przewlekłe zapalenie ucha środkowego, zakażenie dolnych dróg oddechowych, dróg
moczowo-płciowych, bakteryjne zakażenie pochwy
Fusobacterium
fizjologiczne występowanie: jama ustna, na szyjkach zębów, w kieszonkach dziąsłowych, w drogach
oddechowych, w przewodzie pokarmowym, w układzie moczowo-płciowym
zmiany ropne i zgorzelinowe: ropnie płuc i zgorzel płuc, ropnie mózgu, zapalenie gardła i
migdałków, zapalenie opłucnej i otrzewnej, ropnie wątroby, zapalenie szpiku, zmiany martwicze,
owrzodzenia i rany pooperacyjne
Bakterie beztlenowe przetrwalnikujące obejmują rodzaj Clostridium.
Znanych jest ok. 100 gatunków tego rodzaju, z czego ponad 40 izolowano dotąd od ludzi. Niektóre z tych
gatunków wchodzą w skład flory kolonizującej błony śluzowe różnych układów, najczęściej przewodu
pokarmowego. Często są spotykane w kale ludzi zdrowych.
Wszystkie bakterie z rodzaju Clostridium to Gram-dodatnie laseczki, wytwarzające przetrwalniki.
Większość produkuje toksyny i enzymy toksyczne, odpowiedzialne za wywoływanie określonych zmian w
tkankach (skurcz mięśni, zaburzenia przewodnictwa w o.u.n., porażenia spastyczne, zmiany martwicze i
inne). Za toksykoinfekcje odpowiedzialne są głównie:
-
Clostridium perfringens – zgorzel gazowa
(w połączeniu z innymi gatunkami 2, 3 lub więcej, np. Clostridium septicum, Clostridium
novyi, Clostridium sporogenes lub Clostridium histolyticum, Clostridium bifermentans,
Clostridium sordelli lub innych)
-
Clostridium septicum - obrzęk złośliwy
(często w skojarzeniu z Clostridium butiricum, Clostridium baratii, Clostidium
haemolyticum)
-
Clostridium botulinum – zatrucie jadem kiełbasianym
-
Clostridium
difficile
– rzekomobłoniaste zapalenie jelita grubego po
antybiotykoterapii, zespół AAC
-
Clostridium tetani – tężec
Komórki wegetatywne z młodych hodowli barwią się Gram-dodatnio, natomiast ze starych Gram-ujemnie.
Wytwarzają przetrwalniki umieszczone w komórce centralnie, terminalnie lub subterminalnie, stąd
komórki przypominają wyglądem osełkę, rakietę tenisową, pałeczkę dobosza (laseczka tężca) lub maczugę
(można obserwować w preparatach barwionych metodą Schaeffera-Fultona).

10
Należą do drobnoustrojów beztlenowych dlatego muszą być hodowane w warunkach beztlenowych.
Podłoża do hodowli bakterii beztlenowych
-
płynne
bulion tioglikolanowy (bioMerieux - bulion tioglikolanowy z rezazuryną jako
wskaźnikiem stopnia natlenienia podłoża); tioglikolan sodu obniża potencjał oksydo-
redukcyjny podłoża
bulion Schaedlera do izolowania względnych i bezwzględnych beztlenowców; obecność
heminy, ekstraktu drożdżowego, witaminy K3 ułatwia rozwój bakterii o bardzo
wysokich wymaganiach wzrostowych
-
stałe
agar Columbia
agar Columbia + 5% krwinek baranich
agar Schaedlera
agar Schaedlera + 5% krwinek baranich
TSN Agar (Trypcase, Sulfite, Neomycin) (bioMerieux) – podłoże do izolacji
Clostridium perfringens
Systemy do hodowli drobnoustrojów beztlenowych
-
System, który składa się ze szczelnej koperty z przezroczystego plastiku, która
umożliwia dzięki generatorowi, szybkie uzyskanie atmosfery potrzebnej do hodowli
szczepów beztlenowych. Generator zawiera mieszaninę sproszkowanego żelaza, kwasu
cytrynowego i dwuwęglanu sodu. Po dodaniu wody następuje usunięcie tlenu i
wzbogacenie atmosfery w CO
2
, co zapewnia szybki wzrost hodowli beztlenowej np.
Generbag anaer (bioMerieux), Anaerocult P, C mini, A mini (Merck)
-
system, który składa się z puszki (2.5 litrowy zbiornik ze stali nierdzewnej lub
przejrzystego plastiku), generatora umożliwiajacego uzyskanie warunków beztlenowych
Generbox anaer (bioMerieux) – generator w postaci koperty, która zawiera 3 tabletki z hydroboranem
sodu, dwuwęglanem sodu i kwasem cytrynowym, które mogą wytworzyć około 1,850 ml wodoru i 190
ml dwutlenku węgla. Koperta „beztlenowa” umożliwia otrzymanie warunków beztlenowych w
obecności czynnego katalizatora (aluminium opłaszczone 0.5% palladem). W kopercie znajduje się także
wskaźnik - pasek nasycony roztworem błękitu metylenowego, czynnika redukującego i stabilizatora.
Część reagująca, koloru niebieskiego, odbarwia się w warunkach beztlenowych (reakcja ta może trwać
kilka godzin)
Anaerocult A (Merck) – generator w postaci koperty umożliwiający po dodaniu wody bez katalizatora
uzyskanie warunków beztlenowych w przejrzystej plastikowej puszce mieszczącej 12 płytek Petriego.
Wskaźnik warunków beztlenowych – błękit metylenowy stosowany jest w postaci pasków (Anaerotest).
Bakterie z rodzaju Clostridium
-
nie wytwarzają katalazy
-
nie wytwarzają oksydazy cytochromowej
-
nie wytwarzają peroksydazy
Przy identyfikacji bakterii beztlenowych powinny być uwzględnione takie cechy jak:
-
test na tolerancję tlenu (przesiew na podłoże i hodowla w warunkach tlenowych)
-
morfologia kolonii
-
barwienie metodą Grama
-
ruch
-
testy biochemiczne
-
produkty metaboliczne (GLC)
-
wrażliwość na antybiotyki
-
testy serologiczne
Ostatnio również wprowadzono sondę genetyczną. Do identyfikacji biochemicznej dostępne są gotowe
zestawy handlowe: API 20 A z 24 godzinną inkubacją w warunkach beztlenowych i Rapid ID 32 A w
ramach systemu ATB Expression (bioMerieux) – test 4 godzinny nie wymagający inkubacji beztlenowej
oraz kart do identyfikacji beztlenowców w systemie Vitek 2 compact.

11
Część praktyczna
Wpisz do tabeli swoje obserwacje
Szczep nr 1
Szczep nr 2
Szczep nr 3
Wzrost w podłożu płynnym
(zapach)
Wzrost na podłożu stałym
(zabarwienie wskaźnika!,
morfologia kolonii, zapach)
- inkubacja beztlenowa
- inkubacja tlenowa
Morfologia komórki w preparacie
barwionym metodą Grama
Przetrwalniki w preparacie
barwionym met. Schaeffera-Fultona
Wytwarzanie katalazy
Interpretacja

12
Wyszukiwarka
Podobne podstrony:
Cwiczenie 10 przyklad id 99058 Nieznany
CWICZENIE 10 Termistory id 990 Nieznany
CWICZENIE 10 2012 id 125140 Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
Cwiczenia nr 10 RPiS id 124684 Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
Cwiczenia nr 2 RPiS id 124688 Nieznany
cwiczenie 1b inkscape id 125205 Nieznany
mat bud cwicz 10 11 id 282450 Nieznany
analiza swot (10 stron) id 6157 Nieznany
Cwiczenie nr 15 id 125710 Nieznany
Angielski 4 10 2013 id 63977 Nieznany
mat fiz 2003 10 11 id 282349 Nieznany
Cwiczenia nr 6 RPiS id 124693 Nieznany
cwiczenie nr 2 instrukcja id 12 Nieznany
Proseminarium7 10 2012 id 40197 Nieznany
Cwiczenie9 TWN 2013 id 125932 Nieznany
więcej podobnych podstron