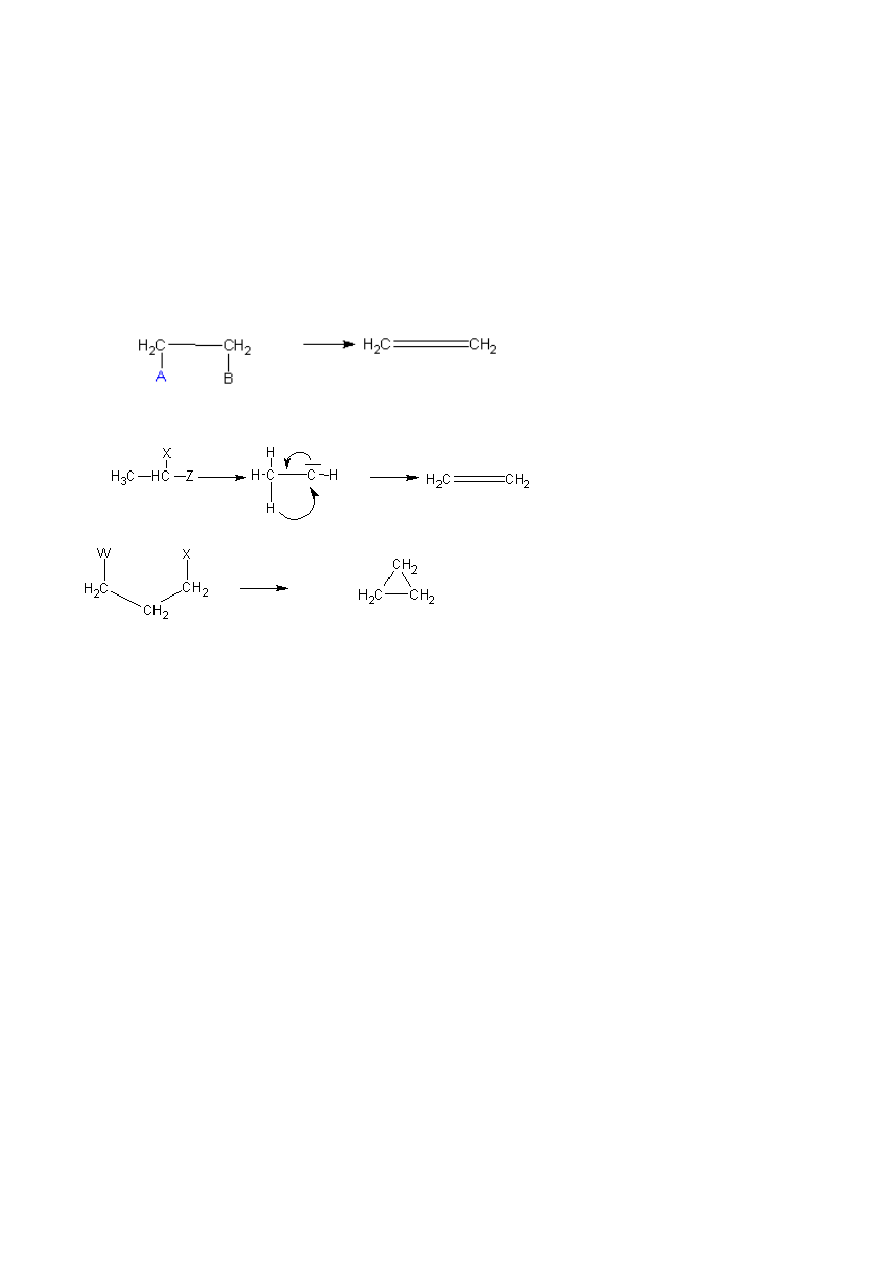
Eliminacja E1 i E2. Mechanizm. Stereochemia, miejsca tworzenia wiązania
podwójnego, reguły (Zajcewa, Hofmanna, Bredta).
Wpływ grupy atakującej i opuszczającej. Wpływ rozpuszczalnika. Zakres stosowalności.
Reakcje konkurencyjne.
Reakcje eliminacji są to reakcje w wyniku, których podstawione węglowodory nasycone przechodzą
w alkeny lub alkiny. Eliminacja E1 tak jak w przypadku Sn1 zachodzi jednocząsteczkowo, natomiast E2,
która jest reakcją konkurencyjną do Sn2 i zachodzi przy użyciu dwóch cząsteczek.
I.
Mechanizm
Ze względu na mechanizm rozróżniamy 3 typy eliminacji:
•
β-eliminacja polega na oderwaniu się dwóch grup od sąsiadujących atomów węgla, co powoduje
powstanie między nimi wiązania podwójnego
•
α-eliminacja polega na oderwaniu się dwóch grup od tego samego atomu węgla i tworzy się
karben. Cząsteczki te mogą utworzyć wiązania podwójne w wyniku przesunięcia jonu
wodorowego.
•
γ-eliminacja polega na oderwaniu dwóch grup i powstaniu pierścienia trójczłonowego
Ograniczę się jednak do omówienia eliminacji β z udziałem dwóch atomów węgla.
A) Mechanizm E1
Reakcja eliminacji E1 jest reakcją dwuetapową i normalnie zachodzi bez obecności zasady. W pierwszym
etapie powstaje karbokation. Etap ten zachodzi powoli a więc decyduje on o szybkości reakcji. W etapie
drugim rozpuszczalnik odrywa proton od węgla β karbokationu, następuje przejście pary elektronowej i
utworzenie podwójnego wiązania. Odłączenie wodoru jest etapem szybkim a więc nie wpływa na szybkość
reakcji. Na szybkość reakcji ma wpływ również budowa łańcucha węglowego. Mianowicie wraz ze
wzrostem rozgałęzienia łańcucha reaktywność rośnie, jest to spowodowane tworzeniem się możliwie
najtrwalszego
karbokationu. Pierwszy etap jest analogiczny do mechanizmu Sn1.
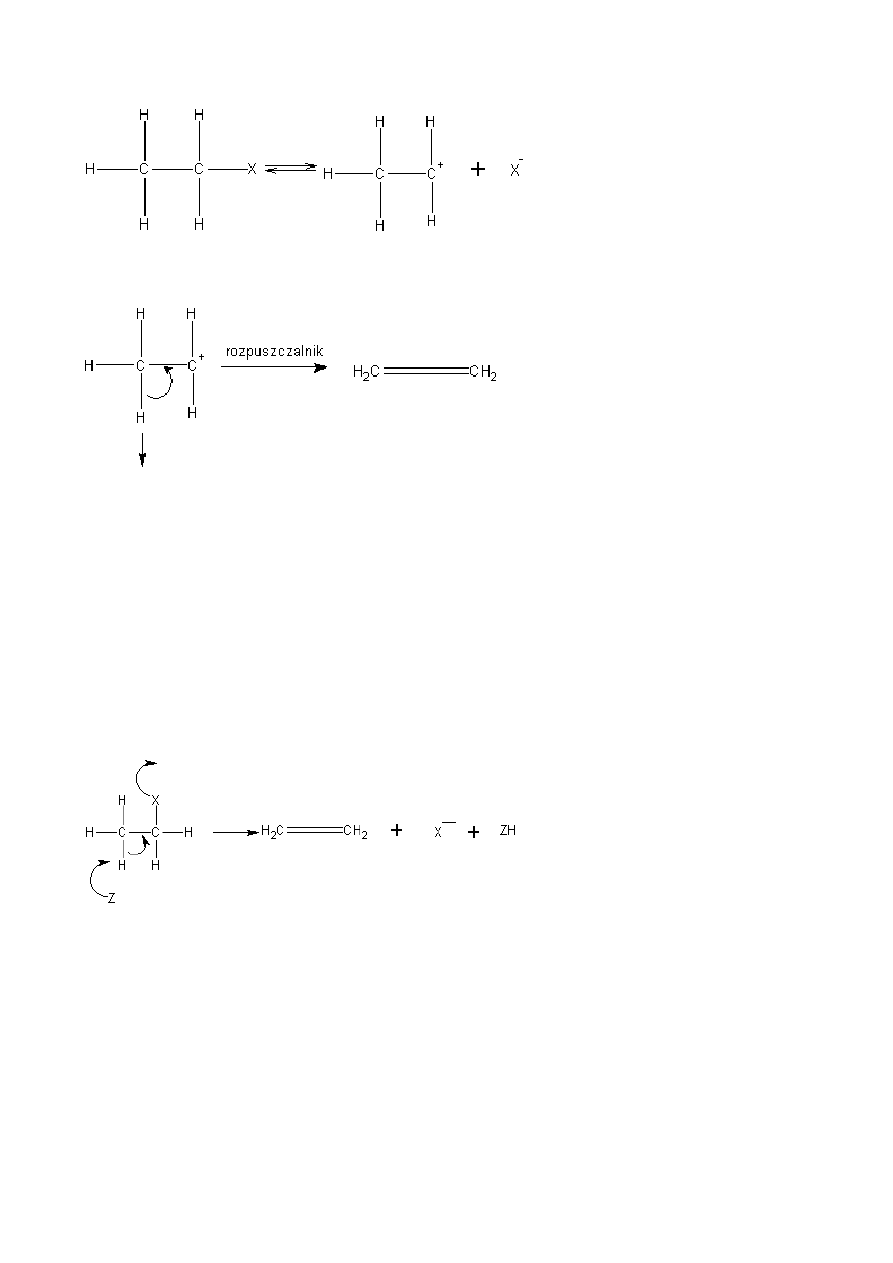
2
Skłonność do eliminacji E1 wykazują głównie trzeciorzędowe halogenopochodne i to wtedy gdy w
mieszaninie reakcyjnej nie znajdują się silne zasady.
Dowody istnienia eliminacji jednocząsteczkowej:
- Reakcja jest pierwszego rzędu w stosunku do substratów
- Jeśli reakcji ulegają dwie cząsteczki różniące się jedynie grupą odchodzącą to szybkości ich reagowania
powinny być rożne, gdyż zależy to od zdolności cząstek do jonizacji. Jeżeli karbokation już się utworzy to w
tym samym rozpuszczalniku i w tych samych warunkach powinny zachodzić identycznego jego przemiany.
Jest to spowodowane brakiem wpływu grupy odchodzącej na drugi etap reakcji.
- Wiele reakcji prowadzonych w łagodnych warunkach przebiega łatwiej, gdy oderwaniu musi ulec wodór z
pozycji cis niż z pozycji trans
- Jeśli powstają przejściowo karbokationy, to przy użyciu odpowiednich substratów można oczekiwać
przegrupowań
B) Mechanizm E2
Jest eliminacją dwucząsteczkową i obydwie grupy odszczepiają się równocześnie, z tym, że proton jest
odciągany przez zasadę.
Reakcja ta zachodzi w jednym etapie i jest drugiego rzędu. Stwierdzono, że reakcje eliminacji E2 tak jak w
przypadku Sn2 przebiegają najczęściej stereospecyficznie, co oznacza ze wszystkie pięć zaangażowanych
atomów leży w jednej płaszczyźnie, natomiast wodór z grupą odchodzącą muszą być w pozycji trans.
Dowody istnienia mechanizmu E2:
- Reakcja jest drugiego rzędu
3
- Eliminacja przebiega w sposób trans, gdy do reakcji weźmiemy związek w konfiguracji treo a z związku
erytro – cis. Eliminacje E2 w sposób trans zaobserwowano również w przypadku, gdy dodatnio naładowaną
grupą nie był proton:
- Eliminacja trans zachodzi również podczas tworzenia wiązania potrójnego, czego dowodzi reakcja
izomerów cis i trans kwasu
COOH
CCl
CH
HOOC
−
=
−
. Wprawdzie z obu powstaje
COOH
C
C
HOOC
−
≡
−
, jednak izomer trans reaguje ok. 50 razy szybciej od izomeru cis, co dowodzi
konfiguracji trans i przewagi eliminacji E2.
II.
Miejsce tworzenia wiązania podwójnego.
W niektórych przypadkach budowa produktu reakcji według mechanizmu eliminacji nie budzi wątpliwości.
Jednakże w wielu przypadkach z jednego substratu może powstać cała grupa produktów, na przykład ze
związku drugorzędowego butylowego może powstać n-buten lub 2-buten.
Nie jesteśmy jednak skazani na zgadywanie struktury produktów. Istnieje szereg reguł pozwalających
określić, jaką strukturę będzie posiadać produkt reakcji eliminacji.
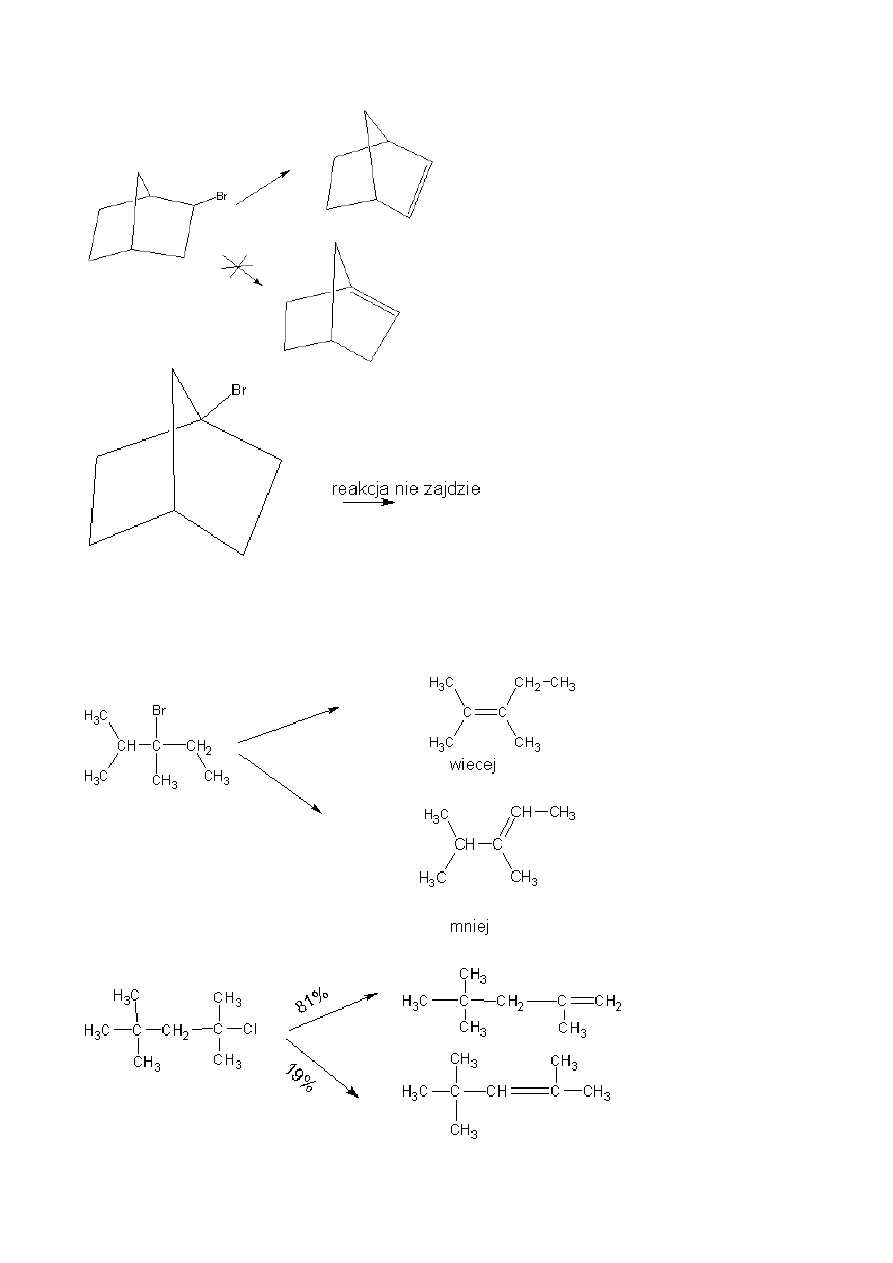
- Wiązanie podwójne w węglowodorach bicyklicznych nie powstaje przy przyczółkowym atomie węgla.
Jest to tzw. Reguła Bredta.
4
- W reakcji E1 w pierwszej kolejności odrywa się grupa, a następnie tworzy się wiązanie podwójne. Takie
reakcje biegną zgodnie z regułą Zajcewa, która głosi, że wiązanie podwójne tworzy się przy atomie węgla,
który jest najbardziej podstawiony. Zgodnie z tym tworzy się głównie alken zawierający możliwie
największą ilość grup alkilowych przy atomach węgla tworzących podwójne wiązanie. Regule tej nie
podlegają reakcje eliminacji E2. Istnieją jednak związki, które reagują niezgodnie z regułą Zajcewa ze
względów przestrzennych.
Reakcja niezgodna z Regułą Zajcewa
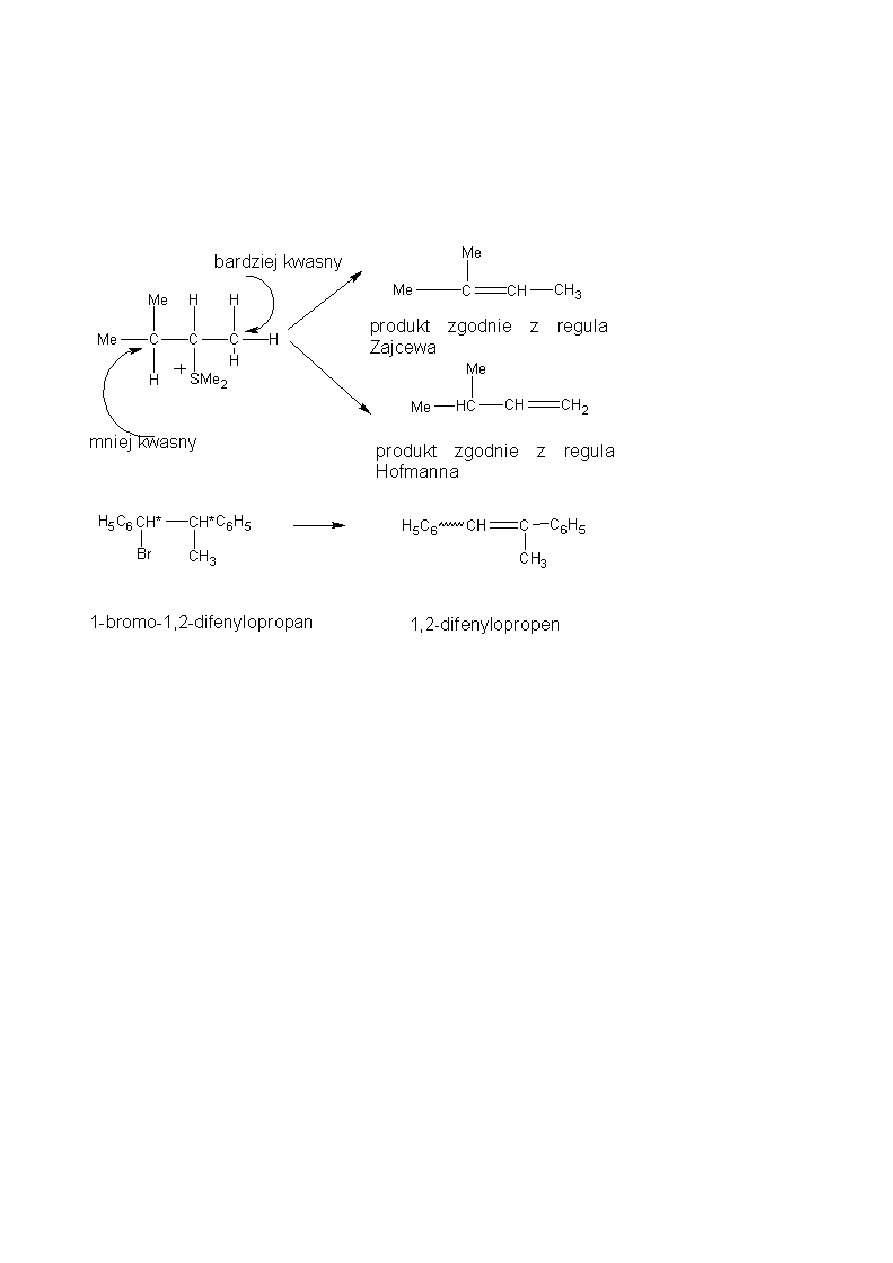
5
- w reakcji eliminacji E2 niezbędny jest atom wodoru leżący w pozycji trans wzglądem grupy odchodzącej.
Jeżeli wodory β znajdują się przy kilku atomach węgla w pozycji trans z grupą odchodzącą to o miejscu
tworzenia wiązania podwójnego decyduje charakter grupy odchodzącej. Przypuszczalnie jeżeli grupa
odszczepiająca się jest naładowana dodatnio to o kierunku eliminacji decyduje kwasowość atomu wodoru.
Związki te reagują zgodnie z regułą Hofmanna, która głosi, że w wyniku eliminacji powstaje alken najmniej
podstawiony. Jest to zgodne ze względną kwasowością wodorów. Jeśli grupa odchodząca nie ma ładunku i
odszczepia się jako jon ujemny to główny produkt powstaje zgodnie z regułą Zajcewa.
III.
Stereochemia
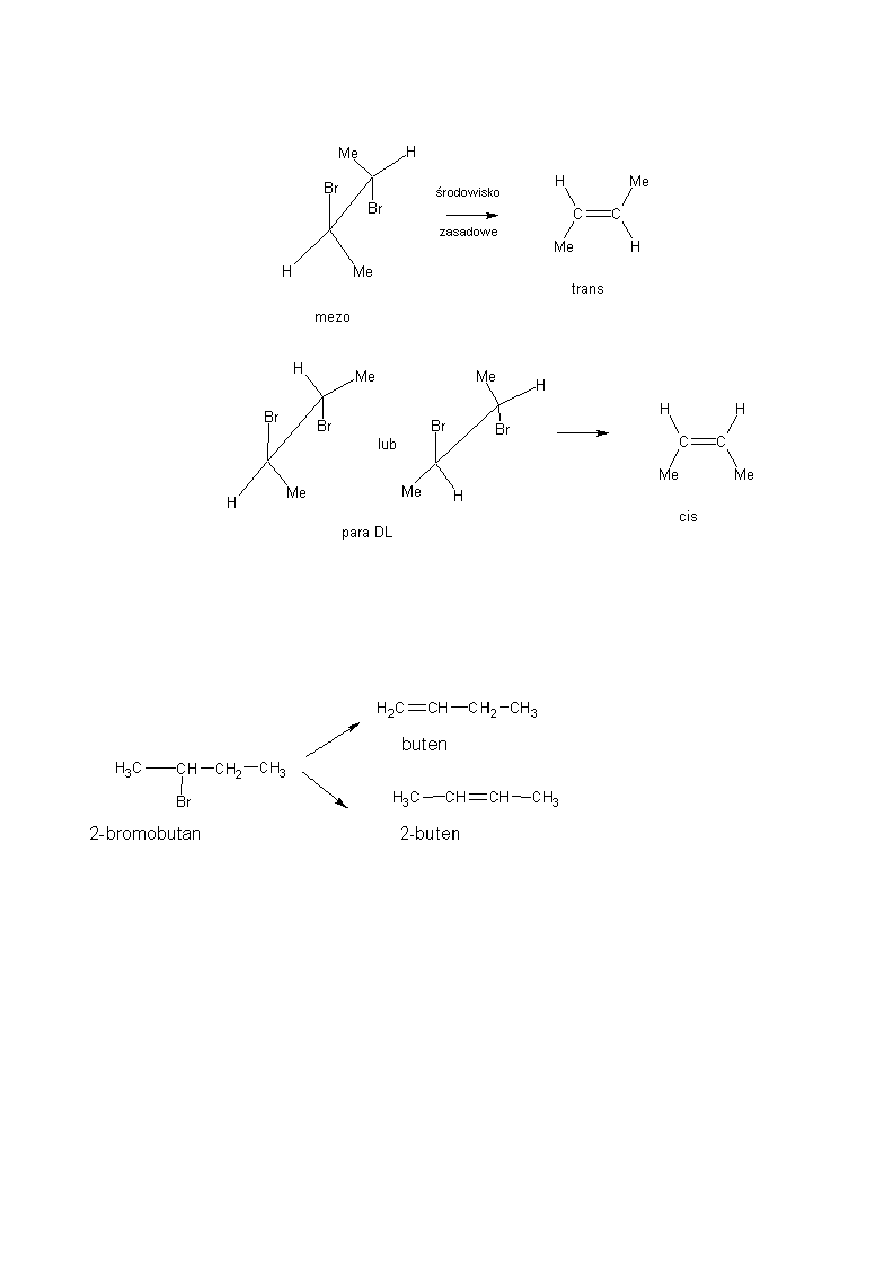
Jeśli jednak halogenek posiada dwa centra chiralności można łatwo wykazać, że może on istnieć w postaci
dwóch par enancjomerów, przy czym każda z par jest względem siebie diastereoizomeryczna. W reakcji
eliminacji E2 z jednej pary enancjomerów powstaje
tylko cis-alken a z drugiej trans-alken. Reakcja jest całkowicie stereospecyficzna.
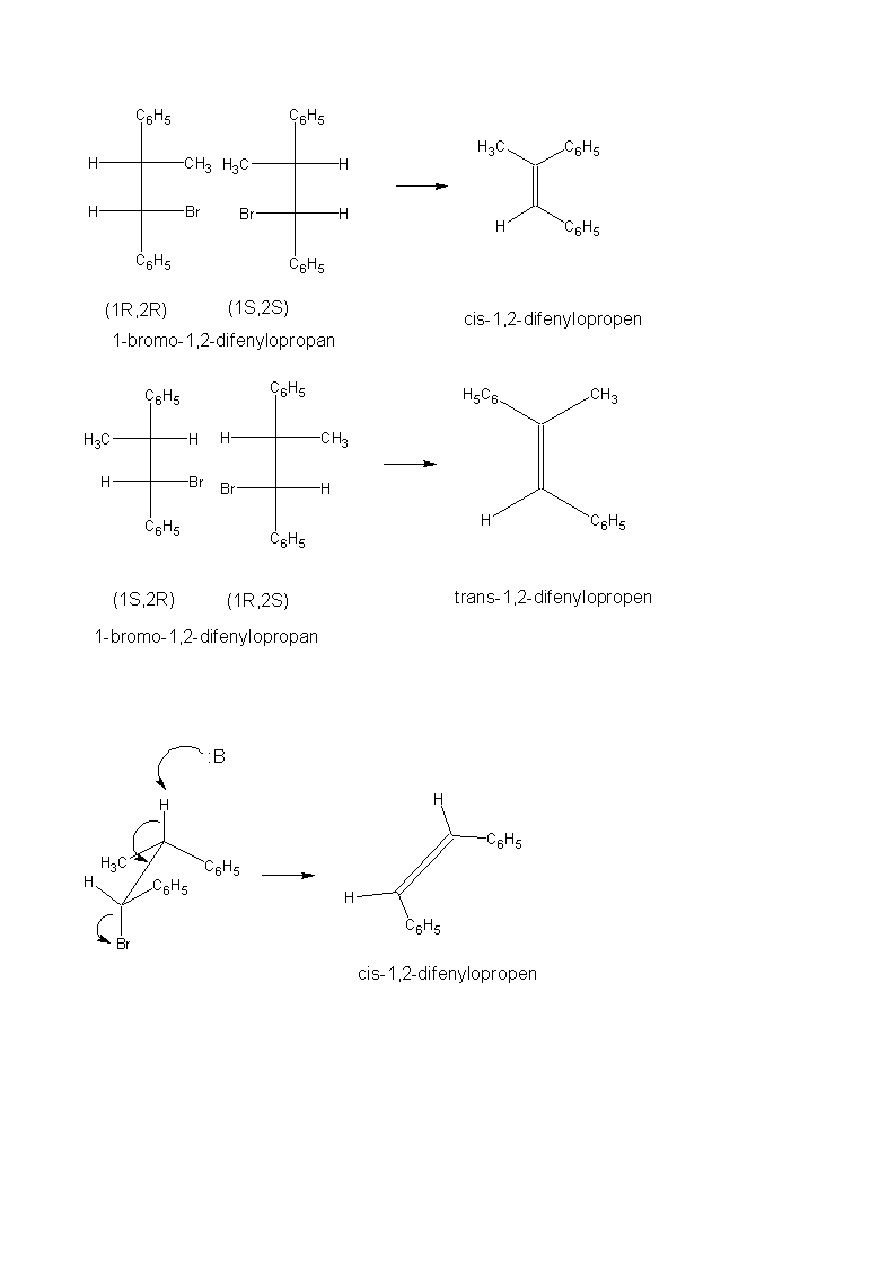
6
Z tego wynika, że dwucząsteczkowa reakcja halogenków jest eliminacją anti. W stanie przejściowym atom
wodoru i grupa opuszczająca są w konformacji antyperiplanarnej, a nie w położeniu wynikającym z
konformacji synklinarnej. Tak więc z diastereizomeru (1R,2R) lub (1S,2S) powstaje cis a z diastereizomeru
(1R,2S) lub (1S,2R) powstaje trans-alken.
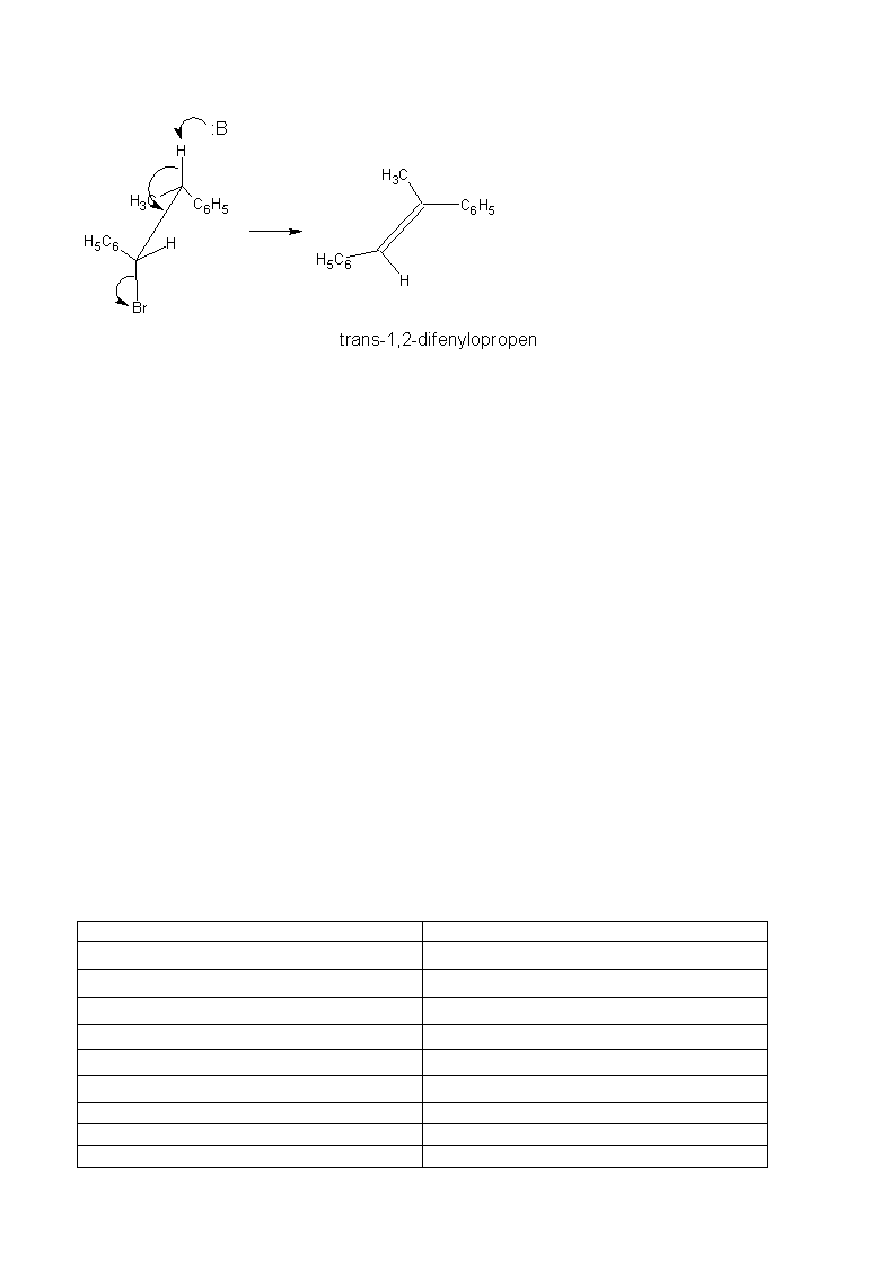
7
Ostatnio ustalono, że reakcje E2 mogą również zachodzić według mechanizmu eliminacji syn. W stanie
przejściowym atom wodoru i grupa opuszczająca są w konformacji synklinarnej. Pomimo że jest to reakcja
nietypowa dla halogenków alkilów, obserwuje się ją często w przypadku czwartorzędowych soli
amoniowych a niekiedy także sulfonianów alkilów.
IV.
Reaktywność
1.
Wpływ budowy substratu
a)
Wpływ na aktywność ogólną
- stabilizować lub destabilizować tworzące się wiązanie podwójne
- stabilizować lub destabilizować powstający karbokation (nie dotyczy E1)
- oddziaływać przestrzennie (dotyczy głównie E2)
Takie grupy jak Ar lub C=C zwiększają szybkość reakcji bez względu na jej mechanizm i to
niezależnie od ich położenia. Grupy przyciągające elektrony zwiększają kwasowość atomów wodoru
będących przy węglu β natomiast nie wywierają wpływu na atom wodoru przy węglu α, chyba, że się
równocześnie sprzęgną z wiązaniem podwójnym.
Grupy zwiększające szybkość eliminacji E2: Br, Cl, CN, NO
2
.
b)
Wpływ na wzajemny stosunek mechanizmów E1 i E2
Grupy α arylowe i α alkilowe wpływają na zwiększenie eliminacji E1, ponieważ stabilizują kompleks
aktywny o charakterze karbokationu. Podobnie pod wpływem grup β alkilowych reakcja nabiera cech
eliminacji E1 ze względu na fakt iż grupy te zmieniają kwasowość wodoru β.
c)
Związki zawierające potencjalną grupę odszczepiającą się w przyczółkowym atomie węgla nie
ulegają eliminacji bez przegrupowania.
2.
Wpływ zasady atakującej
W reakcji biegnącej wg. E1 dodatek zasady na ogól nie jest potrzebny, bo jej rolę spełnia
rozpuszczalnik. Wskutek tego dodatek zasady powoduje wzrost udziału eliminacji E2. Im większe jest
stężenie i im jest mocniejsza tym bardziej mechanizm przesuwa się w kierunku eliminacji E2. Reakcje
E2 najczęściej przeprowadza się z użyciem takich zasad jak:
−
−
−
−
−
−
−
CN
I
LiAlH
CO
NH
OAr
OR
OH
NR
O
H
,
,
,
,
,
,
,
,
,
4
2
3
2
3
2
oraz inne zasady organiczne.
3.
Wpływ grupy odchodzącej
Grupy odszczepiające się w reakcjach eliminacji:
E1
E2
3
NR
3
NR
3
SR
3
PR
+
2
OH
3
SR
+
OHR
+
OHR
R
OSO
2
R
SO
2
OCOR
R
OSO
2
Cl
OCOR
Br
OOH
I
OOR
8
+
2
N
F
Cl
Br
I
CN
W reakcjach o znaczeniu preparatywnym są to grupy
+
2
OH
(zawsze wg E1)
Cl
,
Br
,
I
i
3
NR
(zwykle wg
E2)
4.
Wpływ środowiska
a)
Wpływ rozpuszczalnika na wzajemny stosunek mechanizmów E1 i E2.
Środowisko bardziej polarne zwiększa szybkość reakcji, w których występują częściowo cząstki jonowe.
Jeśli grupy odchodzące są nie naładowane to reakcji E1 będzie sprzyjać wzrost polarności rozpuszczalnika
oraz wzrost jego mocy jonowej. Rozpuszczalnik taki powoduje, że eliminacja zachodzi głównie regułą
Hofmanna, a nie regułą Zajcewa.
b)
Wpływ temperatury
Wzrost temperatury sprzyja bardziej reakcji eliminacji niż podstawienia niezależnie czy przebiega wg
mechanizmu E1 czy E2
V.
Konkurencyjność między reakcjami eliminacji a reakcjami substytucji
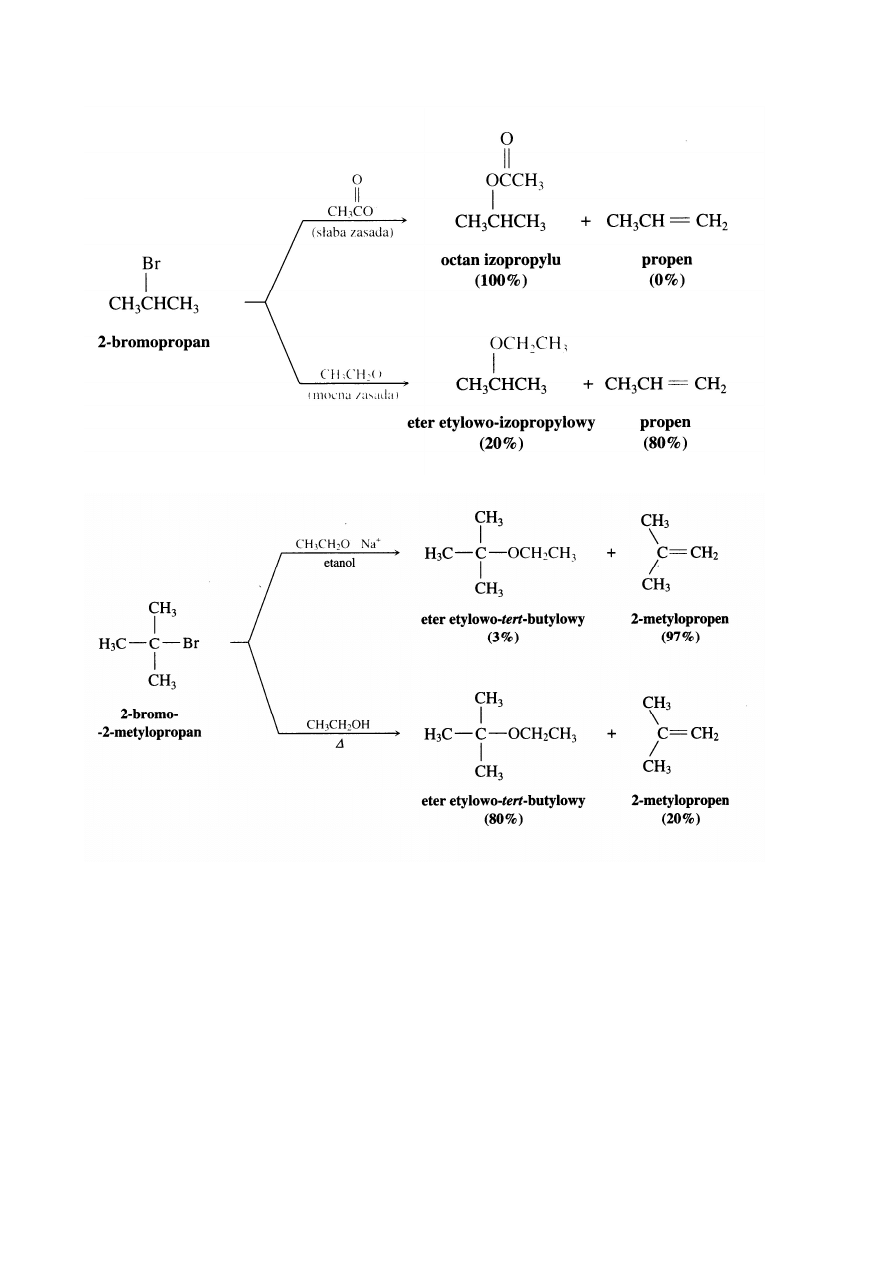
Reakcję otrzymywania alkoholi trzeciorzędowych przeprowadza się stosując rozpuszczalnik o dużej
polarności i reagent o słabej nukleofilowości. Po prostu przeprowadza się ją przez ogrzewanie substratu z
wodą do wrzenia. Nawet w takich warunkach wydajność tworzenia alkoholu trzeciorzędowego nie jest duża.
W znacznym stopniu zachodzi reakcja eliminacji gdyż związkiem przejściowym jest dość trwały
karbokation trzeciorzędowy, który może łatwo utracić proton tworząc alken. Aby w tej reakcji uzyskać
głównie produkt eliminacji należy zastosować rozpuszczalnik o mniejszej polarności i mocną zasadę w
dużym stężeniu.
W reakcji prowadzonej w rozpuszczalniku o małej polarności i z udziałem reagenta nukleofilowego należy
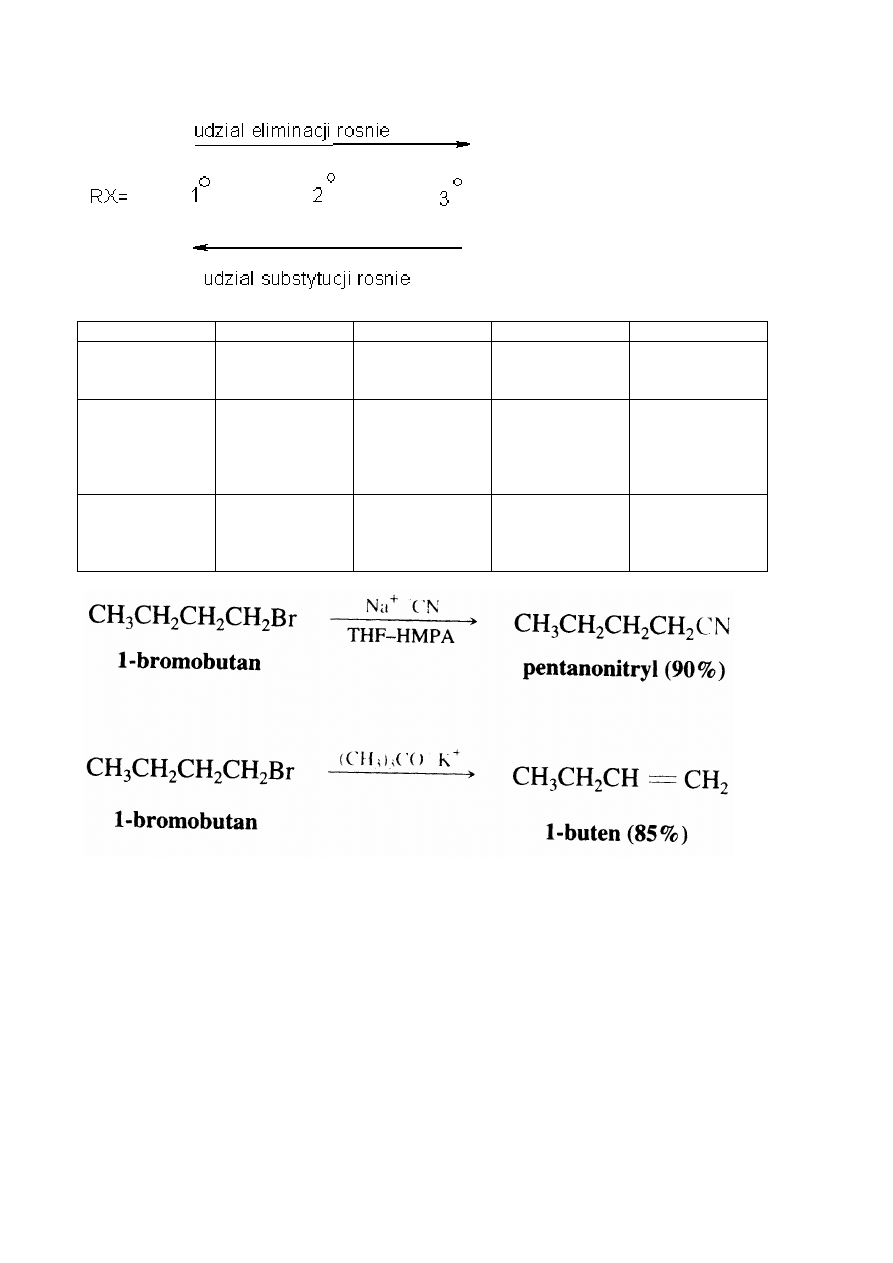
się spodziewać reakcji substytucji. Alkiny powinny się tworzyć najszybciej z halogenków
pierwszorzędowych a najwolniej z trzeciorzędowych. Z drugiej strony szybkość z jaką zachodzi reakcja
eliminacji halogenku alkilu zależy głównie od trwałości utworzonego alkenu. Halogenki trzeciorzędowe
ulegają najszybciej reakcji eliminacji. Udział reakcji eliminacji wzrasta w miarę, jak struktura halogenku
zmienia się od pierwszorzędowej poprzez drugorzędową do trzeciorzędowej.
9
VI.
Podsumowanie
Typ halogenku
Sn1
Sn2
E1
E2
RCH
2
X
Nie zachodzi
Uprzywilejowana
Nie zachodzi
Zachodzi przy
użyciu silnych
zasad
R
2
CHX
Może zachodzić
w przypadku
halogenków
benzylowych i
allilowych
Konkuruje z
reakcją E2
Może zachodzić
w przypadku
halogenków
benzylowych i
allilowych
Uprzywilejowana
przy użyciu
silnych zasad
R
3
CX
Uprzywilejowana
w
rozpuszczalnikach
hydroksylowych
Nie zachodzi
Konkuruje z Sn1
Uprzywilejowana
przy użyciu zasad
Pierwszorzędowe halogenki alkilowe
Drugorzędowe halogenki alkilowe
10
Trzeciorzędowe halogenki alkilowe
Wyszukiwarka
Podobne podstrony:
cLOTHES CROSSWORD E1 E2
chorg w 8 e1 e2
Blaupunkt Travel Pilot E1 E2 Manual
15 Eliminacja E1 i E2id 16021 pptx
Eliminacja trucizny juz wchlonietej
Ch8a E1
eliminacje konkurs II
4) Dynamiczny eliminator drgań
E1 2010 11 zad 2 id 149115
PODSTAWÓWKA ELIMINACJE GMINNE OTWP 2009 ODPOWIEDZI(1), WIOLETTA, Testy + pytania ustne z odpowiedzia
Dieta Eliminacyjna
E2 2010 id 149235 Nieznany
HamInterfacing eliminacji zaklocen w pracy krotkofalarskiej
instrukcja bhp przy eliminowani Nieznany
więcej podobnych podstron