
BUDOWA STOPÓW METALI

Stopy metali
• Substancje wieloskładnikowe, w których co najmniej jeden
składnik jest metalem, wykazujące charakter metaliczny
• Skład chemiczny: stężenie masowe lub atomowe
• Stopy jedno- lub wielofazowe
• Faza: jednorodna część stopu oddzielona granicą
międzyfazową
• Układ: zbiór faz w stanie równowagi termodynamicznej
• Składniki stopów: pierwiastki, roztwory stałe, fazy
międzymetaliczne i międzywęzłowe

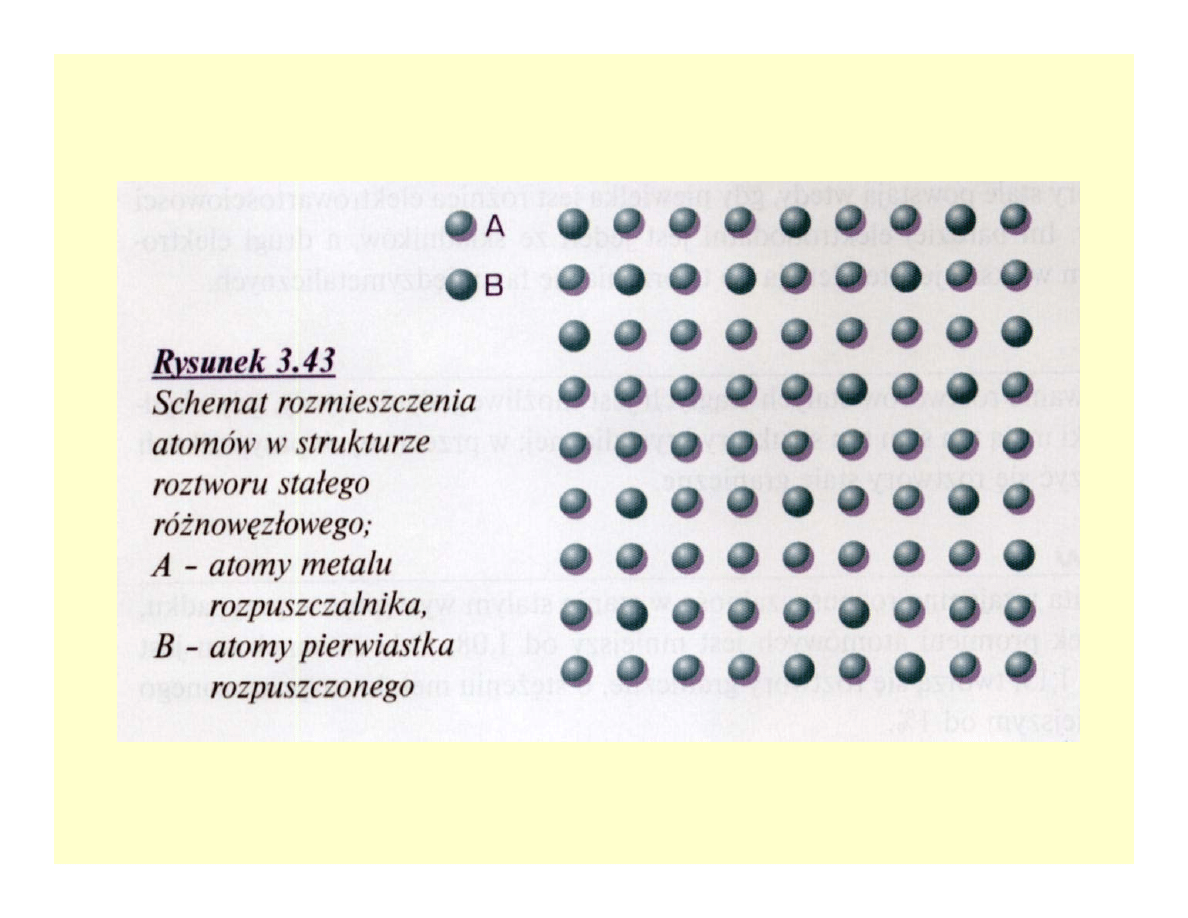
Roztwory stałe
• Jednorodna faza o wiązaniu metalicznym i strukturze
krystalicznej o własnościach metalicznych
• Rozpuszczalnik i pierwiastek rozpuszczony
• Roztwory podstawowe: rozpuszczalnikiem jest pierwiastek
• Roztwory wtórne: rozpuszczalnikiem jest faza
międzymetaliczna
• Roztwory stałe ciągłe i graniczne

Reguły Hume-Rothery`ego
tworzenia roztworów stałych ciągłych
• Typów sieci: oba składniki mają ten sam typ struktury
krystalicznej
• Wielkości atomów: całkowita rozpuszczalność przy
stosunku promieni atomowych <1,08, tylko ograniczona
dla >1,15
• Elektrowartościowości ujemnej: im mniejsza różnica
elektrowartościowości, tym większa możliwość tworzenia
roztworów stałych
• Względnych wartościowości: dla miedziowców
rozpuszczalność metali o wyższej wartościowości w
metalach jednowartościowych jest większa niż odwrotnie

Roztwory stałe
• Międzywęzłowe graniczne; ekspansja sieci.
Tworzy np.. Fe z B, O, C, H, N
• Różnowęzłowe ciągłe lub graniczne;
ekspansja lub kontrakcja sieci
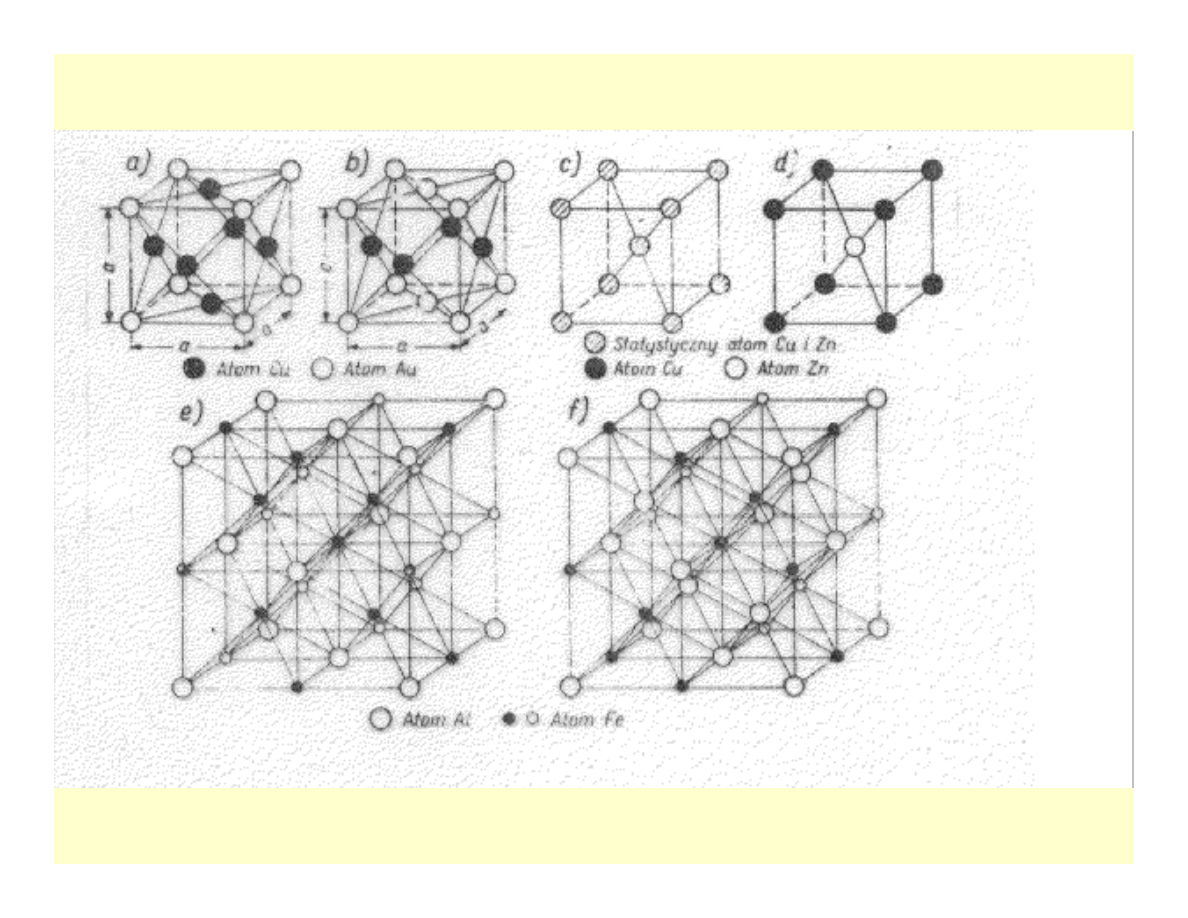



Nadstruktury
• W niektórych roztworach stałych
róznowęzłowych o określonym stężeniu
przemiana nieporządek – porządek w
trakcie chłodzenia lub wygrzewania
• Wzory AB, AB3, A3B


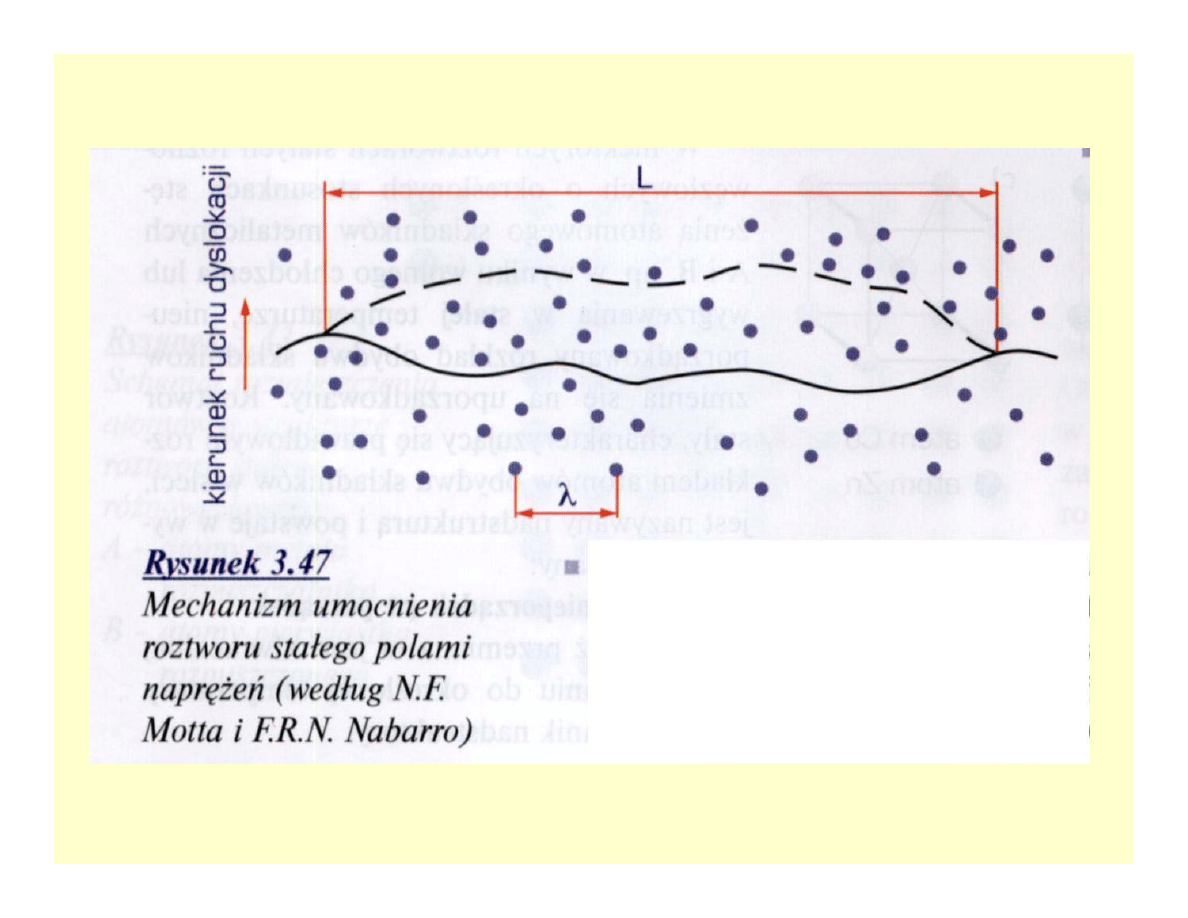
Umocnienie roztworów stałych
• Pokonywanie przez dyslokacje pól naprężeń
(Motta-Nabarro)
• Sprężyste blokowanie ruchu dyslokacji (Cotrella)
• Chemiczne blokowanie rozszczepionych
dyslokacji (Suzuki)
• Geometryczne blokowanie ruchu dyslokacji
(Fishera)

Fazy międzymetaliczne
• Struktura krystaliczna różna od struktury każdego ze
składników
• Uporządkowane rozmieszczenie atomów
• Przewaga wiązania metalicznego
• Wzory podobne do wzorów związków chemicznych przy
braku związku z wartościowością pierwiastków;
odchylenia od stechiometrii
• Roztwory stałe wtórne: różnowęzłowe, międzywęzłowe,
pustowęzłowe
• Klasyfikacja wg stężenia elektronowego lub wielkości
atomów

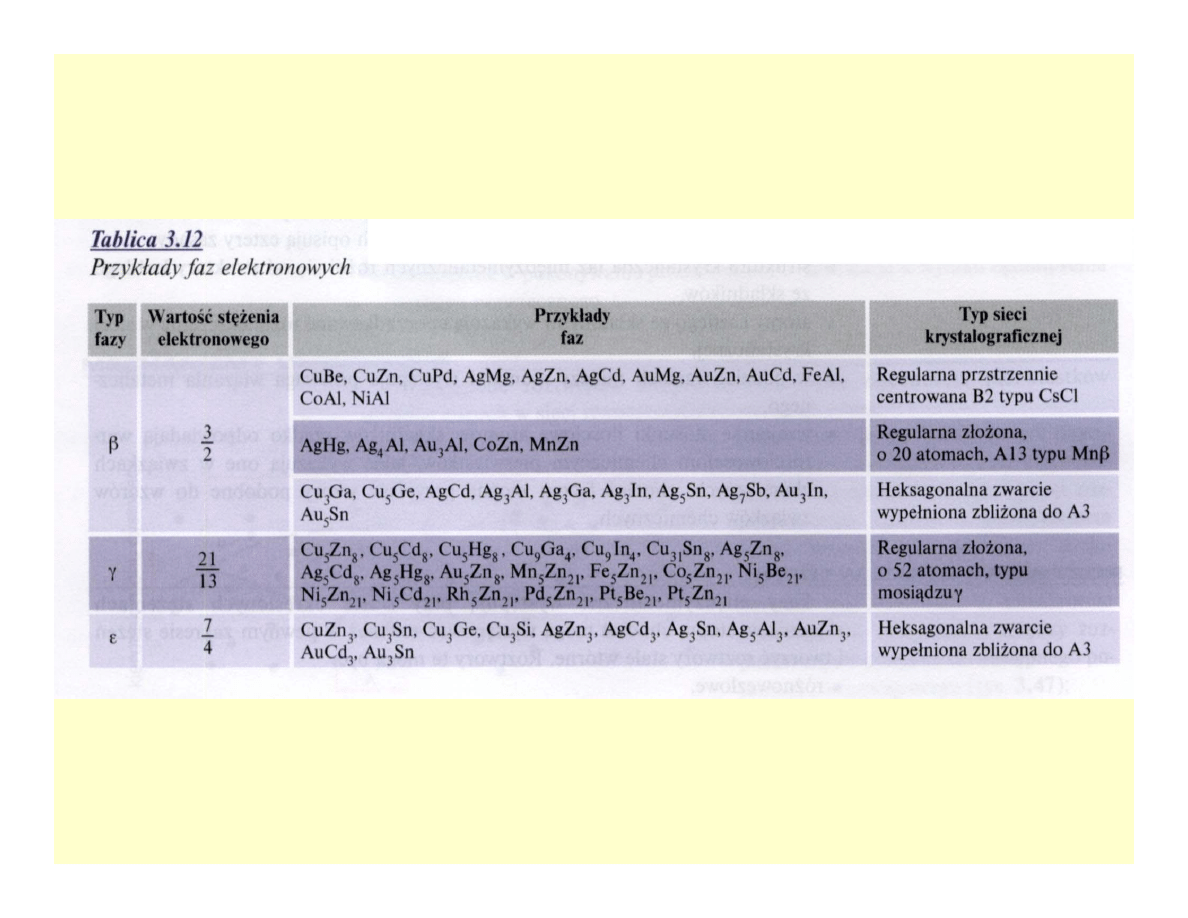
Fazy elektronowe
• Stężenie elektronowe: stosunek liczby elektronów
wartościowości do liczby atomów w komórce
elementarnej (czynnik elektrochemiczny)
• Roztwory stałe wtórne o wyraźnych
właściwościach metalicznych
• Trzy wartości stężenia elektronowego: 21/14
(3/2), 21/13, 21/12 (7/4)


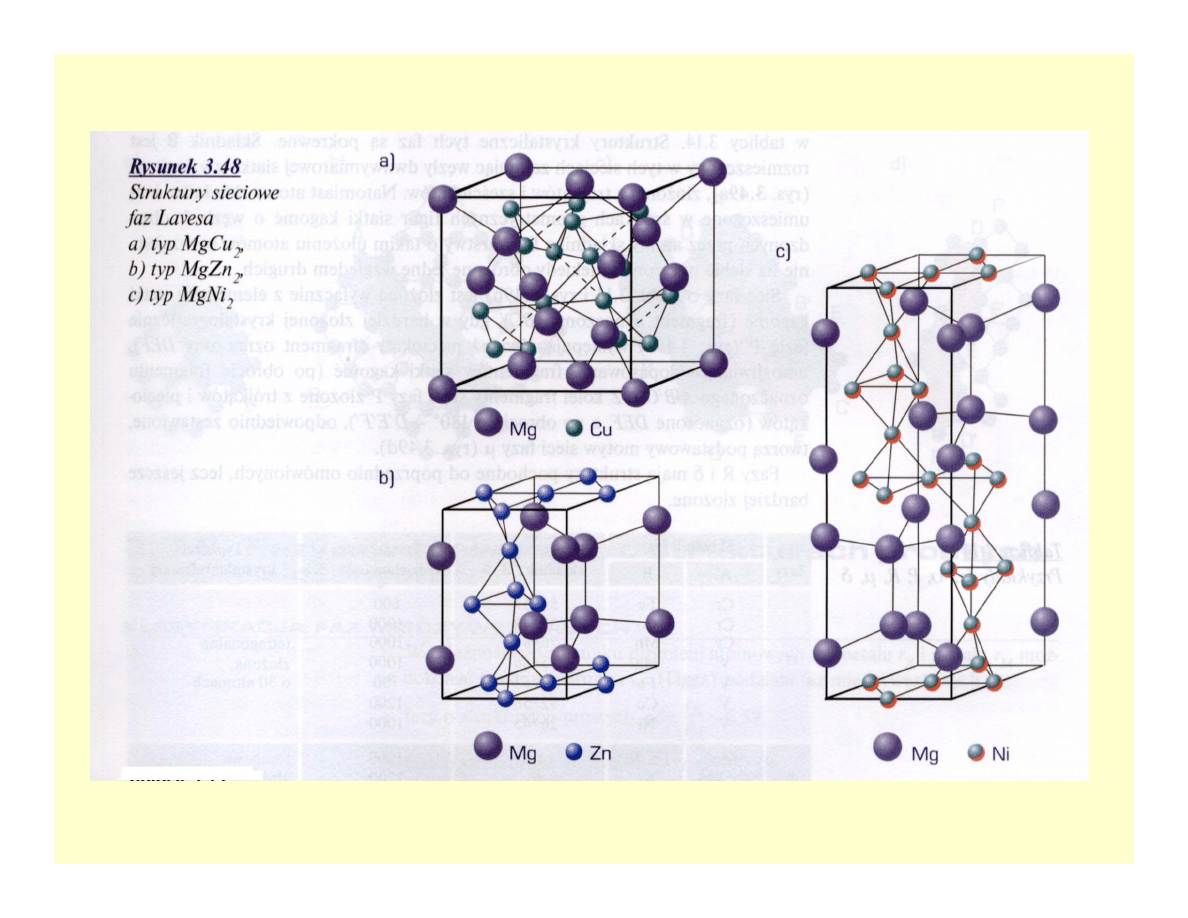
Fazy Lavesa
• Tworzą się przy stosunku promieni atomowych
1,05-1,68
• Wzór AB
2
• M.in. w stopach Fe, Mn, Cr i Mo z innymi
metalami


Fazy o strukturach siatek kagome
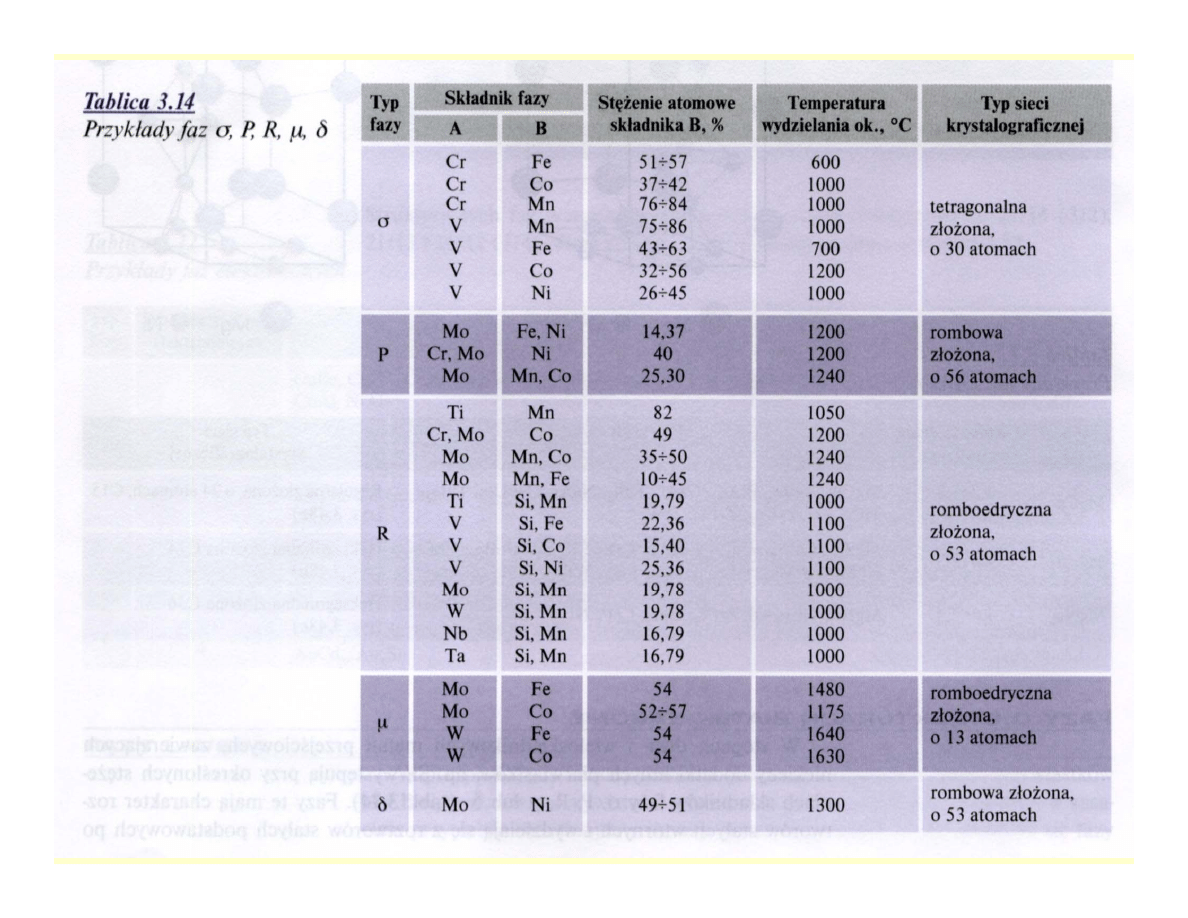
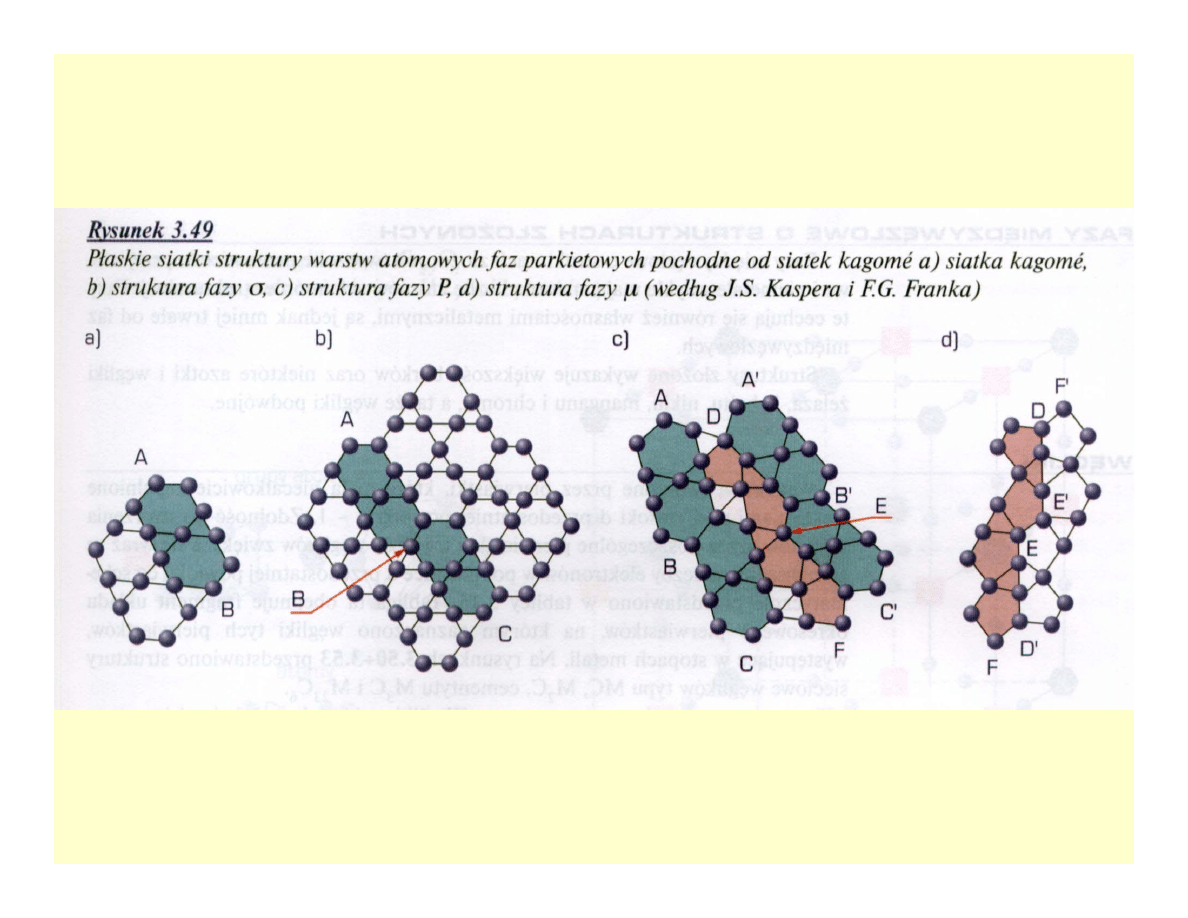
• Fazy
σ, P, R, µ, δ
• Charakter roztworów stałych wtórnych
• Powstają po długotrwałym wygrzewaniu
roztworów stałych podstawowych

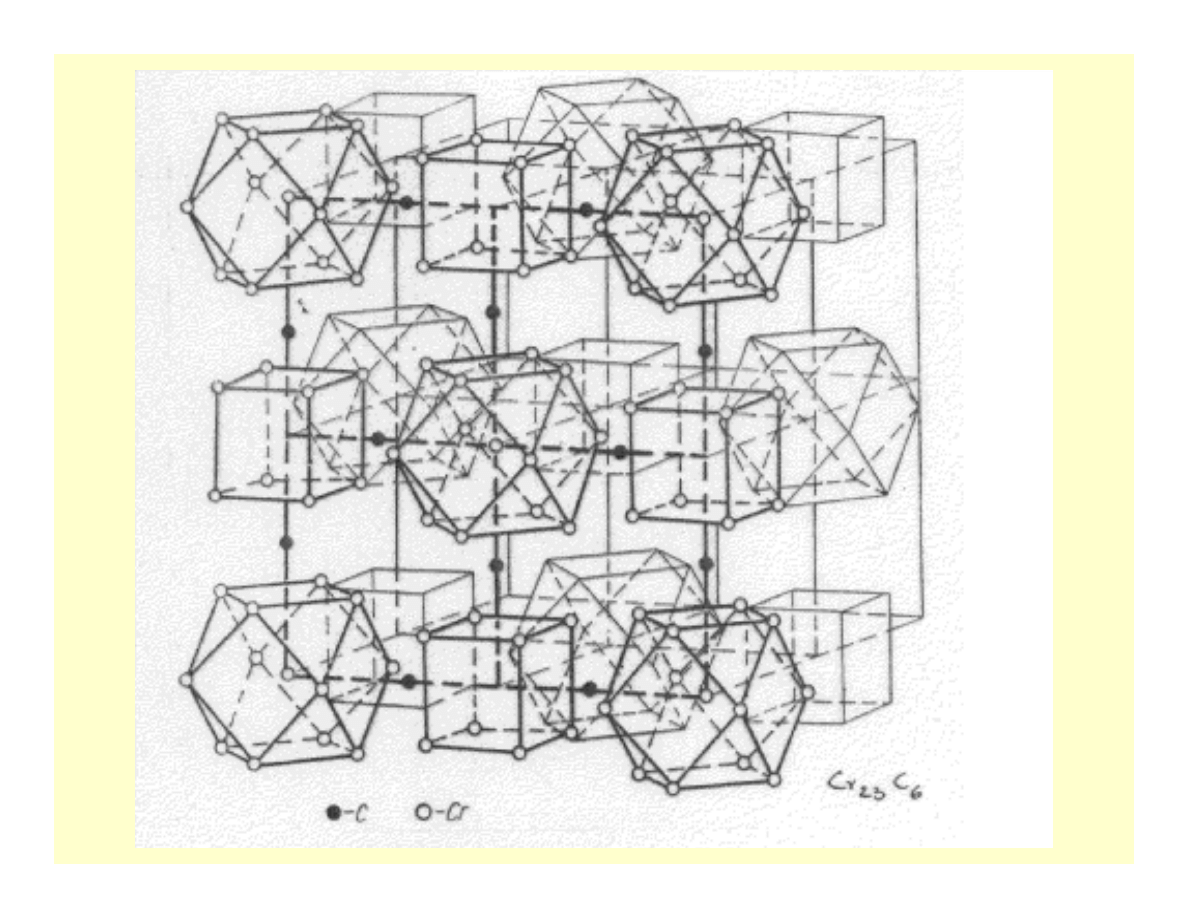
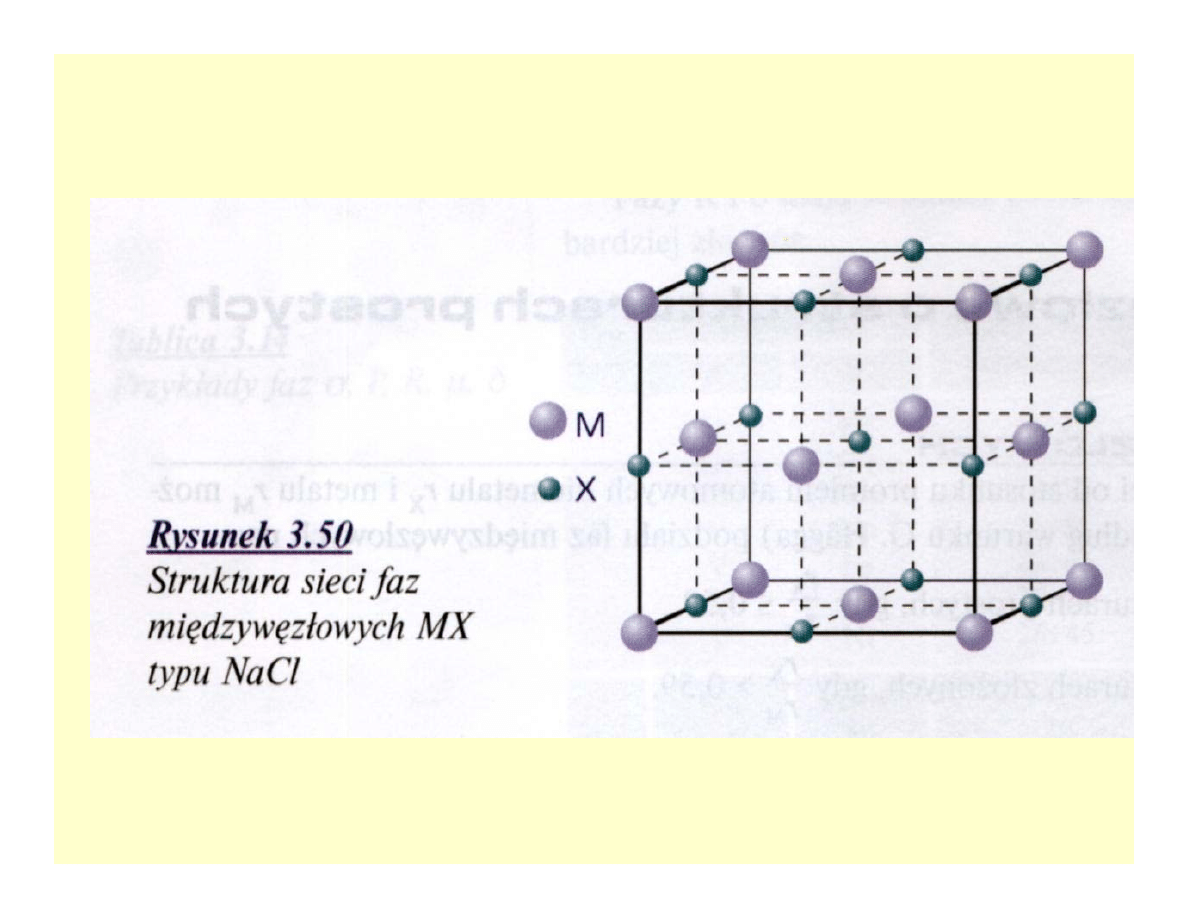
Fazy międzywęzłowe
• Struktury proste r
X
/r
M
≤ 0,59, złożone >
0,59
• Proste: M
4
X, M
2
X, MX, MX
2

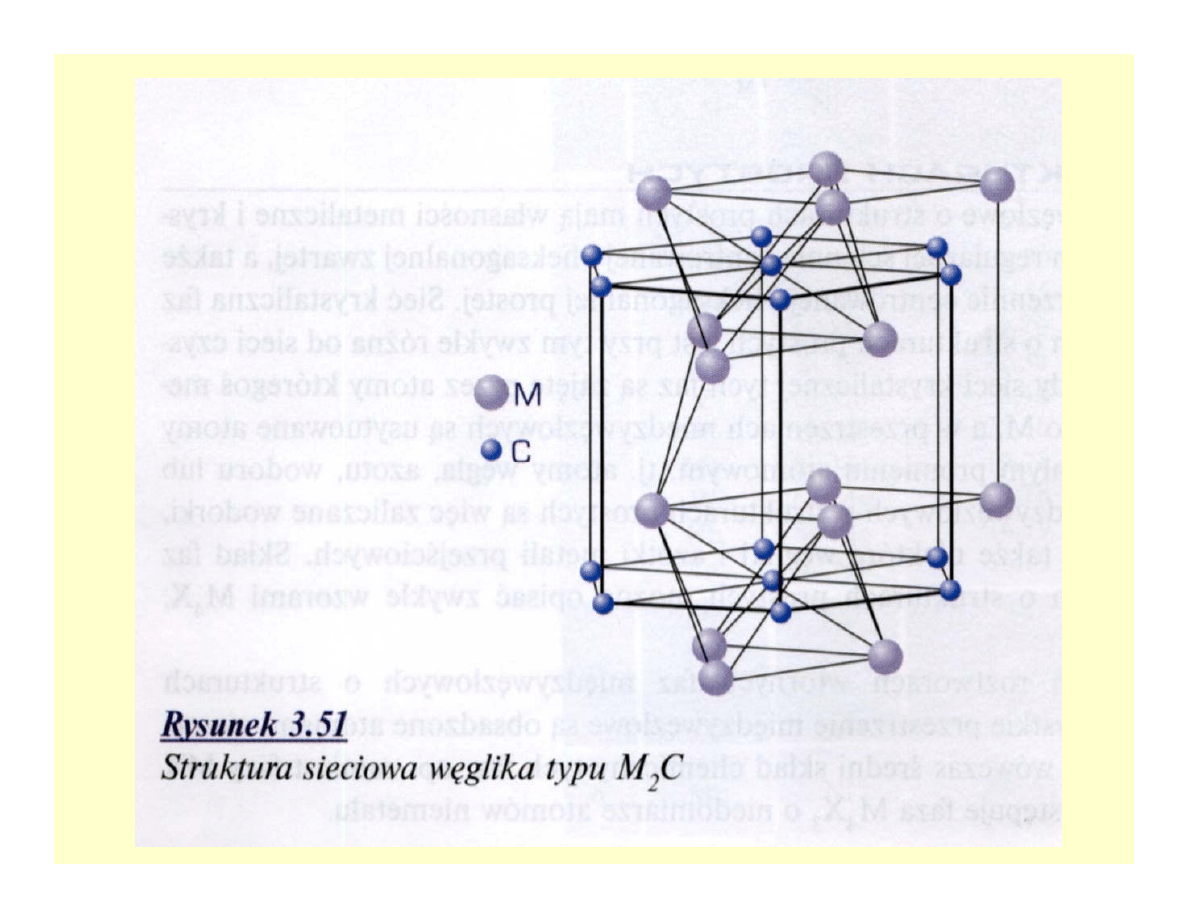
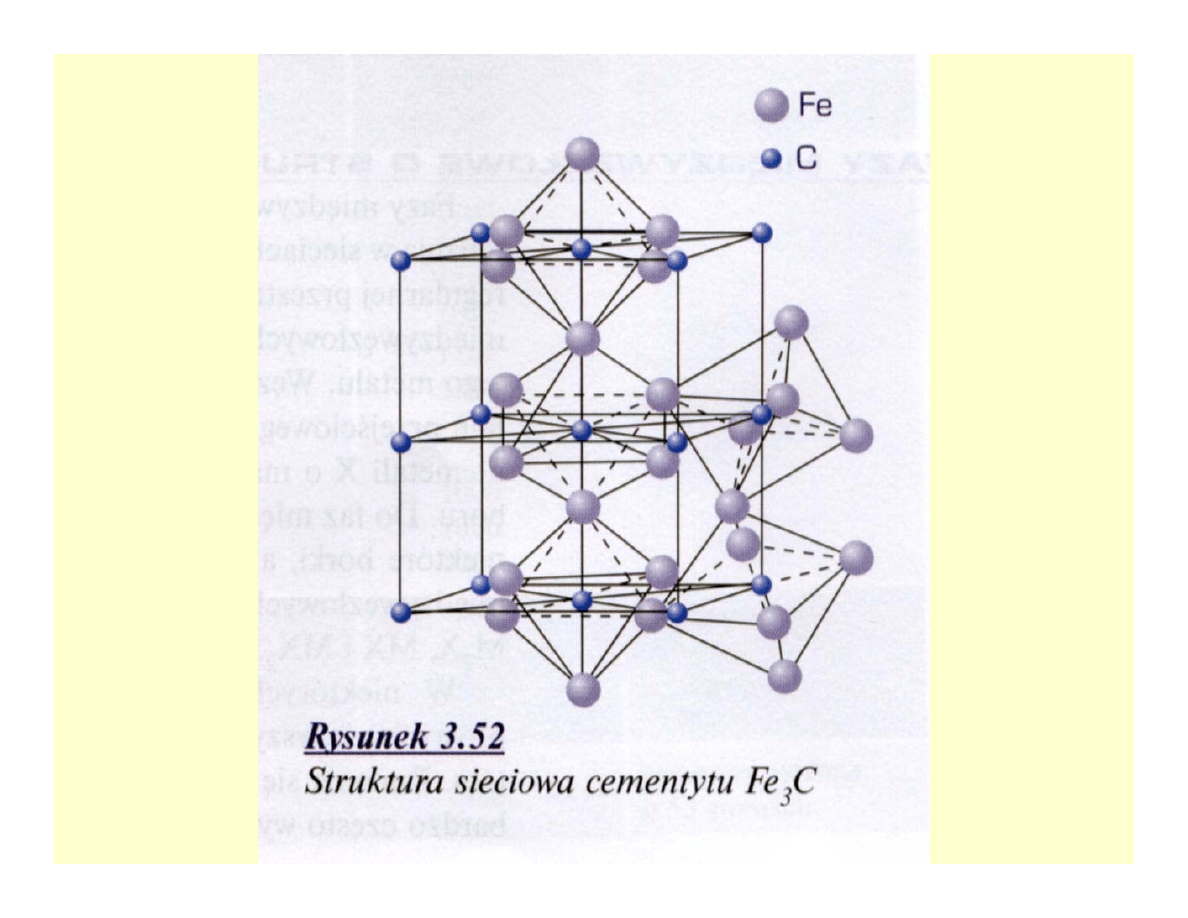
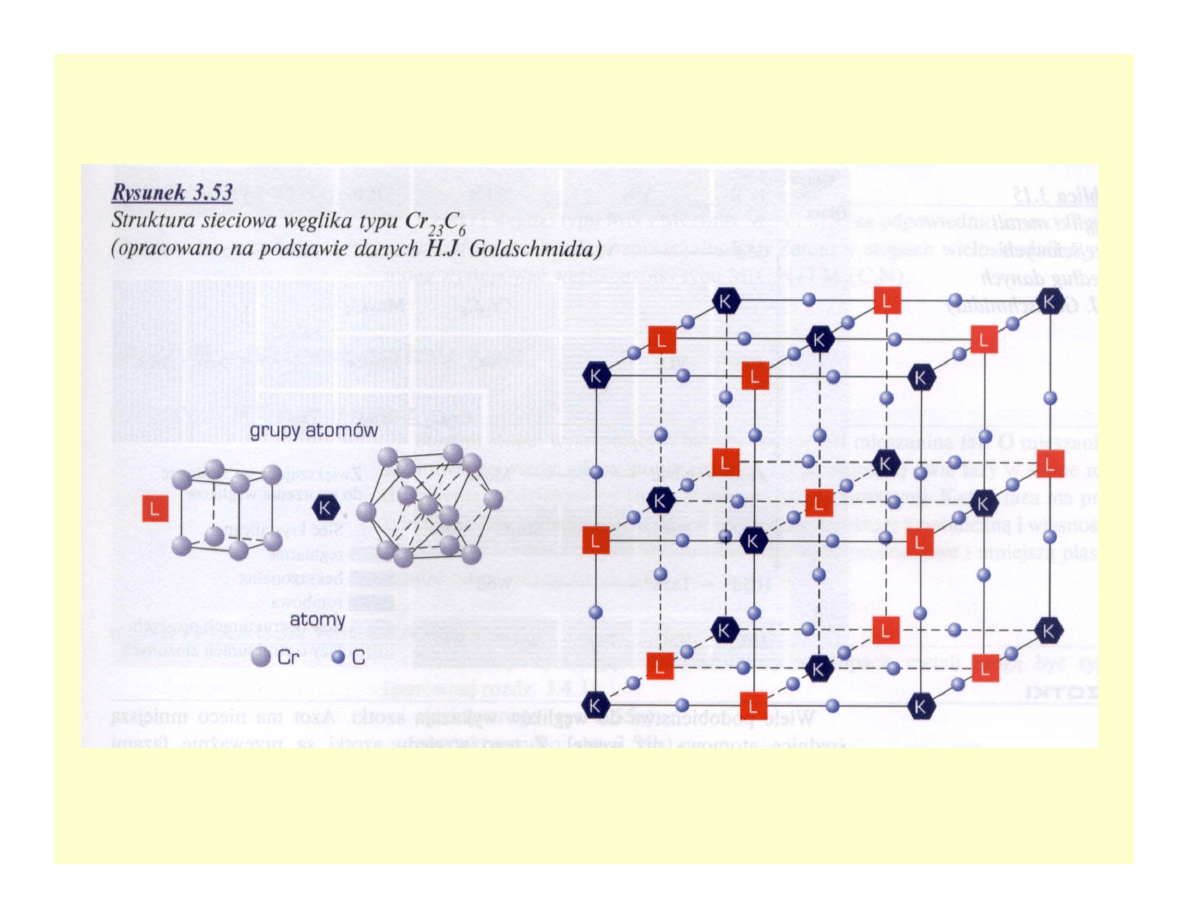
Węgliki
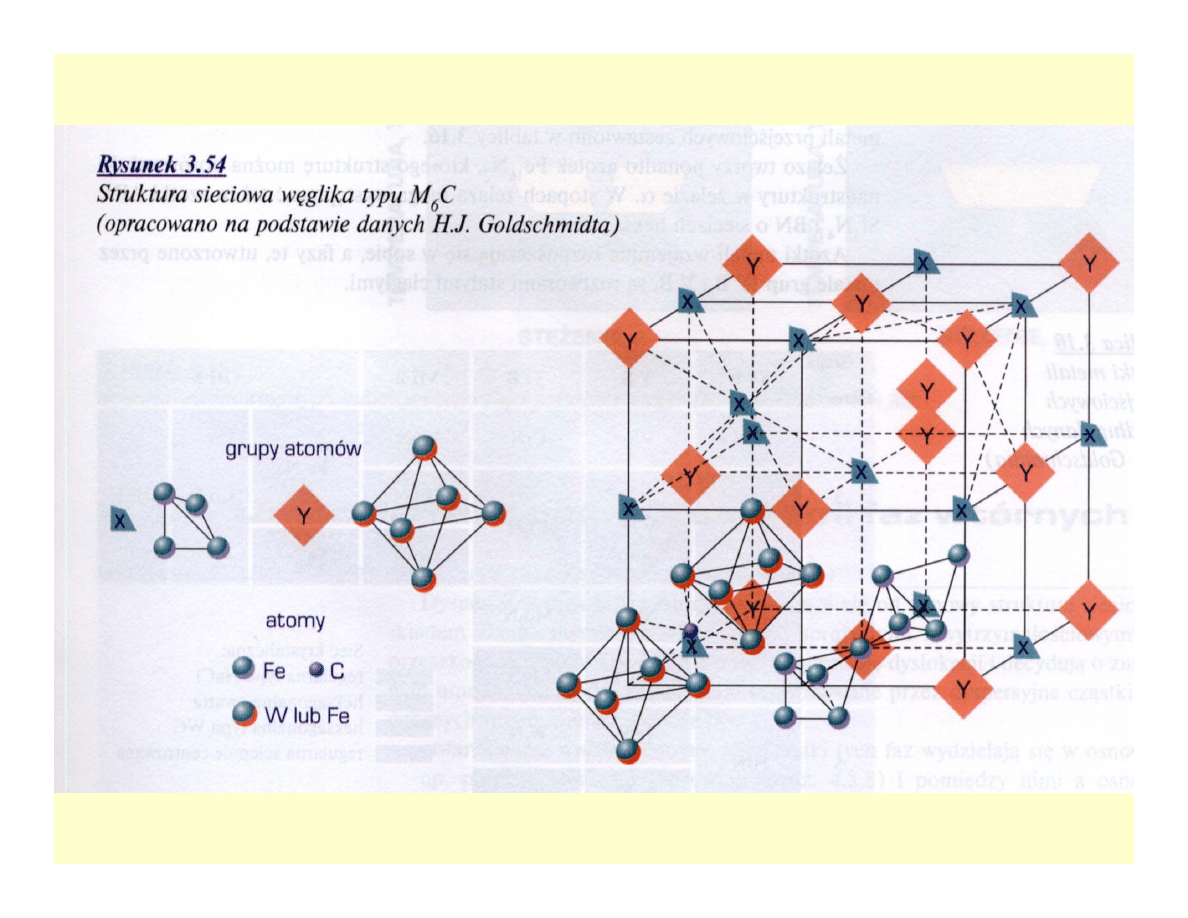
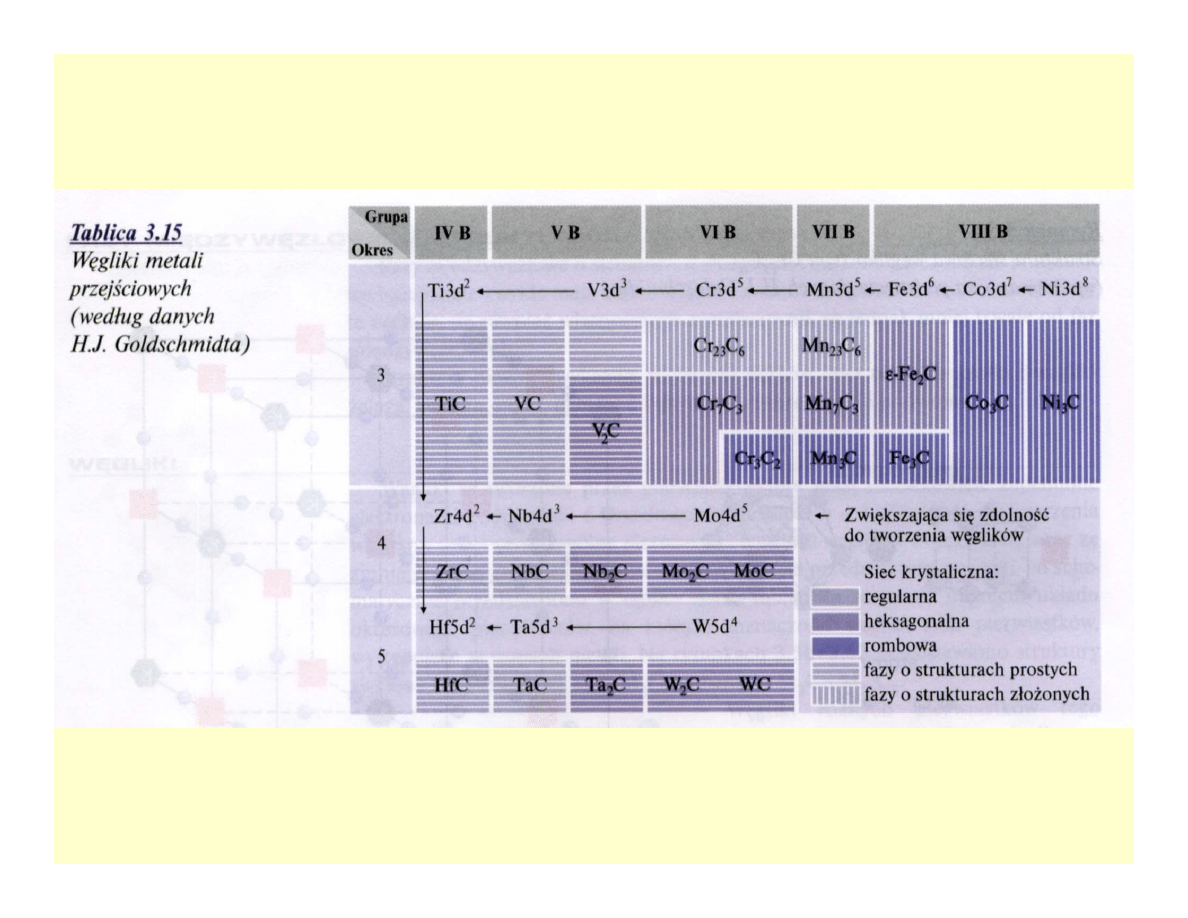

Azotki i węglikoazotki

Document Outline
- BUDOWA STOPÓW METALI
- Stopy metali
- Roztwory stałe
- Reguły Hume-Rothery`egotworzenia roztworów stałych ciągłych
- Roztwory stałe
- Nadstruktury
- Umocnienie roztworów stałych
- Fazy międzymetaliczne
- Fazy elektronowe
- Fazy Lavesa
- Fazy o strukturach siatek kagome
- Fazy międzywęzłowe
- Węgliki
- Azotki i węglikoazotki
Wyszukiwarka
Podobne podstrony:
4 Materiałoznawstwo Budowa stopów metali
6 BUDOWA FAZOWA STOPÓW METALI
ODLEWANIE KOKILOWE STOPÓW METALI NIEŻELAZNYCH
sprawozdanie z metali-obróbka cieplna stopów metali nieżelaz, Studia, Materiałoznastwo, Metaloznastw
budowa stopów dwuskładnikowych
3 Mikroskopowe?dania stopów metali nieżelaznych sprawozdanie
05 - Mikroskopowe badania stopów metali nieżelaznych, AGH, Podstawy Materialoznawstwa
Sem V - ściąga, Produkcja odlewów ze stopów metali
Sprawozdania materialoznastwo, badanie twardości stopów i metali, 1
Badania mikroskopowe stopów metali nieżelaznych (12), AGH, Podstawy Materialoznawstwa
5 6 Budowa stopów met
ćw 4 obróbka cieplna stopów metali
1 Podział Charakterystyka stopów metali przewodnictwo, właściwości, podział
Budowa stopów, studia, Materiałoznawstwo I
Skalowanie staloskopu i analiza jakościowa stopów metali (2)
Skalowanie staloskopu i analiza jakościowa stopów metali v2 (2)
więcej podobnych podstron