Wyznaczanie ciepła topnienia lodu
I. Wstęp teoretyczny
Podstawowe definicje:
1. Energia wewnętrzna - całkowita energia układu będącą sumą: energii potencjalnej i
kinetycznej makroskopowych części układu, energii kinetycznej cząsteczek, energii potencjalnej
oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych (
1
)
2. I zasada termodynamiki - jedno z podstawowych praw termodynamiki, jest
sformułowaniem zasady zachowania energii dla układów termodynamicznych. Zasada stanowi
podsumowanie równoważności ciepła i pracy oraz stałości energii układu izolowanego.
Dla układu zamkniętego (nie wymienia masy z otoczeniem, może wymieniać energię) zasadę można
sformułować w postaci:
∆ = +
Gdzie:
∆ to zmiana energii wewnętrznej układu
Q – energia przekazana do układu jako ciepło
W – praca wykonana na układzie (
2
)
3. Temperatura, jest miarą stanu cieplnego danego ciała. Mikroskopowo jest wynikiem ruchu
cząsteczek, z których złożone jest ciało. Temperatura rośnie, kiedy wzrasta energia tych ruchów.
Stanowi ona miarę średniej energii kinetycznej cząsteczek w ośrodku.
4. Ciepło właściwe - ilość ciepła potrzebna do ogrzania jednostkowej masy danej substancji o
jeden K (lub
C). (
3
)
Zatem ilość ciepła Q potrzebna do ogrzania ciała o macie m o
T wyraża się wzorem:
Q
Q
cm T
c
m T
gdzie: c – ciepło właściwe
Jednostką ciepła właściwego jest
1
1
J kg
K
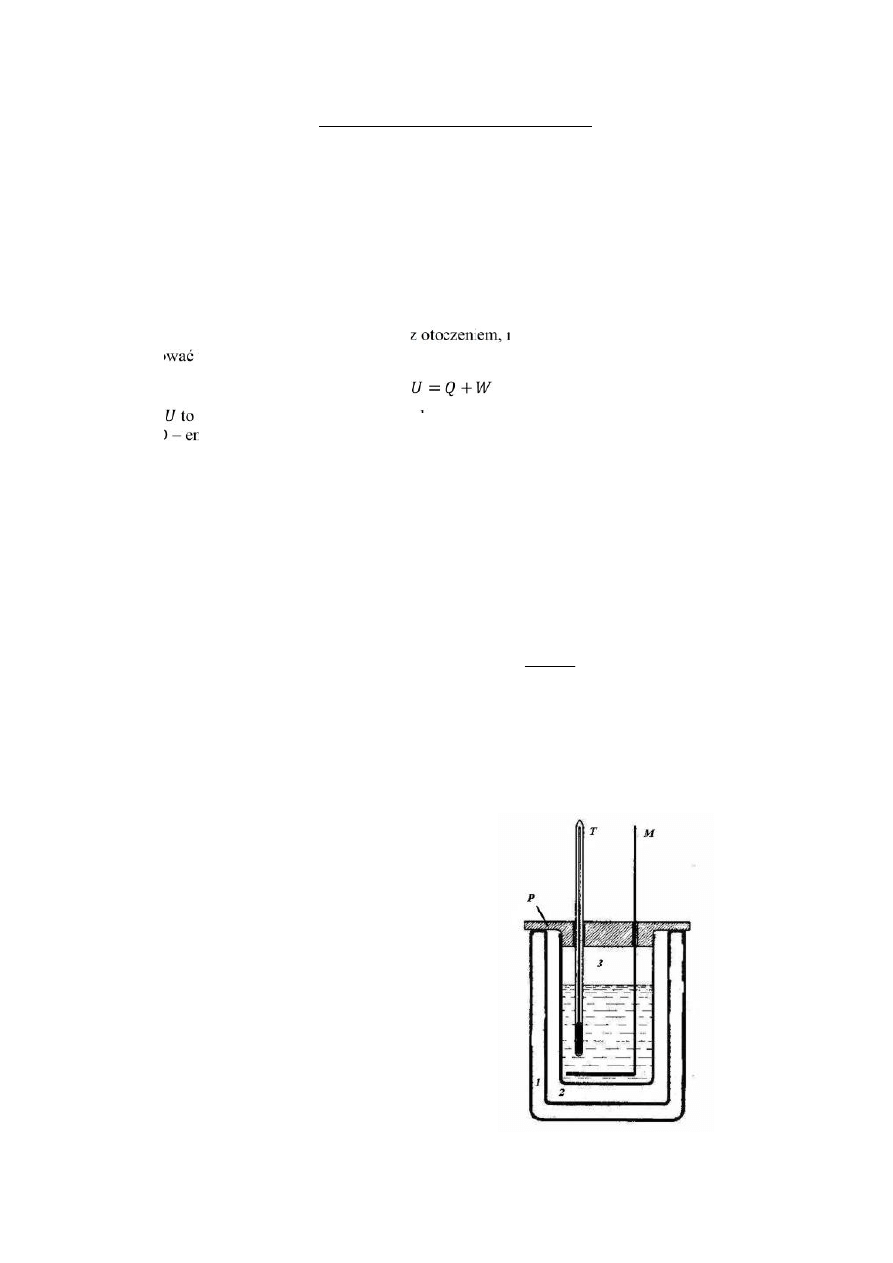
Kalorymetr – to naczynie, które zbudowano tak aby zminimalizować jego kontakt termiczny z
otoczeniem.
Przykładową budowe kalorymetru przedstawia rysunek:
Gdzie:
1 – zewnętrzne naczynie
2 – przestrzeń powietrzna(próżnia) pełniąca rolę izolatora
3 – wewnętrzne naczynie wypełnione cieczą badaną
P – przykrywka
M – mieszadełko
T - termometr

Jeżeli przygotujemy kalorymetr z wodą o znanej masie
w temperaturze
i wrzucimy do niego
masę
topniejącego lodu (
0℃) to lód roztopi się i ustali się temperatura końcowa , a bilans
cieplny będzie wyglądał następująco:
1
(
)(
)
[
(
0
)]
W
K
K
P
K
L
T
W
K
c m
c m
T
T
m q
c
T
C
Wzór ten po przekształceniu pozwoli nam na obliczenie ciepła topnienia lodu:
(
)(
)
W
W
K
K
P
K
T
W
K
L
c m
c m
T
T
q
c T
m
Plan pracy:
1. wypoziomować wagę.
2. zważyć środkowe naczynie kalorymetru razem z mieszadełkiem.
3. zważyć kalorymetr napełniony wodą.
4. pomiar temperatury wody znajdującej się w kalorymetrze po jej stabilizacji.
5. pokruszony lód, umieścić go w naczyniu tak żeby była mieszanina lodu i wody a temp = 0
o
C
6. wprowadzić do kalorymetru kilka suchych kawałków lodu.
7. mieszać wodę z lodem, aż do jego rozpuszczenia.
8. zważyć kalorymetr, zmierzyć temperaturę.
9. wyznaczyć masę wprowadzonego lodu.
10. ponownie wykonać ćwiczenie (10 razy).
II. Zestawienie i opracowanie wyników
Obliczanie ciepła topnienia lodu dla pierwszego pomiaru:
(
)(
)
W
W
K
K
P
K
T
W
K
L
c m
c m
T
T
q
c T
m
C
w
= 4187
∙
=
−
= 902,5
∙
(za wartość ciepła właściwego kalorymetru przyjęto wartość
tablicową dla aluminium)
=
(4187 ∙ 0,2434 + 902,5 ∙ 0,13377)(24 − 21,2)
0,0074
− 4187 ∙ 21,7 = 342,5[
∙ ]
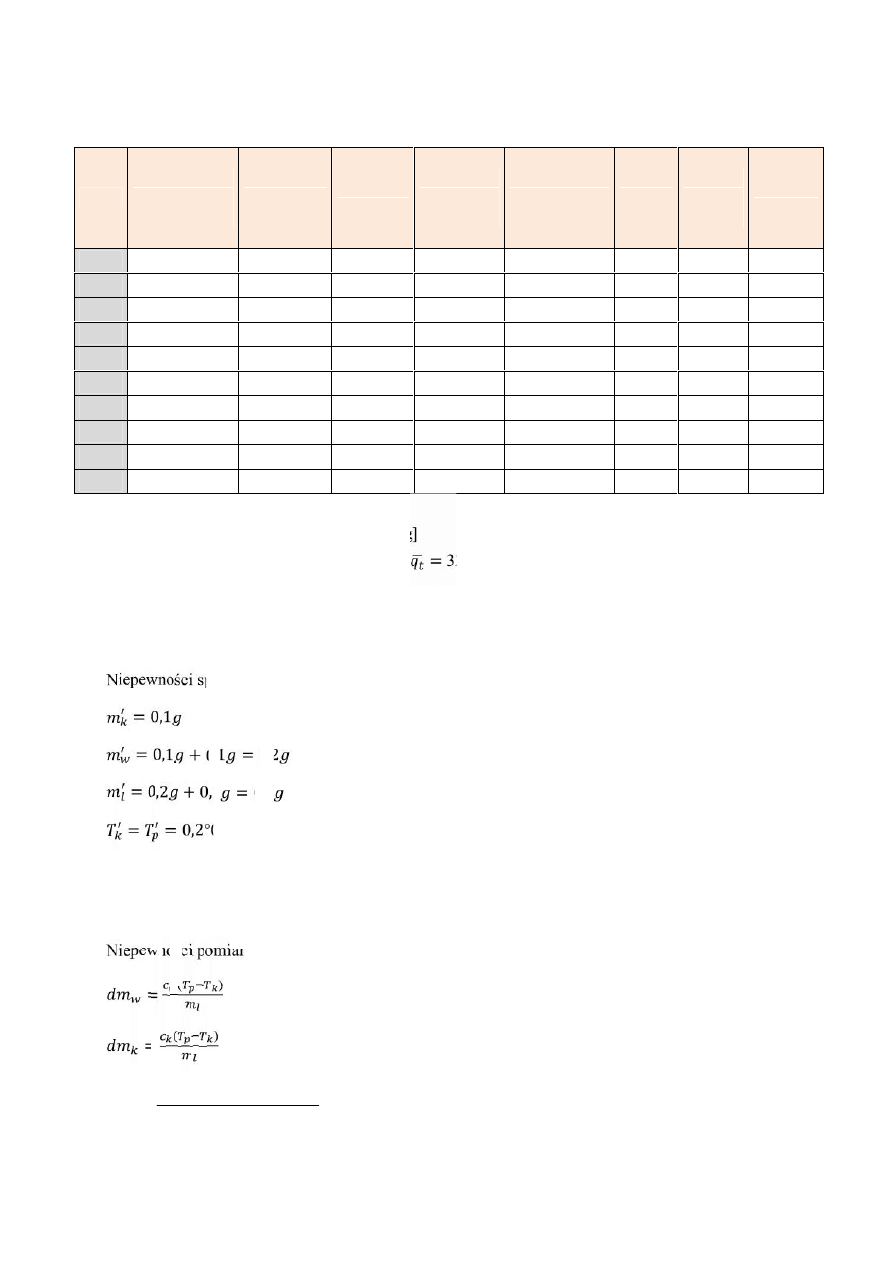
Reszta pomiarów w zestawieniu w tabeli:
Lp.
Masa suchego
kalorymetru
[kg]
Masa
kalorymetru
z wodą [kg]
Masa
wody [kg]
Temp.
Początkowa
[℃]
Masa
kalorymetru z
wodą po
wrzuceniu
lodu [g]
Masa
lodu
[kg]
Temp.
końcowa
[℃]
Ciepło
topnienia
lodu
[kJ/kg*K]
1
0,1337
0,3771
0,2434
24
384,5 0,0074
21,2 342,5
2
0,1337
0,3605
0,2268
23,6
368,7 0,0082
20,6 305,3
3
0,1338
0,3669
0,2331
23,8
373,1 0,0062
21,2 371,2
4
0,1338
0,4486
0,3148
24
453,9 0,0053
22,4 340,6
5
0,1337
0,4827
0,349
24
492,7
0,01
21,4 321,7
6
0,1337
0,3936
0,2599
26,4
398,9 0,0053
24,4 354
7
0,1338
0,3459
0,2121
25,2
354,4 0,0085
21,7 324,5
8
0,1338
0,5765
0,4427
28,4
586 0,0095
26,4 305,1
9
0,1338
0,4108
0,277
27,9
419,8
0,009
25 307,9
10
0,1339
0,3657
0,2318
27,6
376,8 0,0111
23,6 294,4
Wykres 1. Zestawienie wyników
*masa suchego kalorymetru: (133,77 ± 0,1) [g]
Średnie doświadczalne ciepło topnienia lodu:
= 326735347,258
J
≈ 326,735
kJ
Tablicowa wartość ciepła topnienia lodu:
334000
T
q
J
≈ 334
kJ
III. Obliczanie niepewności pomiarowych
Niepewności sprzętu laboratoryjnego:
= 0,1
= 0,1 + 0,1 = 0,2
= 0,2 + 0,1 = 0,3
=
= 0,2℃
Niepewność otrzymanego ciepła topnienia lodu wyraża się wzorem:
'
'
'
'
'
'
t
l
l
w
w
k
k
p
p
k
k
q
m m
m
m
m
m
T T
T T
Niepewności pomiarów obliczamy za pomocą pochodnych cząstkowych:
=
(
)
=
(
)
2
(
)(
)
w
w
k
k
p
k
L
L
c m
c m
T
T
dm
m
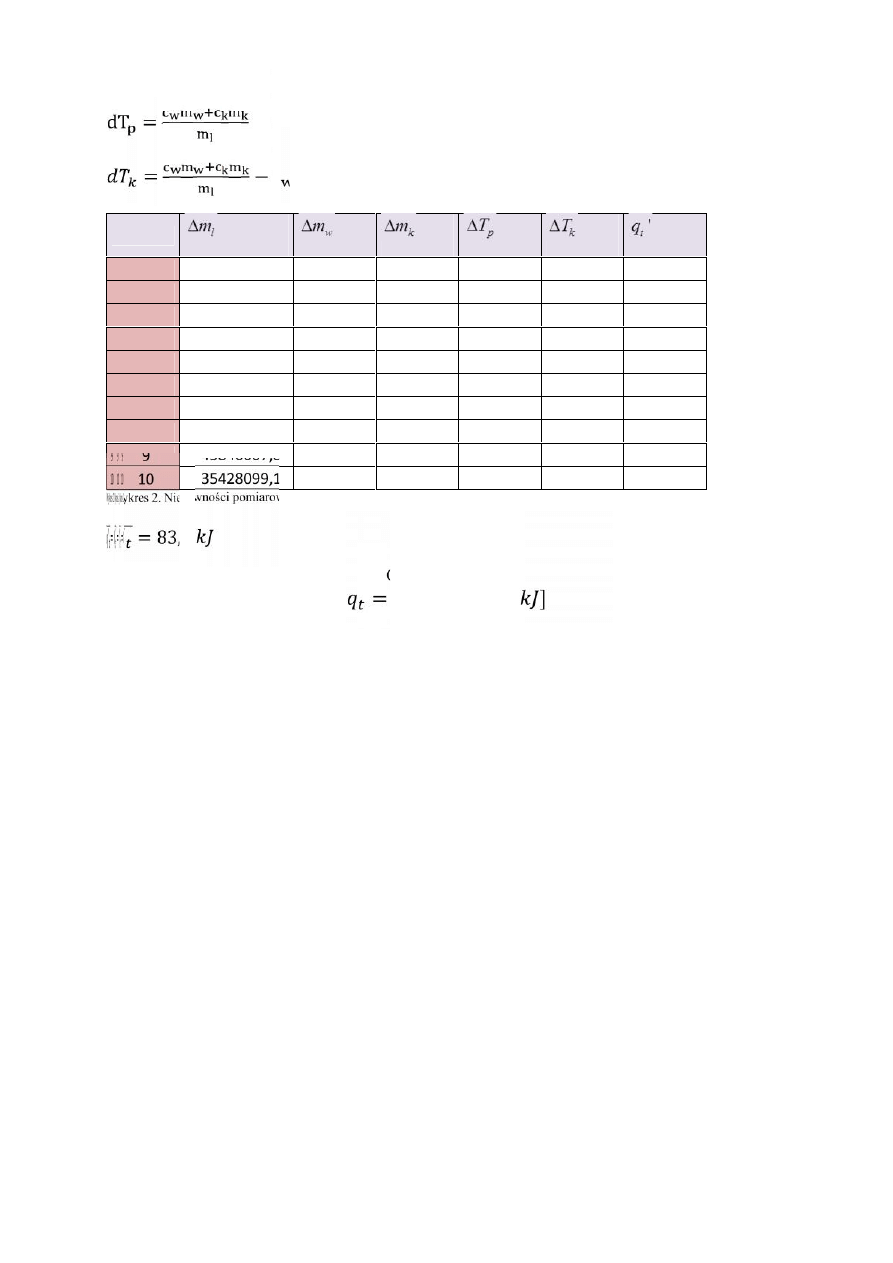
dT =
=
− c
Lp.
1
58282706,9
1584270 341486,5 154032,9 149845,9 78611,56
2
47754566,85
1531829 330182,9 130529,1 126342,1 66040,01
3
74179618,24
1755839 378467,7 176889,9 172702,9 92561,44
4
81953436,81
1264000 272452,8 271470,8 267283,8 132617
5
41131751,05
1088620
234650
158199
154012 75022,93
6
86075380,92
1580000
340566 228099,8 223912,8 116575,2
7
48868725,78
1724059 371617,6 118681,2 114494,2 61677,67
8
43752073,68 881473,7
190000 207822,4 203635,4 95612,46
9
45846007,81
1349144 290805,6 142280,7 138093,7 70127,6
10
35428099,18
1508829 325225,2 98312,98 94125,98 49450,51
Wykres 2. Niepewności pomiarowe
′ = 83,8
Ostateczny wynik:
= 326,74 ± 84 [ ]
*Dane w tabelkach uzupełniano na podstawie obliczeń w programie Ms Excel i obliczenia te pominięto w
sprawozdaniu, aby poprawić przejrzystość i spójność tekstu.
IV. Dyskusja wyniku
Tablicowa wartość ciepła topnienia lody wynosi 334 kj(
4
) a uzyskana przeze mnie w
przybliżeniu 327
± 84 kJ. Jak widać wynik doświadczalny jest bardzo zbliżony do tablicowego.
Niewielkie odstępstwo od żądanego wyniku można wyjaśnić na wiele sposobów. Największy wpływ
na moje wyniki wg mnie miało to, że w sali panowała dość wysoka temperatura, co spowodowało ze
niemożliwym było całkowite osuszenie kostek lodu. Jak wiadomo ciepło topnienia lodu jest bardzo
duże, więc odrobina wody na powierzchni lodu daje duże błędy w bilansie cieplnym. Warto
wspomnieć również to, iż kalorymetr nie do końca izolował termicznie badany układ od otoczenia co
również miało wpływ na moje wyniki.
Bibliografia:
(
1
) Krzysztof Pigoń, Zdzisław Ruziewicz: Chemia fizyczna 1. Wyd. 6. Warszawa: Wydawnictwo Naukowe PWN, styczeń 2007
(
2
)(
4
)Peter William Atkins: Chemia fizyczna. Warszawa: Wydawnictwo Naukowe PWN, 2001, s. 124.
(
3
) A. Magiera, I Pracownia fizyczna, Kraków 2006.
Wyszukiwarka
Podobne podstrony:
c4 18 12 2010 id 97240 Nieznany
c4 10 11 2011 id 97239 Nieznany
C4 (KolokwiumI) id 97238 Nieznany
Mozliwosci C4 WP id 304396 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron