Aneks 3 – (Skrypty studenckie) do pracy Adama Formeli Opracowanie
doświadczeń laboratoryjnych na potrzeby pracowni studenckiej, Lublin 2008
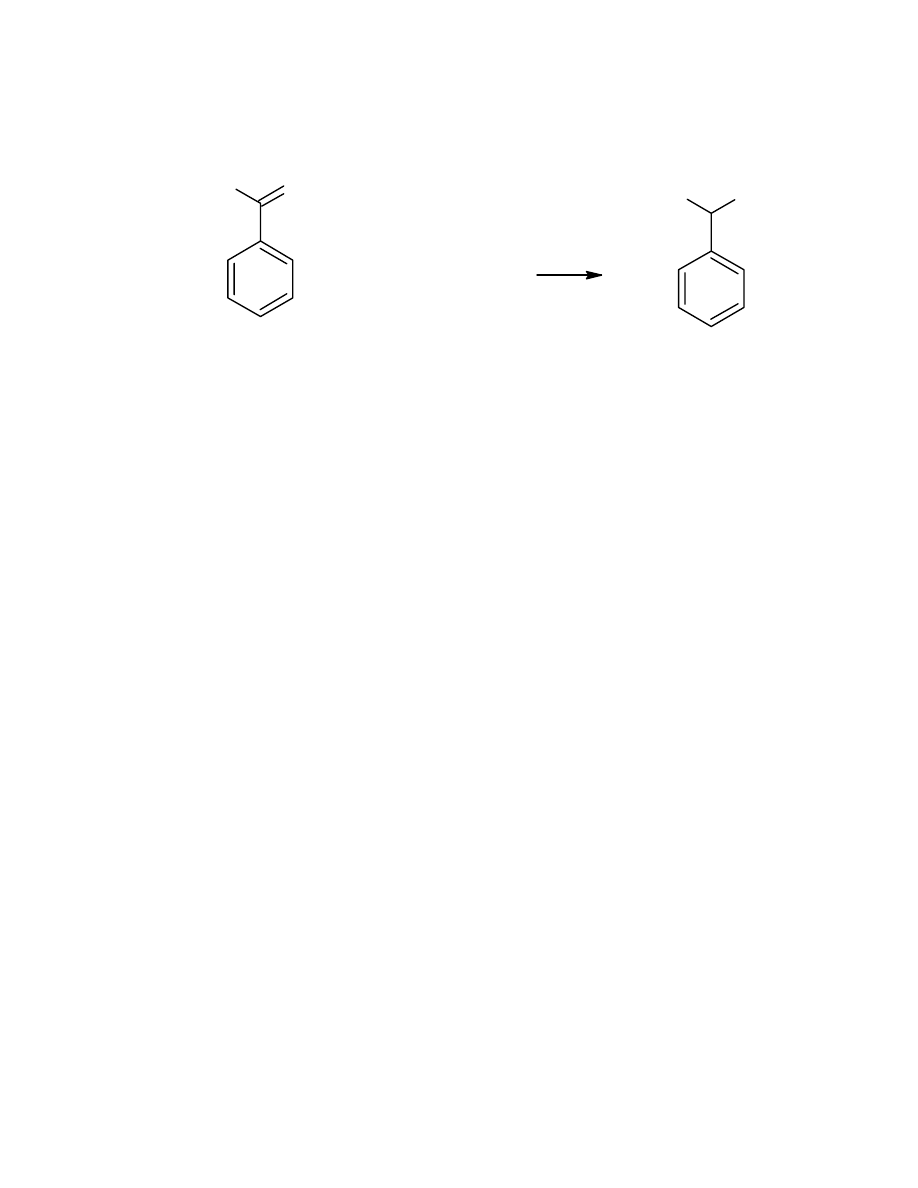
1. Synteza α – fenyloetyloaminy (α-PEA)
C
H
3
O
+
HCONH
2
HCOOH
C
H
3
NH
2
Szkło laboratoryjne: kolba 100mL, wkraplacz 10mL, erlenmajerka 100mL,
rozdzielacz 250mL, zestaw do sączenia, chłodnica zwrotna.
Aparatura: płaszcz grzejny elektryczny, pompka wodna.
Odczynniki:
Eter dietylowy (R12, R19, R22, R66, R67) – 125 mL
Acetofenon (R22, R36, S26) – 7 mL
Formamid (R61, S45, S53) – 8,81 mL
Kwas mrówkowy (R34, S26, S45, S23C) – 2,76 mL 90% roztwór w wodzie
Kwas solny (R34, S26, S45) – 25 mL 36% HCl
W kolbie 100mL zaopatrzonej w chłodnicę zwrotną i wkraplacz
umieszczono 7mL acetofenonu (60mmol) i 8,81mL formamidu (220mmol).
Otrzymaną mieszaninę ogrzano przy pomocy płaszcza elektrycznego do
temperatury wrzenia (około 190°C), a następnie, w ciągu trzech godzin do
mieszaniny zostało powoli wkroplone 2,76mL 90% kwasu mrówkowego. Po
wkropleniu kwasu roztwór był utrzymywany w temperaturze wrzenia jeszcze przez
jedną godzinę i schłodzony do temperatury pokojowej. Dodano 25mL 36% HCl i
mieszaninę gotowano jeszcze przez kolejne 2 godziny. Po schłodzeniu do
93

Aneks 3 – (Skrypty studenckie) do pracy Adama Formeli Opracowanie
doświadczeń laboratoryjnych na potrzeby pracowni studenckiej, Lublin 2008
mieszaniny dodano 50mL wody i przemyto ją 2 razy 25mL eteru. Warstwę
eterową odrzucono, a warstwę wodną zalkalizowano 35mL 40% NaOH. Amina
wydzieliła się jako żółty olej (górna warstwa). Została ekstrahowana trzykrotnie
eterem dietylowym (porcjami po około 25mL). Ekstrakt wysuszony MgSO
4
(co
najmniej 40 minut), odfiltrowano, rozpuszczalnik odparowano. Uzyskano 6,20g
aminy (wydajność 62%).
Theilacker W., Winkler H. G., Chem. Ber. 1954, Nr.5, 690.
Pytanie kontrolne:
W jakim celu dodaje się kwas mrówkowy?
94
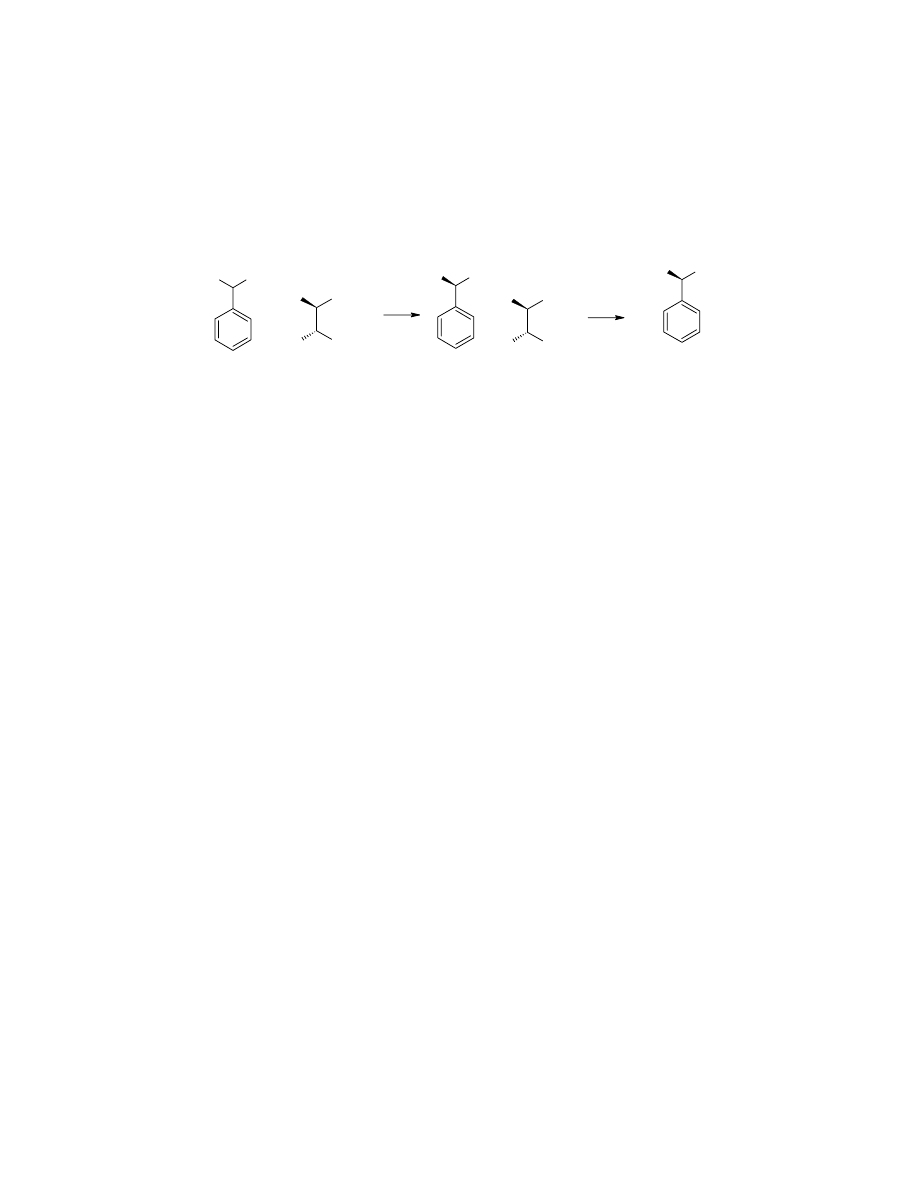
Aneks 3 – (Skrypty studenckie) do pracy Adama Formeli Opracowanie
doświadczeń laboratoryjnych na potrzeby pracowni studenckiej, Lublin 2008
2. Rozdział racemicznej α – fenyloetyloaminy (α-
PEA) na enancjomery
C
H
3
NH
2
+
COOH
O
H
O
H
COOH
MeOH
C
H
3
NH
3
+
COO
-
O
H
O
H
COOH
NaOH
C
H
3
NH
2
Szkło laboratoryjne: kolba okrągłodenna 250mL, chłodnica zwrotna,
wkraplacz 25mL, fiolka, zestaw do sączenia, rozdzielacz 250mL.
Aparatura: płaszcz grzejny elektryczny, pompka wodna.
Odczynniki:
Fenyloetyloamina (R34, S23, S28) – 6,20 mL
Kwas winowy (R36/37/38, S26, S37/39) – 7,75g
Metanol (R11, R23/24/25, S16, S36/37, S45, S7) – 110 mL
Wodorotlenek sodu (R35, S26, S37/39, S45) – 1,3 mL.10% roztwór w wodzie
Dichlorometan (R40, S23, S24/25, S36/37) – 20 mL
W kolbie okrągłodennej o pojemności 250mL zaopatrzonej w chłodnicę
zwrotną
i płaszcz elektryczny rozpuszczono 7,75g kwasu winowego w 110mL metanolu.
Do tak przygotowanego wrzącego roztworu dodano przez chłodnicę powoli (w
ciągu 5 minut) 6,20g aminy. Po wkropleniu ogrzewano jeszcze przez około 30
minut.
95

Aneks 3 – (Skrypty studenckie) do pracy Adama Formeli Opracowanie
doświadczeń laboratoryjnych na potrzeby pracowni studenckiej, Lublin 2008
Po 3 dniach nie zaobserwowano krystalizacji, umieszczono więc w kolbie
zarodki krystalizacji, przygotowany w następujący sposób. W małej fiolce
zmieszano 5kropli handlowej
(-)-α-fenyloetyloaminy, 50mg kwasu winowego i 10kropli metanolu i utarto na
„papkę”. Niewielką ilość „papki” dodano do ostudzonego roztworu
przygotowanego zgodnie
z przedstawioną powyżej procedurą. Po dwóch godzinach zaobserwowano
wzrost kryształów soli. Po czterech dniach krystalizacji zdekantowano warstwę
metanolowa, kryształy przeniesiono na sączek Schotta i osuszono przy pomocy
pompki wodnej. Uzyskano 2,82g soli.
Całą otrzymaną ilość soli rozpuszczono w 1,3mL NaOH 10%,
ekstrahowano dwukrotnie porcjami po 10mL chlorku metylenu. Suszono MgSO
4
przez dwie godziny. Odsączono, rozpuszczalnik odparowano.
Po wydzieleniu według podanej procedury uzyskano 1,35g aminy
(wydajność 22%)
o [α]
D20
=-31,7˚ (c =1, EtOH). (lit. [α]
D20
=-38,3˚). Obliczone ee = 82.7%.
Theilacker W., Winkler H. G., Chem. Ber. 1954, Nr.5, 690.
Pytanie kontrolne:
Przedstaw produkty powstałe w reakcji racemicznej fenyloetyloaminy z
racemicznym kwasem winowym w stosunku 2:1.
96
Wyszukiwarka
Podobne podstrony:
Budowa chemiczna i synteza lopo Nieznany
1 Synteza a fenyloetyloaminy i rozdział racemicznej α – fenyloetyloaminy (α PEA)
Budowa chemiczna i synteza lopo Nieznany
2 Synteza acetonaftonu i otrzym Nieznany
fenyloketonuria 2 id 169226 Nieznany
4 Synteza ukladu automatycznej Nieznany (2)
opis preparatow do syntez id 33 Nieznany
2 Sprzetowa i programowa syntez Nieznany
biologia synteza id 88080 Nieznany
Synteza siarczanu amfetaminy z fenylonitropropenu(P2NP)
06 Podstawy syntezy polimerówid 6357 ppt
Gor±czka o nieznanej etiologii
8a Syntezy prostych aminokwasów
Wykład VIII Synteza układów sekwencyjnych
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
więcej podobnych podstron