
Barwienie komórek, analiza
mikroskopowa obrazu
Barwienie May-Grünwalda-Giemsy
Umożliwia uwidocznienie
zmian morfologicznych komórek
pod wpływem badanej substancji.
Zastosowanie dwóch barwników
umożliwia obserwacje jądra
komórkowego wybarwionego na
kolor fioletowy z ciemniejszymi
jąderkami (barwnik Giemsy wiąże
się do DNA), oraz cytoplazmy
przybierającej niebiesko-różową
barwę (May-Grünwald).
W przypadku bazofili możliwa
jest obserwacja ciemnoniebieskich
granul w cytoplazmie a eozynofili
jasno pomarańczowych. Erytrocyty
barwią się na różowo.
Barwnik May-Grünwalda
Barwnik Giemsy (błękit
metylenowy)
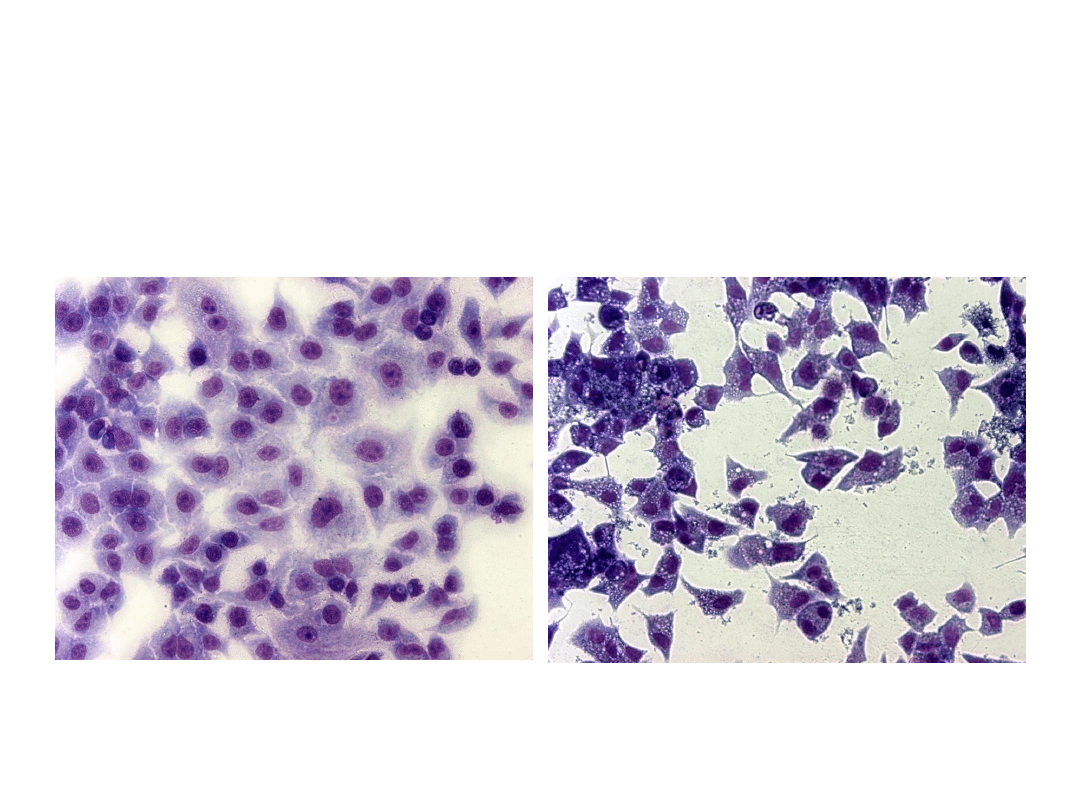
Hodowla kontrolna
Zmiany morfologii komórek pod
wpływem badanej substancji.
Zmiany morfologii
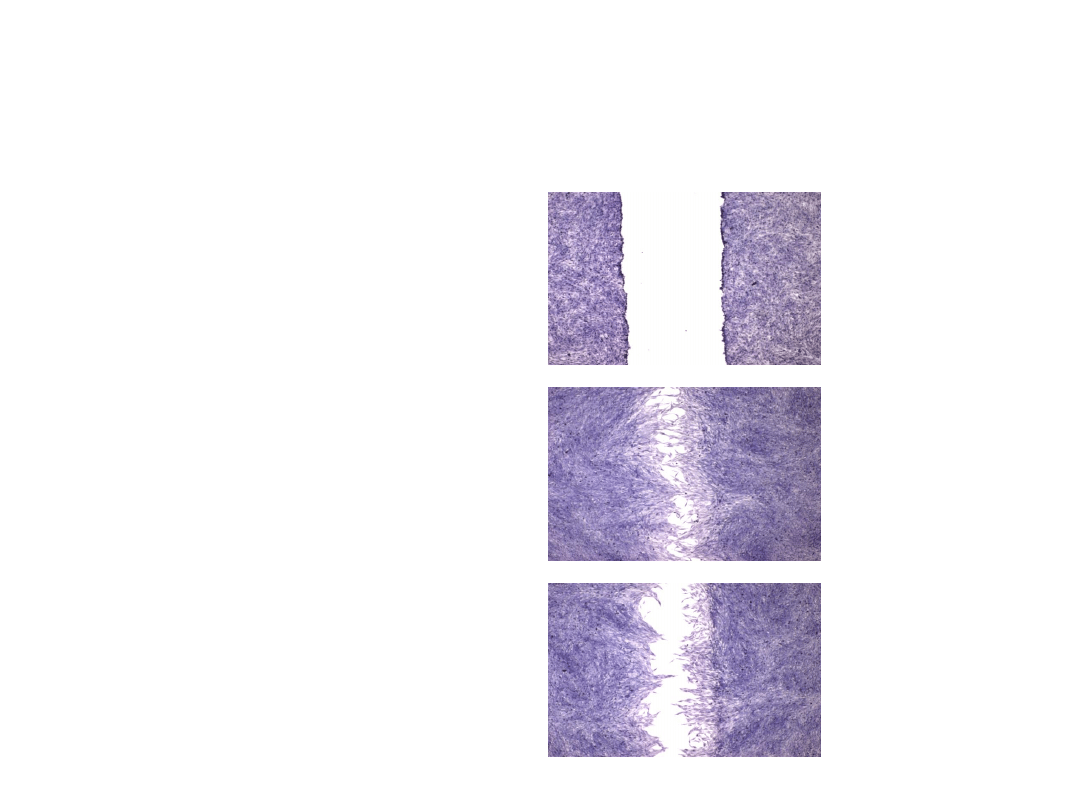
Wound assay - test „z rysą”
Aby oszacować potencjalną
zdolność badanej substancji do
hamowania migracji komórek
przeprowadza się tak zwany test „z
rysą”. Umożliwia on porównanie
liczby komórek migrujących w grupie
kontrolnej (bez substancji) z liczbą
komórek migrujących w grupie
badanej (z odpowiednimi stężeniami
substancji). Liczenie komórek
zasiedlających obszar rysy wykonanej
w zwartej monowarstwie, umożliwia
określenie zdolności do hamowania
przez substancję procesów
przemieszczania się komórek
(związanej ze zdolność tworzenia
przerzutów w przypadku wielu
nowotworów).
Rysa (wound)
Kontrola
Zahamowanie
migracji
komórek
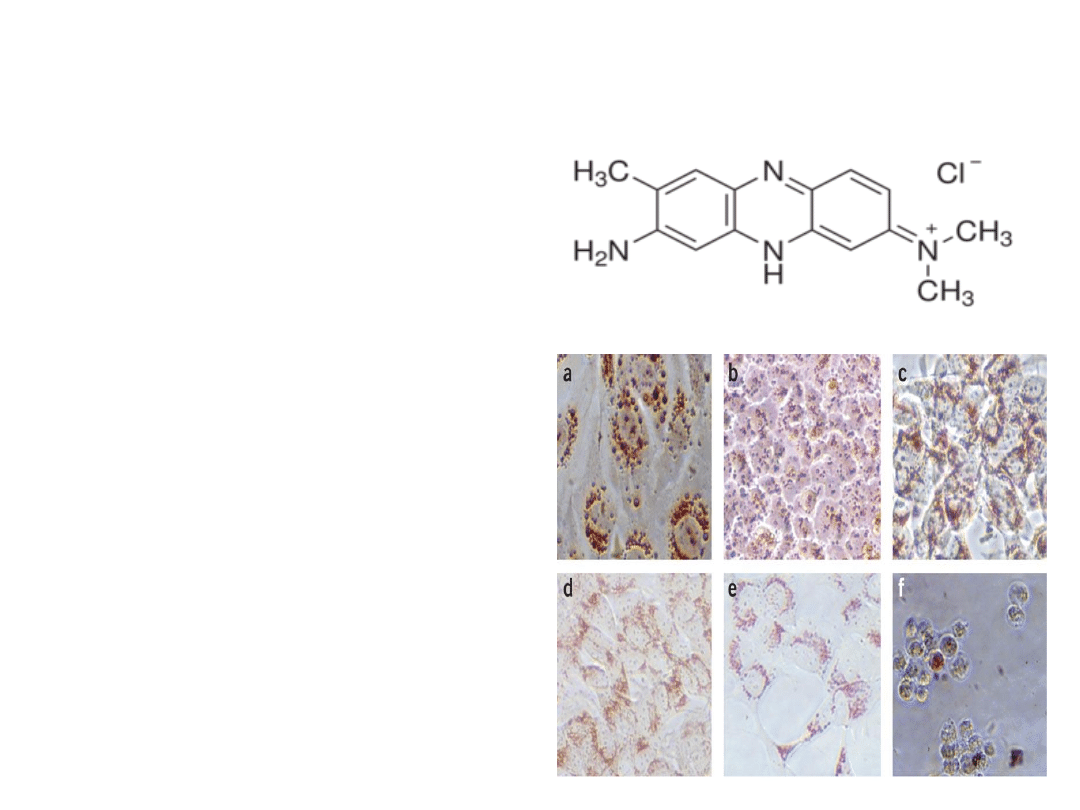
Neutral Red (NR)
Wychwyt czerwieni obojętnej
polega na pobieraniu barwnika NR
(będącego słabym kationem), przez żywe
komórki i gromadzeniu go w lizosomach
(pH lizosomów < pH cytoplazmy, co
umożliwia NR wiązanie się miejscami
anionowymi do macierzy lizosomalnej).
Komórki martwe lub uszkodzone nie
pobierają NR. Dodatkowo ilość
pochłoniętego barwnika jest wprost
proporcjonalna do ilości żywych komórek
co umożliwia przeprowadzenie pomiaru
metodami spektrofotometrycznymi.
Morfologia komórek barwionych
NR.
a) RTG-2 (gonady Oncorhynchus mykiss)
b) PLHC-1 (nowotwór wątroby Poeciliopsis
lucida)
c) SH-SY5Y (ludzka neuroblastoma) po 24h
ekspozycji na d)1 e)20 f)50 mg/ml chlorku
cynku.
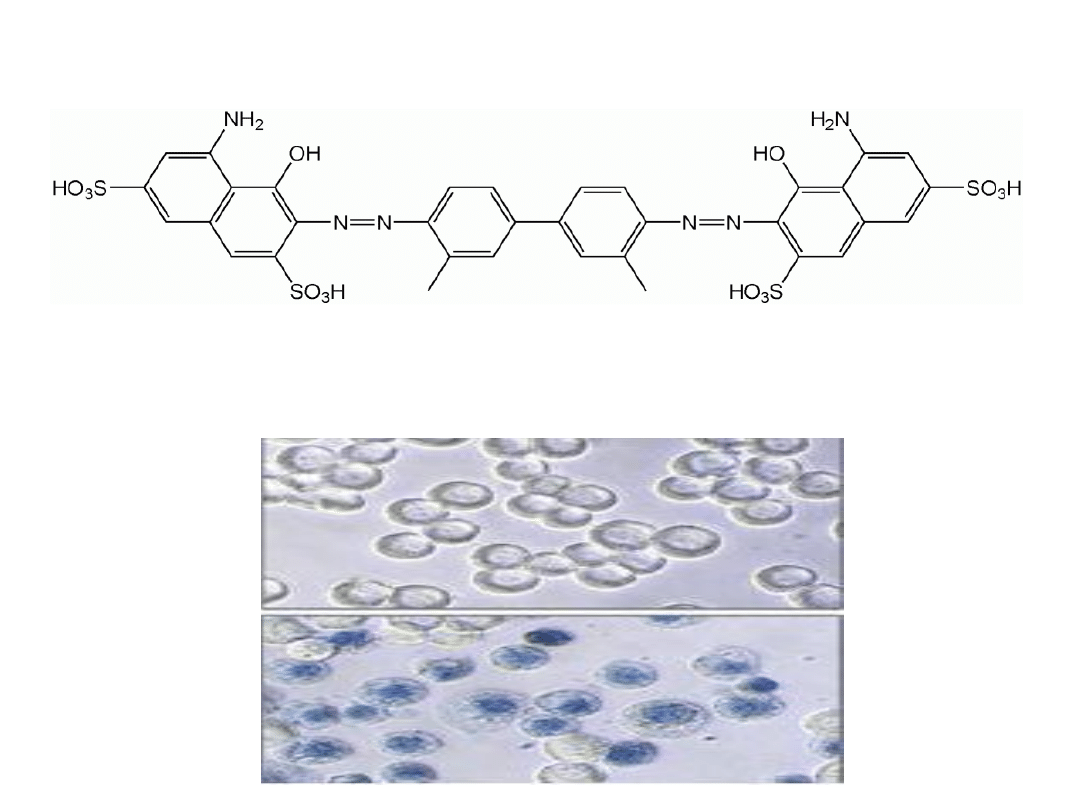
Barwienie błękitem trypanu
Proste barwienie dające możliwość oceny żywotności populacji komórek.
Barwnik przenika do komórek przez uszkodzoną błoną komórkową, barwiąc je na
niebiesko. Nie pozwala rozróżnić komórek nekrotycznych i apoptotycznych.

Komórka umierająca na drodze
apoptozy
•
Liczne pofałdowania błony komórkowej.
•
Zagęszczenie cytoplazmy w wyniku utraty wody przez
komórkę.
•
Zmniejszenie objętości komórki.
•
Kondensacja chromatyny i jej lokalizacja w pobliżu błony
jądrowej.
•
Obkurczanie jądra komórkowego i jego fragmentacja.
•
Fragmentacja DNA na odcinki będące wielokrotnością
nukleosomów (180-200 par zasad).
•
Powstawanie ciałek apoptotycznych.

Komórki umierające na drodze nekrozy
1.
Powstają agregaty chromatyny, dochodzi do przypadkowej
degradacja DNA.
2.
Zwiększeni objętość komórki, pęcznienie organelli oraz ich
rozpad.
3.
Drastyczny spadek poziomu ATP w komórce.
4.
Cytoplazma ulega silnej wakuolizacji.
5.
Uszkodzenie błon powoduje że zawartość komórek wylewa
się do przestrzeni międzykomórkowej.
6.
Indukcja stanu zapalnego.
7.
Komórki utworzą charakterystyczne skupiska, jako że
nekroza obejmuje zwykle zwarte grupy komórek
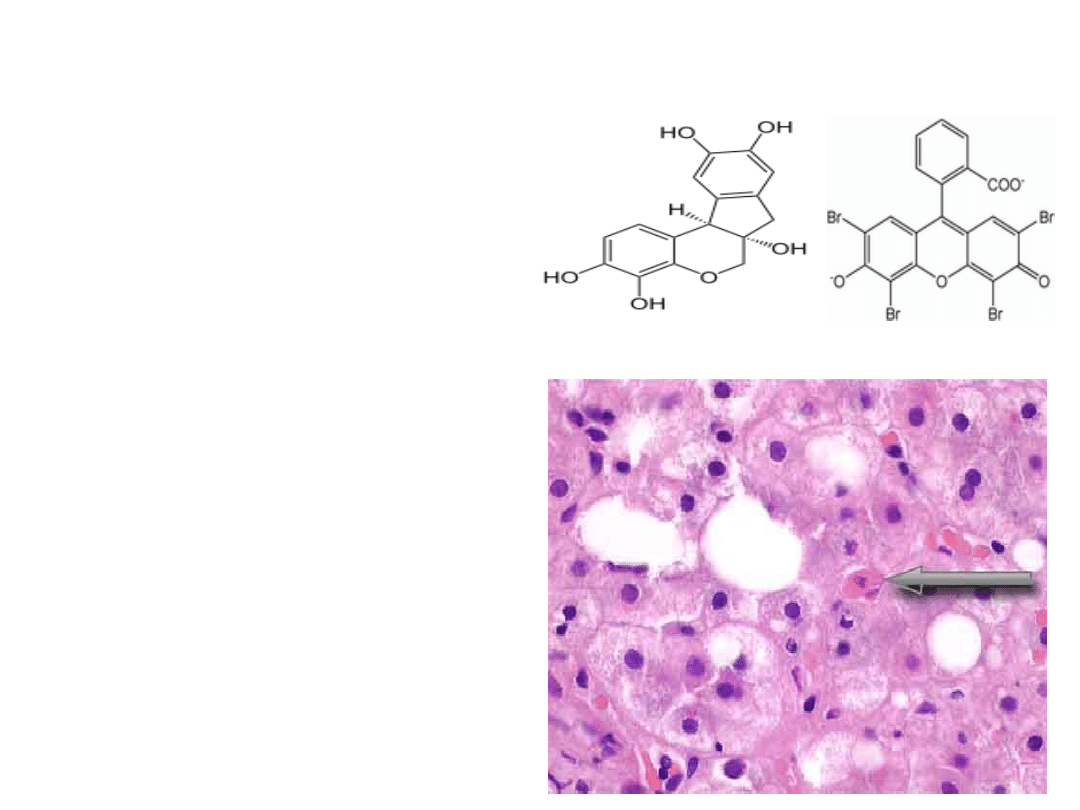
Wykrywanie
apoptozy
Barwienie hematoksyliną i
eozyną
•
Hematoksylina –barwnik
zasadowy, łączący się z
białkami jądra wybarwiając je
na niebiesko. Umożliwia ocenę
stopnia kondensacji
chromatyny i obserwację ciałek
apoptotycznych
•
Eozyna – barwnik kwasowy,
wybarwia białka cytoplazmy na
różowo
apoptotyczne
hepatocyty barwione
eozyną i hematoksyliną
Hematoksylina
Eozyna Y
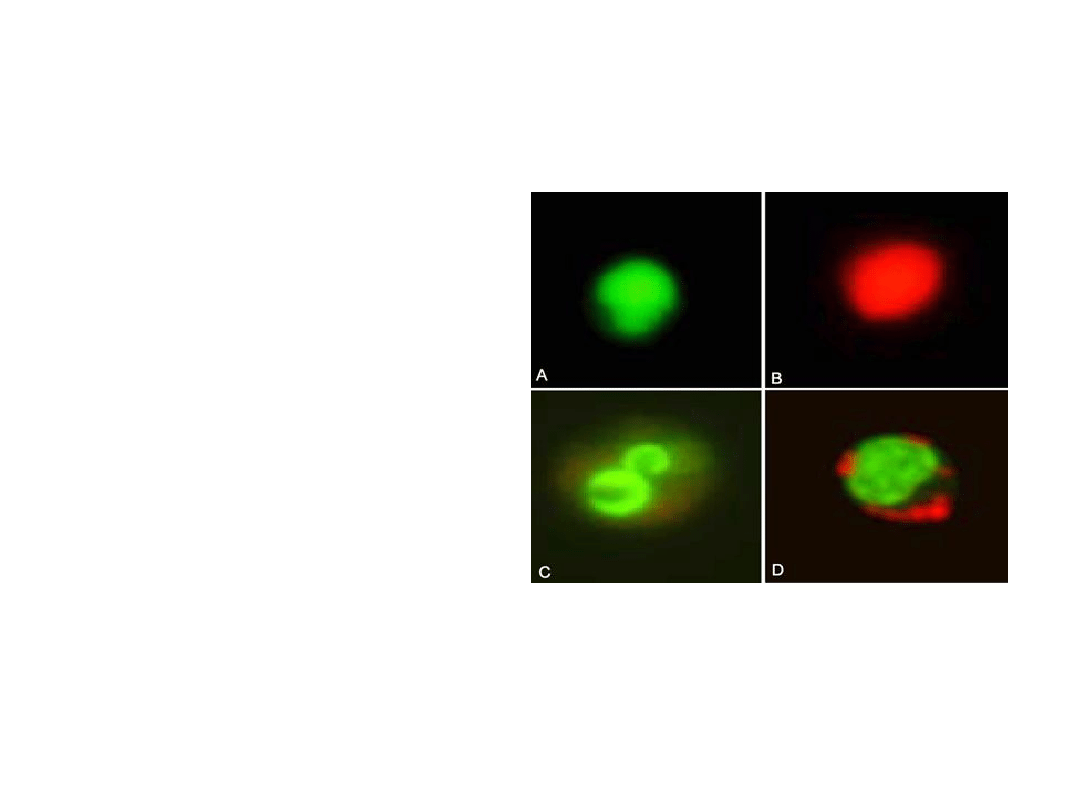
Wykrywanie apoptozy – barwienia
fluoroscencyjne.
Fluorescencyjne barwienie
oranżem akrydyny (OA) i
bromkiem etydyny (BE).
Cząsteczki barwnika interkalują
pomiędzy dsDNA, co można
zaobserwować w mikroskopie
fluorescencyjnym. OA wnikając
do jąder komórek
apoptotycznych zawierających
skondensowaną chromatynę
doprowadza do intensywnego
zielonego świecenia (szczególnie
na obrzeżach). OA ma również
zdolność do łączenia się z RNA
doprowadzają do emisji
czerwonego światła. Natomiast
BE wnika do komórek z
uszkodzoną błoną, wywołując
czerwoną lub pomarańczową
fluorescencję jądra.
Limfocyty barwione OA/BE
A) Prawidłowa komórka
B) Komórka z uszkodzoną błoną
C) Komórki apoptotyczne
D) artefakt
Barwienie OA i BE
oranż akrydyny
bromek etydyny
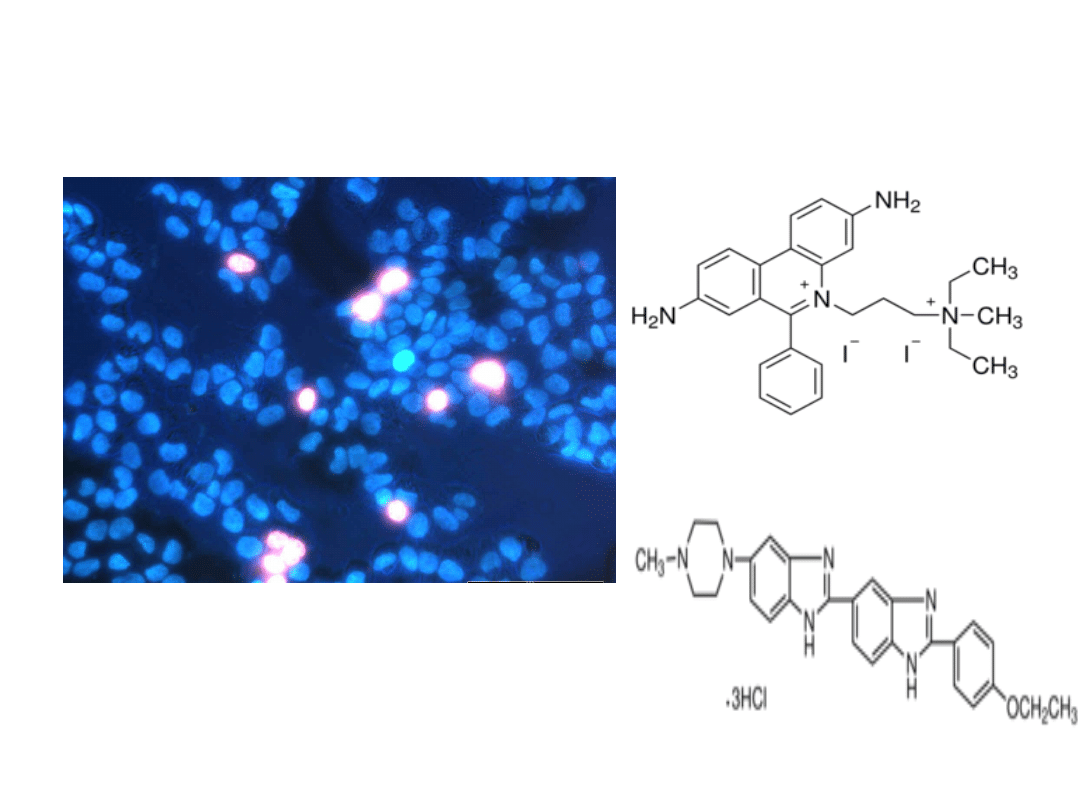
Barwienie jodkiem propidyny i
Hoechst 33342
Hoechst 33342 (bis-benzimid) wzbudza niebieskie
świecenie jądra komórek żywych łącząc się do dsDNA w
miejscach bogatych a A i T. Natomiast pojedyncze
cząsteczki jodku propidyny (IP) łączą się co 4-5 par zasad
do dsDNA umożliwiając obserwację czerwonej
fluorescencji skondensowanych jąder komórek
apoptotycznych.
jodek propidyny
Hoechst 33342
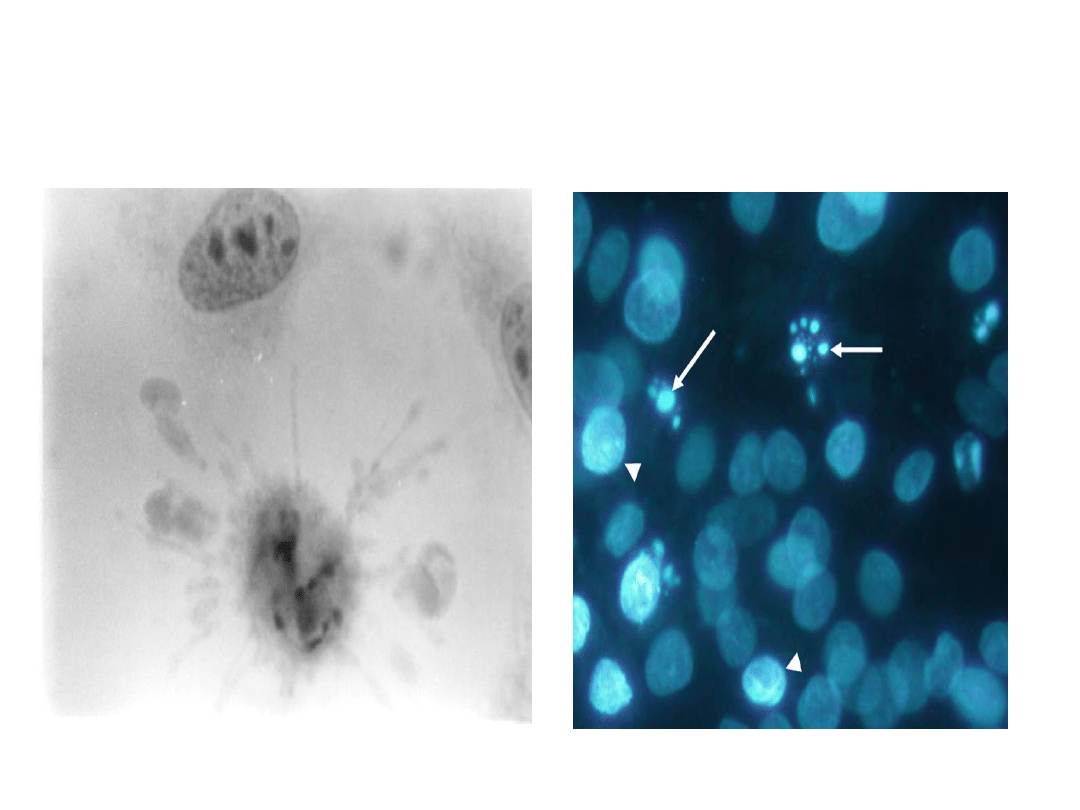
Ciałka apoptotyczne
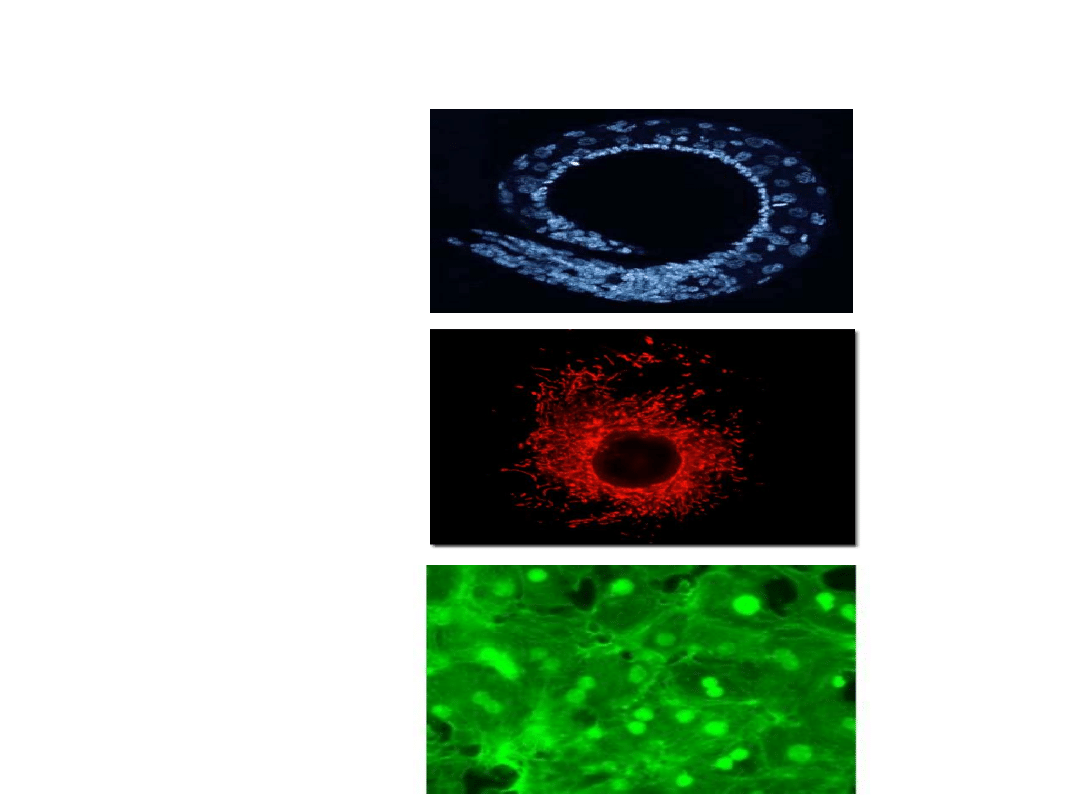
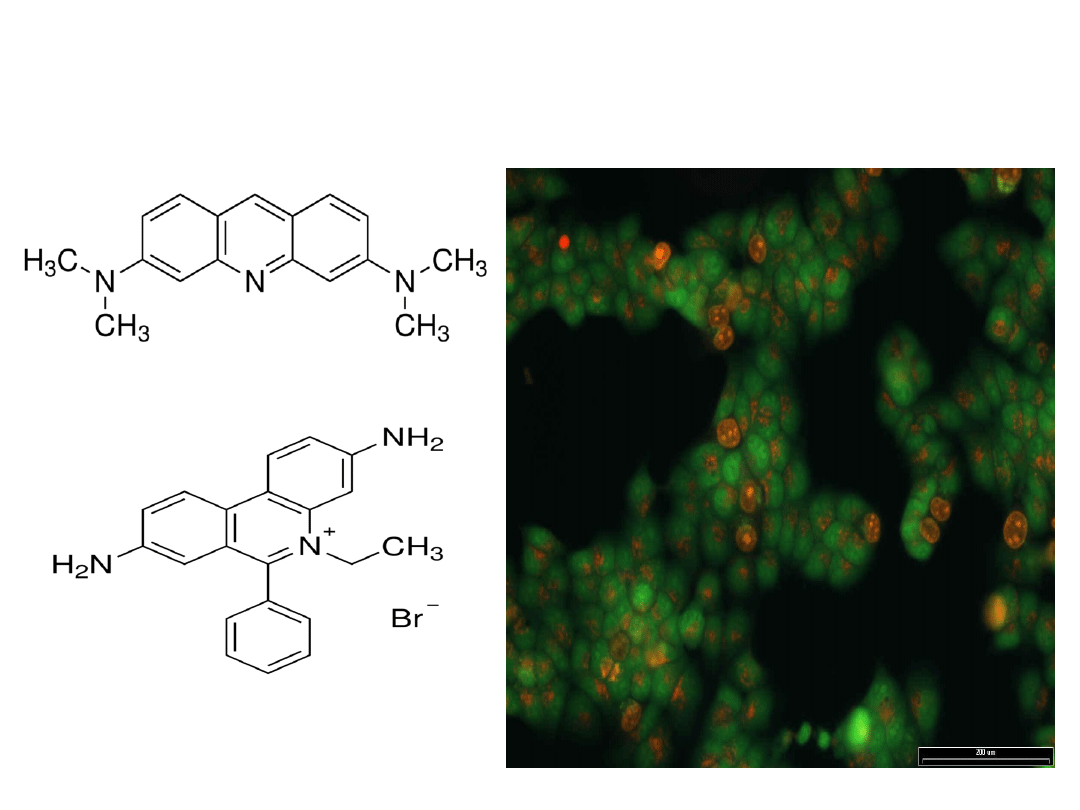
Inne barwniki fluorescencyjne (UV)
DAPI (4',6-diamidyno-2-
fenyloindol) – związek
interkalujący używany do
barwienia jąder i chromosomów.
W UV świeci na niebiesko
Red CMXRos – barwi
mitochondria żywych komórek na
czerwono
Alexa Fluor (AF) – pochodne
kumaryny, rodaminy i ksantenu
poddane sulfonacji (R-SO
2
O-). AF
488 to barwnik sprzężony z
falloidyną łączącą się specyficznie
z włóknami F-aktyny. Barwniki z tej
grupy działające na zasadzie sąd
molekularnych (np. sprzężone z Ig)
umożliwiając różnobarwne
znakowanie określonych struktur.
C. Elegans
barwiony
DAPI
Red CMXRos
Mięśnie
gładkie
szczura
Alexa Fluor 488
barwiący
włókna
aktynowe
Wyszukiwarka
Podobne podstrony:
Dokonaj analizy i interpretacji obrazu Hansa Memlinga
Analiza i interpretacja obrazu
Laboratorium 2 - Instrukcja - Obserwacja komorek zwierzecych w mikroskopie swietlnym, Semestr II, bi
Ilościowa analiza mikrostruktury materiałów?ramicznych teoria
Dokonaj analizy i interpretacji obrazu Hansa Memlinga
Ilościowa analiza mikroskopowa skał
11 Ścieki i ich oczyszczanie Analiza sanitarna wody metodą membranową Analiza mikroskopowa osadu czy
Komputerowa akwizycja i analiza obrazu (lab PolWr)
Pomiar wielkości komórek wątrobowca za pomocą mikroskopu
Metody barwienia i różnicowania komórek
Analiza obrazu Zaślubiny Arnoldinch
100 Rola komorek zmyslowych wewnetrznych i zewnetrznych w analizie dzwieku
Mikroskopia skaningowa i analiz Nieznany
Raport z analizy obrazu
analiza obrazu-opis dziela-APOTEOZA del Pozzo, Analiza dzieł sztuki
więcej podobnych podstron