prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
150
LITOWCE - grupa 1. (IA)
(metale alkaliczne)
Ogólna charakterystyka
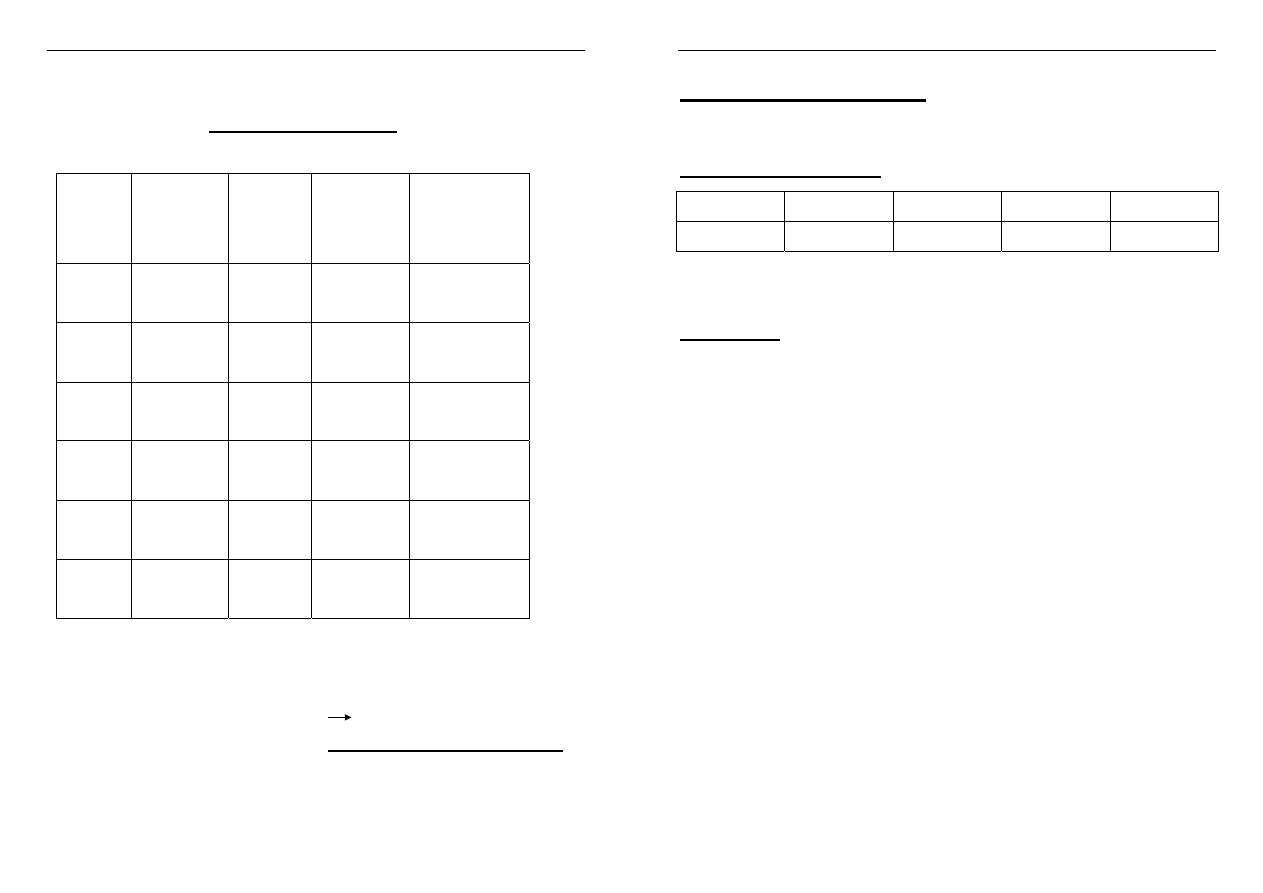
Symbol Nazwa
Walenc.
Konfig.
Elektr.
Elektro-
ujemność
(Allreda-
Rochowa)
E
0
M+/M
Potencjał
Standard.
(V)
Li
lit
2s
1
0,97
-3,04
Na
sód
3s
1
1,01
-2,71
K
potas 4s
1
0,91
-2,93
Rb
rubid 5s
1
0,89
-2,98
Cs
cez
6s
1
0,86
-3,03
Fr
frans 7s
1
0,86
-2,9
Stopnie utlenienia: +1
Metale nieszlachetne E
0
M+/M
od -3 do –2,7 (V)
tzn. łatwo oddają elektrony, M M
+
+ e,
w stanie wolnym (jako metale) są najsilniejszymi reduktorami,
trudno je wydzielić (zredukować) z roztworu.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
151
Występowanie, minerały:
Nie występują w stanie wolnym
Rozpowszechnienie:
Li Na K Rb Cs
2·10
-3
% 2,4 %
2,1 %
9·10
-3
% 3·10
-4
%
(Fr – w ilościach ślad. nietrwały izotop promieniotwórczy)
Minerały:
Li
występuje w skorupie ziemskiej w minerałach
sodu i potasu oraz w glinokrzemianach
Na Na[AlSi
3
O
8
]
albit (grupa skaleni)
NaCl
sól kamienna
woda morska (2,8 %)
NaNO
3
saletra chilijska
K KCl
sylwin
KNO
3
saletra indyjska
Rb, Cs
w minerałach sodu i potasu
Fr
najtrwalszy izotop
223
Fr
(T
1/2
= 21 min)
--------------------------------------------------------------------------------
K, Rb
mają natur. izotopy prom. (długie okresy półtrwania)
40
K (T
1/2
= 1·10
9
lat)
87
Rb (T
1/2
= 6·10
10
lat)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
152
Właściwości fizyczne i chemiczne:
- metale o barwie srebrzystobiałej
- bardzo miękkie
- mają gęstość mniejszą od wody (Li jest najlżejszym
metalem)
- bardzo dobre przewodniki elektryczności
W danym okresie (grupa 1.)
- mają najmniejszy ładunek jądra
- najsłabiej przyciągają elektron walencyjny
i elektrony wewnętrznych powłok
- największy promień atomowy
- największy promień jonowy
Tworzą jony jednowartościowe M
+
Związki litowców mają charakter wyłącznie jonowy
Cs i Fr mają najmniejszą elektroujemność
spośród wszystkich pierwiastków
Li : najsilniejszy ujemny potencjał stand. (-3,04 V)
(1- sze miejsce w szeregu napięciowym)
Lotne związki litowców barwią płomień:
Li
+
–
k
k
a
a
r
r
m
m
i
i
n
n
o
o
w
w
o
o
, Na
+
–
ż
ż
ó
ó
ł
ł
t
t
o
o
, K
+
–
f
f
i
i
o
o
l
l
e
e
t
t
o
o
w
w
o
o
-
-
r
r
ó
ó
ż
ż
o
o
w
w
o
o
Sole litowców są bezbarwne i w większości dobrze
rozpuszczalne w wodzie
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
153
Litowce reagują energicznie :
1) z wodą: Na + H
2
O = Na
+
+ OH
-
+ ½ H
2
tworzą bardzo mocne zasady
(metale przechowuje się w nafcie)
(stałe wodorotlenki litowców są bardzo higroskopijne)
2) z wodorem: 2Na + H
2
= 2NaH (
c. stałe)
wodorki litowców mają charakter jonowy:
NaH + H
2
O = Na
+
+ OH
-
+ H
2
3) z tlenem: - nadtlenki Na
2
O
2
2 Na + O
2
= Na
2
O
2
(aniony O
2
2
-
)
Na
2
O
2
stosowany w okrętach podwodnych do oczyszczania
powietrza:
Na
2
O
2
+ CO
2
= Na
2
CO
3
+ ½ O
2
tlenki: Na
2
O Na
2
O
2
+ 2Na = 2Na
2
O
2Li + ½O
2
= Li
2
O
ponadtlenki: KO
2
, RbO
2
, CsO
2
(aniony O
2
-
)
(produkty spalania K, Rb i Cs w tlenie)
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Wodorotlenek sodu NaOH
Soda żrąca, soda kaustyczna, wodny roztwór NaOH – ług sodowy
Otrzymywanie laboratoryjne
(metaliczny sód + para wodna)
Na + H
2
O = NaOH + ½ H
2

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
154
Otrzymywanie przemysłowe NaOH:
Elektroliza wodnego roztworu NaCl
1) metoda przeponowa
Anoda: 2Cl
-
= Cl
2
+ 2e
-
(utlenienie)
Katoda 2H
2
O + 2e
-
= 2OH
-
+ H
2
(redukcja)
Katoda grafitowa lub żelazna
na katodzie nie wydziela się metaliczny sód, gdyż metal
ten ma niższy potencjał standardowy od wodoru
----------------------------------------------------------------
W pobliżu katody powstaje NaOH (Na
+
+ OH
-
)
całość procesów elektrolitycznych przedstawia równanie:
2 NaCl + 2 H
2
O = Cl
2
+ H
2
+ 2 NaOH
Elektrolizę przeprowadza się tak, aby Cl
2
wydzielający się
na anodzie nie miał kontaktu z NaOH (tworzącym się
wokół katody), aby zapobiec reakcji:
NaOH + Cl
2
= NaCl + NaClO
chloran(I) sodu
Konieczne jest oddzielenie przestrzeni katodowej od
anodowej porowatą przeponą
(mogą dyfundować jony Cl
-
, a nie pęcherzyki gazów)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
155
2) metoda rtęciowa
otrzymany NaOH ma znacznie lepszą czystość
stosowana jest katoda rtęciowa
Na katodzie Hg wydziela się metaliczny sód (Na) !
Przyczyna: - wydzielenie H
2
na idealnie gładkiej
powierzchni elektrody rtęciowej wymaga przyłożenia
wyższego napięcia (nadnapięcia), w porównaniu do
elektrody grafitowej lub żelaznej.
Anoda: Cl
-
= ½ Cl
2
+ e
-
Katoda Na
+
+ e
-
= Na
(amalgamat)
amalgamat = stop metalu z rtęcią
Utworzony amalgamat Na/Hg przenosi się do zbiornika z
czystą wodą:
Na + H
2
O = Na
+
+ OH
-
+ ½ H
2
Wodorotlenek potasu – KOH otrzymuje się metodą
elektrolizy roztworów KCl
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
156
Otrzymywanie węglanu sodu Na
2
CO
3
(sody)
na skalę techniczną
metodą amoniakalną Solvaya (1863)
surowce: NaCl (sól kamienna)
NH
3
CO
2
H
2
O
CaCO
3
Etapy:
NH
3
+ CO
2
+ H
2
O = (NH
4
)HCO
3
(NH
4
)HCO
3
+ NaCl = NaHCO
3
+ NH
4
Cl
2 NaHCO
3
prażenie
Na
2
CO
3
+ CO
2
+ H
2
O
Zasadniczym źródłem CO
2
jest rozkład wapieni:
CaCO
3
= CaO + CO
2
CaO + H
2
O = Ca(OH)
2
wapno gaszone
Ca(OH)
2
+ 2NH
4
Cl = CaCl
2
+ 2NH
3
+ 2H
2
O
--------------------------------------------------------------
2 NaCl + CaCO
3
= Na
2
CO
3
+ CaCl
2
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
157
Zastosowania niektórych związków sodu i potasu
a) proszek do pieczenia ciast
zawiera m.in. wodorowęglan amonu
ogrzewanie
NH
4
HCO
3
NH
3
+ CO
2
+ H
2
O
b) proch strzelniczy
KNO
3
: C
(węgiel drzewny)
: S = 7 : 2 : 1
c) do konserwacji mięsa – saletra KNO
3
d) NaOH – ług sodowy
do dezynfekcji, przetykania rur (płyn „ kret”)
e) Na
2
O
2
do oczyszczania powietrza
w okrętach podwodnych,
aparatach do oddychania:
Na
2
O
2
+ CO
2
= Na
2
CO
3
+ ½ O
2
Wyszukiwarka
Podobne podstrony:
3 litowce
litowce, berylowce oraz glin zadania
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Litowce
Litowce 3
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
LITOWCE
Litowce i fluorowce SPRAWDZIAN, do wykorzystania w szkole
Litowce i berylowce
reakcje+litowce+i+berylowce1
litowce,?rylowce, fluorowce
Litowce i?rylowce
litowce wyklady
litowce - fluorowce, Chemia
litowceberylowce borowce
LITOWCE
Litowce, chemia
litowce 2
więcej podobnych podstron