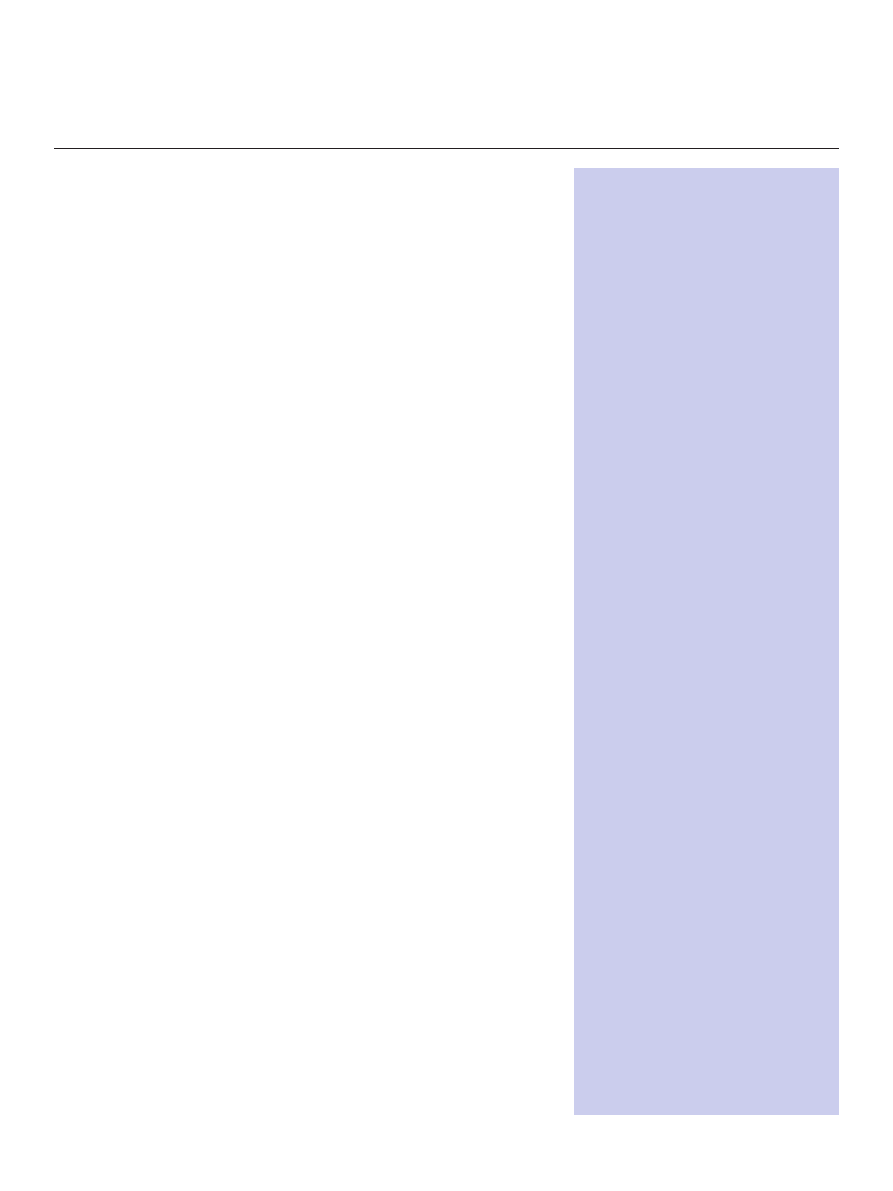
Postępy Biochemii 58 (3) 2012
281
Daria Sałata
1,2,*
Marta Budkowska
1,2
Barbara Dołęgowska
1,2
1
Katedra
Diagnostyki
Laboratoryj-
nej i Medycyny Molekularnej, Pomor-
ski
Uniwersytet
Medyczny,
Szczecin
2
Katedra i Zakład Fizjologii, Pracownia Bioche-
mii i Fizjologii Komórki Macierzystej, Pomor-
ski Uniwersytet Medyczny, Szczecin
*
Katedra Diagnostyki Laboratoryjnej i
Medycyny Molekularnej, Zakład Analityki
Medycznej, Pomorski Uniwersytet Medyczny,
ul. Powstańców Wielkopolskich 72, 70-111
Szczecin; tel.: (91) 466 15 08, e-mail: daria_
salata@wp.pl
Artykuł otrzymano 22 grudnia 2011 r.
Artykuł zaakceptowano 23 maja 2012 r.
Słowa kluczowe: sfingozyno-1-fosforan, me-
tabolizm sfingozyno-1-fosforanu, sfingozyno-
-1-fosforan w fizjologii, sfingozyno-1-fosforan
w patologii, komórka macierzysta
Wykaz skrótów: CXCR4 (ang. C-X-C chemokin
receptor type 4) — receptor dla chemokiny SDF-
1; FTY720 (ang. fingolimod) — fingolimod, lek
immunosupresyjny; GPCR (ang. G-protein
coupled receptors) — receptory sprzężone z
białkiem G; HSCP (ang. hematopoietic stem and
progenitor cells) — hematopoetyczne komórki
macierzyste szpiku kostnego; MAC (ang. mem-
brane attack complex) — kompleks atakujący
błonę; PKC (ang. protein kinase C) — kinaza
białkowa C; S1P (ang. sphingosine-1-phosphate)
— sfingozyno-1-fosforan; SDF-1 (ang. stromal-
derived factor-1) — stromalny czynnik wzrostu
1; SphK (ang. sphingosine kinase) — kinaza
sfingozyny; VSELs (ang. very small embryonic-
like stem cells) — małe komórki macierzyste
podobne do embrionalnych
Podziękowania: Publikacja powstała w trakcie
realizacji projektu „Innowacyjne metody wy-
korzystania komórek macierzystych w medy-
cynie” POIG, 01.02.02-00-109/09 współfinan-
sowanego przez Unię Europejską w ramach
Europejskiego Funduszu Rozwoju Regional-
nego Programu Operacyjnego Innowacyjna
Gospodarka.
Sfingozyno-1-fosforan — dyrygent wśród cząsteczek
STRESZCZENIE
S
fingozyno-1-fosforan (S1P) jest bioaktywnym lipidem z rodziny sfingolipidów, synte-
tyzowanym między innymi przez płytki krwi, magazynowanym w erytrocytach. Efekty
działania tego związku na komórki są związane z obecnością na ich powierzchni swoistych
receptorów (S1P1-S1P5). S1P działa między innymi na komórki układu krwiotwórczego i
nerwowego, wpływając na ich migrację, adhezję, różnicowanie i długość życia. Odgrywa
rolę mediatora w reakcjach zapalnych, procesach angiogenezy i gojeniu się ran. Przeciwdzia-
ła apoptozie w przeciwieństwie do sfingozyny i ceramidu. Doniesienia ostatnich lat dowo-
dzą, że S1P jest czynnikiem uczestniczącym w procesie uwalniania komórek macierzystych
ze szpiku kostnego i ich przechodzeniu do krwi obwodowej. Na ich liczbę mają wpływ:
uszkodzenie komórek i tkanek, stres, wysiłek fizyczny i niektóre leki. Badania nad S1P w
roli głównego czynnika chemotaktycznego dla komórek macierzystych mogą w dużym stop-
niu przyczynić się do rozwoju medycyny regeneracyjnej.
WPROWADZENIE
Sfingolipidy to ważna klasa lipidów występująca w błonach plazmatycznych
wszystkich organizmów eukariotycznych [1]. Syntetyzowane są w siateczce en-
doplazmatycznej i w aparacie Golgiego, skąd są transportowane do błony ko-
mórkowej [2]. Biorą udział w regulacji licznych procesów komórkowych takich
jak wzrost, różnicowanie, ruchliwość chemotaktyczna, kontrolowana śmierć ko-
mórki (apoptoza) w odpowiedzi na stres i działanie cytokin [1,3].
Cząsteczki sfingolipidów wykazują skłonność do samoorganizacji, tworząc
w błonach komórkowych mikrodomeny błonowe zwane tratwami lipidowymi,
uczestniczące w wielu procesach komórkowych, między innymi takich jak prze-
kazywanie sygnałów czy endocytoza niezależna od klatryny [4]. Zaburzenia
funkcjonowania tratw lipidowych mogą odgrywać istotną rolę w patogenezie
cukrzycy typu 2, rozwoju otyłości, chorób nowotworowych, chorób neurode-
generacyjnych (np. choroby Alzheimera), mukowiscydozy, chorób autoimmu-
nologicznych (np. SLE), lipidowych chorób spichrzeniowych oraz uszkodzenia
niedokrwienno-reperfuzyjnego [2,5].
Centralną pozycję w metabolizmie sfingolipidów zajmuje ceramid, cząsteczka
prekursorowa wszystkich sfingolipidów. W reakcji katalizowanej przez enzym ce-
ramidazę z cząsteczki ceramidu uwalniany jest aminoalkohol, sfingozyna (Ryc. 1)
[1,6]. Z kolei kinaza sfingozyny katalizuje reakcję fosforylacji sfingozyny do sfin-
gozyno-1-fosforanu (S1P), związku o olbrzymim znaczeniu z punktu widzenia
procesów komórkowych [6]. Sfingozyna i ceramid odgrywają rolę w procesach
hamowania wzrostu komórek oraz ich apoptozie w przeciwieństwie do S1P, który
wpływa na wzrost i przeżywalność komórek. Wzajemne stosunki ilościowe po-
między tymi lipidami decydują o losie komórek, ich proliferacji lub apoptozie [3].
CHARAKTERYSTYKA SFINGOZYNO-1-FOSFORANU
Sfingozyna (1,3-dihydroksy-2-amino-4-oktadeken) jest jednonienasyconym
aminoalkoholem o konfiguracji trans. W fosforanie-1-sfingozyny (ang. membrane
attack complex) reszta fosforanowa jest połączona wiązaniem estrowym z grupą
hydroksylową sfingozyny (Ryc. 1). S1P jest związkiem o właściwościach amfipa-
tycznych, nieprzechodzącym przez hydrofobowe błony komórkowe z powodu
obecności w cząsteczce polarnej „głowy” fosforanowej [3]. Źródłem sfingozyno-
-1-fosforanu w osoczu jest reakcja fosforylacji zewnątrzkomórkowej sfingozyny
przy udziale kinaz uwalnianych przez komórki śródbłonka, a także płytki krwi
(gdzie S1P jest syntetyzowany w dużych ilościach) oraz erytrocyty i komórki
tuczne [7-9]. Molekularny mechanizm działania sfingozyno-1-fosforanu na ko-
mórki polega na wiązaniu się tej cząsteczki z receptorami błonowymi (S1P1-
-S1P5) sprzężonymi z białkami G [10].
282
www.postepybiochemii.pl
Płytki krwi uważa się za jedno z głównych źródeł S1P.
Wiąże się to ze stwierdzaną w nich wysoką aktywnością
kinazy sfingozyny 1 (SphK 1) i brakiem aktywności liazy
sfingozyno-1-fosforanu [11]. Sfingozyna ulegająca fosfory-
lacji w płytkach krwi pochodzi z osocza lub powstaje w wy-
niku metabolizmu endogennych sfingolipidów [3]. Proces
uwalniania S1P z zewnętrznej warstwy błony komórkowej
płytek krwi do osocza zachodzi pod wpływem sił ścinania
(ang. shear stress), a także po stymulacji trombiną i jest ściśle
związany z aktywnością kinazy białkowej C (PKC). Biorą w
nim udział białka transbłonowe ABC [3,8,12].
Erytrocyty magazynują S1P, chronią go przed degradacją
oraz uwalniają do osocza. Nie stwierdza się w nich obecno-
ści enzymów rozkładających S1P (liaza S1P, fosfataza S1P),
natomiast aktywność erytrocytarnej kinazy sfingozyny
(SphK) jest niewielka. Erytrocyty prawdopodobnie odbie-
rają S1P z tkanek podczas krążenia w organizmie lub też
absorbują egzogenną sfingozynę z osocza i przekształcają
ją w S1P [9,11,13]. Krwinki czerwone są określane jako oso-
czowy magazyn S1P i odgrywają główną rolę w regulacji
stężenia S1P w osoczu [13]. Ito i wsp. wykazali, że ilość S1P
w erytrocytach stanowi około połowę całkowitego stężenia
tego sfingolipidu we krwi pełnej [14]. Erytrocyty stanowią
rodzaj buforu kontrolującego stężenie S1P we krwi obwo-
dowej oraz jego uwalnianie [15].
Czynniki zakaźne, stres, wysiłek
fizyczny, uszkodzenie tkanek i na-
rządów, a także niektóre leki, mogą
prowadzić do aktywacji układu do-
pełniacza, w wyniku czego powstaje
kompleks atakujący błonę (MAC).
MAC jest odpowiedzialny za rozpad
erytrocytów połączony z uwalnia-
niem S1P do osocza [16].
Sfingozyno-1-fosforan uwalniany z
płytek po ich aktywacji oraz z erytro-
cytów stanowi stały składnik osocza i
surowicy. W surowicy stężenia S1P są
większe w porównaniu z osoczem, co
jest spowodowane jego uwalnianiem
z płytek podczas krzepnięcia krwi [8].
W osoczu S1P krąży w połączeniu z
albuminą i lipoproteinami, głównie
frakcją HDL (HDL>LDL>VLDL),
dzięki czemu jest chroniony przed
działaniem osoczowych fosfataz. Po-
łączenie z białkiem i lipoproteinami
reguluje również biodostępność S1P,
chroniąc go przed związaniem się z
receptorami dla S1P obecnymi na ko-
mórkach śródbłonka [11]. Doniesienia
dotyczące stężeniach S1P w surowicy,
osoczu oraz elementach morfotycz-
nych krwi różnią się istotnie w zależ-
ności od zastosowanej przez autorów
metody ekstrakcji i oznaczania tego
sfingolipidu (Tab. 1) [8].
Rycina 1. Metabolizm sfingolipidów.
Tabela 1. Stężenie sfingozyno-1-fosforanu we krwi.
Materiał biologiczny Metoda
Stężenie S1P
Piśmiennictwo
OSOCZE
radioizotopowa
191 ± 79 pmol/mol
[17]
ekstrakcja HPLC
368,8 ± 55,5 pmol/mol
[18]
radioizotopowa HPLC
145 pmol/mol
[19]
ekstrakcja HPLC
711 ± 11 pmol/mol
[20]
ekstrakcja HPLC
212 ± 59 pmol/mol
[21]
SUROWICA
radioizotopowa
484 ± 82 pmol/mol
[17]
ekstrakcja HPLC
982 ± 89 pmol/mol
[22]
ekstrakcja HPLC
1760 ± 11 pmol/ml
[20]
PŁYTKI KRWI
ekstrakcja HPLC
84 ± 15 (pmol/10
8
komórek) [22]
radioizotopowa HPLC
341 pmol/mol
[19]
radioizotopowa
141,4 ± 4 (pmol/10
8
komórek)
[17]
ERYTROCYTY
ekstrakcja HPLC
14,1 ± 1,9 g/dl
[18]
radioizotopowa HPLC
589 pmol/mol
[23]
radioizotopowa
7,17 ± 1,66 pmol/mol
[17]

Postępy Biochemii 58 (3) 2012
283
Na temat zawartości S1P w komórkach i tkankach czło-
wieka wiadomo stosunkowo niewiele. Badania przeprowa-
dzone na tkankach szczura wykazały w nich wielokrotnie
mniejsze stężenia S1P w porównaniu z elementami morfo-
tycznymi krwi. Wyjątek stanowią komórki nowotworowe,
gdzie stężenie S1P jest wysokie ze względu na wysoką ak-
tywność kinazy sfingozyny 1 (SphK1) [24].
METABOLIZM SFINGOZYNO-1-FOSFORANU
Wewnątrzkomórkowy poziom S1P jest wynikiem rów-
nowagi między jego syntezą katalizowaną przez kinazę
sfingozyny (SphK) i degradacją S1P katalizowaną przez fos-
fatazę S1P i liazę S1P [12]. Kinaza S1P katalizuje fosforylację
sfingozyny do S1P (Ryc. 1) i tym samym ustala równowagę
pomiędzy stężeniem S1P i sfingozyny. Scharakteryzowano
dwie izoformy tego enzymu: kinazę sfingozyny 1 (SphK1)
i kinazę sfingozyny 2 (SphK2). Kinaza SphK2, w odróż-
nieniu od Sphk1 występującej głównie w cytozolu, zależ-
nie od typu komórki jest obecna w różnych przedziałach
wewnątrzkomórkowych [25]. Obie kinazy mogą się prze-
mieszczać do błony komórkowej, gdzie katalizują syntezę
zewnątrzkomórkowej puli S1P [26].
SphK1 jest głównym enzymem, którego aktywność regu-
luje poziom S1P. Na aktywność kinaz S1P, a tym samym na
zwiększenie poziomu S1P mogą wpływać między innymi
czynniki wzrostu, agoniści receptorów sprzężonych z biał-
kiem G (GPCR), cytokiny, estry forbolu, witamina D3. W
procesie aktywacji kinazy SphK1 następują kolejno fosfo-
rylacja, translokacja do błony komórkowej, gdzie znajduje
się substrat (S1P) oraz oddziaływanie z fosfolipidami i/lub
niektórymi białkami [12].
Zsyntetyzowany sfingozyno-1-fosforan może działać
jako wewnątrzkomórkowy przekaźnik drugiego rzędu, a
także autokrynnie lub parakrynnie za pośrednictwem re-
ceptorów S1P [11,12]. S1P wyprodukowany wewnątrz ko-
mórek może dotrzeć do receptorów na powierzchni błony
za pomocą białek transportowych ABC, czego przykładem
jest jego wydzielanie z aktywowanych komórek tucznych
[27].
Rozmieszczenie tkankowe kinaz jest zróżnicowane.
Najwyższe aktywności SphK1 stwierdzono w płucach, śle-
dzionie i wątrobie. SphK2 występuje głównie w wątrobie,
mózgu i w sercu. Podwyższone aktywności SphK1 i SphK2
stwierdza się także podczas rozwoju embrionalnego [28].
Geny kodujące SphK1 wykazują znaczną nadekspresję w
wielu rodzajach nowotworów (mózgu, piersi, jelita grube-
go, płuc, jajnika, żołądka, macicy, nerki, odbytnicy i jelita
cienkiego) w porównaniu ze zdrowymi tkankami. SphK1
odgrywa istotną rolę w progresji zmian nowotworowych.
Obecność tego enzymu wiąże się z procesami angiogenezy,
a także z opornością komórek nowotworowych na radiote-
rapię oraz chemioterapię. Funkcja SphK2 jest jeszcze słabo
poznana [3,29].
Liazy S1P i fosfatazy S1P są zlokalizowane w siateczce
endoplazmatycznej. Liaza S1P (zależna od fosforanu piry-
doksalu) katalizuje rozkład S1P do fosforanu etanoloaminy
i heksadecenalu. Rozkład S1P przez liazy S1P wydaje się być
główną drogą umożliwiającą przekształcanie sfingolipidów
do glicerofosfolipidów. Liazy S1P wykazują swoją aktyw-
ność głównie w wątrobie, nerkach, płucach, sercu i mózgu.
Nie występują w płytkach krwi i erytrocytach [10]. W ba-
daniach przeprowadzonych na myszach pozbawionych lia-
zy S1P stwierdzono patologiczne zmiany w płucach, sercu,
drogach moczowych i w kościach oraz skrócony czas życia
zwierząt [30].
Reakcja defosforylacji S1P jest katalizowana przez S1P-
-specyficzne fosfohydrolazy SPP1 i SPP2 lub przez fosfo-
hydrolazy o szerokiej specyficzności substratowej (LPP1,
LPP2 i LPP3) [31]. Fosfataza SPP1 oraz kinaza SphK2
uczestniczą w procesie syntezy ceramidu i innych sfingo-
lipidów. Zmniejszona aktywność SPP1 powoduje zwięk-
szenie zawartości S1P w komórce, natomiast nadaktywność
tego enzymu prowadzi do nadprodukcji ceramidu i inicjacji
apoptozy. Znacznie mniej wiadomo na temat fizjologicznej
funkcji SPP2 [32].
RECEPTORY SFINGOZYNO-1-FOSFORANU
Do chwili obecnej zidentyfikowano pięć ludzkich recep-
torów sfingozyno-1-fosforanu, które sklasyfikowano jako
S1P1-S1P5. Każdy z receptorów jest sprzężony z odpowied-
nim białkiem G (S1P1 — białko G
i
, S1P2 oraz S1P3 — białka
G
i
, G
q
, G
13
, S1P4 — białko G
i
, G
12/13
, S1P5 — białko G
i
, G
12
)
Receptory S1P posiadają siedem domen transbłonowych
wykazujących między sobą około 50% identyczności se-
kwencji aminokwasowej. Głównym ligandem jest dla nich
S1P oraz wykazujący mniejsze powinowactwo dihydro-S1P
[10,33].
Receptory S1P1-S1P5
są obecne w wielu komórkach or-
ganizmu. Obecność S1P1, S1P2, i S1P3 stwierdzono w mó-
zgu, sercu, płucach, śledzionie i wątrobie oraz w mniejszym
stopniu w nerkach, mięśniach i grasicy. S1P4 występuje
głównie w tkankach limfatycznych (grasicy, śledzionie, wę-
złach chłonnych) oraz w płucach. S1P5 jest obecny głównie
w układzie nerwowym i skórze [34,35]. Identyfikacja recep-
torów S1P przyczyniła się do lepszego zrozumienia ich roli
w utrzymaniu homeostazy oraz w wielu procesach patolo-
gicznych [36].
Aktywacja receptorów S1P powoduje dysocjację białek G
na podjednostki alfa i beta co zapoczątkowuje dalsze ścieżki
sygnałowe decydujące o przebiegu wielu procesów fizjolo-
gicznych, między innymi takich jak migracja komórek, krą-
żenie limfocytów, przepuszczalność naczyń czy prawidło-
wa czynność serca [33,35]. Funkcje poszczególnych recepto-
rów i związanych z nimi białek G przedstawiono w tabeli 2.
MECHANIZMY DZIAŁANIA
SFINGOZYNO-1-FOSFORANU
Sfingozyno-1-fosforan za pośrednictwem swoistych re-
ceptorów S1P wywiera istotny wpływ na migrację, adhezję,
różnicowanie i przeżywalność wielu komórek [37]. Migracja
komórek in vivo lub in vitro jest zapoczątkowywana przez
stymulację receptorów na powierzchni komórek i przeka-
zywanie zewnątrzkomórkowego sygnału, który wywołuje

284
www.postepybiochemii.pl
szereg zmian prowadzących do przebudowy cytoszkieletu
[38]. W zależności od typu aktywowanego receptora, S1P
może zarówno zwiększyć jak i zmniejszyć migrację komó-
rek. W przypadku komórek nowotworowych S1P działają-
cy za pośrednictwem receptorów S1P1 oraz S1P3 nasila ich
migrację. Natomiast gdy S1P aktywuje receptor S1P2, pro-
ces ten ulega zahamowaniu (np. w komórkach nowotworo-
wych żołądka) [39]. Uważa się że promigracyjny efekt po-
budzenia receptorów S1P1 i S1P3 wynika z ich połączenia z
białkiem G
i
. Receptor S1P2 występuje głównie w połączeniu
z białkiem G
12/13
, chociaż także
może się łączyć z białkiem
G
i
. Konsekwencją sprzężenia receptora S1P2 z białkiem
G
12/13
jest silna aktywacja białka Rho, hamowanie białka Rac
i migracji komórek [40].
Na migrację komórek wpływają także czynniki wzro-
stu współdziałające z S1P. Stężenie sfingozyno-1-fosforanu
oraz aktywność SphK modulują odpowiedź komórkową
na szereg czynników takich jak płytkowy czynnik wzrostu
(PDGF) [41], nerwowy czynnik wzrostu (NGF) [42], epider-
malny czynnik wzrostu (EGF) [43], transformujący czynnik
wzrostu (TGF-β) [44]. W fibroblastach i komórkach mięśni
gładkich receptor S1P1 wraz z receptorem PDGFβ tworzą
kompleks, którego pobudzenie stymuluje migrację tych ko-
mórek [40].
Sfingozyno-1-fosforan jest kluczowym mediatorem za-
równo w procesach migracji, jak i różnicowania komórek
śródbłonka oraz mięśni gładkich, w angiogenezie, zapale-
niu i gojeniu się ran [38,45]. S1P odgrywa główną rolę w mi-
gracji limfocytów i komórek tucznych do antygenów oraz
do miejsc infekcji [3].
Sfingolipidy wpływają na poziom wapnia w komórce.
Ceramid powoduje uwalnianie wapnia z siateczki endopla-
zmatycznej i prowadzi do zwiększenia zawartości wapnia
w cytoplazmie i mitochondrium. W regulacji homeostazy
wapnia w komórkach ssaków może także uczestniczyć S1P
[46]. Badania sugerują, że S1P jest przekaźnikiem drugiego
rzędu, który może aktywować kanały wapniowe. Sfingo-
zyno-1-fosforan wpływa na wewnątrzkomórkowy poziom
Ca
2+
za pośrednictwem receptorów S1P2 i S1P3 powodując
uwalnianie jonów wapnia z magazynów, głównie z siatecz-
ki endoplazmatycznej [47]. S1P może również indukować
uwalnianie jonów wapnia z permeabilizowanych komórek
na drodze niereceptorowego mechanizmu zależnego od tri-
fosforanu inozytolu [48]. Równowaga pomiędzy stężeniem
ceramidu, sfingozyny i S1P decyduje o śmierci lub przeży-
ciu komórki. Jej przesunięcie w kierunku zwiększonego stę-
żenia ceramidu i sfingozyny prowadzi do śmierci komórki.
Z kolei przeżywalność i/lub proliferacja komórki wymaga
obecności zwiększonego stężenia S1P [49].
Antyapoptotyczne działanie S1P jest związane z kilkoma
różnymi procesami komórkowymi. W niektórych popu-
lacjach komórek S1P może zapobiegać apoptozie poprzez
hamowanie zmiany potencjału błony mitochondrialnej i
uniemożliwiając tym samym uwolnienie z mitochondriów
cytochromu c [50]. W innych komórkach S1P bezpośrednio
stymuluje kinazę MAP (kinaza aktywowana mitogenami)
Tabela 2. Charakterystyka receptorów S1P [37].
Receptor
Białko G
Szlak sygnalny
Obecność w tkankach Fizjologiczne działanie
Agonista/Antagonista
S1P1
Gi/o
↓ AC, ↓ERK,
↑ PLC,
↑ PI3K/Akt,
↑ eNOS,
↑ Rac,
↑ Rho
szeroka dystrybucja
ruchliwość komórek
FTY720-P
cyrkulacja limfocytów
KRP-203
angiogeneza
SEW2871
neurogeneza
VPC 23019
S1P2
Gi/o,Gq, G12/13
↕ AC, ↑ PLC,
↑ JNK,
↑ p38,
↓Rho, ↓ Rac
szeroka dystrybucja,
komórki mięśni
gładkich naczyń
hamowanie ruchliwości,
proliferacji komórek,
pobudzenia neuronalne,
słuch
JTE 013
S1P3
Gi/o,Gq, G12/13
↓ AC,
↑ ERK,
↑PLC,
↑ Rac, ↑ Rho
serce, płuca,
śledziona,
nerki, jelita,
przepona,
tkanka chrzęstna
bradykardia
FTY720-P
nabłonkowa bariera
płuc, słuch
VPC 23019
S1P4
Gi/o,Gs, G12/13
↑ ERK,
↑ PLC
komórki odporności,
leukocyty
cytokineza??
FTY720-P
S1P5
Gi/o,G12/
↓ AC,
↓ ERK, ↑JNK,
↑ p54JNK
ośrodkowy
układ nerwowy,
komórki NK
ruchliwość komórek
FTY720-P
AC — cyklaza adenylanowa; ERK — kinazy regulowane przez sygnały wewnątrzkomórkowe; PLC — fosfolipaza C; PI3K — 3-kinaza
fosfatydyloinozytolu; eNOS — śródbłonkowa syntaza tlenku azotu; JNK — c-Jun, NH
2
-terminalne kinazy; Rac — małe białko G z rodziny Rho;
Ras — małe białko G kodowane przez protoonkogen ras (homolog wirusowego onkogenu zidentyfikowanego w wirusie mięsaka myszy)

Postępy Biochemii 58 (3) 2012
285
na szlaku antyapoptotycznym, prowadząc do aktywacji ki-
nazy Akt i hamowania kilku białek z rodziny kaspaz. S1P
wpływa na utrzymanie równowagi pomiędzy liczbą ,,pra-
widłowych’’ komórek i komórek apoptotycznych [51].
Interesującym wydaje się fakt, że SphK1 i SphK2 wyka-
zują różny wpływ na przeżywalność komórek. Podczas ba-
dań na różnych typach komórek stwierdzono, że nadaktyw-
ność SphK1 i zwiększenie syntezy S1P promuje przeżywal-
ność komórki, indukując jej przejście z fazy G1 do fazy S i
wzrost w fazie S. W porównaniu do SphK1, nadaktywność
SphK2 hamuje wzrost komórek i nasila apoptozę [46]. W ba-
daniach in vitro na komórkach fibroblastów oraz komórkach
nowotworowych wykazano, że nadekspresja genu kodują-
cego kinazę SphK2 powoduje zatrzymanie cyklu komór-
kowego, aktywację kaspazy 3, uwolnienie cytochromu c,
czego konsekwencją jest apoptoza komórek. Apoptoza in-
dukowana przez kinazę SphK2 jest niezależna od aktywacji
receptorów S1P [52].
Przypuszcza się, że S1P powstający przy udziale SphK1,
w normalnych warunkach może działać bezpośrednio lub
pośrednio jako negatywny regulator enzymów uczestniczą-
cych w syntezie ceramidu, takich jak palmitoilotransferaza
serynowa lub syntaza ceramidu. Ta regulacja biosyntezy ce-
ramidu przez S1P może prowadzić do hamowania zależnej
od ceramidu apoptozy. Fosfataza SPP poprzez zmniejszenie
stężenia S1P także może pośrednio regulować stężenie cera-
midu i w konsekwencji proces apoptozy [46].
ROLA SFINGOZYNO-1-FOSFORANU W ORGANIZMIE
Sfingozyno-1-fosforan jest kluczowym mediatorem
w wielu procesach fizjologicznych i patologicznych [37]
(Ryc. 2). Zwiększone zainteresowanie tą cząsteczką w ostat-
nich latach spowodowało odkrycie wielu nowych funkcji
tego sfingolipidu. Poniżej omówiono najbardziej znane pro-
cesy, w których uczestniczy S1P oraz nową koncepcję na
temat roli tego lipidu w fizjologii komórek macierzystych.
PROCESY ODPORNOŚCIOWE
Sfingozyno-1-fosforan pełni główną rolę w uwalnianiu
limfocytów z pierwotnych i wtórnych narządów limfatycz-
nych [53]. Znane są dwa mechanizmy tego procesu: kontro-
la migracji limfocytów oraz kontrola wyjścia limfocytów ze
zrębu. W pierwszym mechanizmie kluczową rolę odgrywa-
ją receptory S1P1 znajdujące się na powierzchni limfocytów.
Stężenie S1P we krwi obwodowej odpowiada za ukierun-
kowaną migrację limfocytów z narządów limfatycznych
do chłonki i dalej do krwi [54]. Lek immunosupresyjny fin-
golimod (FTY720) posiadający wysokie powinowactwo do
wszystkich receptorów dla S1P, hamuje ten proces poprzez
zmniejszenie dostępności do receptora S1P1 na powierzchni
komórek. Powoduje to brak reakcji limfocytów na bodziec
chemotaktyczny jakim jest wzrost stężenia S1P [55]. W me-
chanizmie kontroli wyjścia limfocytów ze zrębu istotną rolę
odgrywają receptory S1P1 obecne w komórkach śródbłonka
oraz w warunkach prawidłowych przepuszczalne dla lim-
focytów połączenia śródbłonkowo-komórkowe. Wysokie
stężenie S1P, czy syntetyczni agoniści receptora S1P1 uru-
chamiają procesy, w wyniku których dochodzi do zamknię-
cia połączeń pomiędzy komórkami śródbłonka i limfocyty
gromadzą się w narządach limfatycznych [55,56].
Sfingozyno-1-fosforan uczestnicząc w ukierunkowanej
migracji komórek T z grasicy i drugorzędowych narzą-
dów limfatycznych odgrywa ważną rolę w prawidłowym
funkcjonowaniu układu odpornościowego. Stwierdzono,
że układ odpornościowy jest wrażliwy na zmiany aktyw-
ności enzymów uczestniczących w metabolizmie S1P [57].
S1P można zatem wiązać z rozwojem wielu chorób autoim-
munologicznych takich jak toczeń rumieniowaty układowy
(SLE), stwardnienie rozsiane, łuszczyca, choroby zapalne
jelit czy cukrzyca [57,58].
Fingolimod poprzez swoje działanie na receptory S1P
okazał się skutecznym lekiem stosowanym między inny-
mi u pacjentów po przeszczepach narządowych [59,60], w
chorobach autoimmunologicznych oraz w stwardnieniu
rozsianym [61]. Badania nad tym lekiem przyczyniły się do
poznania roli S1P w regulacji odporności [59,60,61].
ANGIOGENEZA
Sfingozyno-1-fosforan za pośrednictwem receptorów
sprzężonych z białkiem G (głównie S1P1) wpływa na ko-
mórki śródbłonka (ECs) i komórki mięśni gładkich naczyń
krwionośnych (SMCs) oddziałując na ich migrację, proli-
ferację, powstawanie struktur tubularnych oraz tworzenie
połączeń komórka-komórka [56,62]. S1P wzmacnia inte-
gralność bariery śródbłonkowej. W hodowli komórek śród-
błonka S1P powoduje zwiększenie ilości włókien aktyny i
włókien naprężeniowych [63].
Sfingozyno-1-fosforan odgrywa istotną rolę w angioge-
nezie (neowaskularyzacji) [64]. W procesie tym uczestniczą
czynniki stymulujące kinazę sfingozyny, między innymi
czynnik wzrostu śródbłonka naczyniowego (VEGF), czyn-
nik martwicy nowotworu (TNFα), naskórkowy czynnik
wzrostu (EGF) [12,37,65]. S1P aktywuje z kolei błonową me-
taloproteinazę macierzy zewnątrzkomórkowej typu 1 (MT1-
-MMP) indukującą migrację komórek śródbłonkowych [66].
W terapeutycznej neowaskularyzacji S1P lub jego synte-
tyczny analog (FTY720) zwiększają skuteczność przeszcze-
Rycina 2. Udział sfingozyno-1-fosforanu w patogenezie wielu chorób (wg [25]).

286
www.postepybiochemii.pl
pionych progenitorowych komórek śródbłonka (EPCs) i
jednojądrzastych komórek szpiku kostnego (BMCs) [67].
UKŁAD SERCOWO-NACZYNIOWY
W badaniach eksperymentalnych u zwierząt stwierdzo-
no, że zmiany stężenia S1P prowadzą do zmian ciśnienia
krwi, stężenia wapnia, przerostu miocytów, skurczu tętnic
wieńcowych i bradykardii [68]. Wykazano także, że pod-
czas uszkodzenia niedokrwienno-reperfuzyjnego (IR) w
mięśniu sercowym dochodzi do aktywacji kinazy SphK.
Podczas uszkodzenia IR pobudzane są receptory S1P2 i
S1P3, za pośrednictwem których S1P zwiększa przeży-
walność kardiomiocytów. Z kolei receptor S1P1 wykazuje
zwiększoną aktywność w proliferujących komórkach mię-
śni gładkich naczyń i w blaszkach miażdżycowych [69].
S1P oraz fingolimod działając na komórki macierzyste za
pośrednictwem receptorów S1P3 uruchamiają w nich szlaki
sygnałowe wpływające stymulująco na receptory CXCR4
dla SDF-1 (stromalny czynnik wzrostu 1). Stężenie S1P w
surowicy może być wskaźnikiem choroby wieńcowej. Wy-
niki badań wskazują, że zwiększenie stężenia S1P we krwi
może stanowić zapowiedź incydentu niedokrwienia mię-
śnia sercowego [67,70].
NOWOTWORY
W warunkach patologicznych metabolizm i działanie
S1P może ulegać modyfikacjom. W powstawanie i progresję
nowotworów zaangażowane są enzymy odpowiedzialne za
katabolizm S1P. W komórkach nowotworowych jelita gru-
bego geny kodujące fosfatazę i liazę S1P są antyonkogena-
mi. W innych typach komórek nowotworowych, na przy-
kład w raku jajnika zwiększona aktywność liazy S1P jest
przyczyną oporności na chemioterapię [56]. Liczne badania
wykazały, że gen dla SphK1 może działać jako onkogen
[71]. Zwiększoną aktywność kinazy stwierdzono w wielu
nowotworach, między innymi płuc, okrężnicy, piersi, jajni-
ka, mózgu, żołądka, macicy i nerek [56]. SphK1 moduluje
kumulację czynnika HIF-1α (czynnik 1 indukowany przez
hipoksję) w komórkach nowotworowych, a także hamuje
syntezę czynnika stymulującego inwazyjność niektórych
komórek nowotworowych, urokinazowego aktywatora pla-
zminogenu (uPA) oraz jego receptora uPAR [56,72].
Podczas badań nad glejakiem wielopostaciowym stwier-
dzono nadekspresję genu kodującego białko receptorowe
S1P1 oraz aktywację uPA, co sugeruje, że szlak sygnałowy
uruchamiany przez S1P/S1P1 zwiększa inwazyjność tego
nowotworu, pobudzenie receptora S1P1 prowadzi do mi-
gracji komórek nowotworowych [73]. Aktywacja receptora
S1P2 wywołuje efekt odwrotny. W metastazie istotna jest
zatem równowaga między podtypami receptorów dla S1P.
Rola jaką S1P odgrywa w rozwoju niektórych nowotwo-
rów sugeruje zastosowanie związków działających na re-
ceptory dla S1P jako jeden z możliwych kierunków terapii
przeciwnowotworowej. FTY720 hamuje unaczynienie guza,
angiogenezę oraz pośredniczy w apoptozie komórek nowo-
tworowych [74]. Antagonista S1P, VPC23019 hamuje pobu-
dzaną przez S1P migrację komórek raka tarczycy i jajnika.
Skuteczną w terapii nowotworowej może również okazać
się neutralizacja S1P przeciwciałami monoklonalnymi an-
ty-S1P lub zastosowanie inhibitorów SphK, na przykład
dimetylosfingozyny (DMS), która hamuje wzrost komórek
raka płuc i żołądka u myszy pozbawionych grasicy [75] lub
SK1-I, który wpływa na ograniczanie wzrostu i przeżywal-
ności komórek ludzkiej białaczki [76].
NOWO ODKRYTA ROLA S1P — PRZYCIĄGANIE
KOMÓREK MACIERZYSTYCH ZE SZPIKU
KOSTNEGO DO KRWI OBWODOWEJ
W początkowym okresie rozwoju człowieka progenito-
rowe komórki hematopoetyczne (HSPCs) krążą we krwi
obwodowej i chłonce pomiędzy obszarami aktywnymi
hematopoetycznie (np. śródbłonek aorty, wątroba płodu),
skąd docierają do tkanki docelowej, szpiku kostnego, gdzie
zasiedlają tak zwane nisze [77]. Obecność nisz podobnych
do szpikowych stwierdzono także w innych tkankach, ta-
kich jak tkanki nerwowe, mięśnia sercowego, mózgu i in-
nych [78]. W okresie życia pozapłodowego jedynie niewiel-
ka liczba komórek HSPCs jest uwalniana z nisz szpikowych
do krwi obwodowej, z którą przenoszone są do różnych na-
rządów [77]. Migracja progenitorowych komórek macierzy-
stych w organizmie jest regulowana poprzez oddziaływanie
chemokin z odpowiednimi receptorami chemokinowymi.
Liczba komórek HSPCs uwalnianych ze szpiku kostne-
go może ulec zwiększeniu w odpowiedzi na stres, stany
zapalne, uszkodzenie tkanek, wysiłek fizyczny i niektóre
leki. Najbardziej znanymi lekami powodującymi uwalnia-
nie progenitorowych komórek macierzystych ze szpiku
kostnego są cytokiny (np. G-CSF — czynnik stymulujacy
tworzenie kolonii granulocytów), cytostatyki (np. cyklofos-
famid), inhibitory receptora CXCR4 (np. AMD3100) [78,79].
Komórki macierzyste mogą ulegać ukierunkowanej migra-
cji z nisz szpiku kostnego do krwi obwodowej i zasiedleniu
w tkance docelowej. Procesy te, będąc elementami reakcji
zapalnej i regeneracji tkanek wymagają obecności chemo-
kin, aktywacji układu dopełniacza, a także niektórych fos-
folipidów takich jak sfingozyno-1-fosforan. Stwierdzono, że
niedokrwienie może być jednym z tych procesów, podczas
których dochodzi do zwiększenia stężenia i aktywności che-
moatraktantów (S1P), chemokin (SDF-1), czynników wzro-
stu (VEGF — śródbłonka naczyniowego, HGF — hepato-
cytów), cytokin (LIF — czynnik hamujący białaczkę) oraz
uruchomienia kaskady dopełniacza [80,81].
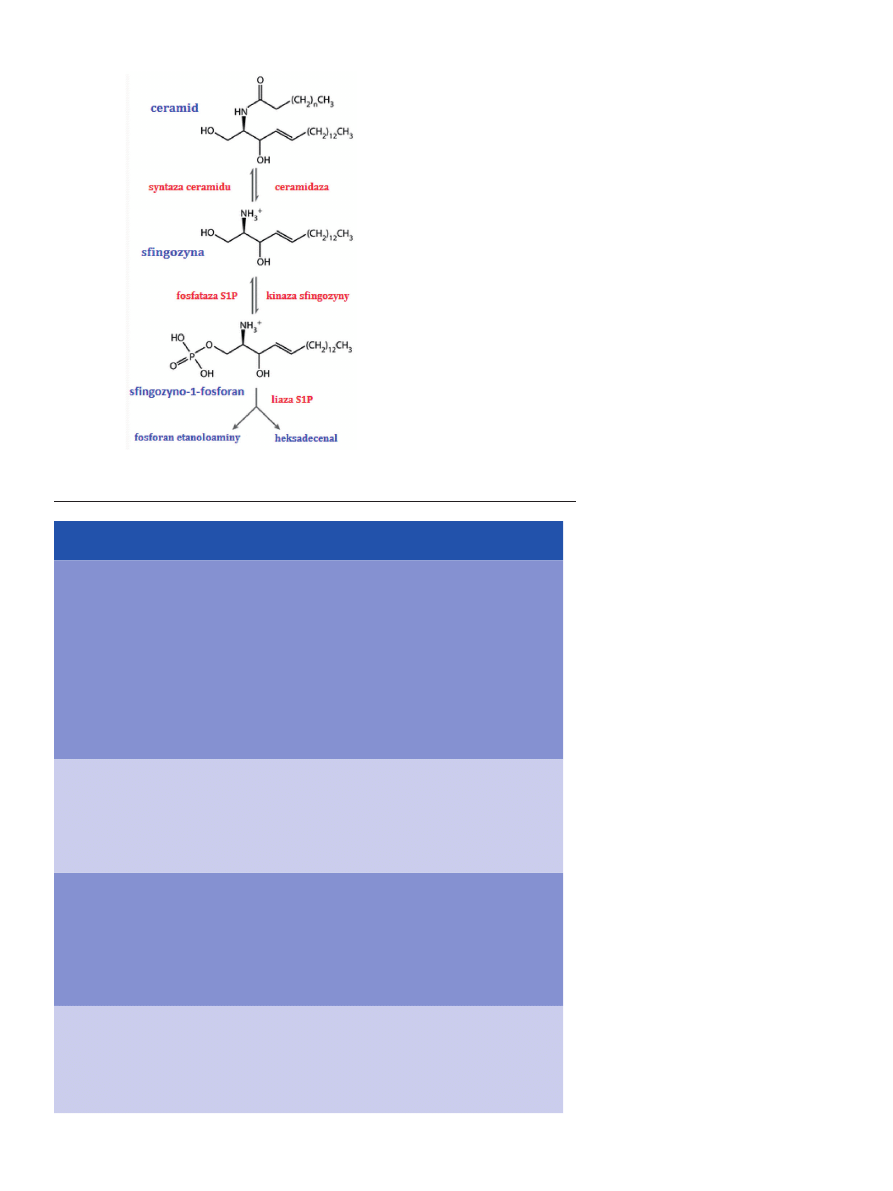
Początkowo sądzono, że czynnikiem pełniącym funkcję
chemotaktyczną w stosunku do komórek macierzystych jest
gradient SDF-1 (stromalny czynnik wzrostu -1). Wykazano
jednak, że stężenie SDF-1 w osoczu nie zawsze koreluje z
efektywnością migracji komórek macierzystych ze szpiku
kostnego [15,82,83]. Badania in vitro chemotaksji mysich ko-
mórek HSPCs wykazały, że osocze krwi myszy poddawa-
nych działaniu środków farmakologicznych silnie przycią-
ga komórki HSPCs w sposób niezależny od SDF-1. W bada-
niach tych stwierdzono również, że gradient stężeń SDF-1
pomiędzy szpikiem kostnym i krwią obwodową nie zawsze
pełni kluczową rolę w uwalnianiu komórek macierzystych,
co wskazuje na udział w tym procesie innych chemoatrak-
tantów [15]. Co więcej, cieplna inaktywacja osocza nie po-
woduje zmniejszenia migracji komórek HSPCs , natomiast
efekt ten uzyskuje się po usunięciu lipidów (ang. charcoal
Postępy Biochemii 58 (3) 2012
287
stripping). Wyniki tych doświadczeń wskazują na istotny
wpływ lipidów na procesy uwalniania i migracji komórek
macierzystych [84].
Sfingozyno-1-fosforan jest bioaktywnym
lipidem odpowiedzialnym za uwalnianie
limfocytów do krwi i chłonki. Wpływa on
także na migrację komórek progenitoro-
wych ze szpiku kostnego do różnych tka-
nek i narządów [85]. Fizjologiczne stężenie
tego sfingolipidu w osoczu jest większe od
stężenia SDF-1. Podczas uwalniania komó-
rek macierzystych z nisz szpiku kostnego
indukowanego u myszy, stwierdzono istot-
ne zwiększenie stężenia S1P we krwi obwo-
dowej [15,86,87]. Zostało to potwierdzone
również w badaniach u ludzi [91]. Działanie
S1P na komórki macierzyste jest związane
z obecnością na ich powierzchni swoistych
receptorów. Komórki HSPCs ze szpiku mi-
grują w kierunku wzrastającego stężenia
S1P we krwi i chłonce. Proces ten jest za-
leżny od receptorów S1P1 oraz S1P3 obec-
nych na powierzchni tych komórek [86]. Po
związaniu się z cząsteczką S1P receptory są
szybko internalizowane z błony komórko-
wej, podobnie jak receptory CXCR4 po ich
połączeniu się z SDF-1 [84]. W wyniku prze-
prowadzonych doświadczeń udowodniono,
że to nie SDF-1, a S1P jest kluczowym che-
moatraktantem dla różnych typów komórek
macierzystych [15,82-84,86-88]. Wniosek ten
stał się podstawą dla nowej koncepcji opisu-
jącej proces uwalniania komórek macierzystych ze szpiku
kostnego do krwi obwodowej (Ryc. 3) [15].
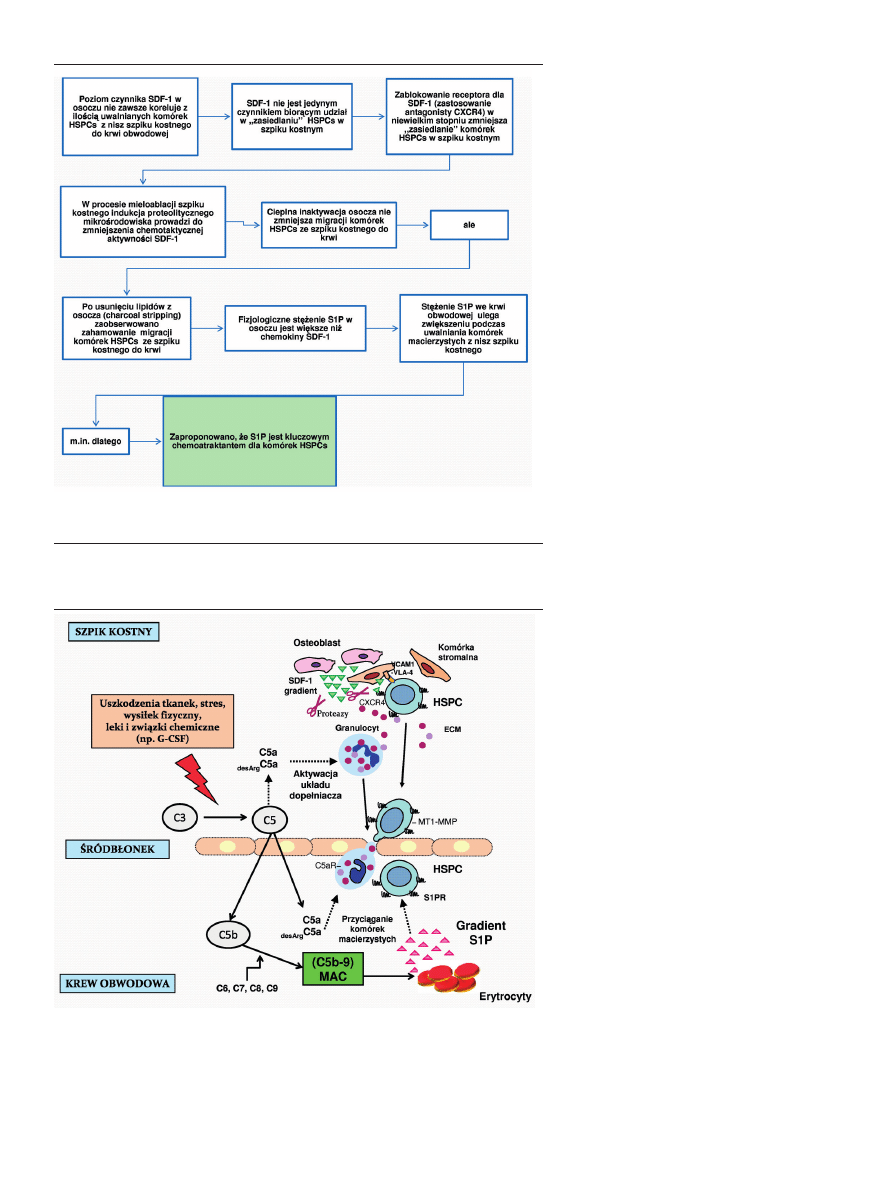
Migracja komórek macierzystych między
innymi może być indukowana przez stres,
wysiłek fizyczny, urazy, niedokrwienie, nie-
które leki i związki chemiczne [79]. Istotną
częścią zmian molekularnych towarzyszą-
cych przyciąganiu komórek macierzystych z
nisz szpiku kostnego do krwi jest aktywacja
układu dopełniacza (Ryc. 4). Uszkodzone
przez enzymy proteolityczne komórki pod-
ścieliska szpiku kostnego eksponują deter-
minantę antygenową (neoepitop), która jest
rozpoznawana przez tak zwane „naturalne”
przeciwciała klasy IgM krążące we krwi ob-
wodowej. Związanie IgM z neoepitopem
aktywuje dopełniacz na drodze klasycznej.
Może także dojść do aktywacji dopełniacza
drogą alternatywną zapoczątkowywaną
przez uwalniane proteazy [72,79]. Akty-
wacja układu komplementu i powstanie
anafilotoksyn C3a i C5a moduluje aktyw-
ność granulocytów. Po pierwsze, mogą one
zwiększać wydzielanie proteaz przez wy-
stępujące w szpiku granulocyty, co prowa-
dzi do enzymatycznej modyfikacji czynni-
ków warunkujących przyleganie HSPCs do
nisz szpikowych (zniesienia oddziaływań
SDF-1-CXCR4, VLA-4-VCAM-I). Po drugie,
fragmenty C5 wraz z interleukiną 8, NAP-2
(białkiem aktywującym neutrofile 2) mogą
Rycina 3. Uwalnianie komórek macierzystych z nisz szpiku kostnego do krwi obwodowej, założenia
nowej koncepcji (wg [15]).
Rycina 4. Proces uwalniania komórek macierzystych z nisz szpiku kostnego do krwi obwodowej z
udziałem sfingozyno-1-fosforanu. C3,C5,C5b — składowe układu dopełniacza; CXCR4 — receptor dla
chemokiny SDF-1; ECM — macierz pozakomórkowa; G-CSF — czynnik stymulujący tworzenie kolonii
granulocytów; HSPC — progenitorowa komórka macierzysta szpiku kostnego; MAC — kompleks ata-
kujący błonę; MT1-MMP — receptor 1 metaloproteinazy macierzy zewnątrzkomórkowej; SDF-1 — stro-
malny czynnik wzrostu 1; S1P — sfingozyno-1-fosforan; S1PR — receptory dla sfingozyno-1-fosforanu;
VCAM-1 — cząsteczka adhezji komórkowej naczyń typu 1, VLA-4 — ligand VCAM1.
288
www.postepybiochemii.pl
wspomagać migrację granulocytów z nisz szpiku kostnego
do krwi obwodowej. Granulocyty zwiększają przepuszczal-
ność bariery krew-szpik kostny, a tym samym torują drogę
dla komórek HSPCs. We krwi obwodowej aktywacja skła-
dowej układu dopełniacza C5 zapoczątkowuje powstanie
kompleksu atakującego błonę (C5b-9), który działając na
erytrocyty powoduje uwalnianie z nich S1P. S1P uwolnio-
ny z krwinek czerwonych działa przyciągająco na komórki
macierzyste dzięki obecności na ich powierzchni swoistych
receptorów [15,89].
Szpik kostny osoby dorosłej jest zasiedlany przez małe
populacje komórek macierzystych, które mogą być uwal-
niane do krwi i transportowane do uszkodzonych tkanek i
narządów. Są to progenitorowe komórki śródbłonka (EPC),
mezenchymalne komórki macierzyste (MSC), a także od-
kryte w ostatnich latach małe podobne do embrionalnych
komórki macierzyste (VSEL). To właśnie z komórkami
VSEL wiąże się największe nadzieje w medycynie regene-
racyjnej [90].
U zdrowych osób we krwi obwodowej i w tkankach moż-
na stwierdzić obecność bardzo niewielkiej liczby komórek
VSEL. W czasie ostrego niedokrwienia mięśnia sercowego
są one uwalniane z nisz szpiku kostnego do krwi obwodo-
wej. Podczas tego procesu we krwi obwodowej stwierdza się
zwiększone stężenia mRNA markerów komórek pluripo-
tencjalnych (wczesnych markerów komórek serca: GATA-
4, Nkx2.5/Csx oraz markerów komórek nerwowych: GFAP,
nestyny, beta-III-tubuliny, Olig1, Olig2, Sox2) [81,91]. Nie-
dokrwienie tkanek zapoczątkowuje proces migracji komó-
rek macierzystych ze szpiku kostnego (lub innych tkanek)
do uszkodzonych narządów. Dochodzi do hamowania od-
działywania SDF-1-CXCR4, zatrzymującej komórki macie-
rzyste w niszach szpiku kostnego. Brak chemotaktycznego
działania SDF-1 w szpiku kostnym powoduje migrację ko-
mórek macierzystych w kierunku wzrastającego stężenia
S1P we krwi obwodowej oraz w uszkodzonych tkankach
[91]. Pierwsze próby zastosowania komórek macierzystych
w terapii uszkodzeń narządowych zostały przeprowadzo-
ne na modelu mysim oraz u pacjentów po zawale mięśnia
sercowego. Wyniki tych doświadczeń, chociaż obiecujące,
wskazują na konieczność kontynuowania badań [4,92,93].
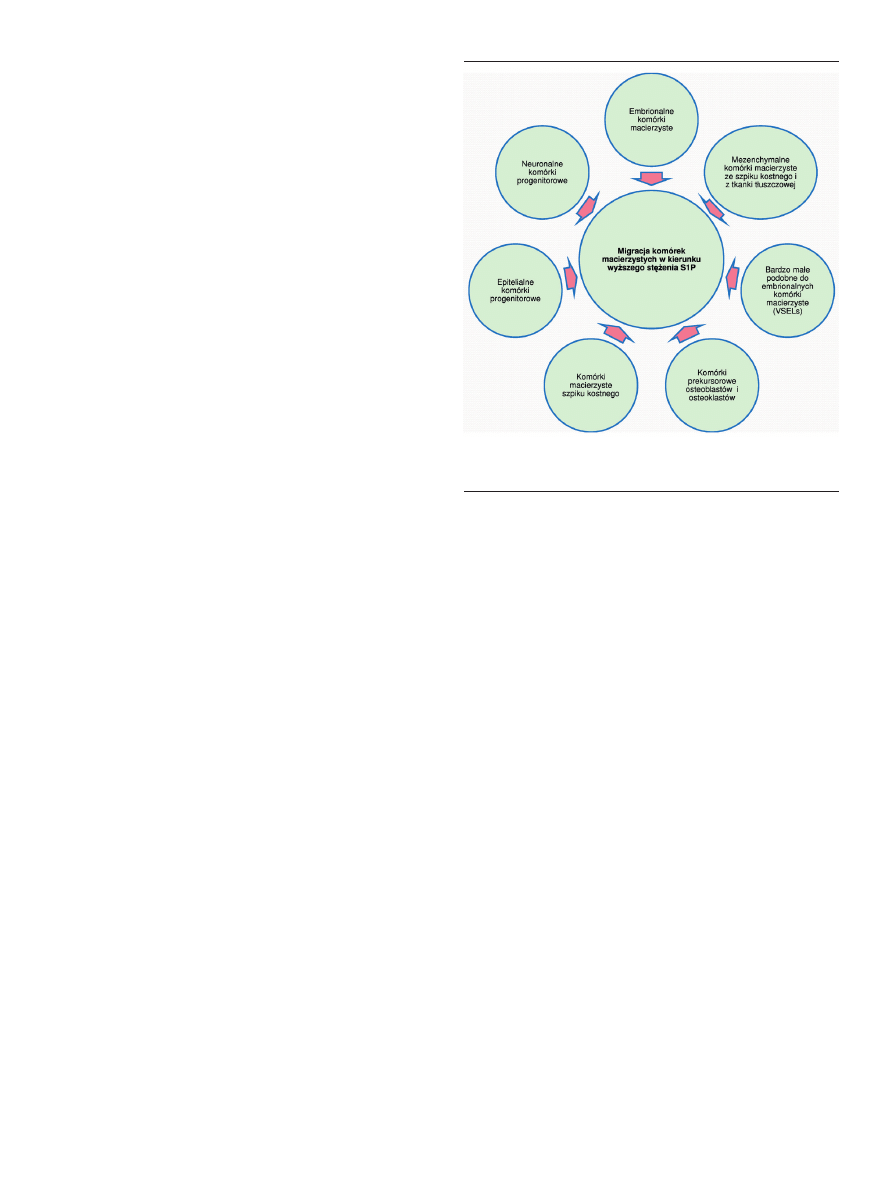
Sfingozyno-1-fosforan odgrywa bardzo ważną rolę w
fizjologii komórek macierzystych. W wielu ośrodkach pro-
wadzone są badania nad wpływem S1P na różne typy tych
komórek (Ryc. 5). Sfingozyno-1-fosforan stymuluje prolife-
rację mezenchymalnych komórek macierzystych ze szpiku
kostnego i z tkanki tłuszczowej z jednoczesnym zachowa-
niem ich multipotencjalności. Działanie S1P nie powoduje
w tym przypadku żadnych istotnych skutków ubocznych, a
komórki zachowują swoją morfologię, profil ekspresji mar-
kerów oraz kościotwórczy i tłuszczowy potencjał różnico-
wania [16].
Funkcja S1P jako chemoatraktanta została potwierdzo-
na w badaniach przeprowadzonych na embrionalnych
komórkach macierzystych [23], neuronalnych komórkach
progenitorowych [94] oraz mezangioblastach [95]. Podob-
ne wyniki uzyskano w przypadku komórek macierzystych
szpiku kostnego. Komórki te zasiedlały uszkodzoną wątro-
bę w odpowiedzi na gradient S1P [96]. W modelu mysim
wykazano, że progenitorowe komórki śródbłonka migrują
do uszkodzonych naczyń krwionośnych w odpowiedzi na
gradient S1P spowodowany nieszczelnością naczyń, płytka-
mi krwi oraz aktywacją układu krzepnięcia. W odpowiedzi
na gradient S1P neuronalne komórki progenitorowe (NPC)
są kierowane do miejsc uszkodzeń w mózgu. Sfingolipid
ten powoduje także migrację i różnicowanie prekursorów
osteoblastów [88].
PODSUMOWANIE
W okresie ostatnich kilku lat poczyniono wielkie postę-
py w poznaniu roli sfingolipidów jako cząsteczek biorących
udział w wielu istotnych procesach komórkowych. Obec-
nie wiadomo, że sfingozyno-1-fosforan jest cząsteczką o
właściwościach plejotropowych. Odgrywa istotną rolę w
procesach migracji, adhezji, różnicowania i przeżywalno-
ści wielu komórek. Z drugiej strony wpływa na patogenezę
wielu chorób m.in. autoimmunologicznych, układu serco-
wo-naczyniowego oraz nowotworów. W chwili obecnej naj-
większe nadzieje wiąże się z faktem, że S1P jest kluczowym
czynnikiem biorącym udział w migracji komórek macie-
rzystych ze szpiku kostnego i innych tkanek do uszkodzo-
nych narządów. Dalsze poznanie funkcji S1P pozwoli lepiej
zrozumieć mechanizmy regeneracji w organizmie, a tym
samym umożliwi w przyszłości opracowanie skutecznych
metod leczniczych mających zastosowanie w medycynie re-
generacyjnej.
PIŚMIENNICTWO
1. Fyrst H, Saba JD (2010) An update on sphingosine-1-phosphate and
other sphingolipid mediators. Nat Chem Biol 6: 489-497
2. Bandorowicz-Pikuła J, Pikuła S, Tylki-Szymańska A (2011) Patogeneza
lipidowych chorób spichrzeniowych. Postepy Biochem 57: 158-167
Rycina 5. Typy komórek macierzystych migrujące w kierunku wzrastającego stę-
żenia S1P (wg [88]).

Postępy Biochemii 58 (3) 2012
289
3. Kim RH, Takabe K, Milstien S, Spiegel S (2009) Export and functions of
sphingosine 1-phosphate. Biochim Biophys Acta 1791: 692-696
4. Zuba-Surma EK, Guo Y, Taher H, Sanganalmath SK, Hunt G, Vincent
RJ, Kucia M, Abdel-Latif A, Tang XL, Ratajczak MZ, Dawn B, Bolli R
(2011) Transplantation of expanded bone marrow-derived very small
embryonic-like stem cells (VSEL-SCs) improves left ventricular func-
tion and remodelling after myocardial infarction. J Cell Mol Med 15:
1319-1328
5. Lingwood D, Kaiser HJ, Levental I, Simons K (2009) Lipid rafts as func-
tional heterogeneity in cell membranes. Biochem Soc Trans 37: 955-960
6. Mullen TD, Hannun YA, Obeid LM (2012) Ceramide synthases at the
centre of sphingolipid metabolism and biology. Biochem J 441: 789-802
7. Olivera A, Rivera J (2005) Sphingolipids and the balancing of immune
cell function: lessons from the mast cell. J Immunol 174: 1153-1158
8. Tani M, Sano T, Ito M, Igarashi Y (2005) Mechanisms of sphingosine
and sphingosine 1-phosphate generation in human platelets. J Lipid
Res 46: 2458-2467
9. Jessup W (2008) Lipid metabolism: sources and stability of plasma
sphingosine-1-phosphate. Curr Opin Lipidol 19: 543-544
10. Pyne S, Pyne NJ (2002) Sphingosine 1-phosphate signalling and ter-
mination at lipid phosphate receptors. Biochim Biophys Acta 1582:
121-131
11. Yatomi Y (2008) Plasma sphingosine 1-phosphate metabolism and
analysis. Biochim Biophys Acta 1780: 606-611
12. Alvarez SE, Milstein S, Spiegel S (2007) Autocrine and paracrine roles
of sphingosine-1-phosphate. Trends Endocrinol Metab 18: 300-307
13. Hänel P, Andrèani P, Gräler MH (2007) Erythrocytes store and release
sphingosine 1-phosphate in blood. FASEB J 21: 1202-1209
14. Ito K, Anada Y, Tani M, Ikeda M, Sano T, Kihara A, Igarashi Y (2007)
Lack of sphingosine 1-phosphate-degrading enzymes in erythrocytes.
Biochem Biophys Res Commun 357: 212-217
15. Ratajczak MZ, Lee H, Wysoczynski M, Wan W, Marlicz W, Laughlin
MJ, Kucia M, Janowska-Wieczorek A, Ratajczak J (2010) Novel insight
into stem cell mobilization-plasma sphingosine-1-phosphate is a major
chemoattractant that directs the egress of hematopoietic stem progeni-
tor cells from the bone marrow and its level in peripheral blood incre-
ases during mobilization due to activation of complement cascade/
membrane attack complex. Leukemia 24: 976-985
16. He X, H’ng SC , Leong DT, Hutmacher DW, Melendez AJ (2010)
Sphingosine 1-Phosphate Mediates Proliferation Maintaining the Mul-
tipotency of Human Adult Bone Marrow and Adipose Tissue-derived.
Stem Cells 2: 199-208
17. Yatomi Y, Igarashi Y, Yang L, Hisano N, Asazuma N, Satoh K, Ozaki
Y, Kume S (1997) Sphingosine 1-phosphate, a bioactive sphingolipid
abundantly stored in platelets, is a normal constituent of human pla-
sma and serum. J Biochem 121: 969-973
18. Ohkawa R, Nakamura K, Okubo S, Hosogaya S, Ozaki Y, Tozuka M,
Osima N, Kokota H, Kieda H, Yatomi Y (2008) Plasma sphingosine-
-1-phosphate measurement in healthy subjects: close correlation with
red blood cell parameters. Ann Clin Biochem 45: 356-363
19. Yang L, Yatomi Y, Miura Y, Satoh K, Ozaki Y (1999) Metabolism and
functional effects of sphingolipids in blood cells. Br J Haematol 107:
282-93
20. Caligan TB, Peters K, Ou J, Wang E, Saba J, Merrill AH Jr (2000) A
high-performance liquid chromatographic method to measure sphin-
gosine 1-phosphate and related compounds from sphingosine kinase
assays and other biological samples. Anal Biochem 15: 36-44
21. Andréani P, Gräler MH (2006) Comparative quantification of sphingo-
lipids and analogs in biological samples by high-performance liquid
chromatography after chloroform extraction. Anal Biochem 15: 239-
246
22. Ruwisch L, Schafer-Korting M, Kleuser B (2001) An improved high-
-performance liquid chromatographic method for the determination
of sphingosine-1-phosphate in complex biological materials. Arch
Pharmacol 363: 358-363
23. Pèbay A, Wong RC, Piston SM, Wolvetang EJ, Peh GS, Filipczyk A,
Koh KL, Tellis I, Nguyen LT, Pera MF (2005) Essential roles of sphin-
gosine-1-phosphate and platelet-derived growth factor in the mainte-
nance of human embryonic stem cells. Stem Cells 23: 1541-1548
24. Pyne S, Pyne NJ (2000) Sphingosine 1-phosphate signalling in mam-
malian cells. Biochem J 349: 385-402
25. Maceyka M, Harikumar KB, Milstien S, Spiegel S (2012) Sphingosine-
-1-phosphate signaling and its role in disease. Trends Cell Biol 22: 50-
60
26. Pitson SM, Xia P, Leclercq TM, Moretti PA, Zebol JR, Lynn HE, Wat-
tenberg BW, Vadas MA (2005) Phosphorylation-dependent transloca-
tion of sphingosine kinase to the plasma membrane drives its oncoge-
nic signalling. J Exp Med 20: 49-54
27. Mitra P, Oskeritzian CA, Payne SG, Beaven MA, Milstien S, Spiegel S
(2006) Role of ABCC1 in export of sphingosine-1-phosphate from mast
cell. Proc Nat Acad Sci 103: 16394–16399
28. Liu H, Sugiura M, Nava VE, Edsall LC, Kono K, Poulton S, Milstien S,
Kohama T, Spiegel S (2000) Molecular cloning and functional charac-
terization of a novel mammalian sphingosine kinase type 2 isoforms. J
Biol Chem 275: 19513-19520
29. Shida D, Takabe K, Kapitanov D, Milstein S, Spiegel S (2008) Targeting
SphK1 as a new strategy against cancer. Curr Drug Targets 9: 662-673
30. Vogel P, Donoviel MS, Read R, Hansen GM, Hazlewood J, Ander-
son SJ, Sun W, Swaffield J, Oravecz T (2009) Incomplete inhibition of
sphingosine-1- phosphate lyase modulates immune system function
yet prevents early lethality and non-lymphoid lesions. PLoS One 4:
4112
31. Mechtcheriakova D, Wlachos A, Sobanov J, Kopp T, Reuschel R, Bor-
nancin F, Cai R, Zemann B, Urtz N, Stingl G, Zlabinger G, Woiset-
schläger M, Baumruker T, Billich A (2007) Sphingosine-1-phosphate
phosphatase 2 is induced during inflammatory responses. Cell Signal
19: 748-760
32. Pyne S, Pyne NJ (2011) Translational aspects of sphingosine-1-pho-
sphate biology. Trends Mol Med 17: 463-472
33. Taha TA, Argraves KM, Obeid LM (2004) Sphingosine-1-phosphate
receptors: receptor specificity versus functional redundancy. Biochim
Biophys Acta 1682: 48-55
34. Gil PR, Japtok L, Kleuser B (2010) Sphingosine 1-phosphate mediates
Chemotaxis of Human Primary Fibroblasts via the S1P-receptor subty-
pes S1P1 and S1P3 and Smad-signaling. Cytoskeleton 67: 773-783
35. Sanchez T, Hla T (2004) Structural and Functional Characteristics of
S1P Receptors. J Cell Biochem 92: 913-922
36. Spiegel S, English D, Milstein S (2002) Sphingosine 1-phosphate si-
gnaling: providing cells with a sense of direction. Trends Cell Biol 12:
236-242
37. Takabe K, Paugh SW, Milstien S, Spiegel S (2008) “Inside-out” signa-
ling of sphingosine-1-phosphate: therapeutic targets. Pharmacol Rev
60: 181-195
38. Gerthoffer WT (2007) Mechanisms of vascular smooth muscle cell mi-
gration. Circ Res 100: 607-621
39. Yester JW, Tizazu E, Harikumar KB, Kordula T (2011) Extracellular
and intracellular sphingosine-1-phosphate in cancer. Cancer Metasta-
sis Rev 30: 577-597
40. Sugimoto N, Takuwa N, Okamoto H, Sakurada S, Takuwa Y (2003)
Inhibitory and stimulatory regulation of Rac and cell motility by the
G12/13-Rho and Gi pathways integrated downstream of a single G
protein-coupled sphingosine 1-phosphate receptor isoform. Mol Cell
Biol 23: 1534-1545
41. Roelofsen T, Akkers R, Beumer W, Apotheker M, Steeghs I, van de
Ven J, Gelderblom C, Garritsen A, Dechering K (2008) Sphingosine-
-1-phosphate acts as a developmental stage specific inhibitor of pla-
telet-derived growth factor-induced chemotaxis of osteoblasts. J Cell
Biochem 105: 1128-1138
42. Nicol GD (2008) Nerve growth factor, sphingomyelins, and sensitiza-
tion in sensory neurons. Sheng Li Xue Bao 60: 603-604
43. Hsieh HL, Sun CC, Wu CB, Wu CY, Tung WH, Wang HH, Yang CM
(2008) Sphingosine 1-phosphate induces EGFR expression via Akt/
NF-kappaB and ERK/AP-1 pathways in rat vascular smooth muscle
cells. J Cell Biochem 103: 1732-1746

290
www.postepybiochemii.pl
44. Gellings Lowe N, Swaney JS, Moreno KM, Sabbadini RA (2009) Sphin-
gosine-1-phosphate and sphingosine kinase are critical for transfor-
ming growth factor-beta-stimulated collagen production by cardiac
fibroblasts. Cardiovasc Res 82: 303-312
45. Harvey KA, Welch Z, Sliva D, Siddiqui RA (2010) Role of Rho kinase
in sphingosine 1-phosphate-mediated endothelial and smooth muscle
cell migration and differentiation. Mol Cell Biochem 342: 7-19
46. Hait NC, Oskeritzian CA, Paugh SW, Milstien S, Spiegel S (2006)
Sphingosine kinases, sphingosine 1-phosphate, apoptosis and dise-
ases. Biochim Biophys Acta 1758: 2016-2026
47. Rapizzi E, Donati C, Cencetti F, Pinton P, Rizzuto R, Bruni P (2007)
Sphingosine 1-phosphate receptors modulate intracellular Ca
2+
home-
ostasis. Biochem Biophys Res Commun 353: 268-274
48. Strub GM, Maceyka M, Hait NC, Milstien S, Spiegel S (2010) Extracel-
lular and intracellular actions of sphingosine-1-phosphate. Adv Exp
Med Biol 688: 141-155
49. Huang YL, Huang WP, Lee H (2011) Roles of sphingosine 1-phosphate
on tumorigenesis. World J Biol Chem 2: 25-34
50. Cuvillier O, Levade T (2001) Sphingosine 1-phosphate antagonizes
apoptosis of human leukemia cells by inhibiting release of cytochrome
c and Smac/DIABLO from mitochondria. Blood 98: 2828-2836
51. Greenspon J, Li R, Xiao L, Rao JN, Marasa BS, Strauch ED, Wang JY,
Turner DJ (2009) Sphingosine-1-phosphate protects intestinal epithe-
lial cells from apoptosis through the Akt signaling pathway. Dig Dis
Sci 54: 499-510
52. Liu H, Toman RE, Goparaju SK, Maceyka M, Nava VE, Sankala H,
Payne SG, Bektas M, Ishii I, Chun J, Milstien S, Spiegel S (2003) Sphin-
gosine kinase type 2 is a putative BH3-only protein that induces apop-
tosis. J Biol Chem 278: 40330-40336
53. Rosen H, Goetzl EJ (2005) Sphingosine 1-phosphate and its receptors:
an autocrine and paracrine network. Nat Rev Immunol 5: 560-570
54. Schwab SR, Pereira JP, Matloubian M, Xu Y, Huang Y, Cyster JG (2005)
Lymphocyte sequestration through S1P lyase inhibition and disrup-
tion of S1P gradients. Science 309: 1735-1739
55. Gräler MH, Goetzl EJ (2004) The immunosupresant FTY720 downre-
gulates sphingosine 1-phosphate G-protein-coupled receptors. FASEB
J 18: 551-553
56. Leong WI, Saba JD (2010) S1P metabolism in cancer and other patholo-
gical conditions. Biochimie 92: 716-723
57. Hla T (2004) Physiological and pathological actions of sphingosine
1-phosphate. Sein cell Dev Biol 15: 513-520
58. Iwasaki T, Tsunemi S, Kitano S, Kanda C, Sekiguchi M, Kitano M, Sano
H (2011) Role of sphingosine-1-phosphate signaling for the pathogene-
sis of autoimmune diseases. Inflamm Regen 31: 175-183
59. Tedesco-Silva H, Mourad G, Kahan BD, Boira JG, Weimar W, Mulga-
onkar S, Madsen S, Charpentier B, Pellet P, Vanrenterghem Y (2005)
FTY720, a novel immunomodulator: efficacy and safety results from
the first phase 2A study in de novo renal transplantation. Transplan-
tation 79: 1553-1560
60. Brinkmann V (2004) FTY720: mechanism of action and potential bene-
fit in organ transplantation. Yonsei Med J 45: 991-997
61. Kappos L, Antel J, Comi G, Montalban X, O’Connor P, Polman CH,
Haas T, Korn AA, Karisson G, Radue EW (2006) Oral fingolimod
(FTY720) for relapsing multiple sclerosis. N Engl J Med 355: 1124-1140
62. Schuchardt M, Tölle M, Prüfer J, van der Giet M (2011) Pharmacologi-
cal relevance and potential of sphingosine-1-phosphate in the vascular
system. Br J Pharmacol 163: 1140-1162
63. Lucke S, Levkau B (2010) Endothelial functions of sphingosine-1-phos-
phate. Cell Physiol Biochem 26: 87-96
64. Igarashi J, Erwin PA, Dantas AP, Chen H, Michel T (2003) VEGF in-
duces S1P1receptors in endothelial cells: implications for cross-talk
between sphingolipid and growth factor receptors. Proc Natl Acad Sci
100: 10664-10669
65. Takuwa Y, Okamoto Y, Yoshioka K, Takuwa N (2008) Sphingosine-
1-phosphate signaling and biological activities in the cardiovascular
system. Biochim Biophys Acta 781: 483-488
66. Langlois S, Gingras D, Béliveau R (2004) Membrane type 1-matrix me-
talloproteinase (MT1-MMP) cooperates with sphingosine 1-phosphate
to induce endothelial cell migration and morphogenic differentiation.
Blood 103: 3020-3028
67. Keul HP, Levkau B, Zeiher AM, Dimmeler S, Aicher J, Urbich C, Spy-
ridopoulos I, Chun J, Brinkmann V, Walter DH, Rochwalsky U, Rein-
hold J, Seeger F (2007) Receptor by Activation of the CXCR 4-Depen-
dent Signaling Pathway via the S1P3. Arterioscler Thromb Vasc Biol
27: 275-282
68. Karliner JS (2004) Mechanisms of cardioprotection by lysophospholip-
ids. J Cell Biochem 92: 1095-1103
69. Means CK, Xiao CY, Li Z, Zhang T, Omens JH, Ishii I, Chun J, Brown
JH (2007) Sphingosine 1-phosphate S1P2 and S1P3 receptor-mediated
Akt activation protects against in vivo myocardial ischemia-reperfu-
sion injury. Am J Physiol Heart Circ Physiol 292: 2944-2951
70. Wojakowski W, Tendera M, Kucia M, Zuba-Surma E, Paczkowska
E, Ciosek J, Hałasa M, Król M, Kazmierski M, Buszman P, Ochała A,
Ratajczak J, Machaliński B, Ratajczak MZ (2009) Mobilization of bone
marrow-derived Oct-4+ SSEA-4+ very small embryonic-like stem cells
in patients with acute myocardial infarction. J Am Coll Cardiol 53: 1-9
71. Vadas M, Xia P, McCaughan G, Gamble J (2008) The role of sphingo-
sine kinase 1 in cancer: oncogene or non-oncogene addiction? Biochim
Biophys Acta 1781: 442-447
72. Słowik-Żyłka D, Poziomkowska-Gęsicka I, Mikołajek-Bedner W
(2009) Udział układu dopełniacza w regulacji krwiotworzenia. Post
Biol Kom 36: 279-294
73. Young N, Pearl DK, Van Brocklyn JR (2009) Sphingosine-1-phosphate
regulates glioblastoma cell invasiveness through the urokinase plas-
minogen activator system and CCN1/Cyr61. Mol Cancer Res 7: 23-32
74. LaMontagne K, Littlewood-Evans A, Schnell C, O’Reilly T, Wyder L,
Sanchez T, Probst B, Butler J, Wood A, Liau G, Billy E, Theuer A, Hla T,
Wood J (2006) Antagonism of sphingosine-1-phosphate receptors by
FTY720 inhibits angiogenesis and tumor vascularization. Cancer Res
66: 221-231
75. Cuvillier O (2008) Downregulating sphingosine kinase-1 for cancer
therapy. Expert Opin Ther Targets 12: 1009-1020
76. Paugh SW, Paugh BS, Rahmani M, Kapitonov D, Almenara JA, Kor-
dula T, Milstien S, Adams JK, Zipkin RE, Grant S, Spiegel S (2008) A
selective sphingosine kinase 1 inhibitor integrates multiple molecular
therapeutic targets in human leukemia. Blood 112: 1382-1391
77. Ratajczak MZ, Kim C, Wu W, Shin DM, Bryndza E, Kucia M, Ratajczak
J (2012) The role of innate immunity in trafficking of hematopoietic
stem cells-an emerging link between activation of complement cas-
cade and chemotactic gradients of bioactive sphingolipids. Adv Exp
Med Biol 946: 37-54
78. Machaliński B (2008) Nieembrionalne komórki macierzyste, a regene-
racja układu nerwowego. Pol Prz Neurol 4: 15-19
79. Ratajczak MZ, Kim C (2011) Bioactive Sphingolipids and Complement
Cascade as New Emerging Regulators of Stem Cell Mobilization and
Homing. J Stem Cell Res Ther 1: 102
80. Janowska-Wieczorek A, Marquez-Curtis LA, Shirvaikar N, Ratajczak
MZ (2012) The role of complement in the trafficking of hematopoietic
stem/progenitor cells. Transfusion, w druku
81. Wojakowski W, Kucia M, Zuba-Surma E, Jadczyk T, Książek B, Rata-
jczak MZ, Tendera M (2011) Very small embryonic-like stem cells in
cardiovascular repair. Pharmacol Ther 129: 21-28
82. Seitz G, Boehmler AM, Kanz L, Möhle R (2005) The role of sphingosine
1-phosphate receptors in the trafficking of hematopoietic progenitor
cells. Ann N Y Acad Sci 1044: 84-89
83. Marquez-Curtis LA, Turner AR, Sridharan S, Ratajczak MZ, Janow-
ska-Wieczorek A (2010) The ins and outs of hematopoietic stem cells:
studies to improve transplantation outcomes. Stem Cell Rev 7: 590-607
84. Ratajczak MZ, Kim CH, Abdel-Latif A, Schneider G, Kucia M, Morris
AJ, Laughlin MJ, Ratajczak J (2012) A novel perspective on stem cell
homing and mobilization: review on bioactive lipids as potent chemo-
attractants and cationic peptides as underappreciated modulators of
responsiveness to SDF-1 gradients. Leukemia 26: 63-72

Postępy Biochemii 58 (3) 2012
291
Sphingosine-1-phosphate — molecular maestro
Daria Sałata
1,2,*
, Marta Budkowska
1,2
, Barbara Dołęgowska
1,2
1
Department of Laboratory Diagnostics and Molecular Medicine and
2
Department of Physiology, Laboratory of Physiology and Biochemistry of
Stem Cells, Pomeranian Medical University, Szczecin, 72 Powstańców Wielkopolskich St., 70-111 Szczecin, Poland
*
e-mail: daria_salata@wp.pl
Key words: sphingosine-1-phosphate, metabolism of sphingosine-1-phosphate, sphingosine-1-phosphate in physiology, sphingosine-1-phosphate
in pathology, stem cell
ABSTRACT
Sphingosine-1-phosphate (S1P), which is a bioactive lipid from the family of sphingolipids is synthesized i.e. by platelates and stored in
erythrocytes. The effects of this compound on the cells are connected with the presence of specific receptors on their surface (S1P1-S1P5). S1P
acts upon, i.e, hematopoetic and nervous cells, having influencing their migration, adhesion, differentation and survival. This molecule plays
mediator role in inflammatory responses, angiogenesis and wound healing. In contrast to spingosine and ceramid, S1P counteracts apoptosis.
Recent studies have shown that S1P is a factor, which participates in the process of release stem cells from bone marrow to peripherial blood.
Cell and tissue damaged, stress, physical exercise and some drugs have influence on the numbers of stem cells. The research on S1P as the
main chemotactic factor for stem cells may have substantial impact on the development of regenerative medicine.
85. Massberg S, von Andrian UH (2009) Novel trafficking routes for he-
matopoietic stem and progenitor cells. Ann N Y Acad Sci 1176: 87-93
86. Golan K, Vagima Y, Ludin A, Itkin T, Cohen-Gur S, Kalinkovich A,
Kollet O, Kim C, Schajnovitz A, Ovadya Y, Lapid K, Shivtiel S, Morris
AJ, Ratajczak MZ, Lapidot T (2012) S1P promotes murine progenitor
cell egress and mobilization via S1P1-mediated ROS signaling and
SDF-1 release. Blood 119: 2478-2488
87. Juarez JG, Harun N, Thien M, Welschinger R, Baraz R, Pena AD, Pitson
SM, Rettig M, DiPersio JF, Bradstock KF, Bendall LJ (2012) Sphingosi-
ne-1-phosphate facilitates trafficking of hematopoietic stem cells and
their mobilization by CXCR4 antagonists in mice. Blood 119: 707-716
88. Liu J, Hsu A, Lee JF, Cramer DE, Lee MJ (2011) To stay or to leave:
Stem cells and progenitor cells navigating the S1P gradient. World J
Biol Chem 26: 1-13
89. Lee HM, Wu W, Wysoczynski M, Liu R, Zuba-Surma EK, Kucia M,
Ratajczak J, Ratajczak MZ (2009) Impaired mobilization of hematopo-
ietic stem/progenitor cells in C5-deficient mice supports the pivotal
involvement of innate immunity in this process and reveals novel pro-
mobilization effects of granulocytes. Leukemia 23: 2052-2062
90. Ratajczak MZ, Zuba-Surma EK, Ratajczak J, Wysoczynski M, Kucia M
(2008) Very Small Embryonic Like (VSEL) Stem Cells – Characteriza-
tion, Developmental Origin and Biological Significance. Exp Hematol
36: 742-751
91. Wojakowski W, Landmesser U, Bachowski R, Jadczyk T, Tendera M
(2012) Mobilization of stem and progenitor cells in cardiovascular di-
seases. Leukemia 26: 23-33
92. Dawn B, Tiwari S, Kucia MJ, Zuba-Surma EK, Guo Y, Sanganalmath
SK, Abdel-Latif A, Hunt G, Vincent RJ, Taher H, Reed NJ, Ratajczak
MZ, Bolli R (2008) Transplantation of bone marrow-derived very small
embryonic-like stem cells attenuates left ventricular dysfunction and
remodeling after myocardial infarction. Stem Cells 26: 1646-1655
93. Wojakowski W, Tendera M, Kucia M, Zuba-Surma E, Paczkowska
E, Ciosek J, Hałasa M, Król M, Kazmierski M, Buszman P, Ochała A,
Ratajczak J, Machaliński B, Ratajczak MZ (2009) Mobilization of bone
marrow-derived Oct-4+ SSEA-4+ very small embryonic-like stem cells
in patients with acute myocardial infarction. J Am Coll Cardiol 53: 1-9
94. Harada J, Foley M, Moskowitz MA, Waeber C (2004) Sphingosine-
-1-phosphate induces proliferation and morphological changes of
neural progenitor cells. J Neurochem 88: 1026-1039
95. Donati C, Cencetti F, Nincheri P, Bernacchioni C, Brunelli S, Clementi
E, Cossu G, Bruni P (2007) Sphingosine 1-phosphate mediates prolife-
ration and survival of mesoangioblasts. Stem Cells 25: 1713-1719
96. Li C, KongY, Wang H, Wang S, Yu H, Liu X, Yang L, Jiang X, Li L
(2009) Homing of bone marrow mesenchymal stem cells mediated
by sphingosine 1-phosphate contributes to liver fibrosis. J Hepatol 50:
1174-1183
Wyszukiwarka
Podobne podstrony:
281 Prawo przewozowe
291
291
MTB 291
281 318
291 296 groborz
281 VRTOPA456H3CERIEQZ4WFLIANW4XQPH7NNDZNCI
Mahabharata Księga V (Udyoga Parva) str 291 345
291 , Praca z osobami niepełnosprawnymi
281, Mariola Pająk
Hall, Lindzey Teorie osobowości str 291 320(1)
mechanizmy lewopolkulowe id 291 Nieznany
Dz U 2004 nr 281 poz 2784
java 281 29
280 281
kk, ART 291 KK, I KZP 8/08 - z dnia 30 czerwca 2008 r
kk, ART 291 KK, I KZP 8/08 - z dnia 30 czerwca 2008 r
Prawo w kontekście społecznym notatki 2013 KCZ 281 29
więcej podobnych podstron