
23. OGNIWA
1
1362. 1982/L
Siła elektromotoryczna ogniwa jest równa:
A. różnicy potencjałów panującej na biegunach ogniwa, gdy obwód jest zamknięty
B. różnicy potencjałów panującej na biegunach ogniwa, gdy obwód jest otwarty
C. różnicy spadków napięcia na oporze wewnętrznym i zewnętrznym
D. spadkowi napięcia na sumie oporów wewnętrznych
1363. 1975/L
SEM ogniwa galwanicznego jest:
A. zależna od rodzaju elektrolitu i od rodzaju metali stanowiących elektrody
B. tym większa, im większe jest natężenie prądu płynącego przez ogniwo
C. równa spadkowi potencjału na oporze wewnętrznym ogniwa
D. zależna od oporów: wewnętrznego i zewnętrznego
1364.
Poniższy wzór podający zależność pomiędzy potencjałem półogniwa a aktywnością formy
zredukowanej (a
red
) i utlenionej (a
utl
) układu redoks:
E = E
0
+ log
gdzie E
0
- potencjał normalny układu redoks, znany jest jako wzór:
A. Volty
B. Leclanche’go
C. Nernsta
D. Faraday’a
1365.
Wartość potencjału elektrody cynkowej w roztworze zanurzonej w roztworze jonów Zn
2+
o stężeniu
0.01 mol/dm
3
jest równa:
A. – 0.7 V
B. – 0.82 V
C. – 0.76 V
D. – 0.64 V
1366. 1996/F
Siła elektromotoryczna ogniwa zbudowanego z następujących półogniw: Zn
Zn
2+
(1 molowy
roztwór) i Au
Au
3+
(1 molowy roztwór) w temperaturze 25
o
C jest równa:
A. 0.66V
B. 2.18V
C. - 2.18V
D. - 0.66V
1367. 1988/L, 1981/L
Siła elektromotoryczna (SEM) ogniwa zbudowanego z elektrody żelaznej zanurzonej w roztworze
FeSO
4
o stężeniu 1 mol/dm
3
i elektrody ołowianej zanurzonej w roztworze Pb(NO
3
)
2
o stężeniu
1mol/dm
3
wynosi:
A. - 0.31V
B. - 0.44V
C. - 0.57V
D. +0.31V
1368.
Zbudowano ogniwo ołowiowo-kadmowe. Jakie jest stężenie jonów Cd
2+
jeśli stężenie jonów Pb
2+
jest równe 0.01M, a SEM ogniwa w temperaturze 25
o
wynosi 0.299V?
A. 0.1M
B. 0.01M
C. 1M
D. 0.001M
1
przy rozwiązywaniu zadań z tego rozdziału należy korzystać z tablicy potencjałów normalnych
(str. 238)
0.059
n
a
utl
a
red
Chemia. Wybór testów...
210
1369. 1992/L
Po zanurzeniu płytki cynkowej i miedzianej w wodnym roztworze kwasu siarkowego i połączeniu
ich przewodnikiem, w pracującym ogniwie zachodzą następujące reakcje:
Anoda: A(- )
Katoda: K(+)
A.
Zn
Zn
2+
+ 2e
2H
+
+ 2e
H
2
B.
Cu
Cu
2+
+ 2e Cu
2+
+ 2e
Cu
C.
Zn
Zn
2+
+ 2e
Zn
2+
+ SO
4
2-
ZnSO
4
D.
Cu
Cu
2+
+ 2e Cu
2+
+ SO
4
2-
CuSO
4
E.
Zn
Zn
2+
+ 2e
Zn
2+
+ 2e
Zn
1370. 1978/L
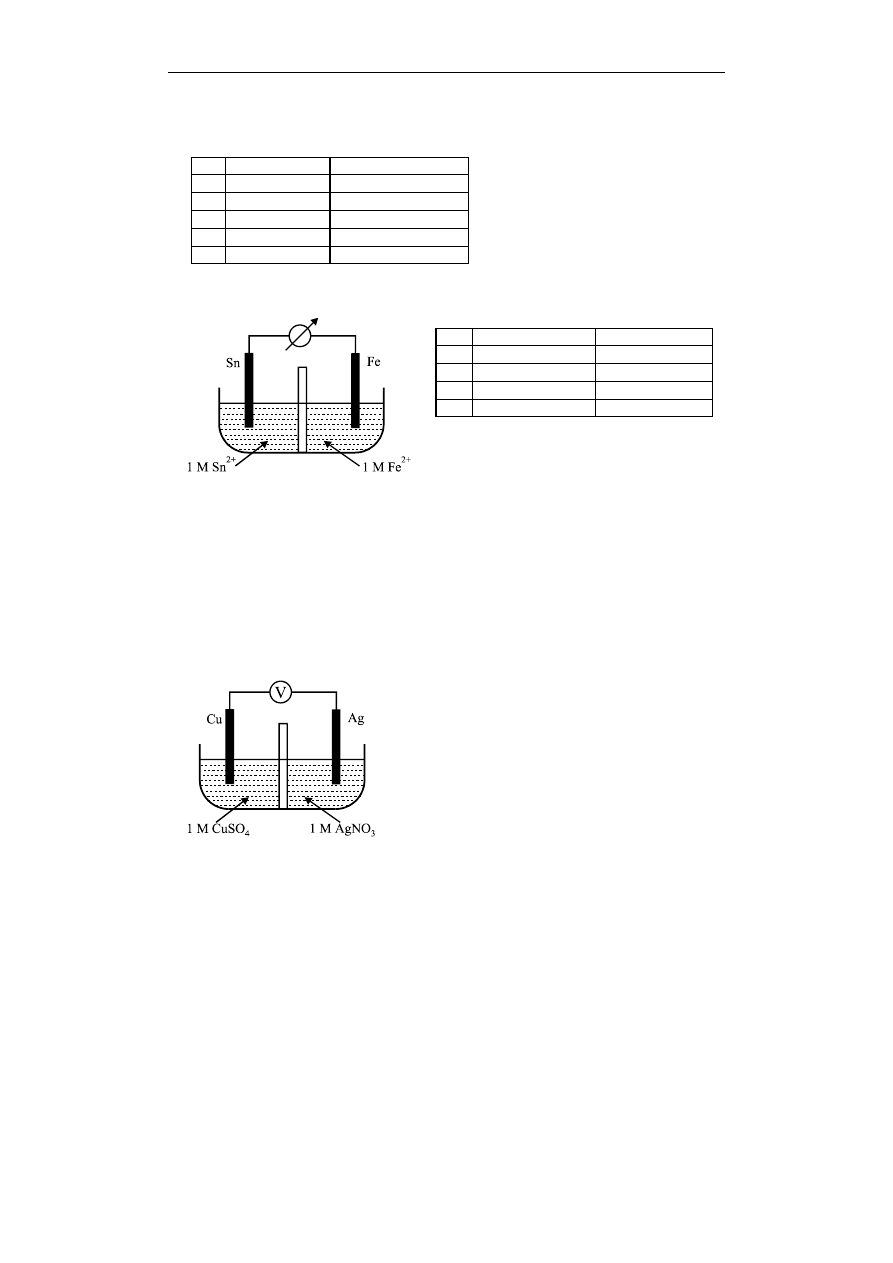
Podczas pracy ogniwa przedstawionego na rysunku, na elektrodach zachodzą procesy:
elektroda dodatnia
elektroda ujemna
A.
Fe
Fe
2+
+ 2e
Sn
2+
+ 2e
Sn
B.
Sn
2+
+ 2e
Sn
Fe
Fe
2+
+ 2e
C.
Fe
2+
+ 2e
Fe
Sn
Sn
2+
+ 2e
D.
Sn
Sn
2+
+ 2e
Fe
2+
+ 2e
Fe
1371. 2001/L
Wskaż procesy, które zachodzą podczas pracy ogniwa niklowo-srebrowego.
katoda
anoda
A. 2 Ag
+
+ 2 e
2 Ag
Ni
Ni
2+
+ 2 e
B. 2 Ag
2Ag
+
+ 2e
Ni
2+
+ 2 e
Ni
C. Ni
Ni
2+
+ 2 e
2 Ag
+
+ 2 e
2 Ag
D. Ni
2+
+ 2 e
Ni
2 Ag
2 Ag
+
+ 2 e
1372. 1975/L
W czasie pracy ogniwa przedstawionego na rysunku:
A. srebro ulega utlenieniu, gdyż stanowi biegun
dodatni (Ag
Ag
+
)
B. miedź ulega utlenieniu, gdyż jest biegunem
ujemnym (Cu
Cu
2+
)
C. następuje równoczesne rozładowanie się na
elektrodach jednakowych ilości jonów miedzi i srebra
D. następuje wydzielanie miedzi na elektrodzie
miedzianej i tlenu na elektrodzie srebrnej
1373. 1999/F
W ogniwie zapisanym następująco: Cd | Cd
2+
|| Ag
+
| Ag , przy podobnych stężeniach jonów obydwu
metali, poszczególnymi elektrodami są:
A. elektroda kadmowa jest katodą a srebrna anodą
B. elektroda kadmowa jest anodą a srebrna katodą
C. umiejscowienie katody i anody jest zależne od stężenia jonów
D. schemat ogniwa jest źle zapisany i nie można określić umiejscowienia katody i anody

Ogniwa
211
1374.
Jeśli w czasie pracy ogniwa składającego się z elektrody wodorowej zanurzonej w 0,1 dm
3
roztworu
HCl o pH = 2 i elektrody miedzianej zanurzonej w 0,1 dm
3
roztworu CuSO
4
o stężeniu 0,1 mol/dm
3
pH
roztworu obniżyło się o 1 jednostkę, to masa elektrody miedzianej:
A. wzrosła o 317 mg
B. wzrosła o 572 mg
C. wzrosła o 286 mg
D. zmalała o 317 mg
1375. 1974/L
W ogniwie, w którym elektrody miedziana i glinowa zanurzone były w roztworze swoich soli, po
pewnym czasie stwierdzono ubytek masy elektrody glinowej o 0.9g. W tym samym czasie masa
elektrody miedzianej:
A. zmniejszyła się o 0.9g
B. zwiększyła się o 0.9g
C. zwiększyła się o 2.13g
D. zwiększyła się o 3.2g
1376. 1995/L
Podczas pracy ogniwa magnezowo-srebrowego masa elektrody srebrnej zmieniła się o 21.6 mg.
W tym czasie masa elektrody magnezowej:
A. wzrosła o 2.4 mg
B. zmalała o 2.4 mg
C. wzrosła o 4.8 mg
D. zmalała o 4.8 mg
1377.
Podczas pracy ogniwa cynkowo-srebrowego masa elektrody srebrnej zmieniła się o 10.8 mg. W tym
czasie masa elektrody cynkowej:
A. wzrosła o 6.5 mg
B. zmalała o 6.5 mg
C. zmalała o 3.25 mg
D. wzrosła o 3.25 mg
1378.
W ogniwie miedziowo-cynkowym płytka cynkowa była umieszczona w 100 cm
3
0.1M roztworu
ZnSO
4
a płytka miedziowa w 100 cm
3
0.1M CuSO
4
. Ogniwo to włączono na pewien czas w obwód
prądu stałego. Po pewnym czasie obwód rozłączono a płytkę miedzianą wyjęto, przemyto, osuszono
i zważono stwierdzając przyrost jej masy o 0.128g. Ile wynosiło stężenie jonów cynkowych w roztworze
w półogniwie cynkowym po doświadczeniu (zakładając, że objętość roztworu nie uległa zmianie)?
A. 0.104M
B. 0.014M
C. 0.14M
D. 0.12M
1379. 1974/L
W ogniwie, w którym elektrody żelazna i miedziana są zanurzone w roztworach swoich soli,
przebiegają dwie reakcje:
1. Fe Fe
2+
+ 2e
2. Cu Cu
2+
+ 2e
Poniżej podano cztery zdania, które ułożone parami (I-II, III-IV) są nawzajem sprzeczne. Zatem
tylko jedno w każdej parze jest prawdziwe.
I. reakcja 1 przebiega w kierunku od strony prawej do lewej, a reakcja 2 w kierunku od strony
lewej do prawej
II. reakcja 1 przebiega w kierunku od strony lewej do prawej, a reakcja 2 w kierunku od strony
prawej do lewej
III. elektrony płyną w zewnętrznym przewodniku od żelaza do miedzi
IV. elektrony płyną w zewnętrznym przewodniku od miedzi do żelaza
Wybierz zdania prawdziwe:
A. I i III
B. I i IV
C. II i III
D. II i IV

Chemia. Wybór testów...
212
Poniżej podano szereg zdań, które ułożone parami (I-II, III-IV, V-VI, VII-VIII) są nawzajem
sprzeczne. Zatem tylko jedno może być prawdziwe. W zadaniach nr 1380 i 1381 masz wybrać zdania
prawdziwe.
I. elektrody o wyższym potencjale normalnym stanowią w ogniwach biegun dodatni względem
elektrod o niższym potencjale normalnym
II. elektrody o wyższym potencjale normalnym stanowią w ogniwach biegun ujemny względem
elektrod o niższym potencjale normalnym
III. na elektrodach dodatnich podczas pracy ogniwa zachodzi proces redukcji - na ujemnych proces
utlenienia
IV. na elektrodach dodatnich zachodzi proces utlenienia - na ujemnych proces redukcji
V. metale o ujemnych potencjałach normalnych mogą być wypierane z roztworów przez metale
o dodatnich potencjałach normalnych
VI. metale o ujemnych potencjałach normalnych mogą wypierać z roztworów wodór i metale
o dodatnich potencjałach normalnych
VII. metale o ujemnym potencjale normalnym są silniejszymi reduktorami niż wodór
VIII. metale o ujemnym potencjale normalnym są słabszymi od wodoru reduktorami
1380.
Za słuszne uważasz zdania:
A. I i III
B. I i IV
C. II i III
D. II i IV
1381.
Za słuszne uważasz zdania:
A. V i VII
B. V i VIII
C. VI i VII
D. VI i VIII
1382.
I. Półogniwa pierwszego rodzaju są odwracalne względem kationu.
II. Półogniwa drugiego rodzaju są odwracalne względem anionu.
III. Półogniwa pierwszego rodzaju składają się z metalu zanurzonego do roztworu elektrolitu
zawierającego kationy tego metalu.
IV. Półogniwa drugiego rodzaju składają się z metalu pokrytego trudno rozpuszczalną solą tego
metalu zanurzonego do roztworu elektrolitu zawierającego anion tej soli.
V. Półogniwa redox zbudowane są z metalu (nie dającego w tym roztworze własnej reakcji
elektrodowej) zanurzonego w roztworze zawierającym zarówno utlenioną jak i zredukowaną
postać układu redox.
Prawdziwymi są stwierdzenia:
A. I, II, V
B. I, II, III i IV
C. tylko V
D. tylko I i II
E. wszystkie
1383. 1992/L
Półogniwo Ag/AgCl/Cl
składa się z elektrody srebrnej pokrytej trudno rozpuszczalnym chlorkiem
srebra i elektrolitu, w którym obecne są jony Cl
. Zbudowano ogniwo, w którym wyżej wymieniona
elektroda Ag spełnia rolę anody. Na tej anodzie w czasie pracy ogniwa zachodzą procesy:
A. Ag - e
Ag
+
i na srebrze osadza się AgCl
B. Ag
+
+ e
Ag
C. Ag
+
+ e
Ag i część AgCl rozpuszcza się
D. 2Cl
Cl
2
+ 2e
E. 2Cl + 2e
2Cl
1384. 2002/L
Półogniwo niklowe zestawiono w ogniwo z półogniwami:
I. Cr
Cr
3+
II. Pb
Pb
2+
III. Cu
Cu
2+
W którym przypadku Ni
Ni
2+
będzie biegunem ujemnym:
A. I
B. II
C. I i II
D. II i III

Ogniwa
213
1385. 1999/L
Poniżej podane są schematy dwóch standardowych ogniw i odpowiadających im wartości SEM.
Pt
(s)
| Fe
3+
, Fe
2+
|| Cl
–
| Cl
2(g)
| Pt
(s)
SEM = 0,59 V
Pt
(s)
| Cr
3+
, Cr
2+
|| Cl
–
| Cl
2(g)
| Pt
(s)
SEM = 1,77 V
Na tej podstawie można powiedzieć, że w ogniwie utworzonym ze standardowych półogniw
Pt
(s)
| Fe
3+
, Fe
2+
oraz Pt
(s)
| Cr
3+
, Cr
2+
na elektrodach zajdą procesy:
anoda
katoda
A.
Cr
2+
Cr
3+
+ e
Fe
3+
+ e
Fe
2+
B.
Cr
3+
+ e
Cr
2+
Fe
2+
Fe
3+
+ e
C.
Fe
2+
Fe
3+
+ e
Cr
3+
+ e
Cr
2+
D.
Fe
3+
+ e
Fe
2+
Cr
2+
Cr
3+
+ e
1386. 1989/L
Dwie blachy żelazne zanurzono do dwóch naczyń zawierających jony Fe
2+
o różnym stężeniu:
w naczyniu pierwszym C
o
1
, a w drugim C
o
2
, przy czym C
o
1
> C
o
2
. Roztwory połączono kluczem
elektrolitycznym. Większy potencjał wykaże półogniwo w naczyniu:
A. pierwszym
B. drugim
C. w obu jednakowy
D. w obu zero
1387.
Siła elektromotoryczna ogniwa stężeniowego: Zn | Zn
2+
|| Zn
2+
| Zn
o
o stężeniach jonów Zn
2+
odpowiednio 0.01 mola/dm
3
i 0.1 mola/dm
3
wynosi:
A. 0.059V
B. 0.0295V
C. 0.118V
D. 0.59V
1388. 1988/F
Siła elektromotoryczna ogniwa stężeniowego: Ag
0
| Ag
+
|| Ag
+
| Ag
0
0.1 mol/dm
3
, 1 mol/dm
3
wynosi:
A. 0.059V
B. 0.118V
C. - 0.118V
D. 0.591V
1389. 1997/L
Równanie reakcji zachodzącej w ogniwie złożonym z półogniw: Zn/Zn
2+
i Ag/Ag
+
wygląda
następująco: Zn + 2Ag
+
Zn
2+
+ 2Ag.
Siła elektromotoryczna tego ogniwa wynosi:
A. 0.04V
B. 0.84V
C. 1.56V
D. 2.36V
1390. 1988/F
Zapas swobodnej entalpii (
G) układu reagującego w ogniwie Daniella przy stężeniach jonów
1 mol/dm
3
wynosi:
A. - 212.3 kJ
B. +96.5 kJ
C. - 106.5 kJ
D. +193.0 kJ
1391.
Jeśli przyłożymy z zewnątrz napięcie wyższe niż 1.1V, do ogniwa Daniella o stężeniu 1 mol/dm
3
względem jonów Zn
2+
i Cu
2+
, to:
A. w ogniwie nie zajdą żadne zmiany
B. nastąpi roztwarzanie miedzi i wydzielanie cynku
C. nastąpi roztwarzanie cynku i wydzielanie miedzi
D. zarówno cynk jak i miedź będą ulegały roztwarzaniu
1392. 1987/F
Wskaż, kiedy potencjał oksydoredukcyjny układu (E
h
) będzie równy normalnemu potencjałowi
układu (E
0
).
A. kiedy potencjał elektrody wodorowej będzie równy 1V
B. kiedy potencjał elektrody wodorowej będzie równy 0V
C. kiedy stosunek formy utlenionej do zredukowanej w elektrodzie wodorowej będzie równy 1
D. kiedy stosunek formy utlenionej do zredukowanej w badanym układzie będzie równy 1
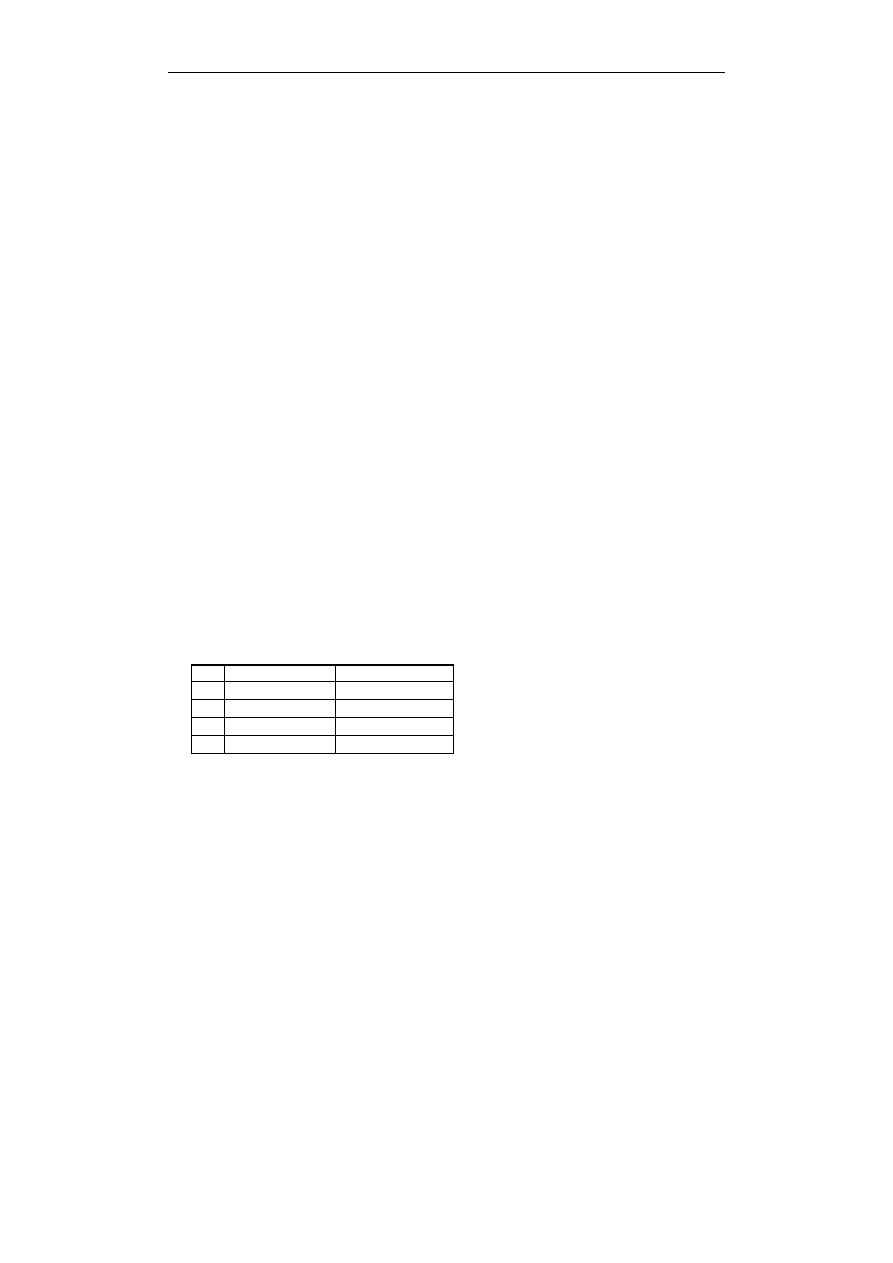
Chemia. Wybór testów...
214
1393. 1998/F
Półogniwo wodorowe w połączeniu z innymi półogniwami pracuje:
A. czasami jako półogniwo dodatnie, czasami jako ujemne, zależnie od rodzaju półogniwa
połączonego z nim
B. zawsze jako półogniwo ujemne (dostarczając elektronów)
C. zawsze jako półogniwo dodatnie
D. dodatnie lub ujemne, w zależności od sposobu zapisu połączenia półogniw w ogniwie.
1394.
W którą stronę będzie przebiegała reakcja w półogniwie:
I. Cr
2
O
7
2
+ 14 H
+
+ 6e
↔ 2 Cr
3+
+ 7 H
2
O
E
0
= 1,33 V
II. SO
4
2
+ H
2
O + 2e
↔ SO
3
2
+ 2OH
E
0
=
0,93 V
Po połączeniu ze standardową elektrodą wodorową?
A. I – w lewo, II – w prawo
B. I – w prawo, II – w lewo
C. I – w prawo, II – w prawo
D. I – w lewo, II – w lewo
1395. 1994/L
pH roztworu elektrody wodorowej jest równe 2. Potencjał elektrody wodorowej w podanych
warunkach wynosi:
A. 0V
B. + 2V
C. + 0.059V
D. - 0.118V E. - 0.059V
1396. 2001/F
W ogniwie pracującym, utworzonym ze standardowych półogniw, którego schemat podano
poniżej:
Mg | Mg
2+
|| Au
3+
| Au
zachodzą reakcje opisane równaniami:
anoda
katoda
A.
2Au°
2Au
3+
+ 6e
3Mg
2+
+ 6e
3Mg°.
B.
3Mg°
3Mg
2+
+ 6e
2Au°
2Au
3+
+ 6e .
C.
3Mg
2+
+ 6e
3Mg°
2Au°
2Au
3+
+ 6e .
D.
3Mg°
3Mg
2+
+ 6e
2Au
3+
+ 6e
2Au°.
1397. 1998/L
Z dwu półogniw Ag
Ag
+
i Mg
Mg
2+
, będących w stanie standardowym, zbudowano ogniwo.
Wskaż w tym ogniwie katodę (elektrodę, na której zachodzi proces redukcji) i podaj jego siłę
elektromotoryczną.
katoda
wartość SEM [V]
A.
Mg
Mg
2+
3.18
B.
Mg
Mg
2+
1.58
C.
Ag
Ag
+
3.18
D.
Ag
Ag
+
1.58
1398. 1997/F
Podczas pracy ogniwa glinowo-cynowego zachodzą następujące przemiany chemiczne:
katoda
anoda
A. 2Al
3+
+ 6e
–
2Al
0
3Sn
0
– 6e
–
3Sn
2+
B. 3Sn
2+
+ 6e
–
3Sn
0
2Al
0
– 6e
–
2Al
3+
C. 3Sn
0
– 6e
–
3Sn
2+
2Al
3+
– 6e
–
2Al
0
D. 2Al
0
– 6e
–
2Al
3+
3Sn
2+
+ 6e
–
3Sn
0
1399.
Przy pomocy ogniwa Daniella zasilano przez 1 godzinę urządzenie pobierające prąd o natężeniu
5 mA. Jak zmieniła się masa anody w tym ogniwie?
A. zmalała o 6,1 mg
B. zmalała o 12,1 mg
C. zmalała o 24,2 mg
D. wzrosła o 12,1 mg
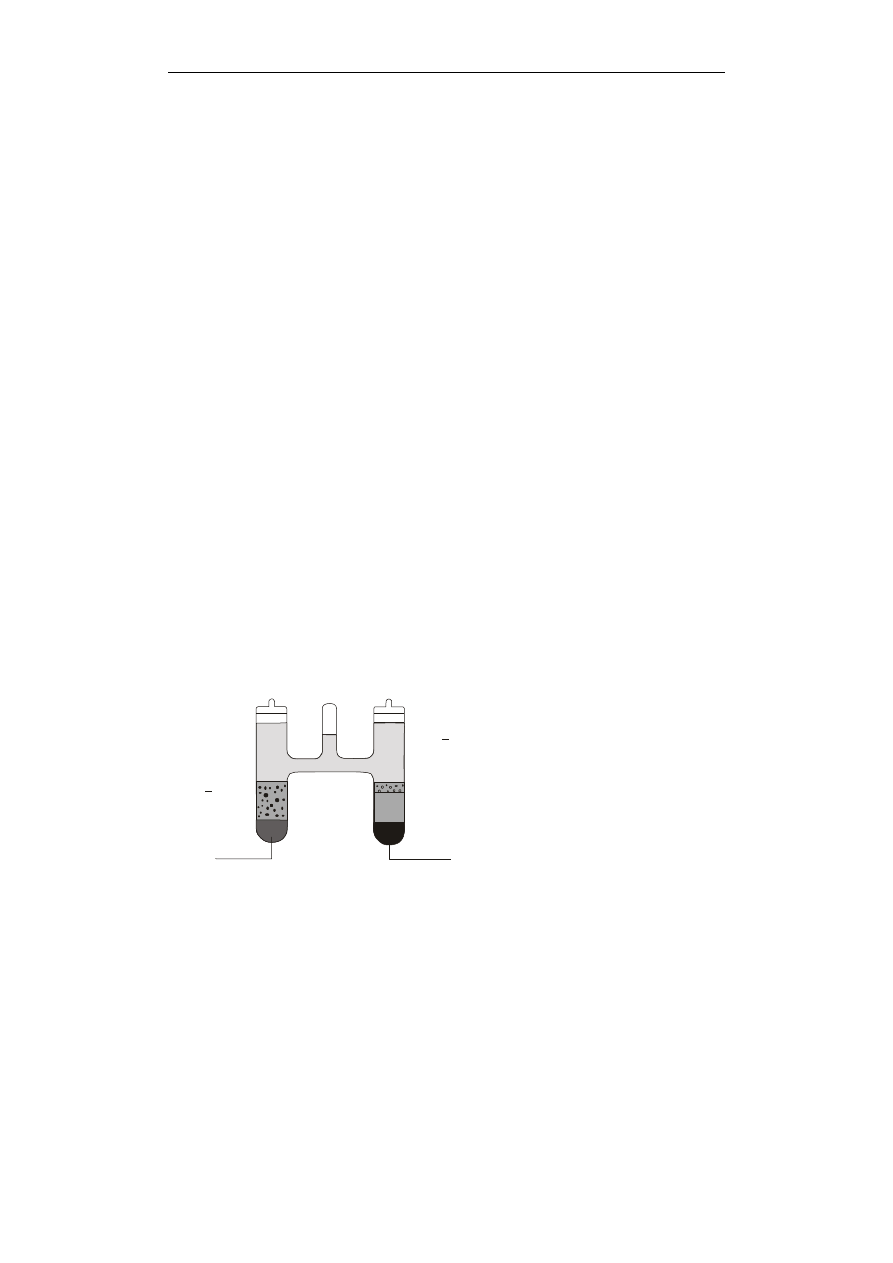
Ogniwa
215
1400.
Z ilu połączonych szeregowo ogniw Daniella powinna się co najmniej składać bateria, aby jej SEM
była nie mniejsza niż 15V?
A. 10
B. 14
C. 15
D. 18
1401.
Poszczególnym ogniwom I, II, III przyporządkuj ich właściwe nazwy X, Y, Z:
I. Zn
o
| Zn
2+
|| Cu
2+
| Cu
o
II. Zn | NH
4
Cl
aq
|| MnO
2
, C
III. Zn | H
2
SO
4
| Cu
X. ogniwo Volty
Y. ogniwo Leclanche’go
Z. ogniwo Daniella
Poprawne przyporządkowanie przedstawia odpowiedź:
A. I - X, II -Y, III - Z
B. I - X, II - Z, III - Y
C. I - Z, II - Y, III - X
D. I - Y, II - X, III - Z
1402.
Podczas pracy ogniwa Daniella masa elektrody cynkowej maleje z szybkością 3,25·10
mg na
sekundę. Natężenie prądu płynącego w obwodzie zewnętrznym wynosi w przybliżeniu:
A. 0,4 A
B. 0,2 A
C. 0,1 A
D. 0,5 A
1403.
Źródłem energii elektrycznej w ogniwie Leclanche’go jest następująca reakcja chemiczna:
A. Zn
2+
+ 2NH
3
[Zn(NH
3
)
2
]
2+
B. 2NH
4
+
+ 2e
2NH
3
+ H
2
C. 2MnO
2
+ H
2
Mn
2
O
3
+ H
2
O
D. Zn + 2NH
4
Cl + 2MnO
2
[Zn(NH
3
)
2
]Cl
2
+ Mn
2
O
3
+ H
2
O
1404.
I. Ogniwo Daniella jest ogniwem odwracalnym, a ogniwo Volty i Leclanche’go nieodwracalnym.
II. W ogniwach Volty i Leclanche’go procesy zachodzą zawsze niezależnie od tego czy obwód
elektryczny jest zamknięty czy otwarty.
III. W ogniwie Daniella przed zamknięciem obwodu nie zachodzi żadna reakcja chemiczna, ustala
się jedynie równowaga dynamiczna w półogniwach tworzących to ogniwo.
Prawdziwymi są zdania:
A. tylko II
B. I i III
C. I i II
D. I, II i III
1405.
Poniższy rysunek przedstawia schemat budowy ogniwa o potencjale łatwo odtwarzalnym i
powtarzalnym (stosowane jako ogniwo wzorcowe):
A. „mokrego” Leclanche’go
B. Westona
C. Edisona
D. Faraday’a
1406. 1999/F
Podczas rozładowywania akumulatora ołowiowego zachodzą następujące procesy:
A. na anodzie utlenia się ołów, na katodzie redukuje siarczan(VI) ołowiu(II) a stężenie kwasu
siarkowego w elektrolicie maleje
B. na katodzie redukuje się dwutlenek ołowiu, na anodzie utlenia się ołów a stężenie kwasu
siarkowego(VI) w elektrolicie maleje
CdSO H O (nas.)
4
2
8
3
.
CdSO H O (nas.)
4
2
8
3
.
CdSO roztwór nasycony
4
Hg + Hg SO (pasta)
2
4
Hg
+
_
kryszta³y
Hg + Cd (amalgamat)
Chemia. Wybór testów...
216
C. na katodzie redukuje się dwutlenek ołowiu, na anodzie utlenia się ołów a stężenie kwasu
siarkowego(VI) w elektrolicie rośnie
D. na katodzie redukuje się siarczan(VI) ołowiu(II), na anodzie utlenia się ołów a stężenie kwasu
siarkowego(VI) w elektrolicie rośnie
1407. 2000/F
Podczas rozładowywania akumulatora ołowiowego na elektrodzie ujemnej zachodzi reakcja:
A. PbSO
4
+ 2H
+
+ 2e
Pb + H
2
SO
4
.
B. Pb + SO
4
- 2e
PbSO
4
.
C. PbO
2
+ 4H
+
+ SO
4
+ 2e
PbSO
4
+ H
2
O.
D. PbSO
4
+ SO
4
+ 2H
2
O - 2e
PbO
2
+ 2H
2
SO
4
.
1408. 1982/L
Przez akumulator o sile elektromotorycznej E = 4V i oporze wewnętrznym R
w
= 0.5
w czasie
ładowania płynie prąd o natężeniu 2A. Różnica potencjałów na zaciskach tego akumulatora w tym czasie
wynosi:
A. 6V
B. 5V
C. 4V
D. 3V
1409.
W akumulatorze żelazo-niklowym (akumulatorze Edisona):
A. na elektrodzie ujemnej zachodzi reakcja:
Fe + 2OH
Fe(OH)
2
+ 2e
na elektrodzie dodatniej zachodzi reakcja:
2Ni(OH)
3
+2e 2Ni(OH)
2
+ 2OH
elektrolitem jest roztwór wodny KOH
B. na elektrodzie ujemnej zachodzi reakcja:
Fe + 2OH
Fe(OH)
2
+ 2e
na elektrodzie dodatniej zachodzi reakcja:
2Ni(OH)
3
+2e 2Ni(OH)
2
+ 2OH
elektrolitem jest roztwór wodny NH
4
OH
C. na elektrodzie ujemnej zachodzi reakcja:
2Ni(OH)
3
+ 2e
2Ni(OH)
2
+ 2OH
na elektrodzie dodatniej zachodzi reakcja:
Fe + 2OH
Fe(OH)
2
+ 2e
elektrolitem jest roztwór wodny KOH
D. na elektrodzie ujemnej zachodzi reakcja:
Ni + 2OH
Ni(OH)
2
+ 2e
na elektrodzie dodatniej zachodzi reakcja:
2Fe(OH)
3
+ 2e
Fe(OH)
2
+ 2OH
elektrolitem jest roztwór wodny KOH
1410. 1988/L
W ogniwach paliwowych stosuje się m.in. elektrochemiczne spalanie wodoru. Do elektrod
niklowych w roztworze KOH doprowadza się tlen i wodór w wyniku czego powstaje ogniwo tlenowo-
wodorowe. Zachodzą tam procesy:
elektroda dodatnia
elektroda ujemna
A. H
2
2H
+
+ 2e
1/2 O
2
+ H
2
O + 2e
2OH
B. H
2
+ OH
H
3
O
+
+ 2e
O
2
+ 2H
+
+ 2e
2OH
C. 1/2 O
2
+ H
2
O + 2e
2OH
H
2
+ 2e
2H
+
D. 1/2 O
2
+ H
2
O + 2e
2OH
H
2
+ 2OH
2H
2
O + 2e
Wyszukiwarka
Podobne podstrony:
mde ogniwa id 290226 Nieznany
mde ogniwa id 290226 Nieznany
ogniwa krzewienia id 333806 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron