
www.lek2002.prv.pl | lek2002.xoopiter.com
StudenciStudentom
MIKROBIOLOGIA
Materiały pomocne w zdaniu
tego wspaniałego ustnego egzaminu
1. część = Wykłady
2. część = przedruk Artykułów
© by C’Hemina i Pe$eT, 2003 r.
pobieżna korekta by Chirek, 2004 r.
Źródło 1: słowo mówione na wykładach w latach 2003 i 2004
(jak się zresztą okazało – niezmienne…)
Źródło 2: krążące wśród braci studenckiej kopie-kopii-kopii-kopii-
kopii…
„artykułów” Profa (jakości i czytelności mizernej – stąd
zdecydowaliśmy się na ich przedruk)
www.lek2002.prv.pl | lek2002.xoopiter.com
www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 1
„Aby coś wyjaśnić trzeba opowiedzieć historię...” - E. Mayr
–
wstęp – pierdy o regulaminie
–
Panu pomaga potrząsanie mikrofonem w przód i w tył i stwierdzenie: „Proszę Was” często
powtarzane...
–
1/3 ludzi na świecie umiera na choroby wywołane przez drobnoustroje (17 mln ludzi
rocznie)
–
„mikrobiologia” – źródłosłów: mikros – mały, bios – życie, logos – nauka
–
jest to nauka o mikroskopijnych organizmach niewidocznych „gołym” okiem
(pierwotniakach, glonach, grzybach, wirusach, wiroidach, prionach).
Ewolucja bakterii
• bakterie (beztlenowe) pojawiły się na Ziemi ok. 3,8 mld lat temu. Proces eukariotyczny
rozpoczął się ok. 3 mln lat temu, formy eukariotyczne – 2 mln temu, odtąd też istnieją
na Ziemi wirusy.
• Od ok. 5 mln lat bakterie i wirusy inicjują stale mechanizmy odpornościowe, te z kolei
wywołują w mikroorganizmach nowe strategie wirulencji.
Definicje podstawowe
• Drobnoustrój posiadający aktywność chorobotwórczą nazywamy patogenem. Aktywność
chorobotwórcza jest zależna od wirulencji.
Podział organizmów żywych obowiązujący na mikrobiologii:
• bakterie, które tworzą królestwo Bacteria w nadkrólestwie Prokaryota
• grzyby, glony, pierwotniaki które tworzą królestwo Eukaryota
• wirusy, które tworzą królestwo Virales
• wiroidy (Viroides)
• i… priony – czynniki subwirusowe (niekonwencjonalne czynniki chorobotwócze,
samopowiela-jące się zakaźne białka)
Wielkość bakterii i wirusów, historia mikrobiologii
• Ludzkie „nieuzbrojone” oko jest w stanie rozróżnić szczegóły o średnicy do 0,1 mm [na
ekranie z rzutnika „reminiscencja do wakacji” – powiększone ziarenka piasku]. Bakterie są
1000-krotnie mniejsze od ziarenka piasku, posiadają rozmiary rzędu 1-10 mikrometrów
(μm), średnio 1-2 μm, można je obserwować w mikroskopie optycznym pod
powiększeniem 1000 ×
• wirusy są mniejsze, mają 20-100(200) nanometrów (nm) i obserwuje się je jedynie w
mikroskopie elektronowym
• Leeuwenhoek [czyt. lewenhuk – pisownia że tak powiem HGW] – samouk, który zbudował
500 mikroskopów (dających 200-300-krotne powiększenia) i on opublikował pierwsze
rysunki bakterii, jest więc tym, który odkrył bakterie i jest zwany ojcem bakteriologii, ale
dla nas nim nie jest, bo „on patrzył na bakterie jak Guliwer” [niezły tekst, co?], nie umiał
połączyć danych bakterii ze zmianami chorobowymi, on nie zauważył związku między tymi
żyjątkami a patologią człowieka, jedynie umiał je ładnie rysować…
• Remak (bodajże Robert) w 1837 r. opisał drobnoustrój chorobotwórczy Trichophyton
shoenleinii (grzyb wywołujący zakażenie skóry i jej przydatków)
• W 1796 r. Edward Jenner (1749-1823) – lekarz wiejski z Anglii zaobserwował, że mleczarki
[wg Wykładowcy „dójki” vel „dojarki”] bydła nie zarażają się ospą prawdziwą, zarażają się
jednak ospą krowią – tzw. krowianką, która nie jest dla człowieka groźna i objawia się tylko
krostami na dłoniach.
On to 14 V 1796 r. zaprasza do siebie ojca z jedynakiem (James’em, 12-latkiem) oraz
„dójkę” Sarę, której pobiera materiał z takiej krosty i wstrzykuje go chłopcu, który nie
chorował w czasie epidemii ospy. Następnie Jenner na własne ryzyko wstrzyknął chłopcu
materiał zakaźny ospy prawdziwej, a ten przeżył. Pasteur na cześć tych doświadczeń
Jennera wprowadza nazwę wakcynacja [ang. vaccination – szczepienie] od łac. vacca –
krowa. „Edward Janner za 8 pensów na własny koszt opublikował rozprawę o szczepieniach
jako możliwości ochrony przed chorobami (1798 r.)”. [Tak, tak… wiemy, jakie to bardzo
ważne, ale Pan mówi – sługa pisze…]. Początkowo wszyscy go olewali… ale już w 1800 r.
wykonywano obowiązkowe szczepienia przeciw ospie prawdziwej w marynarce brytyjskiej.
Mimo tych zasług Jennera nie przyjęto do Brytyjskiej Akademii Nauk, bo nie znał łaciny… W
1801 r. szczepionka trafiła do Warszawy, później do Poznania… Dzięki tej prostej
szczepionce pozbyliśmy się ospy, ostatnie zachorowanie na ospę prawdziwą odnotowano w
www.lek2002.prv.pl | lek2002.xoopiter.com
2

www.lek2002.prv.pl | lek2002.xoopiter.com
Somalii w 1977 r., więc w 1980 r. zaniechano szczepień, ale teraz się do tego wraca, bo
wirus ospy mutuje i jest wciągnięty na listę broni biologicznej [„jest więc sposób na
sprawdzenie wieku dziewczyny, gdy ma bliznę po szczepieniu na ospę, to urodziła się przed
’80”]. W laboratoriach w Atlancie i w Moskwie przechowywane są wirusy patogenne dla
człowieka, tam też jest przechowywany wirus ospy prawdziwej.
• 1847 r. – I. Zemmenrweiss (lekarz z Wiednia) wprowadza mycie rąk przed każdym
badaniem ginekologicznym
• Louis (Ludwik) Pasteur (1822-1895) – nie był lekarzem, a prof. chemii, Francuz; w 1864 r.
obala panującą na Sorbonie teorię samorództwa – „życie powstaje z brudu”; w 1885 r.
przeprowadza skuteczne szczepienie przeciw wściekliźnie – leczy Josepha Meissner’a
sproszkowanym rdzeniem kręgowym od zakażonych królików. Ponadto wprowadza pojęcie
wirus i pojęcie wakcynacja [poza tym Pasteur „lubił kolby z łabędzią szyją...”]
• Robert Koch (1843-1910) – lekarz z Niemiec, w 1876 r. odkrył laseczkę wąglika, choroba
występuje głównie u bydła, skąd może się przenosić na człowieka [nazwa wąglik pochodzi
stąd, że krew padłych na tę chorobę zwierząt ma kolor węgla brunatnego]. W 1882 r.
odkrywa prątki gruźlicy – Mycobacterium tuberculosis, w 1884 r. przecinkowca cholery
[przy niskim pH żołądka przecinkowiec ginie, stąd przytaczana na wykładzie „pokazowa
próba” wywołania cholery poprzez wypicie wody skażonej przez Vibrio cholerae nie
zakończyła się zachorowaniem…]. W 1905 r. otrzymuje Nobla za prątki gruźlicy [z
ciekawszych rzeczy o nim z wykładu, to potem ponoć „załamał się nerwowo”, rozwiódł z
żoną i… poślubił 17-latkę!]
• Obaj w/w badacze zauważyli powiązanie między drobnoustrojami a chorobami, czyli
możemy ich uznać za „ojców mikrobiologii”.
Postulaty Kocha [1884 r.]: (podręcznik Virella – str.4 podaje to ździebko inaczej…)
Warunkiem uznania drobnoustroju za czynnik zakaźny jest:
1. jego występowanie we wszystkich przypadkach danej choroby, wg tej zasady określoną
chorobę wywołuje określony czynnik etiologiczny (określony drobnoustrój)
2. wyizolowany z tkanek zmienionych chorobowo drobnoustrój winien być uzyskany in vitro w
postaci czystej hodowli
3. Możliwość spowodowania u zwierzaka tej samej choroby (z tymi samymi objawami), czy tej
samej patologii, jaka występowała w organizmie człowieka, w sytuacji, gdy ów
wyhodowany szczep podamy wrażliwemu/podatnemu zwierzęciu
4. Musi istnieć możliwość ponownego wyizolowania (od zwierzaka) i wyhodowania tego
drobnoustroju in vitro w postaci czystej i on winien być identyczny z tym wyizolowanym
wcześniej od człowieka
Koch się posunął dalej i twierdził, że „1 bakteria=1 choroba=1 lek”, wiemy dziś, że to bzdura…
Obecnie znamy ok. 15-20 tys. gatunków bakterii, z czego patogennych jest ok. 200-500
gatunków
Dzieje najnowsze
1977 r. - wirus Ebola wyizolowany w Zairze, Sudanie wywołujący gorączkę krwotoczną
1983 r. - wirus HIV (przeniesiony z małpy zielonej w wyniku „różnych” doświadczeń)
1989 r. - wirus C wątroby (HCV)
1986 r. - wirus Herpes
1993 r. - SNV (bezimienny)
1994 r. - wirus SBV
1997 r. - nagroda Nobla za badania nad prionami (Stanley B. Prusiner, on też nadał nazwę
„priony”)
2002 r. - słynna epidemia SARS
www.lek2002.prv.pl | lek2002.xoopiter.com
3

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 2 - Ogólna budowa bakterii
© by Jan Kobuszewski
Królestwo bakterii to 936 rodzajów, w których wyróżniamy 15-20 tys. gatunków bakterii, z
tego 300-500 jest potencjalnie chorobotwórcze.
Komórkę bakteryjną – a więc komórkę Prokaryota cechuje miniaturyzacja i uproszczenie
budowy. Masa suchej komórki bakteryjnej to 0,25 pg – a więc 10 tys. razy mniej niż komórki
Eukaryota.
Morfologicznie wyróżnia się 3 podstawowe kształty bakterii:
1. okrągły/elipsoidalny – ziarniaki
2. cylindryczny – pałeczka, laseczka
3. spiralny – przecinkowce, śrubowce, krętki
Bakterie są związane ze swoim lokalnym środowiskiem. Nawet jeśli posiadają one aparat
ruchu, to przemieszczają się na niewielkie odległości.
Kształt bakterii zoptymalizowany jest pod kątem stosunku powierzchni do objętości. Dla
komórki bakteryjnej najkorzystniej jest, gdy ma ona możliwie dużą powierzchnię przy danej
objętości. Dla większości komórek Eukaryota stosunek ten jest mniejszy od jedności – a więc
p/v<1 [p – powierzchnia, v – objętość], natomiast w wypadku bakterii zawsze p/v>1. Taki
stosunek wynika z faktu, że bakteria odżywia się, oddycha i mnoży z udziałem błony – tak więc
by spełniła ona wszystkie te funkcje musi posiadać dużą powierzchnię. Im wyższy więc
stosunek p/v, tym lepsze przystosowanie bakterii.
Dla poszczególnych form morfologicznych bakterii stosunek ten przedstawia się inaczej:
1. Ziarniaki /coccus/ – p/v = od 5 do 6 (średnio ok. 5,8); średnica ich wynosi od 0,75 do 2
μm. Mogą one tworzyć kolonie różnych rodzajów:
• Dwoinki /gonococcus/ – dwa ziarniaki obok siebie
• Gronkowce /staphylococcus/ – ziarniaki układają się w grona
• Paciorkowce /streptococcus/ – układają się w sznur korali
2. Formy cylindryczne – p/v = ok. 10; długość wynosi 0,4-8 μm; wyróżniamy tu dwa typy
budowy:
a. pałeczka – stosunek długość:przekrój (szerokość) = 2:1, ale są też z mniejszym
stosunkiem – np. Haemphilus influenzae (jest tzw. ziarniakopałeczką, bo jest
bardzo krótka)
b. laseczka – długość:przekrój = 3:1 ... 5:1
Pałeczki nie tworzą form przetrwanych (z 1 wyjątkiem), większość laseczek tworzy
przetrwalniki (endospory), z reguły położone centalnie. Pałeczki posiadają aparat ruchu
3. Formy spiralne – p/v to ok. od 16 do 20 ⇒ są to formy najlepiej zaadoptowane do
warunków zewn. Ich wielkość waha się w granicach 1-15 μm (zwykle 8-10 μm).
Wyróżnia się tu następujące formy morfologiczne:
a. przecinkowce /vibrio/ – przypominają przecinek
b. śrubowce /spirillum/ – przypominają literę S (na ogół nie są chorobotwórcze)
c. krętki /spirochette/ – dług. 5-15 μm, przypominają sprężynę, ich ściana jest
giętka, słabo się barwią, są Gram–. W wypadku krętka kiły [EGZAMIN] – skok
„spirali” wynosi 1 mikrometr (1 μm) – więc po ilości zwojów można oszacować
wielkość bakterii.
Generalnie krętki posiadają regularną, stałą ilość tępo zakończonych zwojów, np.
krętek blady posiada ich 10, położonych w równych odstępach. No ale zawsze są
wyjątki… Leptospira interrogans będącym pasożytem m.in. szczurów wodnych
posiada nieregularną liczbę zwojów. Powoduje on u ludzi chorobę Weila (żółtaczkę
krętkową). Prowadzi ona do zaburzeń czynności nerek i wątroby, krwotoków
wewnętrznych, zapalenia opon mózgowych, wstrząsu. Na całe szczęście już nie
przenosi się między ludźmi. Ale dużo pacjentów z krętkowicą umiera.
Budowa ogólna komórki bakteryjnej
Należy pamiętać, że komórka bakteryjna nie posiada szeregu organelli, które posiada komórka
eukariotyczna – np. mitochondriów, jądra komórkowego, siateczki śródplazmatycznej,
lizosomów, aparatu Golgiego.
Aparat ruchu
• niektóre bakterie posiadają rzęski
• rzęski zbudowane z białka flageliny, która jest antygenem (antygen H)
wykorzystywanym w diagnostyce serologicznej
www.lek2002.prv.pl | lek2002.xoopiter.com
4
www.lek2002.prv.pl | lek2002.xoopiter.com
• rzęski mają średnicę od 12-20 nm
• są one umocowane na haczykowatym ciałku podstawnym zlokalizowanym w błonie
komórkowej
• wykonują ruchy obrotowe z prędkością 10-80 μm/sek. („jak śmigło w samolocie”)
• bakterie wykonując ruch obrotowy rzęskami w kierunku przeciwnym do wskazówek
zegara poruszają się w przód, natomiast obracając się zgodnie z wskazówkami zegara
doprowadzają do „przekoziołkowania” bakterii umożliwiając ruch do tyłu i zmianę
kierunku ruchu
• ze względu na ilość i położenie rzęsek wyróżnia się:
a. bakterie monotrychalne = jednorzęse, np. przecinkowiec chordus
b. bakterie lofotrychalne = czuborzęse – kilka rzęsek wychodzi z jednego miejsca np.
Pseudosomonas, Helicobacter
c. bakterie perytrychalne = (w)okołorzęse – posiadają rzęski na całej powierzchni np.
Proteus
Uwaga: U bakterii można też zaobserwować tzw. ruchy Browna (czyt. Brauna), które nie są
związane z aparatem ruchu tylko z ruchami otaczającego je środowiska np. molekuł wody.
Fimbrie (czyli tzw. pilusy, od łac. pili – fimbrie)
• są to białkowe nici pokrywające powierzchnię Gram–
• są ok. 5 × krótsze od rzęsek, ich średnica – 0,5-12 nm, długość 0,5-1 mikrometra
• dzielimy je na zwykłe (pospolite) i płciowe (tzw. F)
• pierwsze odgrywają rolę w przyleganiu bakterii do powierzchni błon śluzowych, drugie
biorą udział w koniugacji (czyli „akcie seksualnym bakterii”)
• mówiąc „pilus” mamy na myśli z reguły fimbrię płciową
Nukleoid
• jest to chromosom bakteryjny
• zajmuje ok. ½ objętości komórki
• jest nieobłoniony i występuje w ilości 1 szt./bakterię (stąd nazwa „monochromosom”) ⇒
bakterie są 1n (wyjątek: 2 „chromosomy” bakteryjne występują u Brucella melitensis i
Vibrio cholerae)
• całkowita długość bakteryjnego DNA przewyższa 1000-krotnie rozmiary bakterii
sięgając długości 1 mm, natomiast po upakowaniu długość nuklidu w komórce sięga
100-200 nm
• DNA zawarty w nuklidzie określa się jako ccc-dsDNA – czyli Circular Covalently Closed
Double Stranded DNA – a więc kolisty, kowalencyjnie zamknięty dwuniciowy DNA
• upakowanie DNA w komórce odbywa się na następujących poziomach:
1. superskręcenie
2. formy napięte
3. struktura stabilizowana przez białko histonopodobne HV – do którego
przyłącza się 12-80 pętli DNA tworzących domeny chromosomalne.
RNA
HV
1 2
3
• za odpowiednie ustawienie zwojów odpowiada enzym topoizomeraza II – zwana gyrazą,
która wytwarza odpowiednie skręty dające w/w formy
• za upakowanie DNA odpowiada też topoizomeraza IV
• należy pamiętać, że istnieją pewne wyjątki od tej reguły – mianowicie w pewnym krętku
stwierdzamy chromosom liniowy, natomiast przecinkowiec cholery posiada dwa
chromosomy.
• ponadto w wielu bakteriach oprócz nukleosomu występują plazmidy – mniejsze,
również kuliste cząsteczki DNA, które mogą zawierać geny odporności na antybiotyki,
ponadto mogą one być wymieniane pomiędzy różnymi osobnikami.
www.lek2002.prv.pl | lek2002.xoopiter.com
5
www.lek2002.prv.pl | lek2002.xoopiter.com
Rybosomy
• występują w ilości ok. 10 tys./bakterię
• służą do produkcji białek
• rybosom bakteryjny to rybosom 70S złożony z podjednostki dużej i małej –
odpowiednio 50S i 30S [gwoli przypomnienia: Eukaryota – 80S=60S+40S], [S –
jednostka Svedberga]
• Duża podjednostka (50S) składa się z 23S, 5S rRNA i 34 białek [Eukaryota: 5S; 28S;
5,8S rRNA + 49 białek]
• mała podjednostka (30S) składa się z 16S rRNA oraz 21 białek [Eukaryota: 18S rRNA +
33 białka]
• Rybosomy bakteryjne mogą tworzyć struktury polisomów, ale bakterie nie posiadają
rybosomów związanych z siateczką śródplazmatyczną, bo w ogóle nie mają siateczki
Błona komórkowa
• bakterie posiadają błonę komórkową o planie budowy zbliżonym do błony komórkowej
komórek eukaryotycznych – jest to dwupokład fosfolipidowy o szerokości 7-8 nm
• błona komórkowa bakterii nie zawiera steroli, za wyjątkiem klasy Mollicutes, które
wprawdzie posiadają sterole w błonie komórkowej, zalicza się tu też Mycoplasma, ale te
nie mają jednak ściany komórkowej.
• pewne bakterie zawierają hopanoidy – zbliżone do steroli (ponieważ nie lubię biochemii
– więc tego nie sprawdzam)
• 30% suchej masy błony stanowią fosfolipidy
• 70% suchej masy błony stanowią białka o rozmaitych funkcjach – są to enzymy, białka
transportowe etc. Należy pamiętać, że w obrębie błony wyróżnia się białka peryferyjne
(luźno z nią związane i położone powierzchownie) i integralnie (silnie związane z błoną,
z reguły przebijają one błonę na wylot)
• zadanie błony – fizyczna i metaboliczna bariera i selektywna przepuszczalność
• jest narządem pobierania pokarmu i wydalania zbędnych produktów metabolizmu
Ściana komórkowa
• ściana komórkowa występuje we wszystkich bakteriach poza Mollicutes/Mycoplasma
• jest to twór unikalny, tworzący makromolekułę na zewnątrz komórki
• stanowi ochronę przed czynnikami fizycznymi działającymi z zewnątrz oraz przed
ciśnieniem komórki działającym od wewnątrz i wynoszącym 5-30 atmosfer. Ponadto
określa ona kształt komórki
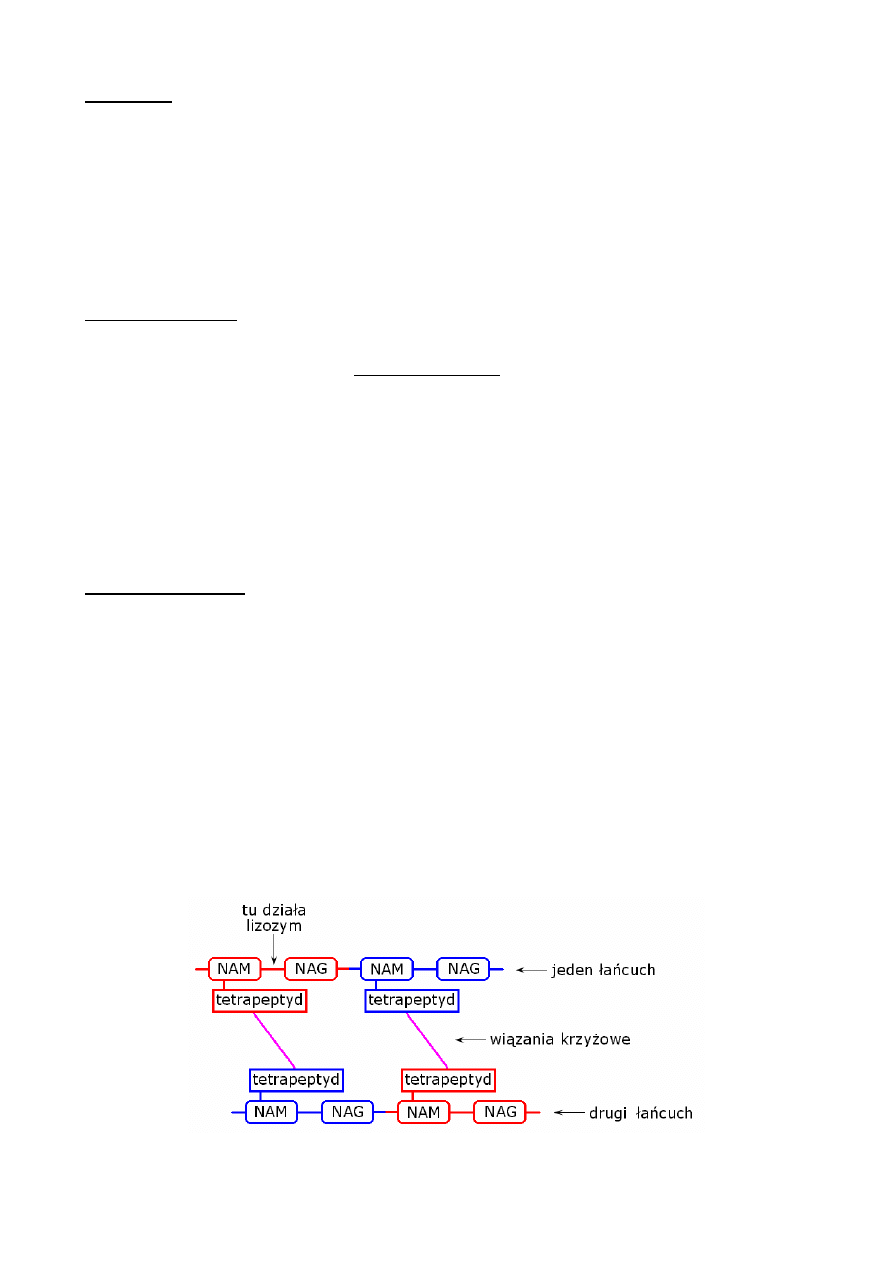
• jej podstawowym elementem budulcowym jest peptydoglikan zwany mureiną
• peptydoglikan jest zbudowany z długich łańcuchów cukrowych składających się z
powtarzających się monomerów połączonych wiązaniami 1,4-β-N-glikozydowymi
• monomerem jest 3 składnikowy kompleks: kwas N-acetylomuraminowy (na rys. NAM), N-
acety-loglukozoamina (na rys. NAG) [też połączone wiązaniem 1,4-β-N-glikozydowym] oraz
dołączony do grupy kwasowej kwasu N-acetylomuraminowego tetrapeptyd
• tetrapeptydy składają się głównie z L-aminokwasów, ale występują w nich również D-
aminokwasy (D-Ala, D-Glu), które nie są obecne w komórce Eukaryota. Dzięki temu są
odporne na proteolizę
• tetrapeptydy jednego łańcucha mogą łączyć się z tetrapeptydami innego łańcucha dając
poprzeczne (krzyżowe) wiązania, co tworzy tzw. usieciowanie
www.lek2002.prv.pl | lek2002.xoopiter.com
6

www.lek2002.prv.pl | lek2002.xoopiter.com
• wyróżnia się dwie zasadnicze grupy bakterii różniące się budową ściany. Różnice te widać
wyraźnie w barwieniu metodą duńskiego lekarza-bakteriologa Christiana Grama – w
związku z tym te rodzaje bakterii określa się jako bakterie Gram „+” i Gram „–”
Ściana bakterii Gram dodatnich
• ich ściana ma grubość 20-50 nm
• peptydoglikan (jej podstawowy składnik) tworzy pokład składający się z 20-80 warstw
• usieciowanie (polegające na wytworzeniu wiązań krzyżowych między łańcuchami
peptydoglika-nu) ma miejsce w 100% tetrapeptydów
• w tą siatkę peptydoglikanu wplecione są polimery kw. tejchojowego
Ściana bakterii Gram ujemnych
• ich ściana ma grubość 10-20 nm
• mimo mniejszej grubości niż w bakteriach Gram+ jej budowa jest bardziej skomplikowana
• peptydoglikan występuje tu tylko w 1-3 pokładach (warstwach), cechuje go słabe
usieciowanie – w ok. 20-30%; nie ma kw. tejchojowego
• nad peptydoglikanem znajduje się „błona zewnętrzna” (outer membrane) – dwupokład
liposacharydowy o grubości 7,5 nm, stanowiący „pieczęć” określonego rodzaju bakterii –
wykrywa się ją jako antygen „O” [o jak Ola]
• tym antygenem błony zewnętrznej jest liposacharyd (LPS) zbudowany jest: z lipidu A,
rdzenia polisacharydowego, a także wystających na zewnątrz polisacharydów tworzących
antygen
• pomiędzy błoną zewnętrzną a właściwą błoną komórkową znajduje się przestrzeń
periplazmatyczna (periplazma), grubości ok. 15 nm, zawierająca białka (np. lipoproteiny),
w tej przestrzeni leży peptydoglikan
• tak więc ograniczenie prokariotycznej komórki Gram– (idąc od środka komórki na
zewnątrz) składa się z następujących części:
1. błona komórkowa [dwupokład lipidowy]
2. przestrzeń periplazmatyczna z peptydoglikanem
3. błona zewnętrzna z LPS’em [lipopolisacharydem]
[Ja jadę wg NMS i wykładu, Zaremba podaje inaczej, ale ona jest z Białegostoku – miasto w
prawdzie ładne - zwł. pałac Branickich, polecam – ale na mikrobach to się chyba nie znają]
• pomimo, że błona tych bakterii jest cienka, posiada dobre właściwości ochronne. Cechuje ją
też wysoka zawartość białek enzymatycznych będących silnymi antygenami. Dodatkowo
enzymy ściany komórkowej bakterii Gram– mogą rozkładać wiele antybiotyków.
www.lek2002.prv.pl | lek2002.xoopiter.com
7
www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 3
© by Wiesław Gołas
Pierwsze chwile wykładu zostały poświęcone (jakże ważnej dla każdego śmiertelnika)
systematyce…
Systematyka:
Królestwo – Bacteria
Gromada
–
Proteobacteria
Klasa – Alpha Proteobacteria [α-Proteobacteria]
Rodzina – Rickettsiaceae, Bartonellaceae, Brucellaceae
Klasa – Beta Proteobacteria [β-Proteobacteria]
Rodzina – Alcaligennaceae (Bordatella), Neisseriaceae, Spirillaceae
Klasa – Gamma Proteobacteria [γ-Proteobacteria]
Rodzina – Francisellaceae, Legionellaceae, Coxiellaceae, Pseudomonocellaceae,
Enterobacteriaceae, Moraxellaceae, Vibrionaceae, Pasteurellaceae
Klasa – Epsilon Proteobacteria [ε-Proteobacteria]
Rodzina
–
Campylobacteraceae,
Helicobacterraceae
Gromada
–
Firmicutes
Klasa – Clostridia
Rodzina – Clostridiaceae
Klasa – Mollicutes [wyjątek nie posiadający ściany komórkowej]
Rodzina – Mycoplasmataceae
Klasa – Bacilli
Rodzina – Bacillaceae, Listeriaceae, Staphylococcaceae, Lactobacillaceae,
Enterococ-caceae, Streptococcaceae
Gromada
–
Actinobacteria
Rodzina – Actinomycelaceae, Corynebactericeae, Mycobacteriaceae, Nocardiaceae
Gromada
–
Chlamydiae
Rząd – Chlamydiales
Rodzina – Chlamydiaceae
Gromada
–
Spirochaetes
Rząd – Spirochaeteles
Gromada
–
Bacterioidetes
Rząd – Bacteroidales
[Ufffff… powyższy fantastyczny podział bakterii sponsorowany jest przez Szpital Psychiatryczny
w Gnieźnie]
Ten podział jest oparty na cechach fenotypowych bakterii – odnosi się do wyniku barwienia
met. Grama.
W klasie delta Proteobacteria [δ-Proteobacteria] nie ma drobnoustrojów patogennych dla
człowieka, dlatego została pominięta. Proteobacterie należą do Gram–, a Firmicutes do Gram+.
Pierwsza systematyka opierała się właśnie na barwieniu metodą Grama. (Christian Gram
wprowadził swoje barwienie w 1884 r. czyli w tym samym czasie co R. Koch pokazuje prątka
gruźlicy)
Międzynarodowy Kod Nomenklaturowy Bakterii oprócz cech fenotypowych uwzględnia cechy
genetyczne.
Dla zrozumienia podziałów systematycznych wprowadźmy parę pojęć:
Kolonie
– jest to zbiór komórek drobnoustroju wyrastających na podłożu stałym i widocznych
gołym okiem.
Gatunek
– (łac. species) jest to podstawowa jednostka taksonomiczna, populacja bakteryjna
wykazująca wysoki stopień podobieństwa fenotypowego i genotypowego [stopień
homologii DNA powyżej 70%]. Gatunki złożone są z szeregu różnych szczepów.
Tworzą one rodzaje i wchodzą w skład rodzin, tworzących z kolei rzędy
Szczep
– typowy przedstawiciel danego gatunku
Kilka cech ułatwiających poruszanie się w nomenklaturze:
• Tak gwoli przypomnienia – językiem obowiązującym w systematyce jest łacina…
• Rodziny posiadają więc końcówkę „-aceae”
• Rzędy posiadają końcówkę „-ales”.
www.lek2002.prv.pl | lek2002.xoopiter.com
8

www.lek2002.prv.pl | lek2002.xoopiter.com
• System nazewnictwa jest binominalny, tzn. że zawsze operujemy nazwą rodzajową
(wyróżnionej zawsze dużą literą) i gatunkową (pisaną z małej litery), np. Salmonella
typhi
Barwienie metodą Grama
Metoda barwienia jest już zapewne wszystkim znana, ale dla przypomnienia:
1. Zalewamy fioletem gencjany na 1-2 min., zlewamy
2. Przemywamy wodą
3. Zalewamy płynem Lugola (roztwór jodu w jodku potasu) na 0,5-1 min., zlewamy
4. Ponownie przemywamy wodą
5. Zalewamy 1 raz alkoholem [perfekcyjny denaturat Polmos Zielona Góra] na 1-3 min.,
zlewamy
6. Przemywamy wodą [wersja druga = pkt. 5 i 6 powtórzyć 2 lub 3 razy, przy czym alkohol –
na 30 sek. ⇒ alkohol → H
2
O → alkohol → H
2
O → alkohol → H
2
O]
7. Zalewamy fuksyną 0,5-1 min., zlewamy
8. Przemywamy wodą
9. Suszymy
Zamiast płynu Lugola można używać trichloroetylenu platyny – ma on lepszą gęstość
elektronową i po barwieniu nim preparaty można oglądać pod mikroskopem elektronowym,
jednak ma małą wadę – jest drogi…
Funkcje elementów:
• Fiolet gencjany barwi wnętrze bakterii
• Płyn Lugola wzmacnia ten efekt powoduje powstawanie agregatów chlor-jod
• Alkohol powoduje rozpuszczenie błon cytoplazmatycznych. W przypadku, gdy ściany
komórkowe zawierają dużo warstw peptydoglikanu, który nie dopuszcza do wypłukania
agregatów znajdujących się wewnątrz [chroni on komórkę przed działalnością alkoholu].
• Fuksyna barwi te bakterie, z których został wypłukany fiolet gencjany.
Rozmnażanie się bakterii
Motto: „Siłą bakterii jest ich nieśmiertelność!!!”, ale oczywiście gdy mają wystarczający dostęp
do substancji odżywczych (do metabolitów potrzebnych do oddychania i odżywiania). Bakterie
rozmnażają się przez podział poprzeczny, przy czym najpierw dzieli się genofor. Podziały
bakteryjne odbywają się w większości przypadków co 15-20 min. Istnieją jednak również
bakterie tzw. wolnonamnażające się, których podziały następują co 48h. Prątek gruźlicy dzieli
się raz na 18h, Legionella – raz na 32-34h, zaś krętki – co 24h.
Wzrost populacji bakterii możemy podzielić na kilka faz (pomijając „procesy starzenia”):
1. Faza adaptacyjna do podłoża, stanowi fazę zahamowanego wzrostu (ok. 20 min., liczba
bakterii nie ulega zmianie – stała)
2. Faza logarytmicznego/intensywnego wzrostu, w niej następuje gwałtowny przyrost
wielkości populacji, do momentu, w którym następuje równowaga między ilością bakterii a
ilością substancji odżywczych
3. Faza stacjonarna, w której ilość powstających w wyniku podziału bakterii jest równa ilości
umierających (trwa kilka godzin), bo w podłożu zaczyna już brakować substancji
odżywczych.
4. Faza wymierania, w której to na pożywce znajduje się już zdecydowanie za mało pokarmu,
dlatego nie może nastąpić dalszy wzrost.
[wszystko podpisane na rewelacyjnym schemacie poniżej]
Rys. Krzywa wzrostu bakterii na danym podłożu
czas
Log[bact]
1
2
3
4
www.lek2002.prv.pl | lek2002.xoopiter.com
9
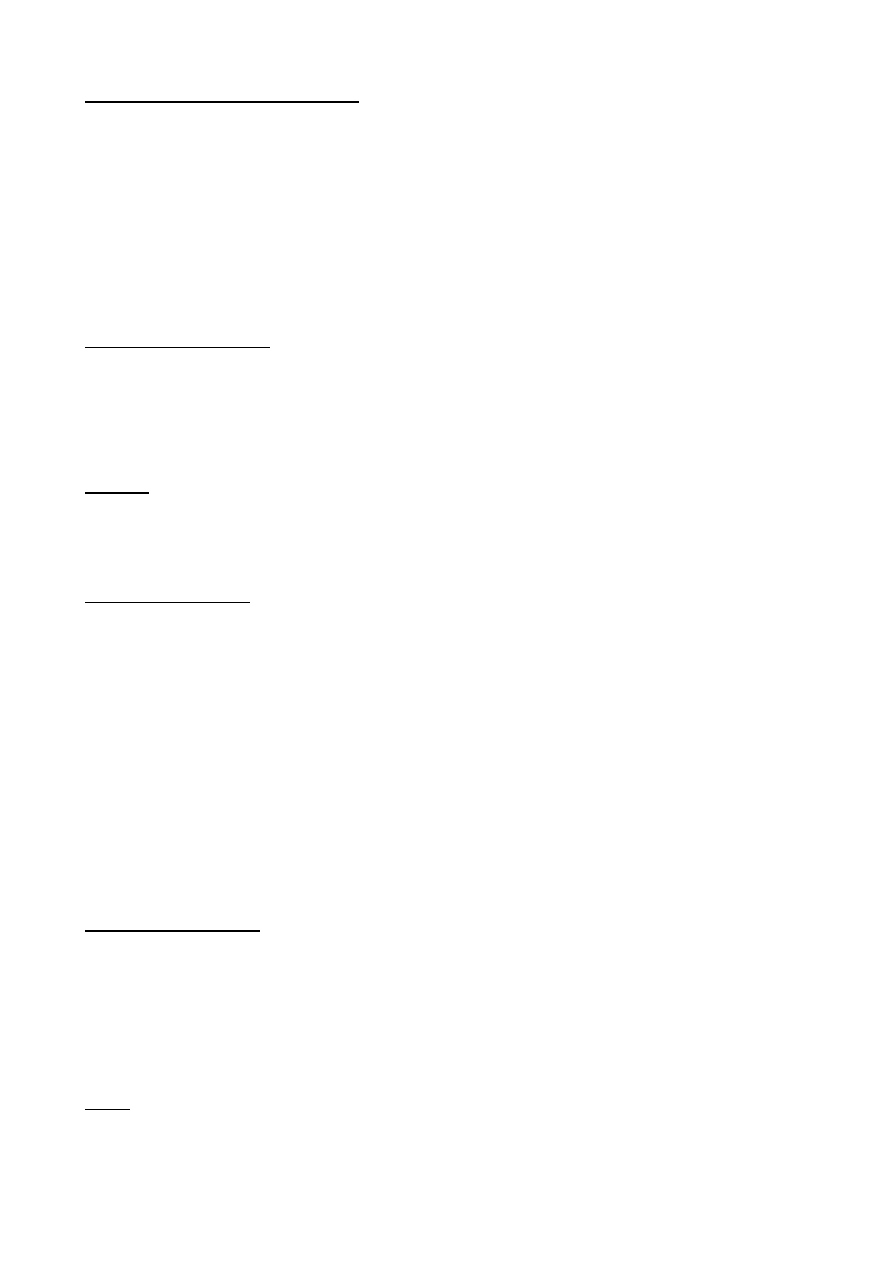
www.lek2002.prv.pl | lek2002.xoopiter.com
Metabolizm komórki bakteryjnej
–
jest to całokształt przemian w komórce
–
obejmuje procesy anaboliczne i kataboliczne oraz określa zdolność bakterii do namnażania
Ciekawostki:
–
1 komórka bakteryjna zużywa 1-10 fentograma ATP
–
1 komórka grzyba zużywa 100 fg ATP
–
1 komórka somatyczna ciała człowieka – 1000 fg ATP
Można to wykorzystać do diagnostyki – metody bioluminescencyjne pozwalają stwierdzić fakt
rozpadu ATP (os poziomu 2 fg), pozwala nam to stwierdzić, że bakterie są, ale nie można
określić jakie. Badanie jest o tyle extra, że trwa koło 5 sekund
Impedymetria
– jest to metoda wykrywania zjonizowanych form bakteryjnych; wykorzystuje
wzrost bakterii na pożywce, powodujący rozpad substancji odżywczych.
Występują wtedy zmiany w tym podłożu.
Pozyskiwanie energii:
Przejdźmy na „górne loty” – czyli wyższą pierdolencję:
W procesie oddychania powstaje „centralna molekuła energetyczna, którą jest ATP” [chyba
rzygnę]. Aby zsyntezować 1 g bakterii – zużywane jest 36 mmoli ATP, z tego po 20 mmoli
przeznaczone jest na syntezę białek.
Przy rozpadzie ATP do ADP uwalniane jest 31,4 kJ energii z 1 cząsteczki.
Bakterie wykorzystują energię do podziałów, do syntezy oraz do wypełniania aktywności
chorobotwórczej. Występuje wobec tego konieczność stałego dopływu składników odżywczych
Energia:
• z ATP
• ze światła słonecznego – fototrofy
• ze związków nieorganicznych – litotrofy [bakterie te żrą skały i grupa ta nie stanowi
patogenów człowieka]
• ze związków organicznych – chemoorganotrofy
Składniki odżywcze:
• Bakterie samożywne – autotrofy
• Bakterie cudzożywne – heterotrofy; dzielimy je na prototrofy [wymagają jednego typu zw.
org.] oraz na auksotrofy [wymagają dodatkowych substancji odżywczych]
Do dodatkowych czynników wzrostowych zaliczamy:
• Czynnik X , V – dla bakterii H. influenzae [cz. X = protoporfiryna IX (lub hemina), cz.
V = NAD]
• Czynnik X – dla H. ducrei, H. parainfluenzae
• Sterole – dla Mycoplasma
• Tryptofan – dla S. typhi
• Kw. nikotynowy – dla Proteus
• Cysteina – dla Streptokoków
• Nikiel i Kobalt – dla H. pylori
• Cysteina i sole żelaza – dla Legionella
• Witamina K i B-kompleks – dla beztlenowców
• CO
2
– bakterie kaprofilne (wymagają zwiększonego dostępu CO
2
, np. Haemophilus,
Brucella, Neisseria)
Znajomość czynników dodatkowych jest wykorzystywana do identyfikacji.
Oddychanie bakterii:
Polega na odłączaniu elektronów od jednego związku i przerzucaniu go ich na inny związek.
Ze względu na typ oddychania bakterie dzielimy na:
1. Tlenowe – najwydajniejsze energetycznie – 38 cząst. ATP/1 cząst. glukozy (przerzucają
elektrony na tlen)
2. Beztlenowe – ok. 24 cząst. ATP
3. Fermentacyjne [i te najbardziej lubi Pe$eT] – od 2 do 2,5 cząst. ATP/1 cząst. glukozy
4. Oddychające endogennie, czyli takie, które w stanach zagrożenia (warunkach „głodowych”)
poświęcają swoje składniki strukturalne
Ad. 1.
W wyniku „przerzucania” elektronów na tlen, powstaje toksyczny rodnik tlenu, który działa w
ułamkach sekundy. O
2
+ 2 e
–
→ O
2
–
Bakterie te posiadają dwa układy rozkładające toksyczny rodnik tlenu
www.lek2002.prv.pl | lek2002.xoopiter.com
10
www.lek2002.prv.pl | lek2002.xoopiter.com
–
dysmutazę ponadtlenkową
[SOD]: 2 O
2
– •
+ H
2
→ H
2
O
2
+ O
2
[w tej reakcji są dwa
anionorodniki ponadtlenkowe – jeden z nich jest reduktorem, a
drugi utleniaczem]
–
katalazę: 2 H
2
O
2
→ 2 H
2
O + O
2
Uwaga: Bakterie aerotolerancyjne posiadają zdolność do detoksykacji rodników za pomocą
dysmutazy ponadtlenkowej, nie posiadają natomiast katalazy w odróżnieniu od pozostałych
bakterii tlenowych.
Istnieją bezwzględne bakterie tlenowe – wymagają do wzrostu O
2
atmosferycznego, rosną więc
wyłącznie powierzchniowo, niektóre z nich to patogenny, np. kultowe prątki gruźlicy, czy
maczugowiec błonicy
Z kolei bakterie mikroaerofilne potrzebują do 5% tlenu, ponieważ stanowi on „terminalny
akceptor” elektronów, np. Helicobacter pylori
Ad. 2.
W oddychaniu beztlenowym akceptorem elektronów są związki inne niż O
2
(np. azotany,
siarczany, itp.)
Bakterie w tej grupie dzielimy dalej na względne i bezwzględne beztlenowce
Względne obejmują większość patogenów, bakterie te mogą wzrastać i żyć w warunkach
tlenowych i beztlenowych, ale korzystają głównie z procesów fermentacji, w razie potrzeby
mogą zmieniać typ metabolizmu – są bardzo uniwersalne
Bezwzględne dzielimy dalej na:
• Ścisłe – rosną z dala od tlenu – toksyczne jest dla nich stężenie 0,5-1% tlenu, np.
Clostridium
• Umiarkowane [4% O
2
działa toksycznie], np. Bacteriodes
Tlen jest dla nich toksyczny dlatego, gdyż nie zawierają układów rozkładających wolne rodniki
tlenowe.
Ad. 3.
− procesy fermentacji dostarczają 2,5 ATP, a cykl Krebsa – 38 ATP
− fermentacja jest to proces oddychania beztlenowego
− brak jest dodatkowego akceptora elektronów (w przeciwieństwie do oddychania!)
− jeden substrat ulega redukcji – drogi utlenieniu
− w zależności od produktu końcowego wyróżniamy różne typy fermentacji
a) fermentacja Clostridium – prowadzi do powstania kw. masłowego, butarolu, acetonu i
CO
2
b) fermentacja Enterobacteriaceae – etanol, kw. mlekowy, kw. bursztynowy, octowy, CO
2
i
H
2
O
c) fermentacja Escherichia i Salmonella – etanol, kw. mlekowy, kw. sukcynowy.
*
„ponadtlekową” a nie „nadtlenkową” – ona rozkłada ponadtlenki, a nie nadtlenki!
www.lek2002.prv.pl | lek2002.xoopiter.com
11

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 4 – Genetyka komórki bakteryjnej
Do lat 40. XX wieku uważano, że bakterie nie mają żadnych genów, odbierano je statycznie,
natomiast w latach 1943-46 udowodniono, że jednak posiadają geny i replikują DNA
Cytacik: „Ach te bakterie… ta niezwykła plastyczność, ta niezwykła zdolność przystosowania się
do zmiennych warunków środowiska, ta narastająca perfidia, jest (proszę Was) uwarunkowana
czynnikami genetycznymi…”
Całość informacji genetycznej zawartej w komórce bakteryjnej zwiemy genomem (dalej
nastąpiła szybka powtórka wykładu o budowie bakt.: nukleoid=monochromosom, typ DNA itp.
itd.)
GENOTYP BAKTERII
Genotyp
– jest to zestaw genów, jakimi dysponuje komórka – są to przede wszystkim geny
znajdujące się na chromosomie bakteryjnym, ale również na plazmidach i transpozonach.
1. Chromosom bakterii
• Składa się zwykle z jednej kolistej cząsteczki ccc-dsDNA [p. wykład o budowie bakterii]
• Posiada różną ilość genów – najmniej jest ich 517 [p. poniżej] – z taką liczbą genów
bakteria prawidłowo namnaża się i wykazuje nawet aktywność chorobotwórczą:
o
Mycoplasma genitalium
(najmniesze bakterie) – 517 genów
o
E. coli
– tj. „modelowa bakteria” ma zidentyfikowanych dotychczas >3100 genów,
ocenia się, że bakteria ta ma ich ok. 4200
o
Y. pestis
(ta od dżumy) – 4012 genów (Mistrzyni – brawa dla niej! Ona ma wg
badań największą liczbę genów, stąd jest cytujemy: „szczególnie perfidna” ze
względu na duże możliwości chorobotwórcze i szczególnie dużą zakaźność)
o
H. influenzae
– ma zidentyfikowanych 1015 genów
o
B. burgdorferi
– 900 genów
W skład genomu, prócz monochromosomu (nukleoidu), wchodzą pozachromosomowe
cząsteczki DNA, są to przede wszystkim plazmidy…
2. Pozachromosomalny DNA = plazmidy
• są to cząsteczki koliste, 2-niciowego DNA, kowalencyjnie zamkniętego, zawierające
standardowo mniej niż 30 genów (choć mogą mieć ich nawet >100); rzadziej spotyka się
cząsteczki jednoniciowe, względnie linearne
• mają one zdolność do autonomicznej replikacji
• szczególnie istotne z punktu widzenia klinicysty są plazmidy wirulencji, odpowiadające za
chorobotwórczość danego drobnoustroju:
• przykładem może być plazmid Ent – odpowiedzialny za produkcję enterotoksyny przez
normalnie niegroźną E. Coli
• bardzo ważne są również plazmidy R [resistance] kodujące lekoooporność – odpowiadają
one za oporność bakterii na antybiotyki
/
chemioterapeutyki. Posiadają one dwie
wyróżnialne komponenty:
o
RTF – jednostkę przenoszącą [Resistance Transfer Factor]
o
RD (R-det) – kodującą enzymy oporności na antybiotyki, które mogą np.
unieczynniać dany antybiotyk, czy też powodować jego aktywne usuwanie z komórki
bakteryjnej, czy też zmieniać miejsce działania antybiotyku
• plazmidy R są szczególnie niebezpieczne, bowiem mogą kodować odporność na szereg
antybiotyków, ponadto są plazmidami koniugacyjnymi, tzn. mogą być wymieniane
pomiędzy różnymi bakteriami, a nawet jednostkami taksonomicznymi bakterii, uzyskanie
takich plazmidów przez bakterie powoduje, że stają się one wszędobylskie (⇒ nazwa:
plazmidy R = plazmidy wszędobylskie, geny R-det = geny wszędobylskie)
3. Transpozony
• odpowiadają za transpozycję – są to ruchome elementy DNA, kodujące tzw. „geny
skaczące”.
• występują jedynie u niektórych gatunków bakterii
Operon i regulon
• operon – to zespół genów określonego szlaku metabolicznego podlegający wspólnemu
mechanizmowi kontroli przez sekwencję DNA zwaną operatorem
• regulon – to zespół 2 lub więcej operonów podlegających wspólnej regulacji – a więc
posiadających wspólny operator.
REPLIKACJA DNA U BAKTERII
www.lek2002.prv.pl | lek2002.xoopiter.com
12

www.lek2002.prv.pl | lek2002.xoopiter.com
• tj. namnożenie, podwojenie DNA bakterii po to, by się mogły poprzecznie podzielić (w
warunkach sprzyjających: 1 podział/15-20 min.)
• replikacja DNA u bakterii ma charakter semikonserwatywny i zachodzi w stałym,
niezależnym od częstości podziałów tempie
• polega na syntezie nowych nici DNA na matrycy znajdującej się w komórce
• ponieważ chromosom bakterii jest zamkniętą pętlą – wymaga otwarcia dla replikacji.
Odpowiada za to enzym helikaza. Rozpoznaje ona jedno specyficzne miejsce w
chromosomie – miejsce OriC
• w punkcie OriC tworzą się widełki replikacyjne i zaczyna się replikacja materiału
genetycznego [tylko w tym jednym miejscu]. Powstają widełki replikacyjne oraz nici
potomne, antyrównoległe do nici pierwotnej, powstające w kierunku 5’ → 3’
• za replikację DNA odpowiada polimeraza DNA III, budująca nową nić DNA na matrycy nici
rodzicielskiej (szablonowej) zgodnie z „zasadą komplementarności zasad azotowych: A=T,
C≡G”. Do rozpoczęcia swej pracy wymaga ona wolnej grupy 3′–OH, która znajduje się na
10-nukleotydowym starterze – cząsteczce RNA zsyntezowanej przez enzym prymazę, który
też nie jest taki samodzielny, bo wymaga grupy białek starterowych
• ze względu na dwuniciowość cząsteczki DNA powstają 2 nici potomne
1. nić wiodąca (powstająca komplementarnie do nici 3’ → 5’) – jest syntezowana w sposób
ciągły
2. nić opóźniona (powstająca komplementarnie do nici 5’ → 3’) – wymaga ciągłej
reinicjacji, bo jest syntezowana w odwrotnym kierunku – „ścieg wsteczny” – jej synteza
odbywa się w tzw. „fragmentach Okazaki” (1000-nukleotydowych fragmentach DNA
porozdzielanych RNA-starterami). Taka synteza wymaga prymosomu – kompleksu
DNA-enzymy, odpowiadającego wielokrotną inicjację i za syntezę fragmentów Okazaki.
Ponadto do syntezy tej nici wymagane są:
• nukleaza – umożliwiająca lizę (rozcięcie) kompleksów nić potomna(DNA)-
starter(RNA)
• polimeraza I DNA – uzupełnia miejsca po usuniętym starterze
• ligaza DNA – łączy DNA zsyntezowany przez polimerazy III oraz I
Tak więc do cech charakterystycznych replikacji DNA u bakterii (w odróżnieniu od Eukaryota)
zaliczyć należy:
1. posiadają jeden punkt inicjacji replikacji DNA – OriC (u Eukaryota – wiele)
2. obie nici są syntezowane przez polimerazę III
3. w replikacji DNA nie uczestniczą telomerazy [co ma miejsce w komórkach Eukaryota] ⇒
komórki bakteryjne się nie starzeją
Chwila ciszy… „Myślę, że Państwo sobie to przemyślicie i wszystko powinno być jasne…”
Doświadczenie Griffitha
• Jest to doświadczenie z 1928 roku, wykonane w czasie epidemii płatowego zapalenia płuc w
Anglii (czynnik etiologiczny – Streptococcus pneumoniae, należący do α-hemolizujących
paciorkowców)
• za chorobę tę odpowiada bakteria Streptococcus pneumoniae. Odpowiada ona również za
zapalenie opon mózgowo–rdzeniowych u dzieci w wieku do lat 5 oraz zapalenie zatok i ucha
środkowego. Rozwój zakażenia przebiega bardzo gwałtownie przy braku śledziony.
Dochodzi do posocznicy, a w jej wyniku do zgonu. W obrębie tego gatunku stwierdza się
występowanie otoczki o 90 odmianach serologicznych. Jeśli otoczka nie posiada cukru C,
wówczas nie typuje się jej według Barbary Lanzefield. Bakterie te wykazują wrażliwość na
optochinę (strefa zahamowania wokół krążka z optochiną ≥ 12 mm).
• Tylko szczepy posiadające otoczkę polisacharydową są chorobotwórcze i zwie się je
szczepami „S” – gładkimi, w odróżnieniu od niechorobotwórczych, pozbawionych osłonki
szczepów szorstkich „R”
• Bakterie te, które zaobserwował Griffith mogą wytwarzać szczep otoczkowy (jako jedyne w
grupie α-hemolizujących), wirulentny powodujący zapalenie płuc, jednakże te same
bakterie posiadają zdolność do wytwarzania szczepu bezotoczkowego
• Zrobił on szereg testów:
1. wszczepił (wstrzyknął) myszom szczep otoczkowy (szczep S), no i one padły, ale „to
niczego nie dowodzi…”
www.lek2002.prv.pl | lek2002.xoopiter.com
13

www.lek2002.prv.pl | lek2002.xoopiter.com
2. wszczepił szczep bezotoczkowy (szczep R), który nie wywołuje choroby, no i podanie
tego szczepu myszom nie dało objawów – fakt ten stanowił więc dowód, że w
przypadku tego gatunku o wirulencji decyduje budowa otoczki
3. dalej Griffith podał myszom zabite w wysokiej temp. szczepy otoczkowe, no i myszy
przeżyły – oznaczało to, że zdolność wirulencji posiadają jedynie bakterie żywe
4. potem wszczepił mieszankę zabitych otoczkowych i żywych bezotoczkowych i ku jego
zaskoczeniu Griffitha myszy zdechły, a przecież w obu powyższych próbach bakterie te
samodzielnie nie wywołały choroby, wyhodował więc te bakterie z martwych myszek i
okazało się, że są one żywe i otoczkowe, a przecież żywe wszczepił bezotoczkowe…
Griffith nazwał ten proces zjawiskiem transformacji (i tłumaczył jakąś bzdurną
zagmatwaną teorią o specyficznej wybiórczej adaptacji…)
• Dziś wiadomo, że Griffith uzyskał szczepy transformowane.
• Okazało się, że gen kodujący otoczkę przeszedł z zabitych bakterii otoczkowych do żywych
szczepów bezotoczkowych
• W 1943 r. lekarz z Nowego Jorku – Ostwal Eurwin (lub Avery – nie dosłyszałem), którego
matka zmarła właśnie na płatowe zapalenie płuc powtórzył doświadczenie Griffitha, przy
czym udało mu się wyizolować „czynnik” odpowiedzialny za transformację i było to
oczywiście DNA zabitych bakterii („niestety nie dostał za to Nobla”)
HORYZONTALNE PRZENOSZENIE GENÓW
Do procesów horyzontalnego przenoszenia genów – czyli przenoszenia genów pomiędzy
różnymi osobnikami bakterii zaliczamy następujące rodzaje procesów: transformację,
koniugację i transdukcję
Transformacja
• Jest to proces aktywnego pobierania przez kompetentne bakterie DNA pozabakteryjnego
(wolnego, nagiego) różnego rodzaju – może to być DNA genoforowe i plazmidowe. Może
pobierać DNA wyłącznie swego gatunku, ale też może innych gatunków bakterii, a nawet
roślin, czy zwierząt…
• Stan kompetencji (usposobienia do pobierania DNA) może się wyrażać u bakterii:
) konstytutywnie (czyli stale) – np. Neisseria, czy Haemophilus
) po wzbudzeniu kompetencji – np. w przypadku niedoborów czynników wzrostowych,
czy składników pokarmowych, czy pod wpływem zniszczenia jakiejś jej struktury.
Bakterie te charakteryzują się więc obecnością pewnych detektorów, które
wzbudzają transformację.
Taki proces (pobieranie DNA przez komórkę) u Eukaryota zwie się transfekcją.
• Transformacja jest to zatem proces naturalnego przetwarzania genów.
Koniugacja
czyli „akt seksualny bakterii” (odkryte 1946 r.)
• Jest to proces przenoszenia genów w wyniku ścisłego kontaktu bakterii, w czasie tego
zjawiska dochodzi do replikacji genów i przeniesienia ich.
• Jest ona uzależniona od typu płciowego bakterii. Wyróżnia się 3 takie typy:
o
F
+
→ typ płciowy „męski” (dawca), posiada plazmid koniugacyjny, często jest to
plazmid lekooporności
o
F
–
→ typ płciowy „żeński” (biorca)
o
Hfr → High freqency recombination – typ płciowy „supermęski” (superman) (dotyczy
tylko komórki-dawcy)
• Typ płciowy bakterii uzależniony jest od fimbrii płciowych (tzw. pilusów, czy pili)
znajdujących się na powierzchni komórki, będących typem fimbrii. Fimbie mają 0,5-1
mikrometra długości, około 12 nm średnicy, są sztywniejsze i krótsze od rzęsek i wyróżnia
się dwa ich rodzaje – fimbrie pospolite (kodowane nukleosomowo) i fimbrie płciowe
(fimbria płciowa=pilus, kodowane przez plazmid koniugacyjny, obecny tylko u typu
„męskiego” F
+
– ja tu widzę ździebko podobieństwa z ludźmi...), przy czym tylko te
ostatnie są istotne w procesie koniugacji
• Koniugację pomiędzy bakteriami tego samego rodzaju eliminuje zjawisko wykluczania
powierzchniowego, bakterie rozpoznają swoje fimbrie (czyli nie jest możliwy „seks
homoseksualny”)
• Koniugacja może zajść między komórką F
+
a F
–
, przy czym plazmid koniugacyjny oprócz
jednostek RTF i R-det; posiada zespół genów „tra” – jest to 15-25 genów warunkujących
wytwarzanie pilusów (i dzięki temu przenoszenia plazmidu) oraz odpowiadającym za sam
„akt” koniugacji
• Dokładnie o co biega przedstawia rysunek:
www.lek2002.prv.pl | lek2002.xoopiter.com
14
www.lek2002.prv.pl | lek2002.xoopiter.com
F+
F-
• Tworzy się mostek cytoplazmatyczny w obrębie którego plazmid z komórki F
+
przepływa do
komórki F
–
i ta F
–
staje się F
+
, jednak nie zawsze, bo istnieje (choć bardzo rzadko)
„zjawisko wyplucia materiału genetycznego” [hmmm wyplucie materiału genetycznego –
ciekawe, ciekawe... bakterie zaczynają mi się podobać…]
• Owy proceder trwa >120 min. [ale te bakterie to mogą… Tylko cicho, bo się laski zaczną
buntować…]
• Typ „supermęski”, czyli Hfr, to taki, którego plazmid koniugacyjny nie „pływa” wolny w
cytoplazmie, ale jest związany (zespolony) z chromosomem bakteryjnym w jedną
cząsteczkę
• Takie połączenie: plazmid-nukleosom zwiększa częstość rekombinacji, stąd nazwa „Hfr”
(high frequency recembinant).
• W wypadku typu „supermęskiego” (Hfr) plazmid (będący zespolony z genoforem
bakteryjnym F
+
) przekazuje się wskutek replikacji całego chromosomu F
+
i przesyłaniu
jednej kopii chromosomu do bakterii-biorcy F
–
. Taki przekazywany chromosom nie jest
kolisty a liniowy. Miejsce rozcięcia kolistej cząsteczki leży w środku plazmidu (tzw. miejsce
OriT). Seksik ten trwa tu coś koło 90-110 minut. F
–
zwykle jednak nie traci swojej
płciowości, ponieważ wiązanie między fimbrią płciową (pilusem) a jej receptorem (białko
OmpA) rzadko utrzymuje się odpowiednio długo, dlatego F
–
nie otrzymuje (nie zdąży
dostać) całego chromosomu od Hfr, na którego końcu znajduje się druga połówka plazmidu
z „genem transferowym” kodującym fimbrię płciową, dostaje tylko tę część plazmidu, która
była przesłana na początku rozciętego chromosomu… [ufff, pocieszenie w tym, że nie warto
być supermanem – za szybko kończy...] [na wykładzie nie było to wyjaśniane, większość
tego punktu powstała na podstawie Virella, str. 31-34]
Transdukcja
(odkryta w 1952 r.)
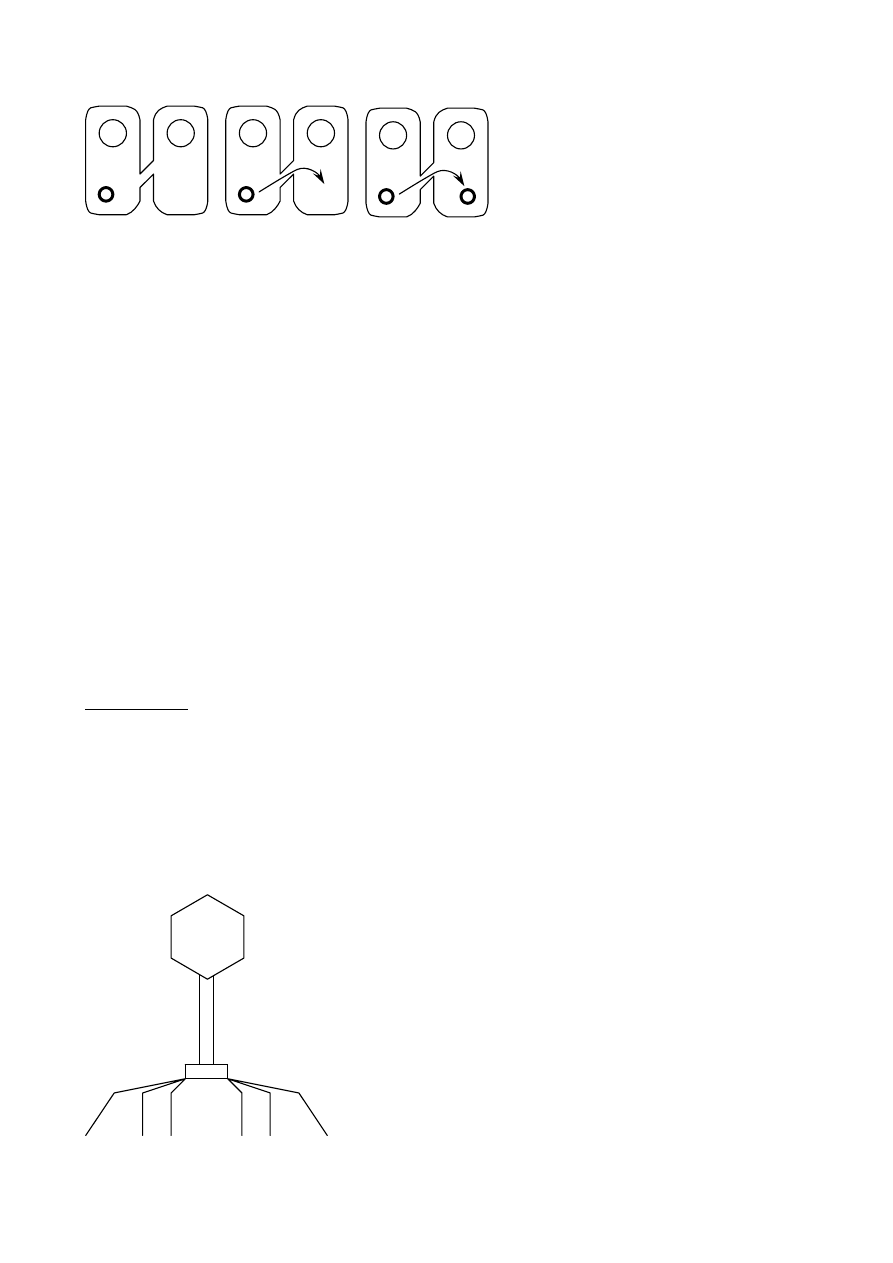
• Jest to proces wymiany informacji genetycznej z udziałem bakteriofagów, czyli wirusów
patogennych tylko dla bakterii (z nazwy tłumacząc „pożeraczy bakterii”)
• Bakteriofagi mają długość około 60 nanometrów, a średnicę główki 22-60 nm. Plan ich
budowy przedstawiono na schemacie.
• Główka zbudowana jest z kapsyny tworzącej kapsyd bakteriofaga, który stanowi
powierzchniową osłonkę białkową, chroniącą znajdujący się wewnątrz materiał genetyczny
– zwykle jedno lub dwulicowe DNA, rzadziej jednoniciowy RNA, ale zawsze tylko jeden typ
kw. nukleinowego
• Ogonek (inaczej szyjka) bakteriofaga zawiera białka z dużą ilością grup sulfhydrylowych (-
SH), one umożliwiają skracanie ogonka
Płytka podstawna
Ogonek
Główka
Włókienka, w ilości szt. 6
www.lek2002.prv.pl | lek2002.xoopiter.com
15

www.lek2002.prv.pl | lek2002.xoopiter.com
Cykl replikacji bakteriofaga
1. Adsorpcja (nie „adherencja”!!!) – łączenie się bakteriofaga z receptorem na powierzchni
komórki bakteryjnej; włókienka i płytka podstawna łączą się z bakterią. Elementy ściany
kom. stanowią receptory dla bakteriofagów, np. u bakterii Gram– to antygeny O i H
2. Dalej następuje penetracja ściany i wstrzyknięcie DNA do bakterii [sama radość…]
3. Faza eklipsy – to czas, gdy wirus jest niewidoczny, jego DNA znajduje się w bakterii,
podlega ono namnożeniu (powstają bakteriofagi lityczne, wirulencyjne, złośliwe)
4. Synteza białek wirusa zachodzi w czasie 20-40 minut i następuje ich połączenie razem z
DNA i utworzenie nowych bakteriofagów w ilości od 50 do 1000, które powodują lizę
komórki bakteryjnej i zostają uwolnione, ale przy tym kompletowaniu może dość
dodatkowo do upakowania do 1% DNA bakteryjnego, co jest przyczyną zjawiska
transdukcji
Jeśli cykl replikacji wirusa przebiega tak jak opisano powyżej, wówczas mówi się o
bakteriofagach litycznych
. Oprócz nich znane są bakteriofagi lizogenne=nielityczne
• Bakteriofagi lizogenne indukują lizogenność bakterii
• DNA tego rodzaju bakteriofagów ulega inkorporacji do genoforu komórki bakteryjnej
(integracja z chromosomem). Daje to stan konwersji lizogennej bakterii. Bakteria żyje i
namnaża się wówczas z wbudowanym DNA wirusa.
• Bakteriofag w takiej formie określamy jako profag – jest on „nieaktywny” i w pewnych
warunkach może ulec indukcji i przejść w stan lityczny (np. pod wpływem UV), ale może
uwolnić się z chromosomu z kawałkiem DNA bakteryjnego
• Zainfekowana bakteria zyskuje nowe możliwości biologiczne wraz z nowym DNA [np.
chorobotwórczość – np. bakteriofag stx i geny toksyny cholery u Vibrio cholerae] – nosi to
nazwę „konwersja lizogenna”
Znaczenie transdukcji
• Bakteriofagi mają zdolność do przenoszenia genów bakteryjnych na zasadzie transdukcji
ogólnej, oraz transdukcji specyficznej (ograniczonej, spontanicznej) związanej z
lizogennością
• Transdukcja ogólna polega na tym, że część chromosomu bakterii „na chama” wciska się
razem z DNA wirusa do jego główki i „na gapę” trafia do innych komórek bakteryjnych.
Następuje bezwładne przenoszenie genów kom. bakteryjnej
• W przypadku transdukcji lizogennej profag nie jest wycinany precyzyjnie z chromosomu
bakterii – tak, że zwykle razem z nim wycinane są sąsiadujące geny gospodarza (bakterii),
które z kolei trafiają do wirusa i dalej do innych bakterii. Jest to przenoszenie genów ściśle
sąsiadujących z miejscem integracji profaga.
Zastosowanie bakteriofagów
• Ponieważ dla każdego gatunku bakterii istnieje szereg bakteriofagów, mogą one znaleźć i
coraz częściej one szerokie zastosowanie w medycynie.
• Diagnostyka – typowanie bakterii przy użyciu fagów – np. w przypadku Salmonella
• Terapia ciężkich, przewlekłych infekcji bakteryjnych, gdy zawodzi terapia antybiotykowa –
np. w oparzeniach skóry. Fagi mają jednak tę wadę, że wymagają sporo czasu na
przygotowanie ich do podania, co ogranicza ich zastosowanie.
www.lek2002.prv.pl | lek2002.xoopiter.com
16

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 5 – poświęcony fantastycznym
przetrwalnikom
© by Wasilij Czapajew
Formy przetrwalne bakterii
Na początku tegóż wykładu została przytoczona historia monarchy Kazimierza Jagielończyka a
następnie historia dotycząca badaczy piramid – generalnie był to wstęp do form przetrwalnych
i na egzaminie ponoć „pytający” luuuuubiiiii ich słuchać…
Oto powyżej wspomniane historya:
1. Kazimierz IV Jagiellończyk (1427-92) – Król Polski (od 1447) i Wielki Książę Litewski (od
1440)– został pochowany w VII 1492 roku i leżał sobie spokojnie ± 500 lat, do V 1973 r.,
gdy ówczesny Kardynał (jeszcze nie papież) Karol Wojtyła zgodził się na otwarcie przez
zespół konserwatorów grobu zawierającego zwłoki króla i jego żony – Elżbiety Rakuszanki.
W efekcie 16 osób, które przy tym były wkrótce zmarło – całość określono jako klątwę
Jagiellończyka [zwanego Kazikiem] – podobną do klątwy egipskiego Tutenchamona.
2. Druga historia jest wszystkim znana – więc nie mam co pisać, no ale dobra… Tutenchamon
był to faraon egipski (skądinąd ciekawy przypadek ortopedyczny, zmarł koło 20-tki po 10
latach panowania, no raczej nie „śmiercią naturalną”…), którego nietknięty przez rabusiów
(a przez co ważki historycznie) grobowiec w Dolinie Królów znalazł lord Howard Carter wraz
ze swoją ekipą. Ogólnie rzecz ujmując umierali kolejni ludzie z tego zespołu (w tym
ostatecznie „w sile wieku” i sam Carter), stąd bajka o klątwie Tutenchamona, a zgony
nastąpiły w wyniku infekcji uaktywnionymi formami przetrwalnikowymi grzybów i bakterii.
Odkryto je m.in. na ścianach grobowca, stąd istnieje w Egipcie zakaz zbliżania się do ścian,
ich dotykania, bo były przypadki zakażeń i to nawet niedawno…
Badania więc na zwłokach i materiale biologicznym niosą za sobą zagrożenie zakażenia
przetrwalnikami. Ustalono, że jakiekolwiek znalezione formy przetrwalnikowe podczas
wykopalisk będą od razu niszczone.
A teraz już do rzeczy – czyli do przetrwalników, zwanych również sporami:
1. Definicja:
Jest to sposób różnicowania się komórek prokariotycznych, który zostaje pobudzony po
umieszczeniu bakterii w warunkach ograniczających dostępność substancji odżywczych.
Możemy dokonać podziału na trzy zasadnicze grupy:
1. klasyczne endospory (endospory)
2. formy pośrednie (egzospory)
3. formy kokoidalne
AD. 1. Endospory – przetrwalniki klasyczne:
• powstają wewnątrz komórki bakteryjnej, z której są uwalniane
• tworzone są przez ok. 150 form bakterii
• prowadzą do tzw. pauzy metabolicznej („śpiączka” bakteryjna)
• niezwykle odporne na czynniki fizyczne (np. UV, czy godzinne gotowanie w temp. 100°C,
stąd gotowanie nie starczy dla sterylizacji, tylko w suszarce przez 30 min. w temp. 180°C
możemy się ich pozbyć) i chemiczne (na antyseptyki)
• mogą przeżyć setki lat, wydobyto z jeziora w USA przetrwalniki, które ocenia się na wiek
ok. 1000 lat, a nawet ostatnio było głośno o przetrwalnikach datowanych na 25 mln lat,
które wyizolowano z bursztynu i które w warunkach sprzyjających przeszły w formy
metaboliczne
• tworzą je tylko laseczki bakterii Gram+ z rodzaju Bacillus (tlenowe) i Clostridium
(beztlenowe), jest jak na razie jeden wyjątek: Coxiella burnetti = Gram– riketsja
powodująca odzwierzęcą gorączkę Q dotyczącą zapalenia płuc i opon mózgowo-
rdzeniowych [C’Hemina – pałeczki nie tworzą takich form]
AD. 2. Formy pośrednie – egzospory:
• są również nietypowe endospory, zwane egzosporami – co brzmi wprost genialnie, lub
inaczej zwane gonidiami
• mówimy, że są to formy odpowiadające przetrwalnikom, ale powstają na zewnątrz komórki
• są odporne na suszę (brak wody), czynniki środowiskowe, brak pożywienia, ale nie odporne
na wysoką temperaturę
• potrafią przetrwać powyżej 7000 lat
www.lek2002.prv.pl | lek2002.xoopiter.com
17

www.lek2002.prv.pl | lek2002.xoopiter.com
• dotyczy to promieniowców – Actinomycetale (należą do bakterii rozgałęzionych,
nitkowatych tworzących pseudogrzybnię, stąd dawniej błędnie klasyfikowane jako grzyby)
• posiadają pseudokonidia/micelle/nitki sporonośne, wystające na zewnątrz komórki
bakteryjnej
• na tych sporonośnych niciach tworzą się konidiospory, czyli zwoje egzospor, tj.
przetwalników zewnętrznych, czyli występujących poza komórką
• pełnią one również funkcje jednostki rozrodczej
• są znacznie mniej odporne na czynniki fizyczne i chemiczne niż endospory klasyczne
(dobrze znoszą jedynie suszę i tzw. niekorzystne warunki środowiskowe), są tylko nieco
bardziej odporne niż formy metabioliczne bakterii
• są formą adaptacji do niekorzystnych warunków środowiskowych
• formy takie tworzy Streptomyces – wytwarzające antybiotyk streptomycynę
AD. 3. Formy kokoidalne:
• nieprawdziwe, nietypowe – stanowią pewien odpowiednik formy egzosporalnej [nie są to
typowe przetrwalniki]
• są to przemijające formy komórek, stabilne przez około 30 dni, odporne na warunki
środowiskowe fizyczne i chemiczne
• giną w temp. 80°C po 10 min.
• powstają w warunkach „stresowych” dla bakterii (np. pełny dostęp tlenu w wypadku
bakterii aerofobnych, braku substancji odżywczych)
• tworzą formy ziarenkowate (kokoidalne) z rzęskami lub bez
• należą do bakterii spiralnych, posiadają lofotrychalnie rozmieszczone 4 do 6 rzęsek
• owe formy tworzą następujące bakterie: Epsilon-Proteobacteria (ε-Proteobacteria),
Campylobacteriaceae (C. jejuni*), Helicobacteriaceae (H.pylori**)
* najbardziej rozpowszechniona bakteria wywołująca chorobę odzwierzęcą, powoduje zap. jelit,
biegunkę, zap. układu pokarmowego, czasem zap. opon mózgowo-rdzeniowych
** powoduje chorobę wrzodową żołądka i uznana jest za karcinogen żołądka (wywołuje raka żołądka)
Przykłady wytwarzających endospory – cd. Ad.1.:
Bacillus anthracis
(laseczka wąglika – wykorzystywana swego czasu jako broń biologiczna w
listach)
• posiada otoczkę polipeptydową
• jest to „mistrz” w wytwarzaniu przetrwalników
• endospora w kształcie „kija bambusowego” położona centralnie (dzięki zastosowaniu
met. Mellera jest koloru czerwonego, nie barwi się w met. Grama, stąd określenie, że
ma strukturę twardą – w miejscu przetrwalnika w barwieniu Grama „puste miejsce”) – met.
Mellera używa 5% kwasu chromowego [„Panie wiedzą, że niszczy pończoszki”] i błękitu
metylenowego ⇒ przetwalnik – czerwony, cytoplazma – niebieska
• metoda też służy do identyfikacji prątków gruźlicy [bo Meller to modyfikacja Ziehl-
Neelsena]
Clostridium tetani
(laseczka tężca)
• długie, dość wąskie leseczki
• bardzo łatwo możemy ulec zakażeniu chociażby przez ukłucie igłą
• szczepionki należy przyjmować co 8-10 lat
• są urzęsione perytrychalnie
• endospora ułożona terminalnie w kształcie owalnym, daje wrażenie, że jest
zewnątrzkomórkowo, ale to nie prawda, bo jest wewnątrzkomórkowo (przypomina „główkę
od szpilki”)
Clostridium botulinum
(laseczka jadu kiełbasianego)
• posiada subterminalnie, owalnie ułożoną endosporę (przypomina „rakietę tenisową”)
• powoduje zaburzenia widzenia, trudności w mówieniu, połykaniu, śmierć – porażenie
ośrodka oddechowego, zatrzymanie akcji serca
• formy urzęsione
Clostridium perfrigens
(laseczka zgorzeli gazowej)
• subcentralne ułożenie endospory
• nie ma urzęsienia
• wytwarza 12 toksyn
• odpowiedzialna za zatrucia pokarmowe i zgorzel
Clostridium difficile
• występuje w przewodzie pokarmowym, bardzo „perfidna” bakteria, produkuje dwie toksyny
www.lek2002.prv.pl | lek2002.xoopiter.com
18

www.lek2002.prv.pl | lek2002.xoopiter.com
• odpowiedzialna za biegunkę poantybiotykową w łagodniejszej postaci (zespół AAD), a w
cięższej rzekomobłoniaste zap. jelita grubego, które nie leczone kończy się śmiercią (zespół
PMC)
• jeżeli w ciągu 36h pacjent podczas terapii antybiotykowej oddał 6 luźnych stolców można
podejrzewać zespół poantybiotykowy, ew. rzekomobłoniaste zap. jelita grubego
• II-ga możliwość na to samo – to biegunki dopiero w 8 tygodni po terapii antybiotykowej
• posiada dwie endospory (wyglądają jak hantle)
• hauteralnie urzęsione
• indukcja przez klindamycynę i ampicylinę, leczenie – metronidazol, wankomycyna
2. Proces tworzenia endospor
• nazywamy to sporulacją
• w warunkach doświadczalnych zachodzi na początku fazy stacjonarnej (patrz wykres str. 8)
• jest procesem złożonym, wieloetapowym
• podczas tych procesów zachodzą zmiany morfologiczne, strukturalne i chemiczne
• zaangażowane jest w to 200 genów, 30 operonów (cytacik: „zobaczcie aż 200 genów dla
zabezpieczenia przetrwania…”)
• trwa 8-10 h
• podczas sporulacji bakterie mogą tworzyć różne substancje czy toksyny, jak np.
Clostridium botulinum – toksynę jadu kiełbasianego, czy laseczki z rodzaju Bacillus
wytwarzają bioinsektycydy – wpływające na niszczenie owadów, co zaczynamy
wykorzystywać
• proces jest inicjowany przez zmniejszenie ilości GTP
• proces odwrotny (czyli powrót z formy przetwalnikowej w metaboliczną) nazywamy
germinacją – „kiełkowaniem”, „kwitnieniem”, jest on dość szybki – trwa od kilkunastu min.
do 1 h; przy czym też mogą się przy okazji wytwarzać różne toksyny (np. laseczka tężca =
Clostridium tetani wytwarza wtedy tetanospazminę)
Stadia tworzenia endospory:
1. inicjacja sporulacji
• związana z niekorzystnymi czynnikami środowiska, np. z niedoborem organicznego
źródła węgla, co odbija się na poziomie molekularnym zmniejszeniem ilości GTP,
indukcja więc zachodzi na poziomie molekularnym
• błona cytoplazmatyczna wpukla się – inwaginacja błony (do wnętrza)(
• po jej oddzieleniu powstaje prespora – zawiera chromosom bakteryjny, zagęszczoną
cytoplazmę z dużą ilością kw. dipikolinowego, który łączy się z jonami Ca
2+
, tworząc
dipikoliniany wapnia dającymi odporność na temp. i zawiera też SASP – małe
kwasorozpu-szczalne cząsteczki białkowe (dające odporność na UV i wzmacniające
odporność na czynniki fizyczne)
2. formowanie endospory dojrzałej
3. uwalnianie
• następuje wskutek lizy ściany kom. bakt.
• pozostanie w takim uśpieniu aż do przyjścia sprzyjających warunków
3. Budowa endospory
Endosporę można podzielić na trzy zasadnicze przedziały:
1. Najbardziej wewnętrzną warstwę stanowi protoplast
• znajduje się w nim chromosom bakteryjny, rybosomy oraz zagęszczona cytoplazma
• znajduje się tu również kw. dipikolinowy (DPA) związany z Ca
2+
zapewniający twardość i
odporność przed wysokimi temperaturami. Tego kw. nie posiadają bakterie i
egzospory!!!
• zawiera też krótkie, niskocząsteczkowe, kwasorozpuszczalne białka SASP
2. Kolejna część to warstwa korowa (tzw. kora endospory)
• zbudowana z peptydoglikanu ale różniącego się od tego znajdującego się w ścianie
bakteryjnej ze względu na niskie usieciowanie
• obecność enzymu GSLE – niezbędny do germinacji (kwitnienia, powrotu do formy
metabolicznej), jest to amidaza, która hydrolizuje korę endopory umożliwiając
uwolnienie protoplastu endospory przy germinacji
• amidozy, hydrolazy potrzebne dla umocnienia nowej kom. bakt.
3. Zewnętrznie znajduje się płaszcz spory (tzw. płaszcz białkowy)
• zbudowany z keratynopodobnego białka
www.lek2002.prv.pl | lek2002.xoopiter.com
19
www.lek2002.prv.pl | lek2002.xoopiter.com
4. ostatnia warstwa, nie zawsze występująca, pokrywa całość – lipoproteinowa błona
zewnętrzna
Uzupełniając (C’H): Endospora jest taką formą bakterii, w której ustały procesy metaboliczne.
Nastąpiła pauza metaboliczna. Stan przetrwania bakterii w formie endospory zwany jest
anabiozą.
Zniszczenie endospor może nastąpić:
• przy zastosowaniu autoklawu (121°C, 1 atm., 30 min.)
• lub suszarki (180°C, 30 min.)
• w wypadku spalenia bakterii [dlatego w czasie epidemii palono dobytek tych, co chorowali]
• inne ciekawe sposoby – np. napromieniowanie dużymi dawkami promieniowania
• jeszcze bardziej absurdalne sposoby – np. umieścić bakterie w obszarze „Ground Zero”
przy wybuchy jądrowym :) [ten sposób poleca Pe$eT – na wykładzie go nie było]
4. Zakażenie
• jest to wniknięcie drobnoustroju do organizmu, którego to konsekwencje mogą nastąpić,
ale nie muszą
• nie jest to termin równoznaczny z chorobą zakaźną
• „Do zakażenia może dojść tu i teraz na tej sali” – jak mawia wiadomo kto [po tych słowach
na sali słyszeć dał się gruźliczy kaszel :)]
• zakażać może komórka, która posiada adhezyny, wlk. 50 kD (należące do lektyn, białek
włókienkowych) znajdujące się na fimbriach zwykłych, kończą się „czynnikiem
kolonizującym”
• każdą bakterię możemy w nowoczesnym ujęciu rozpatrywać jako nośnik białkowych
cząstek powierzchniowych – adhezyn, zlokalizowanych z reguły na fimbriach
• na powierzchni komórek ciała człowieka znajdują się z kolei oligosacharydowe receptory o
masie koło 1 kD – które umożliwiają adherencję (nie „adsorpcję” czy „adhezję”!!!;
adherencja = przyleganie bakterii, adsorpcja/adhezja = przyleganie wirusów!!! – wersja
wykład 2003 r.)
• tzn. na powierzchni śluzówek (kom. epitelialne, endotelialne) są receptory cukrowe
adhezyn
• wiązanie między adhezynami a ich receptorami jest wiązaniem wysokoswoistym,
niekowalencyj-nym, cukrowo-białkowym
• przyszłością jest stosowanie blokerów, które uniemożliwiałyby takie wiązanie
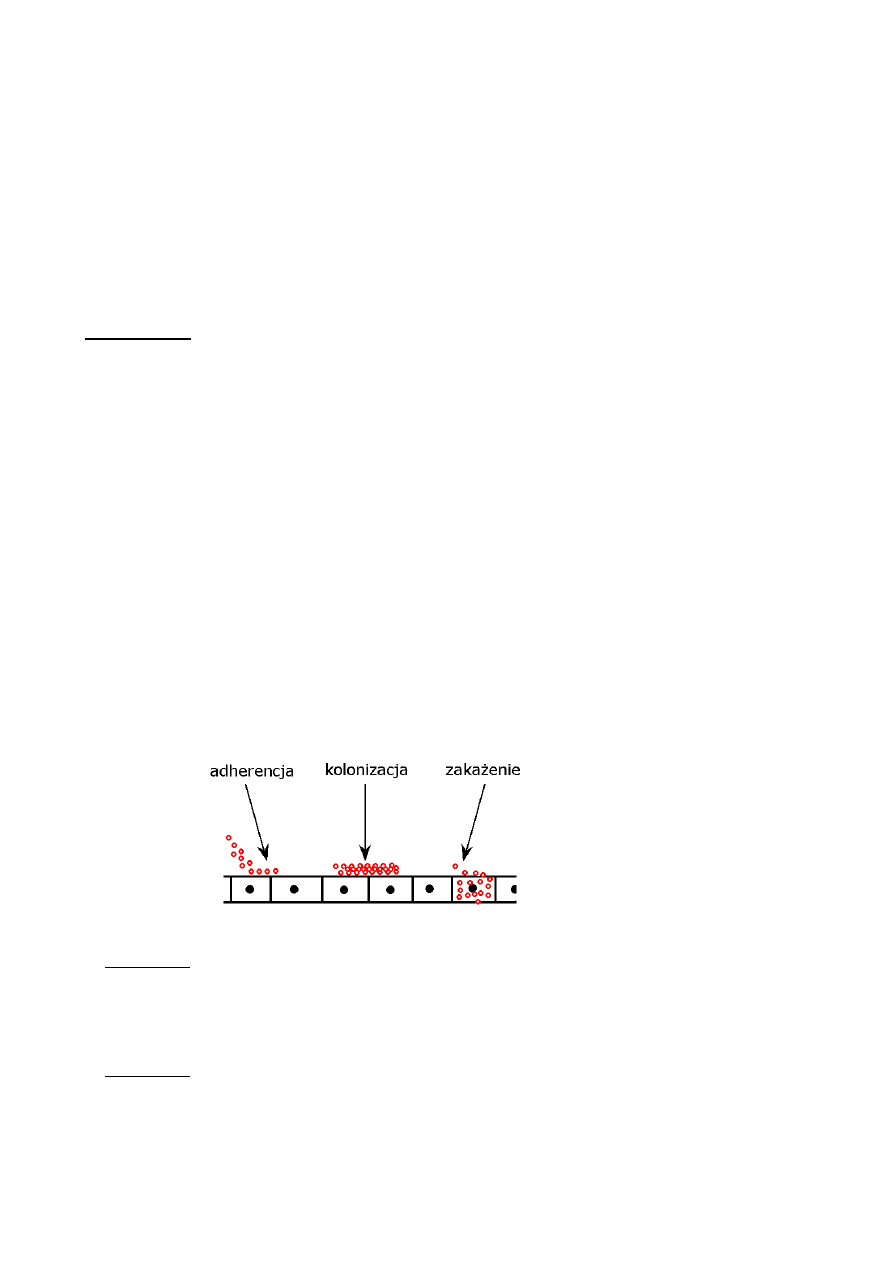
Proces zakażenia dzielimy na następujące etapy:
1. Adherencja 2. Kolonizacja 3. Zakażenie 4. Choroba zakaźna
1. Adherencja
Swoiste niekowalencyjne wiązanie białkowo-cukrowe, czyli połączenie receptora z adhezyną. W
przypadku wirusów jest wysoko swoiste (białka powierzchniowe, glikoproteidy)
Uwaga!!! „adherencja” – termin dotyczy bakterii; „adhezja/adsorpcja” – dot.
wirusów!!!
2. Kolonizacja
Jest to zajęcie błon śluzowych przez drobnoustrój. Wytwarza się tu stan równowagi między
naszym światem makro i światem mikroorganizmów.
Możemy podzielić ją na:
• fizjologiczną, pozytywną dla nas (gronkowce skórne, Lactobacillus) – jak by to kogoś
interesowało: to liczba bakterii które nas kolonizują jest większa od liczby komórek w
www.lek2002.prv.pl | lek2002.xoopiter.com
20

www.lek2002.prv.pl | lek2002.xoopiter.com
naszym ustroju, bo w naszym ciele jest 10
13
komórek, i te komórki są skolonizowane przez
10
14
komórek bakteryjnych, czyli 2 kg z naszej masy to bakterie…
Dochodzi do zasiedlania naszego ciała (prócz krwi, chłonki, płynu mózg.-rdzen. i płuc)
• patologiczną, której zwykle następstwem jest rozwój zakażenia. I w tym momencie
następuje:
3. Zakażenie
Patogen wnika do wnętrza makroorganizmu i rozprzestrzeniania się w nim przez namnażanie,
bo następuje zachwianie stanu równowagi między naszym światem makro i światem
mikroorganizmów ⇒ efekt = rozwinięcie choroby
4. Choroba zakaźna
Jest to patologia narządów i układów organizmu człowieka spowodowana zakażeniem
Leczenie:
grupą symbiotyków:
• prebiotyki – polisacharydowe cukry wiążą się z adhezynami
• protiotypy – wspomagają kolonizację fizjologiczną – czyli poczciwych, przyjaznych bakterii.
A one nie dopuszczają do kolonizacji patologicznej
www.lek2002.prv.pl | lek2002.xoopiter.com
21
www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 6 – Sterylizacja itp.
PN 124/0045-535/73
UWAGA!!! Informujemy, iż mieliśmy tylko jeden stenograficzny zapis z tego wykładu i przy tym
mieliśmy wielkie problemy z odszyfrowaniem wszystkich znaków postawionych przez oddaną
nam stenotypistkę… Proponujemy porównać go z jakimś innym źródłem, bo może zawierać
błędy…
Sterylizacja
• zniszczenie=usunięcie wszystkich form żywych drobnoustrojów (bakterii, wirusów,
grzybów, form przetrwanych, zarodników, mykoplazm, itp.), za wyjątkiem prionów!!!
Dezynfekcja
• niszczenie drobnoustrojów w środowisku człowieka, szczególnie tych chorobotwórczych, ale
to nie prowadzi do sterylizacji
Antyseptyka
• niszczenie drobnoustrojów na skórze, błonach śluzowych i ranach
Aseptyka
• składają się na nią 3 w/w procedury
Metody dezynfekcji:
1. fizyczne:
− woda o temp. 93-95°C przez 10-30 min.
− para wodna o temp. 105°C-110°C przez 5-10 min.
− promieniowanie UV (λ ≈ 250-260 nm)
2. chemiczne
− pochodne fenolu
− związki chloru lub jodu (tzw. jodofory)
− związki z aktywnym tlenem (np. H
2
O
2
)
− alkohole (propanol, izopropanol, etanol)
− aldehydy (glutarowy 0,2% dla 2 m
2
, mrówkowy=formaldehyd)
− czwartorzędowe związki amonowe – QAC
− biguanidy (chlorheksydyna)
Wymagania dla handlowych środków dezynfekcyjnych:
) działanie wiruso-, baterio- i grzybobójcze w temp. pokojowej
) aktywność wobec substancji biologicznych (krew, białka, związków z jonami Ca
2+
, Mg
2+
)
) nie doprowadzanie do korozji narzędzi, sprzętu
) działanie myjące
) łatwość spłukiwania
) łatwość stosowania
) trwałość roztworu użytkowego – 7 dni
) trwałość środka w temp. pokojowej – 2-3 lata
) możliwość zastosowania w myjniach, np. ultradźwiękowej lub ???? w temp. 60°C
Sterylizacja:
− jej skuteczność określa się jako ryzyko przeżycia 1 drobnoustroju lub mniej na 1 mln
wysterylizowanych jednostek produktu [1≤1000000]
− obowiązują odpowiednie procedury – przy stosowaniu pary wodnej: EN-554 (121°C, 20
min., 1 atm.), tlenku etylenu: EN-550, radiacyjnie: EN-552, przy użyciu plazmy, brak norm
dla gorącego powietrza, a w 80% szpitali stosowane
− problem opakowań sterylizacyjnych w świetle norm EN
− metody kontroli – fizyczne, biologiczne, chemiczne
− „stymulatory” penetracji czynnika bójczego, np. test PCD
− walidacja – potwierdzenie skuteczności (9 różnych parametrów)
Warunki sterylizacji dla prionów:
− para nasycona, 134°C, 1h
− NaOH, 1M, 24h
− NaOCl, 5%, 2h
− siarczan dodecylu, 3%, 100°C, 10 min.
www.lek2002.prv.pl | lek2002.xoopiter.com
22

www.lek2002.prv.pl | lek2002.xoopiter.com
− izotiocyjanian guanidyny – 6M, 15 min.
Blok operacyjny (sala operacyjna):
− oddzielony od reszty szpitala pod względem wentylacji, bez okien, drzwi zamykane
automatycznie
− jednokierunkowy przepływ powietrza
− nadciśnienie min. 15 hPa
− klimatyzowane jałowym powietrzem
− wyciąg powietrza dołem – ok. 80%
− jednokierunkowa śluza dla personelu i pacjentów
− filtry HEPA o skuteczności 99,999% dla cząstek 0,1 μm
− bezpieczne powietrze (sala czysta ≤ 30 efu/m
3
, sala używana ≤ 100 efu/m
3
)
− temp. 18-22°C, wilgotność powietrza – 40-55%
− w układzie klimatyzacyjnym nawilżanie tylko parowe a nie wodne (problem z Legionella pn.)
− niski poziom głośności urządzeń klimatyzacyjnych
− wątpliwa przydatność lamp UV i urządzeń przepływowych
Systemy przewietrzania w sali operacyjnej:
− konwencjonalny
− wyporowy
− laminarny – prędkość 0,25-0,5 m/sek. – ogranicza turbulencje
− częściowa recyrkulacja – nie w Polsce (układ otwarty)
System laminarny pionowy – najmniej zanieczyszczeń na m
3
.
Czym dezynfekowane jest powietrze:
− HEPA, ULPA, filtry absolutne
− UV-lampa, aparaty przepływowe
− dekontaminacja miejscowa metodą MFI Air Cleaning
Rodzaje dezynfekcji narzędzi:
− dezynfekcja wstępna (ochrona pracownika)
− dezynfekcja – woda do 90°C
− myjnie ultradźwiękowe
− automaty myjąco-dezynfekujące
− dezynfekcja manualna
Po każdej operacji – dekontaminacja = mycie i gruntowne sprzątanie po dniu operacyjnym
Błędy dezynfekcji:
− nieodpowiednia mieszanina lub czas
− naczynia bez przykrycia
− pozostawienie brudnych narzędzi do wyschnięcia
− pomieszczenie bez wentylacji
− brak walidacji
„Flora bakteryjna skóry pacjenta stanowi najpoważniejsze źródło egzogennego i endogennego
zakażenia miejsca operowanego”.
Przygotowanie pacjenta do zabiegu:
− 30-dniowa abstynencja palenia
− leczenie istniejących zakażeń
− usunięcie włosów z pola operacyjnego – strzyżenie, unikanie golenia
− środki antyseptyczne
− jałowe serwety
− prysznic w płynie antyseptycznym
− pole operacyjne myć wodą z detergentem lub mydłem
− profilaktyka antybiotykowa
Infekcyjne odpady szpitalne – sposoby unieszkodliwiania:
www.lek2002.prv.pl | lek2002.xoopiter.com
23

www.lek2002.prv.pl | lek2002.xoopiter.com
− spalanie (piece c.o., procesy pirolityczne, ekologiczne)
− sterylizacja parowa (dyrektywa UE, WHO)
− makro i mikrofale
− met. radiacyjne
− dezynfekcja chemiczna lub gazowa (chlor, tlenek etylenu)
Zmiana klasyfikacji odpadu na komunalny.
„Najważniejszym wektorem transmisji zakażeń szpitalnych są ręce personelu medycznego!”
Mikroflora skóry rąk:
− przejściowa – powierzchniowa, obca, pochodząca z otoczenia szpitalnego, nie namnaża się
na skórze, łatwa do usunięcia, wysoce chorobotwórcza; znaczenie w higienicznym
opracowaniu rąk
− stała, rezydująca – namnaża się w szczelinach skóry, mieszkach włosowych, gruczołach
łojowych i potowych, trudna do usunięcia za pomocą środków antyseptycznych, ma niższy
poziom patogenności; znaczenie w chirurgicznym opracowaniu rąk
Mikroflora stała i przejściowa skóry rąk:
− Streptococcus
− Staphylococcus aureus – MRSA, VISA
− Streptococcus viridans
− Enterokoki (E. faecalis) – VRE
− E. coli, Candida albicans – paznokcie, fałdy skórne
− pałeczki ???
MIEJSCE NA KOREKTĘ:
www.lek2002.prv.pl | lek2002.xoopiter.com
24

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 7 – Chorobotwórczość
drobnoustrojów
PN 124/0045-535/73
Wstęp, definicje
Bakteriemia – obecność bakterii we krwi krążącej, czyli zakażenie krwi. Może być egzogenna
(bakterie pochodzą z zewn. źródła) lub endogenna (własne bakterie organizmu
– np. przy uszkodzeniu śluzówek podczas endoskopii, po wizycie
stomatologicznej, itp.)
Posocznica – zespół objawów określany jako SIRS (zespół uogólnionej reakcji zapalnej – ang.
Systemic Inflammation Response Syndrome), w przypadku udowodnionej
mikrobiologicznie lub klinicznie obecności bakterii we krwi (czyli posocznica =
SIRS + bakteriemia)
Manifestacja SIRS:
− gorączka powyżej 38°C lub obniżenie temp. poniżej 36°C
− częstość tętna – powyżej 90 ×/min.
− częstość oddechu – powyżej 20 ×/min.
− leukocytoza – powyżej 12 tys./μl lub znaczna leukopenia (w stanach z upośledzoną
odpornością)
Następstwem SIRS’u jest wstrząs endotoksyczny, który przechodzi w zespół MODS – zespół
wieloukładowej dysfunkcji narządowej (Multi Organ Dysfunction Syndrome). Zespół ten
bezpośrednio poprzedza zgon (prawie zawsze).
• Ludzie znają około 15 000 gatunków bakterii, z czego około 300-500 jest chorobotwórcza
lub potencjalnie chorobotwórcza
• Podział bakterii chorobotwórczych:
1. bakterie chorobotwórcze wyłącznie dla zwierząt (np. Salmonella pullorum – drób, S.
abortus ovis – dla koni)
2. bakterie chorobotwórcze dla zwierząt i ludzi – powodują u ludzi „zoonozy” (choroby
odzwierzęce) (np. Brucella – u bydła, owiec, kóz choroba Banga, a u ludzi – bruceloza;
Bacillus antracis – wąglik u bydła i ludzi; Chlamydia psittaci – wywołuje papuzicę u
ludzi, Coxiella burnetti – wywołuje gorączkę Q)
3. bakterie chorobotwórcze wyłącznie dla ludzi [np. Salmonella typhi i paratyphi (dury),
Vibrio cholerae, Shigella (czerwonka bakteryjna), Chlamydia pneumoniae (zap. płuc
śródmiąższo-we), Chlamydia trachomatis (choroby ukł. płciowego i stawów)]
• Chorobotwórczość danej bakterii warunkowana jest przez jej wirulencję. Na wirulencję z
kolei składają się 2 cechy – inwazyjność oraz toksyczność
• Inwazyjność to zdolność do wnikania mikroorganizmu do makroorganizmu, namnażania się
w nim i rozprzestrzeniania
• Toksyczność to zdolność do produkowania toksyn (inaczej toksykogenność).
• Jako czynniki wirulencji rozumiemy takie czynniki, które powodują przekształcenie
drobnoustroju awirulentnego w wirulentny. Definicja ta implikuje jednocześnie fakt, że
poszczególne szczepy w obrębie danego gatunku bakterii mogą znacznie różnić się
wirulencją – „każdy lekarz musi o tym pamiętać”
• Ewolucja doprowadza do wzrostu wirulencji bakterii chorobotwórczych.
Geny odpowiedzialne za wirulencję
O co chodzi z „Genami odpowiedzialnymi za wirulencję” bakterii przedstawia schemat:
www.lek2002.prv.pl | lek2002.xoopiter.com
25
www.lek2002.prv.pl | lek2002.xoopiter.com
OPIS RYSUNKU:
3. geny sposobu życia patogenu
2. geny związane z wirulencją
1. prawdziwe geny wirulencji
GENY WIRULENCJI
1. Kodują one determinanty bezpośrednio warunkujące wirulencję danego
mikroorganizmu, występują tylko u patogenów, nie występują w szczepach
wirulentnych
2. Kodują czynniki pomocnicze, regulujące ekspresję genów wirulencji. Mogą występować
w szczepach niepatogennych
3. Kodują oportunistyczne czynniki wirulencji, odpowiedzialne za strategię przetrwania
patogenu w organizmie człowieka, występują też u bakterii oportunistycznych
TOKSYNY:
− Dzielimy je na:
1. egzotoksyny
2. endotoksyny
EGZOTOKSYNY
ENDOTOKSYNY
Sekrecja
+ –
Właściwości
chemiczne
białka,
polipeptydy
lipoplisacharyd (LPS) – dokładnie
lipid A znajdujący się w błonie
zewnętrznej będącej składnikiem
ściany komórkowej bakterii Gram–.
Uwalnia się przy degradacji kom.
bakteryjnej
Efekt kliniczny
ukierunkowany SIRS
Toksyczność
bardzo wysoka (dawka
śmiertelna dla zwierząt 1-10 μg)
niska (dawka śmiertelna dla zwierząt
200-400 μg)
Antygenowość
(immunogenność)
wysoka słaba
Kontrola syntezy
geny plazmidu lub chromosomu
zawsze geny chromosomu
Zależność od
temp.
ciepłolabilne [ciepłochwiejne]
(ulegają inaktywacji w temp.
65°C w ciągu 30 min.)
ciepłostałe
(ulegają inaktywacji w temp. 100°C i
powyżej 30 min.)
ENDOTOKSYNY
• Endotoksyny [pojęcie wprowadził Pfeiffer (czyt. Fajfer) w 1892 r.] to toksyny bakterii Gram
ujemnych. Chemicznie jest to liposacharyd – LPS – a więc lipid połączony z resztą cukrową
• Endotoksyna znajduje się w błonie zewnętrznej bakterii G–. Jest ona uwalniana w czasie
rozpadu komórki, co faktycznie wiąże się z jej śmiercią. Endotoksyna składa się z trzech
części – zewnętrznej („O”) – specyficznej [ta część jest zbudowana z sacharydów], części
rdzeniowej oraz części lipidowej – tzw. Lipidu A – stanowiącego większą część toksyny
• Pfeiffer spostrzegł, że uogólniony rozwój choroby bakteryjnej indukuje objawy wstrząsu
endotoksycznego, związanego jak wówczas uważano z uwalnianą endotoksyną
Endotoksyny – naprawy ciągłe i bieżące
www.lek2002.prv.pl | lek2002.xoopiter.com
26

www.lek2002.prv.pl | lek2002.xoopiter.com
CHEMICZNIE
• Jest to liposacharyd LPS – złożony w większości z lipidu A
SEKRECJA
• W wypadku endotoksyn nie można mówić o sekrecji, bowiem uwalnia się ona ze ściany
bakterii w wypadku lizy, co dzieje się w czasie intensywnej odpowiedzi immunologicznej, w
czasie podziałów i wzrostu bakterii, przy podaniu zbyt dużej dawki antybiotyku co również
prowadzi do lizy komórki
KLINIKA
• Klinicznie endotoksyny pojawiające się w ustroju wywołują SIRS [zespół uogólnionej
odpowiedzi zapalnej – System Inflammatory Response Syndrome]. Jest to uogólniona
reakcja zapalna przebiegająca z uwolnieniem szeregu mediatorów zapalnych – m.in. IL-1,
IL-6, TNF-α…
• Daje następujące objawy:
o
gorączka z temp. ↑ 38°C, względne temp. ↓ 36°C
o
tętno: ↑ 90 ×/min.
o
częstość oddychania: ↑ 20 ×/min.
o
leukocytoza – ↑ 12 tys./μl, ewentualnie leukopenia – ↓ 3 tys./μl
• SIRS jest wynikiem zakażenia krwi. Może dojść do wstrząsu endotoksycznego,
objawiającego się spadkiem ciśnienia poniżej 90 mmHg, lub jego obniżeniem o ponad 40
mmHg. Razem z innymi zmianami we krwi we wstrząsie endotoksycznym rozwija się
kwasica metaboliczna. Śmiertelność we wstrząsie septycznym wynosi 50-70%
• MODS [multi organ dysfunction syndrome – zespół niewydolności wielonarządowej] jest to
stan rozwijający się w wyniku wstrząsu septycznego i prowadzący nieuchronnie do śmierci
(istnieją szczepionki, ale słaba jest na nie odpowiedź)
TOKSYCZNOŚĆ
• Toksyczność LPS jest w sumie mała, tak więc aby wywołać objawy trzeba sporo
endotoksyny. Np. zatrucie myszy wymaga 200-400 jednostek [śmierć teściowej – po
podaniu 10
69
jedn. na kg masy ciała :)]
IMMUNOGENNOŚĆ
• LPS jest słabo immunogenny
WPŁYW TEMPERATURY
• LPS jest termostabilny – to oznacza w praktyce, że nie zmienia swej struktury po
zadziałaniu temp. 100°C przez czas 30 minut
KODOWANIE
• Gen LPS znajduje się na chromosomie bakteryjnym
EGZOTOKSYNY
• Egzotoksyna [gr. toksicon – trucizna] jest związkiem wydzielanym przez komórkę
bakteryjną na zewnątrz. W przeciwieństwie do egzotoksyn – endotoksyny wywołują
niespecyficzny efekt ogólny
• Obecnie znamy około 240 egzotoksyn, wśród których na szczególną uwagę lekarza
zasługują:
o
Cytolizyny – jest ich około 90; powodują „efekt cytolityczny”, dlatego określa się je
też jako toksyny cytolityczne
o
Enterotoksyny – są to toksyny działające na przewód pokarmowy (biegunka itp.)
• Cytolizyny powodują efekt cytolityczny działając toksycznie na błonę komórkową.
Oddziałują one specyficznie z cholesterolem i wbudowują się w błonę komórki, gdzie pełnią
rolę kanału jonowego. Napływ jonów powoduje obrzęk cytoplazmy i zniszczenie komórki.
• Do cytolizyn zaliczamy m.in.: leukocydyny (niszczące leukocyty), streptolizyny,
hemolizyny, pneumolizyny, listeriolizyna
• Istnieje też pewna grupa szczególnie „popularnych” toksyn, chętnie nabywanych przez
naszych klientów – zaliczamy do nich:
o
„jad” błoniczy – DT – Corynebacterium dyphteriae – 61kD (A – 21kD, B – 40kD)
o
toksyna tężcowa – tetanospazmina – Clostridium tetani – 150kD
o
jad kiełbasiany – botulina – Clostridium botulinum – 150kD (A – 50kD, B – 100kD)
dwie ostatnie to tzw. neurotoksyny (bo mają powinowactwo do neuronów)
• Choroby wywołane przez w/w toksyny są określane jako toksykozy (jadzice), a podstawą
ich leczenia jest stosowanie antytoksyn – czyli surowic leczniczych. W leczeniu toksykoz
www.lek2002.prv.pl | lek2002.xoopiter.com
27

www.lek2002.prv.pl | lek2002.xoopiter.com
podaje się również antybiotyki, należy jednak podkreślić, że pełnią one jedynie rolę
wspomagającą
Egzotoksyny – budowa, eksploatacja
CHEMICZNIE
• Są to proste polipeptydy, wykazujące ciekawą budowę [i jeszcze ciekawszą eksploatację] –
składają się bowiem z 2 łańcuchów połączonych mostkiem disiarczkowym (S–S). Części te
zwyczajowo określało się jako łańcuchy lekki i ciężki – współcześnie natomiast jako
podjednostka A oraz B. Należy zapamiętać, że żadna z tych podjednostek samodzielnie nie
wykazuje właściwości toksyny
o
podjednostka A [zapamiętaj: „A” jak Active (z ang. aktywna, czyt. aktif)] –
zwyczajowo łańcuch lekki [t. błonicy – 22 kD] jest to „toksyna – toksyna”
posiadająca właściwości enzymatyczne – to ona odpowiada za efekt toksyczny
o
podjednostka B [zapamiętaj: „B” jak Binding (z ang. wiążąca, czyt. bajnding)] –
zwyczajowo łańcuch ciężki [t. błonicy – 40 kD], ona odpowiada za wiązanie z
receptorem [zakotwicza toksynę na błonie kom.]
KODOWANIE
• Najczęściej kodowane są na plazmidach, profagach, transpozonach
KLINIKA
Toksyna błonicy (z Corynebacterium dyphteriae):
• podjednostka A – posiada aktywność enzymatyczną, penetruje do wnętrza komórki i
transformuje ona (bo jest transferazą) dinukleotyd nikotynamidoadeninowy (NAD) →
adenina rybozylowana → ADP-ryboza → która z kolei blokuje syntezę białek komórki
inhibując czynnik EF-2 [eukariotyczny czynnik elongacji-2]. Powoduje to efekt
cytotoksyczny
• podjednostka B wiąże się z odpowiednim receptorem na powierzchni komórki, umożliwiając
translokację jednostki A do jej wnętrza
• toksyna ta jest wydzielana jedynie przez szczep zakażony profagiem B. Toksyna ta
wykazuje działanie neurotoksyczne [poraża n. ruchowe – zwłaszcza nn. gałek ocznych,
gardła (IX i X n. czaszk., kończyn dolnych (n. strzałkowego), wywołuje problemy
przełykaniem, uszkodzenie mięśnia sercowego i charakterystyczne nacieczenie migdałków
(martwica komórek epitelalnych), ostatecznie doprowadza do nagłej śmierci.
• miejscowo w gardle toksyna uszkadza nabłonek i powoduje tworzenie tzw. błon rzekomych
(na ścianach gardła, migdałkach, języczku podniebiennym i podniebieniu miękkim)
Toksyna botulinowa/jadu kiełbasianego (z Clostridium botulinum):
• podjednostka A – ma 50kD, odpowiada ona za zahamowanie wydzielania acetylocholiny w
synapsach płytek nerwowo-mięśniowych, dając obraz kliniczny porażenia wiotkiego
• podjednostka B – ma 100kD, wiąże się z receptorami GD1b – jest to sjaloglikozyd
znajdujący się na płytkach nerwowo-mięśniowych
Tetanospazmina/toksyna tężcowa (z Clostridium tetani):
• działa na synapsy neuronów pośrednich rdzenia kręgowego, ponieważ posiadają one dla
niej receptory
• hamuje wydzielanie neuromediatorów (GABA, glicyny, leucyny) – powoduje zanik
hamowania motoneuronów, co objawia się spastycznymi skurczami mięśni (porażenie
spastyczne)
• toksyna ta wiąże się z białkiem GT1 i białkiem GD1b – receptorami tetanospazminy
• laseczki tężca [Clostridium tetani] są bardzo powszechnymi bakteriami, których
przetrwalniki występują powszechnie w glebie i kurzu. Można je złapać np. zakuwając się
szpilką. Chirurdzy [Mayday, uważaj!] muszą zapamiętać, że przetrwalniki mogą się też
uchować w bliznach po operacjach – dlatego też przy rewizji danego zabiegu nie otwieramy
pacjenta po bliźnie.
• początkowo tężec objawia się szczękościskiem [po 3 tyg. od zakażenia], potem skurcze
obejmują pozostałe partie mięśni. Śmiertelność w pełni rozwiniętej choroby sięga 50%.
Toksyna cholery (z Vibrio cholerae):
• toksyna ta pod względem budowy podobna jest do termolabilnej (LT) toksyny E. coli. Obie
toksyny działają za pośrednictwem cyklicznych nukleotydów (V.cholerae przez cAMP, E. coli
przez cGMP), a efekt ich działania jest bardzo szybki. Jedną z różnic między toksynami jest
fakt, że toksyna E. coli kodowana jest przez plazmid (i aktywuje cyklazę guanylową),
www.lek2002.prv.pl | lek2002.xoopiter.com
28

www.lek2002.prv.pl | lek2002.xoopiter.com
natomiast toksyna cholery kodowana jest przez gen na transpozonie (aktywuje cyklazę
adenylową).
• toksyna cholery składa się z jednej podjednostki A [26 kD] otoczonej przez 5 podjednostek
B [82 kD] ⇒ wzór: AB
5
. Podjednostka A powoduje aktywację cyklazy adenylowej, co daje w
efekcie obfitą biegunkę sekrecyjną (utrata Na, Cl, K, węglanów); mechanizm blokowania
polega na przeniesieniu ADP z NAD (dinukleotyd nikotynamidoadeninowy) na podjednostkę
α białka G
s
, hamując jego zdolność do hydrolizy GTP → GDP (co warunkuje jego
„wyłączenie”), przez to białko G
s
jest zablokowane w formie aktywnej, pobudzającej
cyklazę co produkcji cAMP
Werotoksyna/toksyna czerwonkowa/toksyna Shiga (z Shigella dysenteriae typu I):
• powoduje wzrost stężenia cGMP, inaktywację 28S
rRNA (składnik eukariotycznego
rybosomu 60S, poprzez odszczepienie od niego adeniny)
• jest odpowiedzialna za biegunkę krwotoczną = krwotoczne zapalenie okrężnicy oraz zespół
hemolityczno-mocznicowy (tzw. HUS = rozsiane uszkodzenie śródbłonka, zespół rozsianego
wewnątrznaczyniowego wykrzepiania – DIC, hemoliza erytrocytów oraz niewydolność
nerek)
• wrotami zakażenia jest spożywanie mielonki i słabo przegotowanej wołowiny :)
Toksyny ziarniaków
• TSST-1 (pierwsza toksyna zespołu wstrząsu toksycznego) – jest wydzielana przez
Staphylococcus aureus
– odpowiada za zespół wstrząsu toksycznego, występujący np. u
kobiet używających tamponów wysokoabsorpcyjnych [swego czasu modnych w USA w
latach 70. – mogły być rzadziej wymieniane ⇒ istny raj – inkubatornia dla St. saprothyticus
i St. aureus]
• toksyny erytrogenne A, B, C – są toksynami paciorkowcowymi, odpowiedzialnymi za
podobny zespół wstrząsu toksycznego
• powodują gorączkę, wymioty, biegunkę, rumieniową wysypkę, bóle mięśniowe,
niewydolność wielonarządową, wstrząs i ostatecznie śmierć
Toksyna krztuścowa (z Bordatella pertusis):
• składa się z dwóch regionów – A (aktywnego) i B (wiążącego)
• region A ma aktywność transferazy i przenosi ADP z NAD (dinukleotyd
nikotynamidoadeninowy) na białko G
i
(białko G „hamujące”)
• rybozylowane białko G
i
nie jest zdolne do wiązania i hamowania cyklazy adenylowej, co
doprowadza do objawów nadprodukcji cAMP komórkach
• pojawia się hipogligemia i wrasta możliwość anafilaksji
www.lek2002.prv.pl | lek2002.xoopiter.com
29

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 8 – o zakażeniach, odporności
© by Iron Maiden
Zagrożenia zakażeniem nie zmieniły się od wielu mln. lat natomiast zmieniają się środki
terapeutyczne i to nas właśnie poniekąd ratuje.
Ciekawe jest, że 1/3 zgonów spowodowana jest chorobami infekcyjnymi – więcej zgonów
powoduje głód oraz urazy i wypadki [w tym wypadki samochodowe, lotnicze, kolejowe,
motocyklowe, rowerowe, deskorolkowe, wrotkowe, hulajnogowe, windsurfingowe, zderzenia
taknowców, kraksa stacji MIR ze statkiem transportowym Progres na skutek defektu modułu
PIERD – prototypowy inercyjny emiter rotacyjno-defleksyny, wypadki tramwajowe,
autobusowe, TIR-owe, śmierć kierowców Maluchów w skutek przyspieszenia 30G, które
odczuwa człowiek podczas przyspieszana na IV biegu – a więc jak śpiewa Skiba: „Mały Fiat
przetrwa jeszcze 1000 lat!” Brawa dla niego!]
Organizm reaguje na zakażenia odpowiedzią odpornościową, której zadaniem jest zniszczenie
czynnika zakażającego lub przynajmniej ograniczenie jego działalności. Mechanizmy obronne
człowieka osiągnęły maksymalny poziom efektywności, jednak drobnoustroje ciągle zwiększają
swoją wirulencję.
Wyróżniamy:
• odporność naturalną (wrodzoną, nieswoistą)
• odporność nabytą (swoistą) składającą się z odp. komórkowej i humoralnej.
TEKST UMORALNIAJĄCY: „w 10 min. po wypaleniu papierosa zmniejsza się efektywność
odporności”.
Dawka zakażająca patogenem odgrywa olbrzymią rolę w strategii pokonywania mech.
odpornościowych. I tak np. w 1956/7 r. Krulezniew badał upośledzone umysłowo dzieci [ufff,
jakie to szczęście, żem się trochę później urodził], zakażał je WZW typu A i okazało się, że
dawka kału z wirusem A zap. wątroby zawsze prowadząca do choroby wynosi 1 g. Z kolei w
przypadku Wirusa B starczy 0,025 ml surowicy (2,8 × 10
10
cząstek HBV). Ze względu na
stosunkowo małą dawkę zakażającą na listach terrorystycznych znajdują się wirus Ebola (1-
10 sztuk), wąglik (2000 przetrwalników w aerozolu).
Podobno 95% studentów AM posiada przeciwciała przeciw WZW A – to znaczy, że każdy zjadł
w swym życiu min. 1 gram kupy!!! [ja tam wolę z ketchupem… bo wg starej maksymy z
branży spożywczej: „w pomidorach nic nie widać i każdy syf da się w przemycić”].
Wysoka dawka patogenu przełamuje barierę odpowiedzi naturalnej…
Odporność naturalna
• niezwykle istotna w zapobieganiu rozwoju zakażenia
• w następstwie kontaktu z patogenem, jeśli odporność nie jest upośledzona (prawidłowe
odżywianie, brak stresu) reaguje na czynnik zakażający, powoduje brak choroby
(oczywiście jeżeli dawka nie przełamie wydolności mechanizmów naturalnych)
• Mechanizmy:
1. Brak swoistości – skierowanie przeciwko różnym patogenom
2. Nie jest zależna od kontaktu z czynnikiem chorobotwórczym (nie jest zależna od
immunizacji, czyli „edukowania” mech. odpornościowego do swoistej odpowiedzi wobec
danego drobnoustroju jak w przypadku odp. nabytej)
3. Nie posiada pamięci immunologicznej
4. Nie podlega restrykcjom tkankowym, niezależna od HLA
Odporność naturalna ulega zmniejszeniu w wyniku, jak już wspomniano niedożywienia, stresu,
zwiększonej pracy. W sposób naturalny zależny od cyklu menstruacyjnego (u kobiet co 28-30
dni następuje obniżenie zdolności odpornościowej). [Biedne jesteście – nie dość, że gorzej
tolerujecie alkohol, to jeszcze co 20 dni macie zmniejszoną odporność…] [Tej! Lizus! Lizus!]
Jeżeli więc połączymy te dwa czynniki (obniżenie odporności oraz zwiększenie dawki patogenu)
nastąpi choroba infekcyjna.
5. Skład odp. naturalnej
• spontaniczne wł. ochronne osocza (w skład tego sytemu wchodzi działanie bakteriobójcze
dopełniacza)
• zespół kom. krwi, fagocytów wywołujących odp. spontaniczną kom. odp. nat.
6. Naturalne mechanizmy ochronne
• bariery anatomiczne (np. naskórek) – jak nas pies pogryzie to go przerwie i można dostać
wścieklizny [od nietoperza też… – mam w tym doświadczenie ;-)]
• fagocytoza
www.lek2002.prv.pl | lek2002.xoopiter.com
30
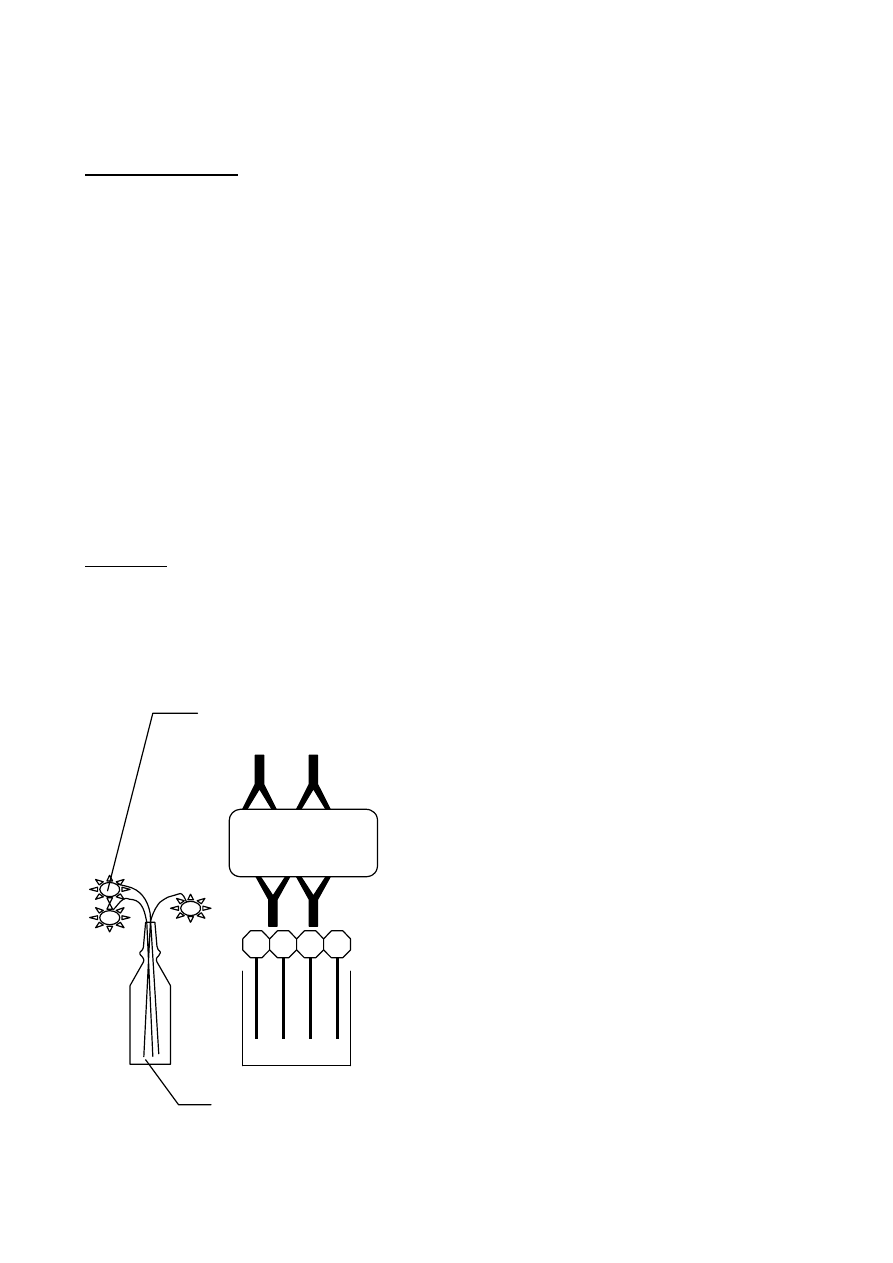
www.lek2002.prv.pl | lek2002.xoopiter.com
• bezpośredni kontakt aktywuje limfocyty cytotoksyczne
• czynniki osoczowe: układ dopełniacza, interferon, lizozym
• płyny ustrojowe – pot, łzy, sok żołądkowy, czy półsyntetyczny olej przekładniowy o klasie
lepkości SAE 80W90
Odporność nabyta
–
jest związana z pozostawieniem pamięci immunologicznej
–
jest swoista
–
musi być spowodowana immunizacją ustroju
–
odp. nabytą dzielimy na czynną i bierną
–
odp. ta jest szybsza od „pistoletu maszynowego” – wiadomo kto powiedział tak kultowy
tekst
1. Odp. czynna naturalna jest związana z procesem immunizacji w wyniku przechorowania.
Dzięki temu układ wyedukowany i może szybko i swoiście odpowiedzieć przy następnym
kontakcie z danym patogenem.
Odp. czynna sztuczna
następująca przez podanie mikroorganizmów, np. przez
szczepienie –odp. czynna [„pytający”] to tak, jakby ktoś kupił gorzelnię, by robić sobie
wódkę [Lodowa RULZ]
2. Odp. bierna naturalna to otrzymywanie przeciwciał od matki razem z mlekiem matki, czy
przez łożysko
Odp. bierna sztuczna
to podanie przeciwciał (np. w przypadku jaglicy), czyli gotowych
produktów; jest ona krótka, przemijająca, stosowana tylko w wypadku konkretnej choroby
np. przy ukąszeniu jadem żmii podanie antytoksyn
Odp. bierna [„pytający”] – to tak, jakby ktoś pił wódkę
Procesy aktywujące poszczególne etapy odpowiedzi immunologicznej
:
Dopełniacz [inaczej komplement] – opis „klasycznej” drogi aktywacji
1. przynajmniej 2 przeciwciała muszą połączyć się z kom. bakteryjną w odległości co
najmniej 20 nm.
2. takie przyłączone przeciwciała doprowadzają do fazy aktywacji dopełniacza – aktywacja
białka C1q (DROGA KLASYCZNA), czyli połączenie się w/w kompleksu z pierwszą
składową kończące się powstaniem C3b [Pe$eT jak masz ochotę to narysuj ten
przepiękny wazon z tulipanami…] [Ja bardziej od tulipanów wolę stokrotki i… piwonie :)
– Pe$eT]
BAKTERIESIA
⇒ C1R ⇒ C1S
⇒ aktywacja
dopeіniacza
Chryzantemy zіociste
Pуіlitrуwka po
czystej
Gratulujemy Panie Pe$eT!
Wygrał Pan główną nagrodę w
konkursie na rysunek abstrakcyjny –
Pana chryzantemy zrobiły furorę…
Ach, te płatki… Aż nam mowę
odebrało…
Jeszcze nie rozstrzygnięto konkursów
na realizm i naturalizm, ale wg naszej
spec-komisji ma Pan duże szanse z tą
„półlitrówką”…
P.S. W nagrodę dla Pana skrzynka
„Wódki Lodowej™”
www.lek2002.prv.pl | lek2002.xoopiter.com
31

www.lek2002.prv.pl | lek2002.xoopiter.com
O.K. – rysunek jest, a teraz… o co w nim chodzi: to na dole ma się kojarzyć z tulipanami w
wazonie [mnie bardziej kojarzy się z taką piosenką, gdzie śpiewają „Chryzantemy złociste w
półlitrówce po czystej, stoją na fortepianie i nie podlewa ich *** nikt” – i to również
przedstawiłem na schemacie]. Ale o co w nim chodzi: mianowicie po opłaszczeniu bakterii
przeciwciałami [to jest to cosik, co przypomina litery Y] wraz z dopełniaczem dochodzi do jego
aktywacji poprzez kaskadę reakcji, czego skutkiem ostatecznym jest likwidacja drobnoustroju.
Do kompleksu: bakteria-immunoglobuliny, przyczepia się składowa C1q dopełniacza, która to
rzekomo jest podobna do wazonu z chryzantemami… – sorry – tulipanami
3. Faza atakowania błony komórkowej
• faza tworzenia MAC – kompleksu atakującego błonę (membrane attack complex)
• tworzenie składowych: C5,6,7,8,9 (czyli C5-C9) – kompleks atakujący błonę komórkową
• fosfolipazy C8 i C9 niszczą liposacharyd, a ten jest obecny tylko w Gram– wobec tego nie
zabija Gram+
• droga klasyczna stanowi odp. nabytą (ponieważ wymaga udziału przeciwciał), natomiast
droga alternatywna – odp. naturalną (nie wymaga udziału przeciwciał).
Aktywacja na drodze alternatywnej polega na bezpośredniej aktywacji dopełniacza (składnik
C3b) przez patogen (przez białka „properdyny”??). Ostatecznie tworzą się „pory” w błonie
zewnętrznej bakterii, przez które wylewa się cytoplazma z komórki i następuje jej śmierć.
Lizozym [muramidaza]
• odkryty 1922 r. przez A. Fleminga (a ten naukowiec odkrył jeszcze potem w 1928
penicylinę i dostał Nobla 1945) [Pe$eT – a więc również wraz z nagrodą 50 000$ – czyli
nawet nie mógł sobie kupić gorzelni, ale spory zapas „Wódki Lodowej™” to i owszem!!!]
• enzym z grupy hydrolaz, niszczy wiązanie pomiędzy kwasem N-acetylomuraminowym a N-
acety-loglukozoaminą powodując rozbicie ściany komórkowej [patrz rysunek str. 5
przestawiający budowę mureiny – głównego składnika ściany komórkowej]
• niewrażliwe na lizozym są bakterie Gram–
• najwięcej znajduje się w białku kurzym
Interferony:
• są to czynniki odp. naturalnej, przeciwirusowej niespecyficznej. Nie działają bezpośrednio
przeciwwirusowo, przez swoje mechanizmy indukują w kom. stan przeciwwirusowy w
następstwie kontaktu z wirusem.
• Nie mają swoistości w stosunku do wirusów, ale są swoiste gatunkowo (zwierzęcy
interferon nie działa u ludzi).
• są glikoproteinami i wyróżnia się ich 2 typy:
− typ I – alfa i beta (α i β) – kodowane przez geny na chromosomie 9, receptor przez
geny na chrom. 21 (alfa produkowany przez leukocyty, beta przez fibroblasty)
− typ II – gamma (γ) – kodowane przez geny na chrom. 12, receptor przez geny na
chrom. 6 (gamma produkowany jest przez aktywowane limfocyty i komórki NK)
• I sposób działania: wnikają do kom., do jądra komórkowego, gdzie elementem docelowym
dla nich jest ISRE; po jego aktywacji następuje ekspresja genów, aktywacja 2’5’-
oligoadenylowej syntetazy prowadząc do stymulacji endonukleaz i w następstwie
zahamowania translacji wirusowej białka
• II sposób działania: aktywacja kinazy proteinowej następnie fosforylacja czynnika elongacji
powoduje to zablokowanie transfomacji wirusowej, potem zahamowanie translacji białek
wirusowych
Bajka nr 2 (rok 2003) – kinazy tyrozyny Jak1 i Jak2 ⇒ transdukcja sygnału z receptora
interferonu prowadzi do aktywacji w jądrze komórkowym ISRE, czyli elementu docelowego, co
powoduje transkrypcję 50-100 genów, a w efekcie aktywację kinazy proteinowej (fosforylacja
EF-3 = czynnika elongacji 3 i zahamowanie translacji białka) i aktywacja oligoadenylanowej
syntetazy (degradacja DNA)…
Uwaga
: Zdrowa osoba nie może jednocześnie chorować na dwie choroby wirusowe. 1 wirus
indukuje stan przeciwwirusowy w kom., który trwa kilka dni i prowadzi do eliminacji tego
zakażenia wirusowego. [Pe$eT – ale potem powiedziano znamienne słowa, że jest to możliwe,
jeśli dwa wirusy wnikną jednocześnie np. WZW B i D]. Ale możliwe jest (i często się zdarza), że
przy chorobie wirusowej występuje druga choroba (wskutek „nadkażenia” bakteryjnego…)
Siła działania interferonu:
• uwidoczniona najsilniej w okolicy 5 dnia od zakażenia, powoli niknie w okolicy 9
• choroba rozwija się tym szybciej, im gorszy posiadamy układ odpornościowy
www.lek2002.prv.pl | lek2002.xoopiter.com
32

www.lek2002.prv.pl | lek2002.xoopiter.com
Fagocytoza
• Odkryta przez Miecznikowa w 1883 r. (Nobel – 1910 r.)
• Posiadamy 126 bilionów fagocytów wymienianych przynajmniej raz na dobę
• Fagocytoza przebiega w dwóch etapach:
• I faza = ingestion – wychwytywanie i pochłanianie kom. obcej
• II faza = digestion – trawienie wewnątrzkomórkowe odbywające się przez połączenie
lizosomu z fagosomem (blokowanie tworzenia fagolizosomu obserwujemy przy
zakażeniu riketsjami, chlamydiami, gronkowcami, paciorkowcami, Salmonella typhi)
Niektóre patogeny używane są jako broń biologiczna, którą dzielimy na:
1. kategoria A – patogenny o wysokiej zakaźności i powodujące bardzo wysoką śmiertelność,
np. Bacillus antracis (dawka: 2000 przetrwalników w aerozolu), Yersinia pestis – dżuma
(dawka od 100 do 900 kom. bakteryjnych), Francisiella tularensis (dawka od 20 do 50 kom.
bakteryjnych), wirusy gorączek krwotocznych (dawka od 1 do 10 j.)
2. kategoria B – umiarkowana śmiertelność i umiarkowana rozsiewalność, np. rodzaj Brucella,
Salmonella, Chlamydia psittaci i Coxiella burnetti, wirusy przenoszone przez komary, np.
wirus zapalenia mózgu
I na koniec światła myśl podsumowująca wykład „Chorujemy tak, jaki mamy układ
immunologiczny” – i za te słowa serdecznie dziękujemy kończąc wykład.
www.lek2002.prv.pl | lek2002.xoopiter.com
33

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 9 – szczepionki
Historia szczepionek
O tym, że nasze rewelacyjne i ukochane szczepionki mają fantastyczną historię wie nawet
dziecko, w każdym razie tu jest to, co podano na wykładzie:
• W 1900 r. odbyła się promocyjna… epidemia błonicy. Wówczas to ktoś wpadł na genialny
pomysł, by chorym podawać surowicę od ozdrowieńców. Chorzy leczeni w ten sposób
przeżywali w większym odsetku niż tzw. „grupa kontrolna”. Był to pierwszy raz, gdy
zastosowano seroterapię. Potem dostali nawet za to Nobla. Później wprowadzono nawet
metody leczenia seroterapią takich niewiarygodnie brzydkich chorób, jak: tężec, czy
botulinizm
• Fantastyczna szczepionka przeciw ospie została skonstruowana i wprowadzona do użytku w
1796 r. przez lekarza wiejskiego z Anglii – Edwarda Jennera. On to bardzo dokładnie
przyglądał się mleczarkom [amator świeżego mleka/mleczarek :)] zauważył dwie rzeczy:
o
mleczarki [wg Wykładowcy „dójki” vel „dojarki”] w małym odsetku padają ofiarami
ospy w czasie epidemii ospy
o
na rękach jednak mają krosty takie jak krowy, gdy chorują na ospę krowią
[krowiankę]
o
dodatkowo przechodzą tę chorobę [krowiankę] stosunkowo łagodnie
• O.K. Zauważył 3 rzeczy – nie ważne – w każdym razie stwierdził, że może da się zakazić
człowieka krowią ospą, ten ją przechoruje i nie będzie chorował na zwykłą ospę. Tak też
zrobił 14 V 1796 r., gdy zaszczepił 12-letniego chłopca. Potem nawet [nie dam głowy]
zaszczepił się sam i próbował się zakażać ospą, ale bezskutecznie – szczepionka działała.
Jego doświadczeniom początkowo nikt nie dawał wiary, ale już coś koło 1801 r. cała armia
Wielkiej Brytanii musiała się szczepić przeciw ospie [zobaczcie też na początek wykładu nr
1 – jak dla mnie, to Imć Pan też ma tylko „dójki” w głowie, bo to już 2 raz, kiedy o nich
mówi tę bajkę…]
• Szczepienie wg Jennera polega na skaryfikacji [zrobienie blizny] na skórze ramienia i
zakażeniu ospą krowią (krowianką)
Definicja szczepionki
Jako szczepionkę rozumiemy biologiczny preparat zawierający antygen danego patogenu,
który wprowadzony do ustroju powoduje powstanie odporności nabytej i zapobiega rozwojowi
choroby wywołanej przez patogen. [Ufff…]
UWAGA! Należy pamiętać, że szczepionka chroni przed chorobą, a nie zakażeniem! Mimo, iż
szczepionka powoduje powstanie immunologicznej bariery odpornościowej dla danego
patogenu!
Cel szczepienia
Zapewnienie bariery indywidualnej oraz populacyjnej (zwłaszcza w okresie dziecięcym).
Pożądane cechy szczepionek
Życzylibyśmy sobie, żeby szczepionki charakteryzowały się następującymi cechami:
• Skuteczność
o
Szczepionka ma zapobiegać chorobie, niekoniecznie infekcji
o
Szczepienie ma dawać długotrwałą odporność
o
Ma ona indukować odpowiednią gałąź odpowiedzi immunologicznej
• Bezpieczeństwo – jak najmniej efektów ubocznych
• Stabilność
o
Preparat powinien długo zachowywać swoją aktywność
o
Nie może dochodzić do rewersji w formę wirulentną
o
Powinna być łatwa do transportu i przechowywania
• Cena – możliwie najniższa, no najlepiej gdyby do szczepionki w ogóle ktoś dopłacał ;)
Czynniki utrudniające postęp w tworzeniu szczepionek
• Brak pełnego zrozumienia mechanizmów patogenezy chorób zakaźnych, jak też reakcji
immunologicznych
• Względy ekonomiczne – często bardziej opłacalne są badania nad wprowadzaniem
nowych leków
• Względy etyczne – np. AIDS jest chorobą człowieka i nie bardzo jest jak przetestować
szczepionkę (brak „ochotników”)
• Względy organizacyjne – brak koordynacji badań nad szczepionkami
www.lek2002.prv.pl | lek2002.xoopiter.com
34

www.lek2002.prv.pl | lek2002.xoopiter.com
Stare, tradycyjne, klasyczne, sprawdzone szczepionki:
1. Szczepionki zawierające żywe drobnoustroje:
a. Szczepionki zawierające drobnoustroje o pełnej wirulencji
• jedyna – ospa krowia (krowianka) – szczepienie to daje odporność na ospę
prawdziwą
b. Szczepionki zawierające żywe, atenuowane [awirulentne, pozbawione zjadliwości]
patogeny
• wąglik – w 1881 r. L. Pasteur podgrzał kolonię wąglika do 42°C
• gruźlica – prątka TB odkrył Koch, natomiast szczepionkę opracowali Calmette-Guérin
[Bacillus Calmette-Guérin]. Szczepionkę otrzymano drogą pasażowania aż 231 razy
prątka Mycobacterium bovis na podłoża z żółcią. Trwało to ładnych parę lat,
pierwszy raz szczepionkę zastosowano w 1921 r.
• MMR – mumps [świnka], measles [odra], rubeola [różyczka] – szczepionka ta u
osób immunoniekompetentnych może spowodować rewersję wirulencji
• polio – szczepionka doustna Sabina (lata 50. XX w.) zawiera atenuowane wirusy.
WHO stawia sobie za cel eradykację polio [jak dotąd praktycznie eradykowano ospę]
• szczepionki tego rodzaju zawierają żywe drobnoustroje i istnieje możliwość
odtworzenia wirulentnego genotypu – a więc rewersja do wirulencji.
• są to najskuteczniejsze szczepionki – indukują bowiem powstanie odporności
komórkowej i humoralnej
• przeciwwskazaniami do stosowania tego rodzaju szczepionek są:
• osoby z niedoborami immunolog. – pierwotnymi i wtórnymi [leczenie,
nowotwory]
• uważać w ciąży (szczególnie z różyczką)
2. Szczepionki zawierające zabite drobnoustroje [ładniej mówiąc: „inaktywowane”]
• polio – szczepionka Salka – zawiera 3 typy wirusów polio [ubitych formaliną]
• Vaxigrip – szczepionka na grypę
• DiPerTe – no nie cała… zabite są tylko pałeczki krztuśca [pertussis]
• ich zadaniem jest indukcja powstania odporności humoralnej
• dają stosunkowo krótkotrwałą odpowiedź, stąd konieczność częstego ich
powtarzania –patrz kalendarz szczepień
3. Anatoksyny
• anatoksyna to przekształcona na drodze procesów fizycznych toksyna bakteryjna,
która traci właściwości toksyczne („odzjadliwiona” toksyna), zachowując właściwości
antygenowe [preparat pozbawiony właściwości toksycznych, ale immunogenny, to
toksoid]
• podanie anatoksyny spowoduje wykształcenie przeciwciał przeciwko toksynie danej
bakterii
• anatoksyna tężcowa – znajduje się m. in. w szczepionce DiPerTe
• anatoksyna błonicy – na wykładzie były dwa rodzaje otrzymywania tej anatoksyny –
podgrzanie toksyny do 58°C, względnie po podgrzaniu w 37°C w obecności
formaldehydu – metoda Ramona
Nowe szczepionki – tzw. „szczepionki nowej generacji”
• nowe szczepionki atenuowane produkujemy dzięki inżynierii genetycznej – atenuację
wywołujemy poprzez wprowadzenie delecji genów wirulencji – takim patogenom nie
grozi więc rewersja do wirulencji
• szczepionki koniugowane – łączą one określony składnik drobnoustroju patogennego
nośnikiem – zwykle anatoksyną. W ten sposób można np. umieścić w szczepionce PRP –
fosforan-fosforybozylo-rybitol. Tak produkowana jest szczepionka
przeciwmeningokokowa, zawierająca wielocukry A i C
• szczepionki zawierające tylko składnik patogenu – np. szczepionka przeciw wirusowi
zapalenia wątroby typu B jest to tylko antygen HBsAg tego wirusa, produkowany przez
rekombinowane drożdże (transfekowane)
Miejsce szczepionek we współczesnej medycynie
• Dziś mamy szczepionki na około 80 chorób zakaźnych
W dalszym ciągu nie ma szczepionek na:
www.lek2002.prv.pl | lek2002.xoopiter.com
35

www.lek2002.prv.pl | lek2002.xoopiter.com
BAKTERIE:
• rzeżączka
• kiła
• trąd
WIRUSY:
• AIDS
• wirus gorączki krwotocznej [Ebola]
• HCV
• wirus Epsteina-Barr (mononukleoza zakaźna)
[na te dwie ostatnie być może niedługo]
• współczesne szczepionki wymagają przeważnie minimum dwukrotnego podania w odstępie
4–6 tygodni. Dlaczego wyjaśnia wykres:
patogen
Ig M
Ig M
Ig G
Ig G
patogen
Odpowiedź
pierwotna
Odpowiedź
wtórna
Szczepimy min. 2 razy, żeby wywołać odpowiedź wtórną, a odstęp jest potrzebny, by układ
immunologiczny przygotował się do niej. Po takim szczepieniu przez dłuższy czas mamy
przeciwciała we krwi
• nie podajemy szczepionek atenuowanych przed 9 m-cem życia, ponieważ immunoglobiny
matki obecne we krwi dziecka mogą ją inaktywować.
Dział badawczo–rozwojowy poleca:
• Przyszłością szczepionek są niewątpliwie szczepionki genetyczne. Tego rodzaju
szczepionki zawierają DNA patogenu opłaszczone cząsteczkami złota. Takie właśnie
DNA jest wstrzykiwane pacjentowi i daje odporność
• Szczepionki transgeniczne są również istotnym kierunkiem rozwoju – często w
badaniach wykorzystujemy patogenną dla roślin bakterię Agrobacterium fumetociens.
Bakterię tę wykorzystuje np. prof. Kapusta z Poznania, który prowadzi badania nad
szczepionkami w transgenicznej sałacie
• W metodzie tej najpierw preparujemy specjalny plazmid, który zawiera interesujący nas
antygen – np. HbS. Następnie plazmidem zakażamy bakterię, namnażamy ją i teraz
bakterią zakażamy np. sałatę. Kto zje sałatę – nabędzie odporność
• Problemem jest tu fakt, że jak mamy plantację pełną takich zmodyfikowanych sałat,
wówczas: tracimy kontrolę nad jakością szczepionki; ponadto szczepionka
transgeniczna ma małą trwałość inkorporacji, w zmodyfikowanych roślinach z czasem
spada ekspresja interesującego nas genu – jest więc mniej prawdopodobne
immunizowanie pacjenta
• Tym niemniej szczepionki genetyczne są niewątpliwie przyszłością szczepień
www.lek2002.prv.pl | lek2002.xoopiter.com
36

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 10
Jest to kultowy wykład, na którym wykładowca przez 15 minut bawił się zasłonami
Antybiotyki i chemioterapeutyki
• aktualnie jest dostępnych jakieś 200 preparatów
• zbyt częste stosowanie antybiotyków powoduje rozwój lekooporności, czyli do powstawania
szczepów opornych
• Mamy trzy podstawowe kryteria podawania antybiotyku
1. lekowrażliwość danego szczepu
2. właściwe optymalne stężenie w miejscu działania (procesu zapalnego)
3. właściwa dawka antybiotyku, zgodna z farmakokinetyką leku
• Poza tym skuteczność antybiotyku zależy od:
) umiejscowienia zakażenia i warunków tam panujących
) rozkładu antybiotyków przez enzymy
• o racjonalnym wyborze antybiotyku decydują badania mikrobiologiczne obejmujące
identyfikację drobnoustroju i określenie lekowrażliwości oraz lekooporności
• w związku z tym, że nie zawsze można z leczeniem zwlekać do otrzymania wyników [3 dni]
– leczenie wówczas rozpoczynamy od tzw. leczenia podstawowego, a gdy dostaniemy w
łapę wynik, to kontynuujemy leczenie w sposób „celowany” (leczenie celowane)
• „droga antybiotyku” zanim zostanie wprowadzony do użycia przebiega tak: najpierw 5 lat
badań podstawowych, następnie 7 lat badań klinicznych; koszty drobne – jakieś 75 mln $,
aktualnie jednak zbliżamy się do końca ery antybiotykowej [kasa się kończy czy jak?]
• penicylina – odkryta przez Fleminga w 1928r., Nobel za jej odkrycie nieco później – 1945 r.
(Fleming, Chain, Florey)
–
została wprowadzona w postaci oczyszczonej w 1941 r.
–
a teraz historyjka.... [początek jest C’Heminy – potem ja się produkuję] pewnego
słonecznego dnia [ja mam, że w 1941 r., a co do słonecznego dnia w Anglii – to ja w to
nie wierzę – idę w zakład, że była mgła! – Pe$eT], pewien policjant zaciął się podczas
golenia... koleś się zakaził i nastąpiła posocznica – nasz policjant umierał, podano mu
więc, jako królikowi doświadczalnemu, penicylinę – ale za późno i policjant zmarł, z tym
że jednak [o czym C’Hemina nie pisała] nasz milicjant z drogówki przeżył dłużej i miał
mniejszą gorączkę i bakteriemię, a problem polegał na tym, że podano ją za późno i w
sumie delikwenta można by uratować, ale Fleming miał za mało czystej penicyliny, więc
dał to, co miał – ale to było niestety za mało… i za późno [no i tu C’Hemina ma rację] –
tu swe 3 grosze doda Chirek: z tego co ja wiem, to tę penicylinę Fleming przez
przypadek odkrył, bo jak na faceta przystało, do sprzątania miał dwie lewe ręce…
wpieprzył pewnego razu brudne szlaki z bakteriami do zlewu i dał nóżkę z laboratorium,
ponoć zostawił otwarte okno nad zlewem, cosik mu ponoć przez to okno się wwiało,
osiadło na szalce i… spleśniało; no, a gdy Flaming zabrał się za sprzątnie, to się zdziwił,
że wokół pleśni na szalce była istna „strefa zero” – żadnej bakterii… No i co Wy na to,
Kobitki, tu niesprzątanie popłacało… [z tego powodu dobrowolnie rezygnuję z dyżuru
sprzątania w tym tygodniu… może coś odkryję…]
• stosowano ją masowo podczas II wojny światowej, nie nadążano wręcz z produkcją
[Związki zawodowe, czy co??? Odp. Chirka: Stary, toć zbyt był jak cholera – kiła wtedy
wręcz szalała (to ta 2-ga strona wojny…), a produkcja dopiero na rozruchu… A tak w
ogóle to polecam filmy wojenne i gwoli wyjaśnień niezrozumiałych obecnie tekstów
dodaję, że wtedy kiła się przymiot albo franca zwała (choroba „francuska”), a zmiany
kiłowe – zmianami francowatymi
]
• trzeba pamiętać, że następuje nawrót choroby po zbyt wczesnym odstawieniu
• sulfonamid – odkryty przez przypadek [jak dla mnie to standard]
• lizozym (też pierwsza pacjentka zmarła po podaniu)
Definicje:
Antybioza – antagonistyczne oddziaływanie jednego produktu drobnoustroju na inne
drobnoustroje.
Pod koniec XIX w. Virelli zauważył można hamować rozwój jednych drobnoustrojów innymi,
np. Vibrio z Pseudosomonas. [Ani C’Hemina ani Pe$eT nie mają pojęcia co kogo hamuje] – ale
*
jak już jesteśmy przy starych nazwach „tych chorób”, to wg książki z 1920 r. rzeżączka = tryper lub
wiewiór [tak, tak: wiewiór!], a wrzód miękki = szankier miękki
www.lek2002.prv.pl | lek2002.xoopiter.com
37

www.lek2002.prv.pl | lek2002.xoopiter.com
za to Pe$eT znalazł, że np. mikroflora powierzchni skóry działa dzięki antybiozie ochronnie, bo
np. St. epidermidis hamuje wzrost innych bakterii G+ (np. St. aureus, Bacillus), ale też
pewnych G– (np. E. coli, P. aeruginosa)
Antybiotyk
Jest to związek pochodzenia biologicznego zawsze posiadający swój wzorzec naturalny. Jest
produkowany przez drobnoustroje. Syntez i półsyntez dokonujemy na podstawie wzorca
naturalnego. Działa przeciwdrobnoustrojowo, bakteriostatycznie, hamuje wzrost, ewentualnie
bakteriobójczo
Chemioterapeutyk
Jest to preparat syntetyczny nie posiadający wzorca naturalnego, wytwarzany przez człowieka,
np. sulfonamidy, chinoliny, nitrofurany, nitrazole i in.
Antybiotyk nie jest tym samym co chemioterapeutyk!!!
Antybiotyki nie działają na wirusy, natomiast chemioterapeutyki mogą działać na wirusy.
Antybiotyki wytwarzane są:
• 70% przez bakterie [większość (60% z tych 70%) przez promieniowce Streptomyces]
• 20% przez grzyby
• poniżej 1% przez glony
Podział antybiotyków:
• antybiotyki β-laktamowe
• ansamycyny (ryfamycyny, np. ryfampicyna) – tzw. nowa grupa antybiotyków
• aminoglikozydy
• tetracykliny
• makrolidy
• glikozamidy
• glikopeptydy
Oksazolidynony (np. Linezolid) – są to antybiotyki nie są związane z żadną w/w grupą
antybiotyków, bo strukturalnie nie przypominają żadnego z w/w. Są to tzw. antybiotyki
syntetyczne.
Działanie antybiotyków jest skuteczne przez 5 dni, od 6 dnia terapii pozostają tylko szczepy
oporne na dany antybiotyk ⇒ zalecenie, by antybiotykoterapia trwała 5 dni.
Na początku terapii polecane są antybiotyki β-laktamowe (jako najbezpieczniejsze), a jeśli nie
zadziałał, to podajemy antybiotyki makrolidowe.
Antybiotyki inne niż β-laktamy działają bardzo szybko, bo działają na rybosomy bakteryjne.
Klonowanie się bakterii
• Mutacja genomu bakterii – czasem nawet jedna starcza do dalszego rozmnażania się.
Po zastosowaniu antybiotyku następuje wyselekcjonowanie takiej jednej zmutowanej
bakterii i z niej rozwija się populacja bakterii opornych. Wywoływane jest to przez
niewłaściwe dawkowanie antybiotyków – jak już wspomniano we wstępie. Selekcja
szczepów opornych zwiększa się z presją antybiotyków na drobnoustroje. Ponadto geny
oporności mogą być przekazywane pomiędzy bakteriami – np. poprzez transpozony czy
plazmidy
• Należy pamiętać, że jak leczymy pacjenta antybiotykiem, to po zakończeniu leczenia w
ustroju pozostają bakterie oporne na ten antybiotyk – więc podawanie go po krótkiej
przerwie nie ma większego sensu
• Jak podajemy komuś antybiotyk to trzeba zwrócić uwagę, czy mamy zamiar skopać d...
bakteriom G+ czy G–, bowiem G– mogą mieć w przestrzeni periplazmatycznej enzymy
rozkładające antybiotyki
Typy oporności bakteryjnej:
• wrodzona (naturalna) – wiąże się z chromosomalnie określoną strukturą bakterii
• wtórna (nabyta) – wiąże się z genami oporności, produkcją enzymów degradujących
antybiotyk np. beta–laktamowy jest niszczony przez β-laktamazy. Wszystkie bakterie
Gram– posiadają te enzymy, mimo to stosujemy leki antybiotyki β-laktamowe pamiętając
jednakże o tym, że musimy jakby „pokonać tor przeszkód z tych enzymów” podając razem z
antybiotykiem broker β-laktamaz
www.lek2002.prv.pl | lek2002.xoopiter.com
38
www.lek2002.prv.pl | lek2002.xoopiter.com
WSTAWKA INFORMACYJNA: PBP – białko wiążące np. penicylinę, przez które działają β-
laktamy, znajduje się w zewnętrznej warstwie błony cytoplazmatycznej
Mamy więc następujące rodzaje oporności wtórnej:
• synteza związków powodujących degradację antybiotyku – np. przez β-laktamazy
• aktywny wyrzut antybiotyku z komórki (zjawisko „reflux”) – pompa wyrzucająca antybiotyki
z komórki
• zaburzanie bariery przepuszczalności (przepuszczalności ściany komórkowej)
• modyfikacja miejsca docelowego, własnych receptorów dla antybiotyków, np. zmiana białka
z PBP na PBP2A (odpowiada za to gen „mec A”)
TABELA – OPORNOŚĆ WRODZONA (NATURALNA) BAKTERII NA ANTYBIOTYKI
Rodzaj drobnoustroju
Niedziałające antybiotyki
Chlamydie
β-laktamy
Enterokoki cefalosporyny, penicylina benzylowa (niski poziom
oporności)
Mykoplazmy
β-laktamy
bakterie z rodziny Enterobacteriaceae makrolidy, antybiotyki glikopeptydowe
paciorkowce – Streptococcus aminoglikozydy
Pseudosomonas
penicylina benzylowa, cefalosporyny I i II generacji,
tetracykliny, aminopenicyliny, aminopenicyliny +
inhibitory β-laktamaz, linkozamidy
szczep MRSA (metycylinooporne szczepy gronkowca złocistego) – jest aktualnie oporny na
metycylinę, antybiotyki beta-laktamowe, aminoglikozydy, makrolidy, tetracykliny. Ostatnią
szansą są antybiotyki glikopetydowe, ale stosujemy je tylko w ostateczności ze względu na
zaobserwowaną już oporność i na te antybiotyki (wankomycyna i teikoplanina), oporność ta
jest spowodowana nabyciem genu mecA, który powoduje zmianę receptora PBP na PBP2A
Antybiotyki Mechanizm
działania Efekt
beta-laktamowe hamują biosyntezę ściany kom. wskutek
blokowania transpeptydacji peptydoglikanu
poprzez kowalencyjne wiązanie PBP
bakteriobójczy
aminoglikozydy
(nie działają na
beztlenowce)
hamują biosyntezę białka poprzez wiązanie się z
podj. 30S rybosomu i zakłócenie odczytu kodu
genetycznego, stosować jednak ostrożnie z
powodu możliwych powikłań nefro- i
ototoksycznych (uszkodzenie nerek i słuchu)
bakteriobójczy
glikopeptydowe hamują biosyntezę ściany komórkowej poprzez
blokowanie syntezy prekursorów peptydoglikanu
bakteriobójczy
linkozamidy,
klindamycyna
hamują biosyntezę białka poprzez wiązanie się z
podj. 50S rybosomu i blokowanie elongacji
łańcucha peptydowego
bakteriostatyczny
makrolidy hamują biosyntezę białka poprzez wiązanie się z
podj. 50S rybosomu i blokowanie translokacji
tRNA
bakteriostatyczny w
wys. stęż.
bakteriobójczy (wobec
paciorkowców)
tatracykliny hamują biosyntezę białka poprzez wiązanie się z
podj. 30S rybosomu i blokowanie przyłączenia
tRNA – nie podawać poniżej 12 r.ż. ponieważ
działają toksycznie na chrząstkę
bakteriostatyczny
ketolidy podobne do
makrolidów
mech. analogiczny do makrolidów, ale 10 ×
silniej wiąże
?...
chinolony działają na gyrazę bakteryjną (enzym niezbędny
do prawidłowego ułożenia DNA w chromosom) –
nie podawać poniżej 12 r.ż., ponieważ odkłada
się w chrząstce
www.lek2002.prv.pl | lek2002.xoopiter.com
39
www.lek2002.prv.pl | lek2002.xoopiter.com
ansamycyny
(ryfamycyny)
działa na polimerazę RNA zależną od DNA,
blokuje więc transkrypcję (stosowane w leczeniu
przeciwprątkowym)
glikozamidy hamują translację białka bakteryjnego
sulfonamidy
jako analogi PABA, blokują syntezę kwasu
foliowego potrzebnego do syntez zasad
azotowych
bakteriostatyczne
β-laktamy dają zablokowanie usieciowania i syntezy peptydoglikanów. Dochodzi do autolizy
kom. bakteryjnej w wyniku aktywacji autolizyn, efekt po 6-8h. Dokładnie blokują
transpeptydazę, która jest enzymem z grupy PBP, umożliwiającym właściwą syntezę
peptydoglikanów.
Antybiotyki i chemioterapeutyki mogą działać na różnych poziomach biosyntezy bakteryjnego
genomu
• na etapie DNA – chemioterapeutyki (np. kw. chinolowy) działają cytotoksyczne, ponieważ
dzięki ich zastosowaniu następuje inhibicja gyrazy DNA i topoizomerazy IV
• na etapie transkrypcji – działa np. ryfampicyna, dzięki niej następuje inhibicja polimerazy
RNA zależnej od DNA
• na etapie blokowania translacji – makrolidy, linkozamidy, linkomycyna (hamują jednostkę
50S rybosomu), tetracykliny (hamują wiązanie tRNA z jednostką 30S rybosomu)
Złote myśli:
• aminoglikozydy zwiększają efekt bójczy β-laktamów
• tetracykliny (np. doxycyklina) mają określone wskazania:
) zakażenia mykoplazmowe i ureaplazmowe
) chlamydiozy
) riketsjozy i Coxiella burnetti
) cholera
) choroby odzwierzęce (np. rularemia, bruceloza)
• makrolidy (np. erytromycyna, azytromycyna) działają na bakterie Gram+, a nie działają na
Gram– (np. pałeczki z rodziny Enterobacteriaceae), są skuteczne wobec bakterii spiralnych
(np. Helicobacter pylori)
• linkozamidy (np. dalacyna) działa na bakt. beztlenowe
• glikopeptydy – antybiotyki ostatniej szansy w zakażeniach szczepami MRSA, czy
enterokokami
• β-laktamy są nieskuteczne w leczeniu z powodu bakterii Gram–
Niektóre chemioterapeutyki:
) sulfonamidy – są antagonistami PABA (kw. paraaminobenzoesowego) [zastępują go w
reakcji tworzenia folianu: glutaminian + PABA + pterydyna → kw. foliowy]; sylfonamidy
działają bakteriostatycznie
ale… biseptol = Bactrim = mix trimetoprimu z sulfametoksazolem w stosunku 1:5 – on daje
zaburzenia powstawania kwasu foliowego. Bimetoprimol = trimetoprim blokuje powstanie
aktywnej postaci kw. tetrahydrofoliowego, działając na reduktazę kw. foliowego, a
sulfametoksazol blokuje powstawanie samego kwasu foliowego [jest analogiem PABA]; ta
mieszanka sulfonamidu z trimetoprimem jest bakteriobójcza
[dla przypomnienia – tetrahydrofolian jest potrzebny do produkcji zasad azotowych ⇒
DNA/RNA]
TABELKA Z PODZIAŁEM CEFALOSPORYN wg Willamsa (1987 r.) zrobiona z uwzględnieniem
działania przeciwbakteryjnego danych preparatów [bo ten klasyczny podział „na generacje”
jest z punktu widzenia praktycznego do d…, bo nie ma nic wspólnego ze stosowaniem, a
jedynie kolejnością wprowadzania preparatów na rynek…]
Klasa cefalosporyn Aktywność przeciwbakteryjna
Preparaty
0
(doustne
cefalosporyny)
dobra aktywność wobec Gram+, a wobec
pałeczek Gram- nieco mniejsza od aktywności
ampicyliny, amoksycyliny
Cefadroksyl, Cefaleksyna,
Cefradyna, Cefaklor
I wysoka
aktywność wobec G+
Cefalotyna, Cefapiryna,
Cefazolina
www.lek2002.prv.pl | lek2002.xoopiter.com
40

www.lek2002.prv.pl | lek2002.xoopiter.com
II wysoka
aktywność wobec Enterobacteriaceae,
H. influenzae, N. gonorrhoeae
Cefamandol, Cefepim,
Cefotaksym, Ceftriakson,
Cefuroksym, Cefuroksym
aksetyl, Cefpodoksym
proksetyl, Cefetamet
piwoksyl
III wysoka
aktywność wobec Pseudosomonas Cefoperazon,
Cefsulodyna,
Ceftazydym
IV
(cefamycyny)
aktywność wobec Bacteroides (bakt.
beztlenowych nieprzetrwalnikujących)
Cefoksytyna, Cefotetan
BADANIE LEKOWRAŻLIWOŚCI
Metoda krążkowo-dyfuzyjna
pozwala na zbadanie, czy dany szczep bakterii jest oporny na dany antybiotyk, czy nie.
Pozwala uniknąć błędów w zastosowaniu antybiotyków, na które bakterie są oporne.
Wynik przedstawiany jest za pomocą liter:
„SIR” oznaczających:
-
S (susceprible) – wrażliwy szczep na ten antybiotyk
-
I (intermediate) – pośredni wynik leczenie jest trudne do prowadzenia, ale jeśli częstość
podawania (możemy zwiększyć dawkę) to skuteczność tego leczenia jest możliwa.
Streptomycyna nie może mieć zwiększonej dawki!
-
R (resistant) – oporny, leczenie tym lekiem jest bezsensowne bo szczep posiada mechanizm
odporności
A tak w ogóle to kiknijcie do załączonego artykułu Profa o „Leczeniu chorób bakteryjnych”…
www.lek2002.prv.pl | lek2002.xoopiter.com
41

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – Wykład 11 – Wirusologia
Wstęp
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Ludwik Pasteur – wprowadził określenie wirus dla nazwania „jadu”, nigdy przecież wirusa
nie widział. Wprowadził również szczepionkę przeciw wściekliźnie
Iwanowski – stwierdził, że mozaikową chorobę roślin wywołuje „nieprzesączalny czynnik” –
odkrywa pierwszego wirusa roślin
1915-17 r. – Anglik i Kanadyjczyk odkrywają bakteriofagi
1901 r. – prymitywnie opisany pierwszy wirus człowieka – wirus żółtej febry [febra =
gorączka]
Pochodzenie wirusów:
1. Teoria komórkowa:
bakterie stanowią ewolucyjne źródło wirusów
wirusy ewoluowały z kom. prokariotycznych 2 mld. lat temu
2. Nowsze (od 1986 r.) – wirusy powstały z samoreplikujących autonomicznych molekuł
) istnieje 15 tys. gatunków bakterii
) istnieje 4 tys. gat. wirusów (zgromadzone w 28 rodzinach)
) przeciętnie bakteria ma 1000-20000 nm
) wirusy są od 10 do 100
× mniejsze od bakterii (oglądany w mikroskopie elektronowym);
największym wirusem jest w. ospy prawdziwej [którego teoretycznie się pozbyliśmy dzięki
Jennerowi], przeciętny wirus ma 20-400 nm
Pod względem wielkości wyróżniamy:
wirusy małe 10-50 nm
wirusy średnie 50-150 nm
wirusy duże 150-400 nm (dorównują więc wielkością Chlamydiom – ich wielkość ok. 300
nm)
Cytacik: „Możemy porównać komórkę atakowaną i wirusa – jeśli przyjmiemy, że komórka to
arena cyrkowa (∅ 13 m), to wirusy są wielkości od orzecha do dyni”.
− pojedyncza cząstka wirusa to wirion
− jest to mały zakaźny mikroorganizm niekomórkowy zawierający jeden typ kw. nukleinowego
(albo DNA albo RNA – ale zawsze tylko jeden), stanowiący genom
− genom otoczony jest strukturalnymi jednostkami białkowymi (kapsomerami) tworzącymi
kapsyd
− genom + kapsyd = nukleokapsyd
− niektóre wirusy posiadają na zewnątrz kapsydu osłonkę glikoproteinową zawierającą
glikoproteiny wirusa wtopione w dwupokład lipidowy (pochodzący z błony komórkowej
gospodarza) i węglowodany [te wirusy, które mają otoczkę zwą się „osłonkowe”, te zaś,
które jej nie mają – „nagie” lub inaczej „bezosłonkowe”]
− gatunek wirusa – to zbiór wirusów o wspólnym replikacyjnym rodowodzie i zajmujące
wspólną „niszę ekologiczną” (wspólne wrażliwe komórki).
Cechy charakterystyczne wirusów:
są bezwzględnymi pasożytami wewnątrzkomórkowymi
nie namnażają się przez podział
replikują się w komórce (którą określamy mianem „permisywna”)
posiadają jeden typ kw. nukleinowego (albo DNA albo RNA)
nie zawierają peptydoglikanu [mureiny]
nie są wrażliwe na antybiotyki, ale mogą być wrażliwe na chemioterapeutyki
genom zawierający jeden typ kwasu nukleinowego jest dwuniciowy (ds – jak większość
DNA wirusów za wyjątkiem Parwowirusów) lub jednoniciowy (ss – jak w większości RNA
wirusów za wyjątkiem Reowirusów)
małe zawierają 32 kapsomery, Adenowirusy – 250, Herpes wirus – 162, Reowirusy – 92,
Papilloma – 72
te, które mają osłonkę (z lipoprotein i węglowodanów) nazywamy wirusami osłonkowymi,
glikoproteinowe kolce na ich powierzchni determinują proces wnikania wirusa do komórki
www.lek2002.prv.pl | lek2002.xoopiter.com
42

www.lek2002.prv.pl | lek2002.xoopiter.com
•
•
•
•
•
•
•
•
•
•
•
nukleokapsyd tworzy dwa typy symetrii:
–
bryłę wielościenną (ikozahedralną, kubiczną) – dwudziestościenna bryła o ścianach z
trójkątów, nadaje wirusom kształt kulisty (DNA, RNA-wirusy)
–
symetria helikalna [śrubowa – „kręta klatka schodowa”], co daje kształt wydłużony
(RNA-wirusy mają kształt kulisty lub wydłużony) – wszystkie z tym typem symetrii są
osłonkowe
kształt wirusa:
–
kulisty
–
nitkowaty (wydłużony)
–
pleomorficzny (mogą przybierać zarówno kształt kulisty lub wydłużony)
Uwaga: jest też wyjątkowy kształt „cegiełkowaty”, taki mają jedynie Poxwirusy
zawierają w genomie 3-200 genów (średnio 10-15)
posiadają genom haploidalny, jedynie rodzina Retroviridae posiada genom diploidalny (np.
wirus HIV)
wszystkie wirusy DNA posiadają cząsteczkę dwuniciowego DNA oprócz jednej rodziny –
Parvoviridae, które mają jednoniciowe i koliste DNA (np. ludzki parwowirus B-19)
wszystkie wirusy RNA posiadają cząsteczkę jednoniciowego RNA oprócz rodziny wirusów
nagich – Reoviridae, które mają dwuniciowe RNA (np. Rotawirus – patogeny dziecięce)
końcówka „-viridae” = rodzina, „-virinae” = podrodzina, np. Filoviridae – rodzina, Filovirus
–rodzaj, wirus Ebola – gatunek
Wirusy są sklasyfikowane w 28 rodzinach. Wirusy człowieka zostały sklasyfikowane w 2 rzędy:
Mononegavirales
– rząd (o „–” polarności)
–
Paramyxoviridae
–
Rhabdoviridae
–
Filoviridae
Nidovirales
– rząd (o „+” polarności)
–
Coronaviridae
–
Arterviridae
–
Picornaviridae
–
Flaviviridae
–
Caliciviridae
ss(+)RNA [jednoniciowy RNA o dodatniej polarności] – dodatnia polarność, tzn. identyczne
sekwencje ułożenia jak matrycowy RNA, ułożony w kolejności 5’ → 3’, on sam jest zakaźny,
bo nie wymaga dodatkowych białek do translacji, wykorzystuje do tego enzymy gospodarza
ss(–)RNA [jednoniciowy RNA o ujemnej polarności] – ujemna polarność = odwrotna
pozycja nukleotydów tzn., że RNA stanowi lustrzane odbicie matrycowego RNA. Stanowią
anty-genom nie mogą pełnić funkcji matrycowego RNA, są niezakaźne. Wirusy z taką
informacją genetyczną muszą mieć enzym odwrotną transkryptazę RNA (inaczej rewertazę
– polimerazę RNA zależną od RNA), umożliwiającą replikację genomu przez syntezę
komplementarnej cząsteczki RNA o dodatniej polarności, czyli takiej jak mRNA gospodarza.
Wirusy człowieka zawierają podwójną nić DNA z wyj. Parvoviridae (ludzkiego Parvovirus B19).
Podział:
Wirusy nieosłonkowe; DNA – linearny [z wyj. Papilloma i WZW-B (kolisty)]
•
•
•
•
•
•
•
•
•
Parvoviridae
(ssDNA)
Papillomaviridae
(dsDNA)
Adenoviridae
(dsDNA)
Poxviridae
(dsDNA) – ma własne polimerazy w wirionie
Wirusy osłonkowe DNA
Hepadnaviridae
(dsDNA) – na pewnym odcinku tylko jedna nić DNA, koliste, poza tym ma
własne polimerazy w wirionie
Herpesviridae
(dsDNA)
Wirusy nieosłonkowe RNA
Picornaviridae
(ssRNA)
Reoviridae
(dsRNA), dwuniciowy
Wirusy osłonkowe RNA
Togaviridae
, np. różyczki
www.lek2002.prv.pl | lek2002.xoopiter.com
43

www.lek2002.prv.pl | lek2002.xoopiter.com
•
•
•
•
•
•
Rhabdoviridae
, np. wścieklizny
Orthomyxoviridae
Arenaviridae
Retroviridae
Paramyxoviridae
Bunyaviridae
Wirusy a ich receptory komórkowe: NA BLACHĘ!!!
Herpesviridae
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
HSV-1 – siarczan heparanu
HSV-2 – siarczan heparanu
CMV, VZV, HHV-6,7 – siarczan heparanu
EBV – CR2 (CD21) limf. B
Adenoviridae
ADV 2, 9 – CAR, integryny
Hepadnaviridae
HBV – albuminowy rec. hepatocyta
Parvoviridae
HPV (human parvovirus) – szczep B19 – antygen P
Reoviridae
Reovirus
– kw. sialowy
Picornaviridae
Poliovirus
1,2,3 – PVR
Coxackievirus
A13, A 18, A21 – ICAM-1
Coxackievirus
B1-B6 – CAR
Rhinovirus
– ICAM-1
Rhabdoviridae
w. wścieklizny – receptor acetylocholinowy (r. ACh)
Paramyxoviridae
w. odry – CD46
Ortomyxoviridae
wirus grypy – kwas sialowy
Retroviridae
HIV1 – CD4 (CCR5 CXCR4 – koreceptory)
Fazy replikacji wirusowej
(z wykładu)
I. Faza adsorpcji (przyłączenia) wirusa do receptora
II. Faza penetracji – czyli wnikanie do wnętrza komórki
•
•
•
•
•
•
•
wirusy bezosłonkowe – wnikają do komórki przez receptor, nukleokapsyd „wślizguje
się” ⇒ wślizgiwanie
wirusy osłonkowe – na dwa sposoby:
a. przez proces fuzji osłonki wirusa z błoną cytoplazmatyczną komórki, za
pośrednictwem receptorów dochodzi do wniknięcia
b. endocytoza – np. wirus grypy, różyczki – tworzy się pęcherzyk endocytarny
[wewnątrz proces „fuzji wewnętrznej” – fuzja osłonki z pęcherzykiem co
określamy mianem wiropeksji]
Po wniknięciu do komórki wirus musi zostać rozebrany
III. Faza – faza odpłaszczania – dochodzi do uwolnienia kwasu nukleinowego
IV. Faza – faza eklipsy („zaćmienia”, „zanikania”) – zanik tożsamości fizycznej cząstki wirusa,
wirus nie jest widoczny w mikroskopie elektronowym, następuje tu synteza białek i
replikacja materiału genetycznego, zwykle trwa 1-27h (ale nawet i 8 lat, jak w przypadku
HIV), wyróżniamy tu fazy:
faza wczesnej transkrypcji
faza wczesnej translacji (prowadzi do syntezy enzymów)
faza późnej transkrypcji
faza późnej translacji (synteza kapsydu i białek replikujących materiał genetyczny)
w/w doprowadzają do gwałtownego namnażania – czyli replikacji
„Wirus to kaseta wideo, którą wkładamy do magnetowidu i odtwarzamy…”
V. Faza kondensacji („składania”) – jest to składanie (materiał genetyczny + białka) i
dojrzewanie
www.lek2002.prv.pl | lek2002.xoopiter.com
44

www.lek2002.prv.pl | lek2002.xoopiter.com
VI. Faza uwalniania się potomnych cząsteczek wirusa
•
•
wirusy bezosłonkowe – przez lizę komórki, w której się namnażały
wirusy osłonkowe – przez pączkowanie – osłonka odrywa się od błony
www.lek2002.prv.pl | lek2002.xoopiter.com
45

www.lek2002.prv.pl | lek2002.xoopiter.com
Mikrobiologia – wykład 12 – kipiący niczem dąb Bartek
[określenie ASa]
© by połowa populacji Zduńskiej Woli i 54 % mieszkańców Sieradza
WIRUSY
Zarys replikacji wirusów.
Zależnie od rodzaju materiału zawartego w danym wirusie cykl jego replikacji ma różny
przebieg. I tak dla wirusów zawierających odpowiednie kwasy nukleinowe przebiega
następująco:
1. dsDNA wirusy [double stranded DNA – 2-niciowy DNA] – np. Poxviridae, Herpesviridae,
Adenoviridae, Papillomaviridae
a. dsDNA → [polimeraza RNA] → mRNA → białka wirusa
b. dsDNA → [komórkowa polimeraza DNA] → kopia dsDNA wirusa
c. białka z pkt. a i DNA z pkt. b → wirion
2. ssDNA wirusy [single stranded DNA = 1-niciowy DNA] – np. Parvoviridae
a. ssDNA → [komórkowa polimeraza DNA] → dsDNA
b. dsDNA → [polimeraza RNA] → mRNA → białka wirusa
c. dsDNA → [polimeraza DNA wirusowa] → ssDNA
d. białka z pkt. b i DNA z pkt. c dają gotowy wirion
3. ds(–)RNA wirusy – Reoviridae
a. ds(–)RNA → [wirusowa transkryptaza RNA] → mRNA [ss(+)RNA]
b. mRNA → białka wirusa
c. mRNA → [replikaza RNA] → ss(–)RNA
d. białka z pkt. b i RNA z pkt. c dają gotowy wirion
4. ss(–)RNA wirusy Mononegavirales, Orthomyxoviridae, Bunyaviridae, Arenoviridae
a. ss(–)RNA → [transkrypraza RNA] → ss(+)RNA
b. ss(+)RNA → białka wirusa
c. ss(+)RNA → [replikaza RNA] → ss(–)RNA
d. białka z pkt. b i RNA z pkt. c dają gotowy wirion
5. ss(+)RNA wirusy Picornaviridae, Coronaviridae, Caliciviridae, Flaviviridae, Togaviridae
a. ss(+)RNA wirusa → białka wirusa
b. ss(+)RNA → ss(–)RNA [forma pośrednia]
c. ss(–)RNA → ss(+)RNA
d. białka z pkt. a i RNA z pkt. c dają gotowy wirion
Do wirusów które dokonują odwrotnej transkrypcji zaliczamy:
1. Retroviridae:
a. ss(+)RNA → [odwrotna transkryptaza] → dsDNA [tzw. cDNA] (odwrotna
transkrypcja)
b. dsDNA → [polimeraza RNA] → ss(+)RNA
c. ss(+)RNA [tu jako mRNA] → białko
d. białka z pkt. c i RNA z pkt. b dają gotowy wirion
2. Hepadnaviridae:
a. ds(+)RNA wirusa → [polimeraza RNA] → ss(+)RNA
b. ss(+)RNA → [odwrotna transkryptaza] → dsDNA (odwrotna transkrypcja)
c. ss(+)RNA → białka
d. białka z pkt. c i DNA z pkt. b dają gotowy wirion
Ponadto przy mikrobiologii wirusów warto wspomnieć o subwirusowych czynnikach
patogennych, do których zaliczamy:
•
priony – są to czynniki transmisyjne encefalopatii gąbczastych [BSE]. Są to białka,
które są cholernie odporne na czynniki zewnętrzne – procedura sterylizacji
autoklawowej w podejrzeniu zakażenia prionami trwa 1 h w temperaturze 134°C, ale
przedtem należy zastosować moczenie w 1M NaOH przez 24 godziny lub w 6M
roztworze izotiocyjanianu guanidyny przez 15 min. [o tym zresztą jest caaały Jego
artykuł…]
• wiroidy – są to małe cząsteczki zakaźne – ccc-ssRNA, które zawierają około 240-380
par zasad. Nie posiadają one kapsydu, są czynnikami infekcyjnymi roślin (znaczenie
ekonomiczne) [teraz można niepostrzeżenie zrujnować trawnik sąsiada :)]
www.lek2002.prv.pl | lek2002.xoopiter.com
46
www.lek2002.prv.pl | lek2002.xoopiter.com
Epidemiologia wirusów
O tym, jak istotna z punktu widzenia klinicznego jest znajomość mechanizmu infekcji
wirusowej niechaj świadczą dane dotyczące zachorowań na choroby infekcyjne w Polsce, w
latach 1975-1995.
Przypadki o etiologii wirusowej
Liczba
zarejestrowanych
przypadków
grypa i
grypopodobne
inne całkowita liczba
przypadków
przypadki o
innej etiologii
42224 29878 9480 39358 2866
100% 70,8%
22,5% 93,3% 6,7%
Myśli światłe odnośnie w/w danych – cytuję: „pomimo, iż leki przepisuje się od 5 000 lat [tyle
liczy sobie pierwsza recepta na aspirynę] to za farmakomechanizm aspiryny Nagrodę Nobla
przyznano w 1981/2 roku. W każdym razie mimo tych 5 000 lat z aspiryną niewiele mamy
leków przeciwwirusowych i należy podkreślić, że przepisywanie na zakażenie wirusowe
antybiotyków mija się z celem! Lekooporność na antybiotyki dla wirusów obciąża organizm, no
i zmniejsza reakcję odpornościową.
Należy zdawać sobie również sprawę, że w krajach rozwiniętych i rozwijających się różnie
kształtuje się udział poszczególnych wirusów jako czynników etiologicznych infekcji wirusowych
i tak odpowiednio:
Najczęstsze czynniki etiologiczne
Kraje rozwinięte
Rinowirusy, wirus grypy, Herpeswirus, Papillomawirusy, wirus
HIV, Paramyksowirusy
Kraje rozwijające się
Wszystkie w/w wirusy + lista znajdująca się poniżej:
Wirusy poliomyelitis, Rotawirusy, HAV, HBV, wirus żółtej
gorączki i gorączki krwotocznej oraz zap. mózgu, wirus
wścieklizny
Slajd – powtórka dotycząca rodzaju materiału genetycznego, który zawierają wirusy
1. dsDNA
• Herpesviridae
• Papovaviridae
• Adenoviridae
• Poxaviridae
• Iridoviridae
• Rotavirus
2. dsDNA – odwrotna transkryptaza
• Hepadnaviridae
3. ssDNA
• Parvoviridae
• Chordoparvoviridae
• Cicoviridae
4. dsRNA
• Reoviridae
• Orthovirus
• Orbivirus
• Coltivirus
• Rotavirus
• Agereovirus
• Birnaviridae
• Agabirnavirus
• Avibirnavirus
5. ss(–)RNA
• Orthomyxoviridae
• Rhabdoviridae
• Lyssavirus
• Vesiculavirus
www.lek2002.prv.pl | lek2002.xoopiter.com
47
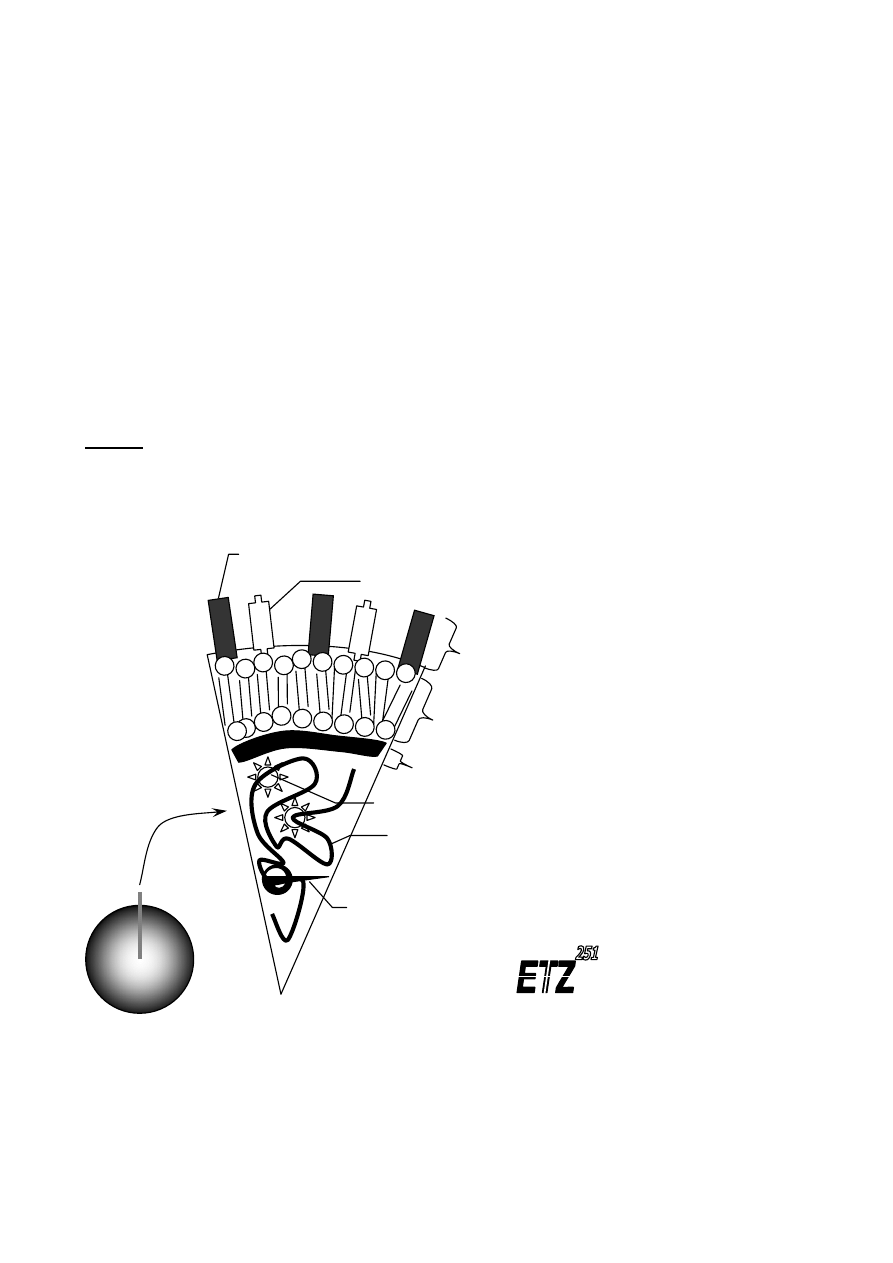
www.lek2002.prv.pl | lek2002.xoopiter.com
• Ephenerovirus
• Paramyxoviridae
• Arenoviridae
• Flivoiridae
• Bunyaviridae
• Bunyavirus
• Hantacvirus
• Nairovirus
• Phlebovirus
6. ss(+)RNA
• Calciiviridae [np. WZW E]
• Astroviridae
• Coranoviridae
• Arterivirus
• Togaviridae
• Flaviviridae
7. ssRNA – odwrotna transkryptaza
• Retroviridae
GRYPA
Fantastyczny wirus grypy – budowa, eksploatacja, naprawy [motory, wszędzie motory…]
Określenie grypy: „influenza” pochodzi od słów: „in fluenaze di frego”, co nasz kryzysowy sztab
tłumaczy przetłumaczył jako choroba z oziębienia [lody i tego rodzaju sprawy …]
• jest to RNA-wirus
Rys. 1. – przekrój przez zwykły wirus grypy
Hemaglutynina – 450 szt.
Neuraminidaza – 100 szt.
Dwuwarstwa
lipidowa
Warstwa białka
matrycowego
Polimeraza RNA
Nukleoproteina
wirusa, zaw. RNA
Znak firmowy MZ
Kolce
glikoproteinowe
Kilka cennych objaśnień do rysunku:
• Jak widać na rysunku zewnętrzna powierzchnia wirusa (osłonka lipidowa) pokryta jest ok.
550 kolcami glikoproteinowymi. Ich rola polega na umożliwieniu adsorpcji wirusa do
wrażliwych komórek, znajdujących się w górnych drogach oddechowych. Receptory wiążą
się z kwasem sjalowym.
www.lek2002.prv.pl | lek2002.xoopiter.com
48

www.lek2002.prv.pl | lek2002.xoopiter.com
• Z tych 550 kolców, ok. 450 to kolce hemaglutyniny, która ma praktyczne zastosowanie –
dzięki jej obecności w wypadku infekcji można wykazać zahamowanie hemaglutynacji, co
ma znaczenie diagnostyczne. Zjawisko hemaglutynacji ma charakter zjawiska fizycznego
(nie immunologicznego), bowiem hemaglutyniny znajdują się na samym wirusie [nie bierze
tu udziału nic z układu immunologicznego].
• Pozostałe kolce to kolce neuraminidazy
• w 1933 r. Smith zidentyfikował wirusa grypy i zaklasyfikował go do Ortomyxoviridae
• RNA zawarte w wirusie grypy jest kwasem o ujemnej polarności
• nukleokapsyd wirusa grypy jest sferyczny, kolisty (lub mniej–więcej helikalny, przy czym
jest nieco wydłużony)???
Typy wirusa grypy:
A – jest to wirus powodujący epidemiczne i pandemiczne zachorowania
B – jest to wirus odpowiedzialny za epidemiczne zachorowania
C – jest generalnie mało groźny (przeziębienia, katary – znaczy się nieżyty)
Dlaczego uważamy wirus grypy za szczególnie niebezpieczny?
• wirus grypy jest klasyfikowany jako szczególnie niebezpieczny ze względu na tworzenie
ogromnej liczby kopii – w czasie każdego cyklu replikacyjnego powstają miliony wirionów
potomnych
• cały problem z tymi „dziećmi wirusa grypy” polega jednakże na tym, że każde pokolenie
nieco różni się od poprzedniego na skutek powstawania mutacji. Przy czym pamiętać
należy, że mutacje dotyczyć mogą antygenów – określamy je wówczas angielskim
terminem drift, czasem zaś dotyczyć mogą poszczególnych białek wirusa – co określa
angielski termin shift
• o ile dryft jest zjawiskiem powolnym, dyskretnym, stopniowym dającym małe zmiany – o
tyle shift powoduje powstanie jakościowo nowego białka – jest to więc znaczny skok
antygenowy – niektórzy porównują shift do „zmiany peruki przez wirusa”, a tak naprawdę
to polega na zmianach antygenowości wypustek otoczki lipidowej wirusa.
Znaczenie shift’u potwierdzić może, że jak dotąd zidentyfikowano 15 typów hemaglutynin oraz
9 typów hialuronidazy (H1-H15 – podtypy hemaglutynin, N1-N9 – podtypy neuraminidaz)
[Saddam pracował nad nowymi :)]. Nowe formy wirusa powstają w wyniku przeróżnych
kombinacji tych podtypów
• Normalnie grypa – mogłoby się wydawać nie jest poważniejszym problemem –
śmiertelność sięga najwyżej 0,1% [gorzej z osobami pow. 65
r.ż.]. Jednak po
uwzględnieniu faktu, że szerzenie się choroby ma charakter epidemii, nieraz wręcz
pandemii – owe 0,1% oznacza kilka tysięcy ofiar i kilka milionów $ zysków dla sektora
pogrzebowego
• Jeszcze gorzej, gdy dojdzie do gwałtownej zmiany antygenowości wirusa – wówczas
epidemia przybiera niespotykane rozmiary – bo nasze układy odpornościowe nie są
przystosowane do walki z jakościowo nowym wirusem. Tego rodzaju szczepy powodowały
wcześniej wiele epidemii:
–
1918 r. – tzw. grypa Hiszpanka – podtyp H1N1 – z powodu zachorowań zginęło
więcej ludzi, niż w skutek działań wojennych podczas I i II wojnie światowej – łącznie
21 mln. osób. Ci co przeżyli zachowali odporność.
–
1957 r. – grypa Azjatka (H2N2) – ten wirus powodował całkowite zaskoczenie układu
odpornościowego
–
1968 r. – w Hong Kongu pojawił się szczep H3N2, szerzył się razem z H1N1 – teraz
oba rodzaje wirusów znajdują się w szczepionkach
–
1977 r. – epidemia grypy w ZSRR – H1N1
–
1976 r. – epidemia grypy w Polsce – co 6 „Obywatel” złapał grypę
• Generalnie ponoć u świnek następuje wymiana genów. Oskarża się też o to dzikie kaczki i
drób. Skoki i nowe formy powstają co 8-10 lat.
• Należy pamiętać, że w/w pandemie wyszły z Chin – a wynika to z faktu, że jest tam
największe zagęszczenie ludności i zwierząt na świecie, co sprzyja przechodzeniu wirusów
zwierzęcych na ludzi. Prosiak/-czek [Mów po ludzku! Tak jak cię na tej uczelni na bioli
uczyli – „świntuch”] potrafi sobie złapać grypę ludzką, gorzej jeśli jednocześnie choruje na
inną infekcję wirusową – wówczas może dojść do przemieszania genów obu wirusów i
powstania „super-grypy”. [Coś tu dla mnie śmierdzi… przecież w wykładzie 7 (str. 29) stoi
www.lek2002.prv.pl | lek2002.xoopiter.com
49
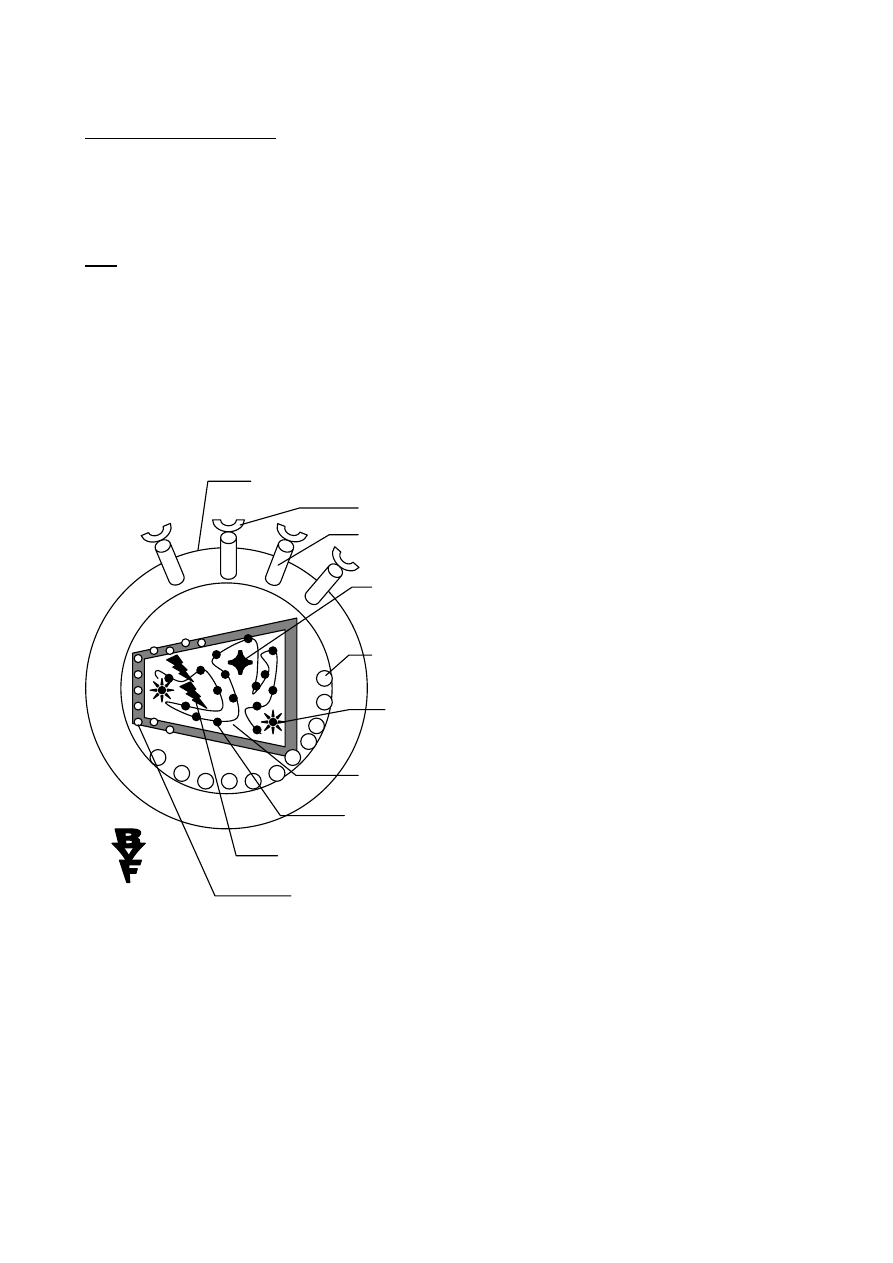
www.lek2002.prv.pl | lek2002.xoopiter.com
napisane, że nie można chorować na dwie choroby wirusowe, no dobra… przyjmijmy to
jako dogmat]
Powikłanie pogrypowe
Powikłania pogrypowe najczęściej zdarzają się w 2 grupach wiekowych – u noworodków, osób
po 65 r. ż. Do najczęściej pojawiających się powikłań zaliczamy:
• zapalenie oskrzeli – 19%
• zapalenie płuc – 2,9%
• zapalenie ucha środkowego – 2,3%
• depresja – 5,8%
HIV
Wirus HIV został zidentyfikowany w 1983 r., natomiast 1986 r. wprowadzono nazwę AIDS –
Zespół Nabytego Upośledzenia Odporności. [Rok później wytwórnia MZ wprowadziła do
produkcji model motocykla ETZ 250 z nowym, lżejszym tłumikiem krótszym o 41 mm i
podgiętym w górę o 7 stopni Chirek: Pe$eT a słyszałeś, jak Smerfy drogowe zwą
motocyklistów? „Orzeszki”, bo ponoć często „zdarza im się trzasnąć klejnotami (orzeszkami) o
wlew paliwa…” No a tak w ogóle chciałem się zapytać jak tam twoje komary w zębach (ponoć
po tym poznać wesołego motocyklistę)? Nie – no ja się wcale z Ciebie nie nabijam, jestem po
prostu bardziej zniewieściały – ja wolę „zawsze czysto, zawsze sucho, zawsze pewnie” – tj.
samochód…]
Wirus HIV – budowa, eksploatacja, naprawy:
Dwupokład lipidowy
GP 41
GP 120
P 17 – składnik
nukleokapsydu
proteaza
integraza
ss-HIV-1RNA
P6 i P9 poł. z RNA
Odwrotna transkryptaza
P 24 – białko
kapsydu
Powyższy rysunek przedstawia schematyczną budowę jedynego i niepowtarzalnego wirusa HIV.
Glikoproteiny GP-41 i GP-120 tworzą razem glikoproteinę GP-160 – określaną jako kolec
glikoproteinowy, jego zadaniem jest zapewnić fuzję ułatwiając penetrację. Występuje w ilości
500 szt. na powierzchni wirusa i jest istotna w penetracji komórki.
www.lek2002.prv.pl | lek2002.xoopiter.com
50

www.lek2002.prv.pl | lek2002.xoopiter.com
750 000
270 000
510 000 – Europa
Zach.
1 300 000
200 000 –
Afryka Pn.
14 000 000 –
Afryka Pd. i Śr.
50 000 –
Europa Wsch.
Azja – 5 300 000
Australia – 13 000
Z kolei powyższy rysunek przedstawia szacowaną liczbę osób zakażonych wirusem HIV na
świecie – stan na rok 2000.
Budowa wirusa HIV.
• Wirus HIV posiada 9 genów, w tym 3 geny strukturalne oraz 6 regulatorowych
• Geny strukturalne kodują białka struktury wirusa:
o
Gen gag – koduje białka nukleokapsydu
o
Gen pol – koduje odwrotną transkryptazę, integrazę, rybonukleazę, proteazę
o
Gen env – envelop (z ang. otaczać) – koduje GP 160
• Geny regulatorowe:
o
tat, rev, nef, vif...
o
Na szczególną uwagę zasługuje gen vpu – tak określa się go w HIV 1, natomiast
w HIV 2 – określa się go jako vpx – jest to gen związany z wnikaniem wirusa –
Virion binding and env processing
• Wirus namnaża się w ustroju w ilości 1-10 mld kopii na dobę
• adsorpcja – GP-120 łączy się z CD4 (wirus łączy się z komórką poprzez receptor CD4).
Wymagane do tego są koreceptory CXCR4 oraz receptory dla chemokin CCR5. Gdy
monocyt lub makrofag nie posiada CCR5 nie ulega się zakażeniu
• penetracja wirusa odbywa się w wyniku fuzji otoczki z błoną komórkową [wirus grypy
penetruje w skutek endocytozy]
• po penetracji i odpłaszczeniu odwrotna transkryptaza przepisuje RNA do dsDNA, które
to DNA dzięki integrynie łączy się genomem gospodarza. Może tam pozostawać, bądź
namnażać się
• diagnostycznym markerem wirusa HIV jest białko P24.
• jest to więc chromosomalny pasożyt, uszkadzający 6000 × wolniej niż wirus grypy
DZIĘKUJEMY ZA OKLASKI!!!
NAPRAWDĘ NIE TRZEBA…
DAROWIZNY (MOGĄ BYĆ W NATURZE) PRZYJMUJE DZIAŁ FINANSOWY…
www.lek2002.prv.pl | lek2002.xoopiter.com
51
Document Outline
- „Aby coś wyjaśnić trzeba opowiedzieć historię...” - E. Mayr
- Ewolucja bakterii
- Definicje podstawowe
- Wielkość bakterii i wirusów, historia mikrobiologii
- Dzieje najnowsze
- Budowa ogólna komórki bakteryjnej
- Systematyka:
- Barwienie metodą Grama
- Metabolizm komórki bakteryjnej
- © by Wasilij Czapajew
- Formy przetrwalne bakterii
- Antybiotyki i chemioterapeutyki
- Wstęp
- Podział:
- Wirusy a ich receptory komórkowe: NA BLACHĘ!!!
- Fazy replikacji wirusowej
Wyszukiwarka
Podobne podstrony:
7 materiały pomocnicze dla egzaminatorów
materiały pomocnicze do egzaminu z rynku kapitałowego 4IPMRFN64Z4YSLYX3Z5PMXWFHYJWRHJ6LZFJ5TY
materialy pomocnicze do egzaminu z psychologii
BO materiały pomocnicze do egzaminu198
BO materiały pomocnicze do egzaminu198
Materiały pomocnicze na egzaminie na tłumacza przysięgłego B Cieślik
Materiały na egzamin, Materiały pomocnicze Technik Informatyk
EGZAMIN z foto test zanaczone , Leśnictwo SGGW niestacjonarne 1stopnia, Semestr 1, Fotogrametria i T
Geografia w pigułce - VADEMECUM - powtórka egzamin gimnazjalny, Szkoła - materiały pomocnicze, preze
Odpowiedzi na egzamin z Podstaw Zarządzania (dr M. Pawłowski WSM Warszawa Kawęczyńska), Pliki, Mater
egzamin - sciaga do druku, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
Egzamin - sciaga, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
Egzamin - teoria 2, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
sciaga na egzamin, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
Kolokwium 2008 (Walusiak) egzamin 2007 (Grochowski), Językoznawstwo ogólne, Językoznawstwo ogólne
więcej podobnych podstron