
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
1
TERMODYNAMIKA
FENOMENOLOGICZNA
Przedmiotem badań są właściwości układów
makroskopowych w zależności od temperatury.
•
Układ makroskopowy
np. 1 gram lub 1 mol substancji
1 mol
zwiera N
A
atomów lub cząsteczek,
czyli tyle, ile jest w 12 gramach węgla C
12
N
A
= 6,022
⋅
10
23
mol
-1
liczba Avogadra
•
Parametry makroskopowe:
właściwości układu, które można mierzyć
(ciśnienie p, objętość V, temperatura T, ...)
•
Związek właściwości makroskopowych
z mikrostrukturą opisuje termodynamika
statystyczna

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
2
ENERGIA WEWNĘTRZNA
Energią wewnętrzną układu nazywa się energię
zależną tylko od stanu termodynamicznego ciała.
W przypadku układu nieruchomego,
nie umieszczonego w żadnym polu zewnętrznym,
energia wewnętrzna jest równa energii całkowitej
układu.
Energia wewnętrzna jest sumą energii oddziaływań
międzycząsteczkowych i wewnątrzcząsteczkowych
układu, a także energii ruchu cieplnego cząsteczek oraz
wszystkich innych rodzajów energii występujących w
układzie.
Wartość energii wewnętrznej jest trudna do ustalenia ze
względu na jej złożony charakter.
W opisie procesów termodynamicznych istotniejsza jest
zmiana energii wewnętrznej, dlatego określając energię
wewnętrzną układu pomija się te rodzaje energii, które
nie zmieniają się w rozpatrywanym układzie
termodynamicznym. Na przykład dla gazu doskonałego
jedyną składową energii wewnętrznej, która może się
zmieniać, jest energia kinetyczna cząsteczek gazu. Stąd
zmiana energii wewnętrznej równa jest zmianie energii
kinetycznej cząsteczek.

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
3
RÓWNOWAGA
TERMODYNAMICZNA
Układy makroskopowe odizolowane od otoczenia
osiągają po pewnym czasie
stan
równowagi termodynamicznej.
•
stan układu jest wówczas ustalony
•
nie występują żadne przepływy
Fluktuacje - zasady równowagi szczegółowej
ZEROWA ZASADA TERMODYNAMIKI
Jeżeli ciało A i B są w stanie równowagi termo-
dynamicznej z trzecim ciałem C, to są one
również w stanie równowagi termodynamicznej
ze sobą nawzajem.

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
4
TEMPERATURA
Każdemu ciału można przyporządkować wielkość
fizyczną nazywaną temperaturą.
Temperatura jest jedną z podstawowych wielkości
fizycznych. Jednostką temperatury w skali
bezwzględnej jest 1 K ( jeden kelwin)
Kiedy dwa ciała są w stanie równowagi
termodynamicznej ich temperatury są równe.
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
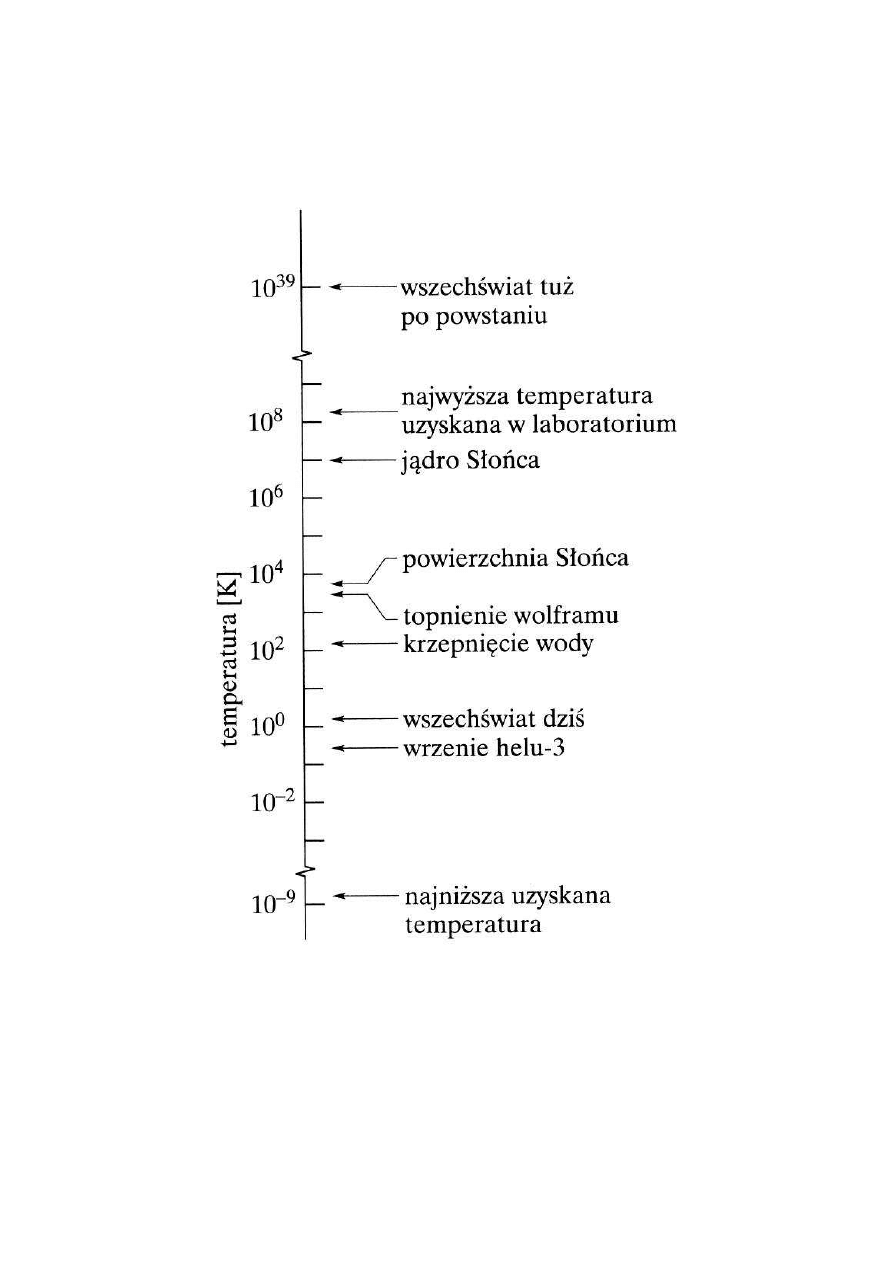
5
SKALA TEMPERATUR
Halliday, Resnick, Walker,
Podstawy fizyki,
PWN 2003 , tom 2
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
6
PARAMETRY EKSTENSYWNE
(proporcjonalne do ilości substancji)
Stany równowagi są całkowicie określone przez
wartości zespołu parametrów ekstensywnych
(U, V, N
1
, ..., N
r
)
1
Parametry ekstensywne są addytywne U = U
1
+ U
2
V = V
1
+ V
2
Przykład:
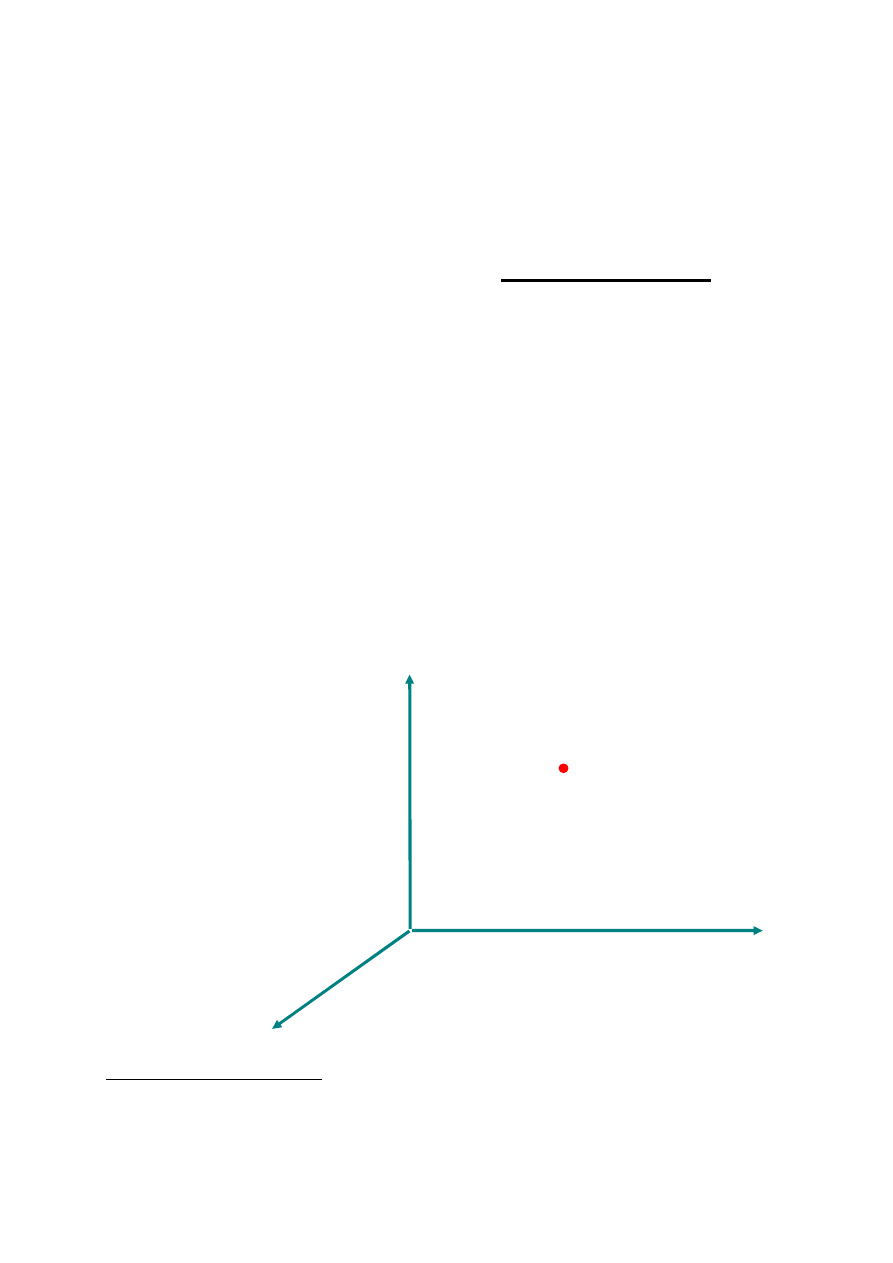
stany równowagi układu jednoskładnikowego
(składającego się z jednego rodzaju atomów lub
cząsteczek)
opisywane
są
przez
punkty
w trójwymiarowej przestrzeni parametrów stanu
(U, V, N)
1
U - energia wewnętrzna, V - objętość, N
i
- ilość moli
substancji „i”
V
N
p
U

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
7
STAN UKŁADU
Stan układu opisuje się w określonych warunkach
zewnętrznych
Oddziaływanie układu z otoczeniem odbywa się
poprzez ścianki.
Ś
cianki mogą być:
•
izolujące –
brak jakiejkolwiek formy oddziaływania
•
zamykające -
brak wymiany cząstek
•
adiabatyczne -
tylko możliwość wykonania pracy
•
diatermiczne -
tylko oddziaływanie termiczne
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
8
CIEPŁO
Energię przekazywaną w wyniku kontaktu
termicznego Q(A,B) nazywa się ciepłem
przekazanym układowi w procesie A – B
Ciepło jest to energia przekazywana między
dwoma układami na skutek istnienia między nimi
różnicy temperatur.
Praca i ciepło
zależą od przebiegu
procesów
– nie są funkcjami
stanu
V
p

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
9
I ZASADA TERMODYNAMIKI
•
Zasada zachowania energii dla układów
adiabatycznych
W
ad
(A,B) = U(B) – U(A)
Praca nad układem osłoniętym adiabatycznie wykonana
w procesie przejścia od stanu A do stanu B jest
całkowicie określona przez te stany i równa różnicy
energii wewnętrznej w stanie B i w stanie A.
•
Zasada zachowania energii dla układów
zamkniętych (nie adiabatycznych), czyli
Pierwsza Zasada Termodynamiki:
U(B) – U(A) = W (A,B) + Q(A,B)
Energia wewnętrzna układu wzrasta, jeżeli układ
pobiera energię w postaci ciepła Q lub gdy siła
zewnętrzna wykonuje nad układem pracę W.
Energia wewnętrzna układu maleje, gdy układ
przekazuje ciepło otoczeniu o niższej temperaturze
(wówczas Q < 0) lub gdy układ wykonuje pracę (wtedy
W < 0).

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
10
II ZASADA TERMODYNAMIKI
Dla każdego układu termodynamicznego istnieje
funkcja stanu
S
, zwana
entropią
, o następujących
właściwościach:
- S jest wielkością ekstensywną
-
w procesach zachodzących w układach
izolowanych entropia nigdy nie maleje.
S(B)
≥
S(A)
Wynika stąd nieodwracalny charakter procesów
w układach odizolowanych.

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
11
ENTROPIA
Entropia jest funkcją parametrów ekstensywnych
U, V, N
1
, N
2
, N
3
,… .
Równanie podstawowe dla układu jedno-
składnikowego (jeden rodzaj cząstek,
N
i
= N)
S = S(U, V, N)
Dla rzeczywistych układów fizycznych entropia
jest rosnącą funkcją energii wewnętrznej, można
więc to równanie przekształcić do postaci:
U = U(S, V, N)

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
12
PARAMETRY INTENSYWNE
(lokalne)
Energia wewnętrzna:
U = U(S, V, N
1
, N
2
, N
3
, … )
Zmiana energii wewnętrznej w układzie
jednoskładnikowym
U
U
U
dU
dS
dV
dN
S
V
N
∂
∂
∂
=
+
+
∂
∂
∂
współczynniki przy różniczkach parametrów
ekstensywnych nazywa się parametrami
intensywnymi.
Parametry intensywne (lokalne)
(∂U/∂S)
V,N
= T temperatura termodynamiczna
(∂U/∂V)
S,N
=
−
p ciśnienie
(∂U/∂N)
S,V
=
µ
potencjał chemiczny
dU = TdS
−−−−
pdV +
µ
dN

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
13
PARAMETRY INTENSYWNE
dU = TdS
−−−−
pdV +
µ
dN
T
- temperatura termodynamiczna
p
- ciśnienie
µ
-
potencjał chemiczny
Przykłady
•
zamiana ścianki izolującej ścianką diatermiczną
w wyniku przepływu ciepła ustala się taki podział
energii, że
T
1
= T
2
•
zamiana ścianki izolującej ścianką przepuszczającą
w wyniku przepływu cząstek ustala się taki podział
materii, że
µ
1
=
µ
2
•
zamiana ścianki izolującej ścianką adiabatyczną
w wyniku przesunięcia ścianki wyrównują się
ciśnienia
p
1
= p
2

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
14
PROCESY TERMODYNAMICZNE
Procesy odwracalne - układ przechodzi przez ciąg
kolejnych stanów równowagi termodynamicznej
w taki sposób, że entropia układu się nie zmienia.
przebieg jest kwazistatyczny
Przykład:
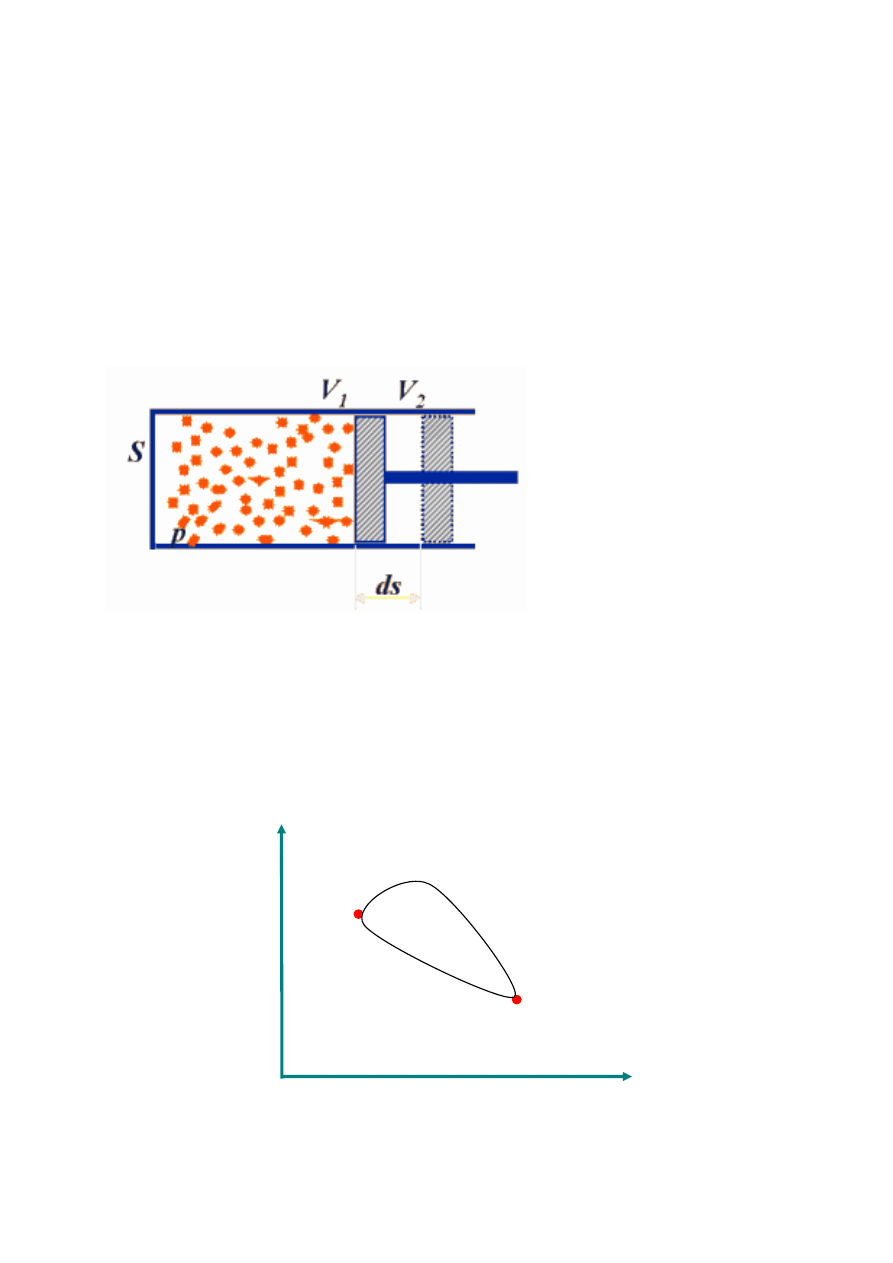
Układ zamknięty (N=const.) w kontakcie termicznym
i mechanicznym z otoczeniem o temperaturze T
0
i ciśnieniu p
0
.
W procesie odwracalnym
•
dU
= T
dS – p
dV
( bo d
Ν
= 0 )
z pierwszej zasady termodynamiki
•
dU =
δ
Q +
δ
W
stąd
δ
Q +
δ
W = T
dS – p
dV
Praca elementarna
δ
W = F dx =
−
pA dx =
−
p dV
δ
Q = T
dS
Jest to podstawowy związek łączący zmianę entropii z
energią wymienianą z otoczeniem przez kontakt
termiczny
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
15
POJEMNOŚĆ CIEPLNA
Dostarczenie ciepła powoduje wzrost temperatury
układu
δ
Q
→
dT
Pojemność cieplna C
, definiowana równaniem
δ
Q = CdT
zależy od rodzaju procesu:
1. dostarczanie ciepła przy stałej objętości (V = const.)
δ
Q = C
V
dT
dla gazu jednoatomowego C
V
=3/2 R
2.
dostarczanie ciepła przy stałym ciśnieniu (p = const.)
δ
Q = C
p
dT
dla gazu jednoatomowego C
p
= C
V
+R
RYS http://1lo-
epsilon.ovh.org/dokumenty%20PDF/CIEPLO_WLASCIWE_
GAZU_DOSKONALEGO.pdf
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
16
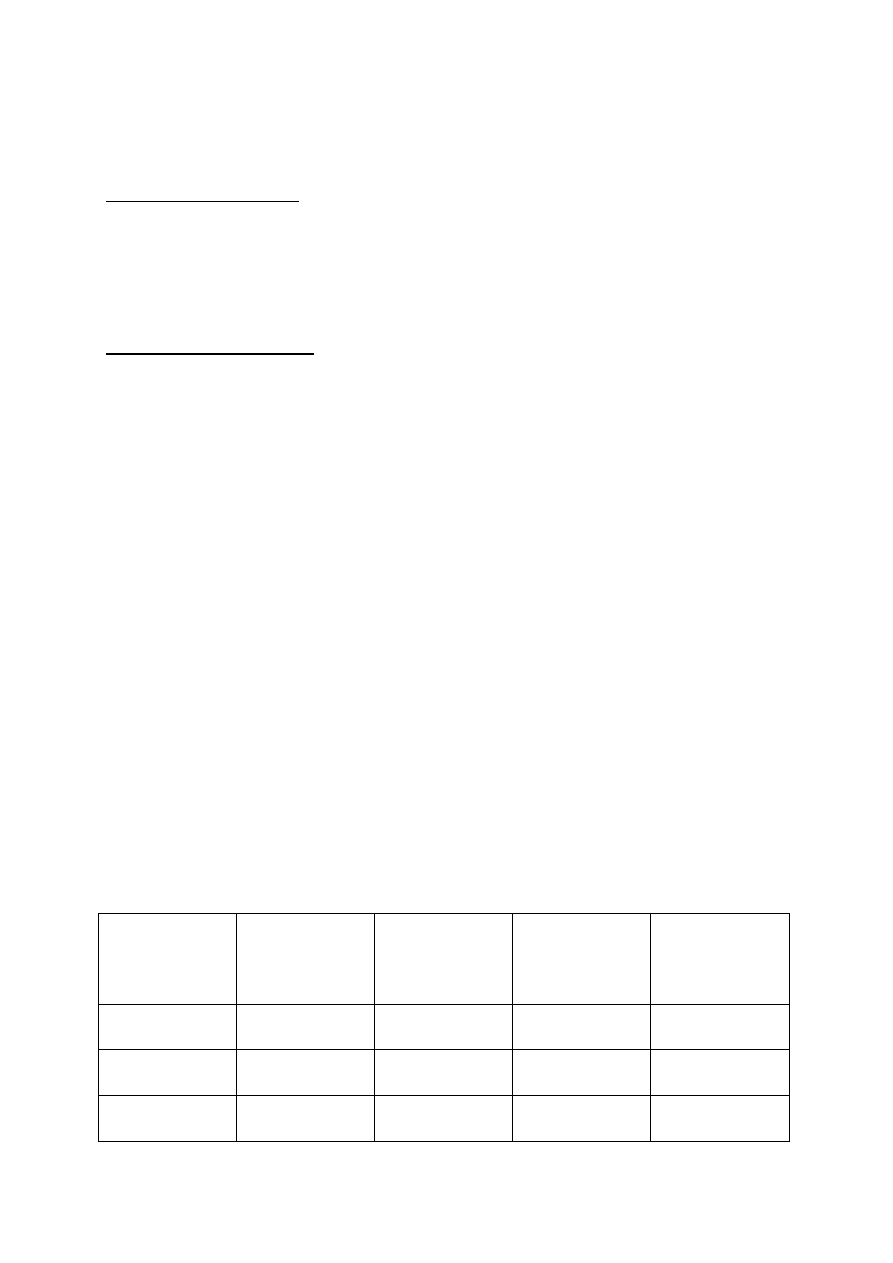
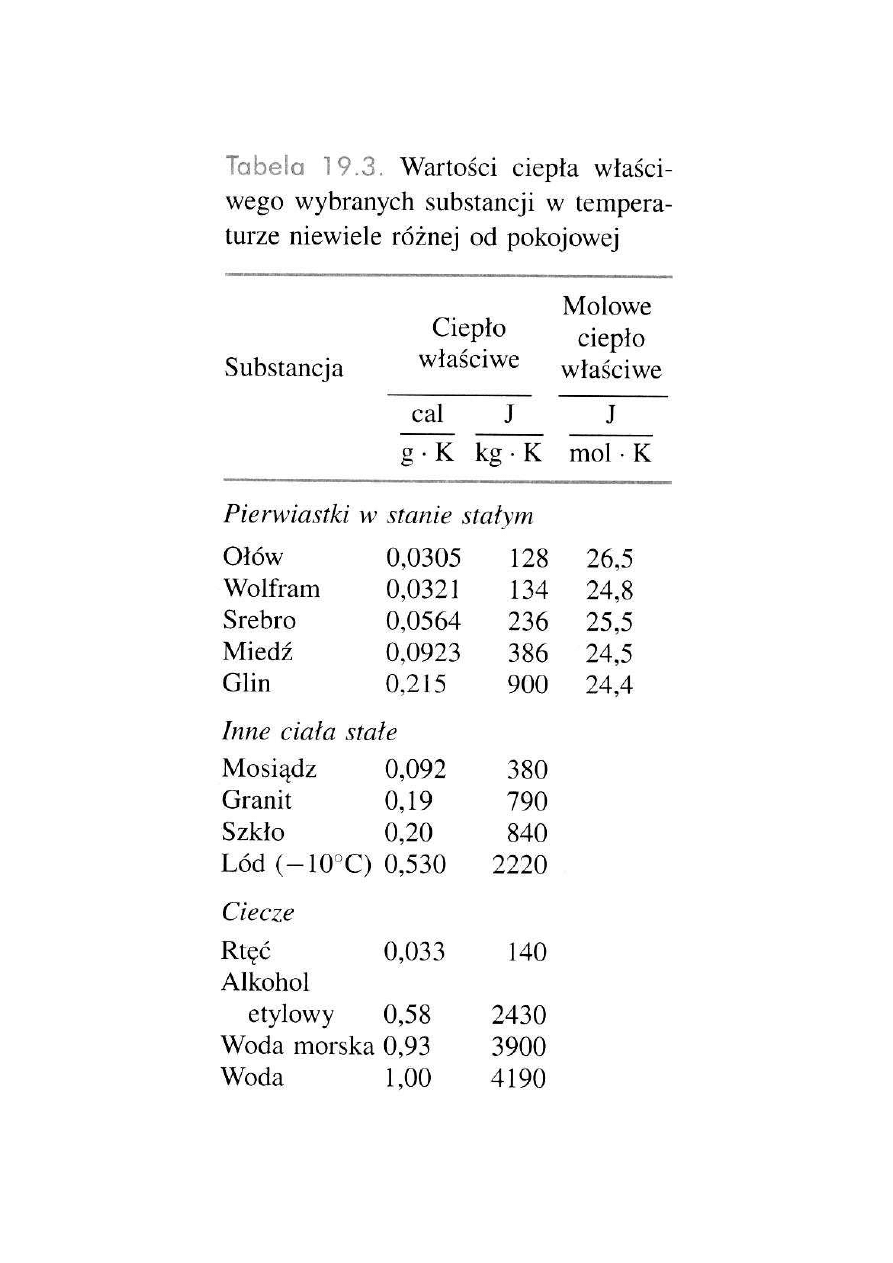
CIEPŁO WŁAŚCIWE
Ciepło molowe:
przy stałej objętości c
V
= C
V
/N
przy stałym ciśnieniu c
p
= C
p
/N
Ciepło właściwe:
przy stałej objętości c
wV
= C
V
/m
przy stałym ciśnieniu c
wp
= C
p
/m
Ciepło właściwe to ilość ciepła, której należy
dostarczyć, żeby podnieść temperaturę jednego
kilograma substancji o 1 K.
CIEPŁO PRZEMIANY
ciepło parowania
Q = c
PAR
m
ciepło topnienia
Q = c
TOP
m
T
TOP
[K]
c
TOP
kJ/kg
T
WRZ
[K]
c
PAR
kJ/kg
tlen
54,8
13,9
90,2
213
woda
273
333
373
2256
miedź
1356
207
2868
4730
Q = c
w
m
∆
T
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
17
CIEPŁO WŁAŚCIWE
1 mol = 6,02 x 10
23

EWR - TERMODYNAMIKA FENOMENOLOGICZNA
18
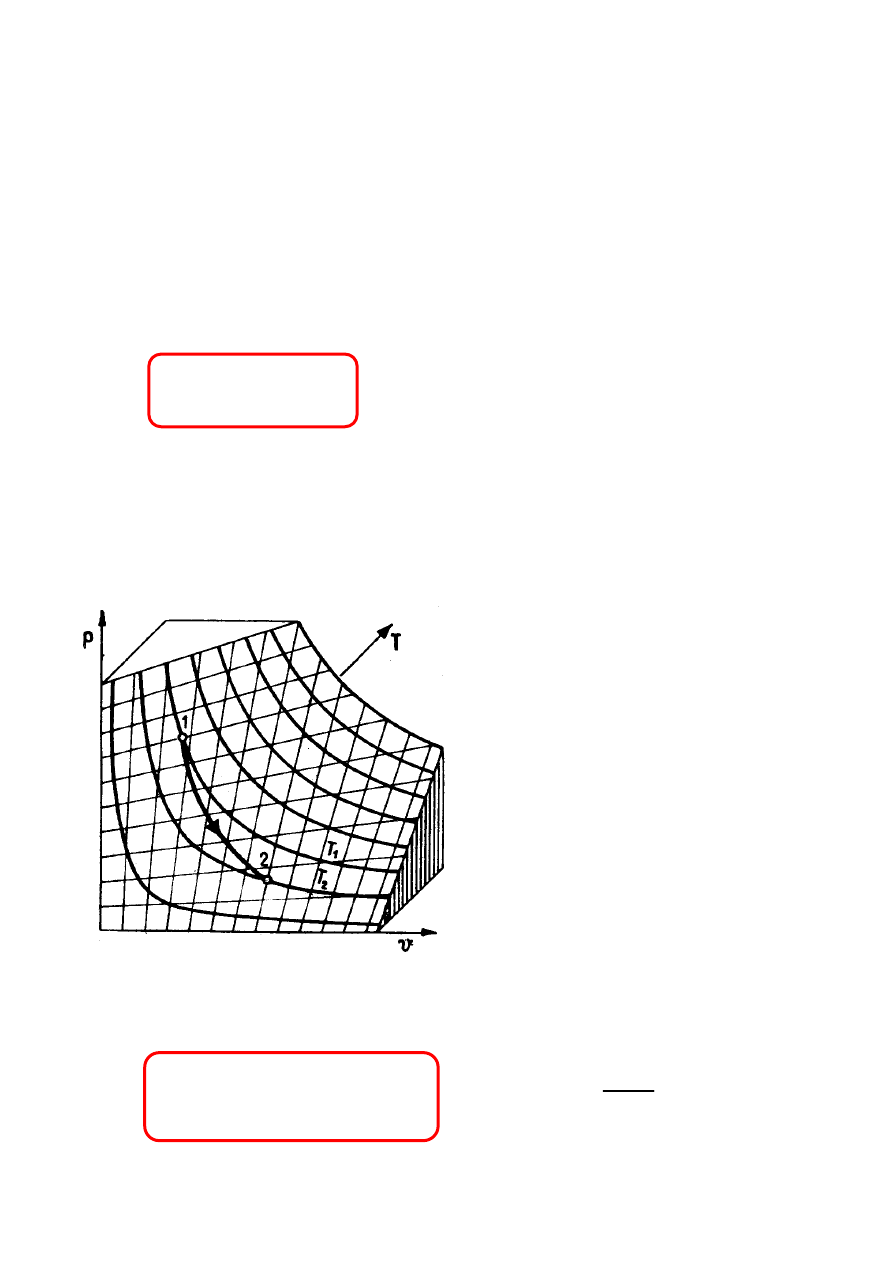
RÓWNANIA STANU
T = T(U, V, N
)
p = p(U, V, N
)
p = p(T , V, N
)
µ
=
µ
(U, V, N
)
Dla N = const.
p = p (V,T
)
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
19
RÓWNANIE STANU
GAZU DOSKONAŁEGO
Dla N = const. równanie stanu gazu doskonałego,
czyli równanie Clapeyrona
pV = NRT
- równanie Clapeyrona
R - stała gazowa R = k N
A
= 8,31 J K
-1
mol
-1
k – stała Boltzmanna k = 1,38·10
-23
J K
-1
T = const. – izotermy
p = const. – izobary
V = const. – izochory
Równanie Poissona (rówanie adiabaty):
.
pV
const
κ
=
1
>
=
V
p
C
C
κ
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
20
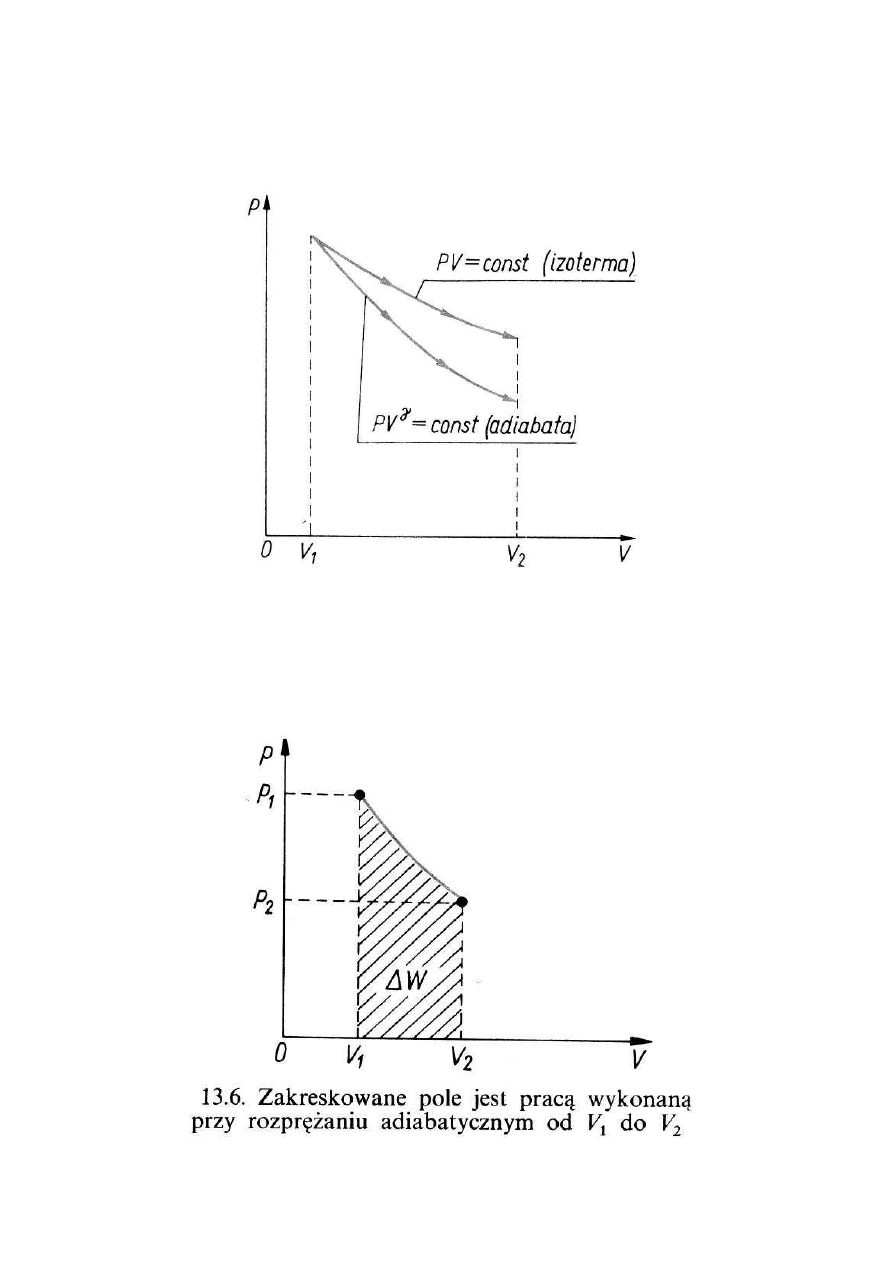
ADIABATA i IZOTERMA
Praca siły zewnętrznej
dW = F dx =
−
pA dx =
−
p dV
Praca wykonana
przez układ:
∫
=
pdV
W
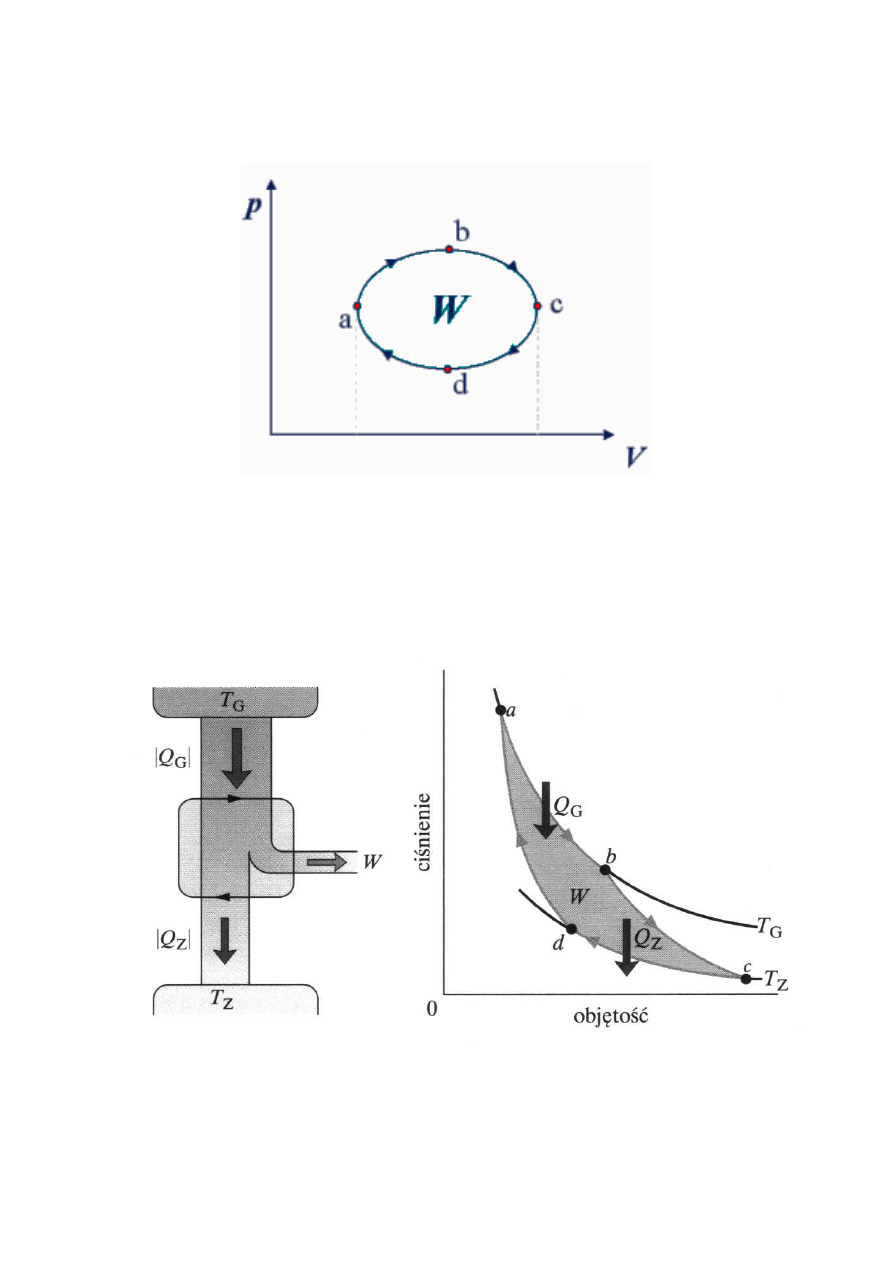
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
21
CYKLE TERMODYNAMICZNE
SILNIK CARNOTA
Halliday, Resnick, Walker, Podstawy fizyki, PWN 2003 , tom 2
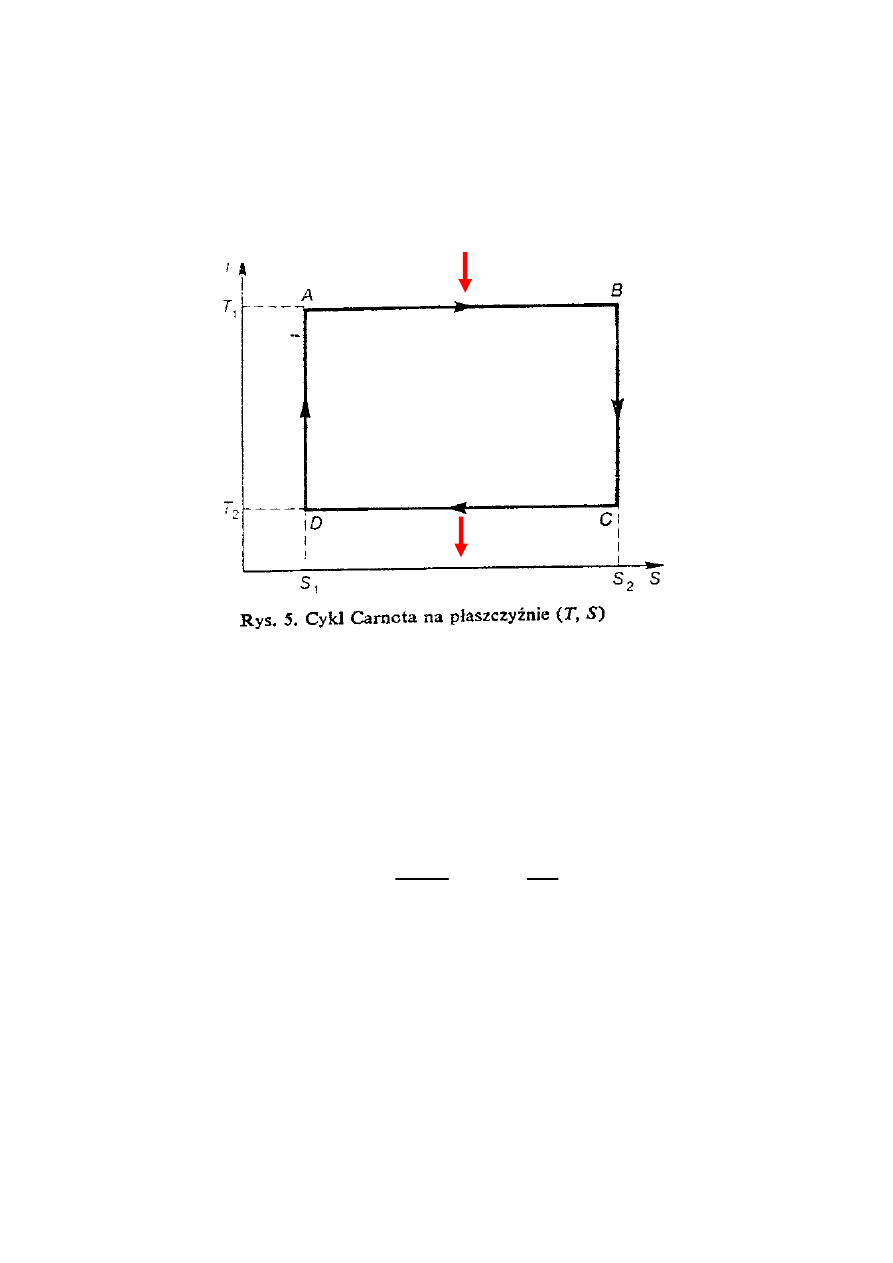
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
22
CYKL CARNOTA
Cykl Carnota na płaszczyźnie
(T, S)
∆
S = 0
∆
S = Q(A,B)/T
1
+ Q(C,D)/T
2
Sprawność silnika
1
2
1
T
T
Q
W
AB
−
=
=
η
W procesie przejścia od stanu A do B układ wykonuje
maksymalną możliwą pracę wtedy, gdy proces jest
odwracalny.
Zmianę entropii układu kompensuje zmiana entropii
otoczenia.
Q(A,B)
Q(C,D)
T
dS = dQ/T
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
23
KONSEKWENCJE DRUGIEJ
ZASADY TERMODYNAMIKI
1.
nie można zbudować perpetuum mobile drugiego
rodzaju
2.
gdy dwa ciała o różnych temperaturach znajdują
się w kontakcie termicznym, to ciepło przepływa
z ciała o wyższej temperaturze do ciała o niższej
temperaturze
3.
ż
adna cykliczna maszyna cieplna, pracująca
między temperaturą górną T
1
i dolną T
2
nie
może mieć sprawności większej niż (T
1
-T
2
)/ T
1
4.
w układzie zamkniętym entropia nie może maleć
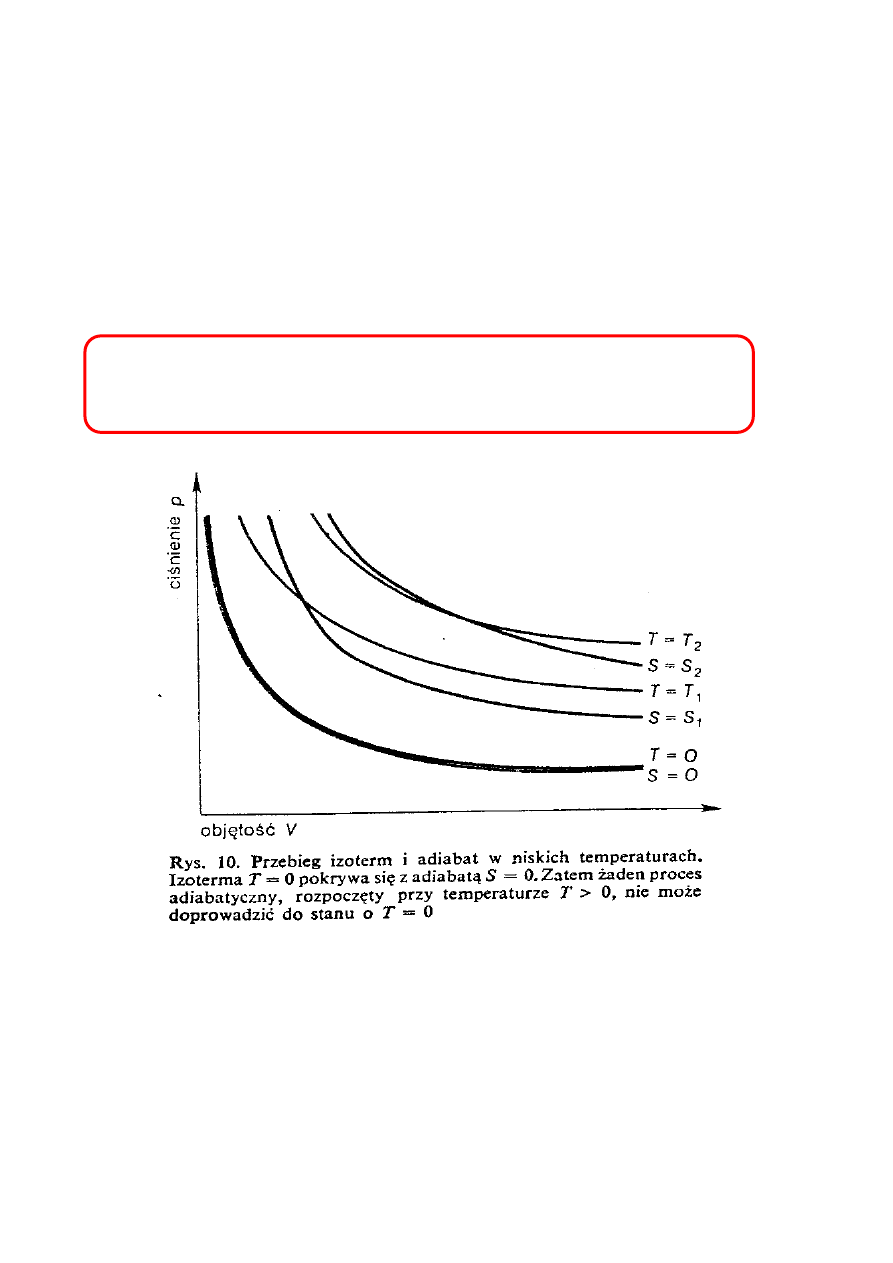
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
24
III ZASADA TERMODYNAMIKI
Opisuje podstawowe właściwości układów w niskich
temperaturach.
Sformułowanie Plancka
W stanach równowagi o zerowej temperaturze
wartość entropii wynosi zero.
Izoterma T = 0 i adiabata S = 0 pokrywają się
Ż
aden proces adiabatyczny rozpoczęty przy T > 0
nie może doprowadzić do T = 0.
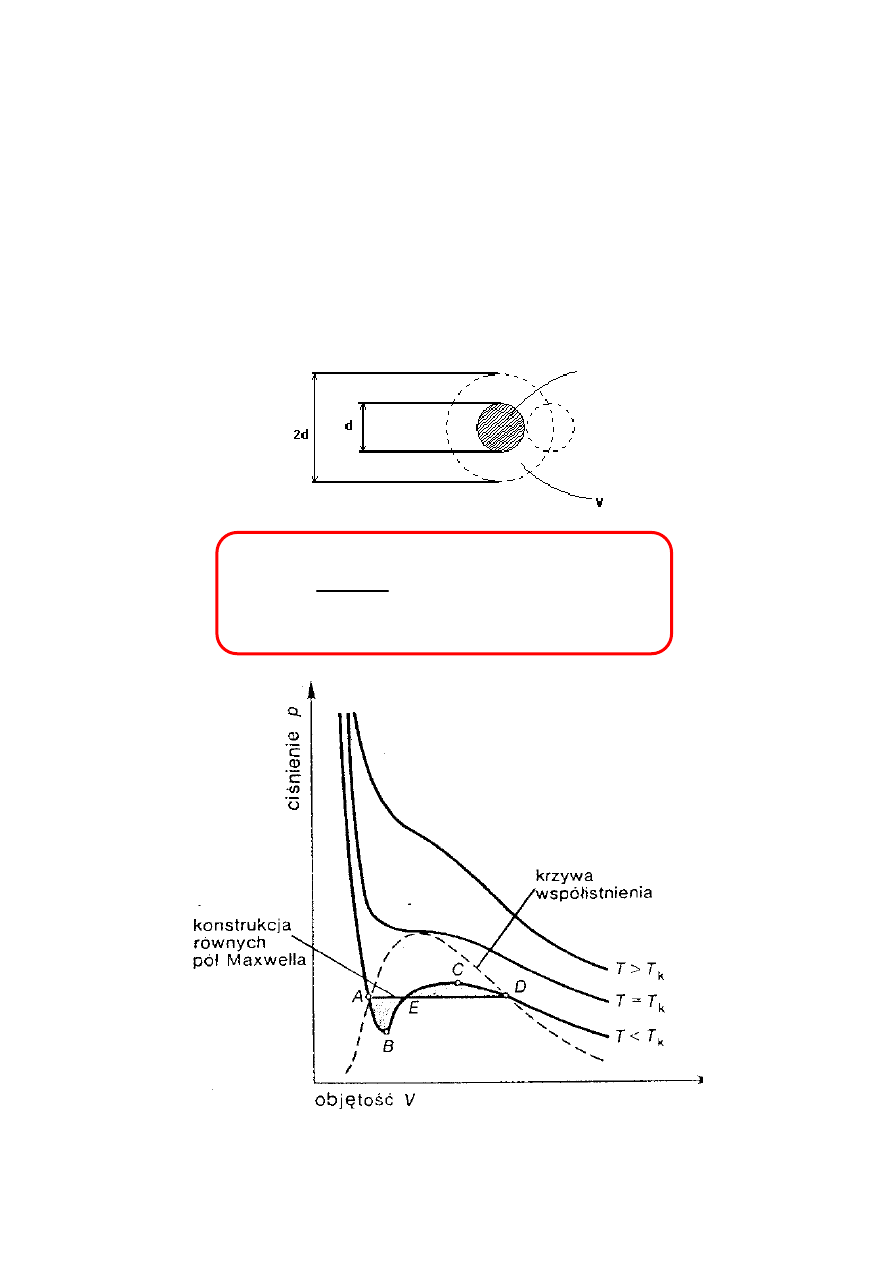
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
25
RÓWNANIE VAN DER WAALSA
•
GAZ DOSKONAŁY
pV = NRT
- równanie Clapeyrona
•
GAZ RZECZYWISTY
(
)
NRT
bN
V
V
aN
p
=
−
+
2
2
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
26
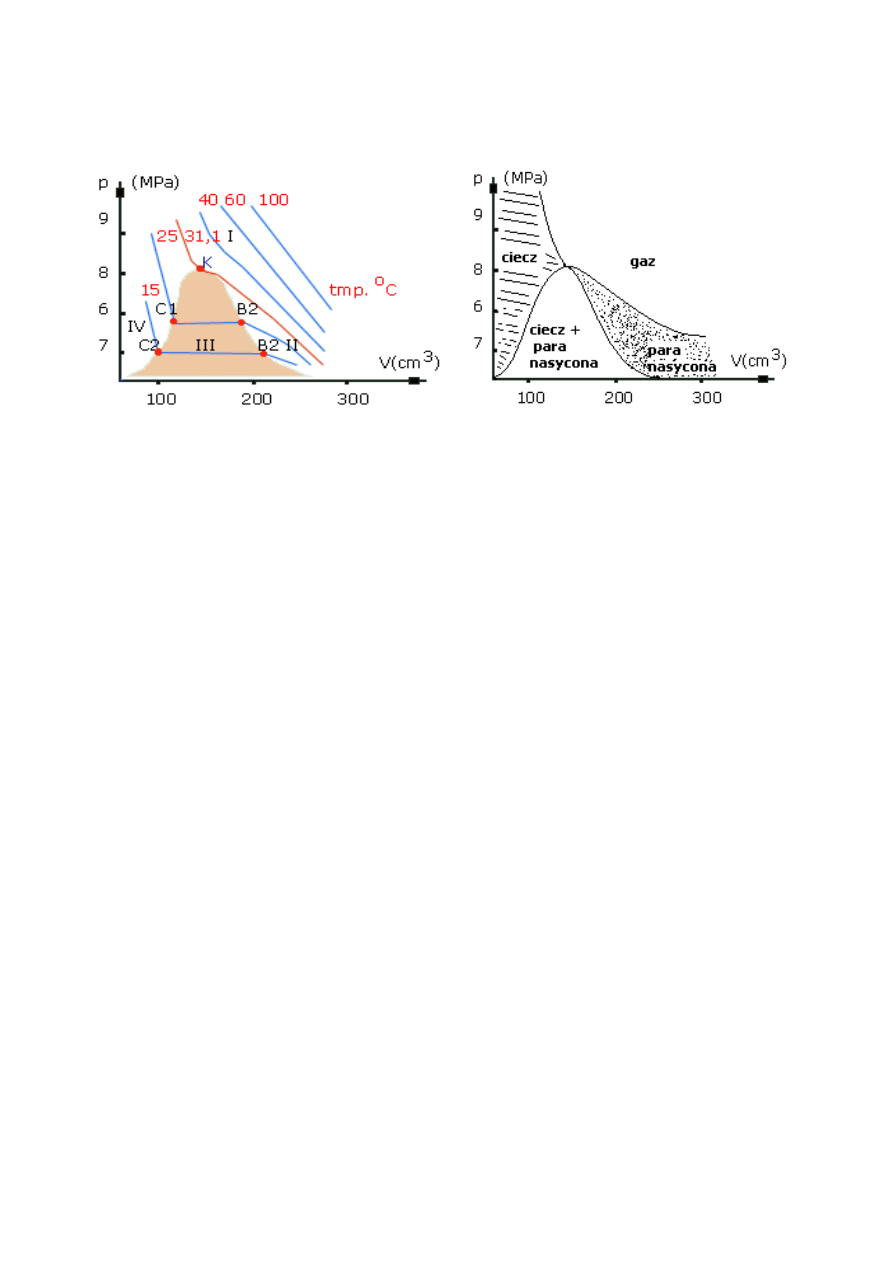
IZOTERMY DOŚWIADCZALNE
Izotermy doświadczalne CO
2
i podział na obszary fazowe,
gazu, pary nasyconej i cieczy
•
Izotermy dla 100, 60, 40
o
C przypominają kształtem
izotermy gazu doskonałego.
•
Dla +31,1
o
C izoterma krytyczna wykazująca punkt
przegięcia K.
•
Izotermy dla temperatur niższych zawierają stopniowo
coraz to dłuższe odcinki poziome, które odpowiadają
układowi zawierającemu ciecz i parę nasyconą.
Punkt K, zwany punktem krytycznym, jest określony
wartością
temperatury krytycznej, ciśnienia krytycznego
i objętości krytycznej
. Zaciera się w nim różnica między
cieczą i gazem.
W temperaturze powyżej temperatury krytycznej nie może
istnieć dana substancja w stanie ciekłym. Skroplenie
substancji (przejście w stan ciekły) następuje po oziębieniu
gazu poniżej temperatury krytycznej.
(
)
K
K
V
p ,
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
27
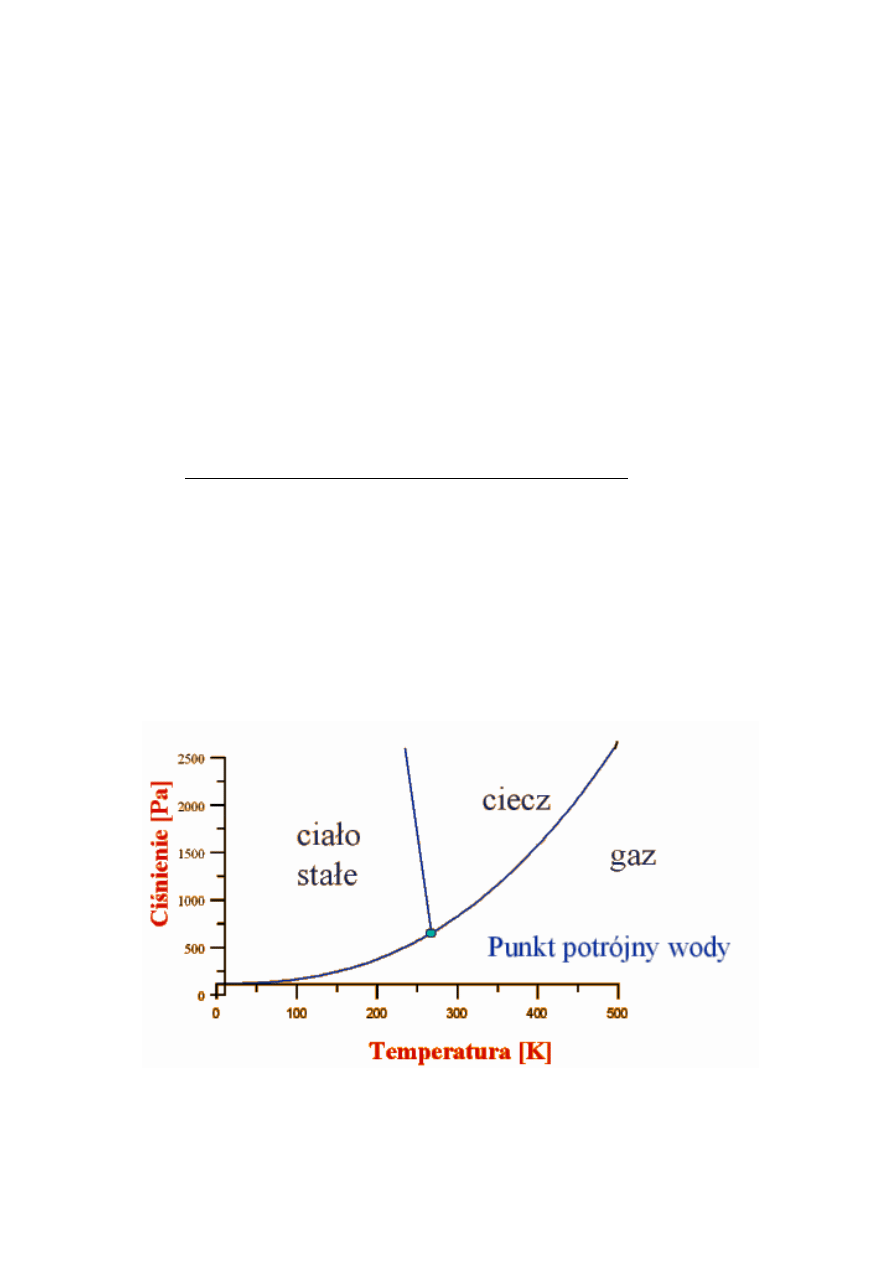
REGUŁA FAZ GIBBSA
Jeżeli układ
r
składnikowy znajduje się w kilku fazach
(na przykład w kilku stanach skupienia) - zawiera
α
faz, to równowaga termodynamiczna wymaga
równości potencjałów chemicznych każdego składnika
we wszystkich fazach:
µ
j
1
=
µ
j
2
=
...
=
µ
j
α
=
µ
j
j = 1,
2, ..., r
liczba termodynamicznych stopni swobody (liczba
parametrów intensywnych mogących zmieniać się
niezależnie) wynosi
f = r + 2 -
α
Ponieważ
f ≥ 0
więc w stanie równowagi może
współistnieć najwyżej
r + 2
faz
Punkt potrójny wody w temp.
273,16 K
Halliday, Resnick, Walker,
Podstawy fizyki,
PWN 2003 , tom 2
r
–
ilość składników
α
–
ilość faz
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
28
ROZSZERZALNOŚĆ CIEPLNA
∆
L =
α
L
∆
T
∆
V =
β
V
∆
T
β
=3
α
T
1
T
2
Halliday, Resnick, Walker,
Podstawy fizyki,
PWN 2003 , tom 2
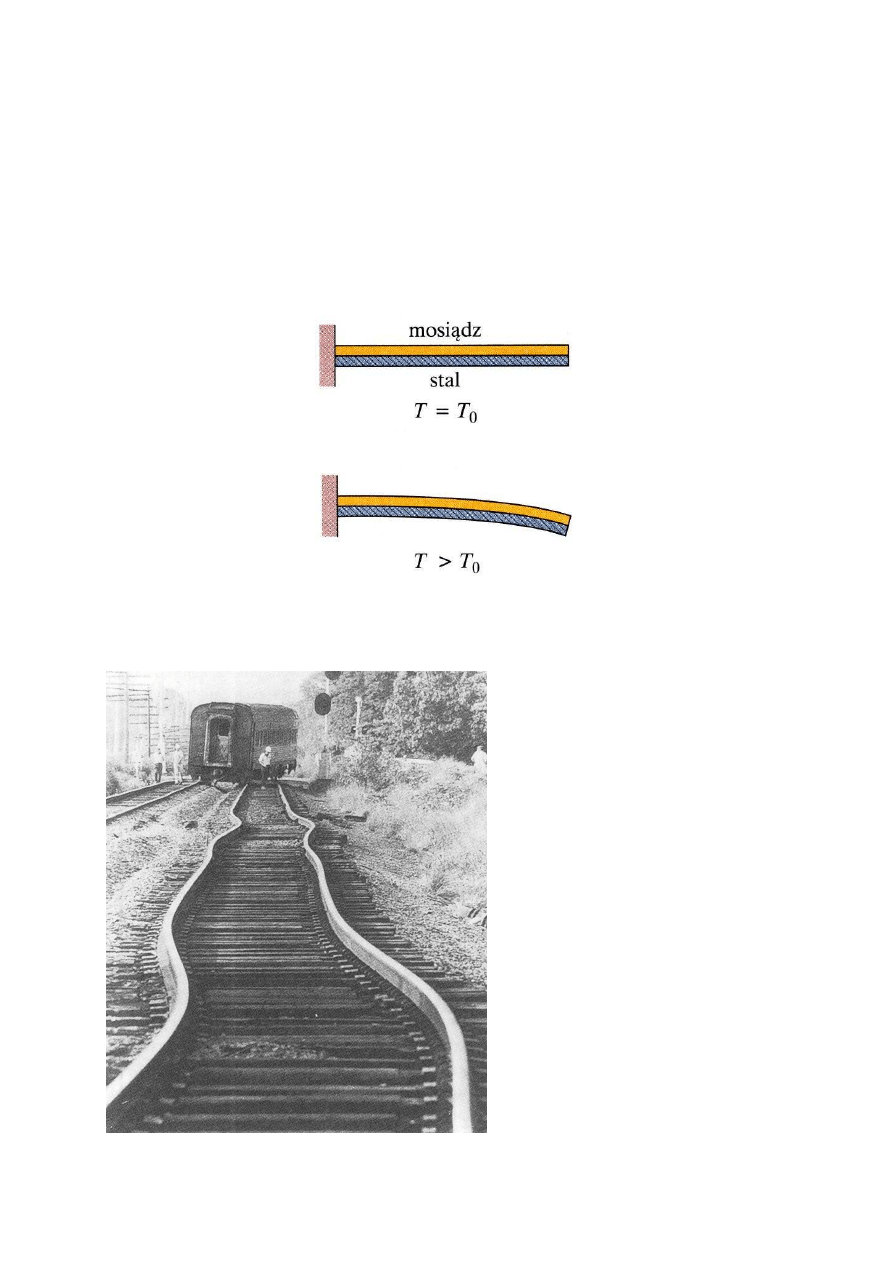
EWR - TERMODYNAMIKA FENOMENOLOGICZNA
29
ROZSZERZALNOŚĆ CIEPLNA
Przykład zastosowania rozszerzalności cieplnej
termometr
bimetal
Rysunki z
Halliday, Resnick, Walker,
Podstawy fizyki,
PWN 2003 , tom 2
Wyszukiwarka
Podobne podstrony:
fizyka termodynamika pr klucz
fizyka, Termodynamika, Termodynamika
Fizyka Termodynamika Zadani ciesiolek id 175608
fizyka termodynamika
termodynamika, Test fizyka: TERMODYNAMIKA
fizyka termodynamika+przemiany, I zasada term
Fizyka - Termodynamika, Fizyka
fizyka termodynamika pr klucz
Fizyka Termodynamika Definicje ciesiolek
,fizyka 1, Termodynamika
Fizyka Termodynamika Wzory ciesiolek
więcej podobnych podstron