1
Ćwiczenie 2
BUDOWA, WŁAŚCIWOŚCI I FUNKCJA BIAŁEK
Część doświadczalna obejmuje:
- ilościowe oznaczanie białek metodą biuretową
- wytrącanie kazeiny w punkcie izoelektrycznym
- frakcjonowanie białek surowicy krwi metodą wysalania siarczanem amonu
- denaturacja białek (termiczna, etanolem o wyższym stężeniu, niektórymi kationami i anionami)
WPROWADZENIE
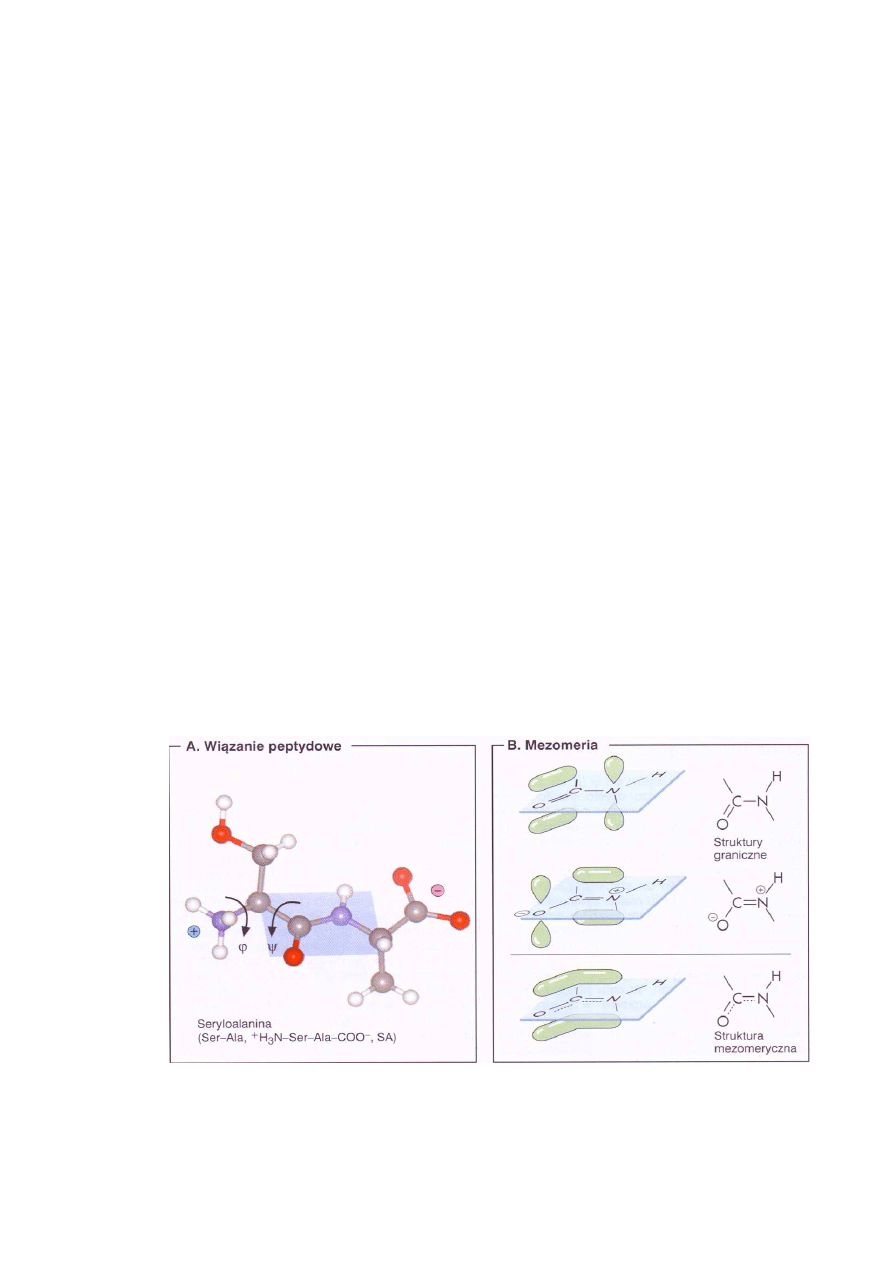
Łączenie się aminokwasów wiązaniami amidowymi prowadzi do utworzenia liniowej makro-
cząsteczki – polipeptydu. Łańcuchy polipeptydowe zawierające ponad 100 reszt aminokwasowych
przyjmuje się określać już jako białka. Wiązanie amidowe, nazywane również wiązaniem pep-
tydowym, powstaje z grupy
α
-karboksylowej i grupy
α
-aminowej. Na ryc. 1A przedstawiono di-
peptyd (seryloalaninę) utworzony z seryny i alaniny. Wiązanie peptydowe jest stabilizowane me-
zomerycznie, gdyż wiązanie C-N ma częściowo charakter wiązania podwójnego C=N (Ryc.
1B). To usztywnienie wiązania peptydowego powoduje, że we wszystkich ułożeniach przestrzen-
nych białek grupy amidowe pozostają płaskie. Swobodna rotacja jest możliwa tylko wokół wią-
zania N-C
α
i C
α
-C, a obroty są opisywane przez wartości kątów torsyjnych
ϕϕϕϕ
(fi) i
ψ
ψ
ψ
ψ
(psi) (Ryc.
1A).
Ryc. 1. Właściwości wiązania amidowego (peptydowego) (Koolman, Röhm 2005)
2
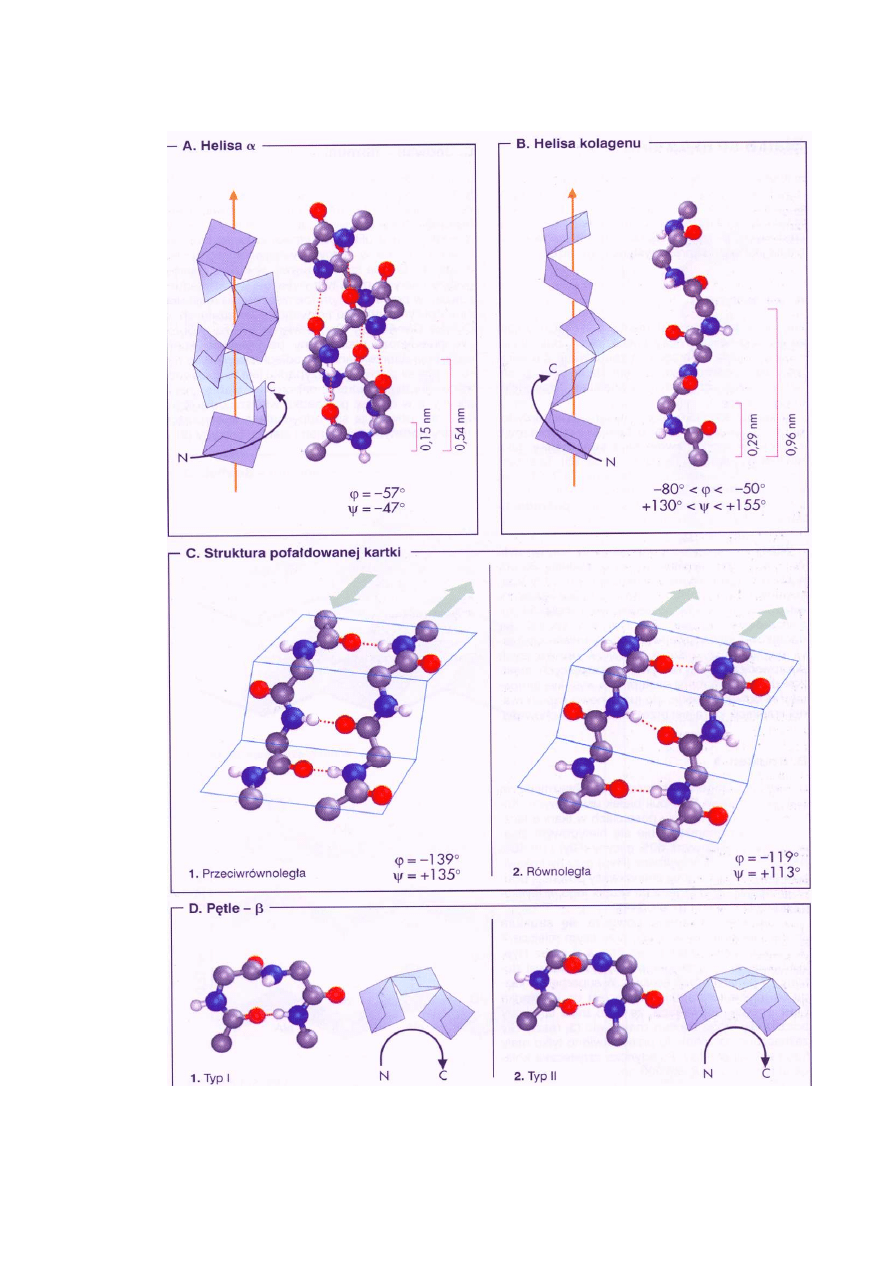
Ryc. 2. Struktury drugorzędowe białek (α-helisa, helisa kolagenu, pofałdowanej kartki, β-pętla)
(Koolman, Röhm 2005)
3
Konformacja łańcucha peptydowego utworzona przez kilka kolejnych reszt aminokwasowych
definiuje strukturę drugorzędową stabilizowaną wiązaniami wodorowymi (Ryc. 2).
Białka, ze względu na skład, dzieli się na białka proste i złożone. Białka proste zbudowane są
tylko z aminokwasów, natomiast białka złożone zawierają szereg różnych komponentów nieami-
nokwasowych, których rodzaj staje się podstawą podziału białek na:
- glikoproteiny - białka zawierające cukry obojętne (galaktoza, mannoza, fukoza), aminocukry
(N-acetyloglukozamina, N-acetylogalaktozamina) lub kwasy pochodne mono-
sacharydów (kwas uronowy, kwas sjalowy)
- lipoproteiny – zawierają fosfolipidy, cholesterol i inne związki lipidowe
- metaloproteiny – zawierają jony metali związane jonowo lub koordynacyjnie
- fosfoproteiny – reszty tyrozyny, treoniny lub seryny są zestryfikowane kwasem fosforowym
- nukleoproteiny – zawierają RNA lub DNA
- chromoproteiny – zawierają grupę prostetyczną, którą stanowią różne związki barwne
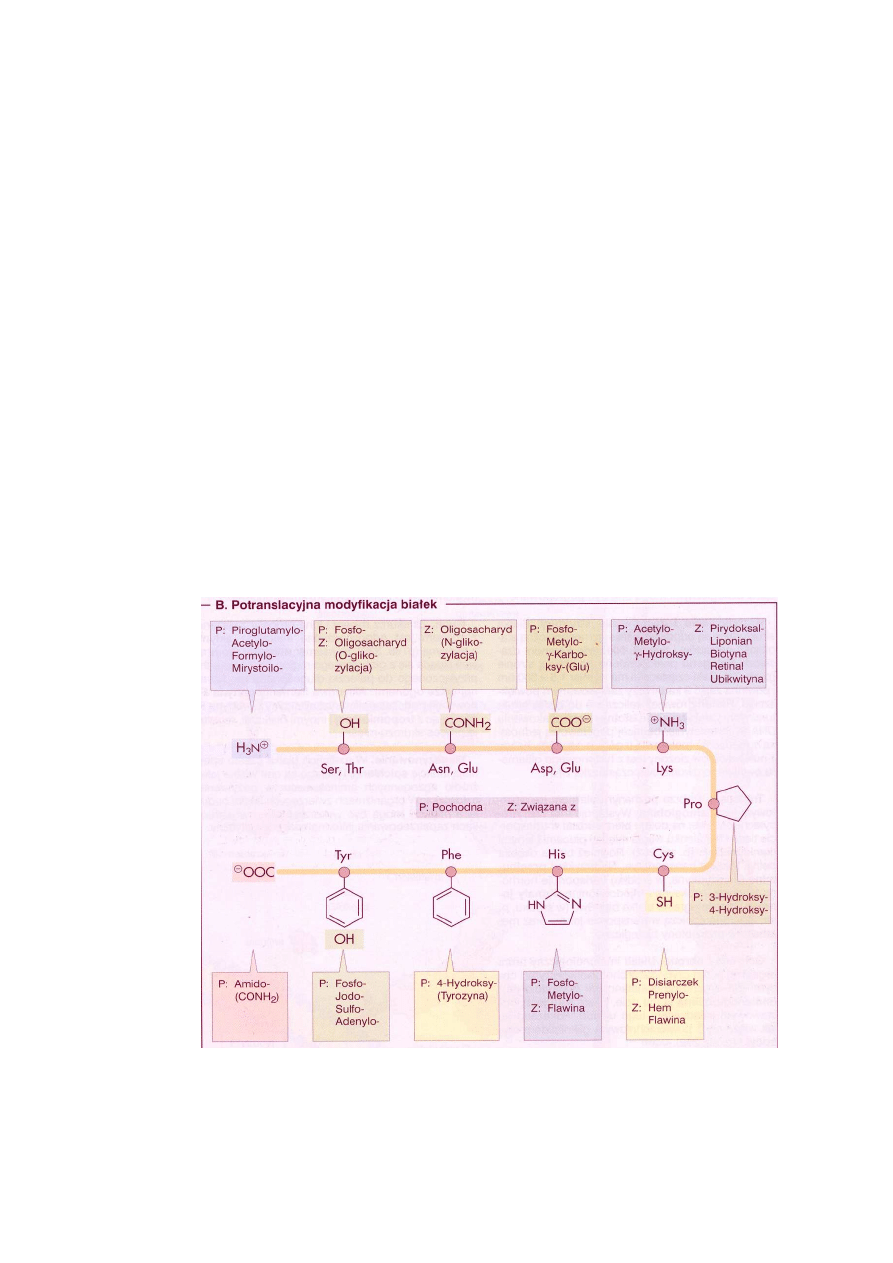
Na ryc. 3 pokazano potencjalne miejsca modyfikacji łańcucha polipeptydowego. Modyfika-
cjom ulegają zwykle polarne reszty aminokwasów, stanowiąc ważne źródło różnorodności białek.
Ryc. 3. Potranslacyjne modyfikacje łańcucha polipeptydowego (Koolman, Röhm 2005)

4
Białka ze względu na pełnione funkcje można podzielić na:
- enzymatyczne – najliczniejsza grupa białek (ponad 2000) o zróżnicowanej masie cząsteczkowej
- strukturalne – są odpowiedzialne za mechaniczną stabilność narządów i tkanek (kolagen, ela-
styna, tubulina, aktyna,
αααα
-keratyna). Do białek strukturalnych zalicza się tak-
że histony pełniące kluczową rolę w upakowaniu DNA w chromatynie
- transportujące – np. hemoglobina uczestniczy w transporcie tlenu i CO
2
Niektóre białka oso-
cza (prealbumina) transportujące hormony, transferyna przenosząca żelazo,
niektóre białka błonowe np. kanały jonowe pośredniczące w transporcie jonów,
nośniki w transporcie metabolitów i jonów, pompy funkcjonujące w transpor-
cie aktywnym jonów i metabolitów
- regulacyjne – białkami są niektóre hormony (somatotropina, insulina), a także receptory
uczestniczące w percepcji różnych cząsteczek sygnałowych. Białkami regulato-
rowymi są także czynniki transkrypcyjne, regulujące ekspresję genów
- odpornościowe – białka układu immunologicznego (np. immunoglobuliny) chronią organizm
przed czynnikami chorobotwórczymi i ksenobiotykami (substancjami obcymi
dla organizmu)
- motoryczne – uczestniczą w procesach związanych z ruchem (aktyna, miozyna); kinezyna
funkcjonuje w przemieszczaniu organelli w komórce
- zapasowe – owoalbumina w białku jaja stanowi źródło aminokwasów dla rozwijającego się za-
rodka; ferrytyna wiąże żelazo w wątrobie, kazeina jest białkiem zapasowym
mleka, niektóre białka budujące mięśnie mogą być wykorzystywane jako mate-
riał energetyczny; także wiele białek roślinnych pełni funkcję zapasową
Ze względu na rozpuszczalność i kształt, białka dzielą się na: globularne (kuliste) i fibrylarne
(włókienkowate, skleroproteiny).
Do białek fibrylarnych należą: α-keratyny włosów, wełny, piór, paznokci, kolageny zawarte
głównie w tkance łącznej, elastyny, fibroina jedwabiu.
Białka globularne obejmują:
-białka obojętne (albuminy, globuliny)
-kwaśne (prolaminy, gluteiny)
-zasadowe (histony, protaminy)
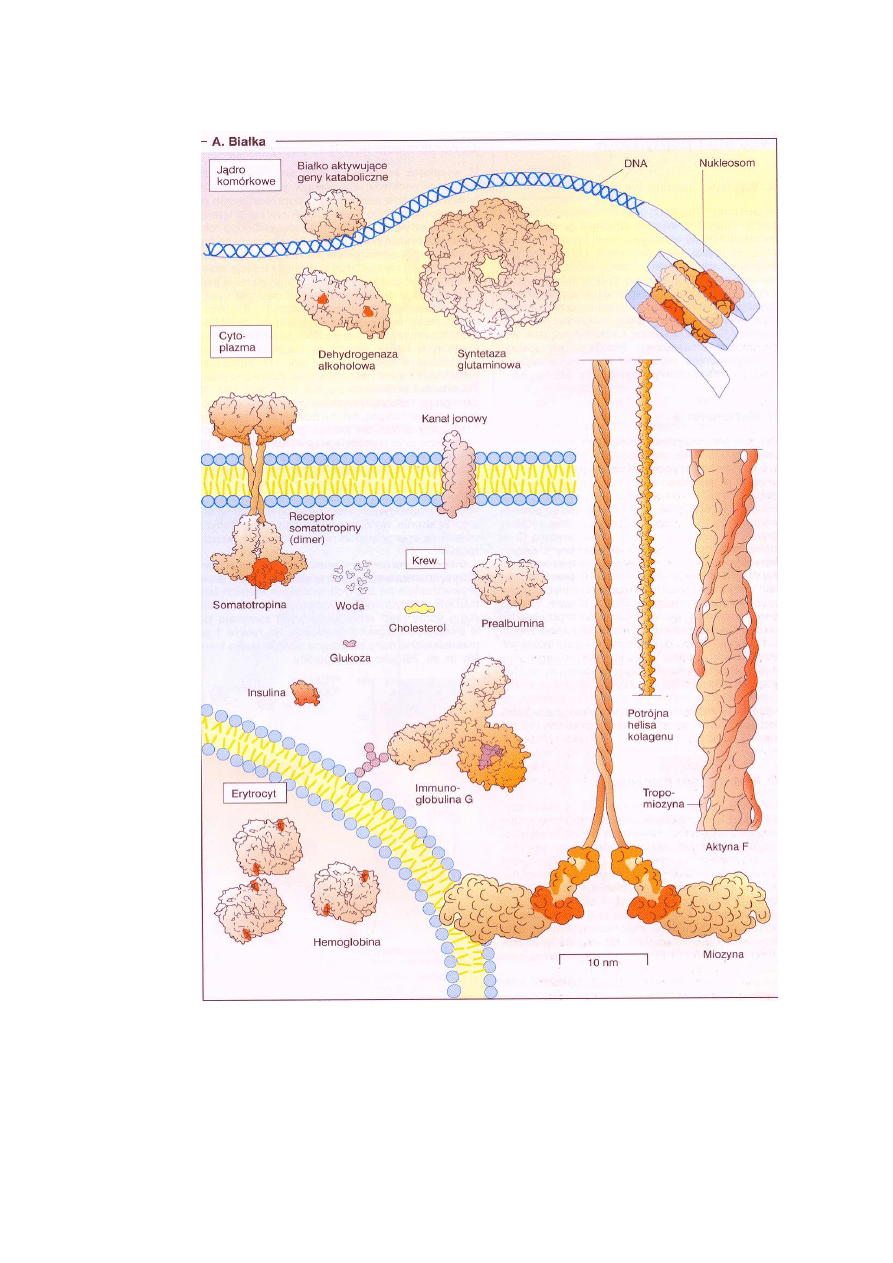
Na ryc. 4 przedstawiono półschematycznie, w około 1,5-milionowym powiększeniu, struktury
kilku wewnątrz- i pozakomórkowych białek.
5
Ryc. 4. Strukturalne i funkcjonalne zróżnicowanie białek (półschematyczne struktury w około 1,5
mln powiększeniu; długość kolagenu w tym powiększeniu wynosi około 30 cm) (Koolman, Röhm
2005)
6
Rozpuszczalność białek globularnych
Cząsteczki białka są amfoterami tworzącymi w roztworach wodnych koloidy. Fazę rozproszo-
ną stanowią cząsteczki białka o wymiarach 5-100 nm i masach cząsteczkowych sięgających nawet
miliona Daltonów (Da). Większość białek wykazuje duże powinowactwo do wody. Takie koloidy
nazywamy hydrofilowymi.
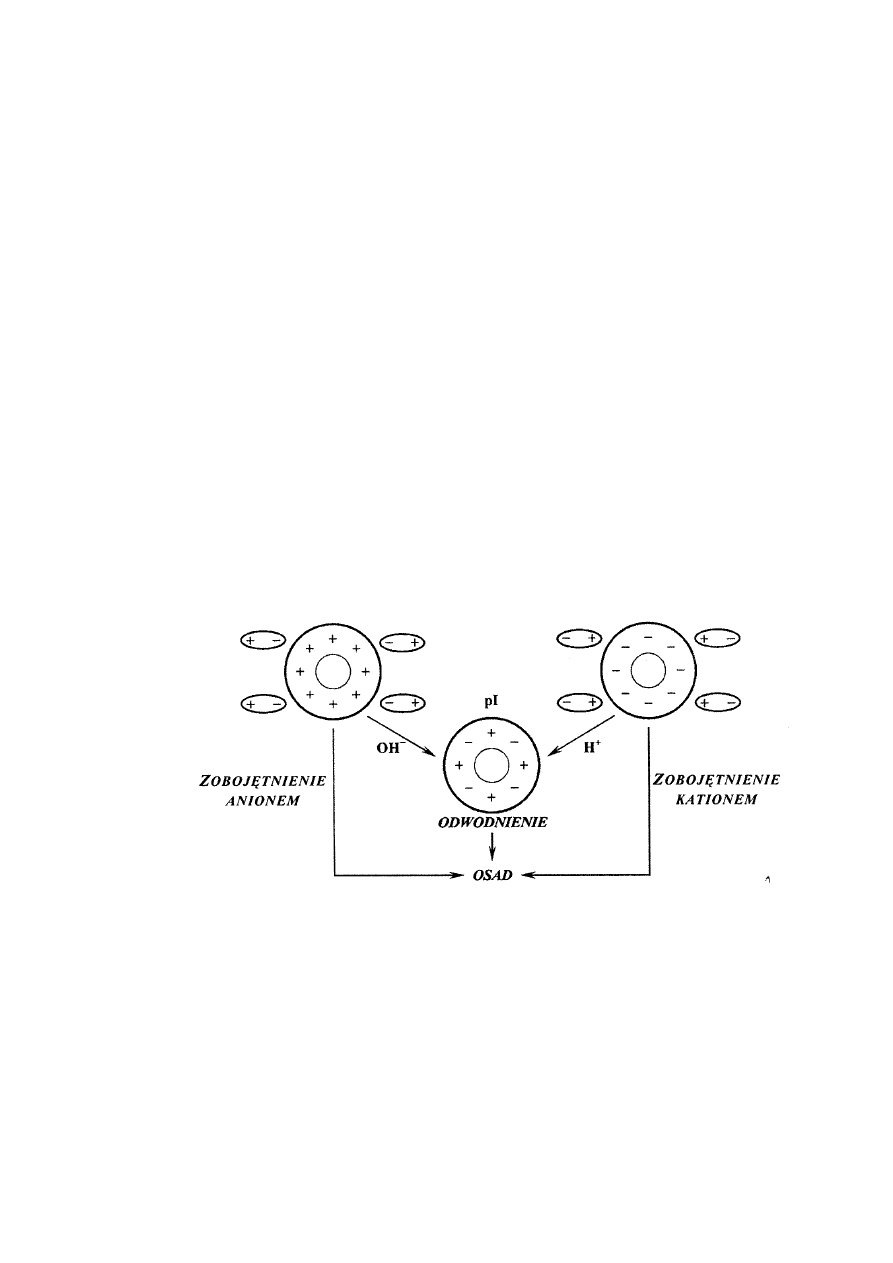
Białka, podobnie jak aminokwasy, posiadają ładunek, lecz w pH równym punktowi izoelek-
trycznemu (pI) są elektrycznie obojętne (Rys. 5). Różne białka mają różne wartości punktu izo-
elektrycznego. W pH powyżej i poniżej pI białka mają ładunek odpowiednio ujemny i dodatni, w
wyniku czego białko zostaje otoczone dipolami wody (hydratacja). Zjawisko to warunkuje roz-
puszczalność w wodzie tak dużych cząsteczek jak białka. Pozbawienie białek ładunku powoduje
dezintegrację otoczki wodnej i utratę rozpuszczalności. Białka różniące się wartościami punktu
izoelektrycznego w tym samym pH środowiska będą posiadały różny ładunek i różne powinowac-
two do wody, co umożliwia ich frakcjonowanie i rozdział.
Ryc. 5. Udział ładunku elektrycznego w procesach wytrącania białka w roztworze
Z powyższego wynika, że wytrącanie białka zachodzi najłatwiej w punkcie izoelektrycz-
nym. Jeśli proces ten będzie przebiegał w niskiej temperaturze (0-5
0
C), to uzyskane w osadzie
białko, po rozpuszczeniu zachowa cechy charakterystyczne dla białka natywnego.
Na ryc. 6 pokazana jest zależność rozpuszczalności białka od pH w warunkach zróżnicowa-
nego stężenia NaCl. Rozpuszczalność białka wyraźnie maleje w pH zbliżonym do pI. Największy
spadek rozpuszczalności obserwuje się w warunkach niskiego stężenia soli (1 mM NaCl).
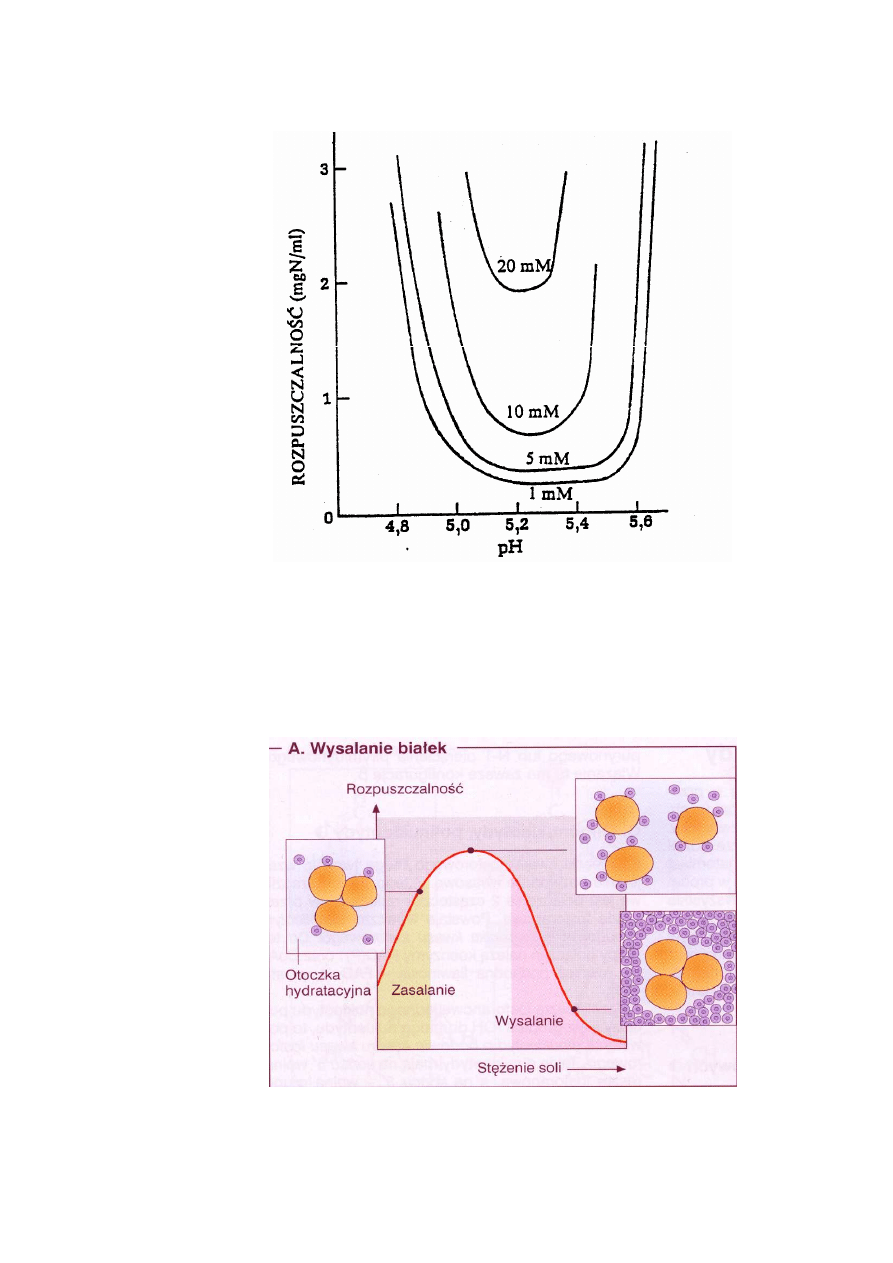
7
Ryc. 6. Wpływ pH i niewielkich stężeń NaCl na rozpuszczalność β-laktoglobuliny w 25
0
C
(Lehninger 1979)
Wpływ stężenia soli na rozpuszczalność białek
Rozpuszczalność jest funkcją zarówno stężenia soli obojętnej, jak też ilości ładunków wszyst-
kich rodzajów jonów znajdujących się w roztworze. Wartości te określają siłę jonową roztworu: µ
= 1/2Σc
i
z
i
2
(c – stężenie jonów; z – ładunek jonów)
Ryc. 7. Zasalanie (wsalanie) i wytrącanie białek (wysalanie) w warunkach rosnącej siły jonowej
roztworu (Koolman, Röhm 2005)

8
Rozpuszczalność białka w wodzie destylowanej jest bardzo mała, natomiast rośnie wraz ze
wzrostem siły jonowej, gdyż rośnie liczba jonów nieorganicznych na powierzchni białka zapobie-
gających ich agregacji. Zjawisko to nazywa się wsalaniem lub zasalaniem (Ryc. 7). Przy odpo-
wiednio dużej sile jonowej, sól odciąga cząsteczki wody od powierzchni białek i doprowadza do
ich agregacji (wysalanie białka) (Ryc. 7). Białko(a) wysolone rozpuszcza się ponownie po usu-
nięciu soli lub po rozcieńczeniu roztworu.
Zdolność wysalająca soli zależy zarówno od charakteru kationu, jak i anionu. Ze względu na
siłę wysalającą można uszeregować kationy i aniony w następujący sposób:
Aniony: cytrynian
3-
> winian
2-
> siarczan
2-
> octan
-
> chlorek
-
> azotan
-
> rodanek
-
Kationy: Th
3+
> Al
2+
> Se
2+
> Sr
2+
> Ca
2+
> Mg
2+
> NH
4
+
> Na
+
> Li
+
Szeregi te noszą nazwę szeregów liotropowych lub szeregów Hofmeistera.
Rozpuszczalność białek jest także funkcją stałej dielektrycznej środowiska, gdyż w warun-
kach nie zmieniającego się pH i siły jonowej maleje po dodaniu rozpuszczalników o niskiej
stałej dielektrycznej takich jak: etanol, aceton, glikol etylenowy. Białka w takich warunkach
agregują, gdyż dodany rozpuszczalnik zmniejsza stopień uwodnienia grup jonowych przez
zmniejszenie ilości dipoli wodnych na powierzchni cząsteczki białka. Obniżenie stałej dielek-
trycznej roztworu przez dodanie rozpuszczalnika powoduje wzrost siły przyciągania pomiędzy
przeciwnie naładowanymi grupami.
Rozpuszczalność większości białek zwiększa się w ograniczonym zakresie (0 – 40
0
C) wraz ze
wzrostem temperatury. W temperaturze powyżej 40-50
0
C większość białek zaczyna tracić trwa-
łość i ulega denaturacji. Białka mogą także denaturować w szczególnie drastycznych warunkach tj.
skrajne pH, wysoka temperatura, promieniowanie jonizujące. Denaturacja pociąga trwałą utratę
funkcji biologicznych i wiąże się ze zmianami w strukturze drugo-, trzecio- i czwartorzędo-
wej białka.
9
WYKONANIE
Kolorymetryczne oznaczanie białek metodą biuretową
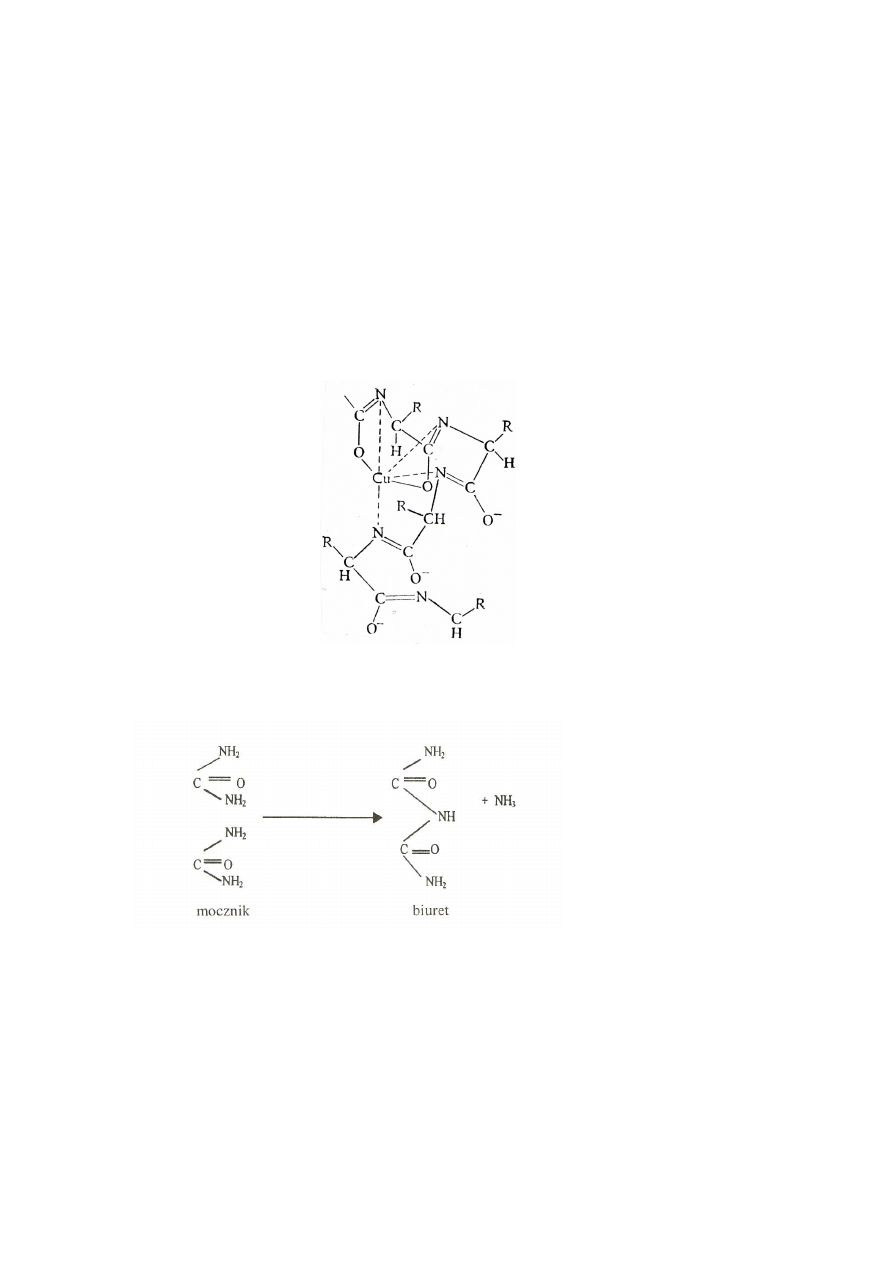
Zasada metody:
Metoda polega na oznaczaniu natężenia barwy powstałej w wyniku wytworzenia związków
kompleksowych białek z jonami miedzi (II) w środowisku zasadowym, z maksimum absorbancji
przy
λ
= 540 nm. Intensywność barwy w reakcji biuretowej jest proporcjonalna do liczby wiązań
peptydowych. Zależność ta jest wykorzystywana do ilościowego oznaczania białek. Czułość me-
tody - 0,1 mg/ml.
Nazwa reakcji pochodzi od biuretu - związku powstającego w wyniku kondensacji dwóch cząste-
czek mocznika, zawierającego w swej cząsteczce wiązania amidowe
Metoda biuretowa nie nadaje się do oznaczania białek w obecności soli amonowych, gdyż jon
amonu daje również barwne kompleksy z jonami miedzi (II). W reakcji przeszkadza także siarczan
(VI) magnezu, ponieważ wytrącający się w środowisku nierozpuszczalny wodorotlenek magnezu
maskuje właściwy odczyn.
10
Odczynniki:
- standardowy roztwór albuminy - 10 mg/ml w 0,9% NaCl
- odczynnik biuretowy: 1,5 g 5hydratu CuSO
4
i 6,0 g winianu sodu i potasu rozpuścić w 500 ml
wody dest. w kolbie miarowej na 1000 ml. Następnie małymi porcjami stale mieszając dodać 300
ml
10% NaOH i uzupełnić objętość wodą dest. do 1 l. Dodać 2g KJ. Odczynnik jest stabilny.
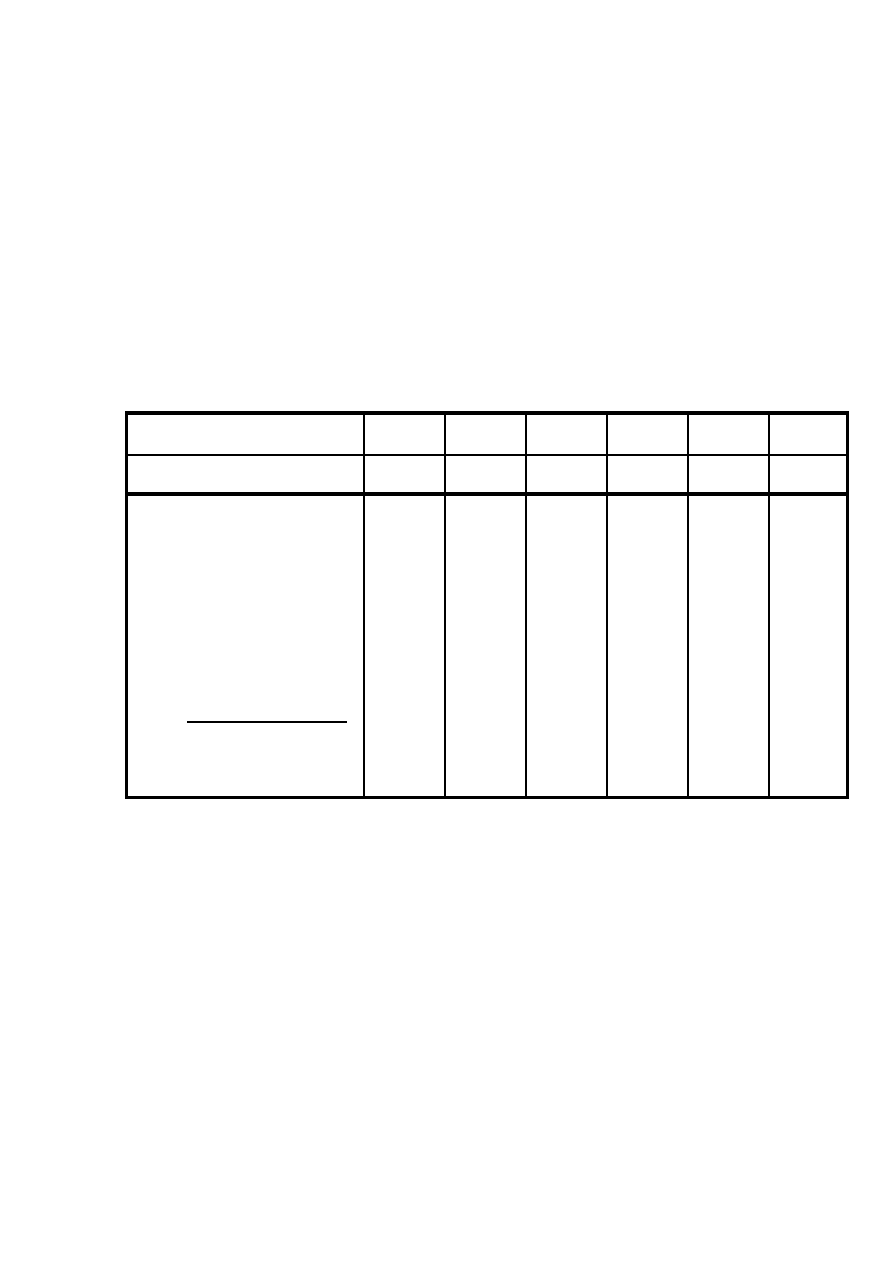
Wykonanie krzywej standardowej i oznaczenie stężenia białek w surowicy krwi
Do suchych probówek odmierz pipetą kolejno podane w tabeli objętości standardowego roz-
tworu albuminy, wody i odczynnika biuretowego. Każdą próbę wykonaj w dwóch powtórzeniach.
Nr próby
1
2
3
4
5
6
Stężenie albuminy (mg/próbę)
1
2
3
4
5
0
Roztwór standardowy (ml)
Woda destylowana (ml)
Odczynnik biuretowy (ml)
A
1
A
540nm
A
2
A
śr
K =
mg albuminy w próbie
A
540 nm
0,1
0,4
2,0
0,2
0,3
2,0
0,3
0,2
2,0
0,4
0,1
2,0
0,5
0
2,0
0
0,5
2,0
Równocześnie oznacz zawartość białka w 10-krotnie rozcieńczonej surowicy krwi (do oznaczeń
pobierz 0,5 i 0,1 ml; w tym drugim przypadku próbę uzupełnij wodą do 0,5 ml). Po upływie 30
min zmierz absorbancję prób przy długości fali
λ
= 540 nm w 1 cm kuwetach. Pomiaru dokonaj
względem próby zerowej nie zawierającej białka (próba 6). Zapisz wyniki w tabeli. Oblicz współ-
czynnik kierunkowy K. Narysuj krzywą wzorcową (zależność wartości absorbancji od stężenia
białka w próbie). Przy obliczaniu ilości białka w próbie stosuj obliczony współczynnik K. Z ozna-
czonej w próbie zawartości białka oblicz stężenie białka w surowicy.

11
Wytrącanie i denaturacja białek
Wytrącanie białek
Wytrącanie białek w punkcie izoelektrycznym
Do 1 ml 0,1% roztworu kazeiny, rozpuszczonej w 50 mM roztworze octanu sodu, dodawać
bardzo powoli pipetą Pasteura, cały czas delikatnie wytrząsając, około 1,5 ml 0,5 M roztworu
kwasu octowego. Obserwować pojawianie się zmętnienia pochodzącego od wytrącającego się
białka, które powinno rosnąć z upływem czasu. Po 5 min dodać porcjami jeszcze około 1,5 ml
0,5 M roztworu kwasu octowego i obserwować czy wytrącona w pI kazeina rozpuszcza się po ob-
niżeniu pH roztworu (wartość pI kazeiny wynosi 4,7)
Frakcjonowanie białek surowicy krwi metodą wysalania siarczanem amonu
Do wysalania białek stosujemy najczęściej związki o wysokim powinowactwie do wody tj.
siarczan (VI) amonu lub siarczan (VI) sodu.
Ćwiczenie wykonujemy w probówkach wirówkowych. Do 2 ml
surowicy (10-krotnie roz-
cieńczonej 0,9% roztworem NaCl) dodać 2 ml nasyconego roztworu (NH
4
)
2
SO
4
. Po zmieszaniu
roztworów uzyskuje się półnasycenie (50% nasycenie) siarczanu (VI) amonu. Agregujące globuli-
ny odwirować w wirówce stołowej, a następnie zlać klarowny supernatant do suchej probówki
wirówkowej. Do osadu globulin dodać niewielką ilość wody destylowanej do całkowitego roz-
puszczenia białek. Do przelanego supernatantu dodawać, cały czas wytrząsając, kryształki
(NH
4
)
2
SO
4
, tak by uzyskać roztwór nasycony (kryształki siarczanu amonu przestają się rozpusz-
czać). Wzrost siły jonowej roztworu powoduje wytrącanie się frakcji albumin.
Wytrącanie białek surowicy krwi etanolem
Do 0,5 ml surowicy 10x rozcieńczonej 0,9% roztworem NaCl i oziębionej w lodzie dodać 1 ml
96% etanolu. Powstaje zmętnienie, które znika po natychmiastowym rozcieńczeniu 0,9% NaCl lub
wodą.
Denaturacja białek
Termin ten dotyczy wszystkich zmian w strukturze cząsteczki białka, w wyniku których białko
traci swoje biologiczne właściwości. Denaturacja następuje wówczas, gdy pod wpływem czynni-
ków fizycznych lub chemicznych ulega zniszczeniu struktura IV-, III- lub II-rzędowa.

12
Denaturacja cieplna białek
2 ml
1% roztworu albuminy lub 1% roztworu białka jaja kurzego ogrzać do zagotowania. Two-
rzy się biały osad wytrąconego białka.
Denaturacja białek etanolem
Rozpuszczalniki organiczne (etanol, aceton, eter) i detergenty działają na strukturę przestrzen-
ną cząsteczki białka, osłabiając wiązanie hydrofobowe, reagują bezpośrednio z naładowanymi
grupami na powierzchni cząsteczki i dezorganizują płaszcz wodny cząsteczki. Działanie denatu-
rujące etanolu objawia się dopiero przy większych jego stężeniach, po dłuższym czasie dzia-
łania i w wyższej temperaturze (20
0
- 30
0
C).
Do probówki dodać 1 ml 1% albuminy i 1 ml 96% etanolu. Po godzinie rozcieńczyć zawartość
probówki wodą. Osad nie rozpuszcza się. Porównaj z ćwiczeniem, w którym białka były wytrą-
cane etanolem.
Strącanie białek za pomocą kationów
Białka w pH wyższym od pI posiadają ładunek ujemny i mogą reagować z kationami. Kationy
metali alkalicznych dają sole dobrze dysocjujące i rozpuszczalne w wodzie, natomiast kationy me-
tali ciężkich (Fe
2+
, Cu
2+
, Hg
2+
, Pb
2+
, Ag
+
) tworzą sole nierozpuszczalne.
Do 0,5 ml 1% roztworu albuminy dodać parę kropel 1% roztworu FeCl
3
. Wytrąca się osad
białczanu żelaza (III). Wykonać analogiczną próbę z HgCl
2
, Pb(CH
3
COO)
2
oraz AgNO
3
.
Strącanie białek kwasem sulfosalicylowym i trójchlorooctowym
COOH
OH
HO
3
S
C
Cl
Cl
Cl
COOH
Kwas sulfosalicylowy Kwas trójchlorooctowy
Do 0,5 ml 1% roztworu albuminy dodać 0,5 ml 10% roztworu kwasu trójchlorooctowego.
Końcowe stężenie kwasu niezbędne do odbiałczania nie powinno być niższe niż 5%.
Do 0,5 ml
1% roztworu albuminy dodać kilka kropel 20% roztworu kwasu sulfosalicylowego.

13
Zagadnienia do przygotowania:
- budowa i właściwości wiązania amidowego (peptydowego)
- struktury drugorzędowe białek (wiązania stabilizujące strukturę)
-wiązania stabilizujące III- i IV- rzędową strukturę białek
- białka proste i złożone; przykłady potranslacyjnej modyfikacji łańcuchów bocznych
aminokwasów
-podział białek ze względu na funkcję (przykłady)
- kolorymetria (zasada ilościowego oznaczania białek metodą biuretową)
-właściwości białek w roztworze (zależność rozpuszczalności białek od pH, siły jonowej, stałej
dielektrycznej rozpuszczalnika, temperatury)
-zasada wytrącania białek w pI, wytrącania przez wysalanie lub obniżenie stałej dielektrycznej
roztworu
- denaturacją białek (termiczna, wyższe stężenie etanolu, kationy metali ciężkich, niektóre kwasy
organiczne)
Piśmiennictwo:
Biochemia – JM Berg, JL Tymoczko, L Stryer PWN, Warszawa, 2005
Biochemia – AL. Lehninger PWR i L, Warszawa, 1979
Ćwiczenia z biochemii - (pod redakcją L. Kłyszejko-Stefanowicz) PWN, Warszawa, 2005
Biochemia. Ilustrowany przewodnik – J Koolman, K-H Röhm, PZWL, Warszawa 2005
Wyszukiwarka
Podobne podstrony:
AMINOKWASY I BIAŁKA BUDOWA WLASCIWOSCI I FUNKCJE
Budowa, właściwości oraz potencjalne funkcje butyrofiliny
Białka – budowa i funkcje 2
Właściwości i funkcje błon biologicznych
Budowa, rola, funkcje skóry
Budowa i właściwości kwasów tlenowych
budowa i właściwości białek
Hormony steroidowe (płciowe) – budowa, przykłady i funkcje biologiczne
Własciwosci funkcjonalne jaj, Wpływ zastosowania czosnku
Tw o granicach wlaściwych funkcji
Pytania dodatkowe na zajęcia laboratoryjne z KSPD, Budowa, właściwości i zastosowania pomiarowe inte
biologia, Budowa komórki i funkcje jej składników
Oko budowa i właściwości
cukry proste i zlozone budowa i wlasciwosci. (2), Prace pisemne
Budowa komórki i funkcje jej składników, Szkoła, przydatne w szkole
więcej podobnych podstron