
Białka – budowa i
funkcje
Małgorzata Sójka

Białka
Białka to związki wielocząsteczkowe,
stanowiące najbardziej różnorodną grupę
peptydów. W ich cząsteczkach może
występować do 20 różnych aminokwasów.
Aminokwasy
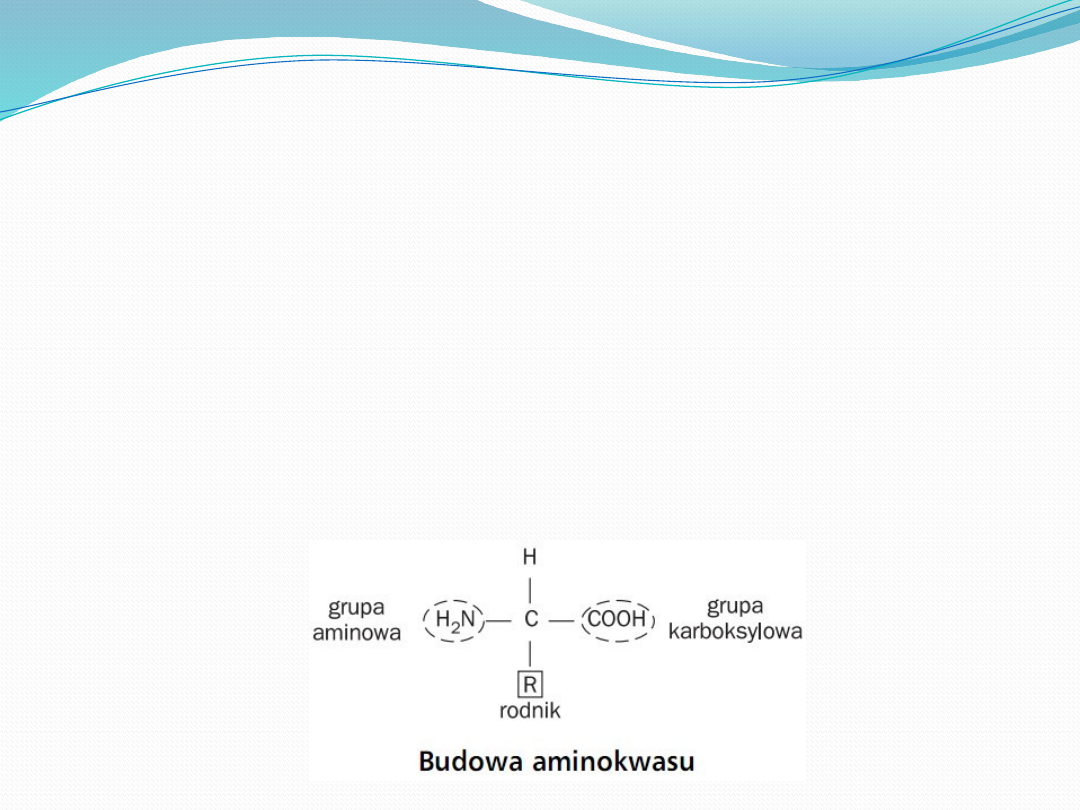
Aminokwasy są podstawowymi jednostkami
strukturalnymi białek. Aminokwas zbudowany
jest z grup: karboksylowej, aminowej, atomu
wodoru oraz charakterystycznej grupy R, które
wiążą się kowalencyjnie z atomem węgla,
określanym jako węgiel alfa.
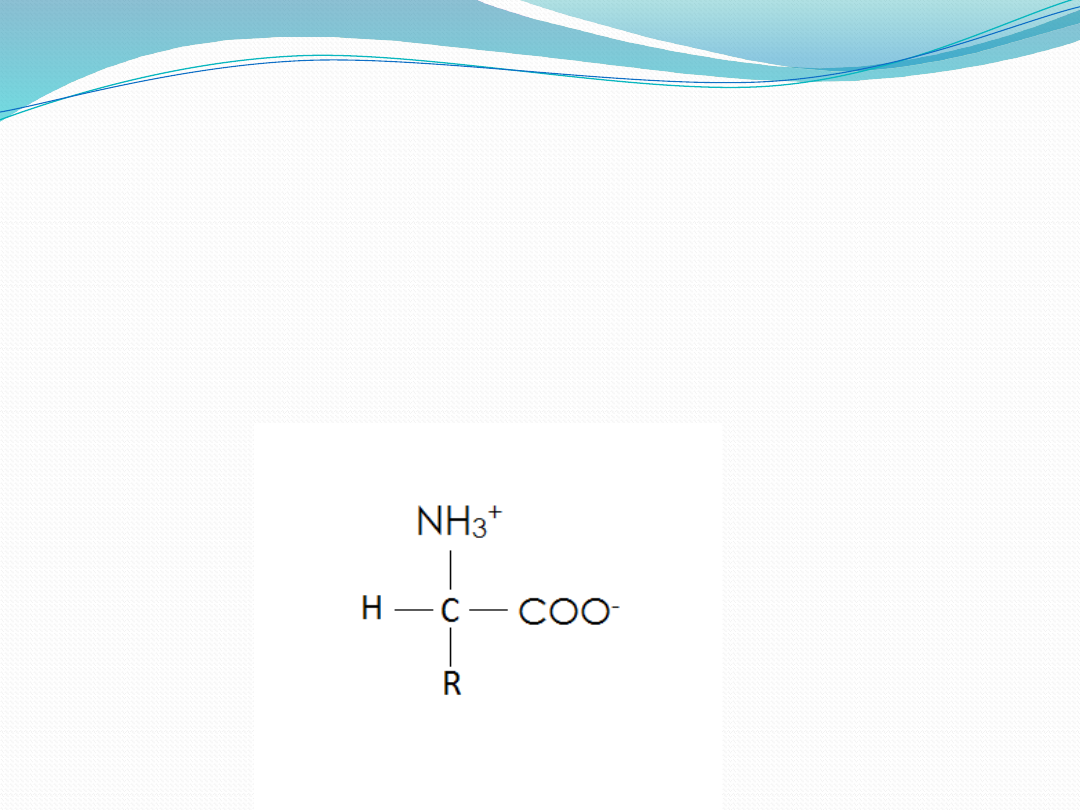
W roztworze, o pH obojętnym aminokwasy
zasadniczo występują w formie zjonizowanej, jako
jony dwubiegunowe. Aminokwas w postaci jonu
dwubiegunowego ma protonową grupę
aminową( NH
3+
)oraz zjonizowaną grupę
karboksylową(COO
-
)

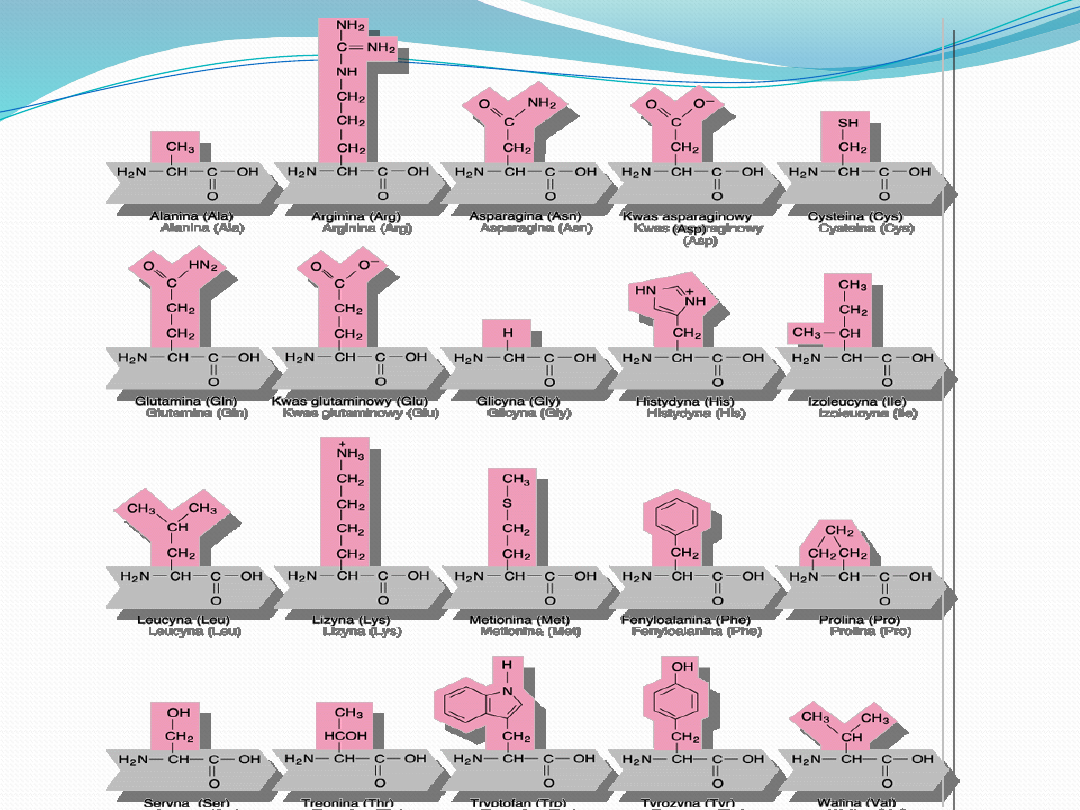
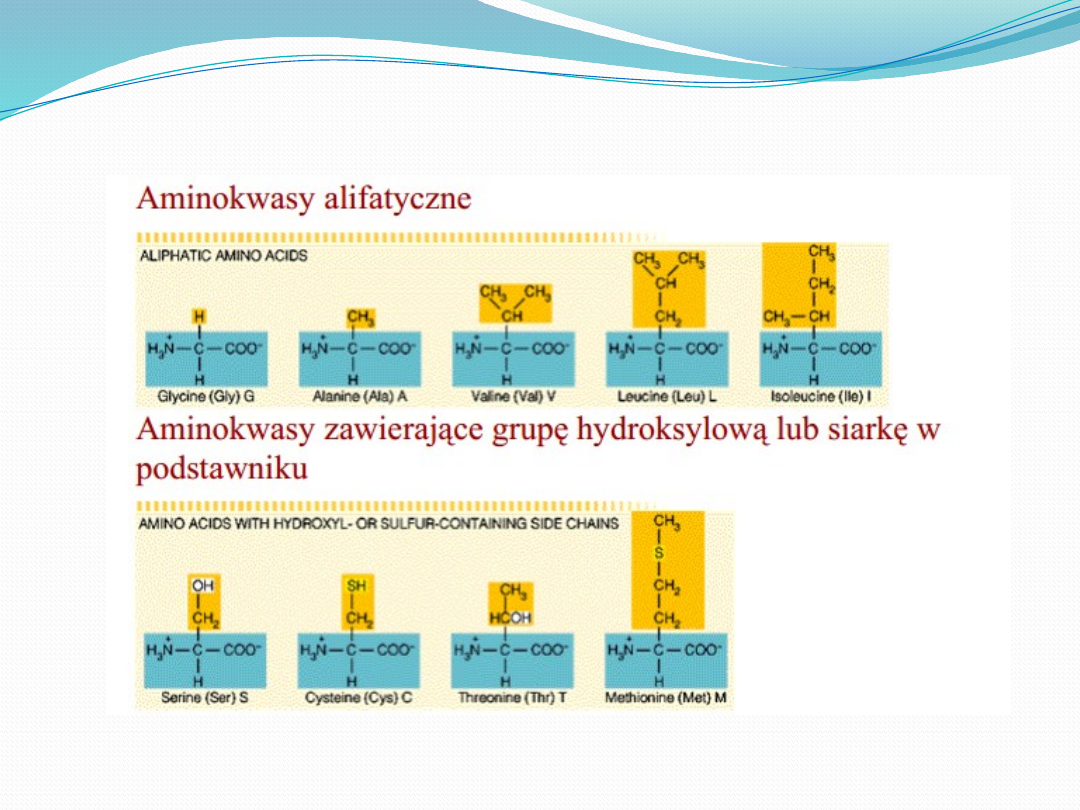
W białkach powszechnie występuje 20 aminokwasów,
których łańcuchy boczne różnią się od siebie:
Wielkością
Kształtem
Ładunkiem elektrycznym
Zdolnością do tworzenia wiązań wodorowych
Reaktywością
Co więcej, wszystkie białka, wszystkich gatunków, od
bakterii do człowieka są zbudowane z tego samego
zestawu aminokwasów.
Aminokwasy
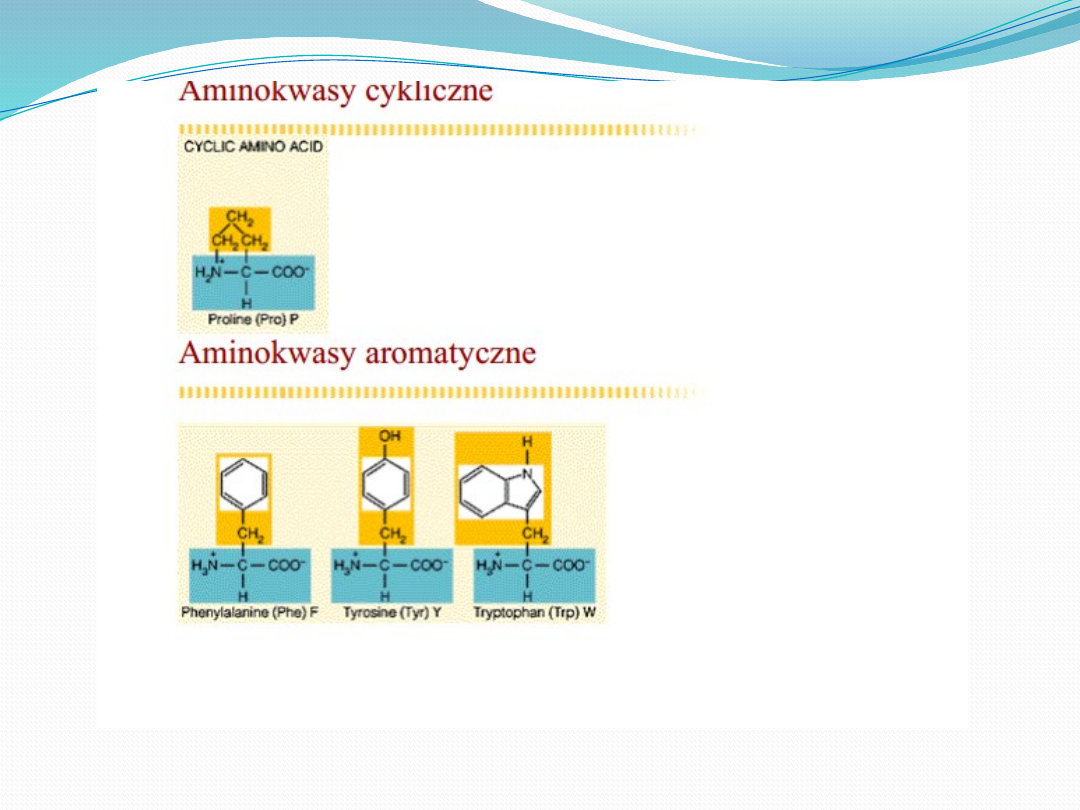
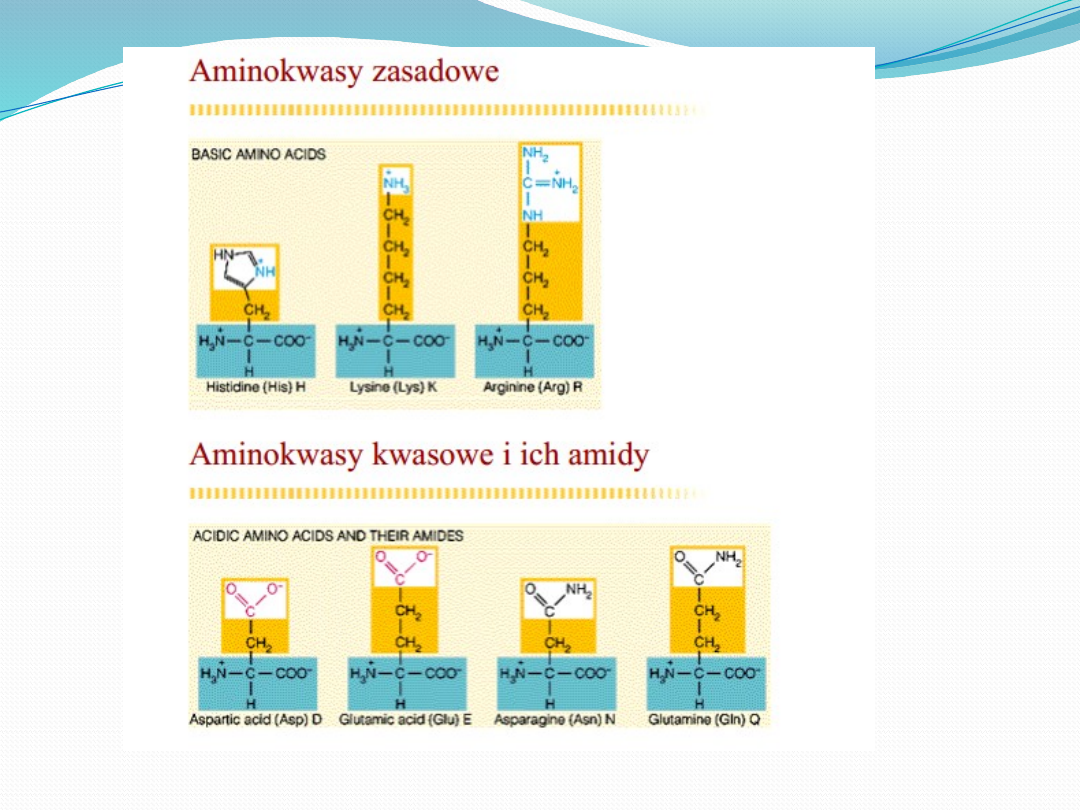
Aminokwasy
egzogenne
endogenne
Arginina
Alanina
Fenyloalanina
Asparagina
Histydyna
Cysteina
Izoleucyna
Glicyna
Leucyna
Glutamina
Lizyna
Kwas asparaginowy
Metionina
Kwas glutaminowy
Treonina
Prolina
Tryptofan
Seryna
Walina
Tyrozyna
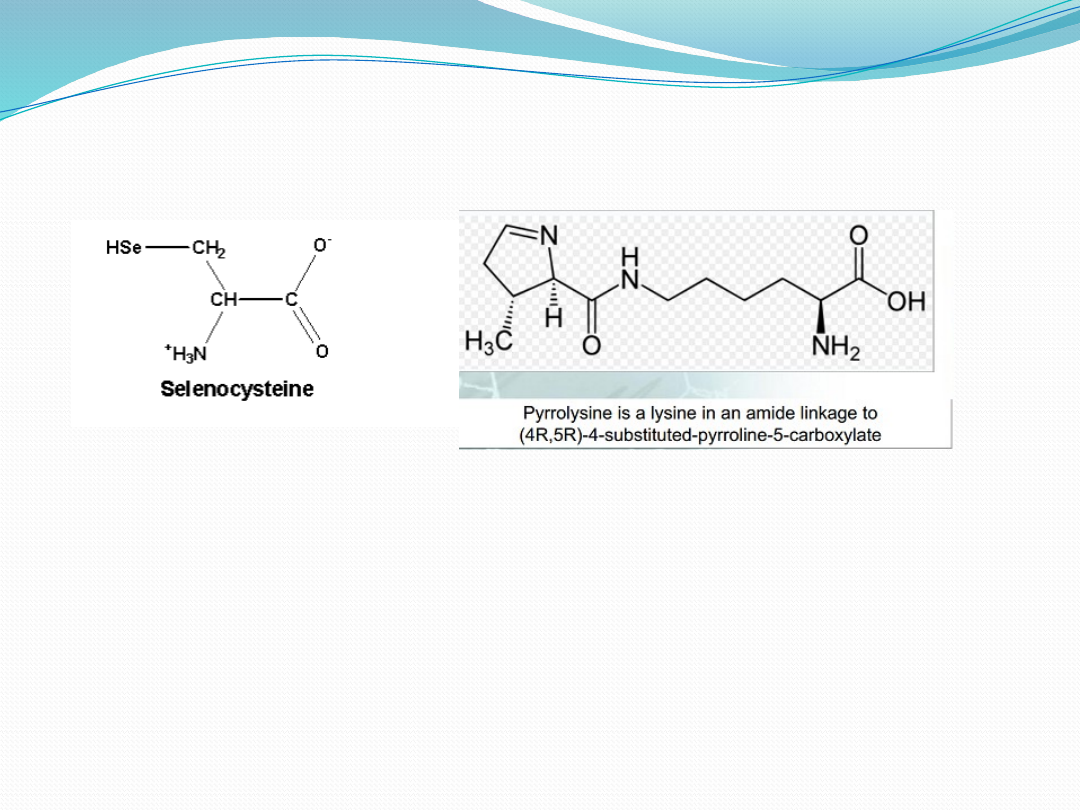
Selenocysteina i
Pirolizyna
Pirolizyna - aminokwas występujący w białkach metanogennych archeowców (oraz
bakterii. Kodowany przez kodon UAG, zwykle będący kodonem stop. Jest 22 poznanym
aminokwasem białkowym.
Selenocysteina jest stosunkowo rzadko występującym aminokwasem naturalnym,
który jest
wbudowywany do niektórych białek (białka selenowe) przy wykorzystaniu kodonu UGA.
Zazwyczaj kodon UGA pełni funkcję kodonu stop, lecz w przypadku syntezy białek, które
wykorzystują kodon UGA do wbudowywania selenocysteiny
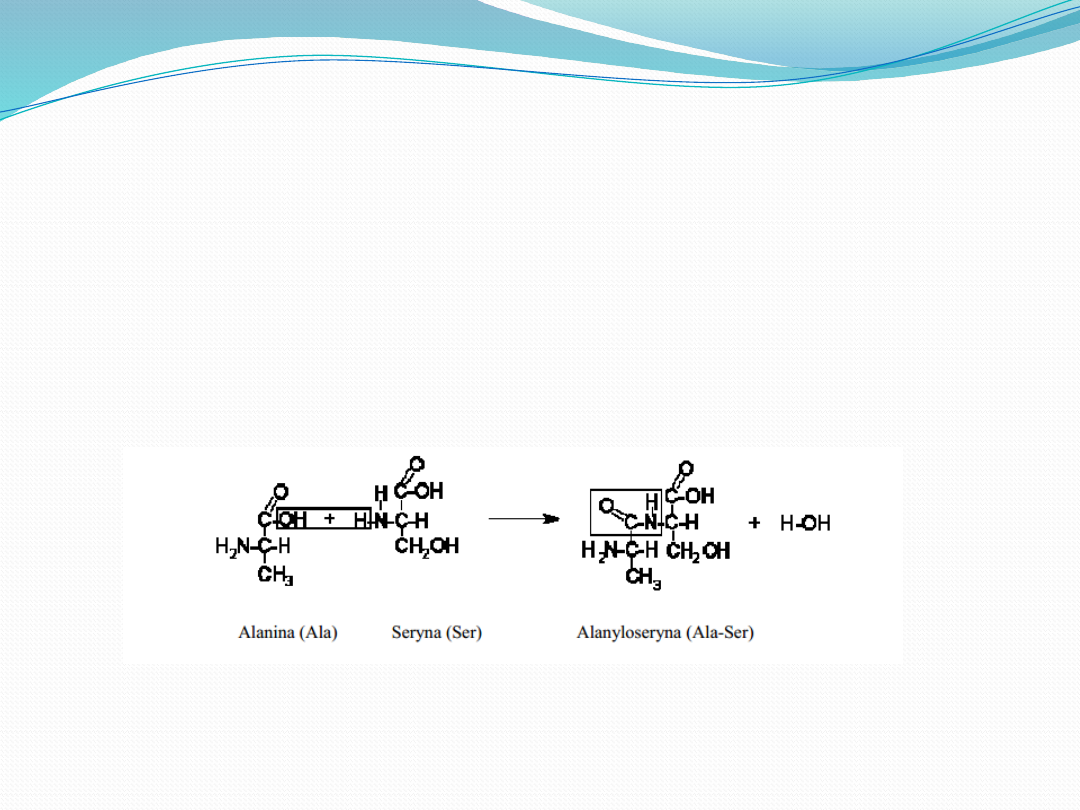
Tworzenie wiązań
peptydowych
Najważniejszą reakcją aminokwasów jest tworzenie grupy
amidowej -NHCO- określanej jako wiązanie peptydowe
(amidowe). Wiązanie peptydowe tworzy się przez
wydzielenie jednej cząsteczki wody z grupy α-aminowej
jednego aminokwasu i α-karboksylowej grupy drugiego
aminokwasu.

Podział białek
Białka proste – proteiny – zbudowane tylko
z aminokwasów
Białka złożone – proteidy – zbudowane z
aminokwasów oraz tzw. części niebiałkowej
(grupa prostetyczna)

Białka proste
Włókienkowate
- keratyna i kolagen (włosy, szkielet, paznokcie,
tkanka łączna)
- miozyna i aktyna (białka kurczliwe w mięśniach)
- fibrynogen (w osoczu krwi, udział w krzepnięciu
krwi)
Globularne
- histony ( białka zasadowe w chromosomach)
- albuminy (surowica krwi, mleko, jaja, nasiona)
- gammaglobuliny (surowica krwi, udział w obronie
immunologicznej)

Białka złożone
Chromoproteidy – połączenie protein z barwnikami – np.
hemoglobina, hemocyjanina.
Fosfoproteidy – połączenie białek z kwasem fosforowym –
np. białko mleka – kazeina.
Glikoproteidy – połączenie protein z cukrowcami – np.
antygeny krwinkowe, warunkujące zróżnicowanie grup krwi.
Nukleoproteidy – związek protein z kwasami nukleinowymi
– nukleosomy wchodzące w skład chromatyny w jadrze
komórkowym.
Lipoproteidy – połączenie protein z lipidami - w żółtku jaja
kurzego, składniki błon.
Metaloproteidy – połączenie protein z jonami metali -
plastocyjanina, transferyna.

Konformacja białek
Konformacja to przestrzenne ułożenie atomów w
strukturze, które można wyznaczyć na podstawie
sekwencji aminokwasów.
Istnieją cztery poziomy struktury białek określane
jako struktura pierwszorzędowa, drugorzędowa,
trzeciorzędowa i występująca czasami, lecz nie
zawsze czwartorzędowa.

Struktura pierwszorzędowa
To liniowa sekwencja aminokwasów połączonych wiązaniami
peptydowymi. Sekwencję tę wyznacza się na podstawie
kolejności ułożenia zasad azotowych w genie kodującym
dane białko.
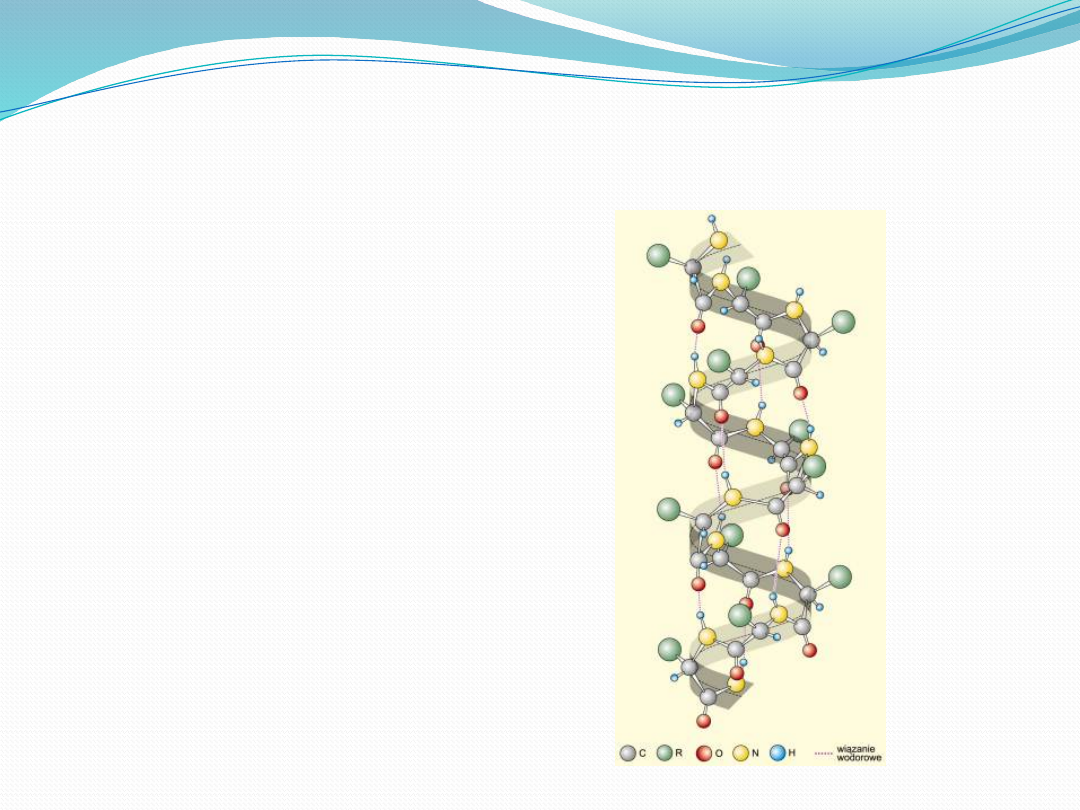
Struktura drugorzędowa
Struktura drugorzędowa białka to
regularne pofałdowanie regionów
łańcucha polipeptydowego. Najczęściej
występującymi sposobami pofałdowania
białka są α helisa i struktura β.
α helisa
ma kształt cylindra
ciasno skręcony łańcuch polipeptydu
tworzy wewnętrzną część cylindra, a
łańcuchy boczne aminokwasów wystają
na zewnątrz w ułożeniu helikalnym
(śrubowym).
helisę α stabilizują wiązania wodorowe
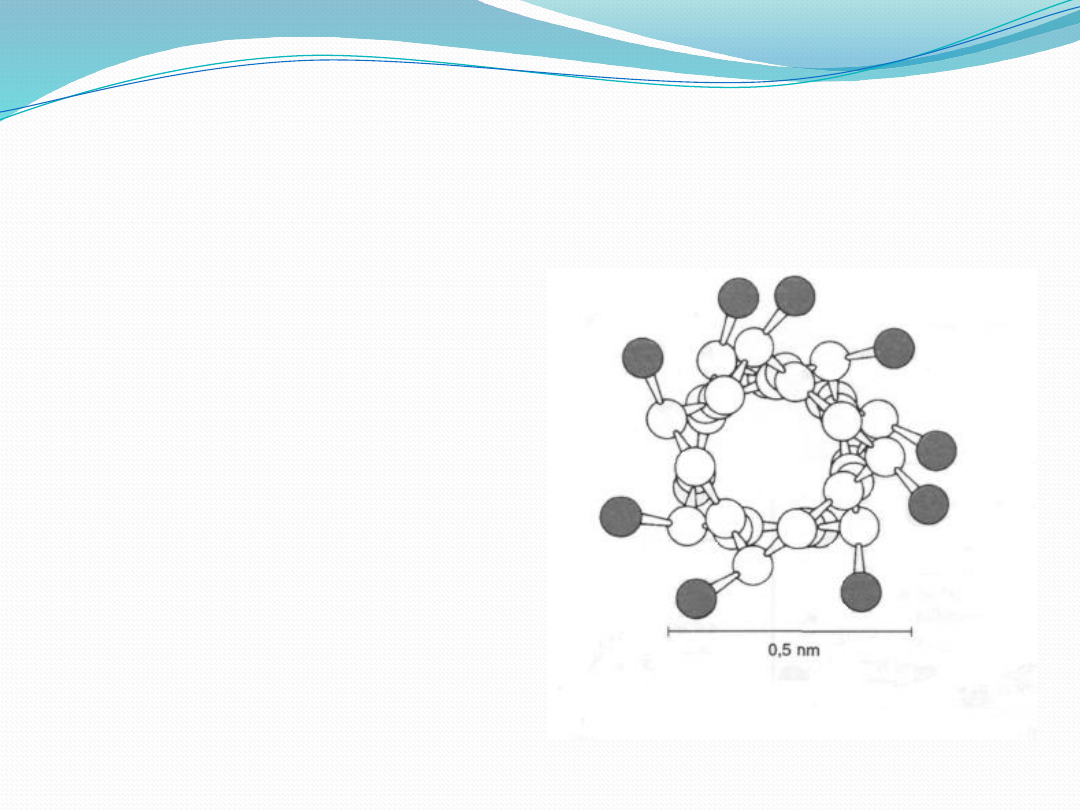
występująca w białkach α
helisa jest prawoskrętna
zawartość α 1 obrót α
helisy 3,6 aminokwasów
0,54nmodległość między
aminokwasami 0,15nm
helisy w białkach jest różna
np. enzym trawienny
chymotrypsyna jest prawie
pozbawiony struktury α
helisy, natomiast w
mioglobinie i hemoglobinie
stanowi ona ok. 75%
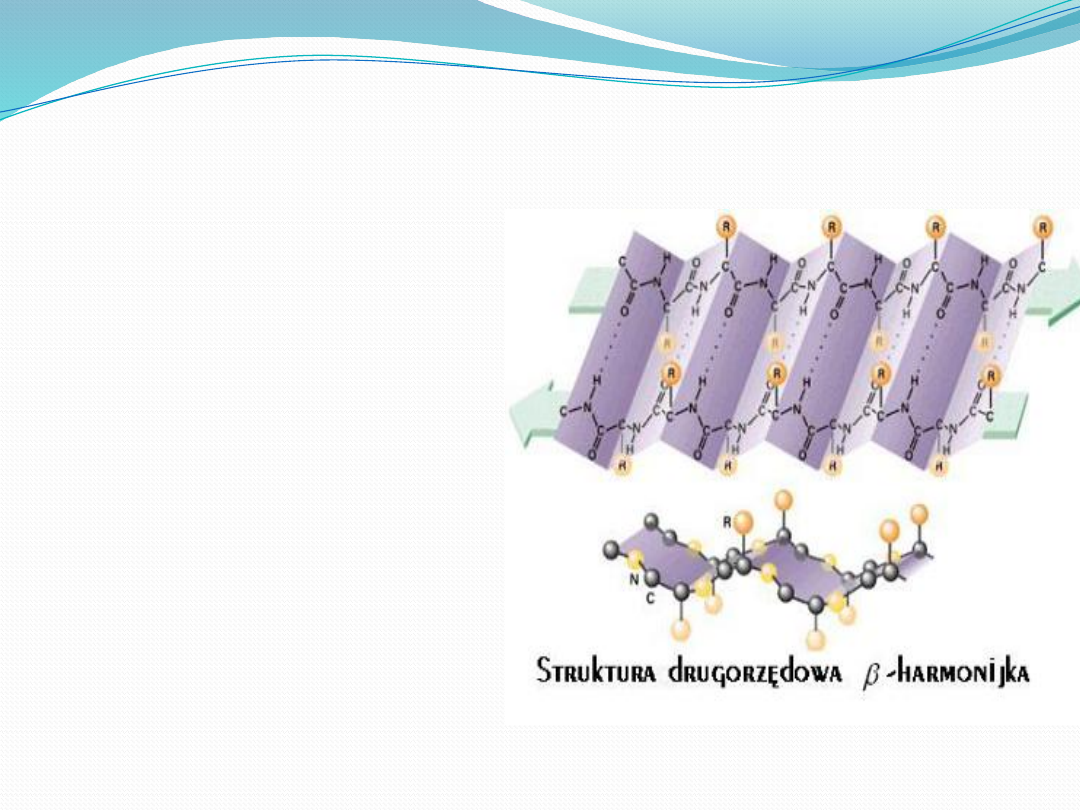
Struktura drugorzędowa
β harmonijka
stabilizują wiązania wodorowe
pomiędzy CO i NH, należącymi do
odrębnych łańcuchów
polipeptydowych
Sąsiadujące ze sobą łańcuchy
harmonijki mogą być ułożone w
jednym kierunku (równoległa
harmonijka) lub w przeciwnych
kierunkach (antyrównoległa
harmonijka)
Łańcuch polipeptydowy jest do
tego stopnia rozciągnięty, że
odległość między dwoma
sąsiednimi atomami Cα wynosi
0,35nm
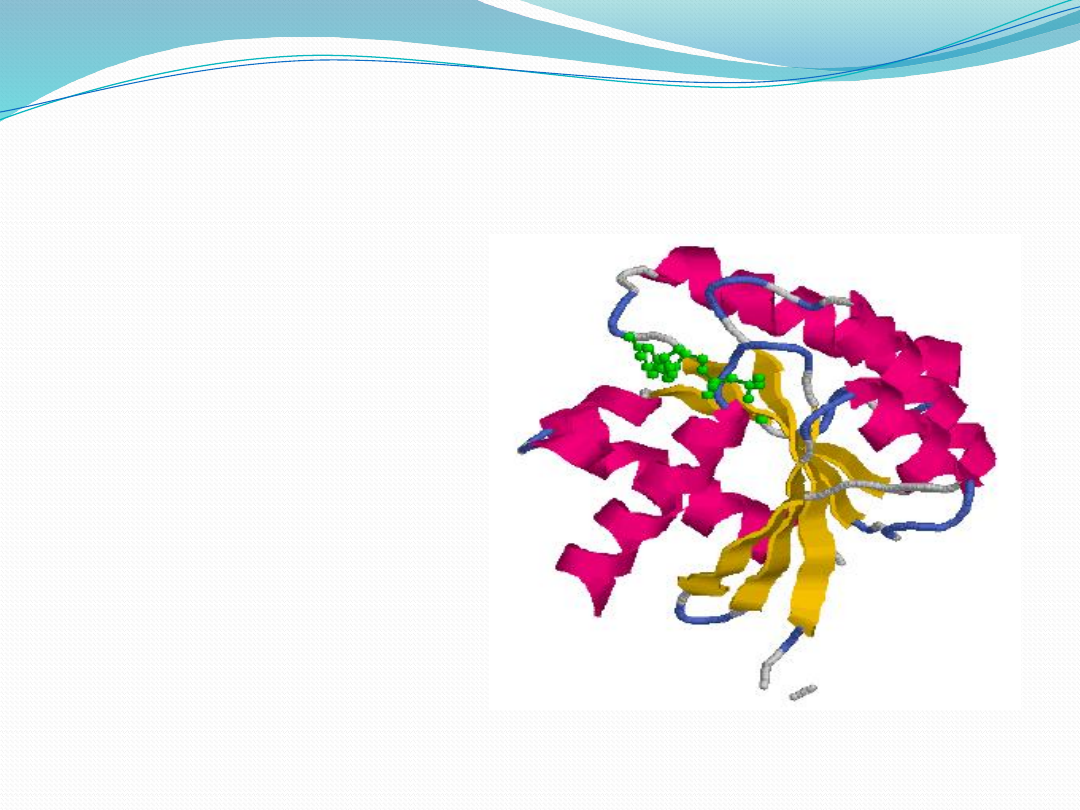
Struktura trzeciorzędowa
dotyczy przestrzennego
ułożenia aminokwasów
zarówno odległych w
sekwencji liniowej jak i
tych, które ze sobą
sąsiadują
Biologicznie aktywna
przestrzenna konformacja
białka jest utrzymywana
dzięki oddziaływaniom
hydrofobowym, przez siły
elektrostatyczne, wiązania
wodorowe i jeśli obecne,
kowalencyjne wiązania
dwusiarczkowe
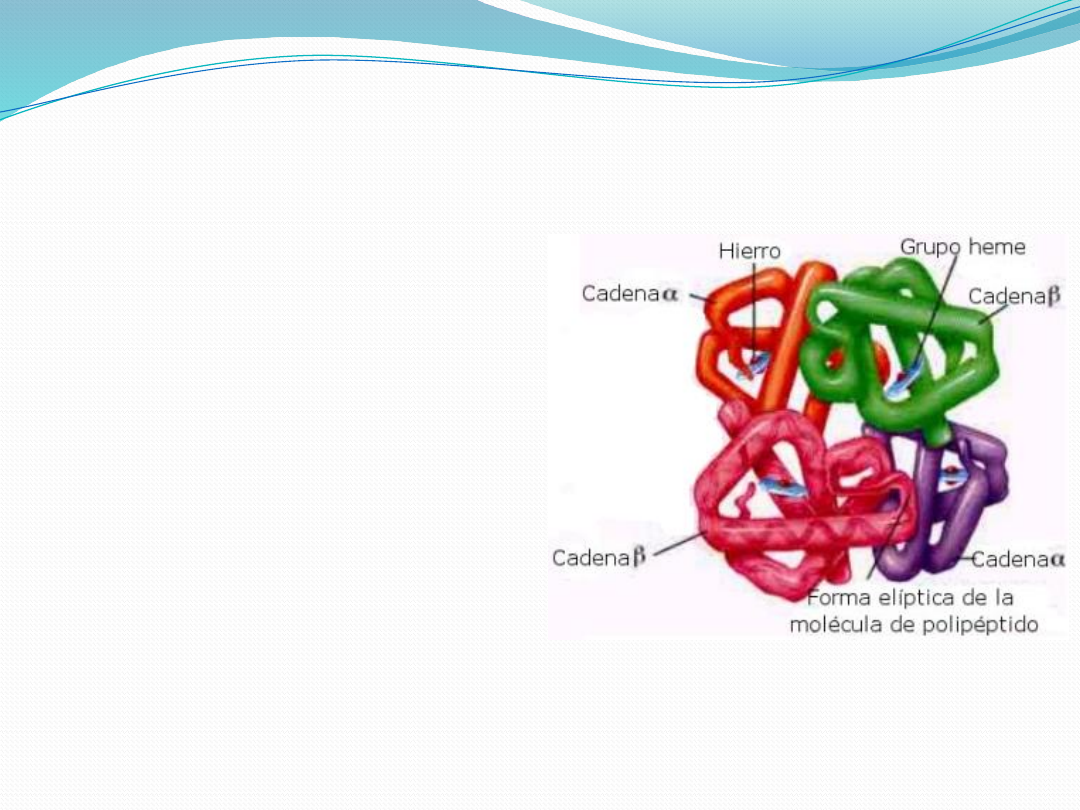
Struktura
czwartorzędowa
najwyższy poziom organizacji
białka. Występuje w przypadku
białek zawierających więcej niż
jeden łańcuch polipeptydowy
np. hemoglobina
występujące oddziaływania:
oddziaływania niekowalencyjne
(siły elektrostatyczne, wiązania
wodorowe i oddziaływania
hydrofobowe).

Stabilność białka
Aktywna konformacja białka utrzymywana jest
przez: wiązania niekowalencyjne
- siły elektrostatyczne
- wiązania wodorowe
- oddziaływania hydrofobowe
wiązania kowalencyjne:
- wiązania dwusiarczkowe
- wiązania peptydowe między kolejnymi
aminokwasami.

Siły elektrostatyczne
to oddziaływania między dwoma grupami jonowymi o
przeciwstawnym ładunku, często nazywane również parą jonową
lub mostkiem solnym.
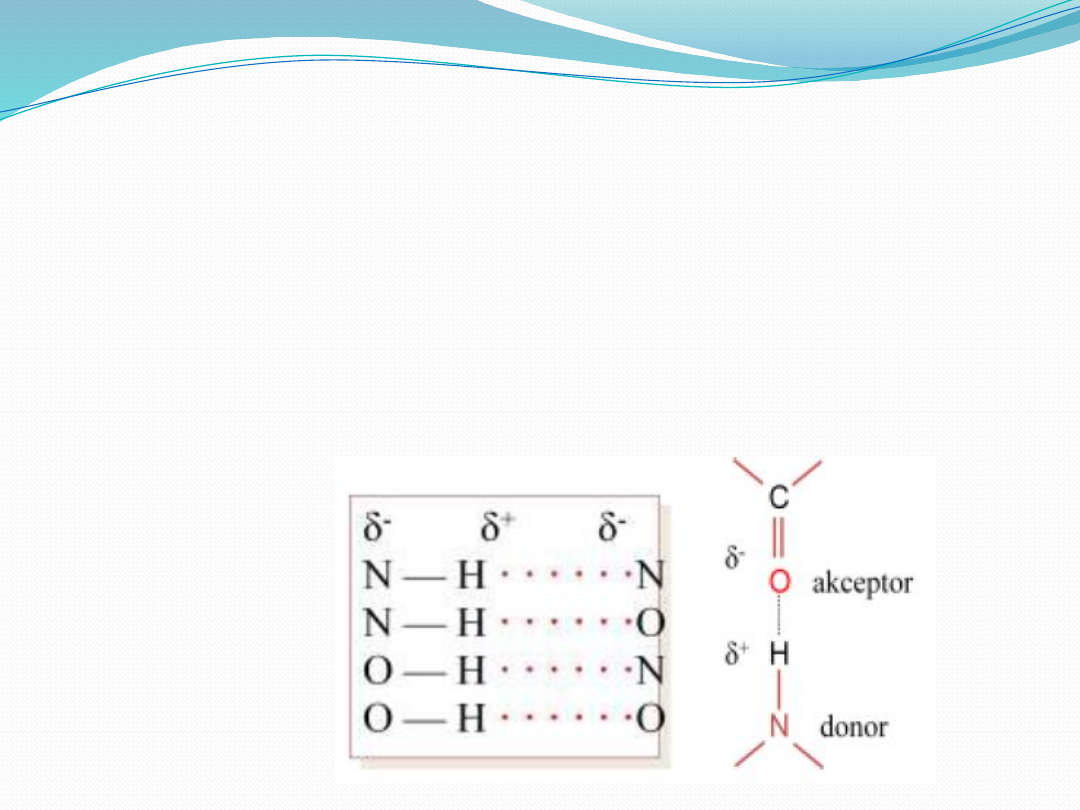
Wiązania wodorowe
- to najczęściej oddziaływania elektrostatyczne między grupą
donorową będącą słabym kwasem oraz akceptorowym atomem
zawierającym wolną parę elektronów i posiadającemu cząstkowy
ładunek ujemny. W warunkach biologicznych grupą donorową jest
atom tlenu lub azotu połączony kowalencyjnie z atomem wodoru, a
akceptorem jest atom tlenu lub azotu. Jeśli donor, atom wodoru i
akceptor leżą w jednej linii, powstaje wiązanie kolinearne.
Oddziaływania
hydrofobowe
oddziaływania odpowiedzialne za minimalizowanie
powierzchni kontaktu niepolarnych cząstek z otaczającą je
wodą. Można je łatwo zaobserwować w przypadku
cząsteczek amfipatycznych (lipidy, detergenty).
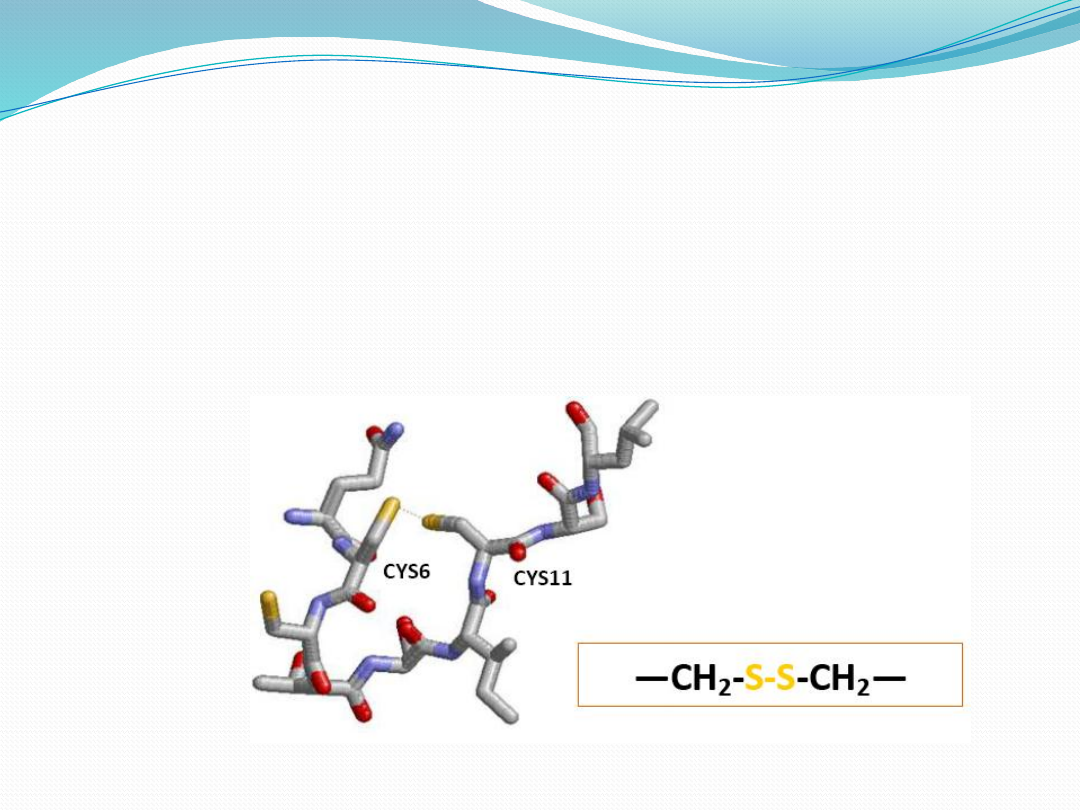
Wiązania dwusiarczkowe
powstają w utleniającym środowisku retikulum
endoplazmatycznego i dlatego można je głownie
znaleźć w białkach zewnątrzkomórkowych i
podlegających sekrecji.

Fałdowanie się białek
w odpowiednich warunkach fizjologicznych białka faładują
się spontanicznie osiągając aktywną konformację. Struktura
przestrzenna białka determinowana jest przez jego strukturę
pierwszorzędową. O fałdowaniu się białka w aktywną
konformację decydują gł. jego reszty aminokwasowe
skierowane do wnętrza powstającej struktury. Główna siła
kierującą fałdowaniem się białka są odzialywania
hydrofobowe.
Fałdowanie się białek w komórce zachodzi szybko dzięki
obecności białek pomocniczych. Wyróżnia się 3 klasy białek
pomocniczych wspomagających fałdowanie się białek:

Wyróżnia się 3 klasy białek
pomocniczych wspomagających
fałdowanie się białek:
Izomerazy dwusiarczkowe białek ułatwiając
tasowanie mostków dwusiarczkowych w białku
Izomerazy peptydyloprolilowe cis-trans
przyspieszają proces przekształcania wiązania
peptydowego X-Pro (X dowolny aminokwas) z
konfiguracji cis w trans
Molekularne chaperony, do których zalicza się
np. białka szoku termicznego, zapobiegają
nieprawidłowemu fałdowaniu się białek i ich
agregacji

Funkcje białek
Transportowa i magazynująca - hemoglobina i mioglobina
przenoszą i magazynują tlen w krwinkach i mięśniach; transferryna
przenosi żelazo w osoczu, a ferrytyna magazynuje żelazo w wątrobie
Mechaniczno- strukturalna – funkcja podporowa; kolagen,
keratyna, elastyna
Regulacyjna - prawie wszystkie znane enzymy są białkami np.
amylaza, pepsyna. Niektóre hormony też są białkami np. insulina,
hormon jodotyroniny
Odpornościowa - przeciwciała odgrywają rolę w rozróżnianiu
między tym co własne i obce dla organizmu; interferon
Udział w ruchu komórkowym - skurcz mięśnia m.in. aktyna,
miozyna; przemieszczanie się chromosomów podczas podziałów
komórkowych – tubulina
Receptorowa - odbieranie bodźców przez komórki dzięki białkom
receptorowym umieszczonym w błonie komórkowej lub cytoplazmie

Bibliografia
,,Biochemia” L. Stryer
,,Biochemia Harpera ilustrowana’’ Murray
Robert K., Granner Daryl K., Rodwell Victor W.
Document Outline
- Slide 1
- Białka
- Aminokwasy
- Slide 4
- Slide 5
- Slide 6
- Aminokwasy
- Slide 8
- Slide 9
- Aminokwasy
- Selenocysteina i Pirolizyna
- Tworzenie wiązań peptydowych
- Podział białek
- Białka proste
- Białka złożone
- Konformacja białek
- Struktura pierwszorzędowa
- Struktura drugorzędowa
- Slide 19
- Struktura drugorzędowa
- Struktura trzeciorzędowa
- Struktura czwartorzędowa
- Stabilność białka
- Siły elektrostatyczne
- Wiązania wodorowe
- Oddziaływania hydrofobowe
- Wiązania dwusiarczkowe
- Fałdowanie się białek
- Slide 29
- Funkcje białek
- Bibliografia
Wyszukiwarka
Podobne podstrony:
BIAŁKA BUDOWA, WŁAŚCIWOŚCI I FUNKCJE
AMINOKWASY I BIAŁKA BUDOWA WLASCIWOSCI I FUNKCJE
układ pokarmowy budowa i funkcja
BUDOWA I FUNKCJA UKŁADU NERWOWEGO, weterynaria, Anatomia
Budowa i Funkcje Układu Nerwowego
Budowa i funkcje komorek bakteryjnych (opracowanie)
budowa funkcje krwi
Budowa i funkcje skóry
2 budowa i funkcje skóry
UkÄaâad oddechowy czÄaâowieka ââZâs budowa, funkcje, choroby
177Tarczyca budowa i funkcje
Budowa i funkcja genomu ludzkiego 02
budowa i funkcje ukladu moczowego
Budowa i funkcje narządów mowy
Budowa i funkcje układu odpornościowego człowieka, Szkoła, przydatne w szkole
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
wydruk, JĄDRO, JĄDRO - budowa i funkcje
Budowa i funkcje serca, Szkoła, przydatne w szkole
więcej podobnych podstron