
Implanty
Wykład 1
28.02.2011
Inżynieria biomedyczna – biomedical
Biomateriał
– substancja inna niż lek lub kombinacja substancji syntetycznych lub
naturalnych, która może być użyta w dowolnym czasie jako część lub całość systemu, który
zastępuje tkankę lub organ lub pełni jego funkcję.
Wyróżnia się następujące grupy biomateriałów:
•
metalowe
- stal Cr-Ni-Mo
- stopy Co (Co-Cr-Mo, Co-Cr-Ni-Mo, Co-Cr-Ni-Mo-V);
- Ti oraz stopy Ti (Ti-Al-V, Ti-Al-Nb, Ti-Al-Nb-Ta, Ti-Mo-Zr-Fe);
- stopy z pamięcią kształtu np. Ni-Ti ←równowagowy (Nitinol)
•
ceramiczne
- bioceramika obojętna (Al
2
O
3
- biokorund, ZrO
2
) →elementy endoprotez (główki)
- bioceramika resorbowalna(HA → hydroksyapatyty →uwodnione fosforany
wapniowe→ materiały porowate, β – TCP)
- bioszkła (SiO
2
-CaO-Na
2
O-P
2
O
3
) (powłoki na implanty)
•
polimerowe → pod wpływem promieni rentgenowskich struktura może ulec zmianie
* polimetakrylan metylu,
* wysokocząsteczkowy polietylen o dużej gęstości
•
węglowe → włókna węglowe → odtwarza się zerwane ścięgno Achillesa (do 24/48h)
•
kompozytowe
Podstawowe definicje i pojęcia
Biomateriały powinien się cechować wymaganą biotolerancją, ( biokompatybilnością ).
Biotolerancji ≠ Biozgodność (raczej implant nie jest biozgodny)
Biotolerancja oznacza:
•
nie wywoływanie ostrych lub chronicznych reakcji
•
brak odczynów zapalnych
•
nieinicjowanie reakcji toksycznych, immunologicznych i alergicznych
•
brak efektu drażnienia tkanek
Z biomateriałów wytwarzane są implanty
Implanty – wszelkie wyroby medyczne wykonywane z jednego lub większej ilości
biomateriałów, które mogą być umieszczone wewnątrz organizmu, jak również umieszczone,
częściowo lub całkowicie pod powierzchnią naskórka i które mogą pozostać przez dłuższy
okres czasu w organizmie.
interdyscyplinarna
Medycyna
Technika

Proteza implantowana (PROTEZA WEWNETRZNĄ ENDOPROTEZĄ) → przyrząd, który
fizycznie zastępuje organ lub tkankę.
Bioproteza – implantowana proteza wykonywana w całości lub części z tkanki dawcy.
Sztuczny organ
– materiał medyczny, który zastępuje w całości lub częściowo funkcję
jednego z głównych organów ciała. Sztuczne organy zastępują funkcję chorych, często w
nieanatomiczny sposób narządów.
Stosowane nazwy implantów nawiązują również do dziedziny medycznej ich zastosowania:
•
implant ortopedyczny
•
implant ustny
•
implant dentystyczny
•
implant czaszkowo-twarzowy
Kryteria jakości implantów
Etapy kwalifikacji jakości biomateriałów
•
określenie struktury chemicznej i fazowej – skład chemiczny i fazowy, stopień
zanieczyszczenia wtrąceniami niemetalicznymi, wielkość ziarna.
•
ocena własności mechanicznych
•
badania własności fizykochemicznych – odporność korozyjna biomateriału, własności
elektryczne, magnetyczne, odporność na korozję wżerową, badania potencjo-
dynamiczne i statyczne
•
badania biologiczne biomateriału – ocena biotolerancji w tkankach dwóch gatunków
zwierząt doświadczalnych (szczury, króliki, psy, barany, świnki morskie)
* ujawnienie reakcji toksykologicznych, alergicznych, efektów drażnienia
* do badań wykorzystuje się następujące tkanki:
- skórę,
- krążącą i pobraną krew,
- kości,
- zębinę,
- tkankę twardą i miękką,
- tkanki organów detoksykacyjnych
•
ocena jakości implantów – np. próba skręcania dla wkrętów kostnych, próba zginania
dla płytek stabilizujących
•
badania kliniczne – akceptacja Komisji Etycznej, jasno sprecyzowane cele badań,
metodyka, zgoda pacjentów, wyczerpująca informacja o możliwości negatywnych
skutków realizowanych badań.
•
ostateczna kwalifikacja jakości i przydatności klinicznej implantów od danego
wytwórcy – pozytywne opinie kilku ośrodków klinicznych
Klasyfikacja urządzeń medycznych
Dyrektywy Unii Europejskiej wprowadzających implanty do grupy urządzeń medycznych ze
względu na:
•
stopień inwazyjności
•
czas ich użytkowania
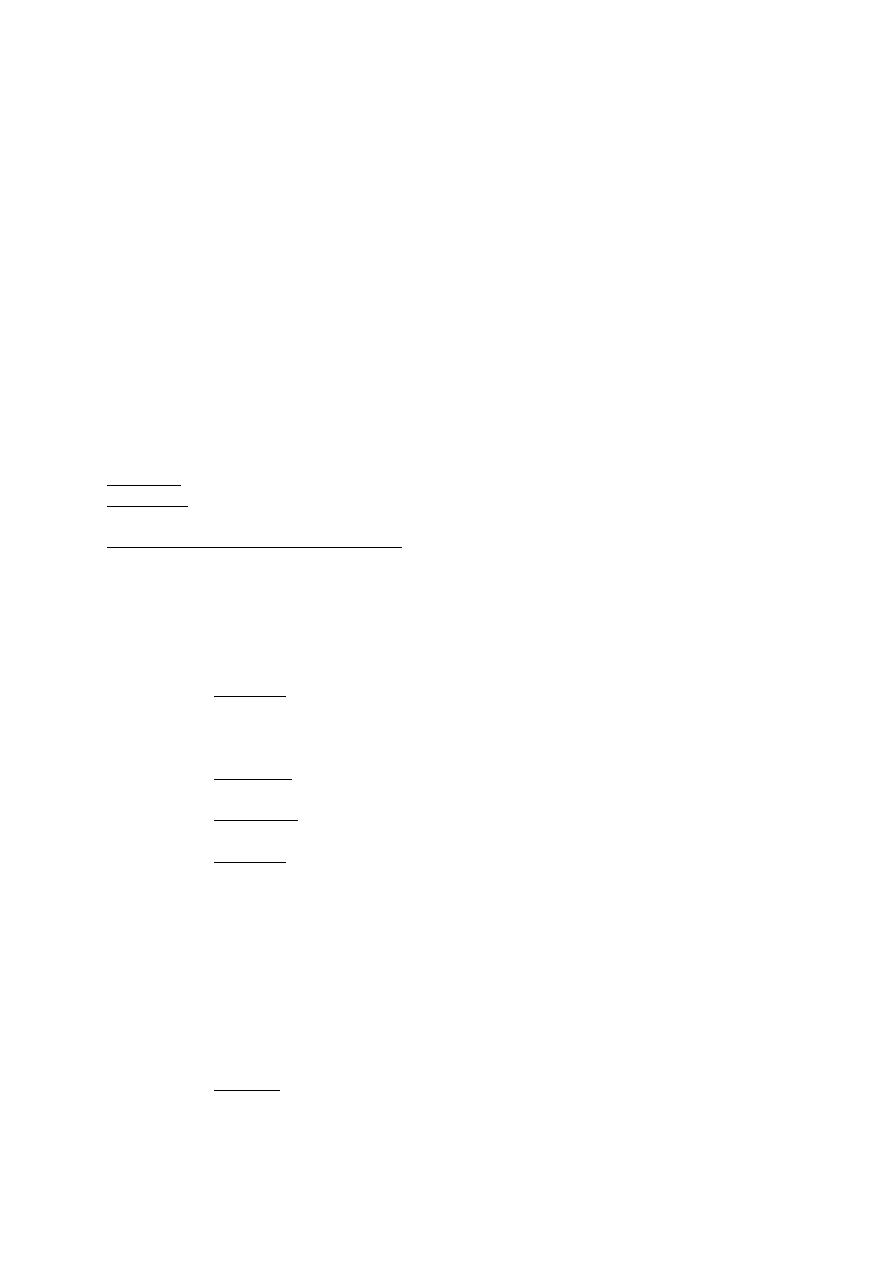
•
reguły ich zastosowania
Ze względu na czas użytkowania wyróżniamy urządzenia
•
przejściowe → t < 60 minut
•
krótkoterminowe → t ≤ 30 dni
•
długoterminowe → t > 30 dni
Jakość produktów medycznych to przede wszystkim bezpieczeństwo ich stosowania.
Wyróżniamy następujące klasy ryzyka:
klasa I → produkty z niskim stopniem ryzyka, które podczas odpowiedniego użycia
nie powodują żadnych, przewidzianych chorób
klasa II → sprzęt chirurgiczny, materiały dentystyczne
◦
klasa II a – sprzęt elektromedyczny
◦
klasa II b – aktywne
klasa III
Wykład 2
07.03.2011
Historia rozwoju implantów metalowych
1. Charakterystyczne okresy rozwoju implantologii:
•
I okres – do 1870r. – brak znajomości zasad aseptyki
•
II okres – 1870 – 1925 – rozwój nowożytnej chirurgii i pierwsze próby
stosowania biomateriałów metalowych
•
III okres – od 1925 do teraz – intensywny rozwój nowych technik
implantologii
2. XVI wiek
– pierwsze doniesienia literatury na temat stosowania implantów
metalowych – Petronicus zastosował złotą (bardzo duża odporność na korozję,
metal plastyczny płytkę do przykrycia podniebienia wady podniebienia u
dziecka (1565 r.)
3. XVII wiek
- druty z żelaza(tragiczne konsekwencje - infekcje), złota i brązu do
zszywania ran przez Fabritiusa
4. XVIII wiek
– wprowadzenie zszywania (drutowanie) złamanych kości (złoto,
srebro)
5. XIX wiek
- pierwsze zespolenie kości z zastosowaniem ściegu drucianego
(drut ze srebra) – 1827 r.
- kolejne lata przynoszą informację o niepowodzeniu w
implantologii materiałów metali (Barton – 1834 r., Dieffenbach
– 1846 r., Hansmann – 1865 r.)
- zespolenie kości za pomocą trzpieni srebrnych i zszycie rzepki
(Listers - 1877 r.) - zwrócenie uwagi na konieczność
zachowania aseptyczności
- zespolenie szyjki kości udowej śrubą metalową (1875 r.)
- płytki do zespoleń kostnych ( Al, srebro, mosiądz) (1886 r.)
6. XX wiek
– rozwój techniki łączenia złamań za pomocą płytek
kontaktowych (Lambotte – 1987 r., Sherman – 1912 r., Lane – 1914 r.)
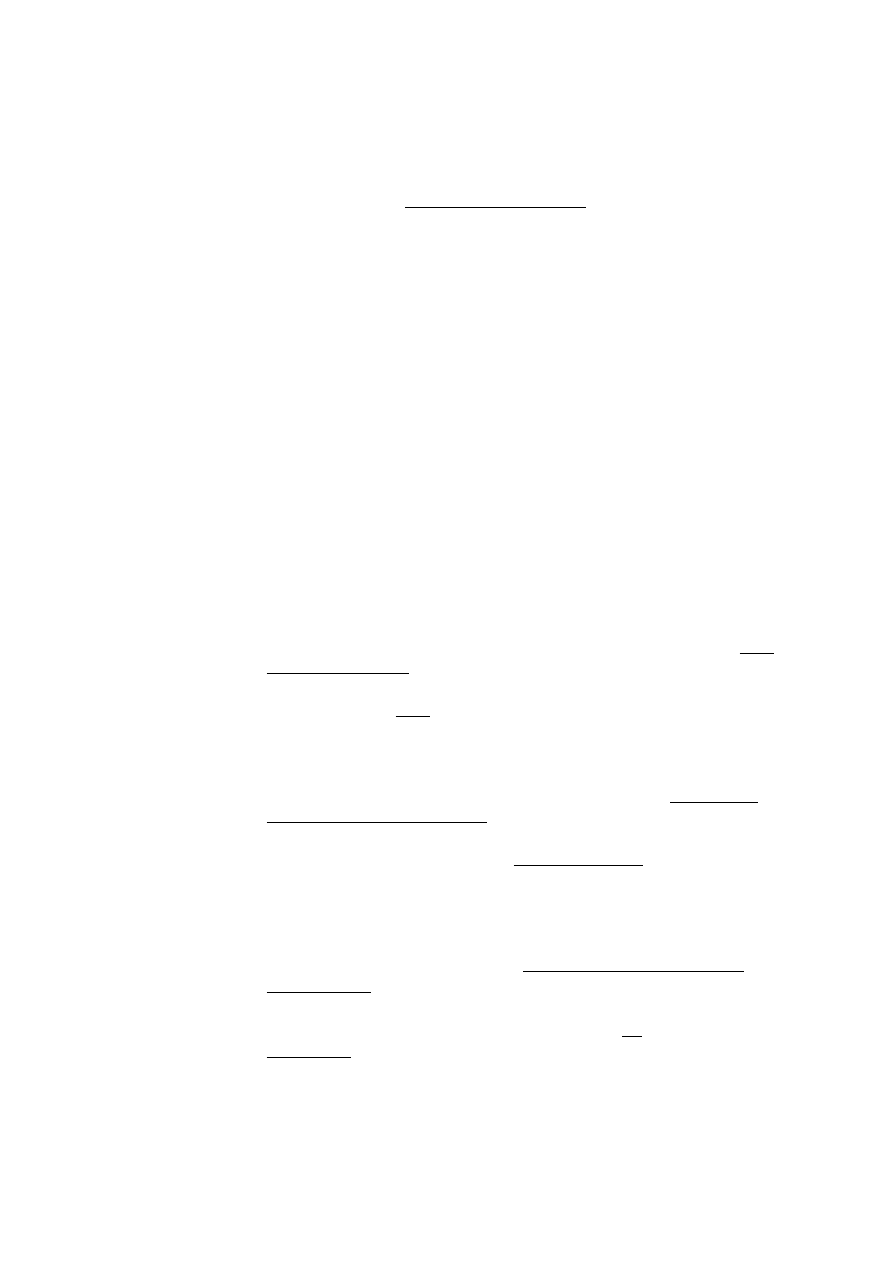
- zwrócenie po raz pierwszy uwagi na problem metalozy przy
zespalaniu kości za pomocą śrub, wchłanianie metali do tkanek
okołowszczepowych
- 1940 – 1949 r. - wprowadzenie do praktyki klinicznej płytki
dociskowej płytka dociskowa Danisa → regulacja odległości
- otwory okrągłe, podłużne i eliptyczne
- małe płytki kątowe
- płytki rynnowe
- śródszpikowe metody zespalania odłamów kostnych
•
wprowadzenie przez Rusha (1939 r.) parami prętów do
jamy śródszpikowej od strony nasady w kierunku trzonu
•
wprowadzenie prętów rurowych w kształcie litery „C”
lub „liścia koniczyny”
•
wprowadzenie ryglowania pręta wkrętami lub bolcami
przechodzącymi poprzecznie przez kość i otwory w
pręcie (Klintscher – 1968 r. oraz Klemm i Schelmann –
1979 r.)
•
kolejny sposób stabilizacji z wykorzystaniem gwoździ
śródszpikowych
•
pręty rurowe
•
druty
7. Postęp w dziedzinie inżynierii biomateriałów:
endoproteza – lata XX ubiegłego wieku
•
1920 r. - poprawa biotolerancji poprzez zastosowanie stali kwasowo –
odpornych Cr – Ni ← struktura austenityczna
•
1926 r. - Lange wprowadza w Niemczech udoskonalony gatunek stali
austenitycznej V2A (konsekwencje prowadzenia badań w tkankach
zwierząt doświadczalnych)
•
modyfikacja stali V4A pod kątem składu chemicznego
•
wprowadzenie do powszechnego stosowania stali 316 L (1972 r. - 1974
r.) Cr – Ni –Mo na implanty
* Mo – odporność na korozję wżerową
•
1929 r. – opracowano w Laboratorium Austenal (USA) odlewniczy
stop Co – Ni – Mo (Vitallium) – możliwość otrzymywania złożonych
kształtów endoprotez (zapoczątkowanie rozwoju alloplastyki stawowej)
•
wprowadzenie przez firmę Sulzer stopu Protasul – 2 (1972 r.) oraz
koncern Kruppa stopu Endocast (1977 r.)
•
1972 r.
•
gromadzenie doświadczeń klinicznych wynikających z użytkowania
implantów oraz wyniki badań z zakresu biomechaniki i biotolerancji
tworzyw metalicznych generowało postęp w dziedzinie inżynierii
biomateriałów
•
stopy Co przerabiane plastycznie
•
1940 r. (USA) i 1955 r. (Europa) – zastosowanie Ti (żarowytrzymałość)
i jego stopy (znakomita odporność korozyjna (HF reaguje) kwas
fluorowodorowy) do wytwarzania implantów w chirurgii kostnej –
początkowo niezadowalające własności mechaniczne
•
1980 r. – wzrost zainteresowania stopami Ti, opracowanie dla potrzeb
chirurgi kostnej stopu Ti – 6 Al – 4 V

•
1976 r. – wprowadzenie przez Castlemana do wytwarzania implantów
stopy z pamięcią kształtu (Ni – Ti)
Implanty stosowane w osteosyntezie
Osteosynteza – uzyskanie zrostu kostnego
Układ kostny człowieka
Kości długie – 80% naszego układu kostnego
Pozostałe kości – 20%
Budowa kości (elementy budulcowe):
•
Osteon – najmniejsza jednostka tkanki kostnej
•
Kość korowa (2)= kość zbita = kość twarda = kość beleczkowa (przenoszenie
obciążeń, najbardziej wytrzymała)
•
Okostna (1) – zewnętrzna tkanka (silnie unaczyniona i unerwiona)
•
Kość gąbczasta (3)
•
Jama szpikowa (4) w środku kości gąbczastej
(Numerowane od warstwy zewnętrznej)
Budowa osteonu (kość beleczkowa) – najmniejsza część budulcowa kości twardej
−
Blaszki
−
Osteocyt
−
Kanał osteonu (Kanał Haversa)
−
Żyła
−
Nerw
−
Tętnica
−
Naczynia krwionośne
Kolejne etapy procesów w obszarze złamania
1. Przerwanie ciągłości tkanki twardej kostnej
2. Przerwanie ciągłości naczyń (występuje ogromny krwiak w
obszarze złamania)
3. Opatrunek gipsowy
4. Odtworzenie struktury naczyń krwionośnych, (które dostarczają
środki budulcowe do kości)
5. Odbudowywanie tkanki twardej
6. Kość zrośnięta
OSTEOSYNTEZA – zespolenie i stabilizowanie odłamów kostnych do momentu powstania
zrostu kości.
Stosowane są następujące grupy osteosyntezy stabiln.:
•
OSTEOSYNTEZA NAKOSTNA PŁYTKAMI I WKRĘTAMI
•
OSTEOSYNTEZA STABILIZATORAMI PŁYTKOWYMI – STABILIZATOR
ZESPOL I POLFIX
•
OSTEOSYNTEZA STABILIZATORAMI ZEWNĘTRZNYMI
•
OSTEOSYNTEZA GWOŹDZIAMI ŚRÓDSZPIKOWYMI
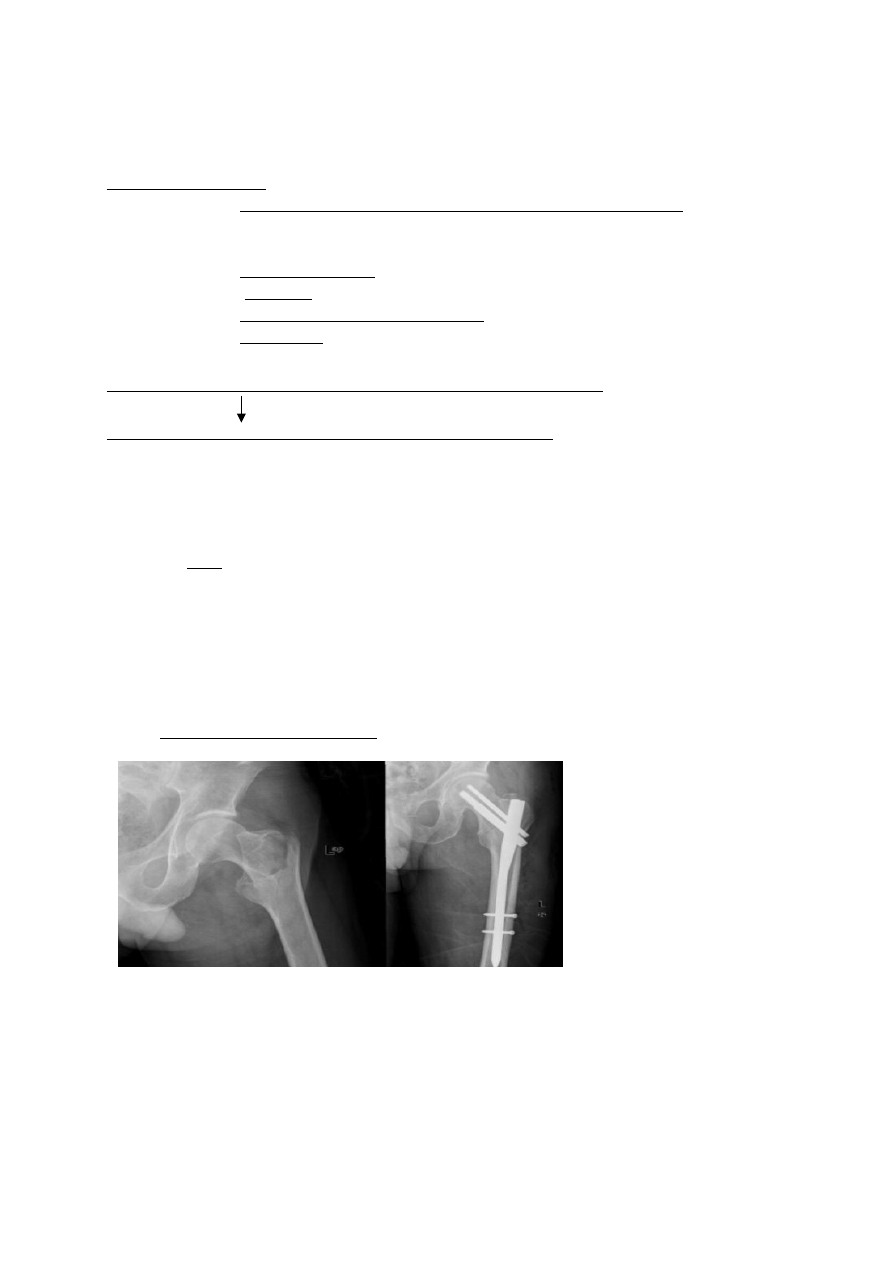
Płytki kostne – implanty stosowane w osteosyntezie nakostnej są płytki kostne.
Ze względu na typ implantu można wyróżnić płytki kostne
•
ZWYKŁE
•
SAMODOCISKOWE – docisk odłamów kostnych
Ze względu na cechy charakterystyczne rozróżniamy płytki kostne
•
PROSTE (wąskie, szerokie)
•
KĄTOWE
•
KSZTAŁTOWE
•
REKONSTRUKCYJNE (proste, wygięte)
Przykład
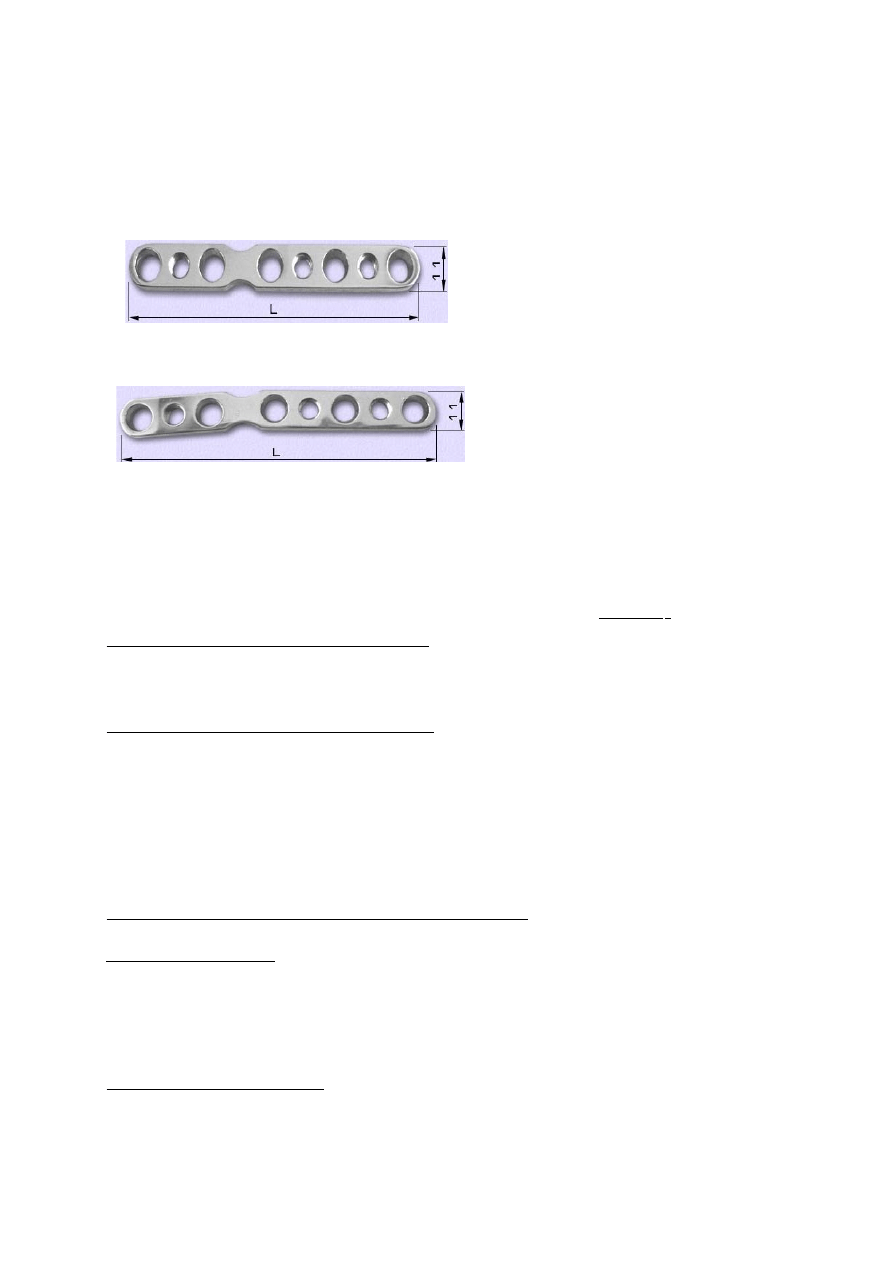
Płytki proste wąskie
•
szerokość – 11 – 12 mm
•
płytki wielootworowe – możliwość wyboru odpowiedniego otworu do wkrętu
•
występują w całym typoszeregu długości – 40 - 260 mm
•
wkręty o średnicy Ø 4,5
5 otworów / 4 otwory niesymetryczna przymocowana za pomocą wkrętów
Płytka prosta wąska z otworami stożkowymi pod wkręty Ø 4,5 wraz z typoszeregiem
Płytki proste szerokie
•
szerokość - 16 mm
•
cały typoszereg długości – 70 – 300 mm
•
średnica wkrętów Ø 4,5
•
wielootworowe
Płytka prosta szeroka z otworami stożkowatymi pod wkręty Ø 4,5 wraz z typoszeregiem
wymiarowym
Płytki kątowe:
•
Płytka do zespoleń szyjki kości udowej 16 x 130
o
L [mm] = 50,60,70,80,90,100,110
Płytka kątowa międzykrętarzowa 16x6
Międzykrętarzowa [M=20
o
]
K [
o
]=105, 110, 115, 120
L [mm]= 50, 60, 70
Płytka przekrętarzowa
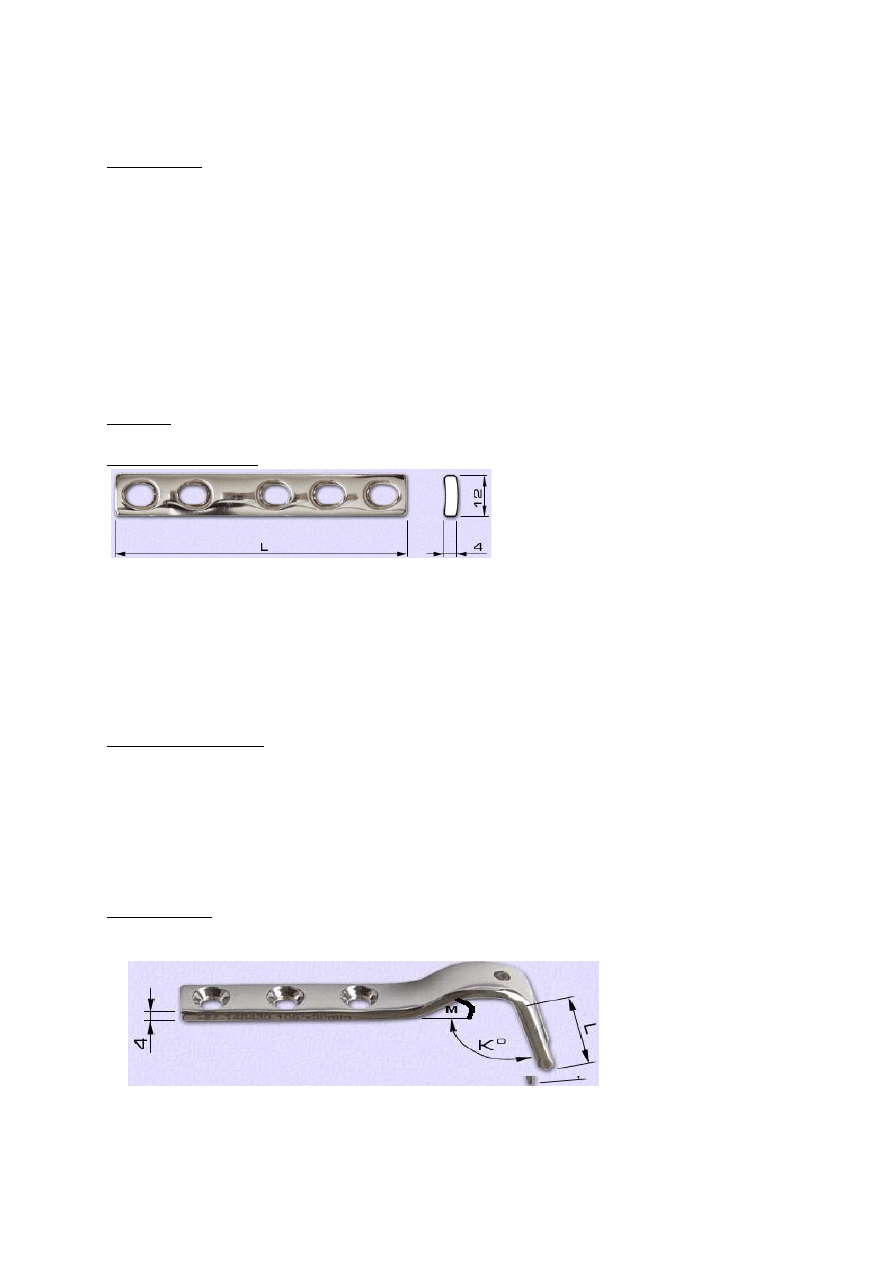
Płytki kształtowe
– kość ramienna, kość piętowa
Płytka ukośna „T” do kości ramiennej prawa pod wkręty Ø 4,5
Płytka do kości piętowej (5 – otworowa)
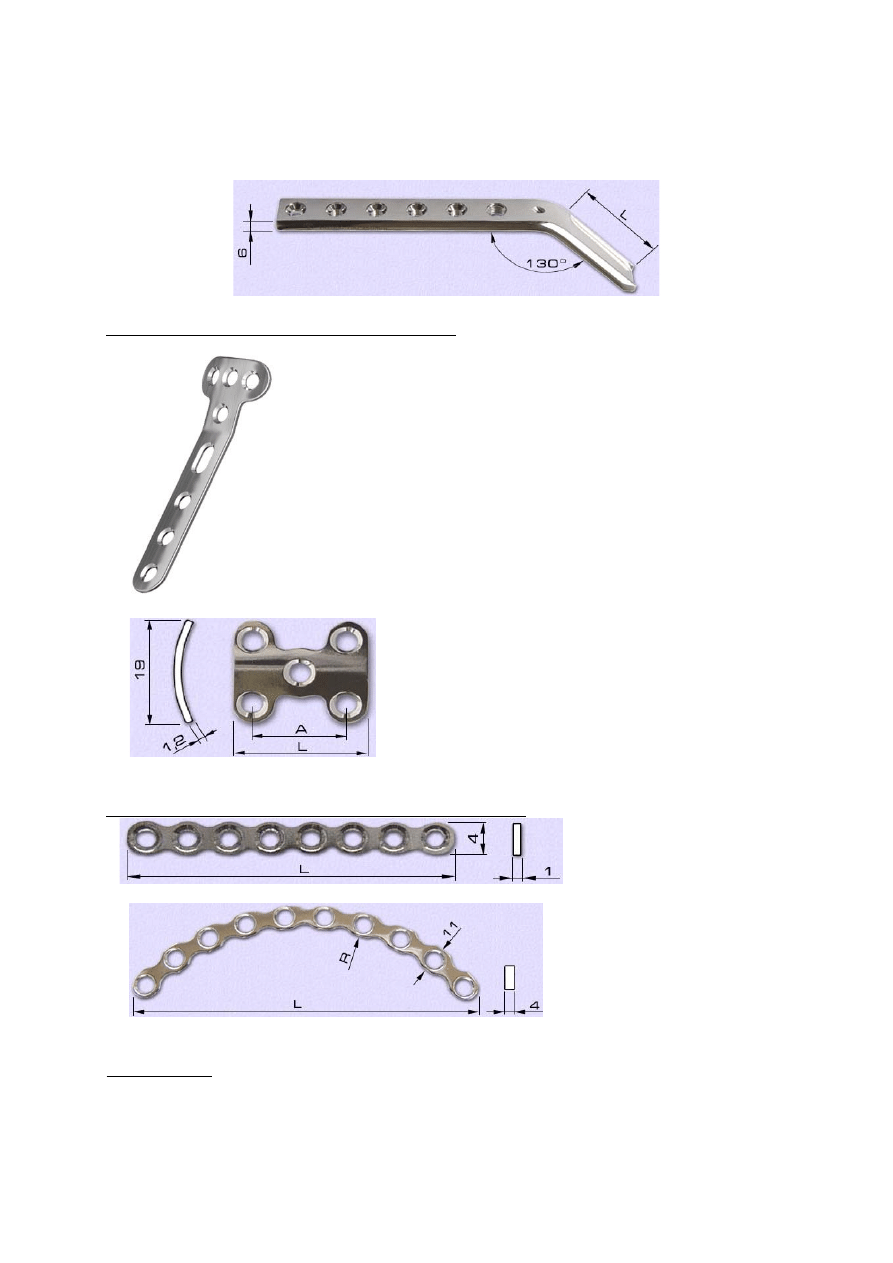
Płytki rekonstrukcyjne
– złamanie dolnej części miednicy
Płytka prosta z typoszeregiem 11 x 2,5 pod wkręty 4,5
Wkręty kostne –
Ze względu na cechy charakterystyczne wkręty kostne dzielimy na:
•
wkręty z gwintem płytkim
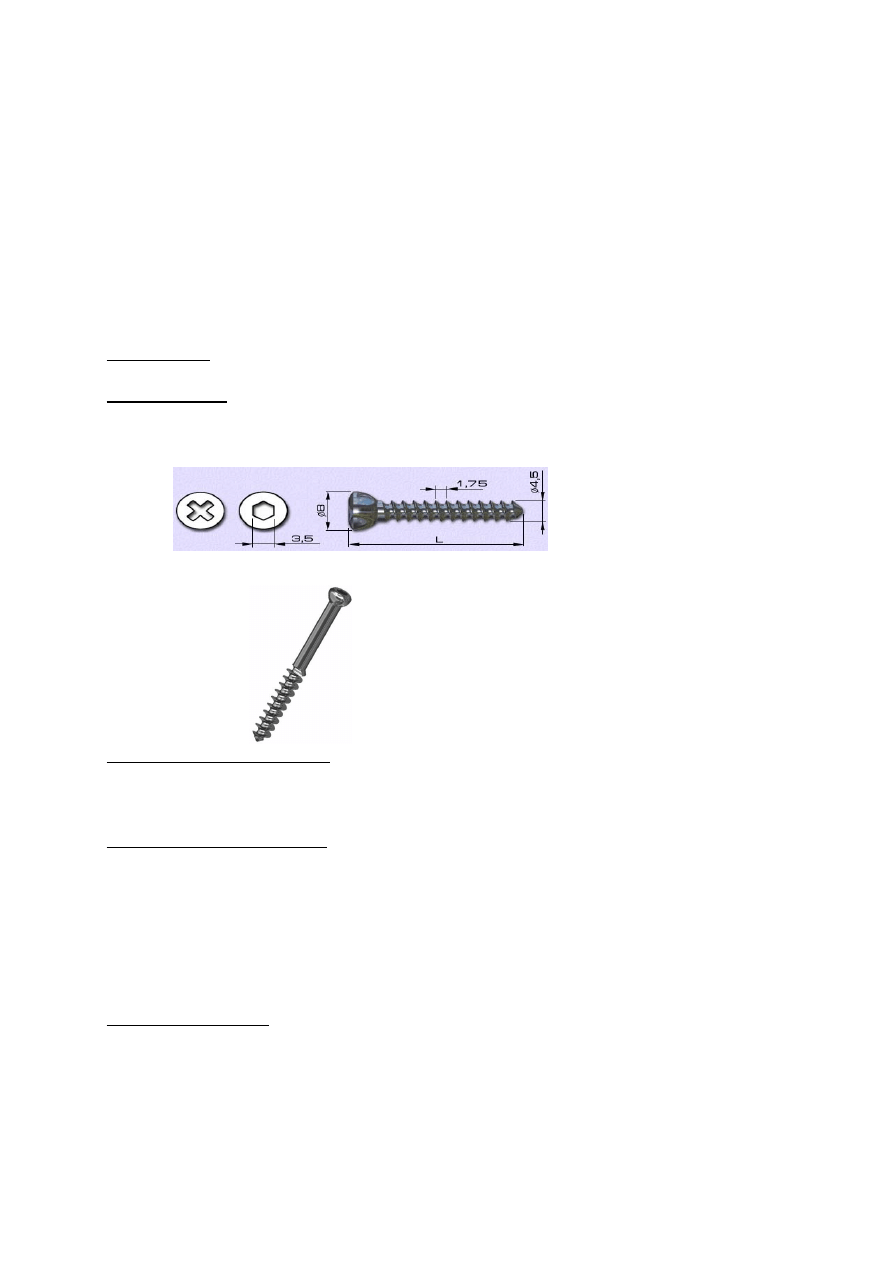
•
wkręty z gwintem głębokim
W zależności od rodzaju kości wyróżniamy:
•
wkręt gąbczasty
•
wkręt korowy
•
wkręty do kości strzałkowej i piszczelowej
•
wkręty do kości łódkowatych
•
wkręty do kości drobnych
stal – jeżeli nie na stałe
tytan – na stałe
Wkręt korowy – wprowadzany do tkanki kostnej korowej
Wkręt gąbczasty – wprowadzany do tkanki kostnej gąbczastej większy skok gwintu
W zależności od jego przeznaczania można wyróżnić dwa sposoby gwintowania
(wprowadzania)
•
na całej długości
•
gwintowany w części końcowej
Zalety osteosyntezy nakostnej:
•
prosta technika operacyjna
•
szeroki zakres stosowania
Wady osteosyntezy nakostnej:
•
upośledzenie ukrwienia (małe)
•
przesztywniony sposobem stabilizacji (największa wada) nie może ściśle przylegać do
kości
•
odłuszczanie okostnej
OSTEOSYNTEZA STABILIZATORAMI PŁYTKOWYMI
Stabilizatory płytkowe- uzyskanie elastyczności konstrukcji, jaką tworzy stabilizator z
odłamami kostnymi, wyeliminowanie bezpośredniego nacisku płytki na kość
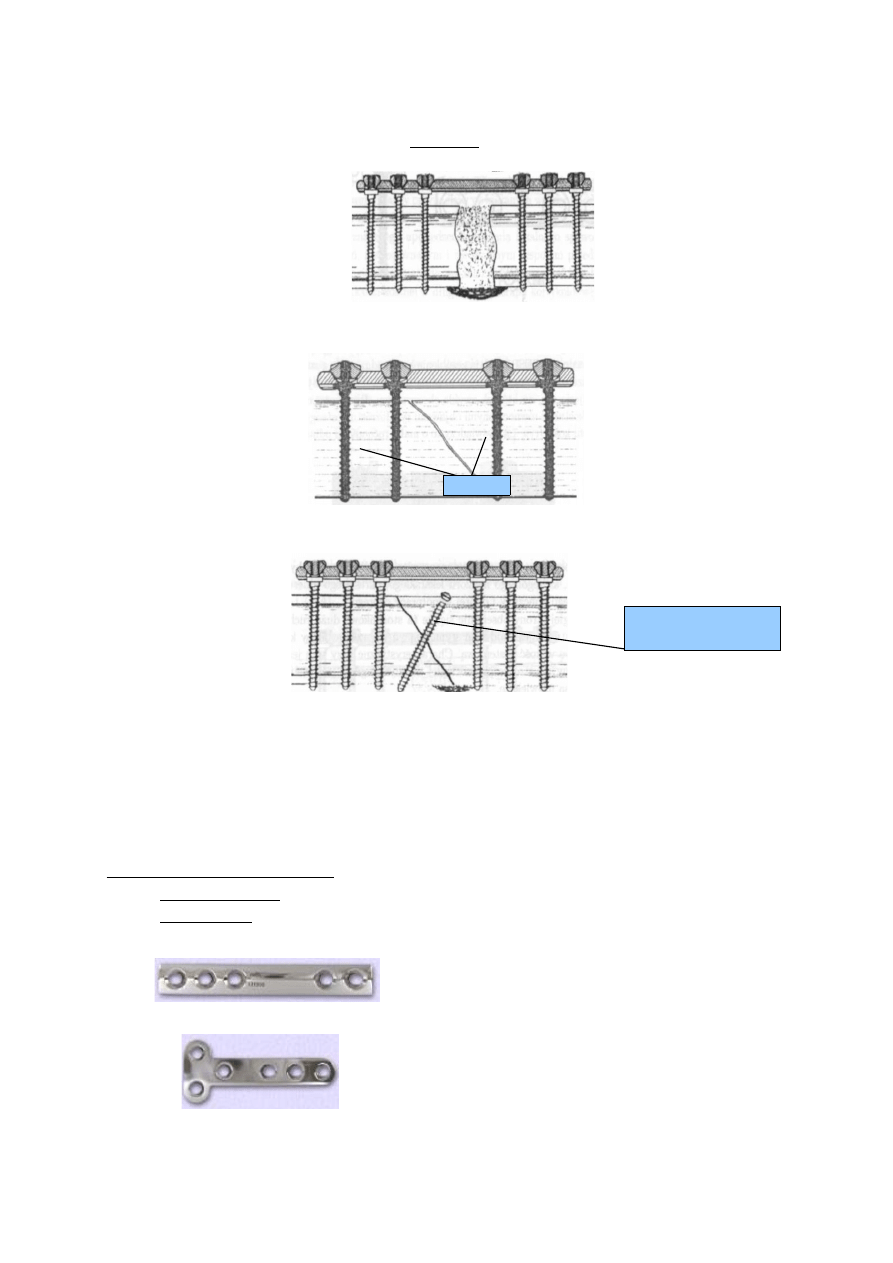
Metody osteosyntezy stabilizatorami płytkowymi
•
zespolenia bez osiowego docisku (ZESPOL)
neutralizujące (śruba ciągnąca)
kontaktowe
mostujące – zbieranie elementów kości i ułożeniu ich w przestrzeni złamania.
Na tych elementach odbudowuje się struktura kostna
•
zespolenia dociskowe – ułożenie stabilizatora:
* przed dokręceniem nakrętek
* po dokręceniu nakrętek
Stabilizator płytkowy ZESPOL składa się z trzech elementów :
•
wkrętu kostnego
mającego postać tzw. śrubowkręta
•
płytka nośna
kość
Po skosie wkręcona
•
nakrętki
Wykład 3
14.03.2011
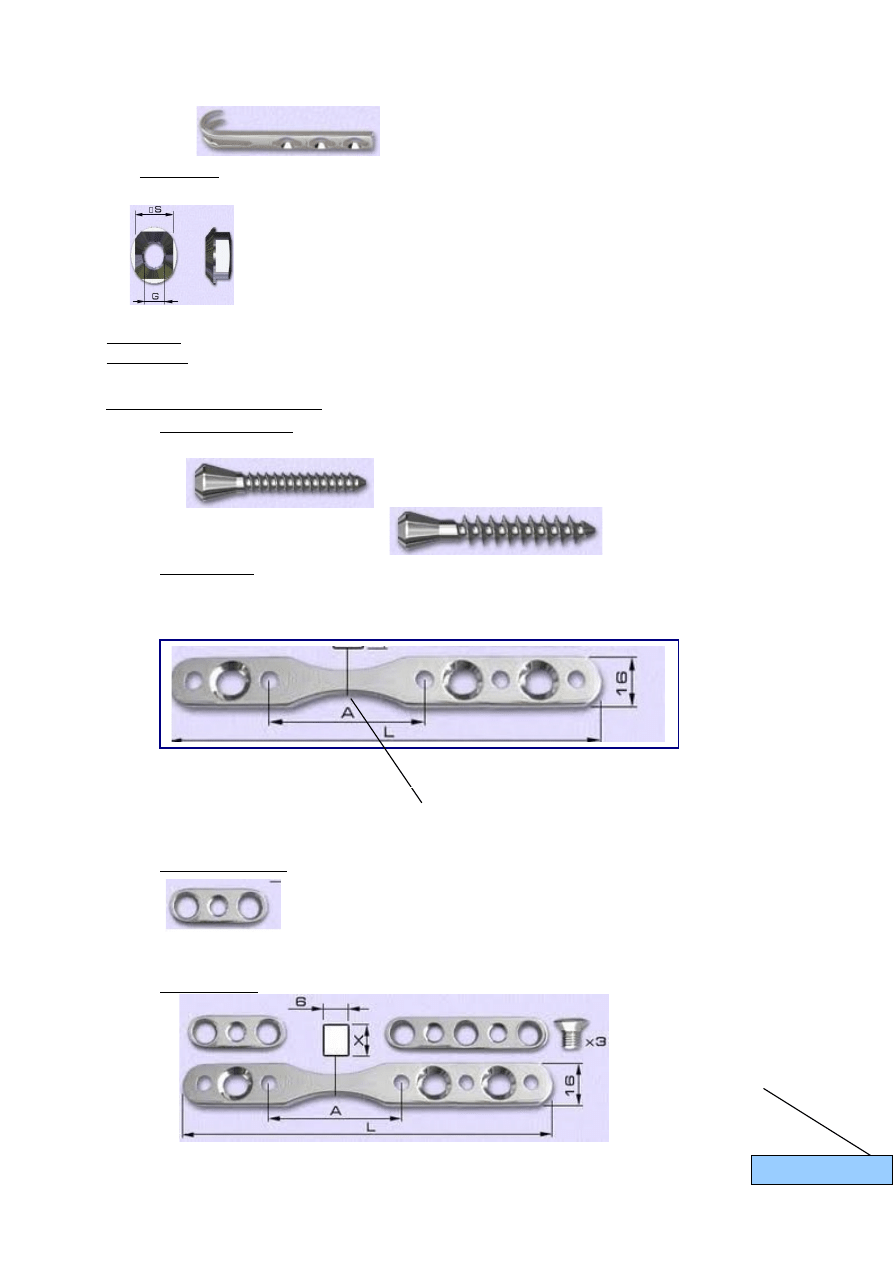
Stabilizator płytkowy
Polfix
składa się z następujących elementów:
•
wkrętów kostnych
* wkręt do kości korowej
* wkręt do kości gąbczastej →
•
płytki nośnej
* 2-otworowa
* 4-otworowa
* asymetryczna
Przykłady płytek nośnych stabilizator:
•
płytki klamrujące
* 2-otworowe
* 3-otworowe
•
śruby łączące
→ łączą płytkę nośną z płytkami klamrującymi
Posiadają przewężenie –
otwory regulacyjne
•
zatyczki
Dodatkowo do użytku klinicznego wprowadzono płytki łączące proste i wygięte
umożliwiające szereg połączeń dwóch stabilizatorów do łączenia załamań dwu i
trójpoziomowych.
Szeregowe połączenie płytek nośnych z wykorzystaniem płytki łączącej (inna postać płytki
klamrującej).
Zarówno na bazie stabilizatora ZESPOL jaki i POLFIX zbudowano
aparat
kompresyjno - dystrakcyjny KoD
służący do:
•
dystrakcji kości
•
wytworzenia kompresji niszczącej nieprawidłowy zrost kostny
Budowa aparatu typu KoD systemu ZESPOL:
•
stała t aparatu
•
prowadnica gwintowana
•
prowadnica gładka z naniesioną skalą odległości
•
nakrętka dystrakcyjna
•
ruchoma część aparatu
•
nakrętka kompensacyjna
Osteosynteza stabilizatorami zewnętrznymi
Stabilizator
Ilizanowa
:
•
zbudowany z półokręgów, które łączy się śrubami w pełne kręgi stanowiące
poszczególne bazy aparatu
•
bazy aparatu łączy się prętami gwintowanymi
•
druty Kirschnera prowadzone przez tkanki miękkie i kość
Stabilizator BHH Mikromed:
•
stabilizator mały – L=150mm
•
stabilizator średni I - L=300mm
prosta
wygięta
•
stabilizator średni II L=350mm
•
duży - L=400mm
Stabilizator Dynastab
•
stabilizator stawu skokowego (złamań kości w obszarze okołostawowej)
•
zastosowanie: załamanie kości okołostawowych
•
zamiast unieruchomienia stawu opatrunkiem gipsowym
•
stabilizator stawu łokciowego
•
stabilizator miednicy
•
stabilizator do złamań trzonów kości długich
•
stabilizator nadgarstka
Implanty stosowane w osteosyntezie śródszpikowej
Gwoździowanie śródszpikowe w osteosyntezie
1. Charakterystyka metody
•
Elastyczna metoda stabilizacji odłamów kości długich
•
Zapewnia utrzymanie odłamów kostnych w anatomicznej pozycji we wszystkich
etapach gojenia
•
Cel:
zapewnienie mikroruchów odłamów kostnych (lepsze pompowanie substancji
odżywczych do miejsca złamania → szybszy zrost odłamów)
•
Następuje stymulacja powstawania regenerującej się tkanki kostnej
•
Zachodzi odkształcenie tkanki w zakresie sprężystym – uruchamia się mechanizm
generujący potencjał. elektromechaniczne w kości
•
Różnicuje się struktura kości, począwszy od ziarniny przez tkankę włóknistą i
chrzestną, aż po odtworzenie struktury kości pierwotnej.
2. Rodzaje złamań kości długich
gwoźdź (pusty w środku,
zawiera otwory na śruby , go
stabilizujące
Ogólnie złamania trzonów kości długich można podzielić na:
•
złamania zamknięte i otwarte
•
z przemieszczeniem i bez przemieszczenia

Ogólna charakterystyka gwoździ śródszpikowych
Zalety:
•
umiejscowienie gwoździa w osi anatomicznej kości
•
dobra fiksacja w kanale szpikowym
•
gwóźdź przechodzi przez oś obojętną obciążenia są przenoszone równomiernie,
wzdłuż kości w sposób zbliżony do naturalnego
•
gwóźdź przenosi naprężenia ściskające i skrętne
•
zminimalizowanie naprężeń zginających – proporcjonalne
•
do odległości pomiędzy implantem a osią kości
Schemat porównania naprężeń
Wady:
•
upośledzenie ukrwienia
•
konieczna rekonwalescencja:
•
około 3 tygodni, gdy kanał nie jest rozwiercany
•
około 6 tygodni, gdy kanał jest rozwiercany
Cechy geometryczne gwoździ
1. Przekrój poprzeczny
•
kształt
* okrągły
* rurowy
* pełny
* przekrój w kształcie gwiazdy, wielokątów lub trójlistnej kończyny
•
zamknięty
•
otwarty – gwóźdź jest nacięty na całej długości
2. Zakres średnic i długości
•
średnice – 10 – 15 mm
•
długość – 260 – 500 mm
Ryglowane gwoździowanie dynamiczne
Wprowadzanie rygli tylko do jednego z odłamów kostnych pozwala na wzajemne nieznaczne
przemieszczanie się odłamów kostnych → aktywizacja zrostu kostnego w wyniku procesów
elektrokinetycznych
Statyczne ryglowanie (utwierdzanie gwoździ) kości
•
Gwóźdź jest zablokowany w obu końcach
•
brak możliwości wzajemnego przemieszczania się odłamów względem siebie
Dynamizacja statycznego systemu
•
usuwa się śruby po jednej stronie złamania generacja naprężeń ściskających kości →
szybszy zrost

Wykład 4
21.03.2011
Implanty stosowane w alloplastyce stawowej
Stawy → skomplikowane struktury stanowiące połączenie kości, które pozwala na
wykonywanie ruchów, zmniejszając w znacznym stopniu tarcie.
Rodzaje:
biodrowy
kolanowy
skokowy
barkowy
łokciowy
Alloplastyka stawowa – staw biodrowy
Staw biodrowy
→ kulisty staw panewkowy o dużym zakresie ruchu. Najbardziej
eksploatowany staw nośny → przystosowany do przenoszenia dużych obciążeń statycznych i
dynamicznych.
Ruchy:
•
w płaszczyźnie czołowej → zgięcie i wyprost
•
w płaszczyźnie strzałkowej → odwodzenie, przywodzenie kończyn
•
w osi pionowej → obrót na zewnątrz i do wewnątrz
Budowa kości udowej:
•
głowa kości
•
krętacz większy
•
szyjka kości
•
trzon kości
•
krętacz mniejszy
Należy do najbardziej narażonych na zmiany przeciążeniowo – zwyrodnieniowe elementów
układu kostno-stawowego z uwagi na:
•
wielkość przenoszonych obciążeń
Nieprawidłowy rozkład obciążeń w stawie biodrowym sprzyja szybkiemu postępowi zmian
zwyrodnieniowych polegających na wadliwym rozwoju panewki (odchylenia w budowie
bliższej części kości udowej). Od wielu lat skuteczną metodą leczenia zmian
zwyrodnieniowych jest ALLOPLASTYKA STAWU BIODROWEGO.
Celem zabiegu alloplastyki stawu biodrowego jest:
•
odtworzenie uszkodzonego stawu
•
umożliwienie wykonywania podstawowych ruchów
•
zapewnienie prawidłowego funkcjonowania endoprotezy → trwałość endoprotezy
W świecie rocznie przeprowadza się ponad 1 mln zabiegów alloplastyki stawu biodrowego →
ok. 6 – 25 % kończy się niepowodzeniem.

Przyczyny niepowodzeń:
•
zmiany zapalne
•
niestabilność
•
obluzowanie trzpienia lub panewki
•
zużycie powierzchni nośnej endoprotezy
Klasyfikacja endoprotez stawu biodrowego
ze względu na zakres implantacji w stawie
* całkowita alloplastyka stawu biodrowego → wymianie podlega panewka oraz głowa
kości udowej
* częściowa alloplastyka stawu biodrowego
→ wymianie podlega tylko głowa
(KAPOPLASTYKA)
ze względu na konstrukcję
* endoprotezy jednolite → z kołnierzem lub bezkołnierzowe
* endoprotezy dzielone → z kołnierzem lub bezkołnierzowe
ze względu na sposób mocowania
endoprotezy cementowe (powierzchnia gładka)
endoprotezy bezcementowe (powierzchnia porowata)
Materiały stosowane w endoprotezoplastyce stawu:
Trzpień
Główka
stopy Co
stopy Ti
tworzywa polimerowe
ceramika korundowa (Al
2
0
3
)
ceramika cyrkonowa
•
Panewka w obudowie metalowej z wkładką:
- polietylenową
- ceramiczną Al
2
0
3
•
Główka:
- stop Co – Cr - Mo
- ceramika Al
2
O
3
lub ZrO
2
•
Trzpień:
- stop Co
- stop Ti
Elementy endoprotez – panewka
Zalety polietylenu jako materiału implantacyjnego:
•
duża wytrzymałość mechaniczna
•
mały współczynnik tarcia
•
elastyczność
•
dobre własności dielektryczne
Wady polietylenu:
•
mała wartość granicy plastyczności
•
podatność na pełzanie i starzenie
•
mała odporność na zużycie
•
zmiana własności mechanicznych w wyniku wielokrotnego naświetlania promieniami
RTG

•
niemożność sterylizacji w wysokich temperaturach
Elementy zużywania się panewek polietylenowych jest:
•
zmiana zabarwienia i jakości powierzchni
•
ubytki cierne
•
mikropęknięcia na powierzchni
•
wykruszenia cząstek polietylenu
Metody uszlachetniania powierzchni endoprotez stawu biodrowego:
•
polerowanie elektrochemiczne oraz pasywacja
•
powłoki nanoszone metodą CVD i PVD
•
implantowanie jonowe
•
napylanie plazmowe
•
powłoki bioceramiczne nanoszone przez:
* elektroforezę
* metodę zol-żel
Zmiany rozwiązań konstrukcyjnych endoprotez dotyczą:
•
kształtu trzpieni
•
materiałów, z których wykonywane są poszczególne elementy
•
techniki implantacji
Czynniki wpływające na dobór endoprotezy stawu biodrowego:
•
wiek kalendarzowy i biologiczny pacjenta
•
jakość tkanki kostnej
•
aktywność życiowa
•
warunki anatomiczne chorego stawu biodrowego
Rozwiązania konstrukcyjne panewek
Gdy panewka stawu naturalnego ( u młodych ludzi) nie jest nadmiernie zniszczona
Starsze typy endoprotez stawu biodrowego – przykłady rozwiązań
Przykłady endoprotez stawu biodrowego:
•
endoproteza bezcementowa Mittelmeiera
* trzpień żeberkowy z kołnierzem (Co – Cr – Mo)
* Panewka → Al
2
O
3
•
endoproteza bezcementowa Parchofera – Möncha
*trzpień → Ti – 6 Al – 4 V
•
endoproteza bezcementowa Bicontact
* główka → Al
2
O
3
Bidox
•
endoproteza bezcementowa Coreil
* trzpień pokryty hydroksyapatytem
* główka → Al
2
O
3
•
endoproteza ABG ceramika – ceramika
* trzpień hydroksyapatytowy (Ti – 6 Al – V)
•
główka → Al
2
O
3
- Al
2
O
3
Problemy przy alloplastyce stawu biodrowego:
•
obluzowanie panewki
•
przemieszczenie trzpienia (siatka wzmacniająca)
•
wykruszenie cementu kostnego
•
pęknięcie kości
•
deformacja, doluzowanie i pęknięcie trzpienia
•
pęknięcie panewki polietylenowej
•
resorpcja kości
•
zmiana grubości kory kostnej
Wykład 5
04.04.2011
Implanty stosowane w chirurgii naczyniowej i rekonstrukcyjnej
Stenty – nowoczesna technika w leczeniu choroby miażdżycowej złogi cholesterolowe
powodują zwężanie
wcześniej stosowana metoda → zabieg wszczepiania bypassów → bardzo długi okres
rekonwalescencji
Balonikowanie → wprowadzanie przez tętnicę (najczęściej udową) cewnika zakończonym
balonikiem (stąd nazwa) → nie zapewnia długotrwałych efektów
metalowy stent osadzony w ściankach śródbłonka
Stentowanie – prosta i szybka metoda
Jeżeli zwężeniem jest objęta znaczna długość wtedy dokonuje się bypassy, a stentowanie
Ciśnienie powodujące rozprężenie stentu 10-15 atmosfer
Problematyka stosowania stentów w chirurgii wewnątrznaczyniowej i rekonstrukcyjnej.
Stosowanie stentów stało się przyjętym sposobem leczenia wielu schorzeń powodujących
zwężanie narządów o kształcie rurowym w obranym układzie krążenia, pokarmowego,
oddechowego i moczowego. Pomijając naczynia wieńcowe serca dotyczy to:
•
zwężeń dużych tętnic i aorty spowodowanych procesem miażdżycowym
•
zwężeń przełyku spowodowanych procesem nowotworowym, bliznowatym, w
sytuacjach wymagających ochrony w przypadku rozdarcia przełyku
•
zwężeń oskrzeli i tchawicy zamykanych przez proces nowotworowy i bliznowaty
•
zwężeń cewki moczowej i moczowodu w wyniku procesu nowotworowego i
bliznowatego lub w sytuacjach wymagających ochrony ( przypadku rozdarcia)
Stenty wszczepiane są w pracowniach hemodynamicznych. Nie wymaga to obecności
kardiochirurga!
Stenty urologiczne
Poszczególne rodzaje stentów muszą mieć zróżnicowane cechy użytkowe:
•
cechy geometryczne
•
własności mechaniczne dostosowania do elastycznej współpracy z określonym
rodzajem tkanek rekonstruowanych narządów

•
własności mechaniczne uwzględnienie stosowaną techniką operacyjną (głównie
małoinwazyjnością)
•
odpowiednie własności fizykochemiczne ograniczające reaktywność (odczyny
okołowszczepowe) i powikłania pooperacyjne
Implanty stosowane w kardiologii interwencyjnej
Grupy niepełnosprawnych w zależności od poszczególnych rodzajów schorzeń
1. Etapy rozwoju miażdżycy wieńcowej
A) Zdrowa tętnica
B) Wczesne stadium odkładania się cholesterolu
C) Blaszka miażdżycowa
D) Blaszka miażdżycowa + skrzep
2. Techniki przezskórnego poszerzania naczyń wieńcowych – PCI
(Percutaneous Coronary Intervensions)
•
brak istotnej zmiany objętości miażdżycowej (non debulking
techniques)
* przezskórna angioplastyka wieńcowa– PTCA (Percutaneous
Transluminal Coronary Angioplasty)
* wszczepianie implantów – stenty wieńcowe
•
zmniejszanie objętości blaszki miażdżycowej (debulking
techniques)
* aterektomia kierunkowa – skrawanie nożykiem złogów
miażdżycowych (cholesterolowych)
* ateroktomia wysokoobrotowa (rotablatory) – wywiercanie
złogów
* angioplastyka laserowa (lasery eksinerowski i)
* trombektory
3. Stent – wszczepialna, rozszczepialna konstrukcja rurowa podtrzymująca
drożność naczynia.
4. Stentgraft
– połączenie jednego lub większej ilości stentów z rurową protezą
naczyniową
Stenty mają małą średnicę.
5.
Klasyfikacja stentów wieńcowych
A) Ze względu na postać konstrukcyjną
•
stenty rurkowe z nacięciami (slotted tube)
* grubość ścianki 0,1 mm
•
stenty w kształcie zwoju (coil)
•
stenty siateczkowe (mesh stent)
•
stenty pierścieniowe (ring)
•
stenty kombinowane

B) ze względu na sposób implantacji
•
stenty samorozprężalne (stopy z pamięcią kształtu Ni Ti –
Nitinol)
•
stenty rozprężalne na baloniku (stenty wszczepiane na zawsze
tytan odpada ze względu na trudność otrzymania drutu w ramach
procesów technologicznych (stopy kobaltu Co, stale Cr – Ni – Mo
także stosowany wolfram i tantal)
Ilość zabiegów wszczepiania stentów wieńcowych w Polsce w latach 2001-2006.
Implantowanie stentu wieńcowego z wykorzystaniem technologii
wysokociśnieniowego rozprężania
Problemy z implantowaniem stentów:
•
Wykrzepianie krwi
•
Restenoza –zapadanie się naczynia
Implantowanie stentu – prawa tętnica wieńcowa
•
Wprowadzanie stentu przy chwilowym niedokrwieniu
•
Badanie stentów wieńcowych w warunkach in vivo – 3 dni po implantacji.
•
Ścianka tętnicy wieńcowej po implantacji stentu widoczne uszkodzenia śródbłonka.
•
Skrzepy powstałe na powierzchni stentu.
•
Stenty DES - warstwa polimerowa nasączona lekami, miejscowo uwalnianymi w
zmianach chorobowych
Własności charakteryzujące prawidłowy stent:
1.
Dotyczy konstrukcji i materiału:
•
Dobra sprężystość
•
Niezawodna rozprężalność
•
Mała stopień skrócenia implantu
•
Mała powierzchnia metalu – stopień ostentowania
•
Dobra widzialność fluroskopowa
•
Dobre własności reologiczne
2.
Dotyczy warstwy powierzchniowej materiału (→ WAŻNE odpowiednia obróbka
powierzchni stentu):
•
Atrombogenność (wykrzepianie płytek krwi na powierzchni stentu)
•
Biotolerancja w środowisku tkanek układu krwionośnego ( hemokompatybilność )
Ø 5 – 5,5 mm → do tętnic szyjnych
3.
Zakres wymaganych badań stentów
według (PN – EN 12006 – 3 :1989) (2010
uaktualnienie) obejmuje ocenę:
•
własności funkcjonalne
•
cech konstrukcyjnych

•
materiału – uwzględnienie właściwości wymaganych do osiągnięcia
zaplanowanego celu
•
sterylizacja
•
pakowanie
4.
Metody ograniczania procesu wykrzepiania i restenozy
A) Polerowanie powierzchni implantów
•
atrombogenność (+)
•
restenoza (±)
B) Wytwarzanie powłok polimerowych
•
niebiodegradowane
* poliuretan
* polisiloksan
* politeraftalon etylenu
* atrombogenność (+)
* restenoza (±)
•
pochodzenia naturalnego
* polilaktyd (PLA)
* polisacharyd
* fibryna
* heparyna
* atrombogenność (+)
* restenoza (±)
C) Wytwarzanie powłok nieorganicznych
•
warstwy Au
* atrombogenność (+)
* restenoza (±)
•
amorficzny Si C
* ograniczenie konwersji fibrynogenu do fibryny
* atrombogenność (+)
* restenoza (+)
D) Stenty uwalniające leki (DES Drug Eluting Stents)
•
rapanacyna
•
paclitaxel
•
atrombogenność (+)
•
restenoza (+)
5. Problematyka kształtowania własności użytkowych stentów powinna obejmować
A. Dobór materiału metalowego z uwzględnieniem
Miniaturyzacji implantów
Techniki implantacji
Stenty rozszerzalne na baloniki
niskie własności wytrzymałościowe, wysokie
plastyczności
B. Ukształtowanie własności fizykochemicznych warstwy
powierzchniowej z uwzględnieniem
•
Uwarunkowań biofizycznych układu serce – naczynia wieńcowe
•
Reaktywności chemicznej układu krwionośnego
•
Techniki implantacji
9. Odczyn kwasowości krwi

•
Osocze krwi tętniczej → pH =7,39 ± 0,02
•
Osocze krwi żylnej 7,34 ± 0,02
10. Uwarunkowania biofizyczne układu serce - naczynia wieńcowe:
Własności fizykochemiczne
Dodatkowe kryteria jakości stentów:
A) Dostosowywanie własności magnetycznych biomateriału
metalowego – PARAMAGNETYK
B) Dostosowanie własności elektrycznych biomateriału
metalowego – DIELEKTRYK
C) Odporność korozyjna
implantu w środowisku krwi w
warunkach angioplastyki wieńcowej
Wykład 6
11.04.2011 r.
Stenty przełykowe
1. Podstawowym wskazaniem do ich zastosowania są nieoperacyjne nowotwory
przełyku i jego łagodne zwężenia.
2. Technika stentowania jest stosunkowo prosta, nie obciąża nadmierną traumatyzacją
stanu ogólnego pacjenta.
3. Zastosowania znalazły dwa rodzaje stentów:
•
stenty polimerowe → konwencjonalne
◦
konieczność wcześniejszego poszerzania światła przełyku, gdyż średnica
stentu jest stała
◦
wadą jest konieczność przeprowadzenia zabiegu w znieczuleniu ogólnym
•
stenty metalowe → samorozprężalne
◦
zaletą metalowych stentów jest fakt, że do ich założenia wymagana jest
mniejsza średnica wprowadzanego stentu niż polimerowego
◦
nie jest wymagane znaczne poszerzanie światła przełyku, przez co
wydatnie redukuje się ryzyko uszkodzenia ściany przełyk
◦
mała średnica pozwala na stosunkowo łatwe wprowadzanie stentu w
miejsce zwężenia
◦
po rozprężeniu stentu niemożliwe jest jego usunięcie lub przesunięcie →
niemożliwa repozycja
◦
zastosowanie stentów samorozprężalnych powoduje jedynie 16% powikłań
◦
implantacja tych stentów stała się uznanym, bezpiecznym i autentycznym
sposobem przywrócenia drożności przełyku
◦
wadą jest możliwość przerastanie przez ściany stenty zmian
nowotworowych powodującą nawrót zwężenia
◦
w nowej generacji stosuje się pokrycia metalowego szkieletu cienką
warstwą silikonu
4. Przykłady stentów przełykowych:
•
Z – Stent (Wilson – Cook) → wykonany ze stali Cr-Ni-Mo
◦
średnica części środkowej = 18 mm, średnica rozszerzonego końca = 25
mm, długość → 60 – 140 mm

◦
wprowadzany jest na cewniku o średnicy = 31 Fr (10 mm)
•
Wallstent → stent siatkowy (Mesh stent)
◦
średnica części środkowej = 19mm, średnica rozszerzonych końców → 18
– 20 mm
•
Ultraflex → stop z pamięcią kształtu (Nitinol)
◦
wprowadzany na cewniku o średnicy = 20 Fr
◦
kielichowa konstrukcja w górnej części
◦
stosowany w chorobie refluksowej
◦
długości stentu → 70, 100, 120 oraz 150 mm
◦
średnica części środkowej = 18 i 23 mm
•
Escopha coil → wykonany z płaskiego drutu nawiniętego na walec, z
rozszerzonymi końcami przeciwdziałającymi przemieszczaniu:
◦
cecha charakterystyczna → najwyższa wartość siły promieniowej podczas
rozprężania, największe skrócenie po implantowaniu
Stenty tchawicowe
1. Budowa układu oddechowego:
•
krtań
•
chrząstka promieniowa
•
tchawica
•
chrząstki tchawicze
•
prawe i lewe oskrzele główne
•
ostroga tchawicy
2. Stosowane w niedrożności górnych dróg oddechowych → z powodu łagodnego lub
złośliwego procesu nowotworowego.
3. Leczenie operacyjne przynosi zadowalający efekt tylko w niewielkiej ilości
pacjentów, będących w dobrym stanie ogólnym.
4. Istnieją anatomiczne ograniczenia dotyczące długości odcinka tchawicy, który może
być usunięty → leczenie z wykorzystaniem stentów.
5. Upowszechnienie intensywnej terapii z wykorzystaniem przedłużonej intubacji lub
tracheotomii stwarza dodatkową, dość liczną grupę pacjentów wymagających leczenie
operacyjnego względnie założenia stentu w miejsce zwężenia pointubacyjnego lub
potracheotomijnego.
6. Rodzaje stentów:
•
Sztywne stenty silikonowe
◦
hamują ruch rzęsek, dając zastój wydzieliny drzewa oskrzelowego w
świetle i postępującą okluzję
◦
wadą jest duża skłonność do przemieszczania się
◦
przykłady:
▪
Montgomery w kształcie T
▪
Hood Westaby T- Y
▪
typu Dumon → do ich wprowadzania służy sztywny bronchoskop
•
tchawicze
•
oskrzelowe
•
umiejscawiane w pobliżu ostrogi tchawicy
•
typu Y

•
Stenty metalowe → Implantacja stentu samorozprężalnego z użyciem
bronchoskopu giętkiego
◦
wytwarzane ze stali Cr – Ni – Mo, stopów Ni – Ti, Co – Cr i Ta
◦
pokrywane silikonem lub poliuretanem o średnicach 8 – 16 mm i długości
26 – 49 mm
◦
łatwość implantowania w znieczuleniu miejscowym
◦
nie upośledzenie drenażu wydzieliny drzewa oskrzelowego
◦
elastyczność umożliwiająca dostosowanie stentu do kształtu oskrzela
◦
dobra tolerancja przez pacjentów, dająca zdecydowaną poprawę komfortu
życia pacjentów → 85 – 90 %
◦
Endoskopowa technika implantacji
▪
zwężenie lewego oskrzela
▪
prowadnik z balonikiem
▪
prowadnik ze stentem przez rozprężaniem
▪
sten po rozprężeniu
◦
Przykłady:
▪
Z – stent → stal Cr – Ni – Mo
•
średnica → 15 – 35 mm
•
długość → 50 mm
▪
Flexstent → mesh stent, stop Ni – Ti
•
stent oskrzelowy
•
stent tchawiczy
▪
Stent TracheobronxaneSimet → Ni – Ti, powłoka poliestrowa
▪
Stent Ultraflex TM Tracheobronchial → Ni – Ti, powłoka z poliuretanu
lub bez powłoki
Stenty urologiczne
1. Stosowane przy udrażnianiu zwężeń cewki moczowej, spowodowanych łagodnym
przerostem stercza → można uniknąć konieczności niewygodnego dla pacjenta
cewnikowania
2. Przydatne u dzieci w zwężeniach cewki moczowej, występujących po operacjach jej
rekonstrukcji
3. Leczenie łagodnych lub nowotworowych zwężeń moczowodów
4. Niwelowanie zwężeń moczowodowych → stenty poliuretanowe
5. Klasyfiakcja:
•
Zakładane na stałe → o konstrukcji siatkowej, metalowe lub poliuretanowe,
implantacja prowadzona jest pod kontrolą fluoroskopową lub endoskopową
◦
stent UroLume → ASI (Advanced Surgical Intervention)
•
Zakładane czasowo → mniejsza średnica, można je usunąć, nie rozprężają się
◦
Stent Prostakath → śródsterczowa spirala wykonana ze stali Cr – Ni – Mo
◦
Stent Memokath
IMPLANTY STOSOWANE W ALLOPLASTYCE STAWU KOLANOWEGO
1. Staw kolanowy
•
największy staw
•
stawo zawiasowo – obrotowy o budowie bardziej złożonej do biodrowego

•
najbardziej obciążony staw
•
Ruchy:
◦
zginanie
◦
prostowanie
◦
obrotowe → przy zgiętej kończynie
•
Budowa:
◦
dwa kłykcie udowe
◦
dwa kłykcie piszczelowe
◦
rzepka
•
Najważniejsze elementy:
◦
części kostne oraz powierzchnie stawowe pokryte są chrząstką
◦
łąkotki
◦
więzadła
◦
mięśnie działające na staw
◦
torebka i jama stawowa wraz z wypełniającym ją płynem umożliwiającym
ruchy stawu (maź synowialna)
2. Zmiany stawu kolanowego od zdrowego do protezy:
•
zdrowe kolano
•
zwyrodnienie
•
endoproteza stawu kolanowego
3. Endoprotezy stawu kolanowego:
•
Obszar wymiany stawu
◦
jednoprzedziałowe
◦
dwuprzedziałowe
◦
trójprzedziałowe
•
Stopień swobodnego ruchu stawu
◦
niezwiązane
◦
częściowo związane
◦
całkowicie związane
•
Sposób zamocowania elementów endoprotezy
◦
cementowe
◦
bezcementowe
◦
hybrydowe
4. Endoprotezy częściowe stawu kolanowego
•
zmiana chorobowa dotyczy tylko jednego z kłykci stawu kolanowego
•
endoproteza typu saneczkowego (płoza) → płoza ślizga się po polietylenowej
wkładce
•
Endo – Modell (W – Link)

•
Oxford
•
Smith & Nephew typu
Accuris
•
Smith & Nephew typu Journey
Deuce
5. Endoprotezy całkowite stawu kolanowego
•
zwyrodnienie w obszarze dwóch kłykci
•
komponent udowy i piszczelowy z polietylenową wkładką
•
typu Journey
•
typu Gemini firmy W. Link
•
Endo – Modell firmy W. Link
◦
z rzepką lub bez rzepki
◦
element centrujący
◦
złączka
◦
stworzeń
◦
otwór na śrubę
•
Legion firmy Smith & Nephew
◦
element piszczelowy → stopy Ti
•
AGC DA
•
Genesis II
◦
z rzepką lub bez rzepki
6. Endoprotezy całkowite stawu kolanowego i biodrowego
7. Materiały na endoprotezy stawu kolanowego:
•
Stopy Co, np. Co – Cr – Mo, Co – Ni – Cr – Mo
•
Polietylen o dużej gęstości
•
Stopy Ti, np. Ti – 6Al – 4V, Ti – Nb – Zr
•
Stopy cyrkonu, np. Zr – 2,5Nb (Oxinium) → NOWOŚĆ!!! → dobra odporność
na ścieranie, większa twardość niż stopy kobaltu
Część udowa wykonywana jest
najczęściej ze stopów Co
•
dobra odporność na ścieranie
Wyszukiwarka
Podobne podstrony:
do kolokwium interna
WODA PITNA kolokwium
KOLOKWIUM 2 zadanie wg Adamczewskiego na porownawczą 97
Periodontologia GBR implanty protetyka
kolokwium 1
Materiały do kolokwium III
Fizjologia krążenia zagadnienia (II kolokwium)
Algebra liniowa i geometria kolokwia AGH 2012 13
analiza funkcjonalna kolokwium
kolokwiumzTMIC
kolokwium probne boleslawiec id Nieznany
Kolokwium (2)
więcej podobnych podstron