
Spis treści:
•
Akryflawina
•
Astaksantyna
•
Błękit metylenowy
•
Chloramina
•
Formaldehyd
•
F M C
•
Trichlorfon
•
Kwas fosforowy i jego sole
•
Kationy miedzi Cu
2+
(siarczan (VI) i chlorek miedzi (II))
•
Nadmanganian potasu
•
Rivanol
•
Sól kuchenna
•
Tiosiarczan sodu
•
Wodorowęglan sodu
•
Zieleń malachitowa
Akryflawina (Trypaflawina)
Z całą pewnością, jest to jeden z najpopularniejszych, uniwersalny, a zarazem skuteczny,
akrydynowy środek leczniczy oraz dezynfekcyjny. Znany i stosowany w akwarystyce od wielu
lat na całym świecie. Zalecany przez ichtiologów do celów dezynfekcyjnych, kąpieli krótko- i
długotrwałych, pędzlowania ran, regeneracji płetw, ochrony ikry i wylęgu przed inwazją
szkodliwych mikroorganizmów, w tym grzybów, powodujących pleśniawkę.
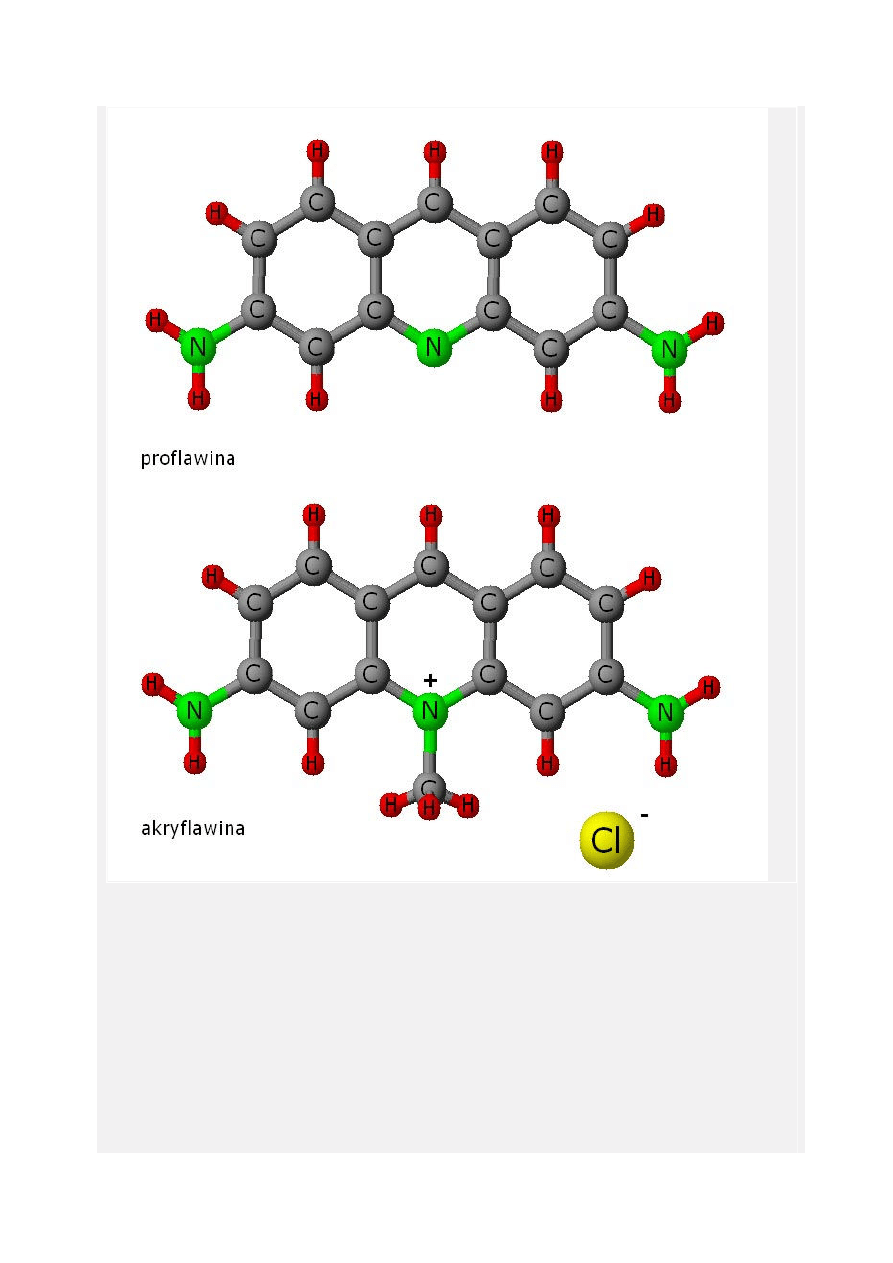
Jak wspomniałem wcześniej Akryflawina jest to pochodna akrydyny, pełna nazwa to 3,6-
diamino-10-metyloakrydyna. Jest to żółtawo-brązowy proszek dający zielonkawe roztwory
wodne. Wzór sumaryczny to C
14
H
15
N
3
, a masa molowa 225,29 g/mol.
W środkach rynkowych jest zmieszana z Proflawiną (3,6-diaminoakrydyna) o czym się rzadko
mówi. Wzory strukturalne obu związków poniżej:
Akrydyna i jej homologi mają własności antyseptyczne. Działanie Akryflawiny polega na tym,
ż
e wnika ona (interkaluje) do DNA (lub RNA) powodując deformację podwójnej helisy DNA
przez rozsunięcie zasad azotowych, co jest przyczyną błędnej replikacji - Akryflawina jest
mutagenna. Błąd w replikacji polega na delecji lub insercji pojedynczych par nukleotydów, a w
dalszej konsekwencji do mutacji typu zmiany ramki odczytu. Akryflawina może działać
szkodliwo na drobnoustroje również dlatego, że jest inhibitorem mitochondriogenezy.
Można ją kupić pod nazwami Akryflawina, Trypaflawina, Acriflavin, JEST Składnikiem
preparatów takich jak Mycopur czy Omnipur (sera). Akryflawiny nie należy mieszać z
preparatami wydzielającymi aktywny chlor (np. Chloramina) lub tlen (KMnO4, woda
utleniona(perhydrol), dwuchromian potasu). Nie należy jej również stosować przy pH powyżej
8. Akryflawinę usuwamy z wody akwariowej poprzez adsorpcję na węglu aktywnym lub
wymianę wody.
Astaksantyna
Zacznijmy od chemii, wzór sumaryczny to: C
40
H
52
O
4
, a masa molowa: 596.84 g/mol. Teraz
prawdziwa rzeź, pełna nazwa chemiczna astaksantyny to : (6S)-6-hydroksy-3-
[(1E,3E,5E,7E,9E,11E,13E,15E,17E)-18-[(4S)-4-hydroksy-2,6,6-trimetylo-3-okso-1-
cycloheksenylo]-3,7,12,16-tetrametylooktadeka-1,3,5,7,9,11,13,15,17-nonaenyl]-2,4,4-
trimetylo-1-cycloheks-2-enon jeśli żyjemy po przeczytaniu tego to mogę przejść dalej.
Astaksantyna to barwnik (pigment), a dokładniej karotenoid należący do dużej klasy
fitochemikalii (zwiąków chemicznych pochodzenia roślinnego) zwanych terpenami
(organiczne związki chemiczne o ogólnym wzorze (C
5
H
8
)
n
, ich główny "szkielet" powstał w
wyniku połączenia pięciowęglowych jednostek izoprenowych, Astaksantyna to tetraterpen ŕ
zawiera 40 atomów węgla). Wśród karotenoidów sklasyfikowano ją do ksantofili do tej grupy
należą też luteina i lykopen. Jak znaczna ilości karotenoidów wykazuje intensywne zabarwienie
- jest mocno czerwona. Za barwę astaksantyny odpowiadają sprzężone wiązania podwójne
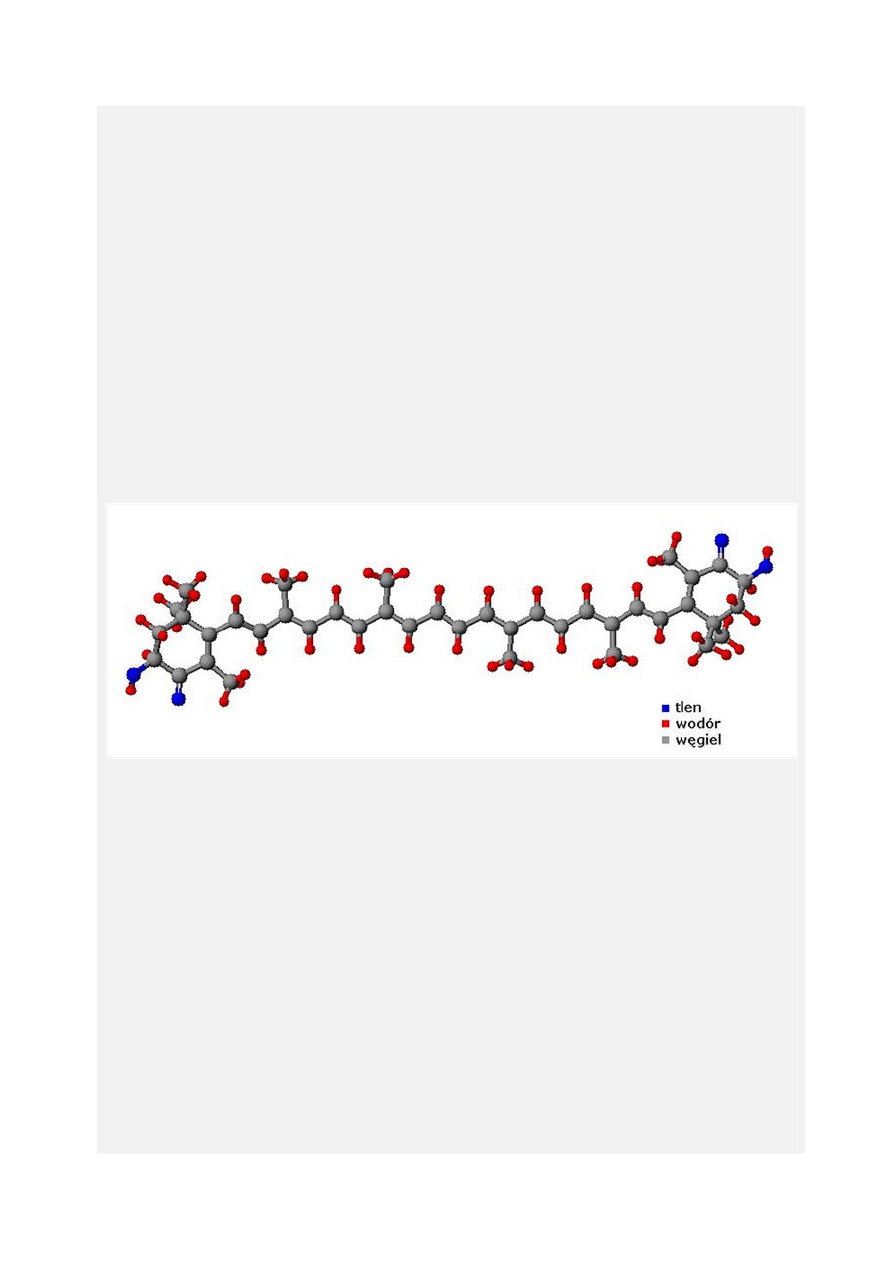
C=C. Wzór strukturalny przedstawia rysunek ponizej:
Astaksantyna jest często porównywana do beta-karotenu (jej skrócona nazwa chemiczna to
3,3'-dihydroksy-4,4'-diketo-beta-karoten), jednak w strukturze i działaniu antyoksydacyjnym
(przeciwutlenającym) znacznie się różni. Działa dziesięć razy silniej niż beta-karoten i ponad
pięćset razy mocniej niż witamina E.
Astaksantyna jest czerwonym barwnikiem nadającym barwę: algom, łososiom, pstrągom,
krewetkom, krylowi oraz flamingom (stąd ich charakterystyczna różowo - czerwona barwa).
Przybliżona zawartość astaksantyny w wybranych naturalnych źródłach (zawartość w ppm):
Łosoś 5, Plankton 60, Kryl 120, Krewetki 1200, Drożdże Phaffia rhodozyma 8000, Algi
Haematococcus pluvialis 40 000.
W związku z tym, że nadaje ona barwę zwierzętom, służy akwarystom jako naturalny środek
wybarwiający i jest dodatkiem do pokarmów wzmacniających ubarwienie ryb akwariowych.
Na koniec kilka ciekawostek o Astaksantynie:
•
Najbogatszym naturalnym źródłem Astaksantyny są algi Haematococcus pluvialis. Algi
te naturalnie akumulują spore ilości tego barwnika (3-4 a nawet więcej procent
masowych ich wagi po wysuszeniu).
•
Tylko organizmy tak proste jak algi i drożdże mogą wytwarzać astaksantynę; nie mają
tej zdolności organizmy wyższe. Dostarczają astaksantynę do organizmu wraz z
pokarmem
•
Zwalcza szkodliwe wolne rodniki. Opóźnia przemiany oksydacyjne białek co jest
charakterystyczne dla zespołu zmian starczych
•
Astaksantyna w przeciwieństwie do wielu karotenoidów, nie przekształca się w
organizmach żywych w witaminę A (Retinol).
Błękit metylenowy
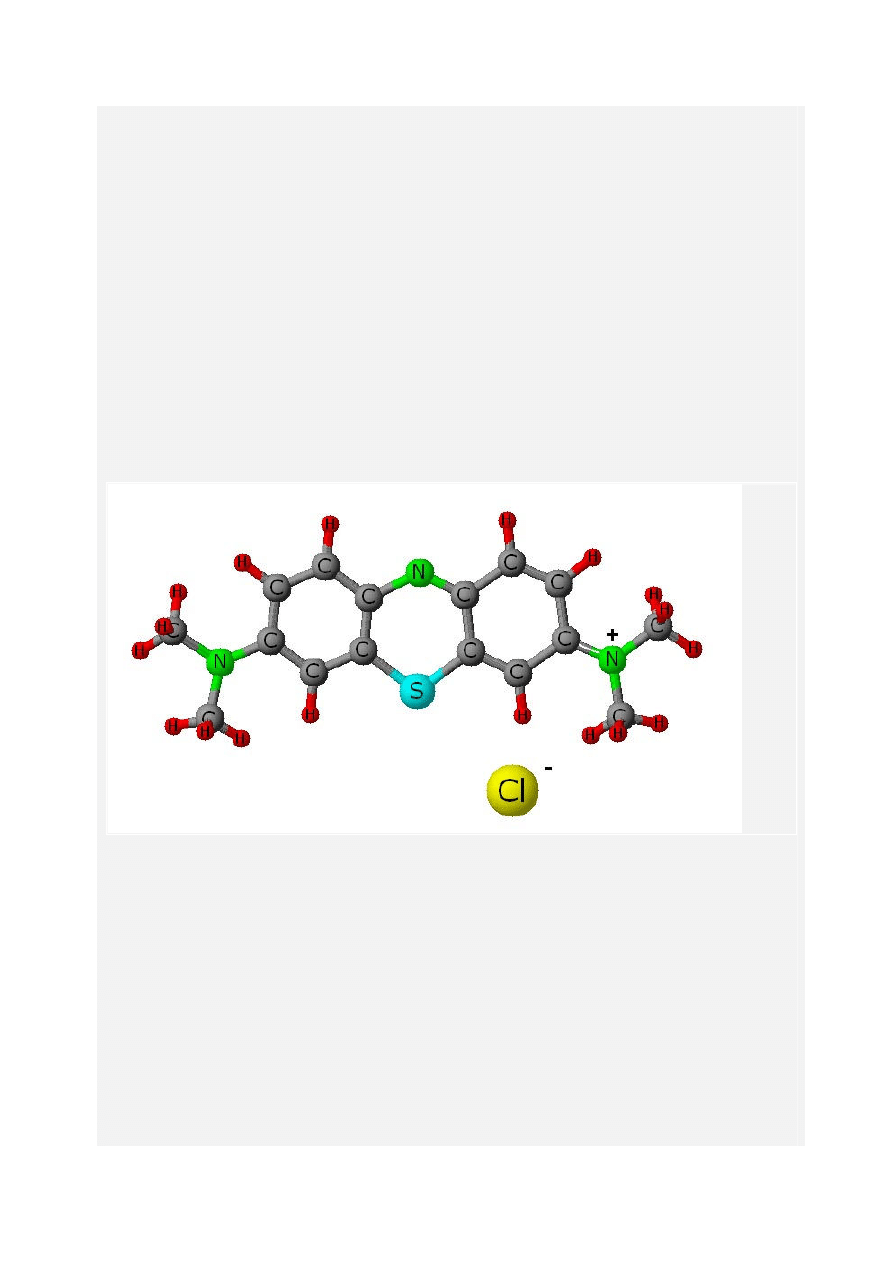
Błękit metylenowy to barwnik tiazynowy, o nazwie chlorek 3,7-bis(dimetyloamino)feno-5-
tioazynowy. Wzór sumaryczny C
16
H
18
ClN
3
S, masa molowa 319,86 g/mol. Kolejny preparat,
będący związkiem organicznym, który wykazuje działanie antyseptyczne. Kształt cząsteczki
(na rysunku poniżej) wskazuje, ze błękit metylenowy ma właściwości polarne (asymetryczna
budowa i częściowo przemieszczony ładunek elektryczny), a przez to dobrze rozpuszcza się w
wodzie, ulegając rozpadowi na dodatni jon organiczny i ujemny jon chlorkowy Cl
-
.
W postaci krystalicznej ma barwę ciemnoniebieską, roztwory wodne również mają niebieskie
zabarwienie.
Używa się go jako zabarwiacza komórek w bakteriologii, w chemii jako wskaźnika reakcji
utlenianie-redukcja, znalazł też zastosowanie w Toksykologii - działą odtruwająco w razie
zatrucia cyjankami (jonami CN
-
) i tlenkiem węgla (czadem, CO). Działą redukuąc grupę
hemową z methemoglobiny do hemoglobiny. Blokuje również akumulację cyklicznego
guanozynomonofosforanu (cGMP) poprzez inhibicję enzymu - cyklazy guanylowej.
Rezultatem jest redukcja odpowiedzi dla związków methemoglobinotwórczych jakimi są np.
cyjanek pokasu czy tlenek węgla.
W weterynarii używa się go jak antyseptyka - zabija grzyby i pierwotniaki. Działanie
antyseptyczne jest ściśle związane z negatywnym wpływem błękitu na procesy oddychania
wewnątrzkomórkowego patogenów. Błękit metylenowy zabarwia komórkę i uszkadza jej
metabolizm. Błękit metylenowy potrafi również utlenić enzym lub jakąś inną cząsteczkę
patogenu będąć w tej sytuacji akceptorem wodoru. Utleniając sam się redukuje, powstaje w ten
sposób biel metylenowa. Enzym po utlenieniu albo traci aktywność albo zmienia właściwości i
katalizuje inną reakcję przez co komórka patogenu ginie.
Błękitu nie mieszamy ze środkami wydzielającymi aktywny chlor lub tlen. Preparat usuwamy
przez adsorpcję na węglu do którego ma duże powinowactwo. Jest tak ponieważ posiada
boczne łańcuchy węglowodorowe (grupy metylowe -CH3)
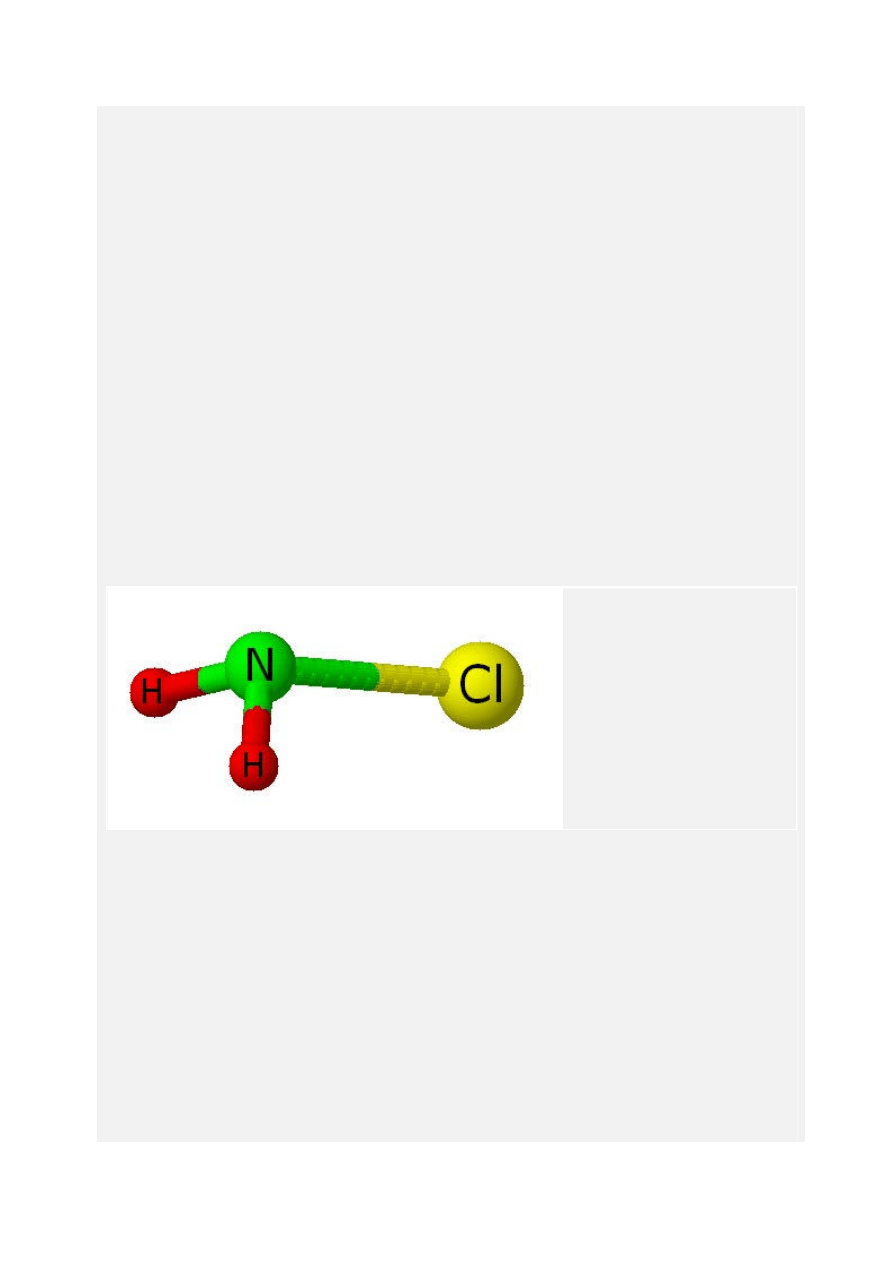
Chloramina
Związek nieorganiczny o wzorze NH
2
Cl, będący znanym środkiem odkażającym, używanym w
roztworach wodnych. Działą lepiej od samego chloru, ponieważ jest trwalsza w roztworach,
ponadto Chloramina ma mniejszą tendencję do tworzenia ze ze związkami organicznymi
szkodliwych halogenometanów ( chloroformu CHCl
3
i czterochlorku węgla CCl
4
) .
Komponenty te zostały uznane za rakotwórcze w 1979 przez Amerykańską Agencję Ochrony
Ś
rodowiska (US EPA, Environmental Protection Agency), teraz jest regulowana ich zawartość
w wodzie i ograniczenie stosowania czystego chloru do chlorowania wody. Poza tym, woda
traktowana chloraminą wydziela mniej zapachu chloru niż ta po użyciu gazowego chloru, ma
też lepszy smak.
Masa molowa chloraminy to 51.48 g/mol, a wzór strukturalny prezentuje się następująco:
Ponadto nazwa Chloramina stosowana jest jako potoczne, jako ogólne określenie związków
organicznych, w których chlor jest związany jest bezpośrednio z azotem z grupy aminowej lub
amidowej, przykładowe chloraminy to:
•
Chloramina B - sól sodowa N-monochlorobenzenosulfamidu,
•
Chloramina DH - N,N-dichloro-2,4,6,2',4',6'-heksachlorodifenylomocznik,
•
Chloramina T - sól sodowa N-monochlorotoluenosulfamidu.
Chloramina B to biały lub żółtawy proszek krystaliczny o zapachu chloru. Działa odkażająco,
antyseptycznie, odwadniająco (niweluje inne zapachy).
Chloramina T-Biała substancja krystaliczna, rozpuszczalna w wodzie, to ona jest stosowana w
preparatach akwariowych.

Działanie chloraminy polega na uwalnianiu aktywnego chloru. Chlor łączy się z grupami
aminowymi aminokwasów i białek, wywołuje destabilizację tych białek.
Usuwanie chloraminy zachodzi w zasadzie z czasem samoistnie.
Cl
2
+ H
2
O --> HOCl + HCl
Kwas chlorowy (I) reaguje z grupą aminową chloraminy, w następstwie czego Amoniak ulatnia
się z wody, usuwanie chloraminy wspomaga wystawienie wody na bezpośrednie działanie
promieni słonecznych. W akwarium działanie chloraminy najłatwiej zniwelować za pomocą
tiosiarczanu sodu reagującego z wydzielającym się chlorem:
S
2
O
3
2-
+ 4Cl
2
+ 5H
2
O --> 2SO
4
2-
+ 8Cl
-
+ 10H
+
Chloraminy:
•
nie należy stosować w wodzie o odczynie silnie kwaśnym - stabilność kwasu
chlorowego (I) HOCl
•
nie należy stosować równocześnie z innymi środkami dezynfekcyjnymi
•
przerwanie działania następuje przez dodanie równej objętościowo ilości antychloru
(jak się dowiemy później mowa o tiosiarczanie sodu i reakcji o której pisałem parę
linijek wcześniej)
•
utrudnia pomiar zawartości amoniaku, azotynów i azotanów
Formaldehyd
Związek organiczny zwany również formaliną lub aldehydem mrówkowym. Najprostszy
aldehyd, zawierający jeden atom węgla w cząsteczce. Nazwa systematyczna: metanal, wzór
sumaryczny HCHO, masa molowa 30,03 g/mol.
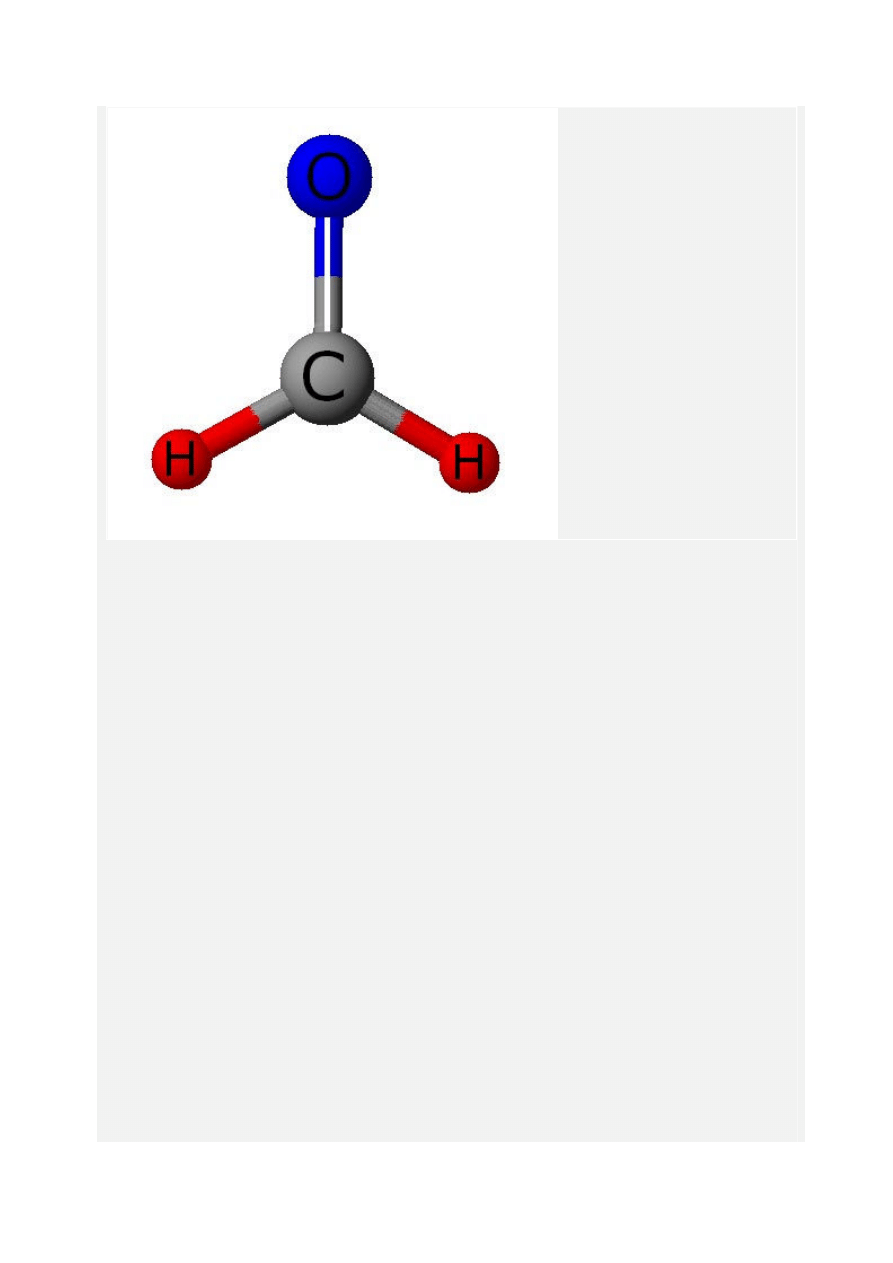
W warunkach normalnych jest to gaz o duszącym zapachu. Silna trucizna! Gaz ten dobrze
rozpuszcza się w wodzie - do około 40% wagowych. Powstały roztwór ma lekko kwaśne pH.
Zazwyczaj mamy doczynienia z 35-40% roztwórem formaldehydu w wodzie - zwanym
potocznie formaliną. Formalina jest bazbarwnym płynem o ostrym, podobnie jak gazowy
formaldehyd drażniącym, duszącym zapachu i smaku. Formalina działa silnie antyseptycznie i
ś
ciągająco. Działąnie polega na denaturacji białek zarówno enzymatycznych jak i
strukturalnych, w zależności od dawki zabija wszystkie organizmy. Roztwory 5% służą do
konserwacji tkanek (w botanice mniej stężone roztwory - około 3%).
Jest to składnik preparatu o nazwie FMC, sam formaldehyd raczej wyszedł z użytku w
akwarystyce (używany np. w leczeniu Tetrachonozy).
Teraz pora na kilka rad praktycznych odnośnie stosowania formaliny. Należy unikać długiego
przechowywania, w szczegółnosci temperatury poniżej 15 stopni Celsjusza (stara lub źle
przechowywana Formalina wytrąca paraformaldehyd - białą kłaczkowatą substancję (polimer
formaldehydu)). Formaldehyd w formie niestabilizowanej polimeryzuje naprawdę bardzo
łatwo. Do stabilizowania formaliny używa się np. etanolu. Formaliny zawierającej osad
polimeru nie należy używać w akwarium gdyż paraformaldehyd jest silnie toksyczny!
Nie należy jej mieszać ze środkami utleniającymi, kwasem nadchlorowym oraz z tlenkiem
azotu - gwałtowne reakcje. W reakcji formaldehydu ze stężonym kwasem siarkowym powstaje
tlenek węgla. Niebezpieczne są jej produkty rozkładu - Formalina głównie pod wpływem
temperatury ulega rozkładowi na tlenek węgla i metanol.
Podczas działania w akwarium "zużywa" duże ilości tlenu dlatego należy pamiętać o bardzo
silnym napowietrzaniu!
Działanie na organizmy żywe:

•
dla rybek w akwariach stężenia 200, 100 i 50 mg/dm
3
okazały się po 10 godzinach
ś
miertelne
•
roztwór z ilością 10 mg/dm
3
formaldehydu, w tym samym czasie, nie był śmiertelny.
F M C
Jest to preparat akwarystyczny zawierający w swoim skłądzie trzy związki chemiczne: błękit
metlenowy (zazwyczaj chlorowodorek), zieleń malachitową (najczęściej chlorowodorek lub
szczawian) i formaldehyd. Wykazuje szerokie działanie przeciw bakteriom, pleśniom,
pierwotniakom. Stosunek wagowy składników w preparatach rynkowych wynosi
błekitmetylenowy : zieleń malachitowa : formaldehyd 1:1:20 , a żeby było jaśniej to gotowe
ilości według Przepisu kamyllo2 na FMC:
•
100 ml formaliny,
•
370 mg błękitu metylowego,
•
370 mg zieleni malachitowej (szczawian).
Dlaczego mieszamy zieleń i błekit z formaldehydem? Otóż usuwa on lub przynajmniej
zmniejsza warstwę ochronnego śluzu u ryb i pozwala mocniej zadziałać dwóm pozostałym
składnikom, będąc samemu również silnym antyseptykiem.
Preparat najłatwiej usunąć poprzez adsorpcję na węglu aktywnym i podmianę wody.
Trichlorfon
Trichlorfon - zwany też metrifonatem, chemicznie to ester dimetylowy kwasu 1- hydroksy-
2,2,2-trichloroetylo fosforowego (III) (fosforawego) , masa molowa wynosi 257.436 g/mol,
związek fosfoorganiczny o wzorze sumarycznym C4H8Cl3O4P i strukturalnym jak na rysunku
poniżej.
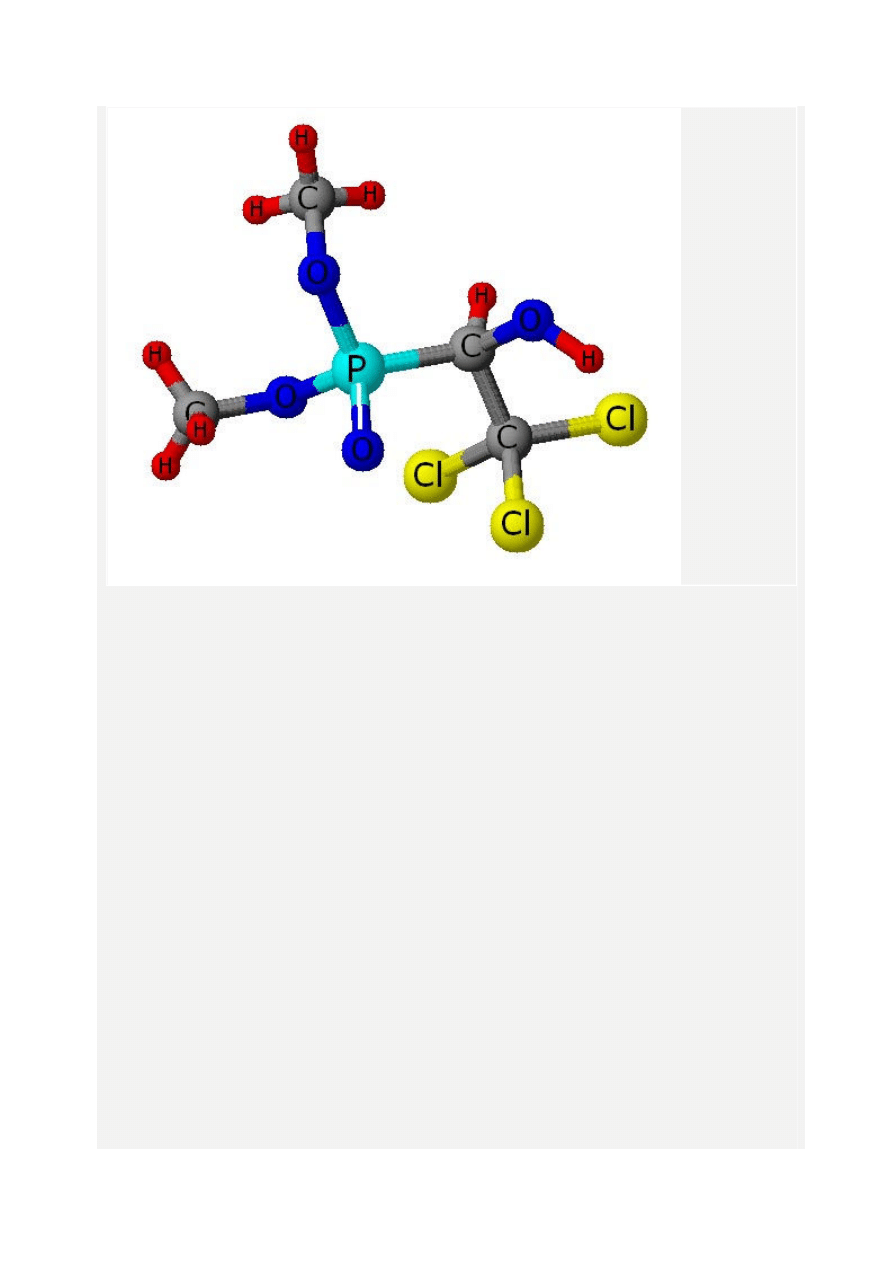
Trichlorfon to lek neuropatyczny, działa na pasożyty wielokomórkowe, takie jak m. in.
przywry skórne i skrzelowe (Gyrodactylus i Dactylogyrus), nicienie, tasiemce, powodując
porażenie i zniszczenie ich systemu nerwowego, a dokładnie jest inhibitorem
acetylocholinesterazy – enzymu rozkładającego acetylocholinę na cholinę i reszty kwasu
octowego. W organizmach żywych acetylocholina jest neuromediatorem (związkiem
chemicznym którego cząsteczki przenoszą sygnały pomiędzy neuronami (komórkami
nerwowymi) )syntetyzowanym w neuronach cholinergicznych. Prekursorem acetylocholiny jest
cholina, która przenika z przestrzeni międzykomórkowej do wnętrza neuronów. Trichlorfon
jest w tym wypadku tzw. inhibitorem kompetycyjnym - chodzi o to, że konkuruje z choliną
ponieważ może się zamiast niej przyłączać do centrum aktywnego enzymu
acetylocholinesterazy i w ten sposób ją dezaktywować (inhibicja). Jest tak bo oba związki mają
podobną budowę i rozmiary a przez to podobne powinowactwo do centrum aktywnego.
Preparat w stężeniach bezpiecznych dla ryb nie działa na jaja pasożytów dlatego leczenie
trzeba powtarzać po kilku dniach. Trichlorfon wchodzi w skład preparatów takich jak np.
Metrifonat, Masoten, Capifos, Neguvon. Lek jest szczególnie słabo tolerowany przez zbrojniki
i niektóre inne ryby przydenne. Preparat można łączyć z niewielkimi stężeniami preparatów
takich jak np. błękit metylenowy, nie łączył bym go z preparatami wydzielającymi aktywny
chlor lub tlen, oraz nie stosował w wodzie o wysokim pH 8 i więcej. Trichlorfon najlepiej
usunąć poprzez filtrację na węglu i podmiany wody
Kwas fosforowy i jego sole
Kwas fosforowy to związek nieorganiczny o wzorze sumarycznym H
3
PO
4
. Kwas ten jest
białym, krystalicznym ciałem stałym, bardzo dobrze rozpuszcza się w wodzie. Jest kwasem o
ś
redniej mocy, nie dysocjuje całkowicie w roztworach wodnych.
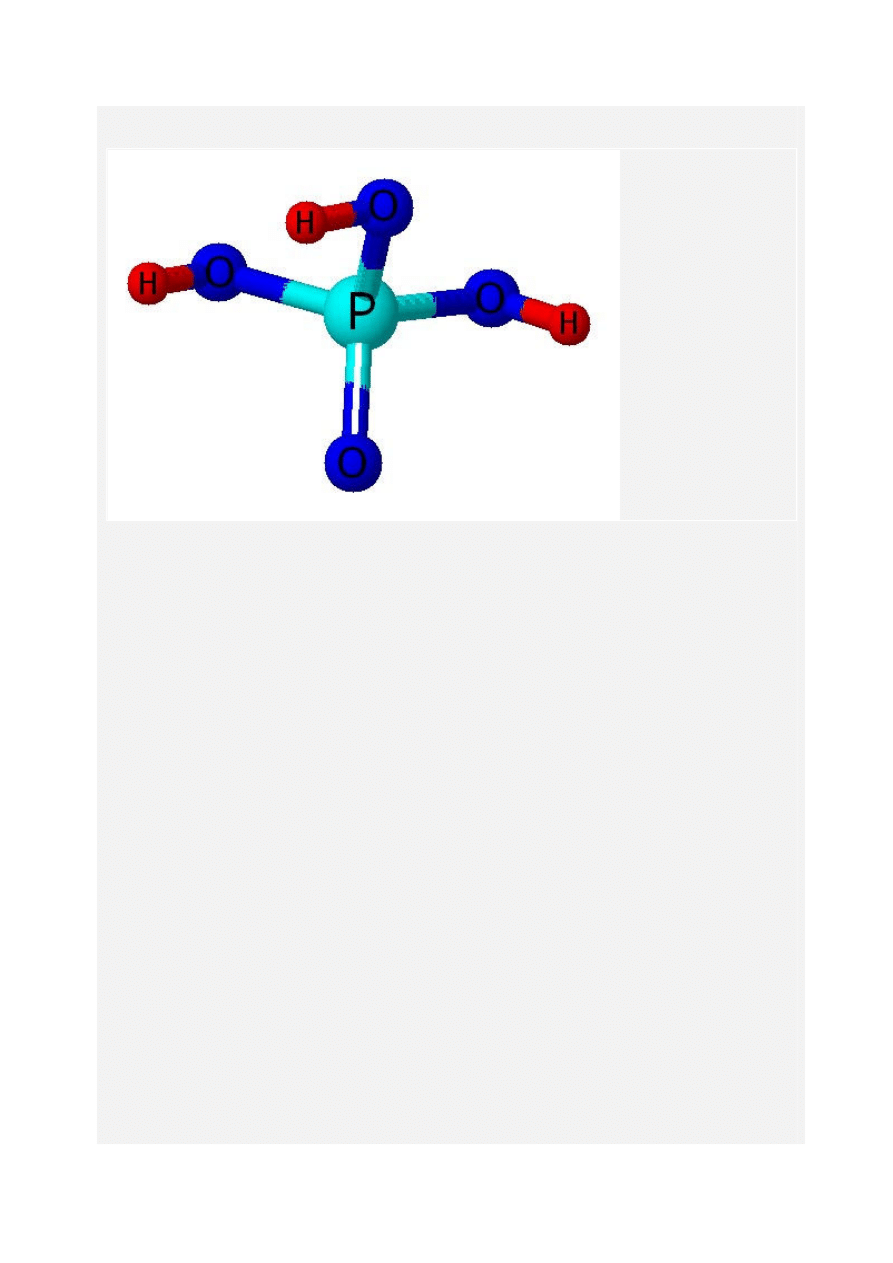
Dzięki częściowej dysocjacji wraz ze swoimi solami tworzy roztwory buforowe. Odnośnie soli-
kwas fosforowy (V) jest kwasem trójprotonowym - tworzy więc trzy rodzaje soli,
odpowiadające trzem kolejnym stopniom dysocjacji kwasu, stałe dysocjacji wynoszą kolejno
pKa1=2,1 pKa2=7,2 pKa3=12,7. Układ buforowy oparty jest na trzech równowagach, każda
odpowiada innym przedziałom pH. Zachodzą następujące reakcje:
H
3
PO
4
+ H
2
O <-> H3O
+
+ H
2
PO4
-
; pKa1=2,1
H
2
PO4
-
+ H
2
O <-> H
3
O
+
+ HPO
4
2-
; pKa2=7,2
HPO
4
2-
+ H
2
O <-> H
3
O
+
+ PO
4
3-
; pKa3=12,7
Akwarystów najbardziej interesuje równowaga drugiej dysocjacji. Roztwór buforowy oparty na
tej równowadze stabilizuje odczyn pH w zakresie 5,5 - 8. Uzyskuje się go wprowadzając jony
H
2
PO
4
-
i jony HPO
4
2-
najczęściej w postaci soli sodowej. Czysty roztwór NaH
2
PO
4
ma pH w
granicach 4 a Na
2
HPO
4
około 9. Sole te są bezpieczne gdyż ciężko dojść do granic pH 4 i 9
oraz potrzeba stosunkowo dużo tych soli aby zmienić pH więc można dość dokładnie
regulować. Można też wprowadzić kwas fosforowy, który zdysocjuje na powyższe sole, za
jego pomocą najlepiej uzyskuje się pH w granicach 6,5 i mniej. Z tego co mi wiadomo wiele
ś
rodków pH plus i pH minus jest opartych na solach fosforanowych np. AQUACID Tropicala,
pH minus Sera itp..
Z kwasem fosforowym i jego solami wiąże się duży minus tej metody - wprowadzenie
fosforanów w ilościach dochodzących do kilkudziesięciu miligramów na litr!!! --> sporo
nawozu dla glonów. Nadmiar fosforanów w naturalnych zbiornikach jest jednym z czynników
prowadzących do eutrofizacji - kwitnięcia wód. Niechciane fosforany dostają się do akwarium
również z pokarmem, wiele granulatów zawiera stosunkowo znaczne ilości fosforu - np. Hikari
Cichlid Gold 1,7% masowego.
Fosforany najłatwiej usuwa się z wody za pomocą adsorpcji na specjalnym granulacie
(najczęściej z komponentami żelazowymi).
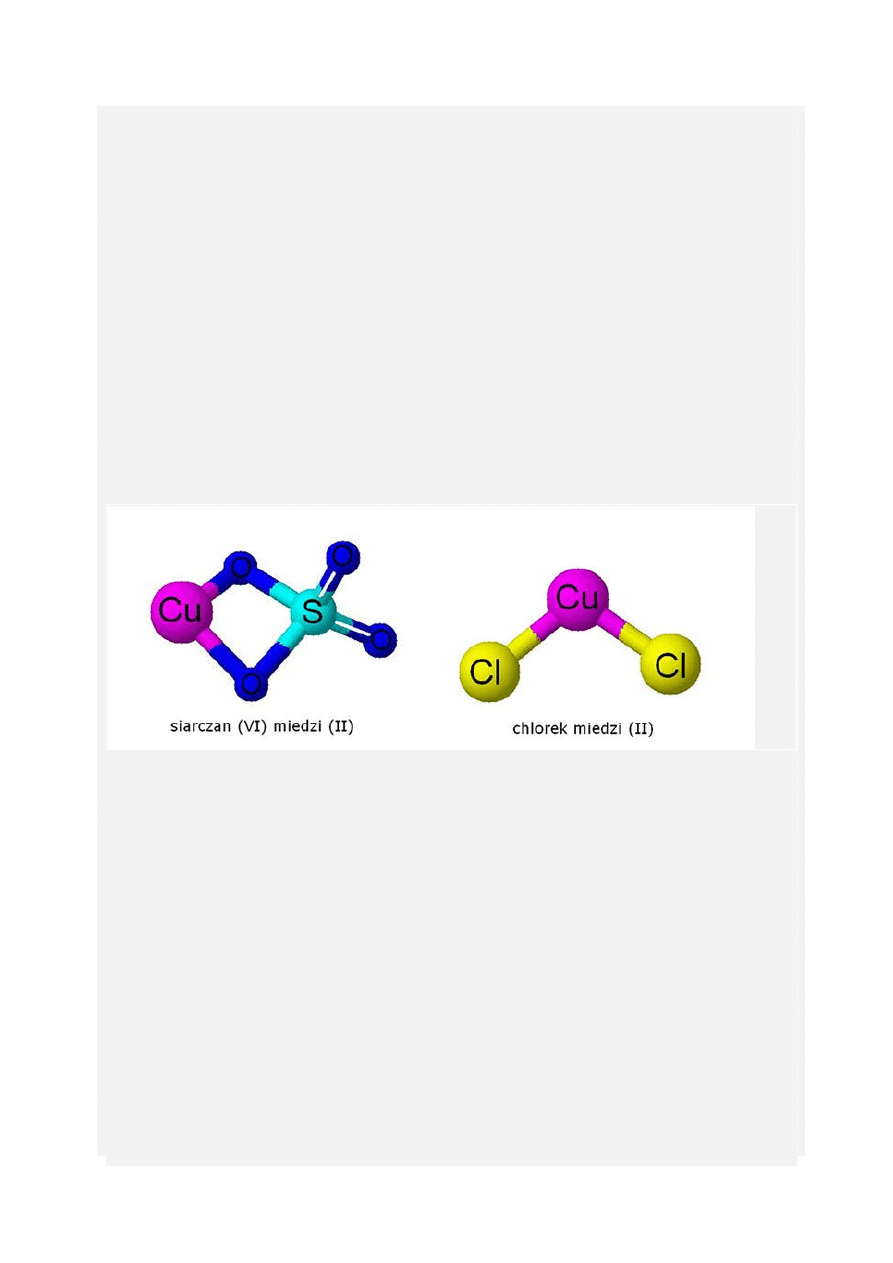
Kationy miedzi Cu(2+) (siarczan (VI) i chlorek miedzi (II))
Jony miedzi(II) są wprowadzane do akwarium najczęściej jako sole: siarczan (VI) lub chlorek.
Chlorek miedzi(II) (CuCl2) - nieorganiczny związek chemiczny, sól kwasu solnego i miedzi na
2 stopniu utlenienia. Sól bezwodna ma barwę brązową, dwuwodna barwę zieloną.
Rozcieńczone wodne roztwory chlorku miedzi(II) wykazują zabarwienie niebieskie. Roztwory
stężone oraz zakwaszone kwasem solnym mają barwę zieloną - powstają żółto zabarwione jony
[CuCl4]
2-
dające z niebieskimi jonami Cu
2+
kolor zielony.
Siarczan (VI) miedzi(II) (CuSO
4
) - sól kwasu siarkowego (VI) i miedzi na II stopniu utlenienia.
Bezwodny siarczan miedzi jest bezbarwny, natomiast pięciowodny jest barwy niebieskiej (jest
to wynik powstawania jonu [Cu(H
2
O)
6
]
2+
). Wodne roztwory mają barwę niebieską.
Rozcieńczone roztwory soli miedzi są używane w akwarium przeciwko różnym pasożytom
ryb: bakteriom, pierwotniakom, grzybom, glonom. Miedź tosowana jest również do usuwania
ś
limaków. Nie można zapomnieć również, że kationy miedzi są bardzo toksyczne dla ryb, także
przed użyciem musimy upewnić się, że podajemy odpowiednią dawkę. Skuteczne w leczeniu a
zarazem bezpieczne stężenia to od 0,15-0,20 ppm. Stężenia te tyczą się kationów miedzi - przy
różnych solach trzeba je odpowiednio przeliczyć. Bardzo wrażliwe na miedź są zbrojnikowate.
Większość glonów można kontrolować bardzo niewielkimi dawkami jonów miedzi. Na rynku
pojawiły się urządzenia uwalniające niewielkie ilości dwudodatnich kationów miedzi na
zasadzie elektrolizy. Urządzenie prowadzące taką elektrolizę składa się z:
•
anody wykonanej ze stopu miedzi
•
katody ze stali nierdzewnej.
Przy przyłożeniu odpowiedniego potencjału (napięcia), które można regulować, zachodzi
proces elektrolizy uwalniający z blaszki miedziowej wolne jony miedzi zgodnie z równaniem:
Cu --> Cu
2+
+ 2 e
-

Gdzie e
-
oznacza elektron.
W określonym stężeniu jony tworzą naturalną barierę dla rozwoju glonów. Anoda w wyniku
elektrolizy ulega na chłopski rozum mówiąc 'rozpuszczeniu' - po pewnym czasie miedź z
blaszki zużywa się i elektrodę trzeba wymienić na nową.
Mechanizm działania miedzi polega na tym, że elektrycznie naładowane jony Cu
2+
'poszukują'
w wodzie 'cząstek' o przeciwnym znaku (naładowanych ujemnie) takich jak bakterie, wirusy
czy grzyby. Dodatnio naładowane jony miedzi z ujemnie naładowanymi ścianami (czy błonami
komórkowymi) mikroorganizmów tworzą elektrostatycznie związane komponenty.
Komponenty te zakłócają przepuszczalność ściany (lub błony) komórkowej i powodują
problemy z przenoszeniem substancji odżywczych. Jon miedzi może również spenetrować
ś
cianę (błonę) i dostać się do wnętrza komórki. Wtedy sam (lub jeśli to możliwe z pomocą
jonów Ag
+
), wiąże się do różnych organelli komórkowych , w tym materiału genetycznego
(DNA i RNA), białek błonowych, enzymów odpowiedzialnych za oddychanie komórkowe w
mitochondriach. Wszystkie systemy życiowe w komórce są unieruchomione, powoduje to brak
wzrostu komórki oraz możliwości namnażania się. Mówiąc krótko miedz jest inhibitorem
rozwoju pasożytów. Właściwości bakterio, grzybobójcze itp. miedzi rosną wraz temperaturą.
Jak usunąć kationy miedzi z wody? Spotkałem się z błędnym mniemaniem jakoby miedź dała
się usuwać węglem aktywnym i tu krótko - nie jest to możliwe. Sposobami na usunięcie
kationów Cu
2+
(poza podmianą wody oczywiście) są:
•
użycie EDTA (skrót od EthyleneDiamineTetraAcetate (kwas
etylenodiaminotetraoctowy)) który tworzy z miedzią chelaty - pokrótce jeszcze co to są
chelaty: EDTA zawiera więcej niż jedną, wolną parę elektronową, może więc związać
się z jonem centralnym (w tym wypadku kationem miedzi) więcej niż jednym
wiązaniem koordynacyjnym i takie ligandy nazywane są 'kleszczowymi' bądź
chelatowymi. Powstałe związki zwane są chelatami. Logarytm stałej trwałości
kompleksu miedzi z EDTA logB1 = 18,9. W tworzeniu dwóch wiązań koordynacyjnych
(kompleks dwukleszczowy) biorą udział dwie wolne pary elektronowe - po jednej przy
obu atomach azotu. Należy pamiętać jednak o ważnej rzeczy, że zwrot usunięcie miedzi
jest w tym wypadku niezbyt fortunny, bardziej pasowałoby tu zamaskowanie. Ponieważ
miedź dalej znajduje się w wodzie tylko już nie w postaci wolnych jonów, trwałość
kompleksów miedzi zależy od wielu warunków (min pH, ilości jonów żelaza, wapnia i
magnezu - ponieważ żelazo, magnez i wapń również tworzą kompleksy z EDTA i mogą
wypierać z nich miedź), gdy taki kompleks ulega 'rozpadowi' wolne jony miedzi znów
dostają się do roztworu. Reasumując, metoda dobra jeśli musimy szybko zniwelować
miedź a nie możemy od razu podmienić (ale zamierzamy to zrobić za jakiś czas).
•
tu chyba prostszy sposób, jony miedzi (podobnie do wapnia i magnezu czyli twardości
ogólnej wody) można usuwać poprzez wymianę jonową za pomocą kationitu. W
kationicie sodowym jony miedzi zostają wymienione na kationy sodu zgodnie z
równaniami reakcji : 2KtNa + Cu
2+
<-> Kt
2
Cu + 2Na
+
. W kationicie wodorowym
kationy miedzi zostają zastąpione kationami wodorowymi, równania reakcji są
następujące: 2KtH + Cu
2+
<-> Kt
2
Cu + 2H
+
Wada tej metody jest taka, że kationit po
użyciu jest w zasadzie do wyrzucenia gdyż miedź ma do niego bardzo duże
powinowactwo, regeneracja niewiele pomaga, pojemność wymiany jonowej przez
ż
ywicę znacznie spada.
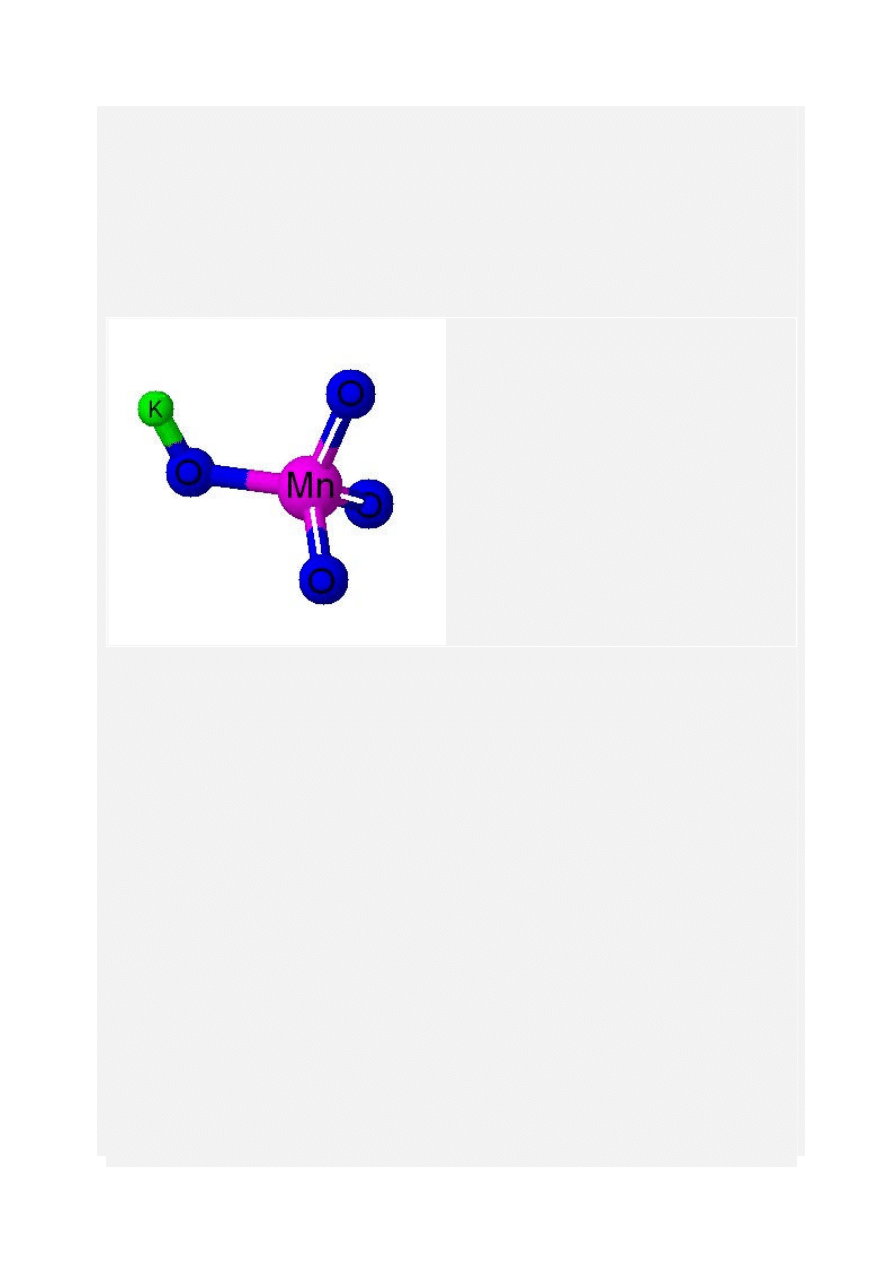
Nadmanganian potasu
Związek nieorganiczny o wzorze sumarycznym KMnO4, masie molowej 158,04 g/mol.
Nadmanganian potasu ma postać ciemnofioletowych kryształków o metalicznym połysku. Jest
bardzo dobrze rozpuszczalny w wodzie. Jego roztwory wodne w zależności od stężenia są
barwy od bladoróżowej do bardzo ciemnofioletowej. Można go uznać za bezwonny,
aczkolwiek nos chemika wyczuje w nim zapach 'świeżości i rześkości'.
KMnO4 jest bardzo silnym utleniaczem i należy do grupy środków antyseptycznych
utleniających. Pod wpływem związków organicznych, materii organicznej ulega redukcji,
wydzielając przy tym aktywny tlen niszczący bakterie, pierwotniaki, grzyby. Znaczenie
antyseptyczne mają również powstałe w wyniku redukcji w środowisku kwaśnym wolne jony
manganu Mn
2+
. Równanie reakcji redukcji jonu MnO
4
-
pochodzącego z dysocjacji
nadmanganianu potasu (niezbędne e- pochodzą ze związków organicznych):
•
w środowisku zasadowym i obojętnym: MnO
4
-
+ 2H
2
O + 3e
-
--> MnO
2
+ 4OH
-
•
w środowisku kwaśnym: MnO
4
-
+ 8H
+
+ 5e
-
--> Mn
2+
+ 4H
2
O
Nadmanganian jest związkiem toksycznym dla ryb, jak podaje karta charakterystyki w
stężeniach powyżej 3,2 mg/l.
Usuwanie - najłatwiej będzie podmienić wodę. Nadmanganian adsorbuje się na węglu
aktywnym (aczkolwiek uważa się również, że częściowo zachodzi tam reakcja redukcji
barwnego nadmanganianu do bezbarwnego jonu Mn
2+
). Kation Mn
2+
można usunąć poprzez
wymianę jonową za pomocą kationitu. W kationicie sodowym jony manganu (II) zostają
wymienione na kationy sodu zgodnie z równaniami reakcji :
2KtNa + Mn
2+
<-> Kt
2
Mn + 2Na
+
W kationicie wodorowym kationy miedzi zostają zastąpione kationami wodorowymi, równania
reakcji są następujące:
2KtH + Mn
2+
<-> Kt
2
Mn + 2H
+
Kolejnym sposobem pozbycia się nadmanganianu jest reakcja z wodą utlenioną. Nadtlenek
wodoru w stosunku do silnych utleniaczy takich jak KMnO4 może działać jako reduktor.
Produktem reakcji jest tlen. Zachodzą reakcje :
•
w środowisku zasadowym i obojętnym: 2 MnO4
-
+ 3H
2
O
2
--> 2MnO
2
+ 2OH
-
+ 2H
2
O
+ 3O
2
•
w środowisku kwaśnym: 2 MnO
4
-
+ 16H
+
+ 5H
2
O
2
--> 2Mn
2+
+ 9H
2
O + 5/2 O
2
Ciekawą alternatywą (podaje to jako ciekawostkę bo chyba byłoby to 'egzotyczne' w
akwarium) może być usuwanie nadmiaru jonów Mn
2+
w wodzie za pomocą bakterii
manganowych. Bakterie te jako źródło energii wykorzystują reakcje utleniania Mn
2+
do MnO2.
Mangan na stopniu utlenienia (IV) w postaci MnO
2
, jako produkt reakcji biochemicznego
utleniania gromadzony jest w komórkach bakteryjnych. Pozostaje w złożu filtracyjnym
(uwalniany jest dopiero w trakcie obumierania bakterii) i inicjuje kolejne procesy
katalitycznego usuwania manganu z wody.
Rivanol
Rivanol to związek organiczny, o nazwie 6,9-diamino-2-etoksyakrydyna, najczęściej spotykany
jako sól: mleczan etakrydyny. Wzór sumaryczny to C
18
H
21
N
3
O
4
, masa molowa 343,38 g/mol.
Jak już wspominałem przy Akryflawinie - akrydyna i jej homologi mają własności

na przyłączeniu etakrydyny do cząsteczek kwasów nukleinowych (DNA, RNA), wynikiem
czego są letalne mutacje.
Działanie Rivanolu bywa ograniczone przez to, że po upływie pewnego okresu czasu (7-14 dni)
patogeny 'uodparniają się' na niego. Nie sprawdza się więc w długotrwałym leczeniu, dobry jest
natomiast na krótka metę. Dodatkową uwagą jest to, iż skuteczność Rivanolu jest większa w
ś
rodowisku zasadowym.
Usuwamy go z wody filtrując ją przez węgiel aktywny lub podmieniając. Podczas stosowania
Rivanolu nie należy używać preparatów utleniających oraz wydzielających chlor. Zdarzało mi
się mieszać go z innymi homologami akrydyny jak proflawina i Akryflawina i nie zauważyłem
negatywnych skutków.
Sól kuchenna
Sól kuchenna czyli chlorek sodu, o wzorze NaCl i masie molowej 58,44 g/mol, to związek
nieorganiczny, sól kwau solnego i wodorotlenku sodu. Jest to biała substancją krystaliczna,
dobrze rozpuszczalną w wodzie.
Sól kuchenna już dawno temu znalazła zastosowanie jako antyseptyk. Jej działanie
przeciwpasożytnicze, przeciwgrzybicze, jest oparte na właściwościach hiperosmotycznych soli.
Mówiąc prosto i zwięźle sól 'wyciąga' wodę z komórek. W dużym uproszczeniu: gdy leczymy
solą stężenie kationów sodu i anionów chlorkowych w wodzie jest większe niż wewnątrz
komórki/ek pasożyta. Wymusza to zjawisko osmozy i przenikanie wody z komórek patogenu
do roztworu (np. woda w akwarium) w którym się znajdują, aż do wyrównania stężeń -
komórka traci wodę oddając ją do roztworu i ginie.
Poza częściową podmianą nie spotkałem się z sensowną do użycia w akwarium metodą
usunięcia soli kuchennej z wody.
Tiosiarczan sodu
Związek nieorganiczny o worze sumarycznym Na
2
S
2
O
3
i masie molowej 158,10 g/mol. Ma
postać bezbarwnych kryształów, jest dobrze rozpuszczalny w wodzie Jest to sól nietrwałego
kwasu tiosiarkowego i wodorotlenku sodu. Jest łagodnym reduktorem.
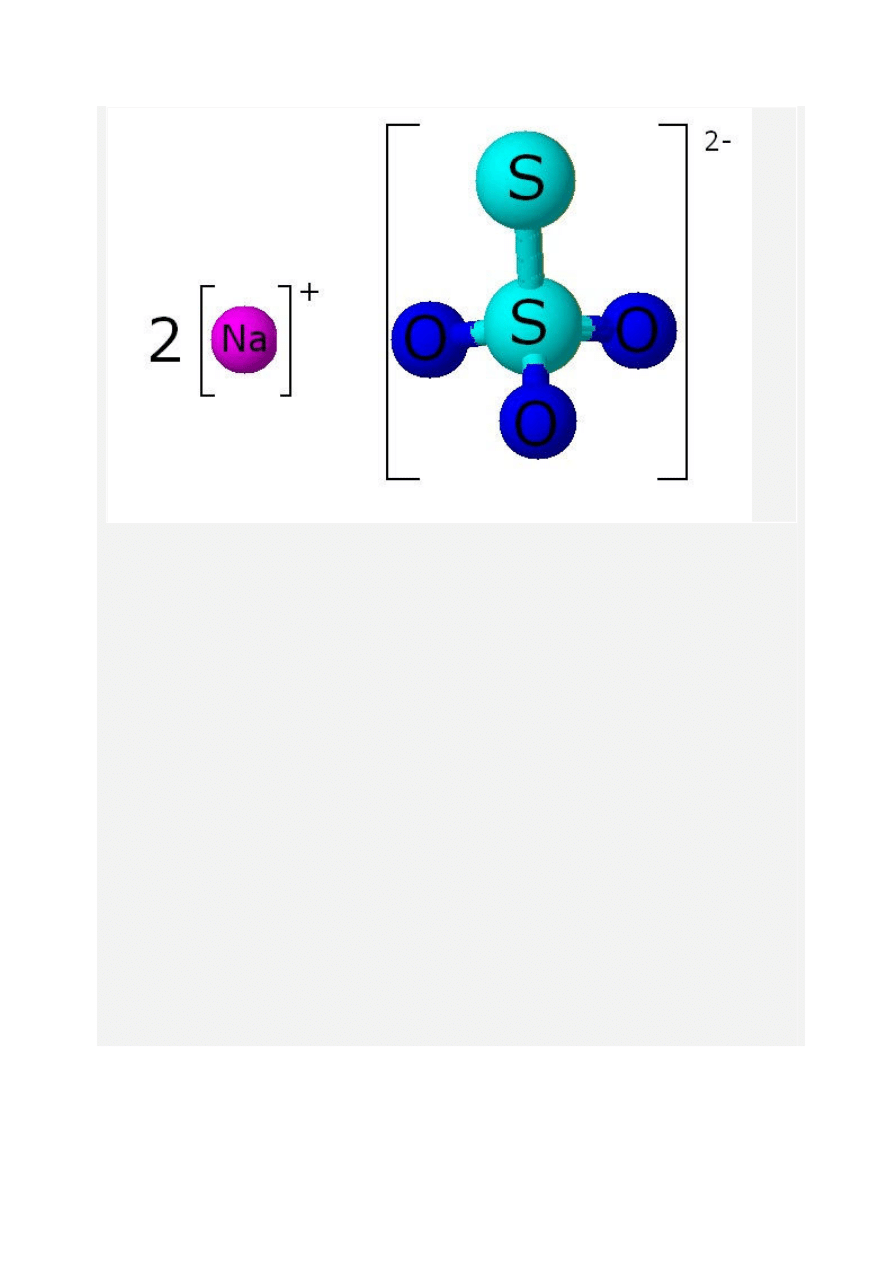
Mówimy o nim gdyż to tiosiarczan sodu kryję się w preparacie pod tajemniczą nazwą
Antychlor. Tiosiarczan sodu redukuje chlor rozpuszczony w wodzie do jonów chlorkowych
zgodnie z równaniem:
S
2
O
3
2-
+ 4Cl
2
+ 5H
2
O --> 2SO
4
2-
+ 8Cl
-
+ 10H
+
Równanie to dobrze pamiętamy z części artykułu poświęconej chloraminie i tu kłania się 2-ga
możliwość użycia go w akwarystyce - usuwanie nadmiaru chloraminy podczas leczenia.
Jeśli chodzi o usuwanie to tiosiarczan z upływem czasu 'sam' się nam utleni do jonów
siarczanowych SO
4
2-
. Jeśli bardzo nam zależy aby ten proces przyspieszyć polecam dodatek
wody utlenionej. Reakcja, która ma wtedy miejsce wygląda następująco:
S
2
O
3
2-
+ 4H
2
O
2
+H
2
0 --> 2SO
4
2-
+ 10H
+
+ 2O
2
Wodorowęglan sodu
Nieorganiczny związek chemiczny, wodorosól kwasu węglowego i wodorotlenku sodu. Ma
postać białej substancji krystalicznej. Najczęściej spotykane nazwy zwyczajowe
wodorowęglanu sodu to soda oczyszczona lub kwaśny węglan sodu. Ta ostatnia nazwa może
być myląca gdyż pochodzi od tego, że wodorowęglan sodu otrzymujemy po zakwaszeniu
roztworu węglanu sodu, nie jest związana z odczynem wodnego roztworu tej soli, który nie jest
kwaśny - wynosi pH=8,31.
Osoby które czytały artykuł 'Chemia wody' pamiętają, ze jon HCO3(-) to amfolit( dla
przypomnienia amfolit (subst. amfiprotyczna) - Elektrolit posiadający właściwości zarówno
kwasowe jak i zasadowe), w związku z tym może ulegać 2 reakcjom dysocjacji.
HCO
3
-
+ H
2
O <-> CO
3
2-
+ H
3
O
+
; Dysocjacja jak dla kwasu
HCO
3
-
+ H
2
O <-> H
2
CO
3
+ OH
-
; Dysocjacja jak dla zasady
Jon HCO
3
-
jest dla nas niezwykle istotny ponieważ wchodzi w skład buforu węglanowego
odpowiedzialnego za pH wody w naszych akwariach. Równowaga tego buforu dla
przypomnienia wygląda tak:
H
2
CO
3
+ H
2
O <-> H
3
O
+
+ HCO
3
-
; stała pKa1=6,37
Z reakcji wynika, że dodatek do kwasu węglowego słabej zasady (wodorowęglanu) będzie
podwyższał pH wody. Podwyższanie pH to jest jedno z zastosowań akwarystycznych
NaHCO3. Drugie zastosowanie jest powiązane z pierwszym, dodając wodorowęglanu sodu nie
tylko zwiększamy pH, ale również twardość węglanową ponieważ jon wodorowęglanowy jest
odpowiedzialny za wysokość KH wody. Preparaty akwarystyczne pH/KH plus zawierają
właśnie stabilizowany jon wodorowęglanowy. Nadmiar wodorowęglanu można szybko
zniwelować odpowiednią dawką kwasu mineralnego - np. solnego.
Zieleń malachitowa
Jest to pochodna triarylometanu, znana jako syntetyczny barwnik zasadowy, dobrze
rozpuszczalny w wodzie i jak sama nazwa wskazuje dający zielone roztwory wodne.
Używany głównie do barwienia tkanin itp. Do czasu kiedy odkryto, że rozcieńczone roztwory,
mogą być używane jako typowy antyseptyk - do walki z pasożytami, infekcjami grzybiczymi i
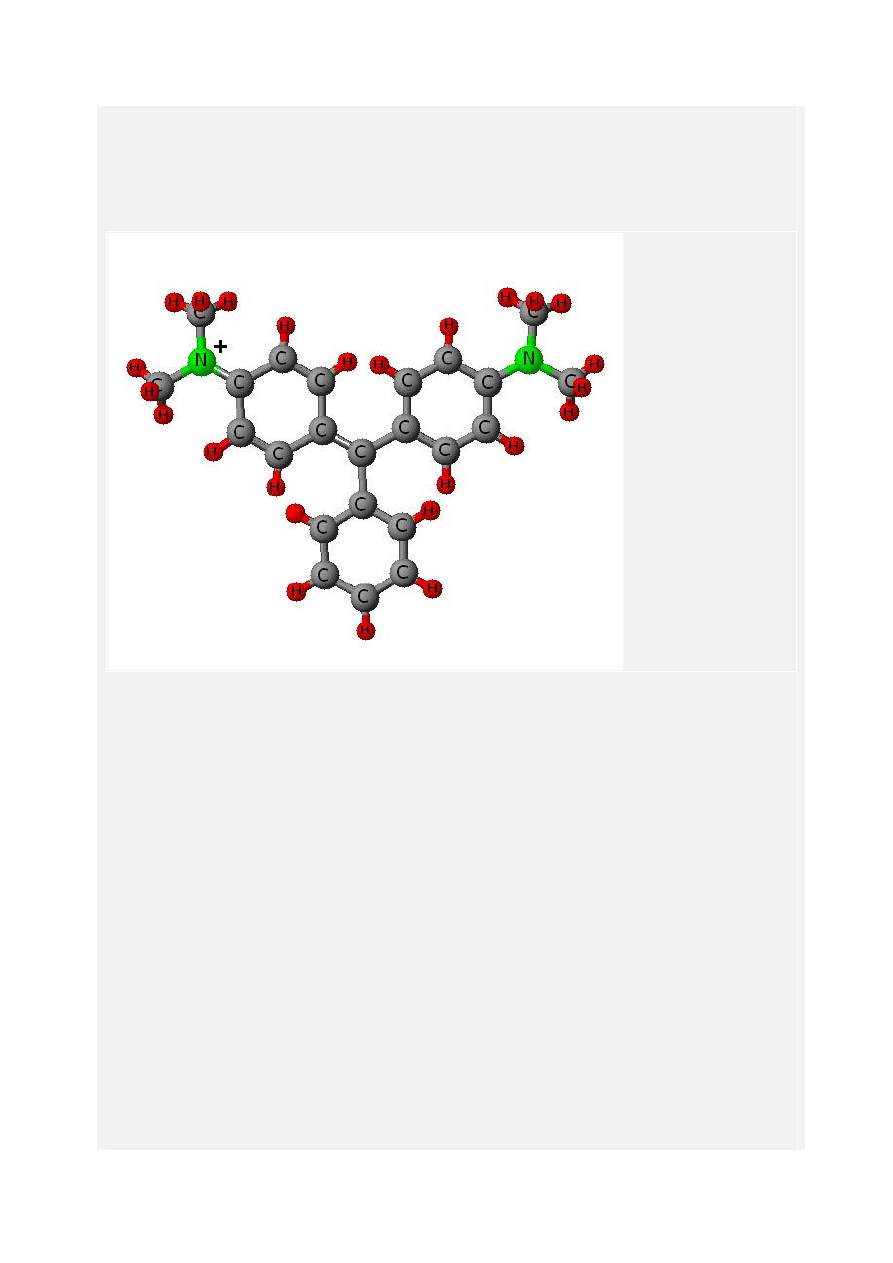
bakteryjnymi u ryb, ikry i narybku. Zieleń malachitowa jest również używana jako barwnik w
bakteriologii. Jej pełna nazwa to 4-[(4-dimetyloaminofenylo)-fenylo-metyl]-N,N-dimetylo-
anilina, związek o wzorze sumarycznym C
23
H
25
ClN
2
i masie molowej 364,911 g/mol.
Teraz w sumie najważniejsze a rzadko się z tym spotykam, Zieleń malachitowa występuje w
trzech formach. W dalszym tekście dla owych trzech form będę używał ich angielskich nazw
gdyż nie spotkałem się z nimi w polskojęzycznych materiałach, a skrót MG jak się można
domyślić oznaczał będzie Malachite Green.
Struktura tych trzech komponentów wyjaśnia ich właściwości chemiczne i biologiczne, między
innymi: jak dobrze mogą być one absorbowane do ciała i jak bardzo są reaktywne (Na grafice
parenaście linijek dalej będzie wyraźnie widać różnice w budowie przestrzennej zieleni
Chromatic MG w porównaniu z Carbinol Base i Leuco MG).
Zieleń malachitowa zazwyczaj znana jest w formie zwanej Chromatic MG, która jest zielonym
barwnikiem. Jednakże, wraz z zaabsorbowaniem przez organizm, jest przekształcana przez
jego mechanizmy w inne formy które są równie ważne. Pierwsza z tych 'wtórnych' form zwana
jest Carbinol Base (Carbinol Form), bezbarwna, jest ona bardzo istotna ponieważ przenika
znacznie szybciej przez błony komórkowe. Kiedy znajdzie się wewnątrz komórki, jest
metabolizowana (metaboliczna aktywacja) do formy zredukowanej (redukcja enzymatyczna)
zwanej Leuco Malachite Green. Ta forma jest również bezbarwna, to ona działa głównie na
pasożyty, została uznana przez naukowców za toksyczną dla nich (i nie tylko), a dodatkowym
faktem jest, że utrzymuje się w ciele przez dłuższy czas niż forma Chromatic MG. Tak
prezentują się trzy kolejne etapy przekształcania zieleni malachitowej przez organizm żywy:

To było ogólne potraktowanie metabolizmu zieleni malachitowej u różnych pasożytów. U
grzybów jest pewien 'dodatek'. Zieleń malachitowa jest enzymatycznie redukowana do Leuco
MG, ale poza tym część zieleni jest przekształcana w N-demetylowane i N-utleniane
metabolity, wliczając pierwszo i drugorzędowe aminy aromatyczne. Związki te są również
toksyczne i wspomagają destrukcję tkanek grzyba.
Skuteczność na pasożyty jak również toksyczność dla ryb wzrasta wraz ze wzrostem
temperatury i spadkiem pH.
To o czym pisałem wyżej, że zieleń występuje w trzech formach, wykorzystała firma sera w
swojej linii preparatów Sera Med. Professional. Jej produkt - Protazol zawiera Zieleń
malachitową w formie Carbinol Base przez co jest skuteczniejszy, bezbarwny (to spory plus -
można go użyć np. w akwarium wystawowym, nie zabarwia podłoża i dekoracji). Dawka jest
mniejsza: 5 mg/100l Carbinol Base zamiast około 11 mg/100l Chromatic MG, kąpiel jest
krótsza - 24 godziny zamiast kilku kilkunastu dni. Jest tak z oczywistego powodu - pasożyt nie
musi wchłonąć tak dużo Chromatic MG i metabolizować to w Carbinol Base (rzadko kiedy
metabolizm jest całkowity, więc pasożyt całej dawki nie 'przerobi', poza tym potrzeba na to
trochę czasu). Jeśli tak jest to dawkę można zmniejszyć gdy dostarczymy gotowy produkt
metabolizmu - plus bo wprowadzamy mniej 'chemii', kuracja jest lepiej znoszona przez ryby.
Zyskujemy też na czasie bo przyspieszenia dodaje skrócenie metabolizmu zieleni o jeden etap,
przyspieszenie to jest znaczne bo dodatkowo jak pisałem na początku Zieleń w formie Carbinol
Base przenika przez błony komórkowe znacznie szybciej!
Istotny szczegółem przy korzystaniu z zieleni malachitowej do celów akwarystycznych jest to
aby była wolna od cynku, który jest często jej zanieczyszczeniem po syntezie (jak pisałem jest
to barwnik syntetyczny, nie pozyskiwany z naturalnych źródeł.) Krótko mówiąc cynk jest
toksyczny dla ryb (szczególnie gdy występuje w wodzie obok kadmu).
Zabrania się stosowania zieleni malachitowej u ryb przeznaczonych do konsumpcji. Jest ona
silnie toksyczna nie tylko dla pasożytów, ale również dla komórek ssaków. Ma właściwości
mutagenne i rakotwórcze. Działanie to zbliżone jest do tego w komórkach pasożytów dlatego
pozwoliłem sobie odbiec od tematu akwarystyki na chwilę. N-demetylowane metabolity tego
związku mają podobne działanie rakotwórcze jak aminy aromatyczne. Po utlenieniu metabolity
te mogą reagować z DNA (przed lub zaraz po jego estryfikacji) powodując uszkodzenie kodu
genetycznego w komórce.
Zieleń malachitową najlepiej usunąć poprzez podmianę wody i adsorpcję na węglu aktywnym.
Preparat ten można łączyć z inną 'chemią' i tak jest np. w preparacie FMC w którym zieleń jest
jednym ze składników. Pamiętać należy, że nie mieszamy jej z preparatami wydzielającymi
aktywny chlor lub tlen. Niebezpiecznie jest też stosować ją w wodzie o pH powyżej 9 ale to u
pawiookich raczej 'nietypowy' przypadek.
Wyszukiwarka
Podobne podstrony:
Pokarmy dla ryb ozdobnych hodowanych w stawikach i oczkach wodnych
Pokarmy dla ryb roślinożernych, AKWARYSTYKA
Jak przygotować akwarium dla ryb z czarnych wód, AKWARYSTYKA
pokarm dla ryb
Hodowla żywego pokarmu dla ryb akwariowych
Hodowla żywego pokarmu dla ryb akwariowych doc
leki dla stom
Leki dla ratownika
Pokarmy dla ryb ozdobnych hodowanych w stawikach i oczkach wodnych
KSIĄŻKI KUCHARSKIE DLA RYB
Hodowla żywego pokarmu dla ryb akwariowych
PROGRAM OCHRONY I ROZWOJU ZASOBÓW WODNYCH WOJ KUJ POM (UDROŻNIENIE RZEK DLA RYB 2 ŚRODOWISKOWYCH)
więcej podobnych podstron