
Y
ORGOS NIKAS
W
ellcome Photo Librar
y
K
oniec lat dziewi´çdziesiàtych by∏
niezwykle p∏odnym okresem w
historii badaƒ biologicznych. Za-
raz po narodzinach Dolly, pierwszego
sklonowanego ssaka, dokona∏ si´ prze-
∏om w hodowli ludzkich zarodkowych
komórek macierzystych, a nied∏ugo po-
tem, u progu nowego tysiàclecia, uda∏o
si´ zakoƒczyç sekwencjonowanie ludz-
kiego genomu.
Od tej pory media, entuzjastycznie za-
ch´cane przez cz´Êç naukowców, raz po
raz wracajà do tych osiàgni´ç, roztacza-
jàc ekscytujàcà wizj´ bliskiego nadej-
Êcia ery medycyny regeneracyjnej. Sà
ludzie, którzy wierzà, ˝e w ciàgu kilku
lat dzi´ki jakiemuÊ bli˝ej nieokreÊlo-
nemu po∏àczeniu klonowania, in˝ynie-
rii genetycznej i wykorzystania komó-
rek macierzystych mo˝liwe stanie si´
stworzenie zupe∏nie nowych komórek,
a nawet ca∏ych narzàdów, które zastàpià
te utracone wskutek chorób, wypadków
lub dysfunkcjonalne w staroÊci.
Nadziejom tym przeciwstawiane sà
etyczne i religijne wàtpliwoÊci zwiàzane
z badaniami nad komórkami macierzy-
stymi, a w szczególnoÊci obawa, ˝e ludz-
kie zarodki b´dà powo∏ywane do ˝ycia
wy∏àcznie w celach naukowych lub me-
dycznych i potem niszczone oraz ˝e klo-
nowanie terapeutyczne utoruje drog´ klo-
nowaniu reprodukcyjnemu.
Dla wielu ludzi wyra˝enie „komórki
macierzyste” pozostaje niezbyt zrozu-
mia∏e, lecz budzi zarówno nadziej´, jak
i obaw´. Niewiele wiemy o prawdziwych
mo˝liwoÊciach komórek macierzystych,
zaÊ szybkie ich wykorzystanie w celach
terapeutycznych ciàgle wydaje si´ niere-
alne. W tym artykule przedstawiam na-
ukowà wizj´ przysz∏oÊci badaƒ nad ko-
mórkami macierzystymi oraz poruszam
kwestie polityczne i prawne, które sk∏a-
niajà w∏adze paƒstwowe i regionalne do
inwestowania w t´ dziedzin´ miliardów
dolarów.
Zacznijmy od kilku podstawowych
definicji. Komórki macierzyste potrafià
przekszta∏caç si´ w wiele typów wyspe-
cjalizowanych komórek, dzi´ki czemu
s∏u˝à w organizmie za biologiczny sys-
tem naprawczy. Teoretycznie mogà
dzieliç si´ bez koƒca, by zastàpiç inne,
obumierajàce komórki. Gdy komórka
macierzysta si´ dzieli, ka˝da z komórek
potomnych mo˝e równie˝ pozostaç ko-
mórkà macierzystà, lub – w zale˝noÊci
od obecnoÊci lub braku pewnych sygna-
∏ów biochemicznych – staç si´ na przy-
k∏ad bardziej wyspecjalizowanà komór-
kà mi´Êniowà, nerwowà lub cia∏kiem
krwi. WyjaÊnienie mechanizmów kon-
trolujàcych ten proces ró˝nicowania
jest dla badaczy jednym z najwi´kszych
wyzwaƒ.
Wykorzystanie komórek macierzy-
stych w medycynie nie jest ˝adnà no-
woÊcià. Takie terapie sà stosowane od
dziesiàtków lat – najlepiej znanym przy-
k∏adem jest przeszczep szpiku kostne-
go w bia∏aczce i innych chorobach krwi,
skuteczny w∏aÊnie dlatego, ˝e szpik jest
pe∏en krwiotwórczych komórek ma-
cierzystych. Jednak we wszystkich do-
tychczas stosowanych terapiach u˝ywa
si´ komórek macierzystych doros∏ych,
wbrew nazwie niekoniecznie pochodzà-
cych od osób doros∏ych, gdy˝ êród∏em
tych komórek mo˝e byç tak˝e dziecko
albo p∏ód. Chyba lepszà nazwà by∏oby
zatem dla nich okreÊlenie „somatyczne
komórki macierzyste”.
Z somatycznych komórek macierzy-
stych mo˝e powstaç ograniczona licz-
ba typów komórek zró˝nicowanych –
jest to obecnie przedmiotem naukowych
sporów, omówionych w towarzyszàcym
artykule [patrz: „Osobista ekipa na-
prawcza”, strona 41]. Wczesne zarodki
sà lepszym êród∏em komórek macie-
rzystych, poniewa˝ wszystkie ich komór-
ki wcià˝ pozostajà niezró˝nicowane.
34
ÂWIAT NAUKI WRZESIE¡ 2005
Komórki, które mogà wszystko
Zanim badania nad zarodkowymi komórkami macierzystymi
przyniosà ludzkoÊci odczuwalne korzyÊci, jednak minie
jeszcze jedno lub dwa pokolenia
Clive Cookson
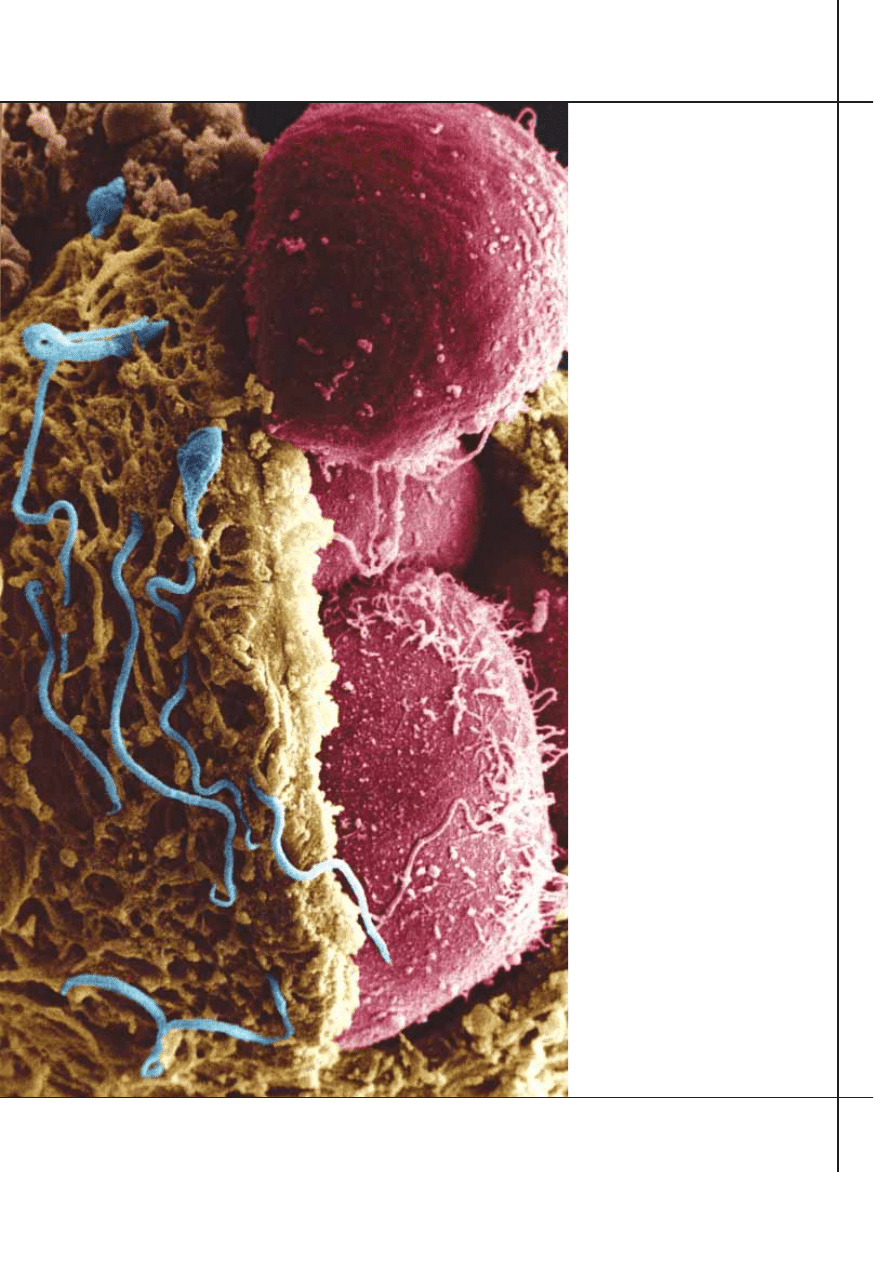
Zarodkowe komórki macierzyste (ko-
mórki ES – embryonic stem cells) sà to-
tipotencjalne – mogà przekszta∏ciç si´
w komórki prawie wszystkich typów.
Pierwszà lini´ (stabilnà, reprodukujà-
cà si´ populacj´) ludzkich komórek ES
wyhodowa∏ w 1998 roku James Thom-
son z University of Wisconsin. By uzy-
skaç takà lini´, trzeba pobraç komórki
z jednotygodniowego zarodka (blasto-
cysty, mikroskopijnej kulki z∏o˝onej
z 50–100 komórek) i hodowaç je na szal-
ce laboratoryjnej w obecnoÊci odpowied-
nich substancji od˝ywczych i czynników
wzrostu. Zwykle zarodki u˝ywane do te-
go celu pochodzà od par poddajàcych
si´ zabiegowi zap∏odnienia in vitro.
Z kilku powsta∏ych podczas tej procedu-
ry zarodków na ogó∏ tylko jeden jest
wszczepiany do macicy, a pozosta∏e zo-
stajà zamro˝one. Z wykorzystania reszty
pary najcz´Êciej rezygnujà i czasem prze-
kazujà je na cele naukowe.
Nawet dziÊ, po siedmiu latach inten-
sywnej pracy w wielu krajach, na ca∏ym
Êwiecie istnieje nie wi´cej ni˝ 150 do-
brze scharakteryzowanych linii komó-
rek ES, gdy˝ proces ich tworzenia wy-
maga bardzo du˝ej zr´cznoÊci. SpoÊród
tych 150 tylko 22 linie mogà byç u˝yte
w USA do badaƒ finansowanych przez
instytucje federalne, gdy˝ administracja
Busha zarzàdzi∏a, ˝e National Institu-
tes of Health nie mogà dotowaç badaƒ
na liniach powsta∏ych po sierpniu 2001
roku. Raz utworzona linia komórek
macierzystych jest zasadniczo nieÊmier-
telna. Mo˝na jà zamroziç i przecho-
wywaç w banku komórek, takim jak
utworzony w zesz∏ym roku w Wielkiej
Brytanii, oraz dostarczaç na zamówienie
innym naukowcom.
Aby obejÊç etycznie kontrowersyjnà
kwesti´ niszczenia ludzkich zarodków w
celach badawczych, niektórzy naukow-
cy poszukujà alternatywnych êróde∏ za-
rodkowych komórek macierzystych. Jed-
no podejÊcie to zidentyfikowanie jak
najmniej zró˝nicowanych somatycznych
komórek macierzystych i zmuszenie ich
do cofni´cia si´ w rozwoju, tak by odzy-
ska∏y zdolnoÊç wielokierunkowego ró˝ni-
WRZESIE¡ 2005 ÂWIAT NAUKI
35
PREKURSORY zarodkowych komórek
macierzystych (czerwony) widoczne
we wn´trzu czterodniowego ludzkiego
zarodka po rozci´ciu otaczajàcego go p∏aszcza
bia∏kowego. Komórki te umieszczone
w hodowli dadzà poczàtek linii komórkowej.

cowania si´, charakteryzujàcà komórki
zarodkowe. Innym rozwiàzaniem mo-
g∏oby byç dzieworództwo – zmuszenie
niezap∏odnionej ludzkiej komórki ja-
jowej, by zacz´∏a dzieliç si´ jak wczesny
zarodek. Nie wiadomo jednak, czy któ-
rykolwiek z tych pomys∏ów uda∏oby si´
zrealizowaç.
Do niedawna naukowcy hodowali
ludzkie zarodkowe komórki macierzy-
ste na podk∏adzie z mysich komórek
skóry, zwanych komórkami od˝ywczymi
(feeder cells), których rola polega∏a na
hamowaniu ró˝nicowania si´ komórek
macierzystych w komórki bardziej wy-
specjalizowane. Do po˝ywki jako sub-
stancj´ od˝ywczà dodawano p∏odo-
wà surowic´ ciel´cà. Niestety, podobnie
jak w wypadku ksenotransplantacji, nie-
pochodzàce od cz∏owieka sk∏adniki
stwarza∏y ryzyko zanieczyszczenia ho-
dowli bia∏kami zwierz´cymi lub pato-
genami. To zaÊ stawia∏o pod znakiem
zapytania bezpieczeƒstwo u˝ycia otrzy-
mywanych w ten sposób komórek ma-
cierzystych w celach terapeutycznych.
W tym roku kilka zespo∏ów badaw-
czych opracowa∏o nowe receptury po-
˝ywki, zast´pujàc zwierz´ce sk∏adniki
ludzkimi odpowiednikami. Niektórzy
naukowcy utrzymujà jednak, ˝e zanie-
czyszczenia w po˝ywkach wspomaga-
jàcych wzrost i ró˝nicowanie komórek
macierzystych sà tak wszechobecne, ˝e
trudno b´dzie je wyeliminowaç [ramka
na stronie 38].
W przeciwieƒstwie do somatycznych
zarodkowe komórki macierzyste nie
mogà byç bezpoÊrednio stosowane w te-
rapii, gdy˝ rozwijajà si´ z nich nowotwo-
ry. W istocie jeden z testów laboratoryj-
nych potwierdzajàcych, ˝e wyizolowane
komórki rzeczywiÊcie sà zarodkowy-
mi komórkami macierzystymi, polega
na wstrzykni´ciu ich myszom i analizie
D
okonania naukowców badajàcych komórki macierzyste zmuszajà
do ponownego rozwa˝enia, gdzie le˝y granica mi´dzy ludzkimi
komórkami zarodkowymi a cz∏owiekiem. Mniejsza natomiast jest Êwia-
domoÊç, ˝e przesuwamy si´ tak˝e w stron´ innej granicy, która nie-
spodziewanie mo˝e okazaç si´ równie nieostra: granicy dzielàcej ludzi od
zwierzàt. Komórki macierzyste u∏atwiajà tworzenie mi´dzygatunkowych
chimer – organizmów, które sà ˝yjàcà mieszaninà komórek ludzkich i
zwierz´cych. Istnienie takich bytów wzbudza nowe dylematy etyczne.
Chimera to potwór z mitologii greckiej majàcy cia∏o lwa, g∏ow´ kozy
i w´˝a zamiast ogona. Pami´tajàc o tym, ∏atwo uznaç chimery stworzo-
ne w laboratorium za ucieleÊnienie chorych pomys∏ów szalonych naukow-
ców. Jednak mo˝e si´ okazaç, ˝e tworzenie chimer jest nie do unikni´cia,
jeÊli kiedykolwiek b´dziemy zamierzali wykorzystaç komórki macierzy-
ste w terapii. Naukowcy b´dà musieli zbadaç, jak reagujà one na sygna-
∏y biochemiczne wewnàtrz organizmu. Je˝eli chcemy uniknàç ekspery-
mentowania na ludziach, b´dzie potrzebne przyzwolenie na testy na
zwierz´tach, a zatem na tworzenie chimer.
Irving Weissman ze Stanford University i jego wspó∏pracownicy zapo-
czàtkowali doÊwiadczenia z chimerami w 1998 roku, kiedy w celu ba-
dania AIDS stworzyli myszy z ludzkim uk∏adem odpornoÊciowym. Póê-
niej ci sami naukowcy we wspó∏pracy z firmà StemCells Inc., której
wspó∏za∏o˝ycielem jest Weissman, przeszczepili ludzkie komórki ma-
cierzyste do mózgów mysich noworodków, uzyskujàc wst´pny model
badaƒ uk∏adu nerwowego. Esmail Zanjani z University of Nevada w Re-
no, pracujàc na owczych p∏odach, wyhodowa∏ doros∏e zwierz´ta majà-
ce ludzkie komórki w ca∏ym organizmie.
Nikt nie wie, jakie skutki wywo∏a zwi´kszanie udzia∏u komórek ludz-
kich w organizmie zwierz´cym. Weissman i inni przewidujà stworzenie
pewnego dnia myszy z ca∏kowicie „ludzkà” tkankà mózgowà. Sztywny
program rozwojowy i niewielki rozmiar tej chimery gwarantujà, ˝e jej zdol-
noÊci mentalne nie b´dà si´ znaczàco ró˝ni∏y od zdolnoÊci normalnej my-
szy. Co jednak by si´ sta∏o, gdyby prekursory ludzkich komórek mózgo-
wych zamiast do myszy wszczepiç do p∏odu szympansa? Niewykluczone,
˝e narodzi∏oby si´ coÊ mniej zwierz´cego, ni˝ byÊmy sobie ˝yczyli.
Beztroskie przemieszanie tkanek ludzkich i zwierz´cych mo˝e rów-
nie˝ zwi´kszyç ryzyko przeniesienia si´ na ludzi zakaênych chorób zwie-
rz´cych. Choroby, które pokonujà bariery mi´dzygatunkowe, mogà byç
szczególnie groêne, gdy˝ uk∏ady odpornoÊciowe nowych gospodarzy sà
na nie zupe∏nie nieprzygotowane (pandemi´ grypy hiszpanki w roku
1918 najprawdopodobniej zapoczàtkowa∏ wirus ptasiej grypy).
Obecnie nie ma ˝adnych mi´dzynarodowych przepisów regulujàcych
eksperymenty na chimerach. W kanadyjskiej ustawie Assisted Human
Reproduction Act z 2004 roku zabroniono tworzenia jakichkolwiek ludz-
ko-zwierz´cych chimer. W Stanach Zjednoczonych nie ma ˝adnych for-
malnych zakazów, lecz senator Sam Brownback z Kansas zaproponowa∏
w marcu wprowadzenie ustawy, która zdelegalizowa∏aby tworzenie kil-
ku rodzajów chimer, m.in. zawierajàcych znaczàcà iloÊç ludzkiej tkan-
ki mózgowej. Niektóre instytucje dostarczajàce naukowcom komórki
macierzyste ustanowi∏y w∏asne zasady dopuszczania eksperymentów
z chimerami.
W USA do ujednolicenia prawa mogà przyczyniç si´ ogólne wytyczne
wykorzystywania komórek macierzystych przyj´te pod koniec kwietnia br.
przez National Academy of Sciences. NAS zezwala m.in. na tworzenie
chimer z wi´kszoÊci gatunków zwierz´cych, zabrania jednak ∏àcze-
nia ludzkich komórek z komórkami innych naczelnych oraz wszczepiania
zwierz´cych komórek do ludzkich blastocyst. Ostrzega równie˝ przed
dopuszczeniem do rozmna˝ania si´ ludzko-zwierz´cych chimer, gdy˝
ludzkie komórki mogà czasem migrowaç do zwierz´cych jajników i jàder,
a w takich wypadkach rozmna˝anie mog∏oby teoretycznie doprowadziç
do potwornego w skutkach zagnie˝d˝enia si´ ludzkiego zarodka w macicy
zwierz´cia.
John Rennie
36
ÂWIAT NAUKI WRZESIE¡ 2005
MU
ZEUM ARCHEOL
OGICZNE WE FL
ORENCJI, W¸
OCHY/ BRIDGEMAN AR
T LIBRARY
Chimery ludzko-zwierz´ce
W niektórych eksperymentach niepostrze˝enie przekroczono granic´ mi´dzy gatunkami
STARO˚YTNA RZEèBA przedstawiajàca Chimer´.
WRZESIE¡ 2005 ÂWIAT NAUKI
37
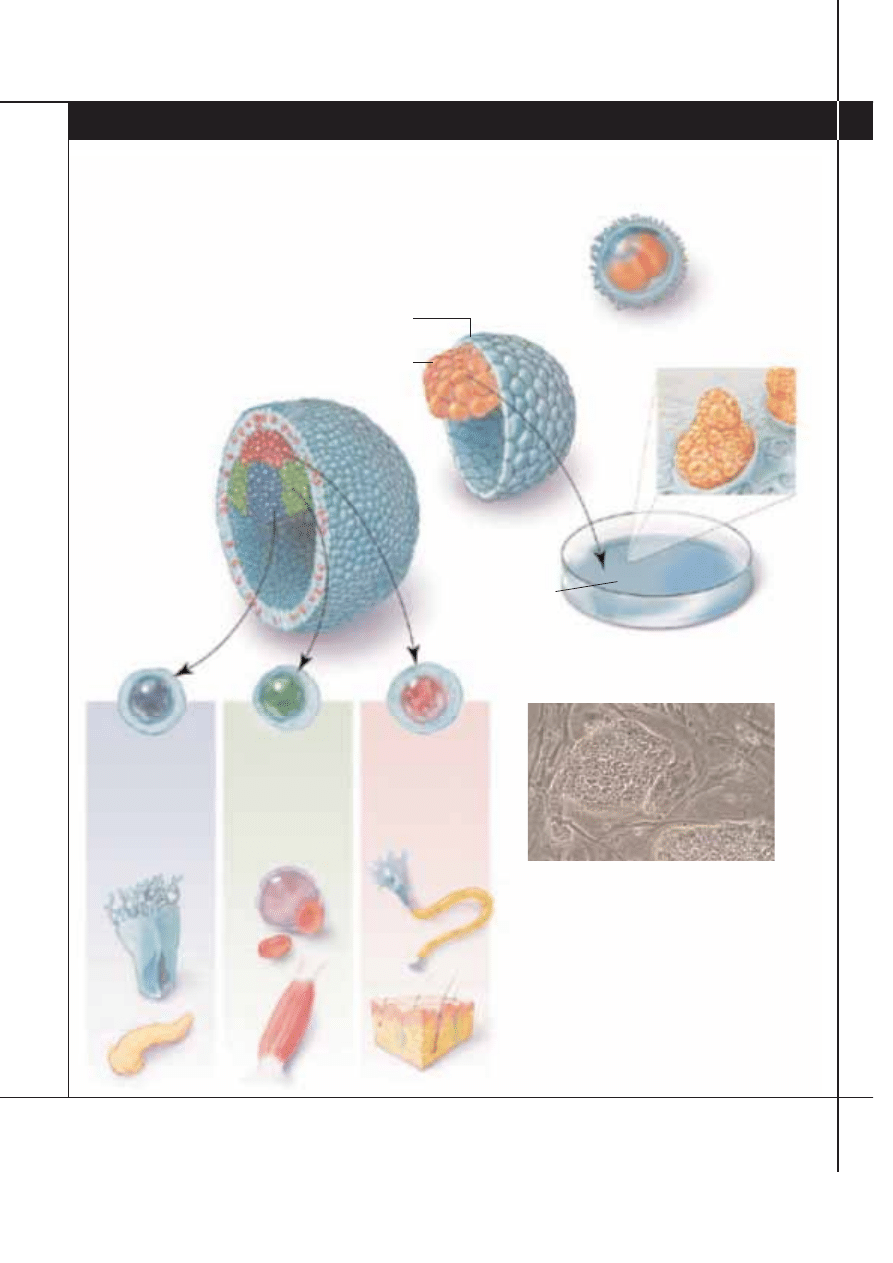
Czym sà komórki macierzyste
ZARODKOWE KOMÓRKI MACIERZYSTE (komórki ES – embryonic stem cells) pochodzà z cz´Êci bardzo wczesnego stadium zarod-
ka, z którego ostatecznie wyroÊnie ca∏y organizm. Poniewa˝ komórki ES powstajà w tym poczàtkowym stadium, zachowujà totipotencjal-
noÊç, czyli zdolnoÊç tworzenia ka˝dej komórki organizmu.
UZYSKIWANIE ZARODKOWYCH
KOMÓREK MACIERZYSTYCH
Aby stworzyç lini´ komórek ES, naukowcy pobierajà
wewn´trznà mas´ komórek z blastocysty wytworzonej
w laboratorium, zwykle pozosta∏ej po próbach
zap∏odnienia in vitro. W´ze∏ zarodkowy jest wprowadzany
do naczynia hodowlanego zawierajàcego komórki
od˝ywcze, do których wkrótce przywiera. W ciàgu kilku
dni wyrastajà nowe komórki ICM, tworzàc kolonie
(powy˝ej). Te komórki sà formalnie nazywane
zarodkowymi komórkami macierzystymi, jeÊli
majà charakterystyczne znaczniki i przesz∏y kilka
podzia∏ów komórkowych (pasa˝y), tzn. kiedy
stanà si´ stabilnà, nieÊmiertelnà linià komórkowà.
LOSY KOMÓREK
W niespe∏na tydzieƒ po zap∏odnieniu ludzkiej komórki jajowej rozwijajàcy si´
zarodek zawiera od 100 do 150 jeszcze niewyspecjalizowanych komórek.
Zarodek jest p´cherzykiem zwanym blastocystà,
sk∏adajàcym si´ z zewn´trznej masy
komórek (z której po zagnie˝d˝eniu
w macicy powstanie ∏o˝ysko)
i z wewn´trznej masy komórek
(ICM – inner cell mass),
czyli w´z∏a zarodkowego,
z której powstanie p∏ód.
Po zagnie˝d˝eniu si´
w macicy komórki te
kontynuujà podzia∏y,
rozpoczynajàc w trzecim
tygodniu specjalizacj´.
Zarodek, zwany w tym
stadium gastrulà,
zawiera trzy ró˝ne
listki zarodkowe,
z których powstanà
setki tkanek.
ZAP¸ODNIONA
KOMÓRKA JAJOWA
(1 dzieƒ)
BLASTOCYSTA
(5–6 dzieƒ)
Kolonie
komórek ES
Komórki ES wywodzà si´
z w´z∏a zarodkowego
Zewn´trzna
masa komórek
(trofoblast)
Wewn´trzna
masa komórek
(w´ze∏ zarodkowy)
GASTRULA
(14–16 dzieƒ)
EKTODERMA
(zewn´trzny listek)
Skóra,
neurony,
przysadka mózgowa,
oczy,
uszy
MEZODERMA
(Êrodkowy listek)
Szpik kostny,
mi´Ênie szkieletowe,
g∏adkie i mi´sieƒ
sercowy, serce
i naczynia krwionoÊne,
kanaliki nerkowe
ENDODERMA
(wewn´trzny listek)
Trzustka,
wàtroba,
tarczyca,
p∏uca,
p´cherz,
cewka moczowa
LISTKI ZARODKOWE
I NIEKTÓRE TKANKI
WYWODZÑCE SI¢
Z TYCH LISTKÓW
ANDREW SWIFT
; ROBER
T P
. L
A
NZA (
mikr
ofotografia
)

38
ÂWIAT NAUKI WRZESIE¡ 2005
GETTY IMAGES
B
adaczy komórek macierzystych irytuje, ˝e ludzie mylà ich prac´ z
klonowaniem, chocia˝ wi´kszoÊç wspó∏czesnych badaƒ nad ko-
mórkami macierzystymi nie ma z klonowaniem nic wspólnego. Jednà z
przyczyn tych pomy∏ek jest fakt, ˝e w obu dziedzinach tworzy si´ zarod-
ki, innà mog∏o byç przypadkowe zbiegni´cie si´ w czasie dwóch nauko-
wych osiàgni´ç. Ludzkie zarodkowe komórki macierzyste po raz pierw-
szy uda∏o si´ wyhodowaç wkrótce po narodzinach Dolly, a komentatorzy
natychmiast wskazali potencja∏ kryjàcy si´ w po∏àczeniu tych dwóch
technik. Ukuto termin „klonowanie terapeutyczne”, który opisuje two-
rzenie klonów jako êróde∏ zarodkowych komórek macierzystych; w pro-
cesie tym sklonowany zarodek ulega zniszczeniu. Tzw. klonowanie re-
produkcyjne polega natomiast na wszczepieniu sklonowanego zarodka
do macicy, by mog∏o urodziç si´ dziecko genetycznie identyczne z daw-
cà jàdra komórkowego.
Nikt jednak nie zaprzecza, ˝e klonowanie mo˝e byç wa˝nym ele-
mentem badaƒ nad komórkami macierzystymi, bo jest to chyba najlep-
szy sposób na pokonanie problemu zwiàzanego z przeszczepami ko-
mórek i narzàdów: immunologicznej odpowiedzi organizmu biorcy.
Uk∏ad odpornoÊciowy atakuje ka˝dy przeszczep, który nie jest gene-
tycznie identyczny z biorcà. Nawet pacjenci po dobrze dobranym prze-
szczepie wymagajà ciàg∏ej terapii lekami immunosupresyjnymi, które
majà powa˝ne dzia∏ania niepo˝àdane, m.in. zwi´kszajà podatnoÊç na
zaka˝enia i nowotwory.
W klonowaniu terapeutycznym stosuje si´ SCNT (somatic cell nuclear
transfer), technik´, która pozwoli∏a na narodziny Dolly. Polega ona na
umieszczeniu jàdra pobranego z jednej z komórek pacjenta w komórce
jajowej od dowolnego dawcy, której w∏asne jàdro uprzednio usuni´to.
Zmodyfikowana w ten sposób komórka jajowa jest nast´pnie odpowied-
nio stymulowana, aby zachowywa∏a si´ tak, jakby by∏a zap∏odniona.
Dzi´ki temu rozwija si´ z niej zarodek, który mo˝e byç êród∏em ko-
mórek macierzystych o DNA identycznym z DNA pacjenta. Prze-
ciwnicy klonowania terapeutycznego wskazujà, ˝e ten sam za-
rodek móg∏by byç umieszczony w macicy i ˝e mog∏oby si´ z
niego rozwinàç dziecko.
Niestety, SCNT jest procesem niewydajnym, zarów-
no w przypadku zwierzàt, jak i ludzi. Pierw-
sze wiarygodne naukowe doniesienie o
klonowaniu cz∏owieka pojawi∏o si´ w
zesz∏ym roku. Woo Suk Hwang i jego
zespó∏ z Narodowego Uniwersytetu w
Seulu u˝yli 242 komórek jajowych,
by uzyskaç 30 wczesnych zarod-
ków, z których uda∏o si´ wyizolo-
waç zaledwie jednà ˝ywotnà lini´
komórek macierzystych. W Korei
Po∏udniowej komórki jajowe cz´sto
oddawane sà na cele naukowe, dzi´ki
czemu badacze mogli pracowaç na ma-
teriale wysokiej jakoÊci.
Istotnie, nawet jeÊli klonowanie tera-
peutyczne sta∏oby si´ wydajniejsze, trud-
no wyobraziç sobie takà dost´pnoÊç ludz-
kich komórek jajowych, by t´ procedur´
da∏o si´ stosowaç powszechnie (chyba ˝e powstanie jakaÊ nowa, prze-
∏omowa metoda klonowania).
Naukowcy majà jednak nadziej´, ˝e w bliskiej przysz∏oÊci klonowanie
terapeutyczne stanie si´ u˝ytecznym narz´dziem badawczym, które
umo˝liwi lepszy wglàd w mechanizm rozwoju ró˝nych chorób. Schorze-
nia uwarunkowane genetycznie, takie jak mukowiscydoza, mogà byç
zbadane dzi´ki uzyskaniu linii komórek macierzystych z zarodków,
o których wiadomo, ˝e niosà pojedynczà mutacj´ w danym genie
[patrz: artyku∏]. Jednak podobne eksperymenty nie sà mo˝liwe w przy-
padku chorób uwarunkowanych wieloma ró˝nymi czy te˝ nieznanymi
czynnikami.
W czerwcu br. zespó∏ Hwanga og∏osi∏, ˝e uda∏o mu si´ wyhodowaç li-
nie zarodkowych komórek macierzystych pochodzàce od pacjentów cier-
piàcych na dziedziczne choroby albo urazy rdzenia kr´gowego. Wydaj-
noÊç procesu podnios∏a si´: ze 185 komórek jajowych uzyskano 31
zarodków-klonów, a z nich 11 linii komórek macierzystych. Testy labo-
ratoryjne potwierdzi∏y, ˝e ka˝da z tych linii by∏a immunologicznie zgod-
na z pacjentem, od którego pochodzi∏a.
Tymczasem inni badacze poszukujà alternatywnych sposobów na
zmniejszenie odpowiedzi immunologicznej przeciw wszczepianym komór-
kom macierzystym. Niektórzy twierdzà nawet, ˝e wszelkie obawy sà
mocno przesadzone, gdy˝ komórki pochodzàce z zarodków i p∏odów sà
znacznie mniej immunogenne ni˝ komórki doros∏e. Przypominajà te˝, ˝e
przeszczepione komórki nerwowe w terapii choroby Parkinsona majà
u∏atwione prze˝ycie, gdy˝ uk∏ad odpornoÊciowy jest znacznie mniej ak-
tywny w mózgu ni˝ w innych rejonach organizmu.
Jednà z dróg zmniejszenia ryzyka odrzucenia przeszczepu z komórek ma-
cierzystych jest taka ich modyfikacja, by sta∏y si´ mniej immunogenne
albo bardziej zgodne z uk∏adem odpornoÊciowym pacjenta.
Drastyczniejszà metodà by∏oby „zresetowanie” systemu
immunologicznego pacjenta i zrekonstruowanie go
tak, by by∏ zgodny z przeszczepianymi komórka-
mi. Niektórzy naukowcy propagujà wizj´ stwo-
rzenia „uniwersalnych komórek dawcy”, któ-
re by∏yby zgodne z ka˝dym uk∏adem
odpornoÊciowym. Nie wiadomo jednak,
czy którakolwiek z tych metod mog∏a-
by zostaç zastosowana w praktyce.
Byç mo˝e bardziej realistyczny, choç
wcià˝ ambitny i wymagajàcy d∏ugiej
i ˝mudnej pracy, jest pomys∏ stwo-
rzenia banku komórek macierzystych
z setkami lub tysiàcami
linii komórkowych repre-
zentujàcymi mo˝liwie
pe∏ny przekrój profili im-
munologicznych. Po-
mys∏ ten opiera si´ na
dà˝eniu do zmniejsze-
nia, nie zaÊ ca∏kowite-
go unikni´cia odpowie-
dzi immunologicznej
organizmu. Ka˝dy pacjent, który potrzebo-
wa∏by komórek macierzystych, móg∏by wtedy oczekiwaç
przeszczepu dobrego, jeÊli nie wr´cz idealnego pod wzgl´-
dem dopasowania genetycznego.
C.C.
Zwiàzki z klonowaniem
Przeszczepy z tkanek klonowanych z komórek macierzystych nie sà nara˝one na odrzucenie
KLONOWANIE TERAPEUTYCZNE
pozwoli duplikowaç narzàdy
potrzebne do transplantacji.

powstajàcego potworniaka (guza z tkan-
ki zarodkowej). Tak wi´c przed ka˝dym
przeszczepem zarodkowych komórek
macierzystych naukowcy b´dà musieli
ukierunkowaç ich ró˝nicowanie tak, by
otrzymaç konkretne wyspecjalizowane
komórki, na przyk∏ad produkujàce in-
sulin´ komórki beta dla cukrzyków al-
bo produkujàce dopamin´ neurony dla
chorych na parkinsonizm. A i tak nie-
zb´dne b´dà rygorystyczne testy, by
upewniç si´, ˝e wÊród tych zró˝nicowa-
nych komórek nie pozosta∏y ˝adne za-
rodkowe komórki macierzyste.
O ile uzyskanie linii zarodkowych ko-
mórek macierzystych wymaga od na-
ukowców du˝ej zr´cznoÊci, o tyle ste-
rowanie procesem ich ró˝nicowania
jest prawdziwym koszmarem. Dopiero
zaczynamy poznawaç warunki Êrodo-
wiskowe i kombinacje czynników wzro-
stu i innych bia∏ek, które potrzebne sà
do ukierunkowania rozwoju ludzkich
zarodkowych komórek macierzystych
tak, by sta∏y si´ komórkami nerwowy-
mi lub mi´Êniowymi czy te˝ innymi
komórkami potrzebnymi do terapii.
DoÊwiadczenia z mysimi zarodkowy-
mi komórkami macierzystymi Êwiadczà
jednak, ˝e opracowanie bezpiecznych
i skutecznych terapii z wykorzystaniem
ich ludzkich odpowiedników b´dzie kie-
dyÊ mo˝liwe. Wyt´˝one prace nad tymi
obiecujàcymi terapiami prowadzone sà
na ca∏ym Êwiecie. Biolodzy sàdzà, ˝e
wi´kszoÊç chorób degeneracyjnych jest
zbyt z∏o˝ona, aby da∏o si´ je leczyç wy-
∏àcznie lekami lub zastosowaç terapi´
genowà. Natomiast u˝ycie ˝ywych ko-
mórek, które produkujà wiele ró˝nych
biologicznie czynnych substancji, daje
wi´ksze szanse powodzenia.
Chocia˝ nie przeprowadzono jeszcze
˝adnych badaƒ klinicznych polegajàcych
na przeszczepianiu zarodkowych komó-
rek macierzystych, inne rodzaje terapii
komórkami wykaza∏y, ˝e ten rodzaj
transplantacji mo˝e byç w przypadku
ludzi skuteczny. Dobrym przyk∏adem,
oprócz powszechnie stosowanego prze-
szczepu szpiku kostnego, jest u˝ycie pre-
kursorów komórek nerwowych z p∏o-
dów do leczenia chorób mózgu oraz
przeszczepianie cukrzykom pozyska-
nych od zmar∏ych komórek beta trzustki,
które wydzielajà insulin´. Takie sukcesy
dajà nadziej´, ˝e zarodkowe komórki
macierzyste w podobnych zastosowa-
niach b´dà kiedyÊ dzia∏aç nawet lepiej,
ale potrzeba jeszcze bardzo wielu ba-
daƒ, by to udowodniç.
Badacze zarodkowych komórek ma-
cierzystych majà pe∏ne r´ce roboty.
Muszà znaleêç sposoby efektywnego
pozyskiwania tych komórek; opraco-
waç lepsze metody identyfikacji zarod-
kowych komórek macierzystych i okre-
Êlania ich rzeczywistego potencja∏u
rozwojowego; metody kontrolowania
ich wzrostu i ró˝nicowania wewnàtrz
cia∏a; ustaliç, czy uk∏ad odpornoÊcio-
wy atakuje zarodkowe komórki macie-
rzyste i te, które z nich powsta∏y, oraz
zrozumieç, jaki zwiàzek majà ró˝nice
pomi´dzy zarodkowymi a somatyczny-
mi komórkami macierzystymi z ich
przydatnoÊcià do ró˝nych zastosowaƒ
klinicznych.
Podczas gdy wi´kszoÊç, w tym polity-
cy, jest zafascynowana mo˝liwoÊcià bez-
poÊredniego u˝ycia komórek macierzy-

stych w lecznictwie, wielu naukowców
twierdzi, ˝e g∏ówne korzyÊci z ich za-
stosowania b´dà natury poÊredniej
– dzi´ki nim uda si´ stworzyç nowe mo-
dele badawcze, które przyÊpieszà opra-
cowanie innych rodzajów terapii. Roz-
pracowanie sieci sygna∏ów chemicznych
i genetycznych, które decydujà o wzro-
Êcie i ró˝nicowaniu si´ komórek macie-
rzystych, b´dzie niezwykle u˝yteczne
w medycynie. Dzi´ki zdobytej wiedzy
da si´ stworzyç modele rozwoju i funk-
cjonowania tkanek, które u∏atwià che-
mikom efektywne testowanie nowych
lekarstw.
Wyobraêmy sobie na przyk∏ad, ˝e opra-
cowano metod´ sterowania rozwojem
zarodkowych komórek macierzystych,
tak by ró˝nicowa∏y si´ w komórki p∏uc.
Gdyby do tego ró˝nicowania u˝yç komó-
rek z zarodków, o których dzi´ki bada-
niom prenatalnym wiadomo, ˝e niosà
mutacj´ powodujàcà mukowiscydoz´,
uzyskalibyÊmy fragment chorej tkanki
p∏ucnej i mielibyÊmy zupe∏nie nowe mo˝-
liwoÊci badania tej choroby oraz poszu-
kiwania terapii. Taka wizja medycyny re-
generatywnej jest bliska farmakologom,
którzy – w przeciwieƒstwie do biologów
eksperymentujàcych z terapià komór-
kowà – koncentrujà si´ raczej na opra-
cowywaniu leków, najlepiej w formie ma-
∏ych czàsteczek stymulujàcych tkanki do
regeneracji, które pacjenci mogliby za˝y-
waç doustnie.
Zanim wielkie odkrycia biologiczne
koƒca lat dziewi´çdziesiàtych przynio-
sà korzyÊci terapeutyczne, mo˝e minàç
jeszcze jedno lub dwa pokolenia. Mamy
zbyt ma∏o danych, aby przewidzieç, jak
potoczà si´ badania nad komórkami ma-
cierzystymi i medycynà regeneratywnà.
Jedno wydaje si´ pewne: pr´dzej czy
póêniej ludzie zacznà korzystaç z owo-
ców tych prac.
n
40
ÂWIAT NAUKI WRZESIE¡ 2005
MA
TT COLLINS
G
dy prezydent George W. Bush w sierpniu 2001 roku zabroni∏ two-
rzenia nowych linii zarodkowych komórek macierzystych za pie-
niàdze federalne, u∏agodzi∏ naukowców obietnicà, ˝e ponad 60 linii ko-
mórek ES nadal b´dzie mog∏o s∏u˝yç badaniom nad rozwojem
nowoczesnych terapii. Jednak narastajàce problemy z tymi komórkami
zmusi∏y FDA do rozwa˝enia, czy pochodzàcy z tych linii materia∏ na
pewno mo˝na bezpiecznie stosowaç w doÊwiadczeniach na ludziach.
Z dopuszczonych do u˝ytku linii komórkowych uzyskanych przed
sierpniem 2001 do dziÊ prze˝y∏o tylko 22, ale ich jakoÊç budzi wàtpli-
woÊci w zwiàzku z ich zaawansowanym wiekiem. Uwa˝a si´, ˝e linie te
sà „nieÊmiertelne”, lecz z doÊwiadczeƒ z innymi komórkami wynika, ˝e
d∏ugotrwa∏a hodowla bardzo im szkodzi. Naukowcy nie byli wi´c specjal-
nie zaskoczeni, gdy pojawi∏y si´ doniesienia, ˝e w niektórych liniach
z rejestrów National Institutes of Health wykryto du˝e nieprawid∏owo-
Êci genetyczne. Inne zatwierdzone linie zacz´∏y traciç zdolnoÊç do ró˝-
nicowania si´ albo ró˝nicowa∏y si´ w Êlimaczym tempie.
Metody post´powania z komórkami macierzystymi zosta∏y znacznie
udoskonalone od czasów sprzed zakazu i badacze uwa˝ajà, ˝e Êwie˝-
sze linie mogà byç utrzymywane w znacznie lepszym stanie. W tym
roku opracowano dwa nowe rodzaje po˝ywek do hodowania komórek
macierzystych, eliminujàc koniecznoÊç stosowania pod∏o˝a z mysich ko-
mórek od˝ywczych, u˝ywanego we wszystkich zatwierdzonych przez rzàd
liniach. Obawy, ˝e zarejestrowane linie komórkowe mogà byç zanie-
czyszczone czàsteczkami mysiego pochodzenia ostatnio potwierdzono
doÊwiadczalnie – ludzkie zarodkowe komórki macierzyste wzrastajà-
ce na pod∏o˝u z komórek mysich pobierajà pewne mysie bia∏ko i pre-
zentujà je na swej powierzchni. Gdy komórki takie wystawiono na dzia-
∏anie normalnej ludzkiej surowicy, zosta∏y zaatakowane i zniszczone
przez obecne w surowicy przeciwcia∏a przeciw temu bia∏ku.
Mimo opisanych problemów kalifornijska firma Geron, posiadajàca pra-
wa do dziewi´ciu z 22 zatwierdzonych przez rzàd linii, og∏osi∏a, ˝e na
poczàtku 2006 roku zamierza wystàpiç do FDA o zgod´ na rozpocz´-
cie doÊwiadczeƒ nad wykorzystaniem tych komórek do naprawy rdze-
nia kr´gowego u ludzi. Prezes Geronu, Thomas Okarma, jest prze-
Êwiadczony, ˝e komórki nale˝àce do tej firmy sà czyste – pomyÊlnie
przesz∏y bowiem surowe testy. ˚adna inna firma w USA formalnie nie
wystàpi∏a o pozwolenie na wypróbowanie pochodnych zarodkowych
komórek macierzystych na ludziach, lecz dyrektor Stem Cell Institute
w University of Minnesota, John Wagner, poinformowa∏ stanowe w∏a-
dze legislacyjne, ˝e w zesz∏ym roku jego zespó∏ ju˝ próbowa∏ uzyskaç
zgod´ FDA na takie doÊwiadczenia. Wagner odmówi∏ podania jakich-
kolwiek szczegó∏ów.
Równie˝ FDA nie chce komentowaç, ile wp∏yn´∏o do niej podaƒ o
zgod´ na próby kliniczne z u˝yciem zarodkowych komórek macierzy-
stych ani kiedy b´dzie je rozpatrywaç. Ryzyko zanieczyszczeƒ zwierz´-
cych nie przekreÊla automatycznie mo˝liwoÊci podania ludziom komó-
rek zatwierdzonych przez amerykaƒski rzàd. W przesz∏oÊci zgod´ FDA
uzyska∏y ksenotransplantacje Êwiƒskich zastawek sercowych, a nawet
przeszczep szpiku pawiana do organizmu cz∏owieka. Rzecznik FDA za-
znaczy∏ jedynie, ˝e decyzje oparte b´dà na naukowej wartoÊci propono-
wanych doÊwiadczeƒ, nie zaÊ na przes∏ankach politycznych.
Christine Soares
Brudne i obumierajàce, ale z amerykaƒskim atestem?
Problemy z zanieczyszczeniem i genetycznymi nieprawid∏owoÊciami linii zarodkowych
komórek macierzystych nie mogà wstrzymywaç prac nad ich wykorzystaniem w terapii.
LUDZKIE ZARODKOWE komórki macierzyste hodowane
w laboratoriach zosta∏y zanieczyszczone czàsteczkami
pochodzàcymi ze wspierajàcych ich wzrost komórek mysich
i mogà si´ okazaç nieprzydatne do leczenia ludzi.
Wyszukiwarka
Podobne podstrony:
osobista ekipa naprawcza id 341 Nieznany
Kom macierzyste
Kom macierzyste
Kom macierzyste
Indukowane pluripotencjalne kom macierzyste
Kom macierzyste
kom macierz i czynnik wzrostu
Medycyna oparta o kom macierzyste
Kom macierzyste w udarze mozgu
RAID konfiguracja macierzy dyskowj, Komputer - naprawa
Biol kom cz 1
Kom rka
Ustawa z dnia 25 06 1999 r o świadcz pien z ubezp społ w razie choroby i macierz
macierz BCG
macierze 2
PODSTAWY MARKETINGU WSZIB KRAKÓW Sprzedaż osobista Promocja sprzedaży
więcej podobnych podstron