f + s = n + 1
suma maksymalnej liczby faz f , jakie mog wspó
ł
istnie w stanie równowagi,
oraz liczby stopni swobody s jest równa liczbie sk
ł
adników n plus jeden (izobaryczne).
Wykresy równowagi fazowej
Reguła faz Gibbsa
o budowie fazowej stopów (jakie i ile faz współistnieje) w stanie równowagi decyduj trzy
parametry: temperatura, ci nienie oraz st enie poszczególnych składników (skład chemiczny),
- ograniczamy si do układów (stopów) dwuskładnikowych oraz warunków izobarycznych,
s = n – f + 1
lub
f
max
= n + 1
gdy:
s = 0
układ – zbiór faz w stanie stałym, ciekłym lub gazowym zajmuj cy, przy okre lonej temperaturze
i ci nieniu, stał obj to ,
stopnie swobody (s) – liczba parametrów okre laj cych stan termodynamiczny układu (temperatura,
ci nienie, st enie składników), które niezale nie mog ulec zmianie nie wytr caj c
układu ze stanu równowagi,
układ jest niezmienny, gdy współistnieje ze sob maksymalna liczba faz (s = 0)
(zmiana dowolnego parametru bez zmniejszenia liczby faz wytr ci układ ze stanu równowagi)
(+)
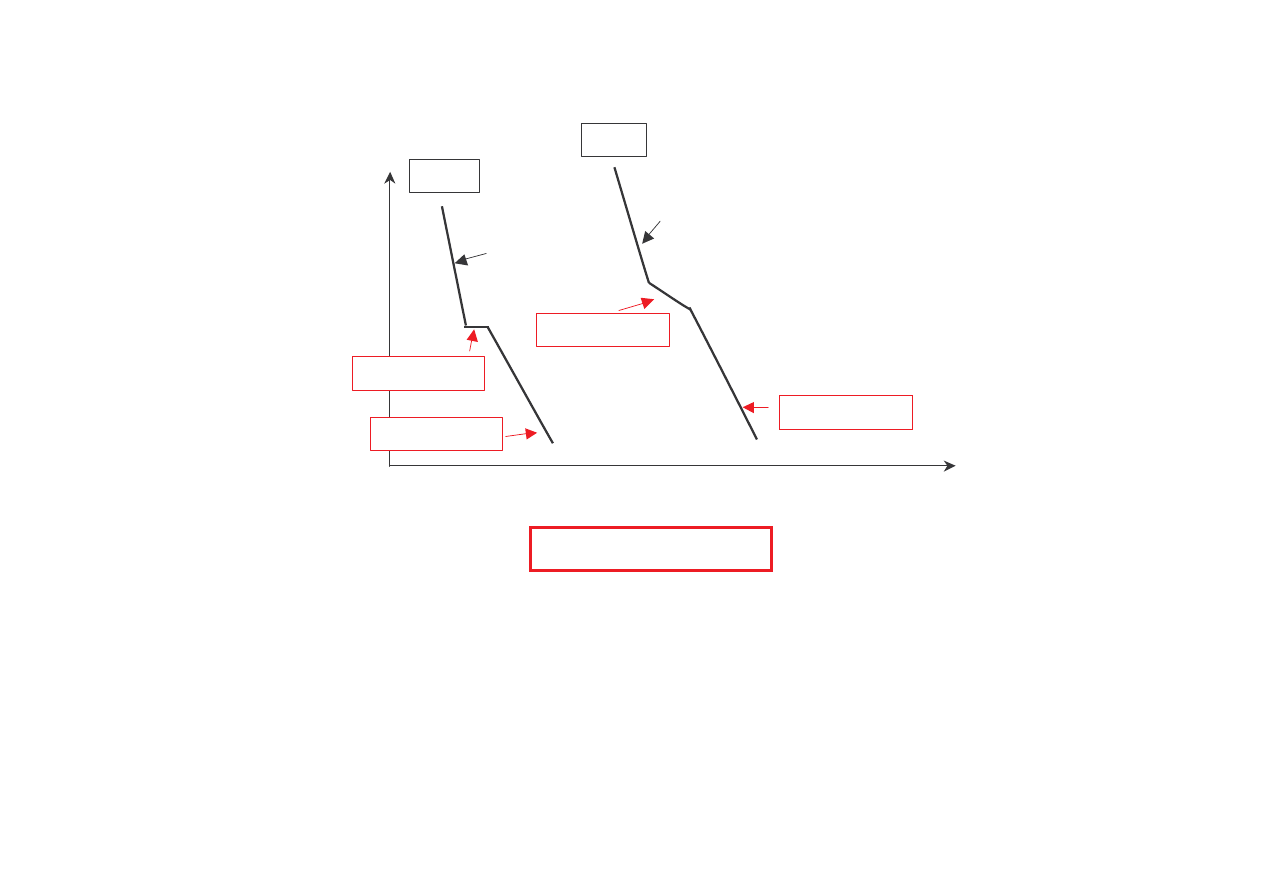
Krzywe chłodzenia dla czystego pierwiastka A oraz stopu dwuskładnikowego A-B
Czas
Te
m
pe
ra
tu
ra
stop pierwiastków A i B
pierwiastek A
T
tA
T
L
T
S
f = 1
s = 1
f = 2
s = 0
f = 2
s = 1
n = 1
n = 2
s = - f + n + 1
f = 2
s = 2
(za B. Ku nick )
••••
dla uk
ł
adu dwusk
ł
adnikowego:
- gdy w stanie równowagi
f = 1
s = 2
(temperatura i st enie mog ulega zmianie)
- gdy w stanie równowagi
f = 2
s = 1
(temperatura lub st enie mo e ulega zmianie)
- gdy w stanie równowagi
f = 3
s = 0
(temperatura = const, st enie = const)
- stan równowagi w przypadku
f > 3
jest niemo liwy.
(+)
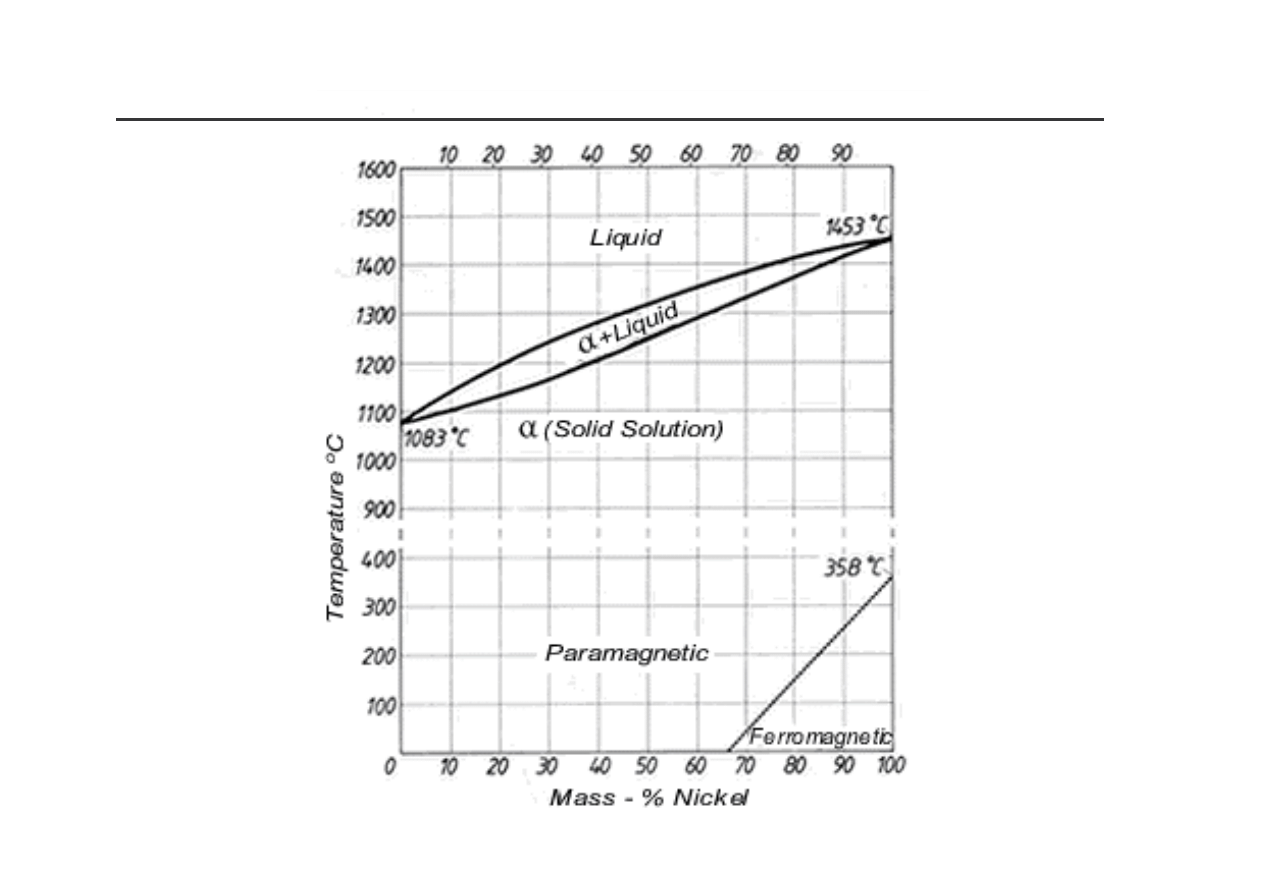
Wykres równowagi fazowej układu dwuskładnikowego:
całkowita rozpuszczalno
składników w stanie ciekłym oraz w stanie stałym
(
L
)
αααα
- roztwór stały ci gły
Cu
Ni
przykładowo:
układ Cu-Ni
(www.copper.org/applications/cuni/txt_DKI.html)
(+-)
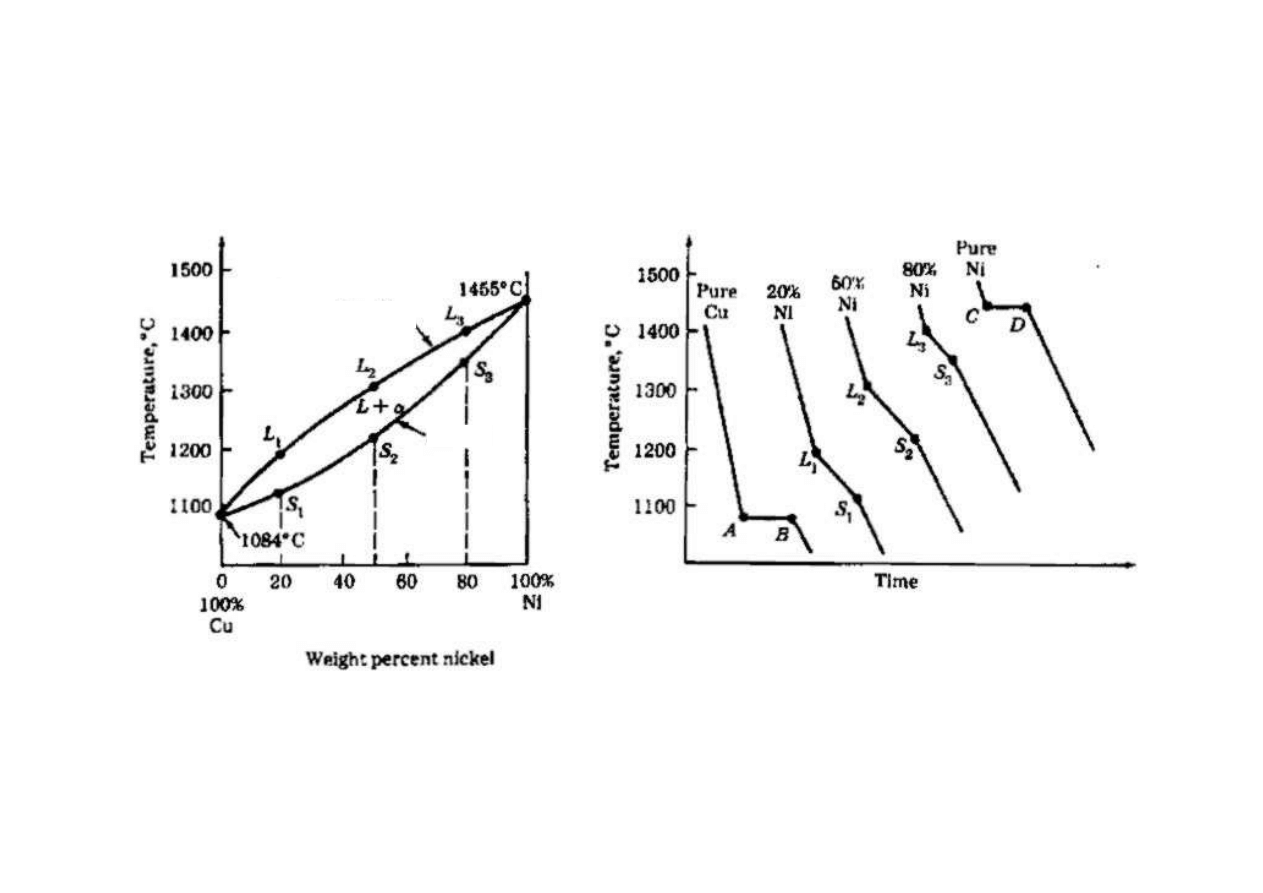
Otrzymywanie wykresu na podstawie krzywych chłodzenia
αααα
L
likwidus
solidus
(www.ce.berkeley.edu/~paulmont/CE60/alloys/sld005.htm)
(+-)
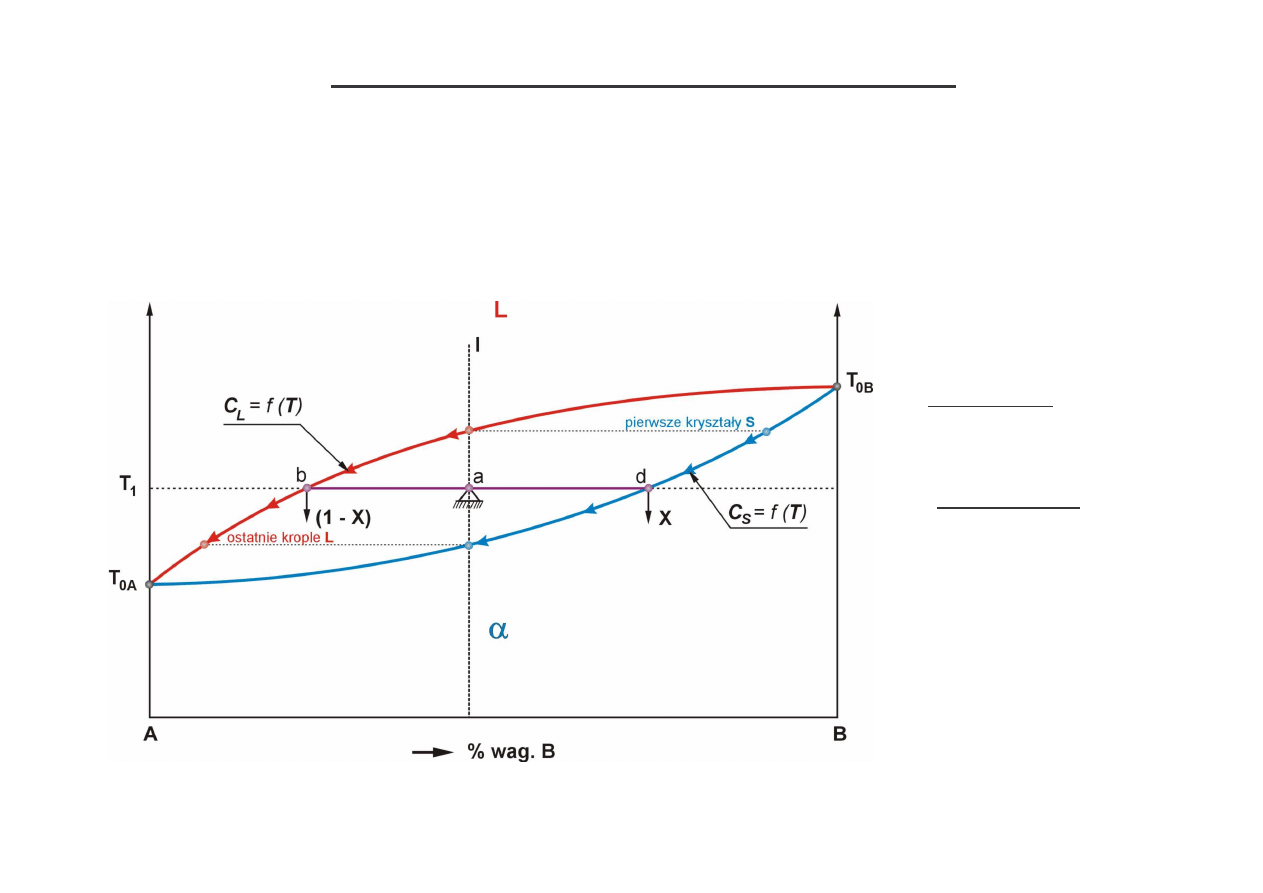
Wła ciwo ci konody – stwierdzenia reguły d wigni
konoda
– odcinek izotermy (bd) zawarty w obszarze dwufazowym,
1) ko ce konody wskazuj jakie fazy współistniej oraz jaki jest ich skład chemiczny,
2) rozpatrywany stop dzieli konod na odcinki proporcjonalne do udziału faz w stopie,
traktuj c konod jak mechaniczn d wigni podpart st eniem naszego stopu:
X – udział fazy stałej (
αααα
), (1 – X) – udział fazy ciekłej (L), gdzie „1”- ci ar całego stopu,
równanie momentów (udziały traktujemy jak siły): X · ad = (1 – X) · ab
X = ab/bd
oraz
wi c:
(1 – X) = ad/bd
udział fazy
αααα
:
%
αααα
= (c
a
– c
b
)/(c
d
– c
b
) · 100%
udział cieczy L:
%L = (c
d
– c
a
)/(c
d
– c
b
) · 100%
k = c
S
/
c
L
zwykle
<
4
równowagowy współczynnik segregacji:
dla stopu (I) w temp. T
1
:
(+!)
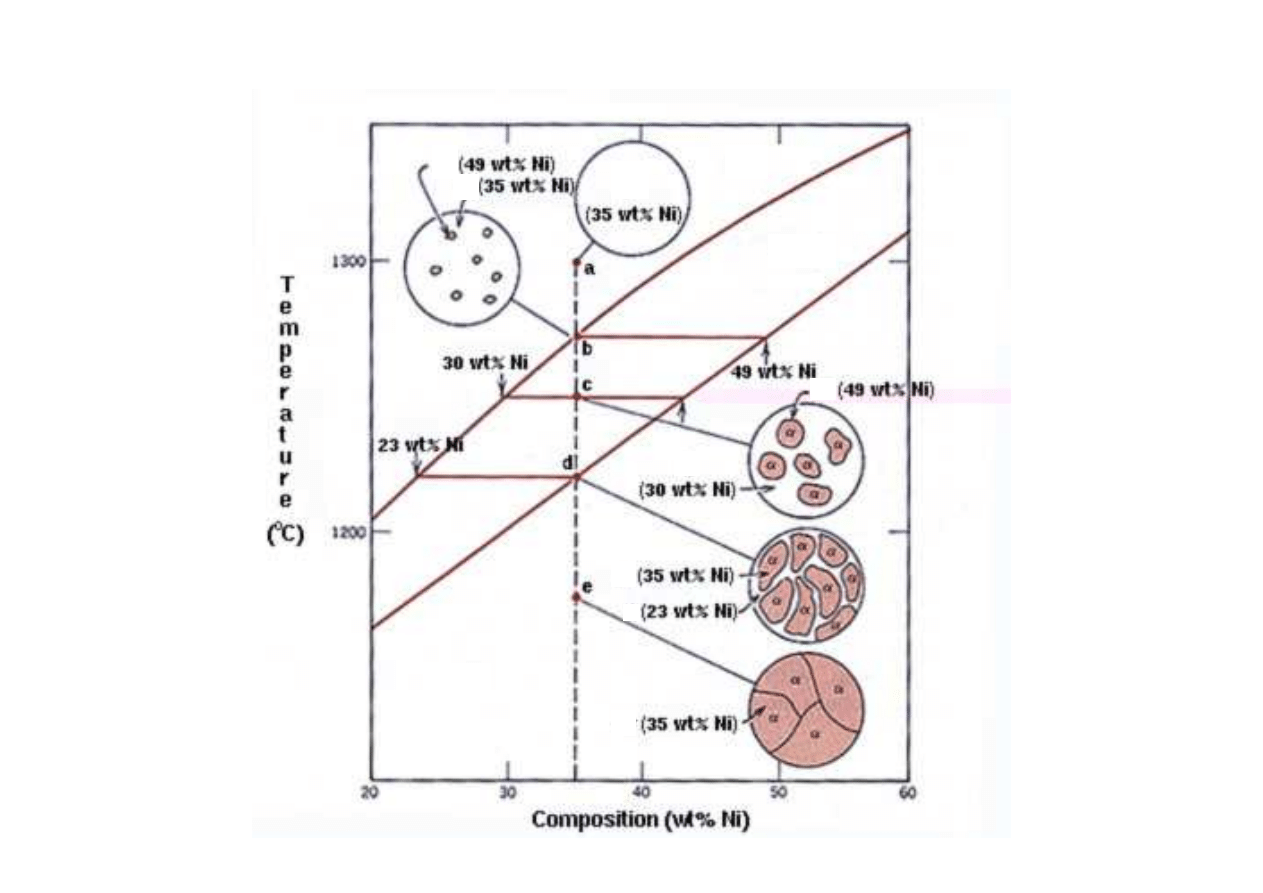
Kolejne fazy krzepni cia przykładowego stopu
(www.sv.vt.edu/classes/MSE2094)
(+-)
L
L
αααα
+
L
αααα
αααα
L
αααα
L
αααα
L
αααα
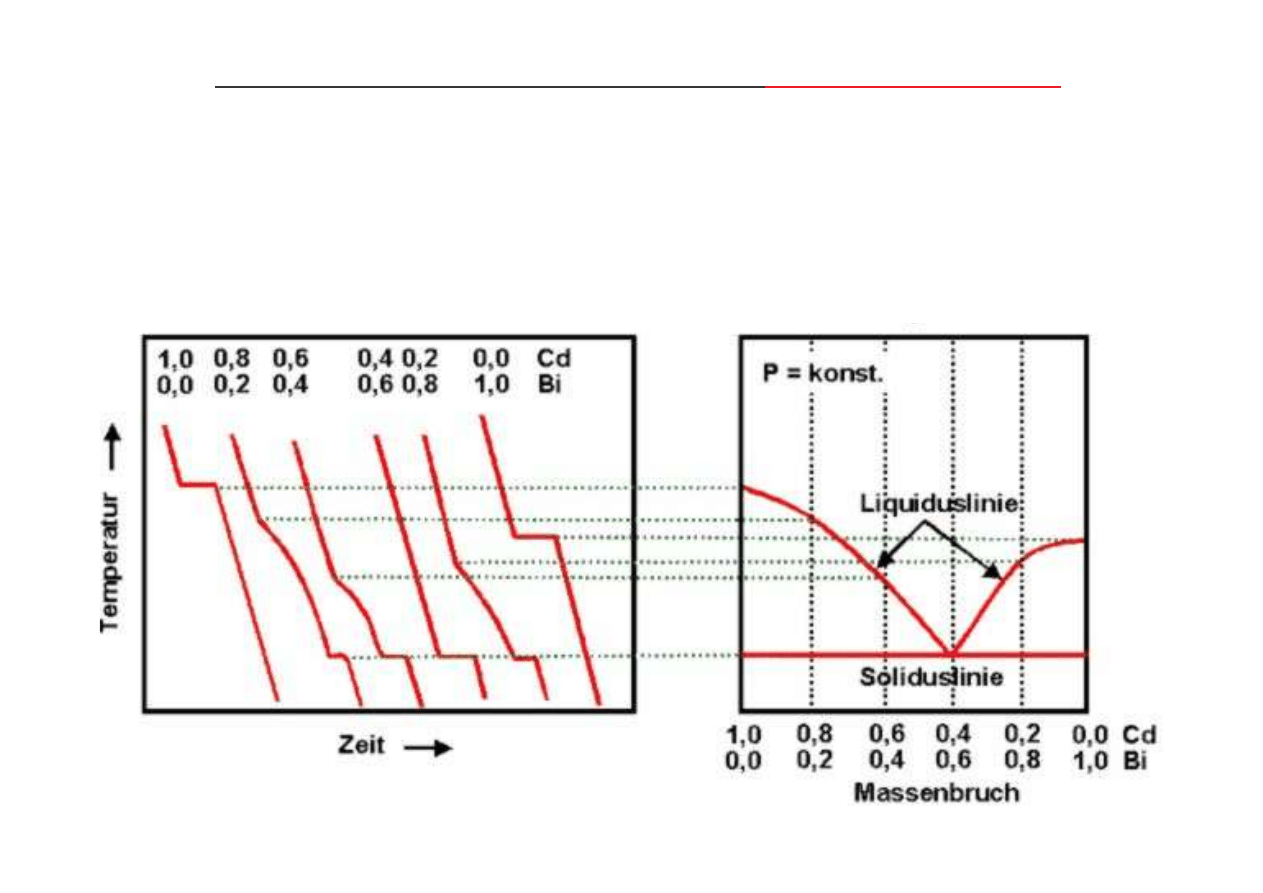
otrzymywanie wykresu fazowego układu Bi-Cd na podstawie krzywych chłodzenia stopów:
Wykres równowagi fazowej z izotermiczn
przemian eutektyczn
składniki układu:
- nie rozpuszczaj si w stanie stałym,
- nie tworz faz po rednich,
- nie s polimorficzne.
(http://ac16.uni-paderborn.de/lehrveranstaltungen/)
krzywe chłodzenia:
wykres fazowy:
(+-)
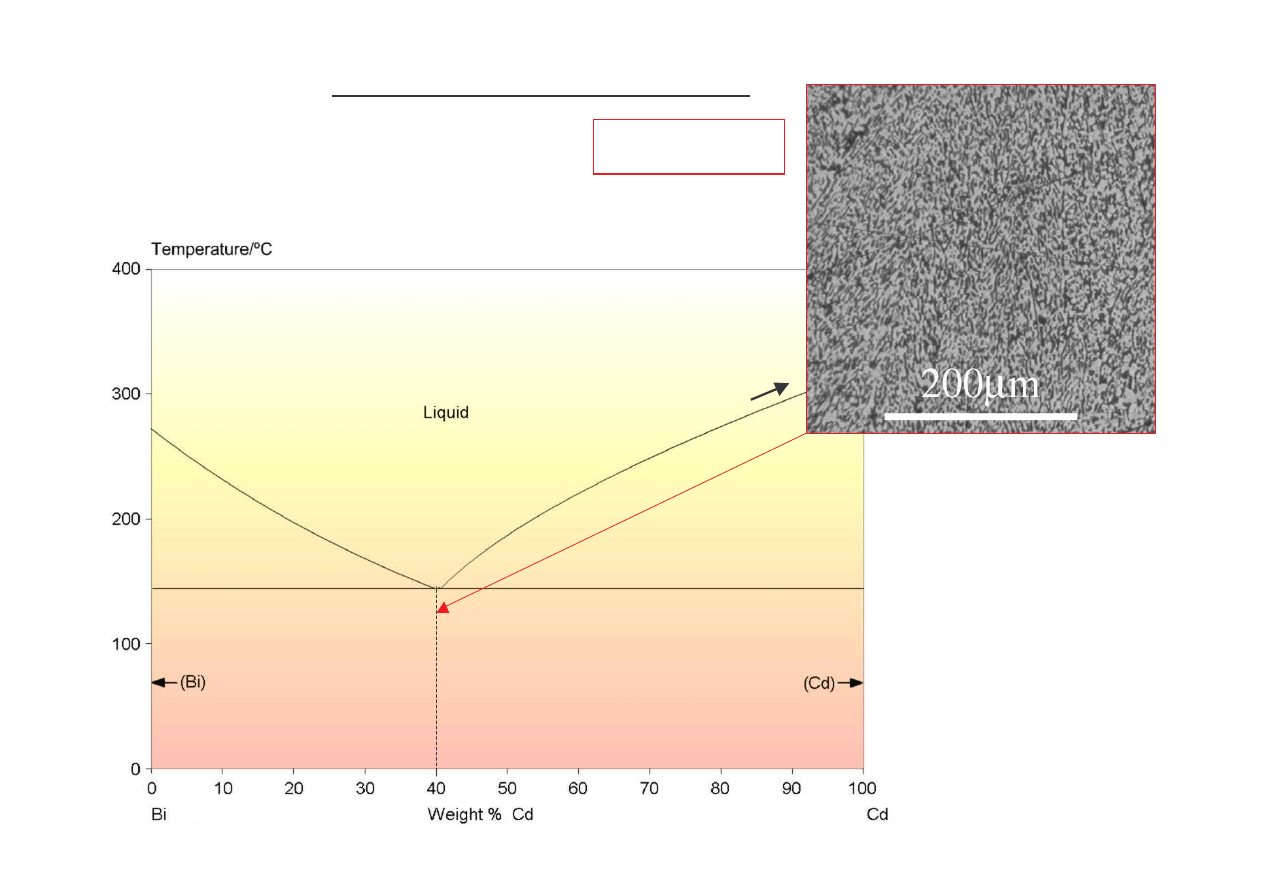
Bi + (Bi + Cd)
(B
i +
C
d)
Cd + (Bi + Cd)
L + Bi
L + Cd
L
Wykres równowagi układu Bi-Cd
271
321
144
Równanie izotermicznej przemiany eutektycznej:
L
E
↔
↔
↔
↔
(Bi + Cd)
E
mikrostruktura eutektyczna
(ciemny Cd, jasny Bi)
(prof. T.W. Clyne)
(www.doitpoms.ac.uk)
(+-)

BiCd40
(eutektyczny)
BiCd20
(przedeutektyczny)
(prof. T.W. Clyne)
(Bi + Cd)
Bi
Cd
Cd
Bi
(+-)
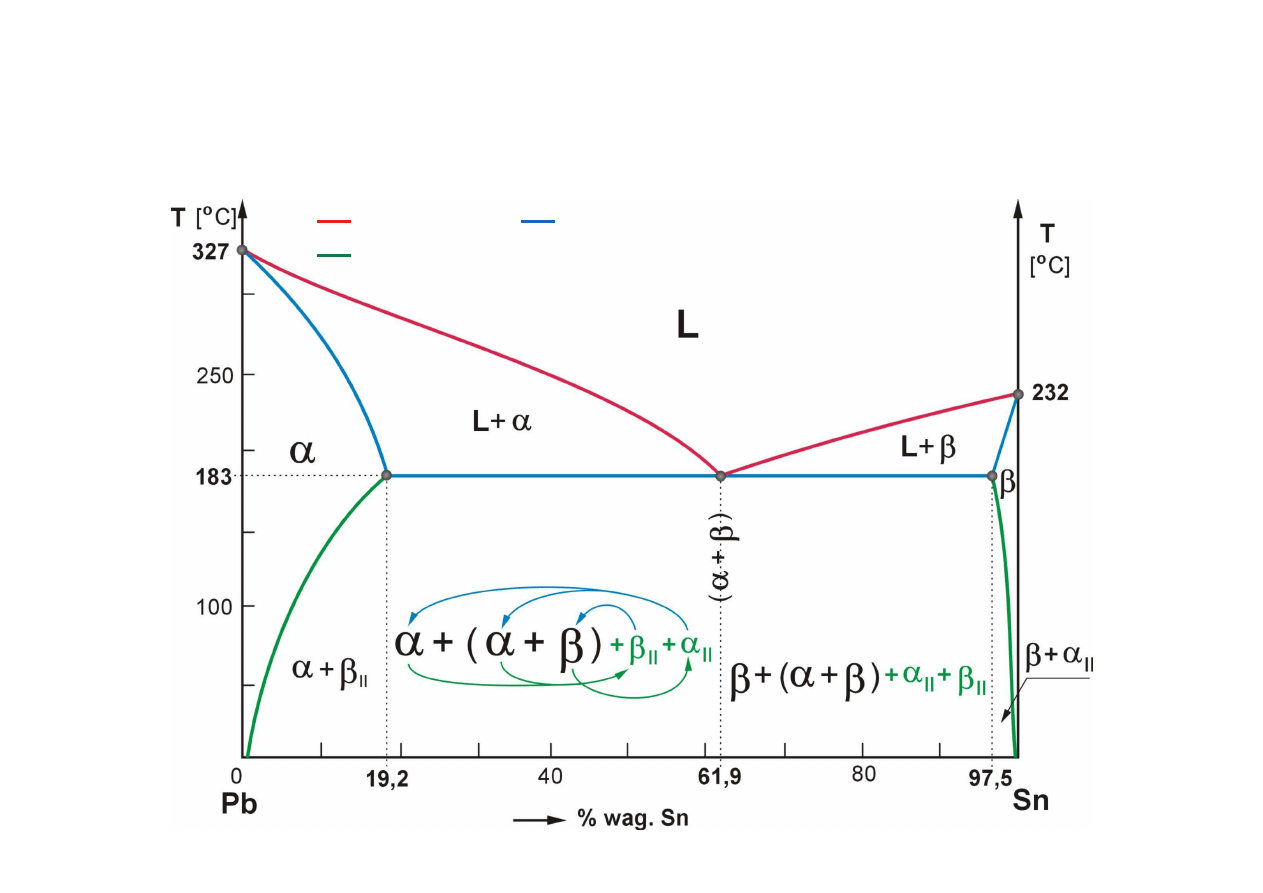
Przykład strukturalnego opisu wykresu równowagi (układ Pb-Sn)
fazy stałe:
αααα
- roztwór stały podstawowy, ró now złowy, graniczny Pb(Sn),
ββββ
- roztwór stały podstawowy, ró now złowy, graniczny Sn(Pb),
linie likwidus,
linie solidus,
linie solwus (linie granicznej rozpuszczalno ci),
C
D
E
F
G
A
B
(+!)
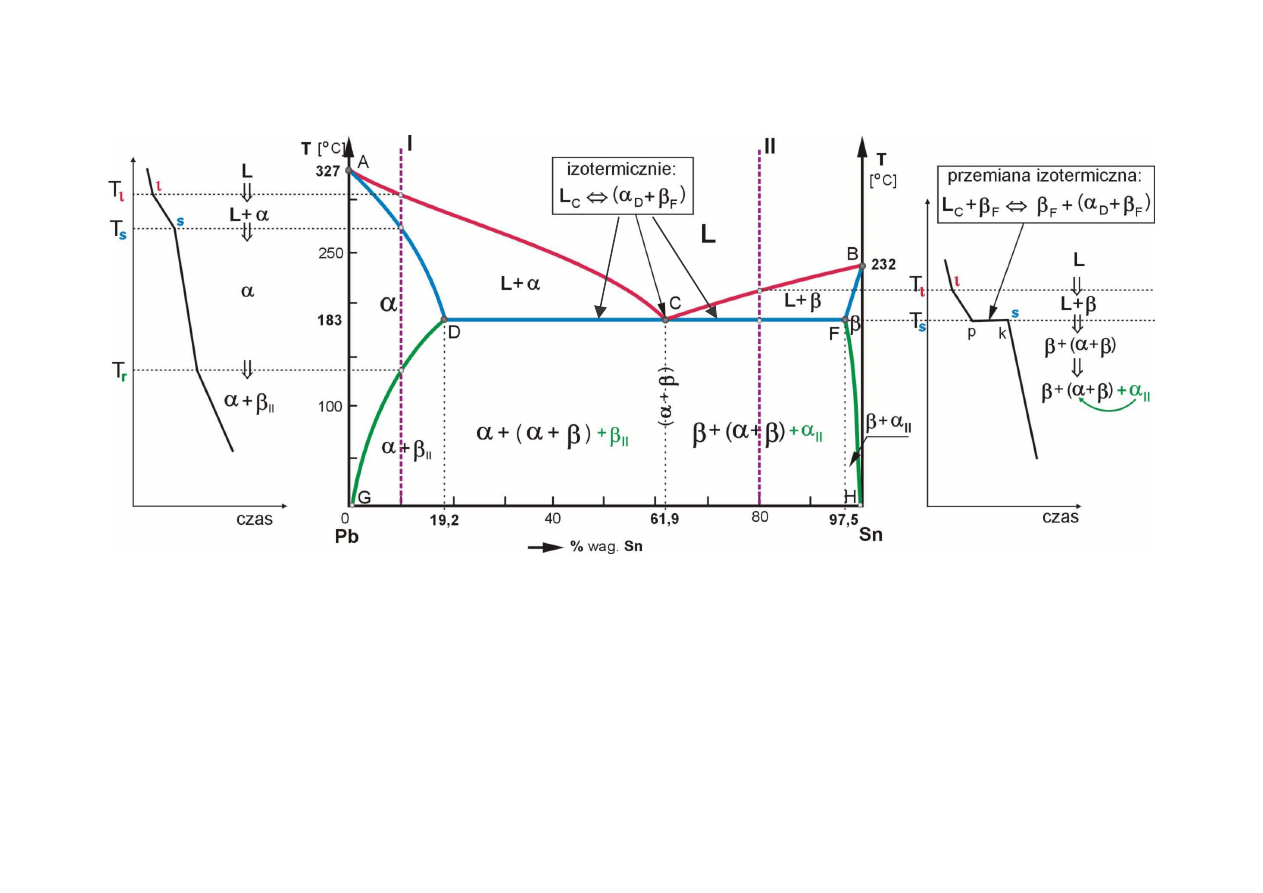
Przykład analizy stopów wykresu równowagi (układ Pb-Sn)
(
αααα
+
ββββ
) – eutektyczna mieszanina faz, krystalizuj ca w stałej temperaturze (s=0) –
składnik struktury
,
αααα
II
,
ββββ
II
-
fazy drugorz dowe
, krystalizuj ce po przekroczeniu linii granicznej rozpuszczalno ci,
- w stopach bez eutektyki jako
faza strukturalnie wolna
(zwykle na granicach ziaren),
- w stopach z eutektyk zwykle nie tworzy nowych osobnych wydziele lecz tylko pogrubia
wydzielenia wcze niej istniej ce,
- wszystkie stopy od D do F ko cz krzepni cie izotermiczn przemian eutektyczn , w której ciecz
(po osi gni ciu st enia punktu C) krzepnie w postaci eutektycznej mieszaniny faz,
(+!)

stop eutektyczny (ok. 38% Sn)
- eutektyka płytkowa (faza
β
ciemniejsza)
stop nadeutektyczny (ok. 60% Sn)
ββββ
(
strukturalnie wolna)
(
αααα
+
ββββ
)
(
αααα
+
ββββ
)
stop ok. 97% Sn; na granicach ziaren fazy
ββββ
(ciemna)
wydzielona faza
αααα
II
(jasna)
αααα
II
ββββ
Struktury wybranych stopów układu Pb-Sn:
(www.scielo.br) – C. S. Kiminamib
(www.sv.vt.edu/classes/MSE2094)
(+-)

stop przedeutektyczny (ok. 25% Sn)
(
αααα
+
ββββ
)
αααα
(
faza strukturalnie wolna)
stop eutektyczny (ok. 38% Sn)
Struktury po bardzo wolnym chłodzeniu
(inna budowa mieszaniny eutektycznej)
(www.scielo.br) – C. S. Kiminamib
(
składnik struktury)
(-+)
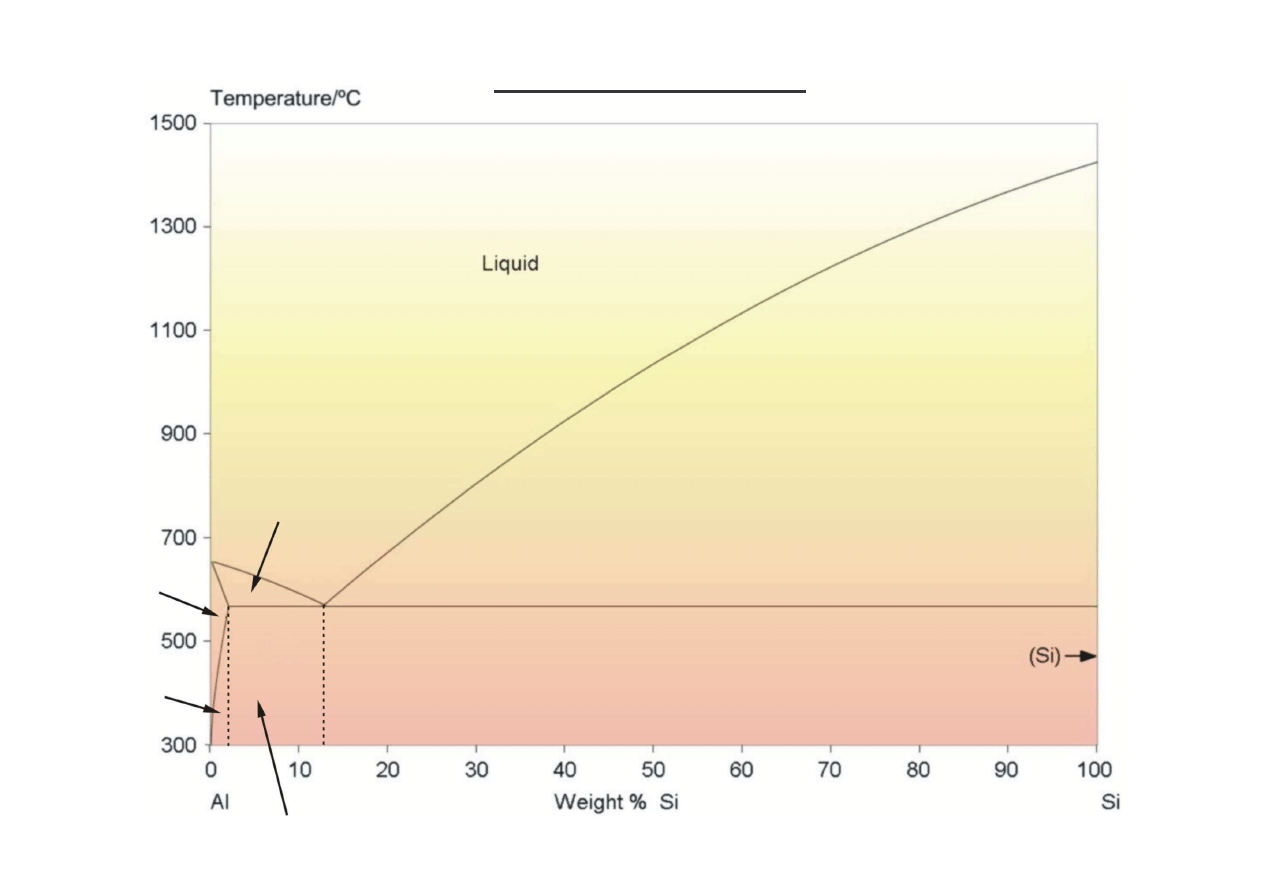
αααα
Si + (
αααα
+ Si)
(
αααα
+
S
i)
αααα
+ (
αααα
+ Si) +
Si
II
αααα
+ L
L
L + Si
αααα
+ Si
II
Wykres równowagi Al-Si
1414
660
577
12,6
1,65
(www.doitpoms.ac.uk)
A
B
C
D
E
(+)

stop eutektyczny niemodyfikowany, (
αααα
+ Si)
stop eutektyczny, nieprawidłowo modyfikowany
stop przedeutektyczny modyfikowany,
αααα
+ (
αααα
+ Si)
stop zaeutektyczny niemodyfikowany, Si + (
αααα
+ Si)
(-+)
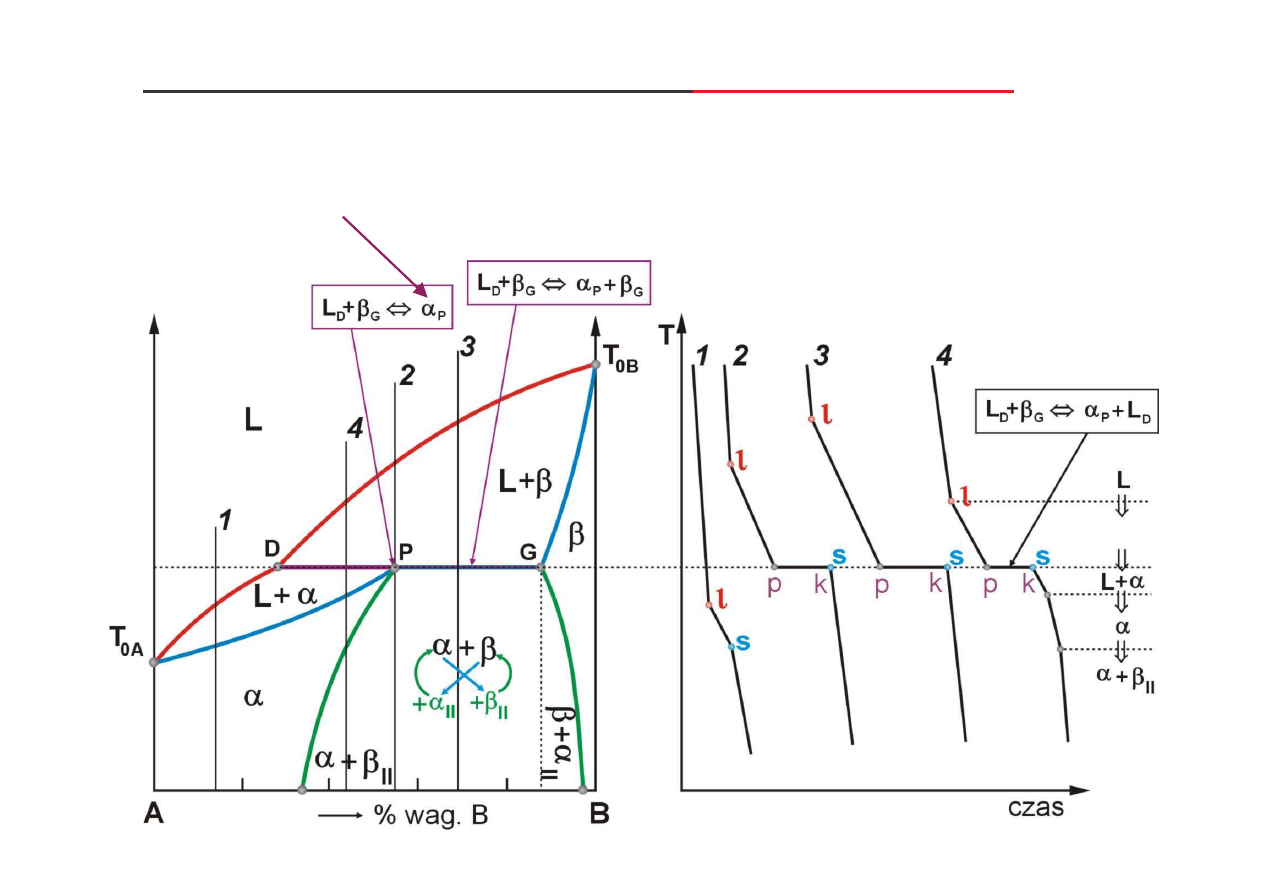
Wykres równowagi fazowej z izotermiczn
przemian perytektyczn
składniki układu:
- rozpuszczaj si w stanie stałym, tworz c roztwory stałe podstawowe graniczne,
- nie tworz faz po rednich,
- nie s polimorficzne.
perytektyka
jest faz (tutaj roztwór
αααα
) powstaj c w wyniku swoistej reakcji dwóch faz (tutaj L oraz
ββββ
),
(wi cej, patrz: R. Haimann, cz. 1)
(+)
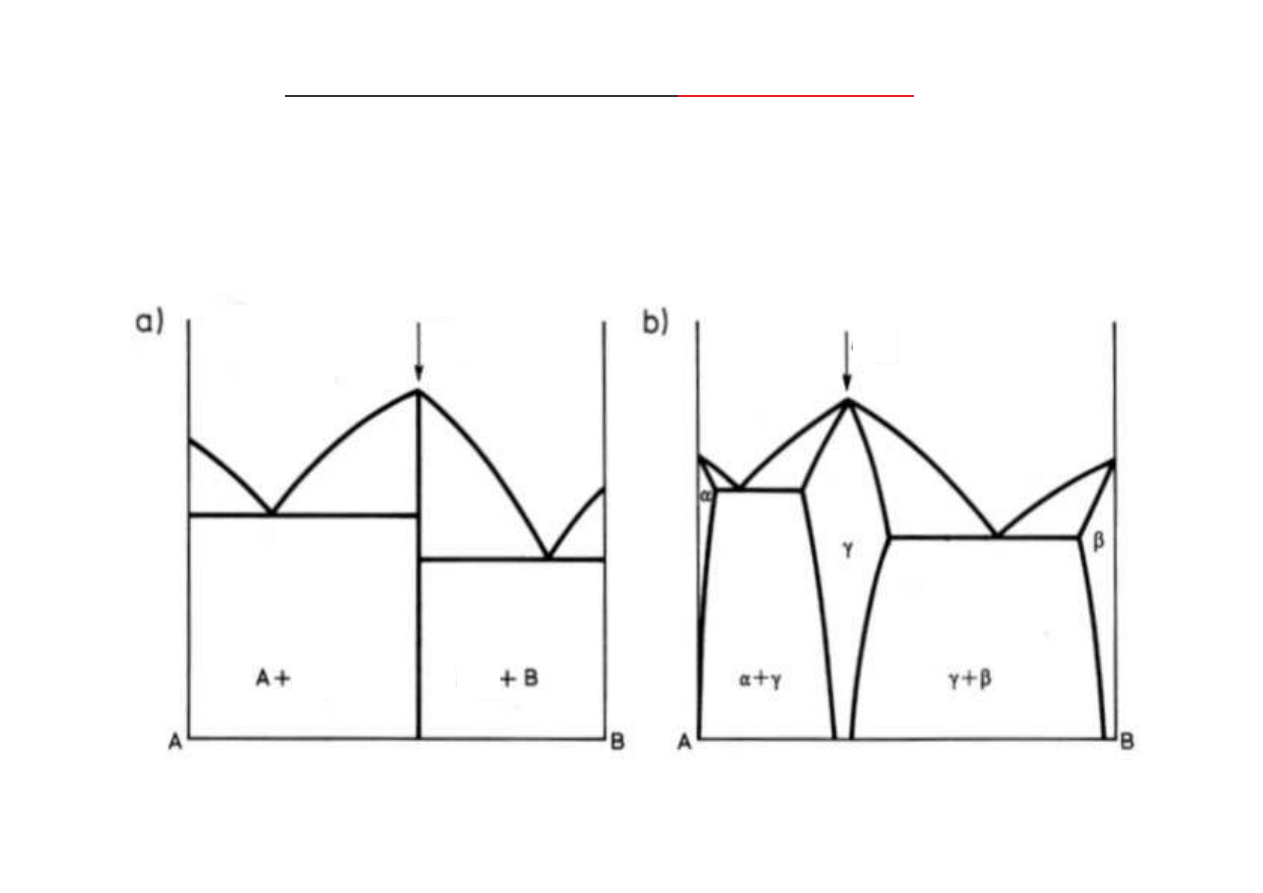
Zło one wykresy równowagi z
fazami po rednimi
wykresy z faz po redni trwał
(krystalizuj c bezpo rednio z cieczy)
a) faza wyst puje przy ci le okre lonym stosunku stechiometrycznym (A
n
B
m
),
b) faza wyst puje w pewnym zakresie st e jako
roztwór stały wtórny
– A
n
B
m
(A,B),
fazy po rednie dziel wykres zło ony na wykresy proste, które rozpatrujemy niezale nie,
A
n
B
m
A
n
B
m
A
n
B
m
A
n
B
m
(+)
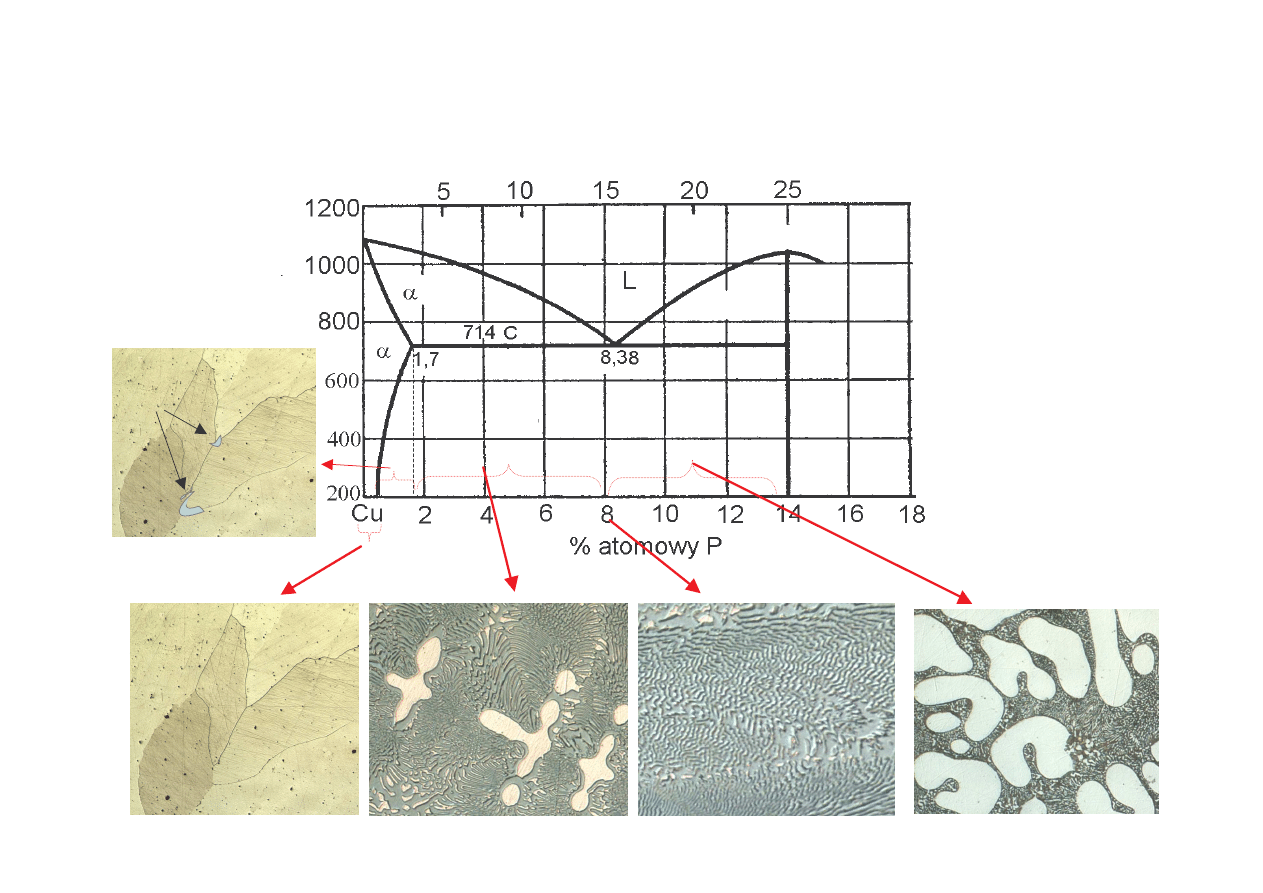
Cu
3
P
L + Cu
3
P
°
% masowy P
°C
+ L
+ Cu
3
P
αααα
(
αααα
+ Cu
3
P)
(
αααα
+ Cu
3
P)
(
αααα
+ Cu
3
P)
αααα
Cu
3
P
αααα
Cu
3
P
II
(za B. Ku nick )
przykład wykresu z trwał faz po redni (mi dzymetaliczn )
układ Cu-P:
(+-)
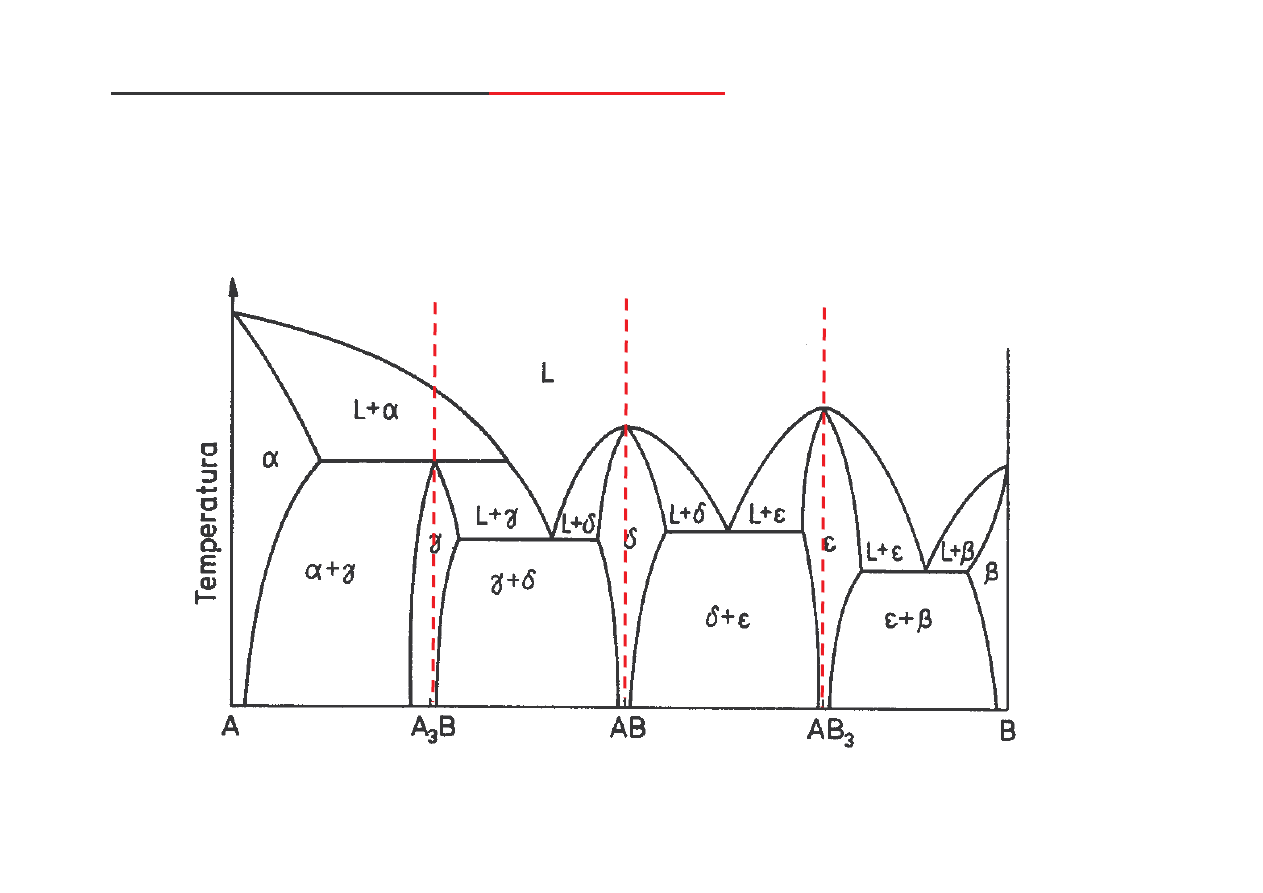
Zło ony wykres równowagi z
fazami po rednimi
składniki układu:
• rozpuszczaj si w stanie stałym, tworz c roztwory stałe podstawowe graniczne,
• tworz fazy po rednie: AB, AB
3
(trwałe) oraz A
3
B (nietrwała) - wyst puj jako roztwory stałe wtórne,
• nie s polimorficzne.
(za B. Ku nick )
(+-)
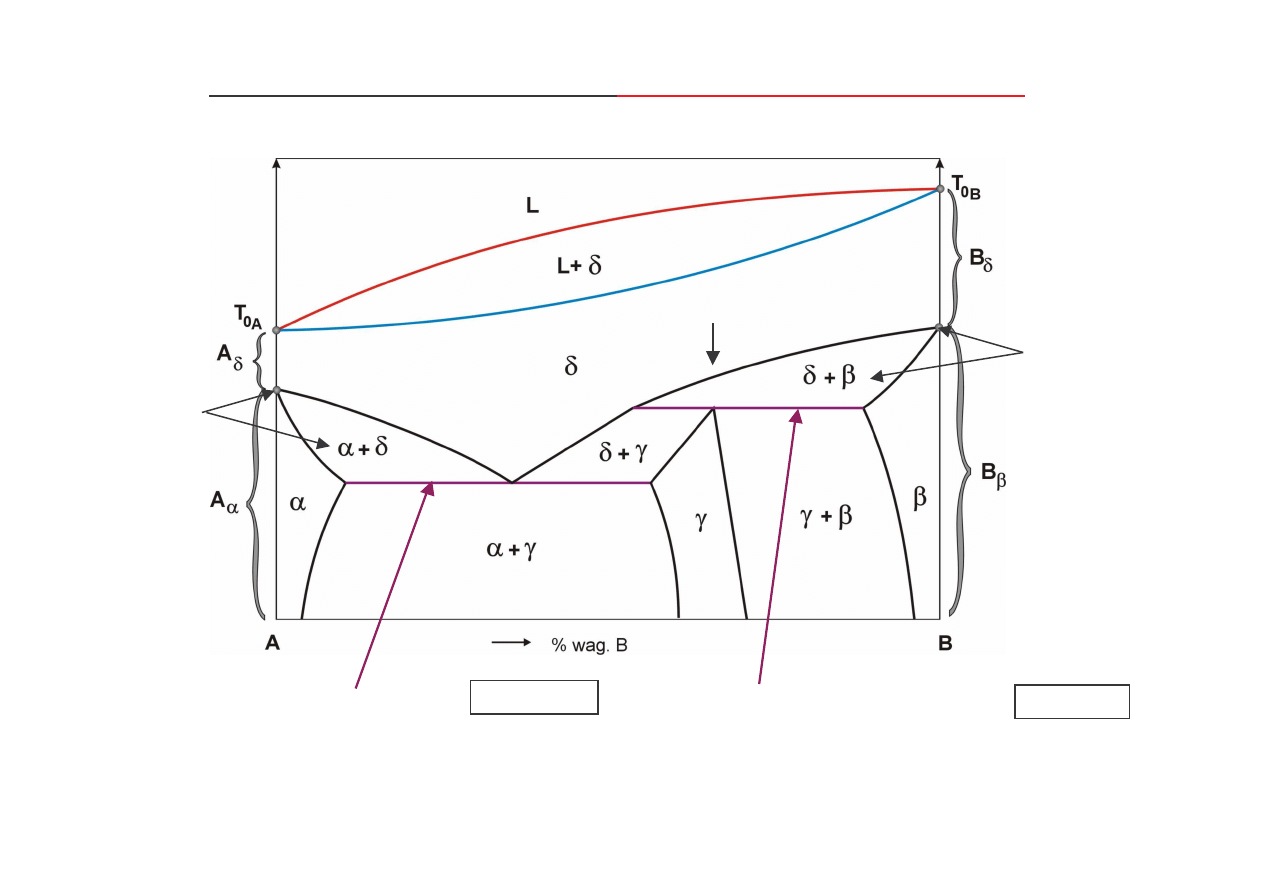
Zło one wykresy równowagi ze
składnikami wielopostaciowymi
wykresy składaj si z wykresów prostych poło onych jeden nad drugim,
izotermiczna przemiana
eutektoidalna
:
δδδδ ↔
↔
↔
↔
(
αααα
+
γγγγ
)
izotermiczna przemiana
perytektoidalna
:
δδδδ
+
ββββ ↔
↔
↔
↔ γγγγ
przemiana
alotropowa
przemiana
alotropowa
δδδδ
-
roztwór stały podstawowy ci gły od
A
δδδδ
(B)
do
B
δδδδ
(A)
,
αααα
oraz
ββββ
-
roztwory stałe podstawowe graniczne
A
αααα
(B)
oraz
B
ββββ
(A),
γγγγ
-
roztwór stały wtórny
A
n
B
m
(A,B)
A
n
B
m
{
fazy stałe:
C
D
E
F
G
H
K
P
M
N
(+)
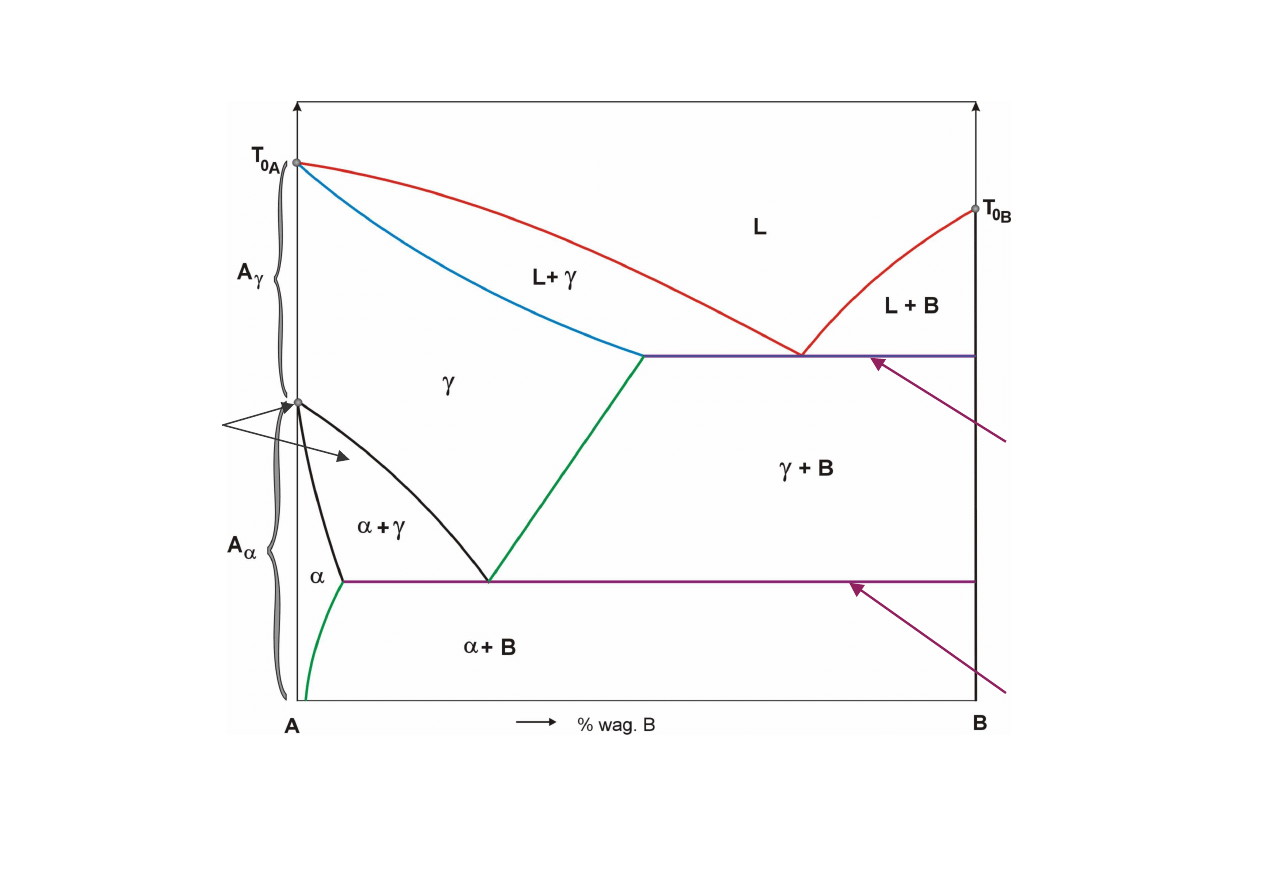
γγγγ
-
roztwór stały podstawowy graniczny
A
γγγγ
(B)
,
αααα
-
roztwór stały podstawowy graniczny
A
αααα
(B),
B -
czysty składnik
{
fazy stałe:
przemiana
eutektyczna
przemiana
eutektoidalna
przemiana
alotropowa
C
D
E
F
G
H
K
(+)
Wyszukiwarka
Podobne podstrony:
WykresDocelowy ppt
MTZ W5 fazy ppt
wykresy ppt
WykresDocelowy ppt
MTZ W5 fazy ppt
MTZ Wyklad2 ppt
w6 diagnoza spoleczna ppt
W6 PPT
Logika W6 2013 14 ppt
MTZ Wyklad3 ppt
MTZ Wyklad4 ppt
MTZ Wyklad1 ppt
epi w6 opis wektorow ppt
(w6 1) Co to jest podpis elektroniczny ppt
w6 Gazy rzeczywiste, ciecze, cia│a sta│e ľ ppt
więcej podobnych podstron