Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadania z chemii (7)
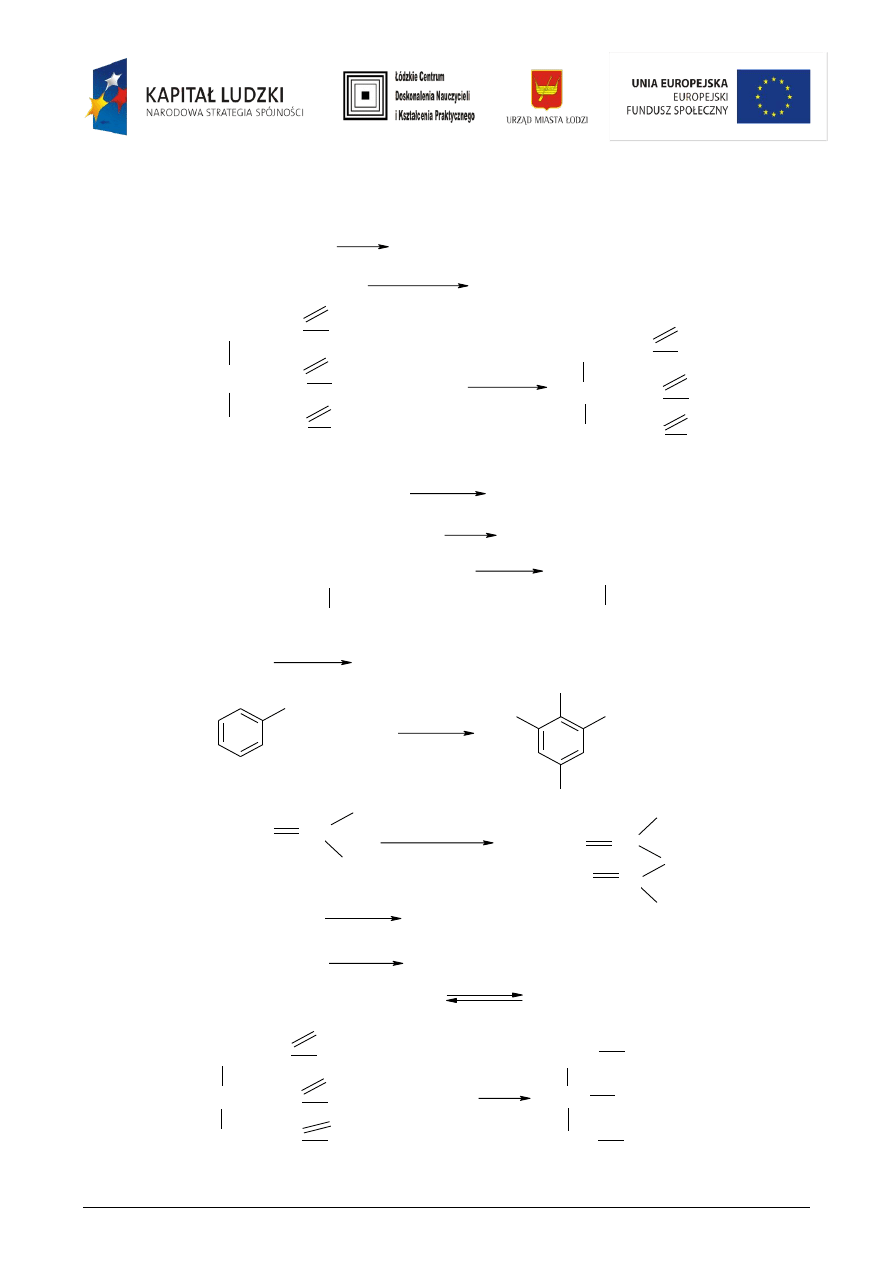
Informacja do zadań 1 i 2
HCHO + Ag
2
O
HCOOH +
CH
3
-CH
2
-OH + O
2
oksydaza
CH
3
COOH + H
2
O
CH
3
-CH
2
-CHO
CH
3
-CH
2
-COOH
CH
3
- CO-CH
3
temp.
CH
3
Cl +
C
6
H
12
O
6
enzym
C
2
H
5
OH +
CO
2
HNO
3
H
2
SO
4
OH
NO
2
NO
2
O
2
N
NH
2
NH
2
temp.
NH
2
NH
NH
2
NH
3
C
6
H
6
Pt
C
6
H
12
CH
3
- CH
2
-COOH + CH
3
OH
CH
3
-CH
2
- COOCH
3
+ H
2
O
H
2
SO
4
OH
OH
OH
C
15
H
31
COONa
C
17
H
33
COONa
1.
2Ag
2.
3.
CH
2
-O -C
CH - O -
CH
2
- O - C
C
O
O
O
C
17
H
33
C
17
H
33
C
17
H
35
+ 2H
2
Pt
CH
2
-O -C
CH - O -
CH
2
- O - C
C
O
O
O
C
17
H
35
C
17
H
35
C
17
H
35
4.
+ 2Cu(OH)
2
+ Cu
2
O + 2H
2
O
5.
+
3I
2
+ 4NaOH
CHI
3
+ CH
3
COONa +3H
2
O + 3NaI
6.
CH
3
- CH -CH
2
- Cl +2Na
CH
3
CH
3
- CH - CH
2
- CH
3
+ 2NaCl
CH
3
7.
2
2
8.
OH
+ 3
+ 3 H
2
O
9.
2
O
C
O
O
C
C
+
10.
CH
4
+ 2O
2
CO
2
+ 2H
2
O
11.
+ 3H
2
12.
13.
CH
2
-O -C
CH - O - C
O
O
O
C
15
H
31
C
15
H
31
C
17
H
33
+ 3NaOH
CH
CH
2
CH
2
2
+
H
2
O
CH2 - O - C
Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadanie 1
W chemii organicznej wiele reakcji oprócz, nazwy oznaczającej typ reakcji (np. reakcja substytucji, addycji)
nosi nazwy zwyczajowe, które są powszechnie stosowane. Przyporządkuj podane niżej nazwy reakcji
reakcjom podanym w informacji.
Lp.
Nazwa reakcji
Nr reakcji
A
Próba Tollensa
B
Próba jodoformowa
C
Reakcja nitrowania
D
Próba Trommera
E
Zmydlanie tłuszczy
F
Fermentacja octowa
G
Reakcja biuretowa
H
Próba lustra srebrnego
I
Utwardzanie tłuszczy
J
Fermentacja alkoholowa
K
Spalanie całkowite
L
Reakcja estryfikacji
M
Reakcja Wurtza
N
Reakcja uwodornienia
Zadanie 2
Wskaż, w której z podanych reakcji:
a) alkohol jest: substratem .............., a w której produktem .......................;
b) kwas karboksylowy jest reagentem ....................................;
c) metal jest substratem ............., produktem ............, a w której katalizatorem ............. .
Zadanie 3
Wskaż, który z podanych schematów przedstawia reakcje równoległe, a który następcze?
Reakcje równoległe - schemat: ........................... reakcje następcze – schemat: ......................................
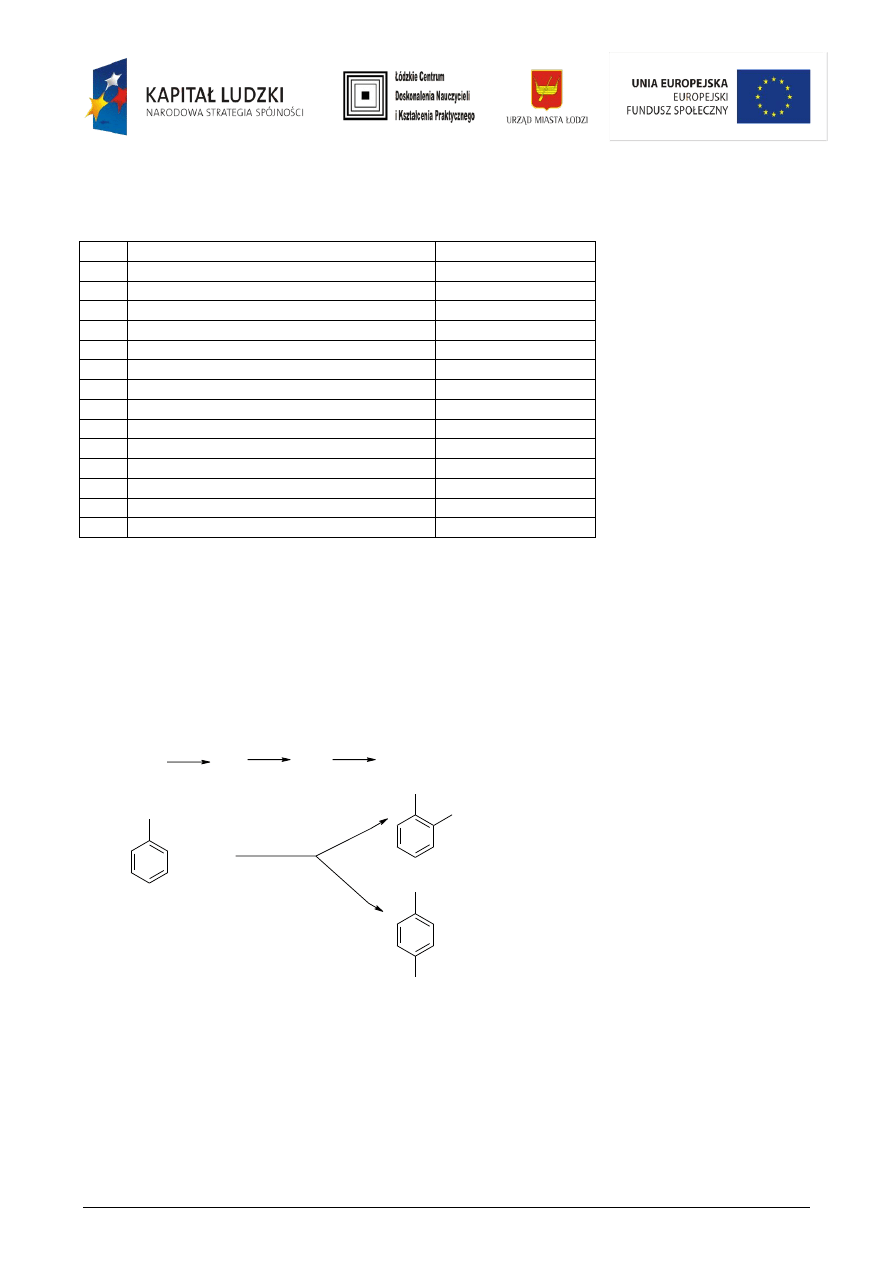
Zadanie 4
Uzupełnij podane niżej ogólne schematy reakcji hydrolizy estrów.
CaC
2
C
2
H
2
C
2
H
4
C
2
H
4
Cl
2
Br
2
Br
Br
Br
Br
FeBr
3
H
2
/Pt
Cl
2
1)
2)
Br
+
+
+
HBr
HBr
H
2
O
Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadanie 5
Ustal na podstawie podanych produktów reakcji jakie estry uległy hydrolizie
Wzór estru
Produkt I
Produkt II
CH
3
COOH
CH
3
CH
2
CH
2
OH
CH
3
CHCOONa
CH
3
CH
3
OH
C
6
H
5
COOH
CH
3
CH(CH
3
)OH
Informacja do zadania 6
Dla pochodnych dwupodstawionych benzenu – np. dibromobenzen podając nazwy stosuje się specjalne
oznaczenia położenia podstawników. Związek mający podstawniki w pozycjach 1 i 2 nosi nazwę izomeru
orto-, 1 i 3- izomeru meta- , a 1 i 4 – izomeru para- .
W. Danikiewicz „Chemia organiczna”, WSiP , Warszawa 1992
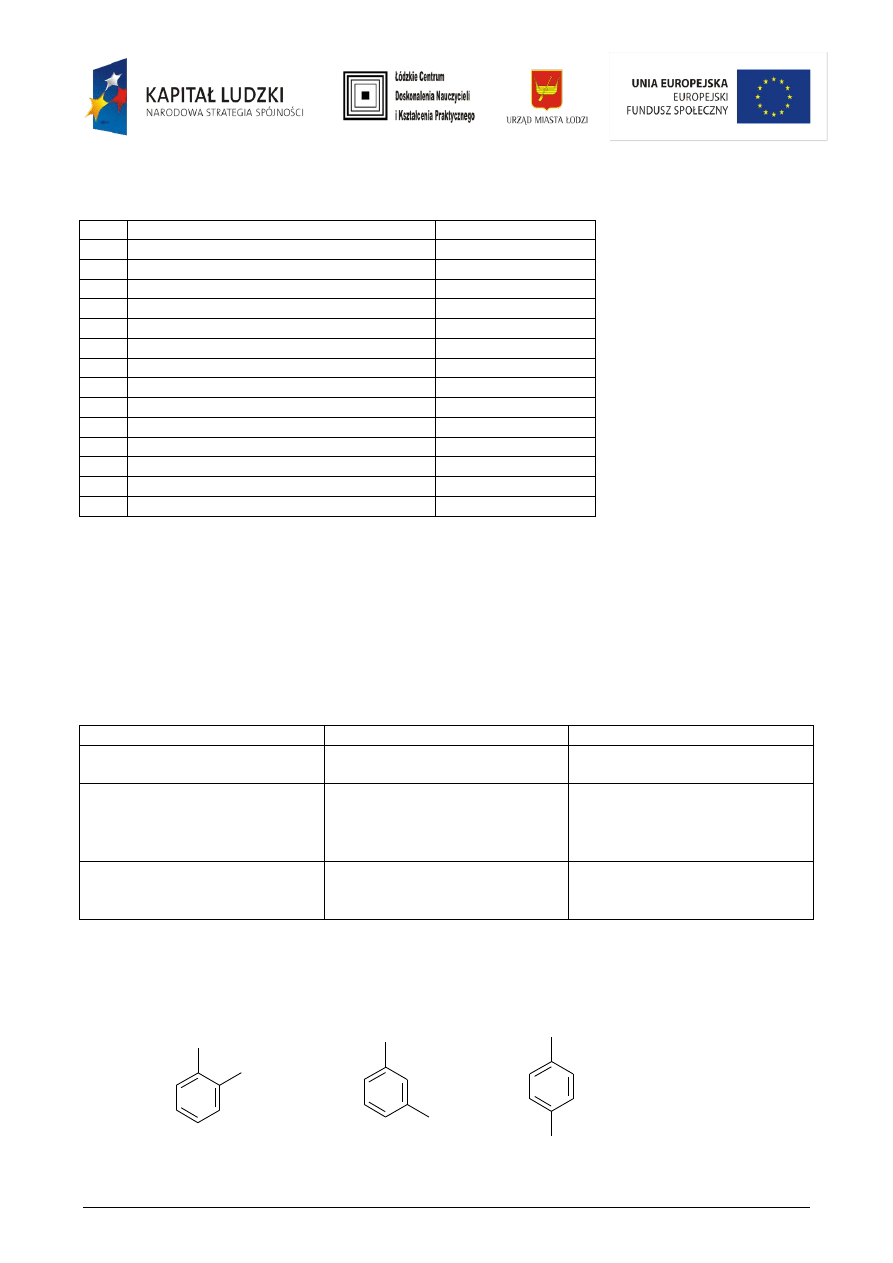
Zadanie 6
Narysuj wzory półstrukturalne wszystkich możliwych izomerów metylobromobenzenu i podaj ich nazwy
stosując nazewnictwo orto- , meta-, para-.
Wzory związków:
...........................................................................................................................................................
Nazwy związków:
.............................................................................................................................................................
Informacja do zadania 7
W reakcjach aromatycznego podstawienia wpływ na budowę produktu mają wszystkie podstawniki
związane z pierścieniem. Jedne kierują kolejny podstawnik w pozycję orto- i para- i je nazywamy
podstawnikami I rodzaju. Do nich należą: grupy alkilowe (np. – CH
3
, - C
2
H
5
), grupa hydroksylowa – OH,
atomy fluorowców ( -F, -Cl, -Br, -I) i inne. Drugi rodzaj podstawników, kieruje w pozycję meta-, i
nazywamy je podstawnikami II rodzaju. Należą do nich: grupa nitrowa (- NO
2
), grupa karboksylowa
(-COOH) oraz inne.
W. Danikiewicz „Chemia organiczna”, WSiP , Warszawa 1992
R
1
COOR
2
+ H
2
O
H
2
SO
4
R
1
COOR
2
+ NaOH
R
1
COONa
I.
......................... + R
2
OH
II.
+ .................
H
2
O

Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadanie 7
1) Na podstawie informacji uzupełnij tabelę:
Rodzaj
podstawnika
Pozycja w jaką kierowany jest
nowy podstawnik
Przykłady podstawników
I rodzaju
II rodzaju
2) Zapisz reakcje dla benzenu:
a) chlorowania, a następnie nitrowania
...............................................................................................................................................................................
...............................................................................................................................................................................
b) nitrowania, a następnie chlorowania
...............................................................................................................................................................................
...............................................................................................................................................................................
3) Podaj nazwy systematyczne powstałych w reakcjach produktów.
a) ..........................................................................................................................................................................
b) .........................................................................................................................................................................
Zadanie 8
Wpisz w miejsce liter A,B, C, D wzory półstrukturalne związków, które biorą udział w reakcjach
przedstawionych schematem:
H
2
O p, T Cl
2
/Fe NH
3
NaOH
CaC
2
A
B
C
C
6
H
5
NH
3
+
Cl
D
Zadanie 9
Na podstawie podanych równań reakcji uszereguj występujące w nim kwasy i fenol według rosnącej mocy.
1) C
6
H
5
ONa + H
2
O + CO
2
C
6
H
5
OH + NaHCO
3
2) HCOONa + CO
2
+ H
2
O
reakcja nie zachodzi
3) C
6
H
5
ONa + HCOOH
C
6
H
5
OH + HCOONa
..............................................................................................................................................................................

Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadanie 10
Napisz, stosując wzory półstrukturalne (grupowe), równania następujących reakcji:
a) 1,2-dibromoetanu z cynkiem,
b) pentan –2-onu z wodorem,
c) benzenolu z potasem,
d) kwasu octowego z wodorem,
e) propanalu z wodorotlenkiem miedzi(II),
f) chlorometanu z roztworem wodnym wodorotlenku sodu.
a) ............................................................................................................................................................
b) ............................................................................................................................................................
c).............................................................................................................................................................
d).............................................................................................................................................................
e).............................................................................................................................................................
f) ............................................................................................................................................................
Zadanie 11
Zaprojektuj doświadczenie, którego przebieg pozwoli odróżnić etan od etenu. W tym celu:
a) napisz, jaką różnicę w budowie cząsteczek tych związków weźmiesz pod uwagę planując
eksperyment;
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
b) uzupełnij schemat doświadczenia wpisując nazwę użytego odczynnika wybranego z podanej
poniżej listy:
zawiesina wodorotlenku miedzi(II),
wodny roztwór chlorku żelaza(III),
silnie zakwaszony wodny roztwór manganianu(VII) potasu;
Schemat doświadczenia:
I etan II eten
╗ ╗
║ ║
Odczynnik:
............................................
...........................................
Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
c) napisz, jakie obserwacje potwierdzą obecność etanu w probówce I i etenu w probówce II po
wprowadzeniu tych gazów do wybranego odczynnika (wypełnij poniższą tabelę).
Barwa zawartości probówki
przed zmieszaniem reagentów
po zmieszaniu reagentów
probówka I
probówka II
Zadanie 12
Badano działanie świeżo sporządzonego wodorotlenku miedzi(II) na próbki roztworów wodnych
etanolu, etanalu, glicerolu i glukozy. Obserwacje zestawiono w tabeli.
Przeanalizuj zestawione poniżej obserwacje i wpisz do tabeli nazwy zidentyfikowanych substancji.
Próbka
I
II
III
IV
wodorotlenek
miedzi(II) bez
ogrzewania
klarowny
ciemnoniebieski
roztwór
klarowny
ciemnoniebieski
roztwór
brak widocznych
zmian
brak widocznych
zmian
wodorotlenek
miedzi(II) z
ogrzewaniem
ceglastoczerwona
zawiesina
brak danych
ceglastoczerwona
zawiesina
czarna zawiesina
nazwa badanej
substancji
............................
............................
............................
............................
Zadanie 13
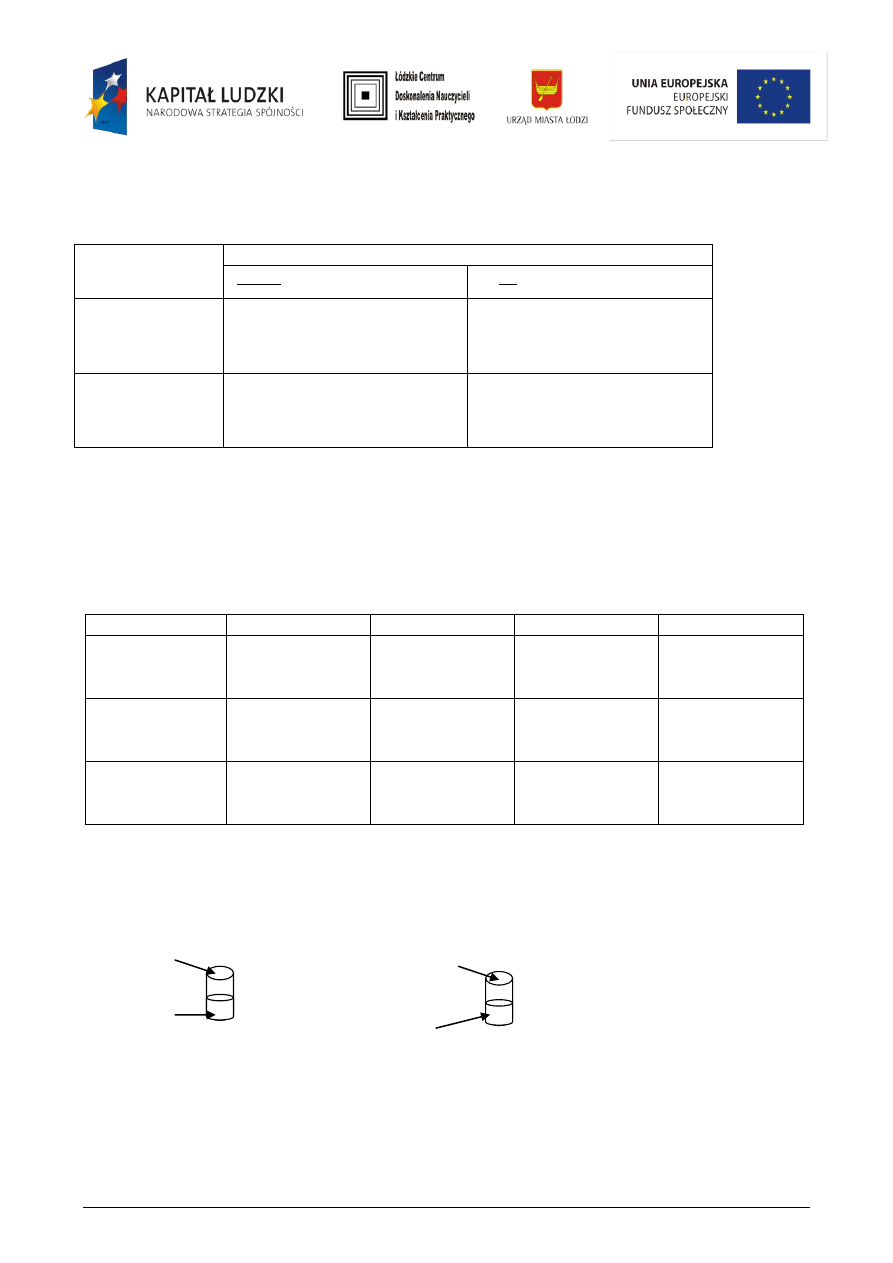
Poniższy rysunek przedstawia doświadczenie, za pomocą którego badano właściwości kwasu
etanowego.
Mg woda z oranżem metylowym
I II
CH
3
COOH
CH
3
COOH
a) Przedstaw obserwacje dla obu probówek
I ...........................................................................................................................................
...........................................................................................................................................

Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
II ...........................................................................................................................................
...........................................................................................................................................
b) Zapisz równania reakcji przebiegających w każdej z probówek
I ...........................................................................................................................................
II ...........................................................................................................................................
Zadanie 14
Do probówki z boczną rurką wlano kilka cm
3
rozcieńczonego roztworu manganianu(VII) potasu
i dodano parę kropli kwasu siarkowego(VI), następnie wkroplono do niej stężony kwas mrówkowy.
Delikatnie ogrzano probówkę z mieszaniną reakcyjną. Zaobserwowano odbarwienie fioletowego
roztworu manganianu(VII) potasu, czemu towarzyszyło wydzielanie się bezbarwnego gazu.
Wydobywające się z probówki gazy wprowadzono do probówki z wodą wapienną
i zaobserwowano zmętnienie roztworu.
A. Czerwiński, A. Czerwińska, M. Jelińska-Kazimierczuk, K. Kuśmierczyk, Chemia 1, WSiP, Warszawa 2002
a) Napisz, jakie własności kwasu mrówkowego wykazano w opisanym doświadczeniu
...........................................................................................................................................
b) Narysuj wzór strukturalny kwasu mrówkowego i zaznacz grupę odpowiadającą za badane
właściwości. Podaj jej nazwę.
...........................................................................................................................................
...........................................................................................................................................
...........................................................................................................................................
...........................................................................................................................................
...........................................................................................................................................
c) Ułóż cząsteczkowe równanie opisanej reakcji. Sporządź do niej bilans elektronowy.
...........................................................................................................................................
...........................................................................................................................................
Zadanie 15
W czterech nieoznakowanych próbówkach znajdują się: glukoza, fruktoza, sacharoza i skrobia.
Aby zidentyfikować wymienione węglowodany przeprowadzono z nimi szereg prób:
1. Do wszystkich probówek wprowadzono I2 w KI, ale tylko w probówce II odczynnik zabarwił się
na granatowo.
2. Do pozostałych trzech dodawano świeżo strącony (w silnie zasadowym środowisku) Cu(OH)
2
,
który w probówkach I, III i IV rozpuścił się, a roztwór uzyskał barwę lazurową.
3. Potem te trzy probówki wstawiono do łaźni wodnej, w wyniku czego w I i III wytrącił się
ceglasty osad, a w IV czarny.
4. Żeby zidentyfikować substancje w I i III probówce, do tych roztworów dodano NaHCO
3
i wodę
bromową, na skutek czego zaobserwowano wydzielanie się bezbarwnego i bezwonnego gazu w
probówce III.

Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
a) Przypisz węglowodany odpowiednim próbówkom.
węglowodan
I
II
III
IV
b)Wyjaśnij, dlaczego w IV probówce po ogrzaniu z Cu(OH)
2
wytrąca się czarny osad.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
c) Wyjaśnij, dlaczego używając wody bromowej w środowisku NaHCO
3
można rozróżnić cukier I
i III. Zapisz równanie reakcji.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Odpowiedzi
Zadanie 1
Lp.
Nazwa reakcji
Nr reakcji
A
Próba Tollensa
1
B
Próba jodoformowa
5
C
Reakcja nitrowania
8
D
Próba Trommera
4
E
Zmydlanie tłuszczy
13
F
Fermentacja octowa
2
G
Reakcja biuretowa
9
H
Próba lustra srebrnego
1
I
Utwardzanie tłuszczy
3
J
Fermentacja alkoholowa
7
K
Spalanie całkowite
10
L
Reakcja estryfikacji
12
M
Reakcja Wurtza
6
N
Reakcja uwodornienia
3, 11
Zadanie 2
a) alkohol jest: substratem 2,12, a w której produktem 7, 13.
b) kwas karboksylowy jest reagentem 1, 2, 4, 12;
c) metal jest substratem 6, produktem 1, a w której katalizatorem 3, 11.
Zadanie 3
Reakcje równoległe - schemat: 2 Reakcje następcze – schemat: 1
Zadanie 4
Schemat I: R
1
COOH Schemat II. R
2
OH
Zadanie 5
a)
Wzór estru
Produkt I
Produkt II
CH
3
COOCH
2
CH
2
CH
3
CH
3
COOH
CH
3
CH
2
CH
2
OH
CH
3
CHCOOCH
3
CH
3
CH
3
CHCOONa
CH
3
CH
3
OH
C
6
H
5
COOCH(CH
3
)CH
3
C
6
H
5
COOH
CH
3
CH(CH
3
)OH
Zadanie 6
CH
3
Cl
CH
3
Cl
CH
3
Cl
o -chlorometylobenzen
m -chlorometylobenzen
p -chlorometylobenzen
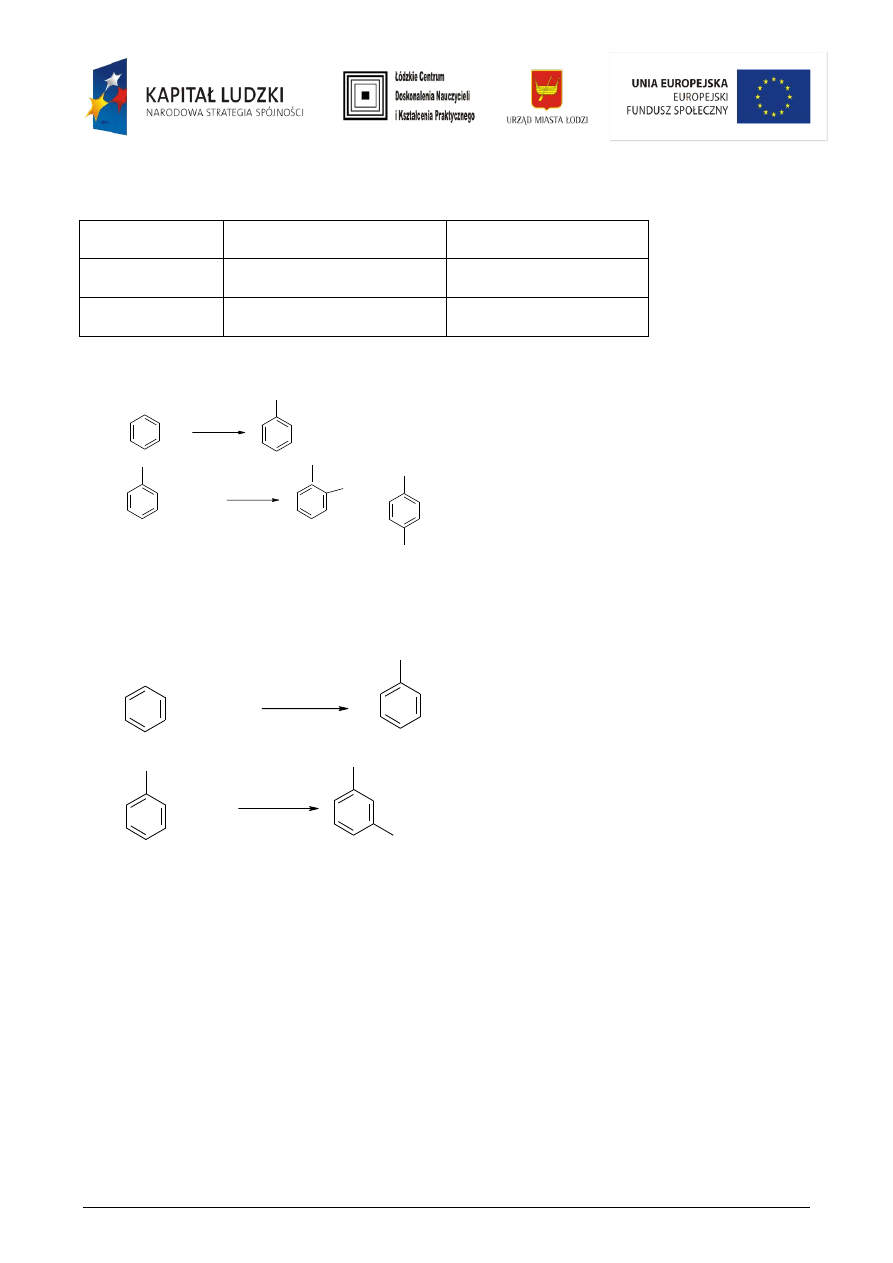
Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
Zadanie 7
1)
Rodzaj
podstawnika
Pozycja w jaką kierowany jest
nowy podstawnik
Przykłady podstawników
I rodzaju
orto- i para-
– CH
3
, - C
2
H
5
, – OH,
-F, -Cl, -Br, -I
II rodzaju
meta-
-NO
2
, -COOH
2) Zapisz reakcje dla benzenu:
a) chlorowania, a następnie nitrowania
b)
3)
a) chlorobenzen, o-chloronitrobenzen, p-chloronitrobenzen
b) nitrobenzen, m-chloronitrobenzen.
Zadanie 8
H
2
O p, T Cl
2
/Fe NH
3
NaOH
CaC
2
C
2
H
2
C
6
H
6
C
6
H
5
Cl
C
6
H
5
NH
3
+
Cl
C
6
H
5
NH
2
Zadanie 9
C
6
H
5
OH, H
2
CO
3
, HCOOH
Zadanie 10
a) 1,2-dibromoetanu z cynkiem
BrCH
2
-CH
2
Br + Zn
CH
2
= CH
2
+ ZnBr
2
Cl
Cl
HNO
3
Cl
NO
2
Cl
NO
2
H
2
SO
4
FeCl
3
Cl
2
+ HCl
+
2
2
+
+ 2 H
2
O
HNO
3
NO
2
H
2
SO
4
NO
2
FeCl
3
NO
2
Cl
+
+ H
2
O
+ Cl
2
+ HCl

Projekt współfinansowany ze środków Unii Europejskiej
w ramach Europejskiego Funduszu Społecznego
b) pentan –2-onu z wodorem
Pt
CH
3
-CO-CH
2
-CH
2
CH
3
+ H
2
CH
3
-CH(OH)CH
2
-CH
2
-CH
3
c) fenolu z potasem
2C
6
H
5
OH + 2K
2C
6
H
5
OK + H
2
d) kwasu octowego z wodorem Pt
CH
3
COOH + H
2
CH
3
CHO
Pt
lub CH
3
COOH + 2H
2
CH
3
CH
2
OH
e) propanalu z wodorotlenkiem miedzi(II)
CH
3
CH
2
CHO +2 Cu(OH)
2
CH
3
CH
2
COOH + Cu
2
O + 2 H
2
O
f) chlorometanu z roztworem wodnym wodorotlenku sodu
H
2
O
CH
3
Cl + NaOH
CH
3
OH + NaCl
Zadanie 11
Wiązanie podwójne; roztwór KMnO
4
, barwa roztworu dla etenu przed reakcją: fioletowa/różowa, po –
bezbarwna, dla etanu i przed i po - fioletowa/różowa.
Zadanie 12
I-glukoza, II- gliceryna, III- etanal, IV- etanol
Zadanie 13
I- wydziela się gaz, roztwarza magnez, Mg + 2 CH
3
COOH
(CH
3
COO)
2
Mg + H
2
II- oranż przyjmuje barwę czerwoną, CH
3
COOH
CH
3
COO
‒
+ H
+
Zadanie 14
Wł. redukujące, grupa aldehydowa
Bilans: C
II
→C
IV
+ 2e│
.
5; Mn
VII
+ 5e
.
→ Mn
II
│
.
2;
5 HCOOH + 2 KMnO
4
+ 3 H
2
SO
4
→ 5 CO
2
+ 2 MnSO
4
+ K
2
SO
4
+ 8 H
2
O
Zadanie 15
a) I- fruktoza, II- skrobia, III- glukoza, IV- sacharoza
b) Czarnym osadem jest tlenek miedzi(II) powstały po rozkładzie wodorotlenku miedzi(II), ponieważ
sacharoza nie ma własności redukujących.
c) Tylko glukoza (jako aldoza) jest utleniana przez brom w środowisku NaHCO
3
, fruktoza (ketoza) nie
wykazuje w tych warunkach własności redukujących.
CHO COOH
│ │
(CHOH)
4
+ Br
2
+ 2 NaHCO
3
(CHOH)
4
+ 2 NaBr + 2 CO
2
+ H
2
O
│ │
CH
2
OH CH
2
OH
Wyszukiwarka
Podobne podstrony:
Chemia 9 id 111927 Nieznany
Chemia 5 id 111883 Nieznany
Chemia 8 id 111914 Nieznany
Angielski chemia id 64030 Nieznany (2)
Chemia id 111494 Nieznany
egzamin chemia 2 id 152021 Nieznany
chemia 2 id 111520 Nieznany
chemia4 id 113223 Nieznany
Chemia 2 id 113193 Nieznany
Chemia 6 id 111902 Nieznany
Chemia 9 id 111927 Nieznany
Chemia 5 id 111883 Nieznany
chemia zadania 2 id 113035 Nieznany
chemia lato 12 07 08 id 112433 Nieznany
chemia fizyczna lab id 112228 Nieznany
Chemia kliniczna kontrola id 11 Nieznany
więcej podobnych podstron