Chemia pierwiastków przej
ś
ciowych
Sc Ti V Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo
Tc
Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir Pt AuHg
Ce Pr
Ac
Ac
Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U
Np Pu Am Cm
Cf Es Fm Md No Lr
Bk
Pierwiastki zewn
ę
trznoprzej
ś
ciowe (blok d), grupy 3-12:
konfiguracja elektronowa: [g.szl.] ns
2
(n-1)d
n
(n=1,2,.....10)
Pierwiastki wewn
ę
trznoprzej
ś
ciowe (blok f),
lantanowce i aktynowce,
konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
1
(n-2) f
m
(m=1,2,.....14)
Wła
ś
ciwo
ś
ci pierwiastków
wewn
ę
trznoprzej
ś
ciowych
Lantanowce
, czyli metale ziem rzadkich
konfiguracja elektronowa [Xe]6s
2
5d
1
4f
m
Ce Pr Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
La
6s
2
5d
1
4f
1
f
2
f
3
f
4
f
5
f
6
f
7
f
8
f
9
f
10
f
11
f
12
f
13
f
14
Prazeodym
Cer
Gadolin
Neodym
Promet
Samar
Erb
Lantan
Europ
Dysproz
Holm
Terb
Tul
Iterb
Lutet
Pierwiastki metaliczne
, tworzą sieci o symetrii regularnej lub
heksagonalnej.
Występują zazwyczaj na +3 stopniu utlenienia, tworząc wiązania
o przeważającym charakterze jonowym
103101100
-
96 95 94 92 91 89 88 87 86 85
r
j
3+
[pm]
Zwi
ą
zki lantanowców
Charakter chemiczny lantanowców - podobieństwo do
glinowców i berylowców
Ln
O
2
Ln
2
O
3
S
8
Ln
2
S
3
N
2
LnN
C
LnC
2
(metanek)
H
2
O
Ln(OH)
3
+H
2
8
(powoli)
sole + H
2
8
X
2
(fluorowce)
LnX
3
Aktynowce
Th Pa U
Np Pu Am Cm
Cf Es Fm Md No Lr
Bk
Ac
Ac
Pierwiastki metaliczne
, tworzą sieci o symetrii regularnej lub
heksagonalnej. Tylko cztery pierwsze posiadają trwałe izotopy.
Występują zazwyczaj na +3 stopniu utlenienia. Znane są
również związki na+2, +4, +V, +VI stopniu utlenienia (ze
wzrostem stopnia utlenienia charakter wiązań staje się coraz
bardziej kowalencyjny).
Pierwiastki zewn
ę
trznoprzej
ś
ciowe
Sc
3d
1
4s
2
Ti
3d
2
4s
2
V
3d
3
4s
2
Cr
3d
5
4s
1
Mn
3d
5
4s
2
Fe
3d
6
4s
2
Co
3d
7
4s
2
Ni
3d
8
4s
2
Cu
3d
10
4s
1
Zn
3d
10
4s
2
Y
4d
1
5s
2
Zr
4d
2
5s
2
Nb
4d
3
5s
2
Mo
4d
5
5s
1
Tc
4d
5
5s
2
Ru
4d
7
5s
1
Rh
4d
8
5s
1
Pd
4d
10
5s
0
Ag
4d
10
5s
1
Cd
3d
10
4s
2
La
5d
1
6s
2
Hf
5d
2
6s
2
Ta
5d
3
6s
2
W
5d
5
6s
1
Re
5d
5
6s
2
Os
5d
6
6s
2
Ir
5d
7
6s
2
Pt
5d
9
4s
1
Au
5d
10
6s
1
Hg
5d
10
6s
2
III B
IVB VB
VIB VIIB
R VIII B X
IB IIB
3
4
5
6
7
8
9 10
11 12
(n-1)d
4
ns
2
º
(n-1)d
5
ns
1
(n-1)d
9
ns
2
º
(n-1)d
10
ns
1
Pierwiastki zewn
ę
trznoprzej
ś
ciowe
Pierwiastki metaliczne
, tworzą sieci o symetrii regularnej lub
heksagonalnej.
3
4
5
6
7
8
9 10 11 12
NUMER GRUPY
1000
2000
3000
4000
4
5
6
Temperatury topnienia
pierwiastków zmieniają się
w funkcji konfiguracji
elektronowej
Promienie atomowe:
- są najwyższe na początku
każdego okresu (>170 pm);
- są najniższe w środku
każdego okresu (<130 pm);
- rosną w obrębie każdej
grupy
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE
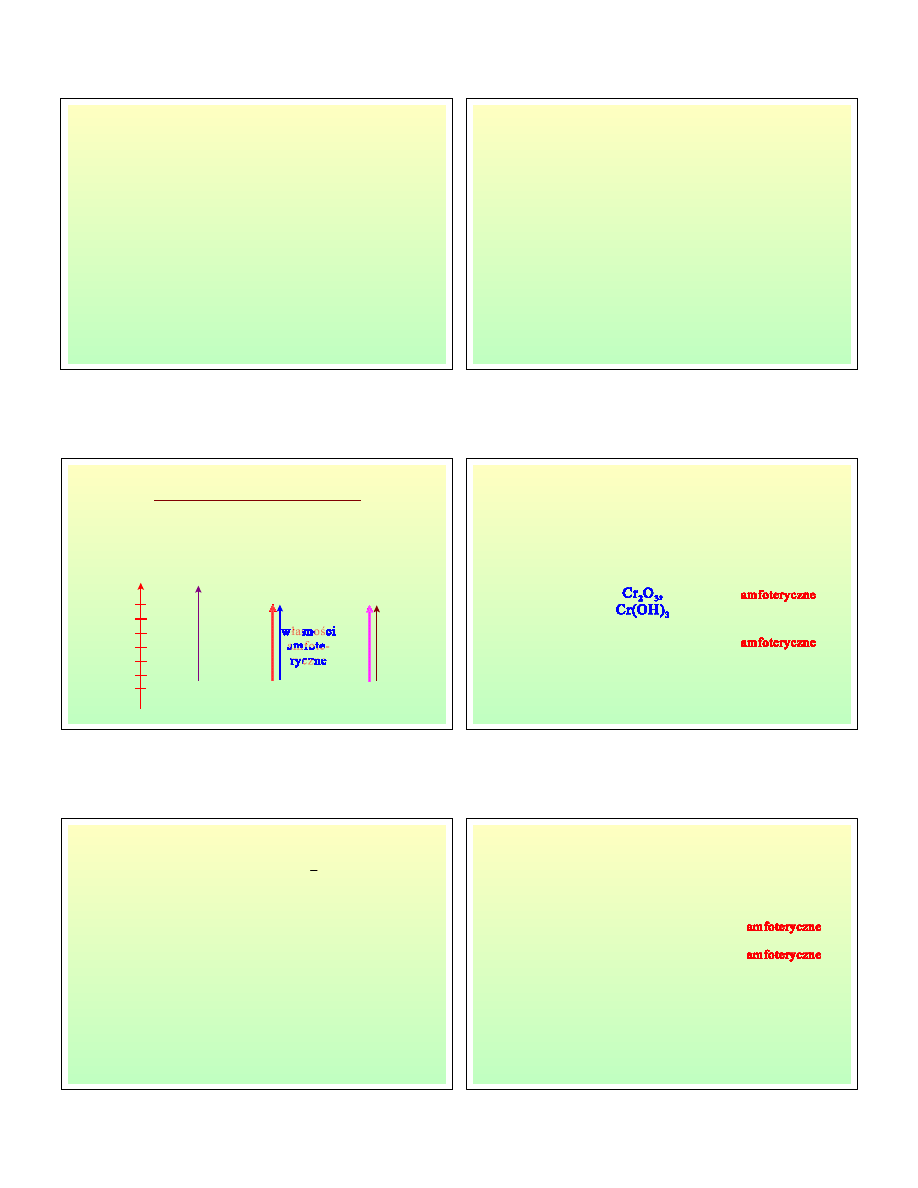
Cr
H
Cr
H
2
3
1
2
2
+
+
+
+
→
+
Cr
3H O
Cr(OH)
Cr(OH)
chromiany (III)
Cr O MgCr O FeCr O
3
2
3H
3
+3OH
6
3
2
3
2
4
2
4
-
+
+
−
+
←
→
←
→
↓
+
,
2CrO
2NH
N
Cr O
3H O
3
3
2
2
3
2
+
← →
+
+
CrO
H O
H CrO
H CrO
H O
H O
CrO
3
2
2
4
2
4
2
3
4
2
+
← →
+
← →
+
+
−
2CrO
2H O
Cr O
3H O
4
2
3
2
7
2
2
−
+
−
+
← →
+
Pierwiastki zewn
ę
trznoprzej
ś
ciowe (2)
WŁA
Ś
CIWO
Ś
CI FIZYCZNE I CHEMICZNE
Gęstość pierwiastków:
- zwykle gęstość d > 5 g@cm
-3
;
-
najlżejsze
: Sc - 3,0 Y - 4,5
Ti - 4,5
-
najcięższe
: Pt - 21,5 Os - 22,6
Ir - 22,7
Elektroujemność
- niska, choć znacznie wyższa niż metali grup
głównych
W związkach ten sam metal przejściowy występuje na wielu
stopniach utlenienia
, od
+I
do
+VIII
. Ze wzrostem masy
atomowej rośnie trwałość związków na wyższych stopniach
utlenienia, a maleje na niższych stopniach utlenienia.
W wyjątkowych przypadkach (tylko w związkach
koordynacyjnych)
stopień utlenienia
może wynosić
0
,
-I
lub
-II
.
Zwi
ą
zki metali przej
ś
ciowych
Wła
ś
ciwo
ś
ci optyczne
Zabarwienie związków metali przejściowych - absorpcja światła
w zakresie promieniowania widzialnego zależy od obecności
elektronów d
, a więc od
stopnia utlenienia
:
Zabarwienie w roztworze związków tytanu:
‚
Ti
4+
(brak elektronów d)
º
bezbarwny
‚
Ti
3+
(1 elektron d)
º
ciemnoniebieski
‚
Ti
2+
(2 elektrony d)
º
fioletowy
Zwi
ą
zki metali przej
ś
ciowych (2)
Stopie
ń
utlenienia a wła
ś
ciwo
ś
ci tlenku
Ze wzrostem stopnia utlenienia metalu przejściowego w tlenku
rośnie udział charakteru kowalencyjnego we wiązaniach
(równocześnie maleje udział wiążania jonowego).
wzrost
stopnia
utlenienia
Me
3+
Me
+
Me
+V
Me
+VII
wiązanie
jonowe
wzrost
udziału
wiązania
kowalen-
cyjnego
własności
zasadowe
własności
kwasowe
własności
utleniające
własności
redukujące
Chemia zwi
ą
zków chromu (1)
Konfiguracja elektronowa:
3d
5
4s
1
stopień
utlenienia
ZWIĄZEK
Właściwości
+2
CrCl
2
zasadowe
,
silnie redukujące
+3, +III
+IV
CrO
2
+VI
CrO
3
CrO
4
2-
,
Cr
2
O
7
2-
kwasowe,
silnie utleniające
Chemia zwi
ą
zków chromu (2)
Cr
2+
Cr
3+
Cr
VI+
Bezwodnik
kwasowy:
ś
rodowisko zasadowe
ś
rodowisko kwaśne
Chemia zwi
ą
zków manganu (1)
Konfiguracja elektronowa:
3d
5
4s
2
stopień
utlenienia
ZWIĄZEK
Właściwości
+2
MnSO
4
, MnO
zasadowe
+3
Mn
2
O
3
+IV
MnO
2,
, MnO(OH)
2
+V
MnO
4
3-
, Li
3
MnO
4
słabo kwasowe,
słabo utleniające
+VI
MnO
4
2-
, K
2
MnO
4
kwasowe,
utleniające
+VII
MnO
4
-
, KMnO
4
kwasowe,
silnie utleniające
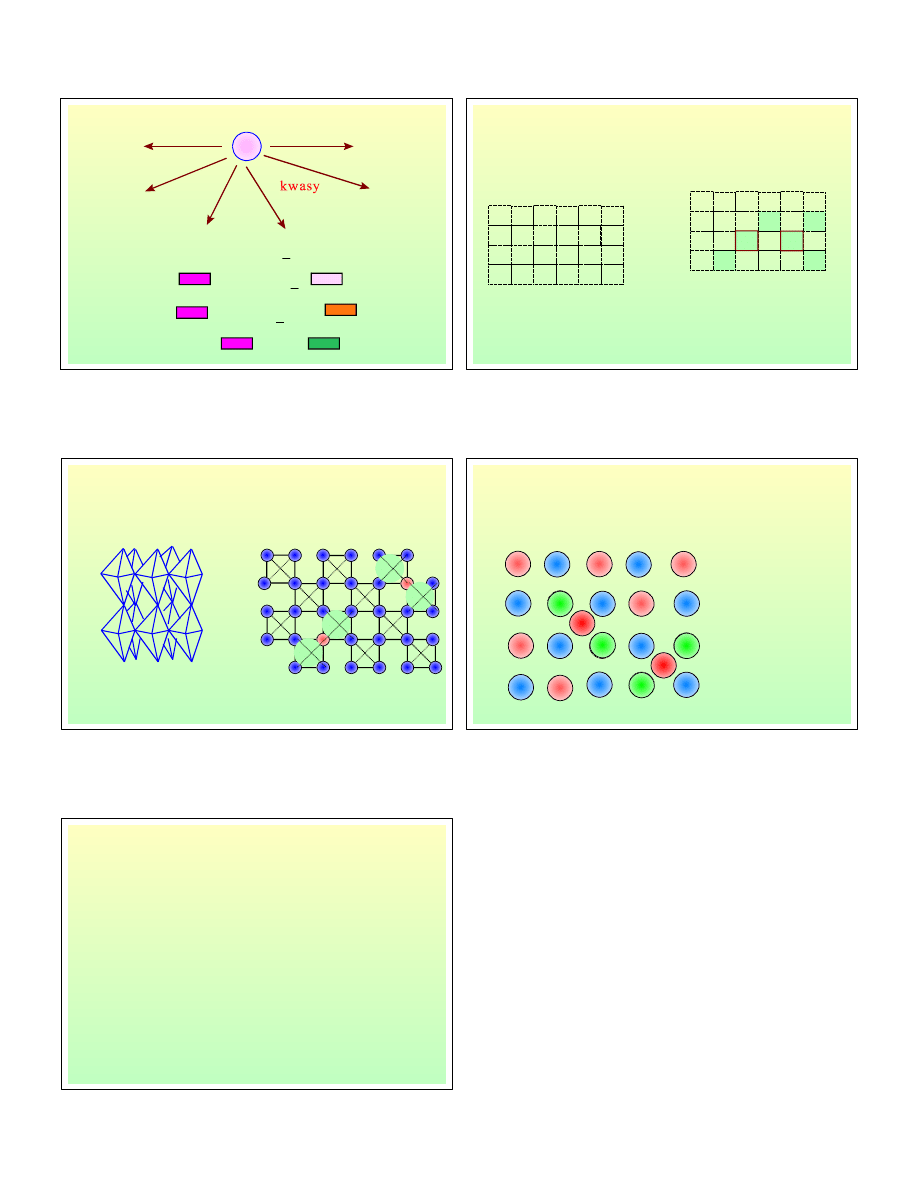
MnO
8H
Mn
4H O
4
-
2
2
+
+
→
+
+
+
5e
MnO
2H O
MnO
4OH
4
-
2
2
-
+
+
→
+
3e
MnO
MnO
4
-
4
2-
+ →
e
Fe
Fe O
1 3
2
2
3
−
+
+
x
x
W
W O
1 2x
VI
2x
V
3 x
−
+
+
−
Chemia zwi
ą
zków manganu (2)
Mn
O
2
Mn
3
O
4
X
2
(fluorowce)
MnX
2
S
2
MnS
N
2
Mn
3
N
2
C
Mn
3
C
sole Mn
2+
+ H
2
8
kwaśny
obojętny
zasadowy
Zwi
ą
zki niestechiometryczne (1)
Tlenki żelaza: FeO (II), Fe
2
O
3
(III), Fe
3
O
4
[Fe
II
Fe
2
III
O
4
]
Tlenek FeO wykazuje odstępstwa od stechiometrii bez zmiany
struktury, jego wzór powinien być Fe
1-x
O (x=0÷0,2)
- rzeczywisty
niedomiar metalu
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
FeO
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
3+
Fe
3+
Fe
3+
Fe
3+
Fe
1-x
O
Każda ‘luka kationowa’ (brak jonu
Fe
2+
) jest uzupełniona
pojawieniem się dwóch jonów
Fe
3+
Zwi
ą
zki niestechiometryczne (2)
Trójtlenek wolframu
,
WO
3
, jest związkiem przejawiającym
rzeczywisty niedomiar tlenu. W jego sieci krystalicznej
pojawiają się luki tlenowe (nieobsadzone pozycje anionów
tlenowych). Jego wzór brzmi zatem
WO
3-x
Aniony
O
2-
w sieci WO
3
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
6+
W
5+
W
5+
W
5+
W
5+
WO
3-x
Zwi
ą
zki niestechiometryczne (3)
Tlenek cynku, ZnO, jest związkiem przejawiającym
rzeczywisty nadmiar metalu -
Zn
1+x
O
O
2-
Zn
2+
O
2-
Zn
2+
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
Zn
1+
Zn
1+
Zn
2+
Zn
1+
Zn
1+
W sieci krystalicznej
ZnO pojawiają się
nadmiarowe jony
cynku, zwane
międzywęzłowymi.
Powoduje to także
obniżenie ładunku
innych jonów cynku
Zwi
ą
zki niestechiometryczne (4)
Występowanie odstępstwa od stechiometrii jest
charakterystyczne dla związków zawierających kationy metali o
zmiennym stopniu utlenienia (związki metali przejściowych):
rzeczywisty niedomiar metalu:
w sieci krystalicznej pozostają nieobsadzone miejsca
kationów
(luki kationowe)
, a stopień utlenienia pozostałych
kationów ulega
podwyższeniu
rzeczywisty niedomiar utleniacza:
w sieci krystalicznej pozostają nieobsadzone miejsca anionów
(luki anionowe)
, a stopień utlenienia kationów ulega
odpowiednio
obniżeniu
rzeczywisty nadmiar metalu:
w sieci krystalicznej pojawiają się dodatkowe kationy
metalu
(atomy międzywęzłowe)
, a stopień utlenienia pozostałych
kationów ulega odpowiednio
obniżeniu
Wyszukiwarka
Podobne podstrony:
chemia lato 05 07 08 id 112417 Nieznany
chemia lato 09 07 08 id 112430 Nieznany
chemia lato 07 07 08 id 112423 Nieznany
chemia lato 08 07 08 id 112426 Nieznany
chemia lato 01 07 08
chemia lato 13 07 08
podst chemii 05 07 08 id 365984 Nieznany
chemia lato 03 07 08
podst chemii 08 07 08 id 365991 Nieznany
chemia lato 10 07 08
07 08 id 418350 Nieznany (2)
chemia lato 06 07 08
podst chemii 02 07 08 id 365977 Nieznany
chemia lato 11 07 08
chemia lato 10 07 08
chemia lato 04 07 08
więcej podobnych podstron