1
1
Jądro atomowe
2
Co decyduje o właściwościach atomu ?
• masa (protony + neutrony + elektrony)
– prawie cała masa atomu skupiona jest w jądrze,
wkład elektronów jest niewielki
• ładunek jądra oraz liczba elektronów
– wzajemne oddziaływania o charakterze
elektrostatycznym
•
ułożenie elektronów (konfiguracja)
– istotne dla właściwości chemicznych są
zwłaszcza elektrony położone daleko od jądra
3
Czy prawo zachowania masy jest zawsze spełnione ?
Czy jest spełnione na poziomie atomowym ?
• Masa każdego izotopu jest sumą mas protonów,
neutronów i elektronów. Wkład elektronów jest
mało znaczący.
• Masa danego izotopu powinna być (w j.m.a.)
liczbą zbliżoną do całkowitej
• Izotop
9
Be - masa powinna wynosić 9 u,
tymczasem jest niższa o 0,0624 u ...
• Czy to błąd rachunkowy ? Jeśli nie, to co się stało
z brakującą masą ?
4
„Defekt” masy
• Zgodnie z teorią Einsteina, masa i energia są sobie
równoważne
E = m·c
2
• „Brakująca” masa zamienia się w energię
stabilizacji jądra atomowego, która wynosi w tym
przypadku
E = 931,5 MeV = 1,49210
-10
J
(dla
każdego jądra)
• 1 eV - energia, jaką uzyskuje elektron w polu na
drodze o spadku potencjału o 1 V
• 1 MeV = 10
6
eV
5
Energia wiązania w jądrze
A
100
50
150 200
250
E
(MeV)
liczba masowa
û
waha się od 7 - 8,7 MeV/nukleon
6
Stabilność jąder atomowych
0
20
40
60
80
100
0
20
40
60
80
100
120
140
160
lic
z
b
a
n
e
u
tr
o
n
ó
w
w
j
ą
d
rz
e
liczba atom owa, Z

2
7
Promieniotwórczość naturalna
Samorzutny rozpad nietrwałych
nuklidów, połączony z emisją
promieniowania elektromagnetycznego
lub strumienia cząstek
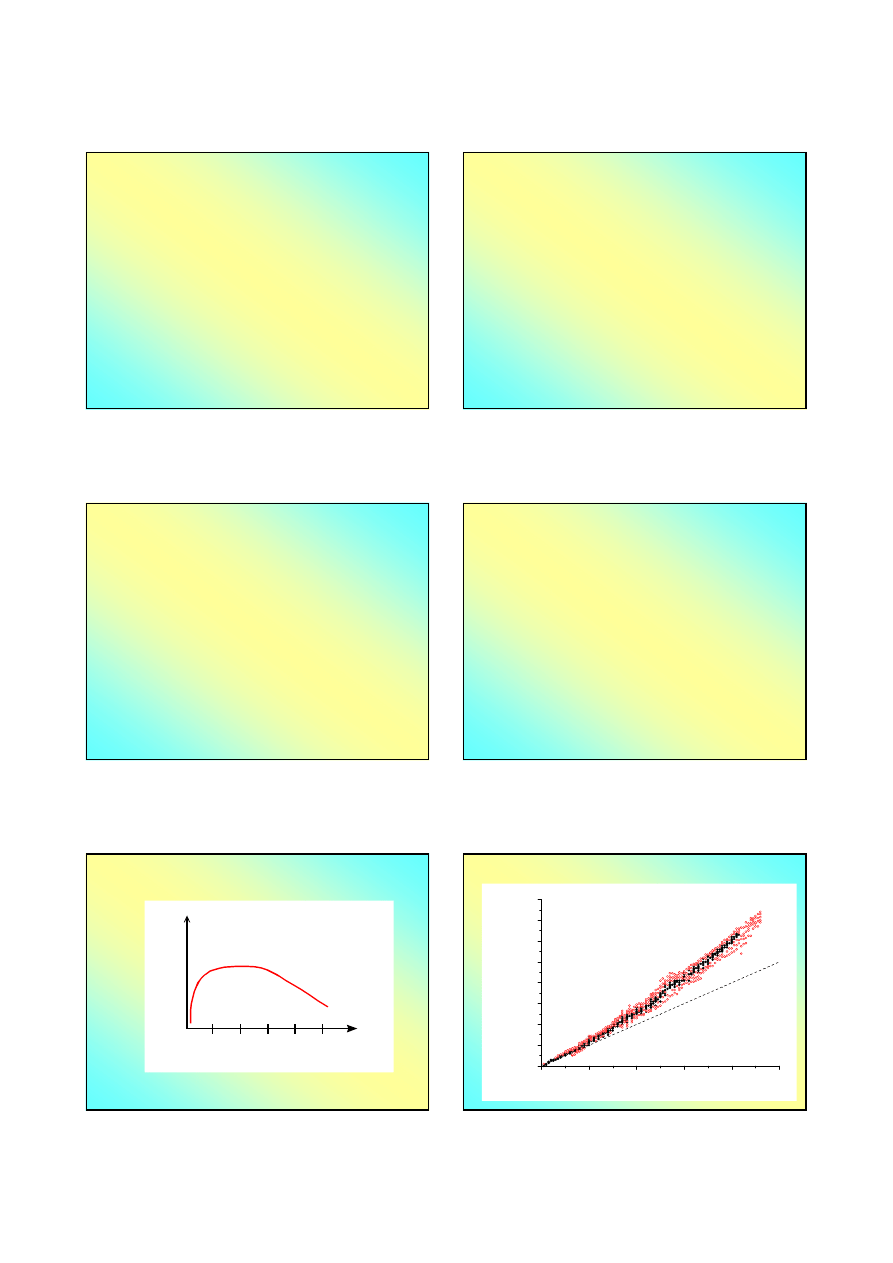
Henri Becquerel, małżonkowie Curie, 1896
Rodzaje promieniowania:
α
- strumień jąder nuklidu izotopu helu
β
- strumień elektronów
γ
- “twarde” promieniowanie elektromagnetyczne
Nagroda Nobla z fizyki 1903,
http://nobelprize.org/nobel_prizes/physics/articles/curie/index.html
8
Znaczenie promieniotwórczości
Czy badanie promieniotwórczości ma związek z
chemią ?
Tak, dlatego że:
- promieniotwórczość dostarcza wielu cennych
informacji o budowie jądra atomowego;
- izotopy promieniotwórcze mogą pełnić rolę
“znaczonych” atomów danego pierwiastka i przez to
ułatwiać badanie mechanizmów reakcji chemicznych;
- można zrealizować odwieczne marzenie alchemików,
to znaczy zamieniać jedne pierwiastki w drugie
9
Promieniotwórczość
naturalna
10
1. Promieniowanie β
-
n
p
e
→
+
+
+
−
ν
Jest to strumień elektronów, powstających w wyniku
przemiany wewnątrz jądra:
Neutron rozpada się na
proton
,
elektron
i
antyneutrino
6
14
7
14
C
N
→
+
+
−
e
ν
Z
A
Z 1
A
X
X'
→
+
+
−
−
β
(
)
e
ogólnie:
11
2. Promieniowanie β
+
Jest to strumień cząstek o masie elektronów, ale o
ładunku dodatnim
, powstających w wyniku przemiany
wewnątrz jądra:
p
n e
+
+
→
+ +
ν
Proton
rozpada się na neutron,
elektron o ładunku
dodatnim (pozyton)
i
neutrino
Z
A
Z
A
X
X
e
→
+
−
+
+
1
'
(
)
β
12
3. Promieniowanie α
(emisja cząstki α)
2
4
He
Na skutek przemian wewnątrz jądra na zewnątrz
wyrzucany jest strumień cząstek złożonych z
dwóch protonów i dwóch neutronów - jąder
izotopu
92
235
90
231
2
4
2
4
U
Th
( He)
→
+
α
Z
A
Z 2
A 4
2
4
2
4
X
X'
( He)
→
+
−
−
α
3
13
4. Wychwyt K
Jądro pochłania elektron z najbliższej
powłoki (K). Wydziela się energia,
związana z przeniesieniem innego elektronu
bliżej jądra.
Elektron
łączy się z
protonem
i
powstaje
neutron
p
e
n
+
−
+
→
Z
A
Z
A
X
e
X
energia foton
+ →
+
−
−
1
'
(
)
Wynik - jak dla przemiany β
+
14
5. Promieniowanie γ
Przegrupowanie protonów i neutronów w jądrze
prowadzi do wyemitowania nadmiarowej energii w
postaci promieniowania elektromagnetycznego:
Z
A
Z
A
X
X
energia foton
→
+
(
)
15
Szybkość przemian promieniotwórczych
v
N
dN
dt
= − =
λ
Szybkość rozpadu jąder promieniotwórczych (przemian
promieniotwórczych) jest proporcjonalna do liczby jader,
które ulegają przemianie
−
=
+
ln N
t
λ
const
N
N
0
t
=
⋅
−
e
λ
dla N =
t = t
N
2
1/2
0
16
Okres półrozpadu albo półtrwania t
1/2
* jest to stała charakterystyczna dla danej przemiany i
jest miarą trwałości danego izotopu;
* oznacza okres czasu, po którym dokładnie połowa
jąder promieniotwórczych ulegnie rozpadowi lub
pozostanie niezmieniona;
* waha się od mikrosekund (dla izotopów nie-
trwałych) do milionów lat (dla jąder trwałych);
17
Okres półrozpadu albo półtrwania t
1/2
0
1622
3244
4866
6488
8110
9732
0
20
40
60
80
100
120
140
t
1/2
= 1622 lata
N
l
u
b
m
a
s
a
t (czas)
88
226
86
222
Ra
Rn+ He
1622 lata,
2
4
α
→
18
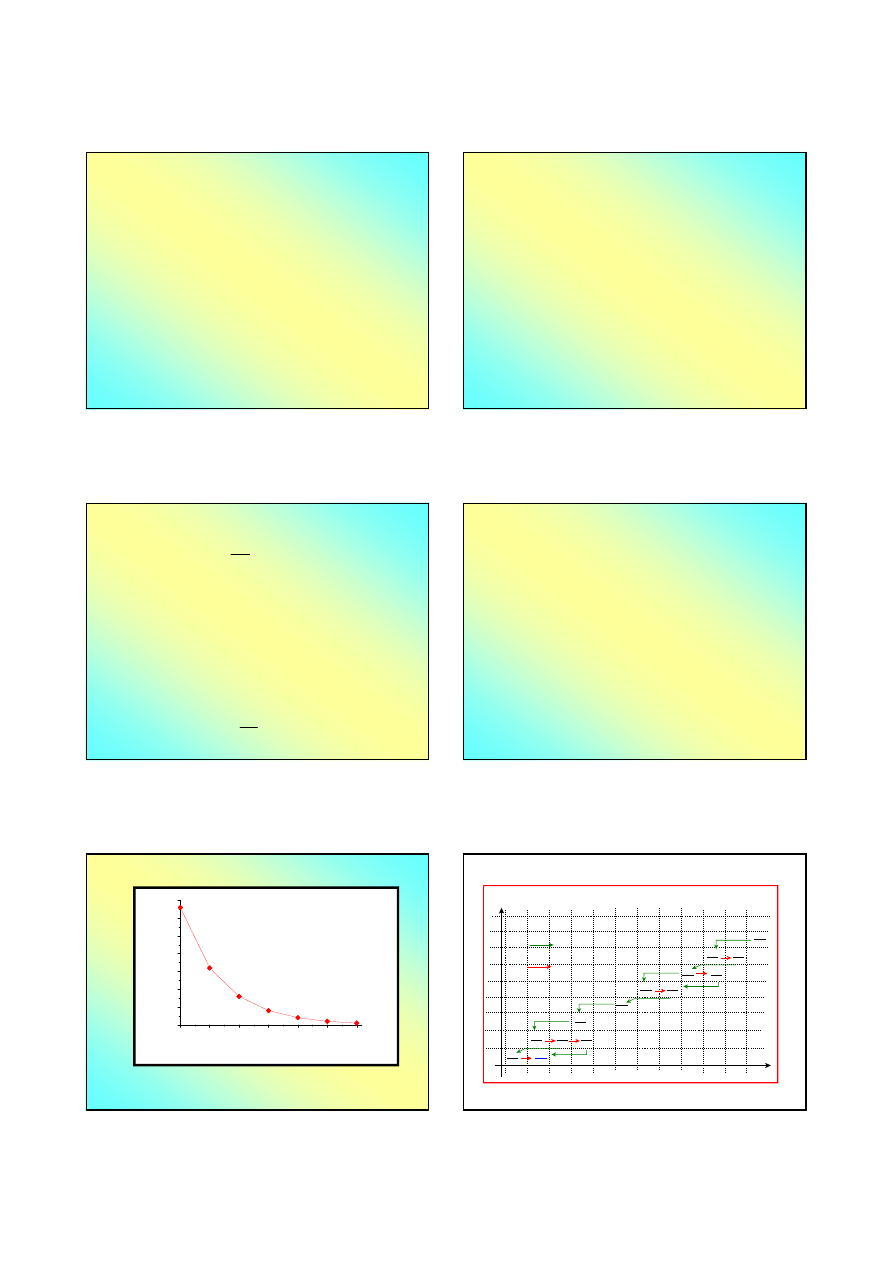
Naturalny szereg promieniotwórczy
A
Z
91 92
92
90
89
88
87
86
85
84
83
82
81
235
231
227
223
219
215
211
207
"
$
U
235
92
7
@
10
9
lat
231
90
Th
25,6 h
231
91
Pa
32500 lat
227
89
Ac
21,7 lat
227
90
21,7 lat
223
87
Fr
21,8 min
223
88
Ra
18,7 dni
11,4 dni
219
86
Rn
3,9 s (!)
215
84
Po
1,7
@
10
- 3
s
211
82
Pb
211
83
Bi
211
84
207
81
Tl
211
82
4
19
Promieniotwórczość sztuczna
20
Sztuczne przemiany promieniotwórcze
* Sztuczne przemiany promieniotwórcze -
jądra atomowe pochłaniają cząstki, którymi
są „bombardowane”
• pochłanianie cząstek α
• pochłanianie neutronów
• pochłanianie protonów
• pochłanianie promieniowania γ
* i ulegają dalszym przemianom
* Ich skutkiem jest pojawienie się nowych
izotopów
21
Sztuczne przemiany promieniotwórcze (2)
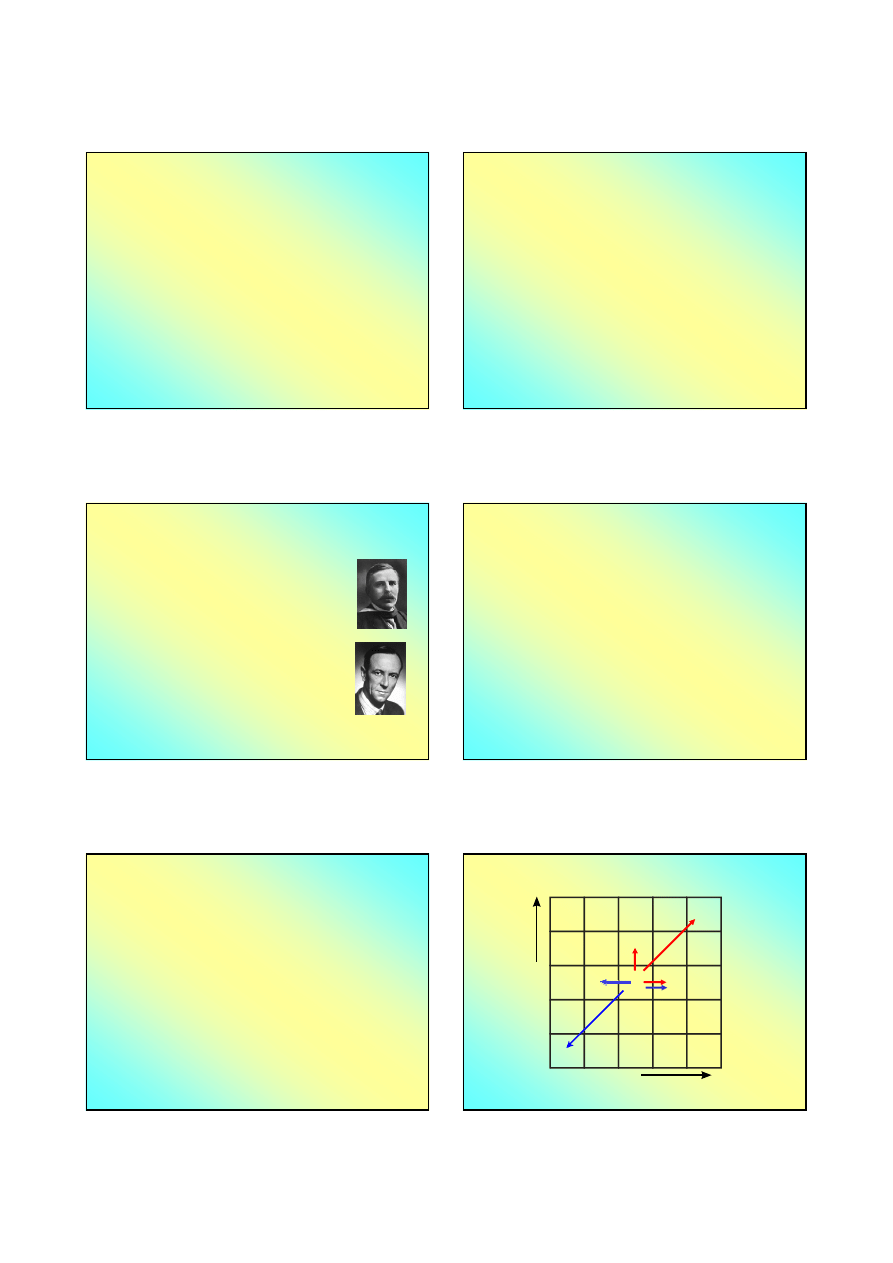
– Bombardowanie cząstkami α
7
14
2
4
8
17
1
1
N
He
O
H
+
→
+
Rutherford,1919
4
9
2
4
6
12
0
1
Be
He
C
+
→
+
Chadwick,1932
n
Ernest Rutherford
James Chadwick
Ta ostatnia reakcja bywa stosowana do
otrzymywania neutronów w laboratorium
22
Sztuczne przemiany promieniotwórcze (3)
• Przemiany jednych pierwiastków w drugie
(transmutacje pierwiastków):
– Bombardowanie neutronami
12
24
0
1
11
24
1
1
Mg
Na
H
+
→
+
n
13
27
0
1
11
24
2
4
Al
Na
He
+
→
+
n
11
23
0
1
11
24
Na
Na
+
→
+
n
energia( )
γ
Trzy różne procesy związane z bombardowaniem neutronami
prowadzą do otrzymania tego samego nuklidu
23
Sztuczne przemiany promieniotwórcze (4)
– Bombardowanie protonami
:
3
7
1
1
2
4
Li
p
He
+
→
Cockroft Walton 1932
,
,
2
- Pochłanianie promieniowania γ:
4
9
4
8
0
1
Be
Be +
+ →
γ
n
24
Klasyfikacja przemian
A
(A-Z)
X
naturalne
i
sztuczne
-α
+α
+n
+p
β
-
β
+
wychwyt K
5
25
ROZSZCZEPIENIE JĄDER ATOMOWYCH
92
235
0
1
56
141
36
92
0
1
U
Ba
Kr +3
+
→
+
n
n
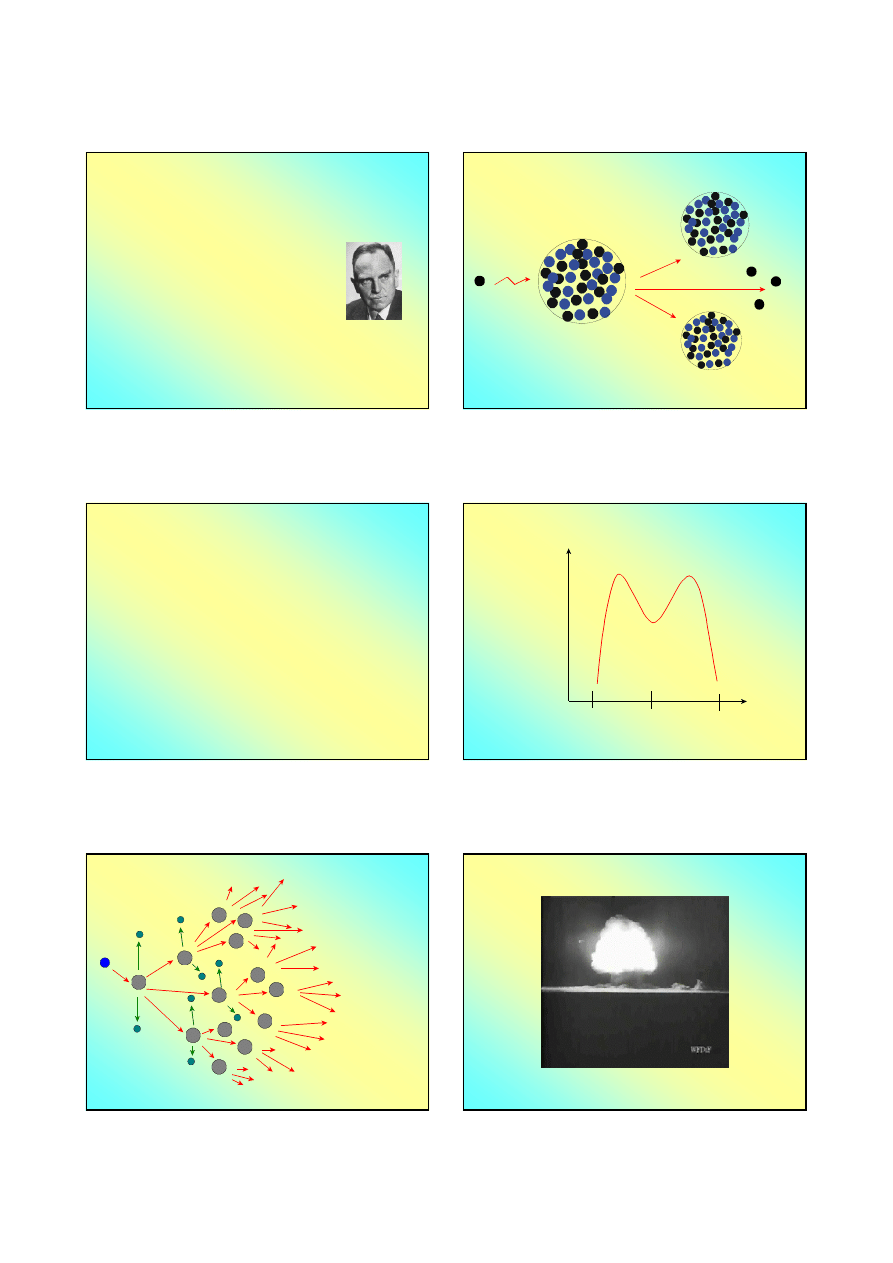
Otto Hahn (1879-1968), 1938
Nagroda Nobla 1944
Fritz Strassman, Lisa Meitner
92
235
0
1
Z'
A'
Z"
A"
0
1
U
X
Y + (2 - 3)
+
→
+
n
n
26
ROZSZCZEPIENIE JĄDER ATOMOWYCH
jądro izotopu
rozszczepialnego
neutron
dwa inne jądra
2-3
neutrony
27
Rozszczepienie jąder atomowych
• izotopy rozszczepialne
92
235
94
239
U,
Pu
W czasie rozszczepienia 1 jądra uranu zostaje
wyzwolona energia równa 200 MeV
Rozszczepienie 1 grama uranu wyzwala energię
równą 82·10
6
kJ (spalenie 2,5 tony węgla!)
28
Produkty rozszczepienia
A
80
120
160
Wydajność
produktów
rozszczepienia
29
Rozszczepienie jest reakcją łańcuchową
30
Niekontrolowana reakcja łańcuchowa
6
31
Kontrolowana reakcja łańcuchowa
• Niekontrolowana reakcja łańcuchowa
przebiega tylko wtedy, gdy zostanie
przekroczona tzw. masa krytyczna izotopu
rozszczepialnego
• Można ją kontrolować pochłaniając część
neutronów powstających w czasie
rozszczepienia
• Najlepszymi moderatorami są grafit, ciężka
woda, niektóre metale ...
32
Synteza termojądrowa
Słońce jest tzw. „zimną gwiazdą” T~10
7
K
CYKL PROTONOWY:
1
1
1
1
1
2
0 07
H
H
H +
pJ
+
+ →
+
β
,
1
1
1
2
2
3
0 88
H
H
He +
pJ
+
→
+
γ
,
2
3
2
3
2
4
05
He
He
He +2 H + 2
pJ
1
1
+
→
,
4 H
He +
+ + 6,7MeV
1
1
+
→
2
4
2
β
γ
33
Synteza termojądrowa na Słońcu
• Na Słońcu w każdej sekundzie:
– ulega przemianie 600 mln ton wodoru
– wydziela się 3,72·10
23
kJ energii
• Ponieważ na Słońcu jest 10
27
ton wodoru,
jeszcze długo go nie zabraknie...
Wyszukiwarka
Podobne podstrony:
podst chemii 05 07 08 id 365984 Nieznany
podst chemii 08 07 08 id 365991 Nieznany
chemia lato 12 07 08 id 112433 Nieznany
podst chemii 11 07 08
podst chemii 09 07 08
podst chemii 01 07 08
chemia lato 07 07 08 id 112423 Nieznany
podst chemii 12 07 08
podst chemii 04 07 08
podst chemii 13 07 08
podst chemii 12 07 08
chemia lato 05 07 08 id 112417 Nieznany
07 08 id 418350 Nieznany (2)
chemia lato 09 07 08 id 112430 Nieznany
G2 PB 02 B Rys 3 08 id 185397 Nieznany
chemia lato 08 07 08 id 112426 Nieznany
podst chemii 10 07 08
podst chemii 03 07 08
więcej podobnych podstron