1
Reakcje utleniania i redukcji
Równowagi w procesach utleniania i redukcji
Niektórym reakcjom towarzyszy przeniesienie
(transfer) elektronów od jednej substancji do drugiej
MgO
O
Mg
2
2
1
→
+
-
2
2
2
1
O
2
O
→
+
e
+ 2 e
redukcja
e
2
Mg
Mg
2
+
→
+
- 2 e
utlenianie
reduktor
,
utlenia się
w reakcji
utleniacz
redukuje się
w reakcji
Reakcje redoks (redox)
o
Reakcje redoks mają charakter odwracalny,
zatem każdy pierwiastek (związek ?) może
istnieć w formie utlenionej i zredukowanej
red
↔
↔
↔
↔
ox
+ nē
UTLENIANIE
ox
+ nē
↔
↔
↔
↔
red
REDUKCJA
Reduktor
ulega reakcji
utlenienia,
w wyniku której traci elektrony
Utleniacz
przyjmuje elektrony i ulega
redukcji
Przypomina to tworzenie się wiązania jonowego, choć w
reakcji redoks pierwiastki pobierające i oddające
elektrony mogą znajdować się w różnych związkach
Stopie
ń
utlenienia pierwiastka
Stopień utlenienia
pierwiastka charakteryzuje jego
formalny
ładunek:
– stopień utlenienia
jonu jest równy jego ładunkowi;
– dla
cząsteczek o wiązaniu spolaryzowanym
biorących
udział w reakcji redoks zakładamy całkowite
przesunięcie ładunku (dla potrzeb bilansu
elektronowego);
– przypisanie ładunku wszystkim atomom w cząsteczce
wymaga przyjęcia, że wszystkie
wiązania są jonowe
(co zwykle nie jest prawdą);
– dla cząsteczek o wiązaniu czysto atomowym
(pierwiastków)
stopień utlenienia
wynosi
zero (0)
Bilans elektronowy
Uzgdodnienie reakcji redoks wymaga, by liczba
elektronów oddanych przez
reduktor
była równa
liczbie elektronów przyjętych przez
utleniacz:
1.
Stopień utlenienia
pierwiastków wynosi zawsze 0.
2. Suma
stopni utlenienia
wszystkich pierwiastków;
wchodzących w skład cząsteczki jest równa zeru, a
wchodzących w skład jonu - ładunkowi jonu;
3.
Stopień utlenienia
fluoru (F)
w jego związkach
wynosi zawsze -1, metali alkalicznych (litowców)
zawsze +1, metali ziem alkalicznych (berylowców)
zawsze +2.
4.
Stopień utlenienia
wodoru
wynosi zawsze +1, z
wyjątkiem wodorków metali grup 1 i 2 (-1).
5.
Stopień utlenienia
tlenu
wynosi zawsze -2, chyba, że
jest to sprzeczne z którymś z powyższych warunków
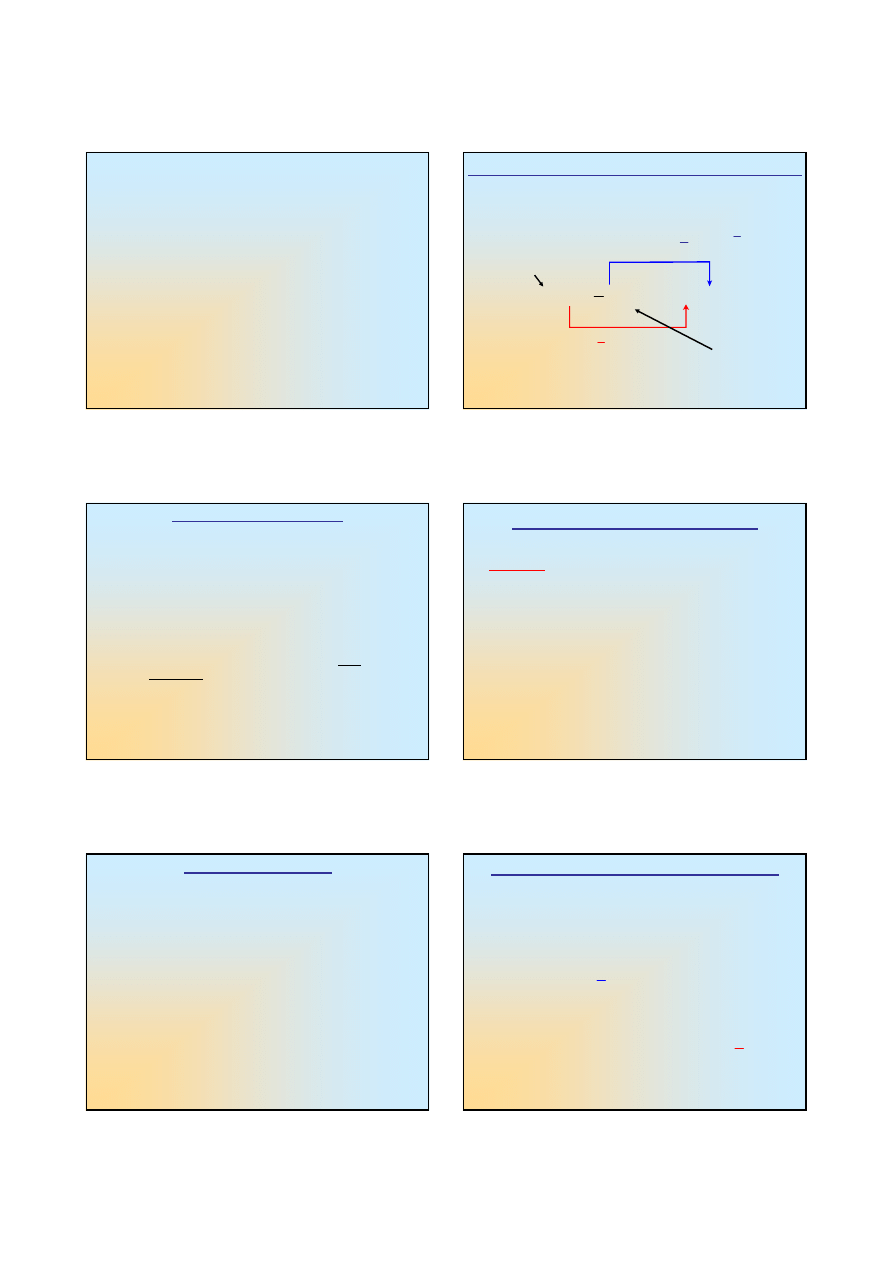
Reakcja pomiędzy jonami cyny i żelaza
4
2
2
3
SnCl
2FeCl
SnCl
2FeCl
+
→
←
+
+
+
+
+
+
→
←
+
4
2
2
3
Sn
2Fe
Sn
2Fe
+
+
→
+
2
3
2Fe
2
2Fe
redukcja
e
e
utlenianie
2
Sn
Sn
4
2
+
→
+
+
FORMA
UTLENIONA
FORMA
UTLENIONA
FORMA
ZREDUKOWANA
FORMA
ZREDUKOWANA
Reakcje „połówkowe”:
2
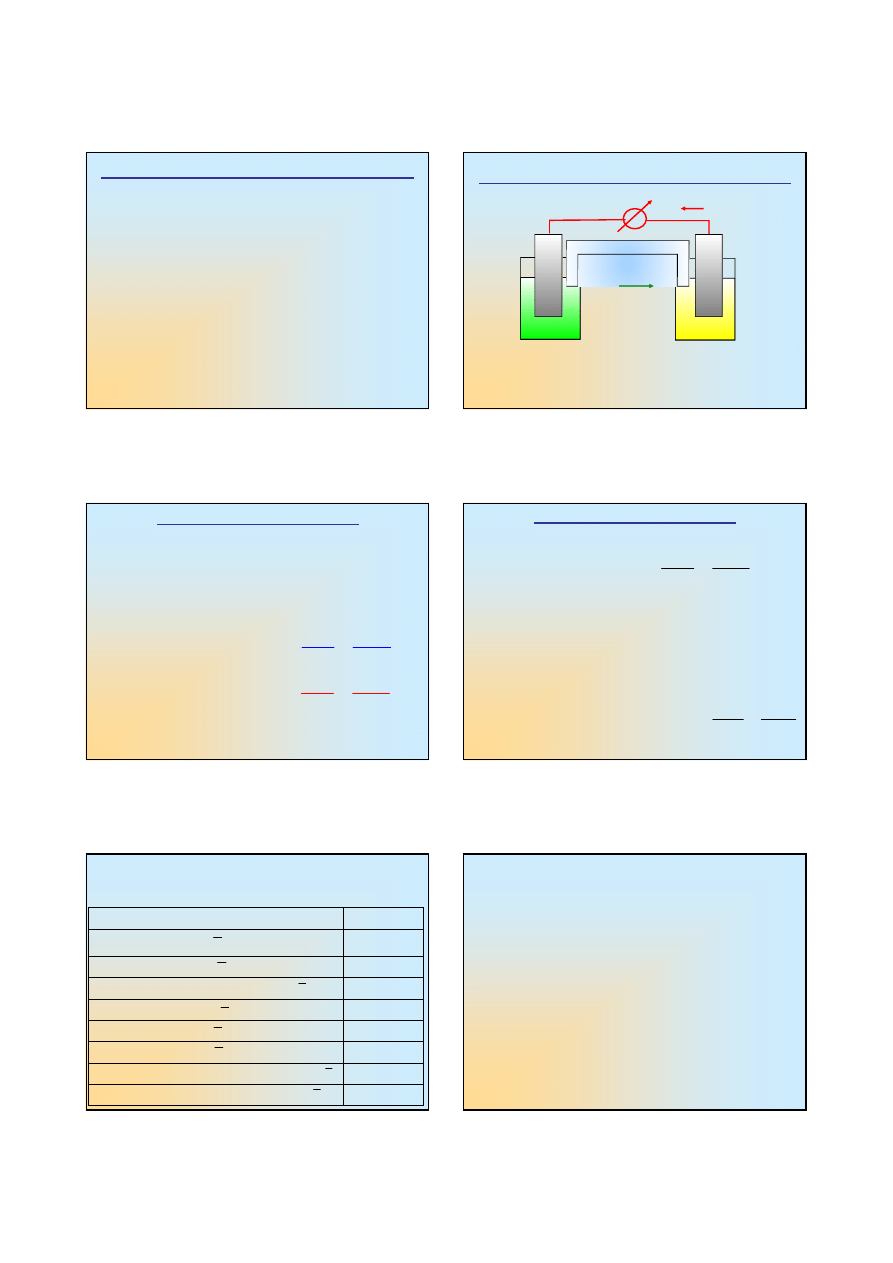
Reakcja pomiędzy jonami cyny i żelaza (2)
♦
Dlaczego jony Fe
3+
ulegając
redukcji
do Fe
2+
utleniają
jony Sn
2+
do Sn
4+
, a nie na odwrót ?
♦
Czy tak będzie w każdej sytuacji ?
♦
Każda z reakcji połówkowych charakteryzuje się
sobie właściwym potencjałem elektrochemicznym
♦
A czy reakcje połówkowe można rozdzielić i każdą
z nich obserwować z osobna ?
Fe
3+
/Fe
2+
Sn
2+
/Sn
4+
Reakcja pomiędzy jonami cyny i żelaza (3)
e
+
+
→
+
2
3
Fe
Fe
e
e
2
Sn
Sn
4
2
+
→
+
+
K
+
Cl
-
Cl
-
Potencjał elektrochemiczny
• Elektrony w obwodzie zewnętrznym płyną od elektrody
zanurzonej w roztworze jonów cynowych do elektrody
zanurzonej w roztworze jonów żelaza. Dzieje się tak dlatego, że
potencjał elektrody Fe
2+
/Fe
3+
jest wyższy niż potencjał
elektrody Sn
2+
/Sn
4+
. Można go obliczyć korzystając ze wzoru
Nernsta, który określa zamianę potencjału chemicznego reakcji
na potencjał elektryczny (reakcji utleniania) ...
+
+
+
+
+
+
⋅
⋅
+
=
2
3
3
2
3
2
ln
1
0
/
/
Fe
Fe
Fe
Fe
Fe
Fe
c
c
F
T
R
E
E
+
+
+
+
+
+
⋅
⋅
+
=
2
4
4
2
4
2
ln
2
0
/
/
Sn
Sn
Sn
Sn
Sn
Sn
c
c
F
T
R
E
E
F - liczba Faraday’a, 96 500 C (ładunek 1 mola elektronów)
Potencjał reakcji utleniania
RED
↔
↔
↔
↔
OX
+ nē
RED
OX
OX
RED
OX
RED
c
c
F
n
T
R
E
E
ln
0
/
/
⋅
⋅
+
=
Jeżeli c
OX
= c
RED
, to wówczas E
RED/OX
= E
0
RED/OX
;
jest to tzw. potencjał normalny (standardowy) reakcji
utleniania, zależny tylko od rodzaju reakcji
Można również używać pojęcia potencjału redukcji:
E
OX/RED
= - E
RED/OX
OX
+ nē
↔
↔
↔
↔
RED
OX
RED
RED
OX
OX
RED
RED
OX
c
c
F
n
T
R
E
E
E
ln
0
/
/
/
⋅
⋅
+
=
−
=
Klasyfikacja reakcji odwracalnych według
względnych standardowych potencjałów
redoks (reakcje utleniania)
0,0
Potencjał
odniesienia
Potencjał [V]
Reakcja
e
2
2H
H
2
+
→
+
e
+
→
+
+
3
2
Cr
Cr
+ 0,41
e
2
O
H
NO
OH
NO
2
3
2
+
+
→
+
−
−
−
- 0,01
e
2
Sn
Sn
4
2
+
→
+
+
- 0,15
e
+
→
+
+
2
Cu
Cu
- 0,153
e
+
→
+
+
3
2
Fe
Fe
- 0,77
e
H
O
Cr
O
H
Cr
6
14
7
2
2
7
2
2
3
+
+
→
+
+
−
+
- 1,33
e
5
8H
MnO
O
H
Mn
4
2
2
+
+
→
+
+
−
+
-1,51
Konsekwnecje wielkości względnych
standardowych potencjałów redoks reakcji
Jeśli zestawimy ze sobą ogniwo z dwóch
połówek, w których zachodzą reakcje o róznych
potencjałach redoks, i jeśli
to wówczas reakcja utleniania będzie zachodziła
w połówce o wyższym potencjale, a reakcja
redukcji (
proces biegnący w przeciwną stronę!
)
w połówce o niższym potencjale (lecz zmiana
kierunku oznacza zmianę znaku potencjału!)
0
/
0
/
+
+
>
m
n
B
B
A
A
E
E
3
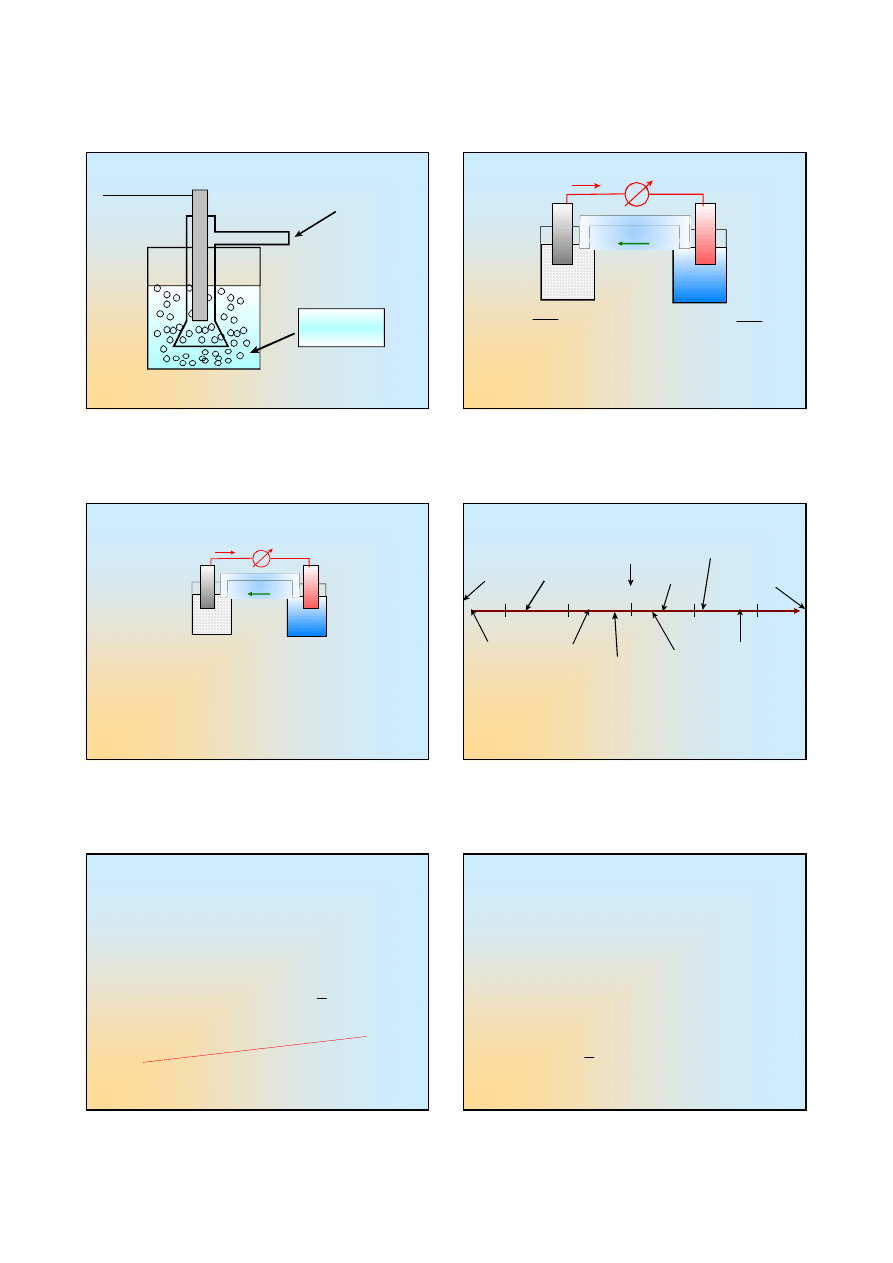
Co to jest normalna elektroda wodorowa ?
a
H O
3
1
+
=
H
2
, 101,3 kPa
25
E
C
Pt
E
H
H
2
0
0
/
+
=
Ogniwa galwaniczne
Zn
Cu
e
K
+
Cl
-
Cl
-
Zn
2+
Cu
2+
e
2
Zn
Zn
2
0
+
→
+
0
2
Cu
2
Cu
→
+
+
e
+
⋅
⋅
+
=
2
ln
2
0
Zn
Zn
Zn
c
F
T
R
E
E
+
⋅
⋅
+
=
2
ln
2
0
Cu
Cu
Cu
c
F
T
R
E
E
UTLENIANIE
REDUKCJA
Cu
Zn
Cu
Zn
+
→
+
+
+
2
2
Taka reakcja może zachodzić również wtedy, gdy do soli
miedzi wrzucimy kawałek metalicznego cynku
Utlenianie i redukcja w ogniwach
Zn
Cu
K
+
Cl
-
e
Cl
-
Zn
2+
Cu
2+
OGNIWO
DANIELLA
UTLENI
A
NIE
N
O
D
A
REDU
K
CJA
A
T
O
D
A
Reduktor (
utleniając się
)
wypiera utleniacz (
który się
redukuje
) z jego soli.
Anoda =
utlenianie
Katoda =
redukcja
Potencjały reakcji utleniania
E[V]
-2
-1
0
+2
+1
-2,9
K
º
K
+
+
‘
Mg
º
Mg
2+
+2
‘
-2,4
1,66
Al
º
Al
3+
+3
‘
Zn
º
Zn
2+
+2
‘
-0,7
Ni
º
Ni
2+
+2
‘
-0,23
H
2
º
2H
+
+2
‘
+0,5
2I
-
º
I
2
+2
‘
Cu
º
Cu
2+
+2
‘
+0,34
+1,1
2Br
-
º
Br
2
+2
‘
Au
º
Au
+
+
‘
+1,7
+2,85
2F
-
º
F
2
+2
‘
W parze reduktor-utleniacz, zawsze pierwiastek o niższym
potencjale utleniającym będzie
reduktorem
, a pierwiastek o
wyższym potencjale -
utleniaczem
...
Potencjały utleniające pierwiastków
Reduktor
(utleniając się) wypiera utleniacz z jego soli.
Uwaga na pierwiastki, dla których
formą utlenioną
jest
pierwiastek, a formą
zredukowaną
jego ujemny jon.
0
2
2
0
Cu
Zn
Cu
Zn
+
→
+
+
+
Metale wypierają wodór z wody i kwasów:
↑
+
→
+
2
2
1
2
H
NaOH
O
H
Na
↑
+
→
+
+
+
2
2
H
Zn
2H
Zn
↑
+
→
+
+
+
2
2
???
H
Cu
2H
Cu
Miedź i inne metale szlachetne nie rozpuszczają się w
kwasach z wydzielaniem wodoru, gdyż mają od niego
wyższy potencjał utleniający ...
Potencjały utleniające pierwiastków (2)
Dlatego niemetale o wy
ż
szym potencjale
utleniaj
ą
cym wypieraj
ą
z soli reduktory o ni
ż
szym
potencjale ...
2
2
I
2Br
2I
Br
+
→
+
−
−
2
2
Br
2F
2Br
F
+
→
+
−
−
nie mówiąc o reakcjach niemetali (utleniaczy) z
metalami (reduktorami):
−
+
+
→
+
Cl
K
Cl
K
2
2
1
4
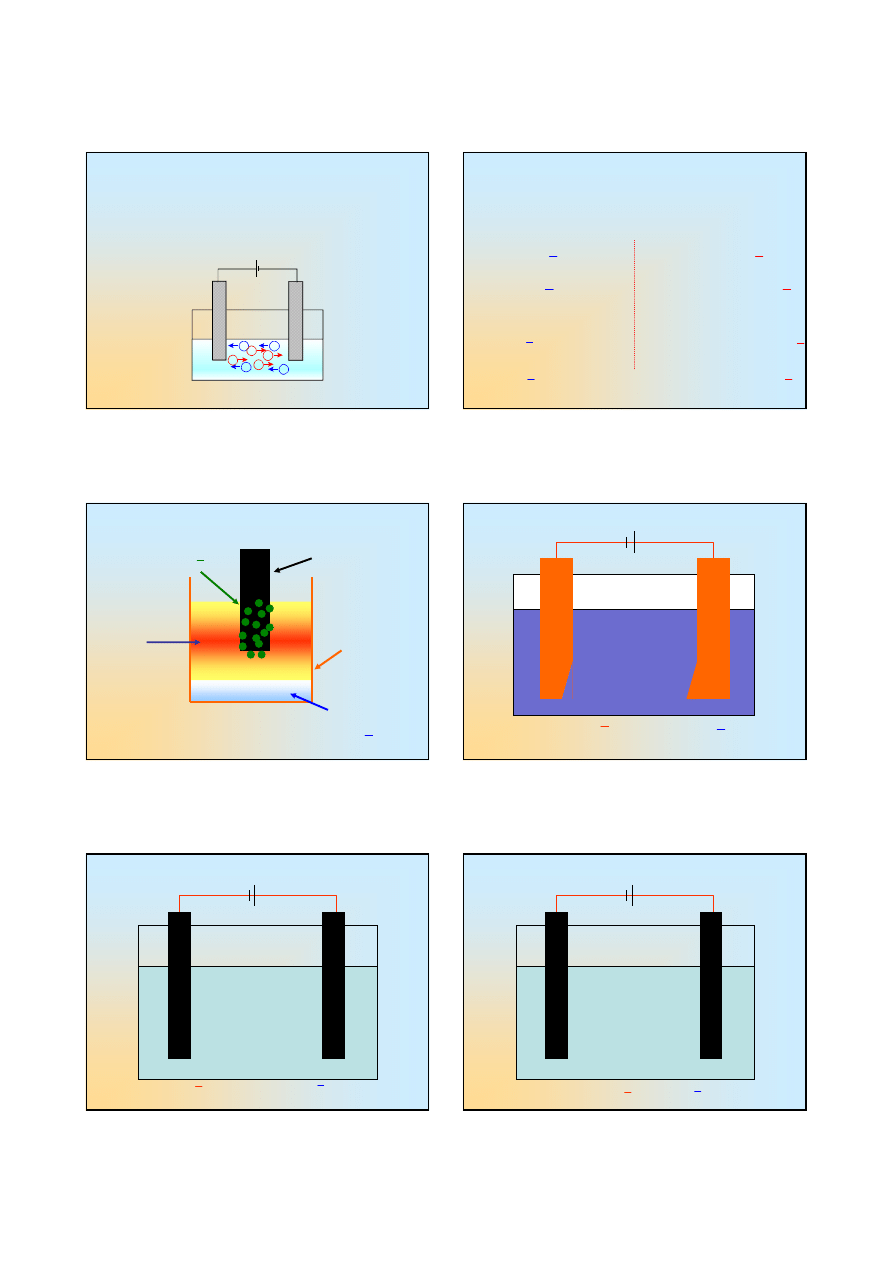
Elektroliza
Elektrolizą
nazywamy całokształt zjawisk
zachodzących w czasie przepływu prądu
elektrycznego przez roztwory elektrolitów, lub
przez stopione elektrolity ...
+
-
+
+
+
+
-
-
-
-
W roztworze
elektrolitu
przewodzenie
prądu odbywa
się na drodze
migracji jonów
dodatnich
i
ujemnych ..
.
Na elektrodach
zachodzą
procesy
utleniania
(anoda)
i
redukcji
(katoda)
Procesy elektrodowe
Jeśli poddamy elektrolizie wodny roztwór elektrolitu
o jonach dodatnich M
n+
i jonach ujemnych X
m-
...
KATODA
redukcja
ANODA
utlenianie
Me
Me
n
→
+
+
e
n
e
n
+
→
+
n
Me
Me
−
→
+
m
2
2X
2
X
e
m
e
m
2
X
2X
2
m
+
→
−
Woda także ulega elektrolizie ...
−
+
↑
→
+
2OH
H
2
O
2H
2
2
e
e
4
4H
O
O
2H
2
2
+
+
↑
→
+
O
2H
H
2
O
2H
2
2
3
+
↑
→
+
+
e
e
4
O
O
2H
4OH
2
2
-
+
↑
+
→
Elektrolityczne otrzymywanie metali
ciekły NaCl
t > 600ºC
katoda Fe
anoda - grafit
stopiony sód
UTLENIANIE
e
Cl
Cl
2
2
2
+
→
−
REDUKCJA
Na
e
Na
→
+
+
Elektrolityczne oczyszczanie metali
Cu
Cu
e →
e
Cu
Cu
2
2
+
→
+
Utlenianie
Cu
e
Cu
→
+
+
2
2
Redukcja
ANODA
KATODA
roztwór soli
miedziowej
Otrzymywanie gazów przez elektrolizę
e
Cl
Cl
2
2
2
+
→
−
e →
ANODA
KATODA
roztwór HCl
O
H
H
e
O
H
2
2
3
2
2
2
+
→
+
+
Elektroliza wody
e
O
O
H
OH
4
2
4
2
2
+
+
→
−
e →
ANODA
KATODA
roztwór KOH
−
+
→
+
OH
H
e
O
H
2
2
2
2
2

5
Elektroliza w ujęciu ilościowym -
prawa Faraday’a
Michael Faraday,
1791-1867
Masa substancji, która w wyniku
elektrolizy wydzieliła się na elektrodzie
lub uległa rozpuszczeniu jest proporcjo-
nalna do wielkości ładunku elektrycznego,
który przepłynął przez elektrolit
m=k
⋅⋅⋅⋅
Q=k · i · t
k
-
współczynnik elektrochemiczny,
charakterystyczny dla danej substancji
Jest to pierwsze prawo elektrolizy Faraday’a
Drugie prawo elektrolizy Faraday’a
Jeśli na katodzie osadza się metal, którego jony są
jednowartościowe, to:
Me
+
+ e
→
→
→
→
Me
na wydzielenie 1 mola metalu
potrzeba 1 mola elektronów
Jeśli na katodzie osadza się metal, którego jony są
dwuwartościowe, to:
Me
2+
+ 2e
→
→
→
→
Me
na wydzielenie 1 mola metalu
potrzeba 2 moli elektronów
Jeśli na katodzie osadza się metal, którego jony są
n-wartościowe, to:
Me
n+
+ ne
→
→
→
→
Me
na wydzielenie 1 mola metalu
potrzeba n moli elektronów
Drugie prawo elektrolizy Faraday’a
Współczynnik elektrochemiczny
Ładunek 1 mola elektronów (można obliczyć!)
wynosi
F=96500 C
i nosi nazwę stałej Faraday’a
k
n
Me
=
⋅
M
F
gdzie
k - współczynnik elektrochemiczny [gmol
-1
]
M
Me
- masa molowa metalu [g]
n -
liczba moli elektronów potrzebna do
zobojętnienia jednego mola jonów
t
i
F
n
M
m
Me
⋅
⋅
⋅
=
DWA W JEDNYM -
PRAWA ELEKTROLIZY
FARADAY’A
W JEDNYM WZORZE
Wyszukiwarka
Podobne podstrony:
podst chemii 05 07 08 id 365984 Nieznany
podst chemii 11 07 08
podst chemii 09 07 08
podst chemii 01 07 08
podst chemii 12 07 08
podst chemii 04 07 08
podst chemii 12 07 08
podst chemii 10 07 08
podst chemii 02 07 08 id 365977 Nieznany
podst chemii 03 07 08
podst chemii 10 07 08
chemia lato 13 07 08
więcej podobnych podstron