
POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY
CHEMIA ANALITYCZNA
WYKŁADY
ANALIZA ELEMENTARNA
ZWIĄZKÓW ORGANICZNYCH
Prof. dr hab. inż. M. Biziuk

2
Spis treści:
1
ANALIZA ELEMENTARNA.
------------------------------------------------------------------- 3
1.1
E
LEMENTARNA ANALIZA ORGANICZNA
.
-------------------------------------------------------- 3
1.2
P
ODSTAWOWE PODRĘCZNIKI
.
-------------------------------------------------------------------- 3
1.3
R
OLA I ZADANIA ANALIZY ELEMENTARNEJ
.
---------------------------------------------------- 3
1.4
S
POSÓB REALIZACJI
:
------------------------------------------------------------------------------ 4
1.5
Z
ASADY PRAWIDŁOWEGO WAŻENIA
.
------------------------------------------------------------ 6
1.6
M
ETODY MINERALIZACJI
.
------------------------------------------------------------------------ 6
1.6.1
Metody mineralizacji utleniającej na drodze mokrej.
------------------------------- 10
1.6.2
Metody mineralizacji utleniającej na drodze suchej
-------------------------------- 10
1.7
M
ETODY OZNACZANIA WĘGLA I WODORU
.
--------------------------------------------------- 13
1.8
O
ZNACZANIE WĘGLA METODĄ MOKRĄ
.
------------------------------------------------------- 16
1.9
S
POSOBY OZNACZANIA ZAWARTOŚCI ZWIĄZKÓW ORGANICZNYCH W POWIETRZU
.
------ 17
1.10
S
POSOBY OZNACZANIA ZAWARTOŚCI ZWIĄZKÓW ORGANICZNYCH W WODACH
.
----- 17
1.10.1
Etapy-----------------------------------------------------------------------------18
1.11
Oznaczanie
Cl, Br. I i S---------------------------------------------------------------18
1.12
P
ROBLEMY OZNACZANIA
TOX
W ŚRODOWISKU
.
----------------------------------------- 20
2
OZNACZANIE AZOTU.
------------------------------------------------------------------------ 21
2.1
I
NNE METODY OZNACZEŃ KOŃCOWYCH
:
----------------------------------------------------- 25
2.2
A
NALIZATORY
CHN
---------------------------------------------------------------------------- 25
3
OZNACZANIE AZOTU - METODY MOKRE.
-------------------------------------------- 26

3
1 ANALIZA ELEMENTARNA.
Organiczna i nieorganiczna.
1.1 Elementarna analiza organiczna.
Joseph Gay Lussac, L.J.Thenard
Justus Liebig, Fritz Pregl, Jean Baptiste Andre Dumas, J. Kjeldahl
prof. Bogusław Bobrański, prof. Edmund Kozłowski.
1.2 Podstawowe
podręczniki.
B.Bobrański, Analiza ilościowa związków organicznych, PWN,
Warszawa 1979.
J.P.Dixon, Modern methods in organic microanalysis, Van Nostrand,
Princeton 1968.
F.Ehrenberger, S.Gorbach, Methoden der organischen Elementar -
und Spurenanalyse, Verlag Chemie, Weincheim 1973.
A.Steyermark,
Quantitative
Organic Microanalysis, Academic Press,
New York 1961.
Metody instrumentalne w kontroli zanieczyszczeń środowiska (red.)
J.Namieśnik], Wyd. Pol. Gdańskiej, Gdańsk 1992.
Fizykochemiczne metody kontroli zanieczyszczeń środowiska,
(red.) J.Namieśnik, Z.Jamrógiewicz, WNT, Warszawa 1998.
Czasopisma:
Mikrochimica Acta.
Microchemical Journal.
1.3 Rola i zadania analizy elementarnej.
Wyznaczenie procentowej zawartości pierwiastka w związku
organicznym.

4
Obliczenie wzoru empirycznego i sumarycznego (znając masę
cząsteczkową).
np. C : H : N : O = % C / MC : % H / MH : % N/ MN : % O/MO
% C : % H : % O = 52.17 : 13.04 : 34.78
MC = 12.01; MH = 1.008; MO = 16.00
C : H : O = 4.348 : 13.04 : 2.174 / : 2.174
C : H : O = 2 : 6 : 1
C
2
H
6
O (C
2
H
5
OH)
Sprawdzanie
czystości związku
Oznaczanie
składu mieszanin
∆
%x
= A
1
- A = b (B-A) /100
A - % zawartość pierwiastka w oznaczanym związku
A
1
- % zawartość pierwiastka w mieszaninie
B - % zawartość pierwiastka w domieszce
b- procentowa zawartość drugiego związku w mieszaninie np.
zawartość winylopirydyny (%N = 13.39 - A) w koprecypitacie
wynik oznaczenia - 2.00 % N (A
1
); tylko winylopirydyna zawiera
azot (B = 0) 2.00 - 13.39 = (100-x). (0 - 13.39)/100
x = 200/13.39 = 14.94%
Oznaczanie
śladowych zawartości związków organicznych (TOC),
azotoorganicznych (TON), siarkoorganicznych (TOS),
chlorowcoorganicznych (TOX) itd. w środowisku (woda, powietrze,
gleba, żywność itd).
1.4 Sposób
realizacji:
zmniejszanie skali oznaczeń,
wprowadzanie szybkich technik analitycznych,
zastosowanie fizykochemicznych metod oznaczeń końcowych,
jednoczesne oznaczanie kilku pierwiastków,
automatyzacja
i
komputeryzacja,
sprzężenie z innymi metodami.
Maksymalnie krótki czas przy jak największej ilości informacji z jak
najmniejszej próbki.

5
Etapy analizy elementarnej
przygotowanie i odważenie próbki
podanie próbki do analizy
mineralizacja próbki
usunięcie produktów przeszkadzających
oznaczenie końcowe
obliczanie wyników
oszacowanie błędów i analiza wyników
Przygotowanie próbki
Do wyznaczania wzoru empirycznego substancja musi być chemicznie
czysta, tzn. taka, by poddana zabiegowi rozdzielania nie zmieniała składu
chemicznego i właściwości fizykochemicznych.
Sprawdzanie czystości:
− temperatura topnienia,
− temperatura wrzenia,
− gęstość,
− współczynnik załamania światła,
− badanie mikroskopowe,
− chromatografia (bibułowa i cienkowarstwowa).
Oczyszczanie:
− suszenie,
− krystalizacja,
− destylacja,
− ekstrakcja,
− sublimacja,

6
− chromatografia preparatywna, bibułowa i cienkowarstwowa.
Rozdrobnienie i homogenizacja.
1.5 Zasady
prawidłowego ważenia.
ustawienie wagi (z dala od źródeł ciepła wstrząsów i przeciągów).
waga powinna być czysta i nieuszkodzona,
ustawiona w poziomie,
przed
ważeniem sprawdzić i (ewentualnie) ustawić zero (wyzerować
wagę),
przedmiot ważony umieszczamy na lewej szalce, odważniki na
prawej,
płynne zaaretowywanie i odaretowywanie,
nieużywana waga powinna być zaaretowana,
wszystkie operacje na zaaretowanej,
przedmioty
ważone suche, czyste i w temp. pokojowej,
ciecze
ważymy w naczyniach zamkniętych,
nie
przekraczać maksymalnego obciążenia,
nie
stosować naczyń, na których powstają ładunki elektrostatyczne,
nie
dotykać palcami odważników i elementów ważonych.
Naczynka wagowe - zależą od sposobu mineralizacji.
Dodatek katalizatora: V
2
O
5
; K
2
Cr
2
O
7
; WO
3
Inne sposoby podawania próbki.
− dozowanie poprzez membranę,
− pętla gazowa.
1.6 Metody
mineralizacji.
Mineralizacja - przeprowadzenie oznaczanych pierwiastków
występujących w skomplikowanych połączeniach organicznych w proste i łatwe
do oznaczeń końcowych związki nieorganiczne.

7
Redukcyjne mokre:
− Kekulé - amalgamat sodowy z wodą,
− sód, potas, lit, wapń w roztworach etanolu, etanoloaminy lub
dioksanu,
Redukcyjne suche,
− stapianie z metalicznym sodem, stopem Devarda, krzemkiem
wapnia,
− katalityczna hydrogenizacja wobec katalizatora platynowego lub
niklowego - Ter Meulen (do oznaczania tlenu i chlorowca),
− mineralizacja w strumieniu azotu wobec katalizatora platynowego
Unterzaucher (do oznaczania tlenu).
Wady:
− zawodne,
− niebezpieczne (wodór),
− skomplikowane,
− retencja produktów mineralizacji na węglu,
− zakłócenia oznaczeń końcowych przez produkty niecałkowitej
mineralizacji.
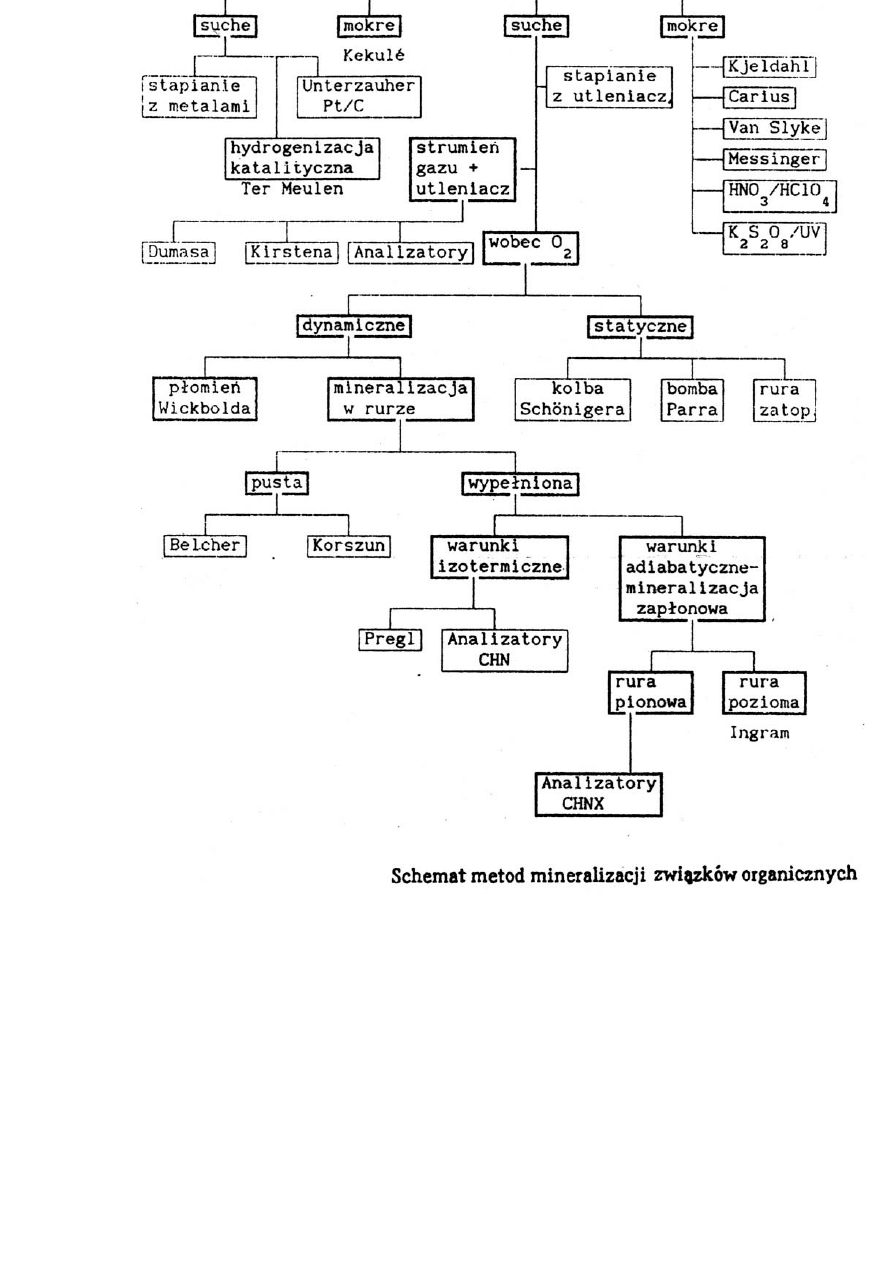
8
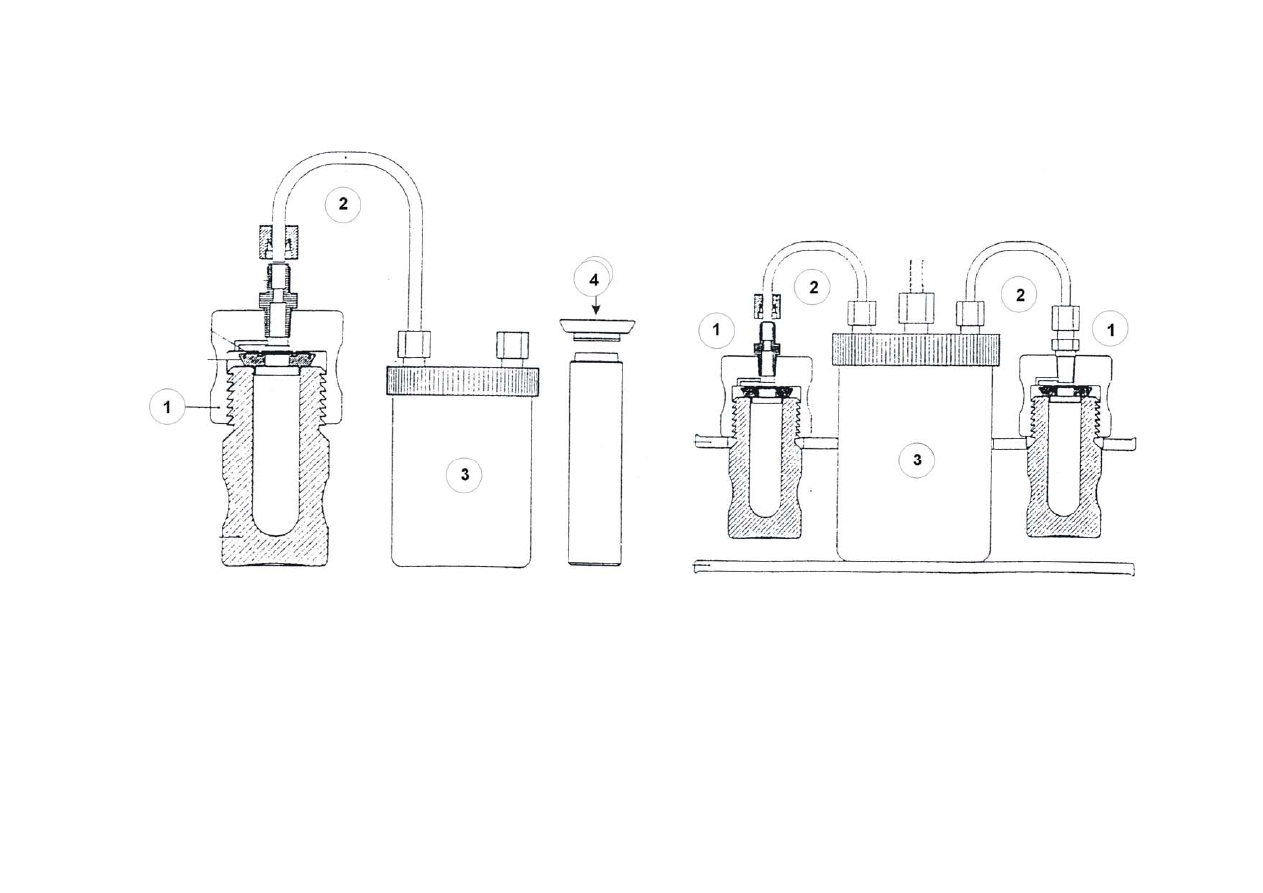
9
Rys. Bomba teflonowa do mineralizacji. 1. – Nakrętka; 2. – przewód łączący teflonowy; 3. – naczynie zabezpieczające; 4. – uszczelka zabezpieczająca.

10
1.6.1 Metody mineralizacji utleniającej na drodze mokrej.
metoda Kjeldahla (głównie do oznaczania azotu) - mineralizacja
poprzez ogrzewanie (na palniku lub w mineralizatorze) ze stężonym
kwasem siarkowym z dodatkiem utleniaczy,
ogrzewanie z kwasem azotowym z dodatkiem kwasu nadchlorowego
lub wody utlenionej (fosfor, siarka, bor, metale),
mineralizacja w kuchence mikrofalowej w kwasie azotowym w
zamkniętym naczyniu teflonowym,
Messinger - mineralizacja w kwasie siarkowym z dodatkiem kwasu
nadchromowego,
Van Slyke -mineralizacja w mieszaninie kwasu chromowego i
jodowego,
mineralizacja za pomocą promieniowania UV po dodaniu K
2
S
2
O
8
,
(oznaczanie TOC - automatyczne analizatory),
metoda Cariusa - mineralizacja w zatopionej rurze z kwasem
siarkowym w temp. 300
0
C pod podwyższonym ciśnieniem,
stapianie w bombie Parra z NaNO
3
, KNO
3
, Na
2
CO
3
, Na
2
O
2
.
1.6.2 Metody mineralizacji utleniającej na drodze suchej
W strumieniu gazu obojętnego z dodatkiem utleniaczy.
met Dumasa-Pregla - w strumieniu CO
2
wobec CuO (700
0
C),
met. Kirstena - w strumieniu CO
2
wobec NiO ( 1000
0
C),
analizatory CHN - w strumieniu helu z dodatkiem różnych utleniaczy.
Wobec tlenu – statyczne.
kolba
Schönigera,
bomba
Parra,
zamknięta rura.
Wobec tlenu dynamiczne.
płomień Wickbolda (płomień wodoro-tlenowy),
pusta rura (Belcher, Korszun, Denstedt).
− metoda popiołowa.
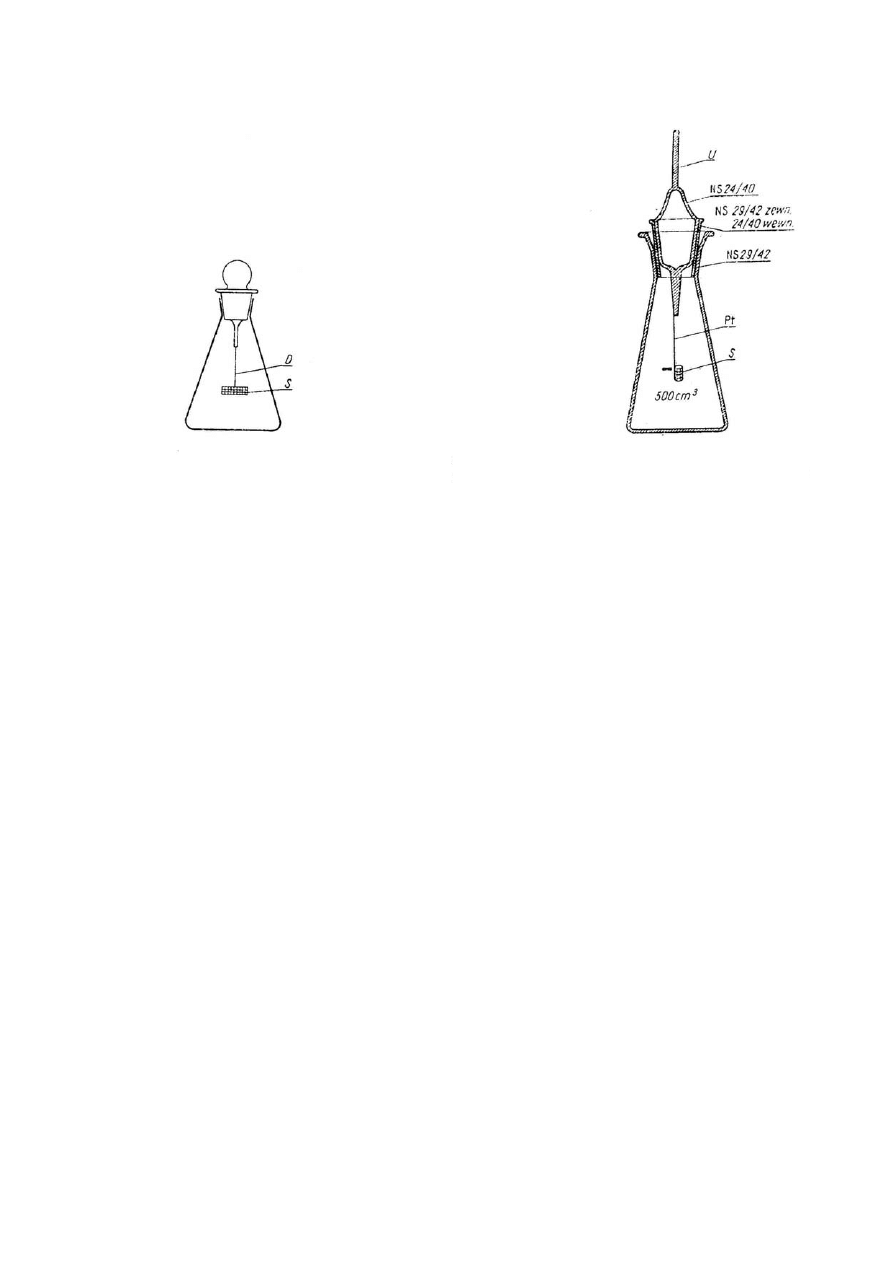
11
rura
wypełniona, warunki izotermiczne.
− Pregl,
− analizatory
CHN.
rura
wypełniona, warunki adiabatyczne - mineralizacja zapłonowa.
rura
pozioma,
rura
pionowa,
analizatory.
Zalety mineralizacji zapłonowej:
− szybkość,
− ilościowość,
− wysoka temperatura – 1700
0
C.
Modyfikacje:
− wkładka ochronna,
− zaworek
zwrotny.
Stosowane katalizatory i utleniacze: Pt, CuO,
kat. Körbla - produkt termicznego rozkładu AgMnO
4
;
Co
3
O
4
, V
2
O
5
, MnO
2
, NiO, CeO
2
Osadzone na nośnikach:
pumeks, porowata krzemionka, korund Horacek - zdolności utleniające:
Co
3
O
4
> MnO
2
> NiO > CuO > Cr
2
O
3
> CeO
2
Rys. Kolba do spalań w tlenie według
Schönigera: D – drut platynowy, S – siatka
platynowa.
Rys. Kolba Gedansky’ego; U – uchwyt, Pt –
drut platynowy, S – siatka platynowa.
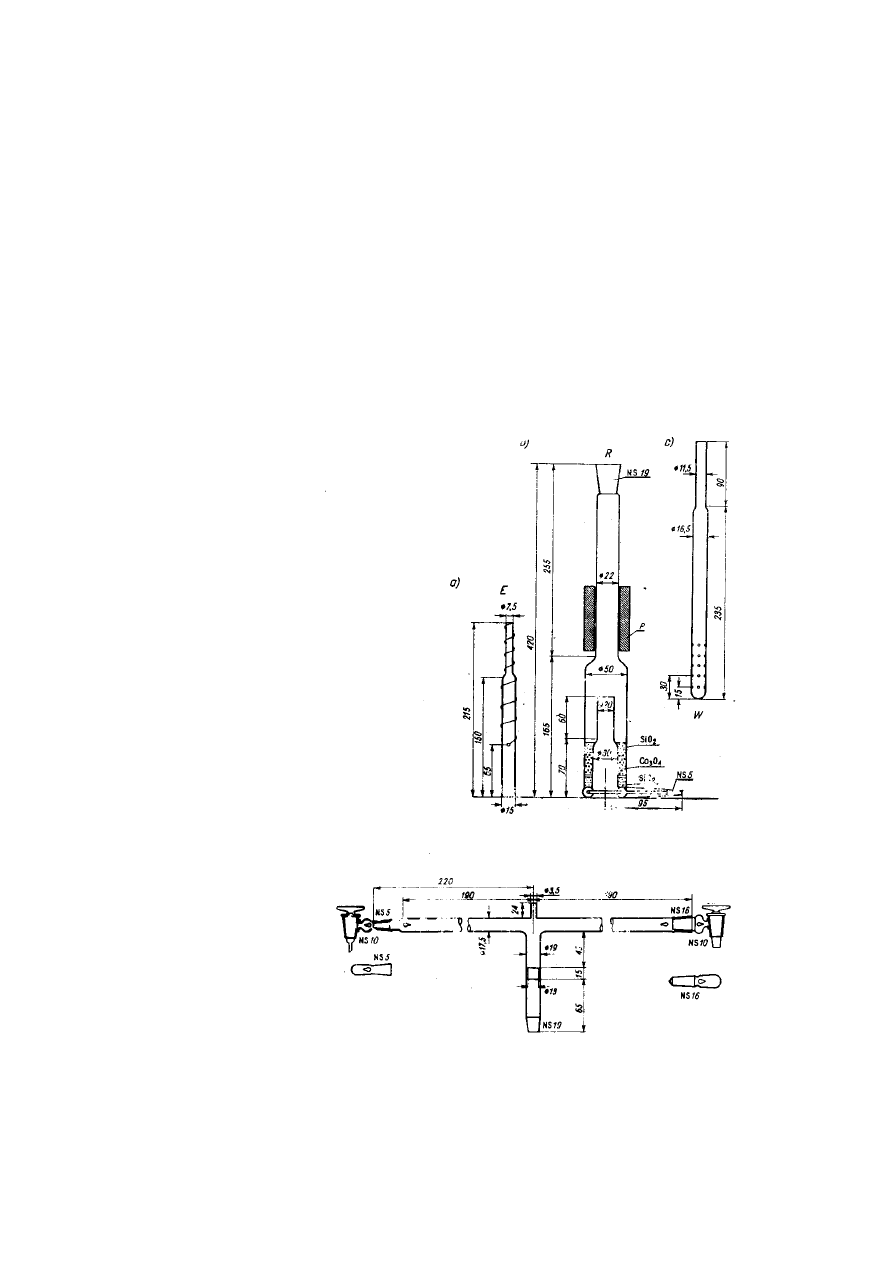
12
Cząstkowe ciśnienie tlenu
MnO
2
> Pb
3
O
4
> Co
3
O
4
> CuO.
Zasady doboru:
− brak reakcji wypełnienia z rurą do mineralizacji,
− brak retencji oznaczanych produktów mineralizacji,
− odporność mechaniczna,
− wysokie temperatury topnienia, odporność temperaturowa,
− zdolność zatrzymywania przeszkadzających produktów
mineralizacji.
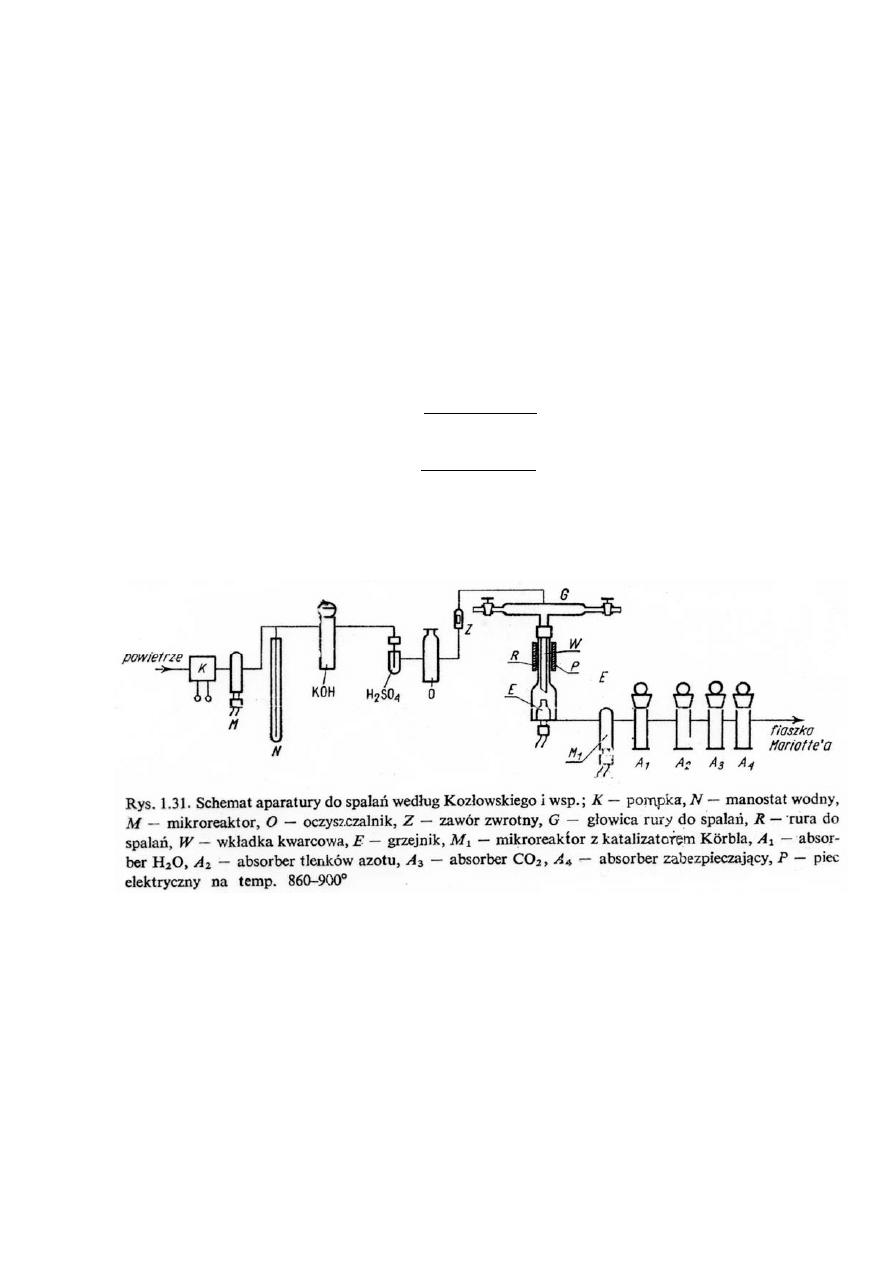
Rys. Głowica rury do spalań według Kozłowskiego
Rys. Rura do spalań według
Kozłowskiego; R – rura
kwarcowa, W – wkładka,
E – wkład grzejny
Oznaczanie węgla i wodoru

13
Oznaczenia końcowe.
I. Bezwzględne.
II. Porównawcze.
Bezwzględne:
metody
grawimetryczne:
− strąceniowe,
− grawimetria
bezpośrednia.
metody
wolumetryczne:
− miareczkowe,
− gazomiernicze.
Porównawcze:
metody fizykochemiczne:
− termokonduktometria,
− kulometria,
− potencjometria,
− elektrody jonoselektywne,
− spektrometria mas,
− spektrofotometria (kolorymetria, IR, AAS, ICP).
1.7 Metody oznaczania węgla i wodoru.
Zaleta oznaczeń jednoczesnych:
− oszczędność próbki,
− oszczędność czasu,
− większa ilość informacji z jednego oznaczenia.
Najczęściej mineralizacja utleniająca na drodze suchej w przepływie
strumienia gazu (tlen, powietrze, hel + tlen).
I. Oczyszczanie strumienia gazu.
− mineralizacja
związków organicznych,
− usuwanie wody, CO
2
i innych produktów przeszkadzających w
oznaczeniach końcowych (związki chlorowców i siarki).

14
II. Mineralizacja.
− Gay Lussac sprasowana pigułka zawierająca chloran
potasowy i analizowaną substancję (lampa spirytusowa),
− Berzelius - pozioma rura,
− Belcher (konstrukcyjne - pusta rura, strumień tlenu, temp.
800-900
0
C),
− Korszun - wkładka pirolityczna,
− Belcher i Spooner - zmiany konstrukcyjne rury,
− Denstedt - gwiazdy platynowe,
− Pregl-rura
wypełniona CuO (750
0
C), azbestem platynowanym
i srebrem,
− Ingram - mineralizacja zapłonowa,
− Kozłowski, Miller, Merz, Francis-Minnik, Clerc,
− pionowa rura,
− kapsułki z folii srebrnej, cynkowej lub glinowej,
− dodatek utleniacza (problem czystości),
III. Oczyszczanie gazów po mineralizacji.
X, S, - katatalizator Körbla, Ag, Ag/Al
2
O
3
, wolframian srebra,
P - reakcja z rurą kwarcową, dezaktywacja wypełnienia, koksiki
fosforowe, filtr z MgO,
F - atakuje kwarc, produkty lotne (SiF
4
, CF
4
), filtr z MgO lub Pb
3
O
4
metale - (mogą wiązać CO
2
) - dodatek K
2
Cr
2
O
7
, V
2
O
5,
As, Sb, Bi - zatruwają Pt, atakują kwarc i wypełnienie,
B - trudno spalające się związki,
N - problem tlenków (redukcja na ogrzanej miedzi, pochłanianie
zewnętrzne i wewnętrzne).
Wewnętrzne:
− PbO
2
w temp. 180
0
C,
− PbO
2
+ 2 NO
2
= Pb(NO
3
)
2,
− PbO
2
+ 2 NO = Pb(NO
2
)
2.
Wady:
− pochłania pary organiczne, niezupełna adsorpcja,
− higroskopijne,
rozkłada się.
15
Zewnętrzne:
− MnO
2.
IV. Oznaczanie końcowe.
Grawimetryczne.
− woda: suchy CaCl
2
, stężony H
2
SO
4
, bezwodny CaSO
4
,
P
2
O
5
(najbardziej ilościowy), bezwodny Mg(ClO
4
)
2
-
anhydron, CoCl
2
(zmienia kolor),
− CO
2
: askaryt (azbest i NaOH), NaOH, LiOH.
s
O
MH
H
2
19
,
11
%
∆
×
=
s
MCO
C
2
29
,
27
%
∆
×
=
V. Źródła błędów oznaczeń.
Pobieranie,
¾
Przygotowanie,
¾
Odważanie,
¾
Błędy metodyczne,
− czystość katalizatorów i utleniaczy,
− tło gazu nośnego,
− nieszczelność zestawu,

16
− niecałkowita mineralizacja: koksiki, CH
4
, CxHy, CO,
− cofanie produktów mineralizacji poza gorącą strefę,
− metale alkaliczna, tlenki azotu, inne zanieczyszczenia,
− substancje organiczne z drenów i smarów,
− ważenie absorberów.
1.8 Oznaczanie
węgla metodą mokrą.
Kiedy - wobec As, Sb, Bi, B, metali alkalicznych, zw. wybuchowych
Messinger: ogrzewanie z H
2
SO
4
i kwasem chromowym.
CO
2
i CO przez rozżarzoną CuO
Van Slyke: działanie kwasu chromowego i jodowego w środowisku
bezwodnym (mieszanina dymiącego H
2
SO
4
i H
3
PO
4
).
h
ν /K
2
S
2
O
8
- usuwanie C nieorganicznego przez zakwaszenie H
3
PO
4
K
2
S
2
O
8
i podgrzewanie w 180
0
C
Oznaczenia końcowe:
¾
grawimetryczne,
¾
miareczkowe,
¾
IR,
¾
elektrody jonoselektywne.
Oznaczanie OWO (TOC) – ogólnego węgla organicznego:
Wskaźniki sumaryczne - ich przydatność w analizie środowiskowej.
W środowisku co najmniej 100 000 związków organicznych na poziomie
zawartości większej niż 10
-10
%.
W powietrzu miejskim identyfikowano 41 - 126 lotnych związków organicznych.
Ilości związków organicznych w wodach:
głębinowe
>0,1mg/l
oceaniczne 0,5 – 1,5
morska
2-8
Bałtyk 4-7
rzeki ok. 10
jeziora
6 - 15

17
Sposoby podejścia - metody oznaczania:
powietrze
TIC = CO
2
+ CO
TOC = CH
4
+ NMTHC
woda
TIC = CO
2
+ HCO
3
-
+ CO
3
-2
TOC = SOC + DOC
TOC = VOC + NVOC
TOC = EOC + NEOC
TOC = POC + NPOC
TOC = AOC + NAOC
1.9 Sposoby oznaczania zawartości związków organicznych w
powietrzu.
TIC - selektywne utlenienie CO do CO
2.
TOC
bezpośrednie z wykorzystaniem FID lub PID (fotojonizacyjny, nieczuły na
metan) sygnał zależy od rodzaju związku, a więc zafałszowanie
wzbogacenie na sorbencie, desorpcja termiczna i FID lub PID
(indywidualnie)
mineralizacja i oznaczanie CO
2
= TOC konwersja do metanu i FID
różnicowy pomiar zmian temperatury złoża katalizatora spowodowanych
ciepłem spalania katalitycznego
usunięcie TIC, utlenienie organicznych składników, oznaczenie CO
2
1.10 Sposoby oznaczania zawartości związków organicznych w wodach.
strata przy prażeniu suchej pozostałości.
ChZT - chemiczne zapotrzebowanie tlenu - ilość związków
organicznych ulegających rozkładowi wobec silnego utleniacza
(KMnO
4
K
2
Cr
2
O
7
) i podwyższonej temperatury.

18
BZT - biologiczne zapotrzebowanie tlenu - zużycie tlenu
rozpuszczonego w trakcie rozkładu związków organicznych.
TOC – najlepszy.
1.10.1 ETAPY.
Pobieranie i przygotowanie próbek:
− naczynia
szklane,
− przechowywać w temp. 4-6
0
C w cieniu, bez
napowietrzania;
− usuwanie
zawiesiny,
− oznaczenie najlepiej do 2 godz. od pobrania,
− jeśli nie można, to zakwasić do pH < 2 za pomocą HCl lub
H
2
SO
4.
1.11 ZNACZANIE Cl, Br, I i S.
Metody redukcyjne:
Hydrogenizacja katalityczna (Ter Meulen), wobec Pt w 1000
0
C,
oznaczanie HX lub H
2
S;
wady: zawodna, skomplikowana, niebezpieczna, retencja na
osadzającym się węglu, produkty niecałkowitej mineralizacji
zakłócają oznaczanie końcowe.
stapianie z amalgamatem sodowym (K, Ca, Li) – Kekulé.
Metody utleniające mokre:
Metoda Cariusa - zatopiona rura ze stężonym HNO
3
; ogrzewanie
w 550
0
C powstaje NH
4
X, (NH
4
)
2
SO
4
,
(500ml)
Metoda Kjeldahla - stęż. H
2
SO
4
+ K
2
Cr
2
O
7
HNO
3
(szczególnie do S) i HClO
4
S SO
4
-2
Stapianie z Na
2
CO
3
, NaNO
3
, KNO
3
, Na
2
O
2
- bomba Parra
dodatek substancji organicznych.

19
Metody utleniające suche:
kolba Schönigera: 250 – 500 ml; tlen; t do 1250
0
C, czas 20-30 s
dodatek KNO
3
, KClO
3
, Na
2
O
2
roztwór absorpcyjny - NaOH +
H
2
O
2.
pusta rura - Belcher - w strumieniu tlenu (zawodna
mineralizacja)
rura z katalizatorem platynowym - gwiazdy Denstedta (PtX lotne,
zatrucia gwiazd).
rura z wypełnieniem - Co
3
O
4
, V
2
O
5.
mineralizacja zapłonowa.
płomień Wickbolda - w strumieniu tlenu i wodoru, ochłodzenie,
absorpcja na kolumnie z pierścieniami i oznaczenie końcowe.
Oznaczenia końcowe.
Chlorowce:
grawimetria
− strąceniowe (halogenki i siarczany)
− bezpośrednia
− w rurze na BaCO
3
za rurą na Ag w temp. 400-800
0
C (kat.
Körbla, MnO
2
, PbO
2
, Sb, Bi).
Metoda Kozłowskiego z tlenojodkiem srebra Ag
2
OI
2
C
t
Ag
I
OI
Ag
C
t
HX
X
0
2
2
2
0
550
220
,
=
=
s
f
X
Ag
100
%
×
∆
×
=
f
Cl
= 0,2794
f
Br
= 0,6297
− możliwość identyfikacji;
− możliwość oznaczania wobec siebie poprzez ważenie srebra i
tlenojodku
Metody miareczkowe:
− pochłonięcie w rurze na BaCO
3
lub za rurą w roztworze
alkalicznym
− acydymetria
bezpośrednia:

20
− argentometria (AgNO
3
) - metody Volharda i Mohra:
niedokładne, niskie stężenia, słaba zmiana barwy,
miareczkowanie azotanem rtęciowym wobec fluorosceiny dla
Cl, eozeiny dla Br, miareczkowanie nadchloranem rtęciowym
wobec dwufenylokarbazonu.
Metoda Winklera Leiperta:
I
2
+ 5Br
2
+6 H
2
O 2HIO
3
+ 10 HBr
2 HIO
3
+ 10 HI 6 I
2
+ 6 H
2
O
Metody współoznaczania X z C i H.
w pustej rurze; kontakt platynowy; grawimetryczne lub
miareczkowe
w rurze wypełnionej Co
3
O
4
Zyskowska
X na sucho
X na mokro (sorpcja w H
2
O
2
; wygotowanie; miareczkowanie
nadchloranem rtęci wobec dwufenylokarbazonu)
s
f
X
100
%
×
×
=
v
gdzie: f = NxR
N - stężenie titrantu; R
Cl
= 35,457; R
Br
= 79,916
NHX – Biziuk
1.12 Problemy oznaczania TOX w środowisku.
Analizatory TOX.
9
Mitsubishi - AOX, węgiel aktywny, wymycie chlorków nieorganicznych
roztworem azotanu; mineralizacja; kulometria, ślepa wartość mniejsza
niż 0,4µg/l, granica oznaczalności 2 µg/l TOX
9
Dohrmann
9
Ströhlein - AOX wytrząsanie z węglem aktywnym
EOX - heksan/heptan
POX – wypłukiwanie (stripping) w temp. 60
0
C
21
2 Oznaczanie azotu.
Tradycyjnie oznaczany pojedynczo.
Znaczenie:
− wzór
sumaryczny
− stopień czystości
− skład mieszaniny dwuskładnikowej
− skład produktów technicznych
− analiza
środowiskowa
Metody mineralizacji:
I. utleniająca na drodze suchej - Dumasa Pregla
II. utleniająca na drodze mokrej - Kjeldahl
III. redukcyjne na drodze suchej
− Ter Meulen - w strumieniu wodoru; kat. Ni; oznaczania
NH
3
miareczkowe lub metodą mokrą
− stapianie z Na, stopem Dewara lub krzemkiem magnezu,
końcowe oznaczanie w postaci jonów cyjankowych lub
amonowych.
Pozioma rura; w atmosferze CO
2
; CuO/Cu
700
0
C
500
0
C
C
x
H
y
N
z
O
w
CO
2
, CO, H
2
O, N
x
O
y
, N
2
, O
2
CO
2
, CO, H
2
O, N
2
CuO
Cu
200
0
C
50 %
CO
2
, H
2
O, N
2
N
2
CuO
KOH
100
)
(
%
0
×
−
×
=
s
k
N
v
v
gdzie: v
0
- objętość tła
v - zmierzona objętość
k - gęstość azotu w danych warunkach ciśnienia i temperatury
pomniejszona o prężność pary wodnej nad 50 % roztworem
KOH
s - wielkość odważki
Źródła CO
2
: aparat Kippa; stały CO
2
; butla ze sprężonym CO
2

22
Możliwe wady:
¾
redukcja CO
2
do CO na miedzi metalicznej
¾
rozkład CuO powyżej 650
0
C
¾
powietrze zaokludowane na CuO
¾
powstawanie metanu przy długich łańcuchach (dodaje się V
2
O
5
,
Co
3
O
4
, CeO
2
)
¾
koksiki azotowe (heterocykle, pochodne chlorofilu, pirymidyny,
imidazolu, puryny)
¾
niecałkowita redukcja N
x
O
y
do N
2
¾
retencja N
x
O
y
¾
długi czas analizy
Zmiany:
− podwyższenie temperatury - Kirsten NiO/Ni (1050
0
C)
CO
2
CO + 1/2 O
2
− dodatek tlenu (elektroliza, butla, rozkład H
2
O
2
) - Unterzaucher
− mineralizacja
zapłonowa
− Merz - spalanie w czystym tlenie, wypłukiwanie helem
− Kozłowski / Biziuk
Oznaczanie końcowe:
Gazomiernicze w azotometrze
Pregl
Mitsui
Ehrenberger
Gustin - Merz
Problemy: ociekanie i pienienie się ługu, czas na dojście do równowagi
termicznej,
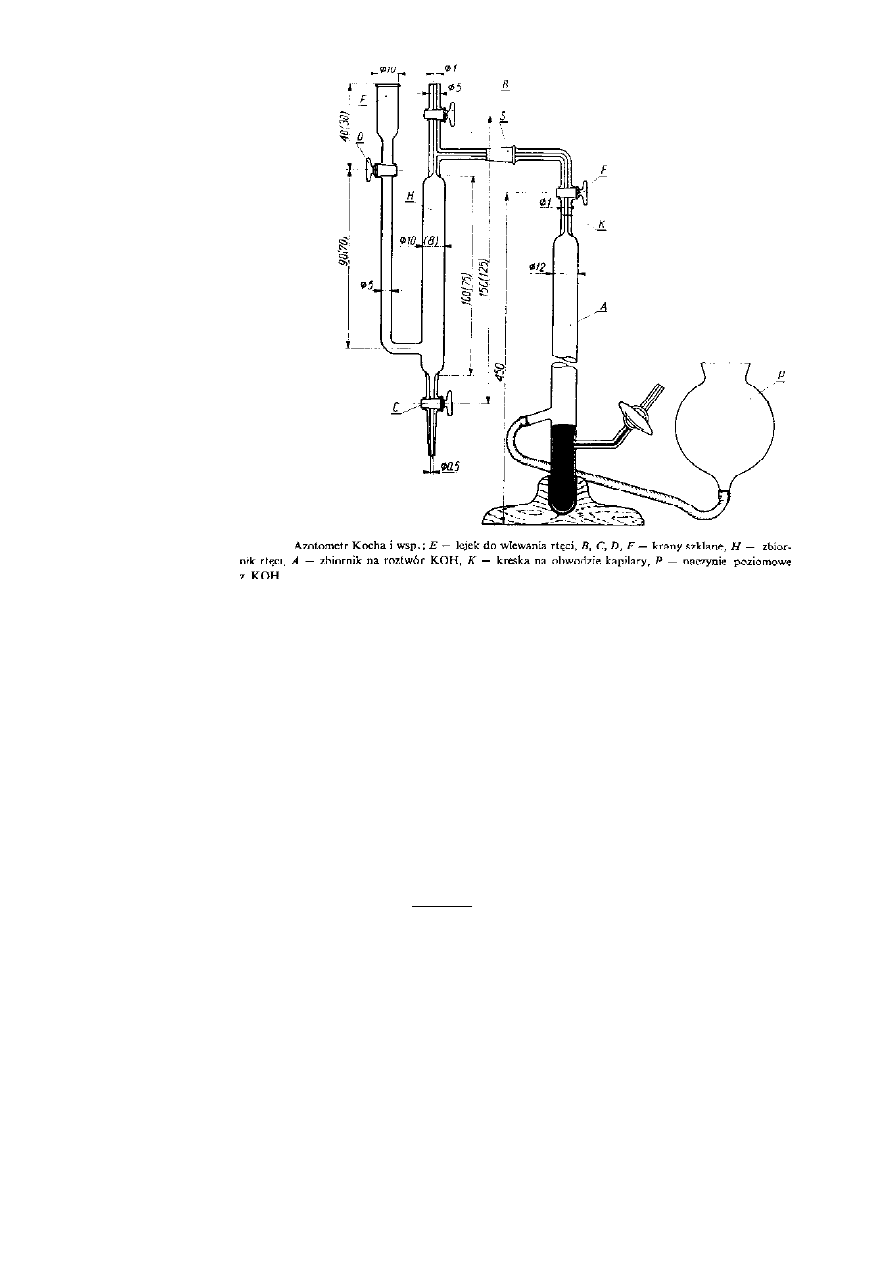
azotometr wagowy Kocha: eliminacja błędów wynikających ze
żrącego działania KOH
1 cm
3
N
2
= 13,55 g rtęci.
23
Zasada działania azotometru Kocha:
Rtęć w zbiorniku H
napełnia się zbiornik ługiem do pkt K przy otwartych zaworach F i B
zamyka się kran F i przeprowadza spalanie przy opuszczonym
naczynku wyrównawczym
zamyka się krany B i D i podnosi nacz. wyr. do poziomu K
otwarcie kranu F i wypuszczenie przez kran C tyle rtęci, by roztwór
dotarł do poziomu K
100
%
×
×
=
s
M
F
N
Hg
gdzie: M
Hg
- masa rtęci w g;
F - współczynnik do przeliczania gramów rtęci na miligramy
azotu, zależny od ciśnienia barometrycznego i temperatury
pomiaru (dla 750 mm Hg i t. 22
0
C F = 0,08395)
Rys.
24
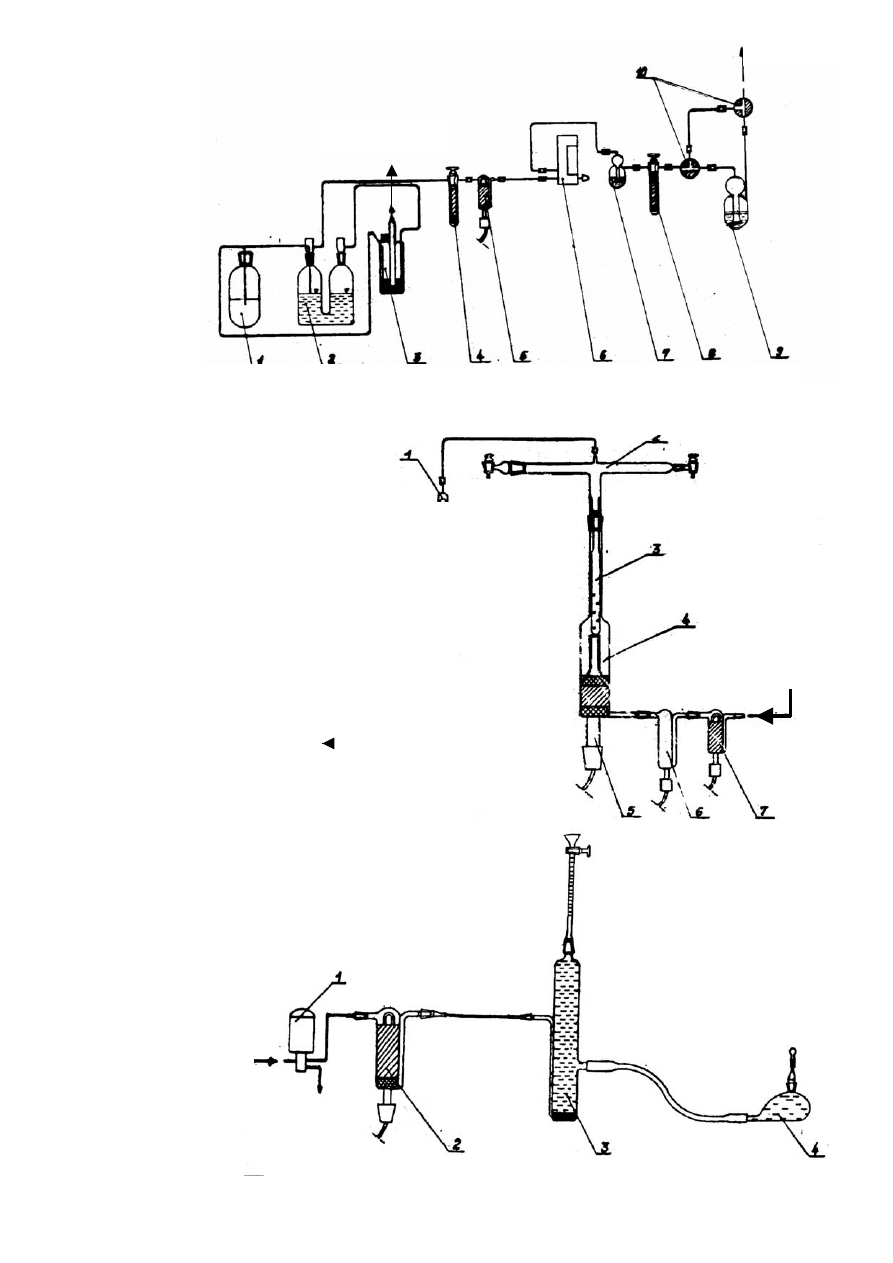
Rys. Schemat połączeń gazowych układu
mineralizacyjnego analizatora; 1. – zaworek zwrotny,
2. – głowica rury, 3. – wkładka ochronna, 4. – rura do
mineralizacji, 5. – wkład grzejny, 6. – mikroreaktor
wypełniony Ag
2
OJ
2
i owinięty folią glinową, 7. –
mikroreaktor wypełniony srebrem.
Gaz z zasilacza
gazowego
Do automatu
grawimetrycznego
lub układu
azotometru
Rys. Schemat połączeń gazowych zasilacza gazowego analizatora; 1. – generator CO
2
, 2. – elektrolizer, 3. – wyrównywasz
ciśnień, 4. – osuszalnik, 5. – mikroreaktor, 6. - rotametr, 7. – licznik banieczek, 8. – osuszalnik, 9. – nawilżacz powietrza,
10. - krany dwudrogowe.
N
2
+ nadmiar CO
2
na zewnątrz
Do układu
mineralizacyjnego
Rys. Schemat połączeń gazowych układu
azotometru analizatora; 1. – zawór
elektromagnetyczny, 2. – mikroreaktor
wypełniony Cu+CuO, 3. – azotometr,
4. – naczynie wyrównawcze.
Z automatu
grawimetrycznego
Na zewnątrz

25
2.1 Inne metody oznaczeń końcowych:
• grawimetryczne - MnO
2
• manometryczne
• spektrometria
mas
• termokonduktometria
(czuły, mało zawodny, niedrogi; reaguje na
CO
2
, H
2
O, N
2
, i na: CO, CH
4
, H
2
S, SO
2
, C
2
H
2
, liniowy w szerokim
zakresie). Wady: Konieczność kalibracji, stosowania He (drogi i
gorsze warunki mineralizacji), dodatku tlenu i usuwania tlenu,
niska czułość na H
2
O (przetwarzanie w H
2
lub CH
4
), liniowość
tylko przy niskich stężeniach,
• chemiluminescencja - czysta, szybka (30 s do 8 min), dokładna i
precyzyjna, 1000
0
C
N NO + O
3
NO
2
* +O
2
NO
2
+ O
2
+ h
ν
Automatyczne oznaczanie N
Merz (gazomierniczy)
Coleman (gazomierniczy)
Antek (chemiluminescencyjny)
Carlo Erba (gazomierniczy)
Dohrmann (chemiluminescencyjny)
Współoznaczanie azotu z innymi pierwiastkami
NH - Wurzschmidt
NH - Ono, Nakamura, Kawada
NHX - Kozłowski, Biziuk
2.2 Analizatory
CHN
I. Zalety:
− czas
− mniej pracochłonne
− uniezależnienie od subiektywnych predyspozycji
eksperymentatora

26
II. Automatyzacja:
− ważenia (mechaniczna, pneumatyczna, elektroniczna)
− wyliczanie wyników z zastosowaniem łańcucha zazębiających
się metod
− wprowadzanie próbek - podajniki
− mineralizacja (zapłonowa)
− oznaczania końcowe (fizykochemiczne)
Analizatory: Perkin-Elmer
Hereus
Hewlett Packard
Technicon (Walish)
Fisher
Laboratory Instr.
Wösthoff
Carlo-Erba
3 Oznaczanie azotu - metody mokre.
Metoda Kjeldahla - analiza roztworów wodnych, moczu, krwi, płynów
fizjologicznych
Ograniczone zastosowanie w przypadku związków: nitrowych,
heterocykli i łatwo lotnych.
− aparat Parnasa Wagnera
¾
Mineralizacja próbki w stężonym H
2
SO
4
z dodatkiem utleniaczy i
katalizatorów: kw. nadchlorowy, woda utleniona, rtęć, CuSO
4
, Se, Hg
2
O,
K
2
SO
4
do podwyższenia temp. wrzenia do 410
0
C
− kw. salicylowy, pirogalol w przypadku grup azowych
− glukoza, redukcja jodowodorem, Zn + HCl - grupy nitrowe
¾
Zalkalizowanie 40 % roztworem NaOH
¾
Oddestylowanie z parą wodną
¾
Pochłonięcie w nasyconym roztworze kwasu borowego wobec czerwieni
metylowej i zieleni bromokrezolowej

27
Miareczkowanie alkacymetryczne (0,01 mol/l HCl) lub jodometryczne.
100
v
%
×
×
×
=
s
c
14
N
l
HC
gdzie: - v - objętość zużytego HCl
c
HCl
- stężenie HCl
s - wielkość odważki
Inne metody oznaczeń końcowych:
− kulometryczne
− potemcjometryczne
Aparat Kjeltec - firmy Tecator
− roztwór do celki: KBr, KHCO
3
, KOH
− roztwór
uzupełniający : KBr i NaOH
¾
Mineralizacja próbki - kwas siarkowy, woda utleniona, Se – 360
0
C
¾
Kalibracja przyrządu, sporządzenie krzywej wzorcowej
¾
Oznaczenie
¾
Obliczenie wyników.
%
100
%
2
×
×
=
s
cN
N
k
v
dla zawartości białka
% B = % N x 6,25
gdzie: cN
2
- wyznaczone z krzywej kalibracji stężenie azotu w badanej
próbce
v
k
- objętość kolbki z analizowana próbką
s - wielkość odważki
Oznaczanie białka w paszach, żywności i azotu w wodzie.
10 - 150 analiz dziennie
Reakcje:
2 NH
4
+
+ 3OBr
-
= N
2
+ 3 Br
-
+ 2 H
+
+ 3 H
2
O (pH = 8,6 do 9,3)
Br
2
+ OH
-
= OBr
-
+ Br
-
+ H
2
O
2Br
-
= Br
2
+ 2 e
-
28
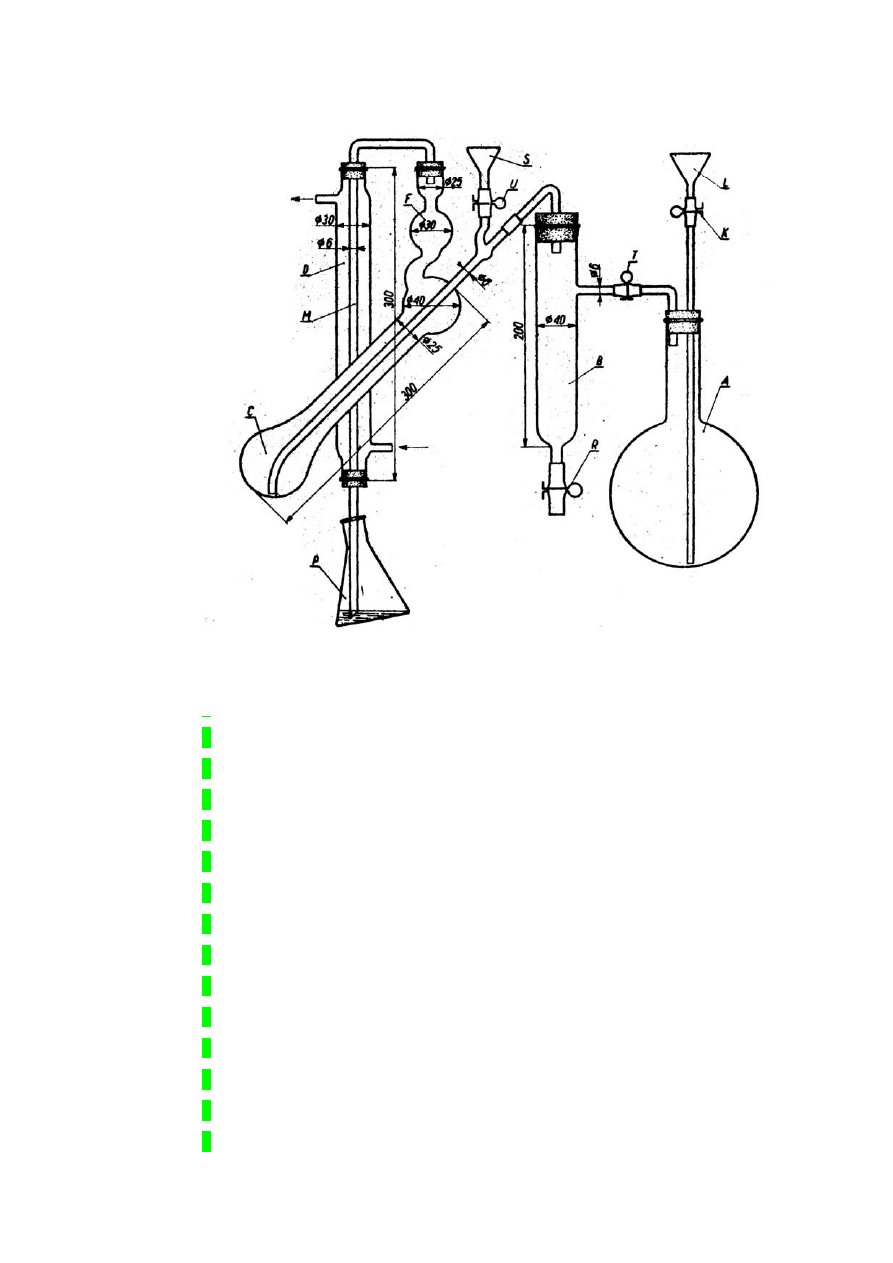
Rys. Aparat Parnasa i Wagnera do destylacji amoniaku; A – kolba do wywiązywania pary wodnej, B – rura
osuszająca parę, C – kolba destylacyjna, F – deflegmator, D – chłodnica, M – rura srebrna chłodnicy, P –
odbieralnik, S – lejek do wlewania roztworu zawierającego amoniak, K, R, T, U – ściskacze sprężynowe, L – lejek
do napełniania wodą kolby A.
29
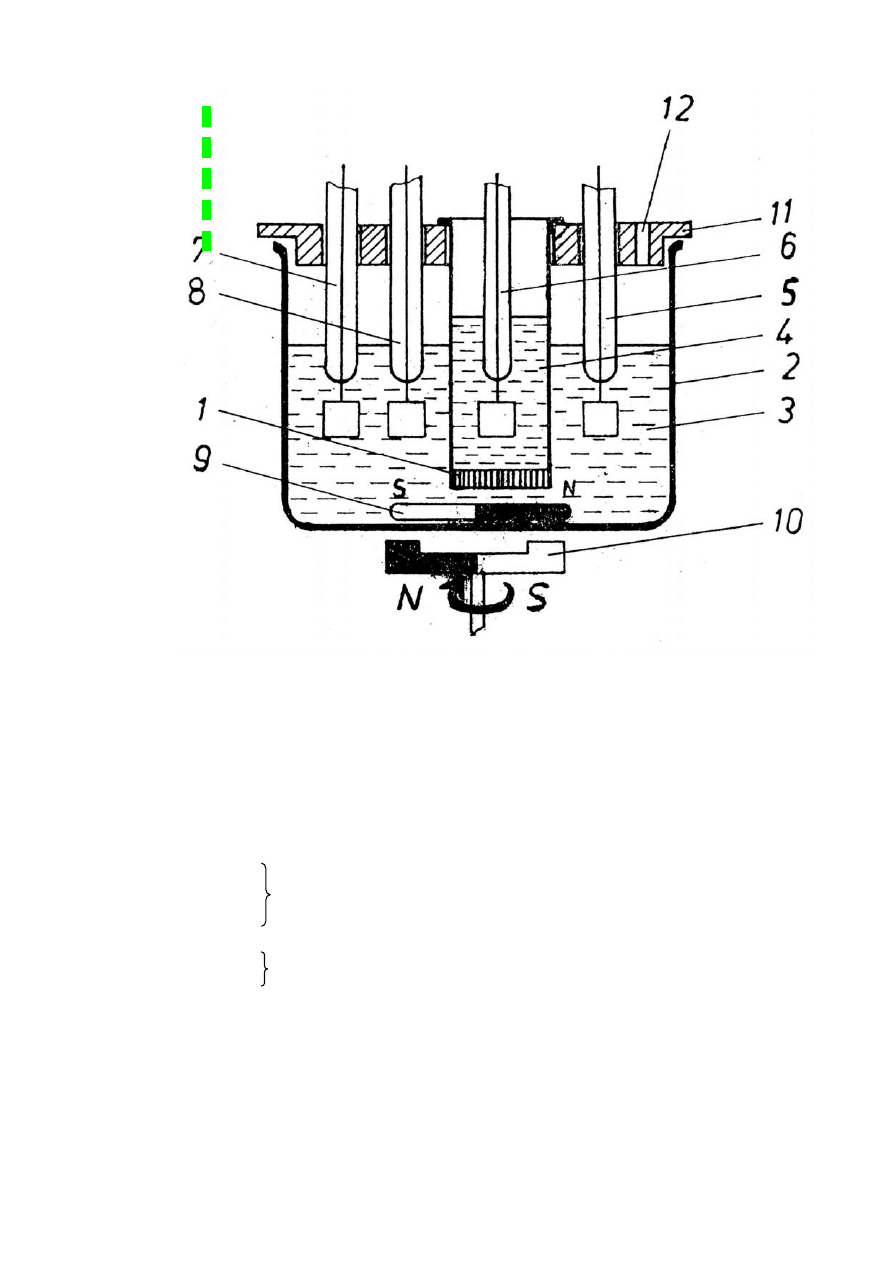
Rys. Celka kulometryczna:
1. przegroda
2. celka kulometryczna
3. roztwór KBr, KHCO
3
,
KOH
4. roztwór elektrody wskaźnikowej
5. elektrody pomiarowe
6.
7. układ elektryczny do wyznaczania punktu końcowego
8.
9.
10.
11. pokrywa z tworzywa sztucznego
12. otwór do uzupełniania roztworu
mieszadło elektromagnetyczne
Wyszukiwarka
Podobne podstrony:
chemia analityczna wyklad 11 i 12
chemia analityczna wyklad 02
chemia analityczna wyklad 13 i 14
Chemia analityczna wykład prezentacja
chemia analityczna wyklad 01
analityczna egzamin pohl, Studia PWr, IV semestr, Chemia analityczna, Wykład (Pohl), Egzamin
chemia analityczna wyklad 07
chemia analityczna wyklad 08 i 09
Pytania na kolokwium wykładowe, Chemia, Analityczna, wykład
chemia analityczna wyklad 10
chemia analityczna wyklad 04
chemia analityczna wyklad 05
chemia analityczna wyklad 10
chemia analityczna wyklad 06
chemia analityczna wyklad 01
chemia analityczna wyklad 11 i 12
więcej podobnych podstron