
Inżynieria Środowiska
2008/09 sem. zimowy
Wykład 13
08 01 2009
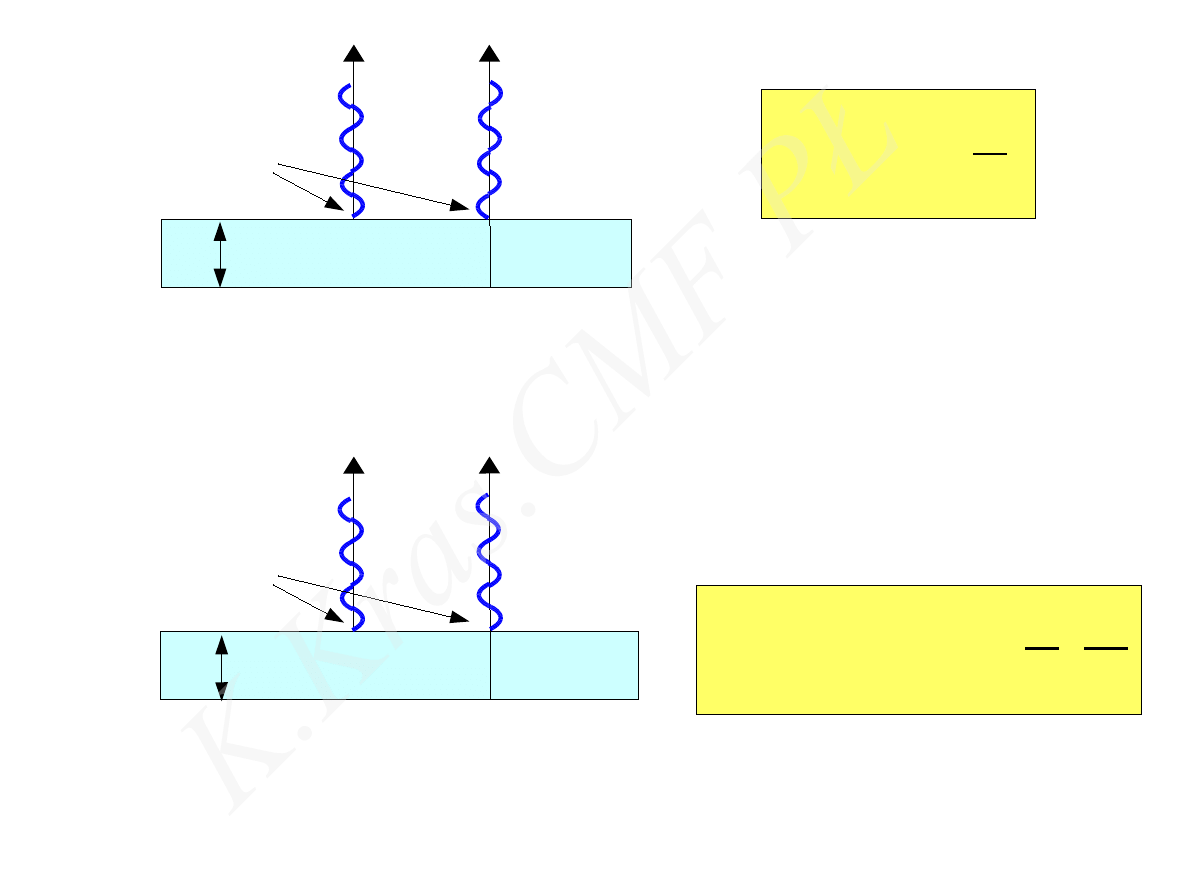
d
d
2 d = k
n
2 d = 2 k −1
n
1
2
n
n
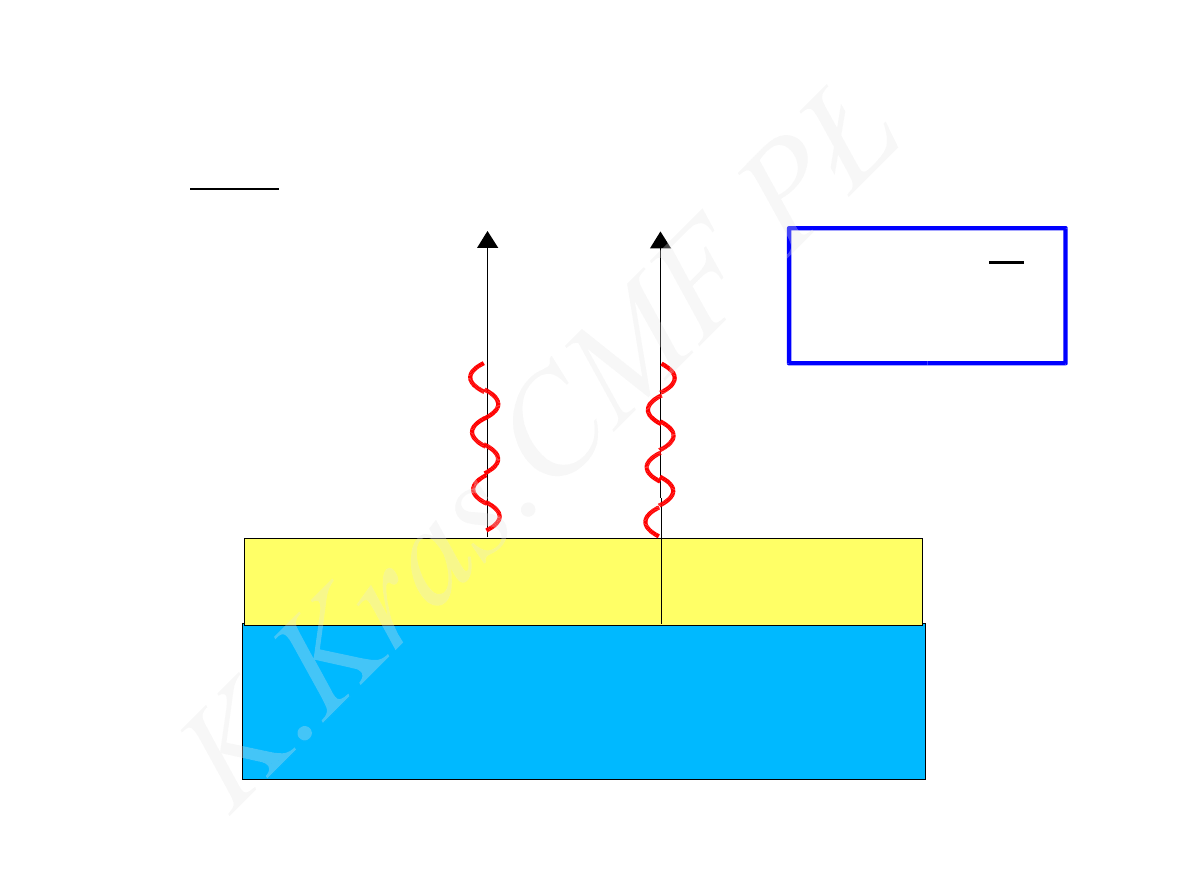
nn
w
n
w
n
w
=
n
=
n−1
n1
2
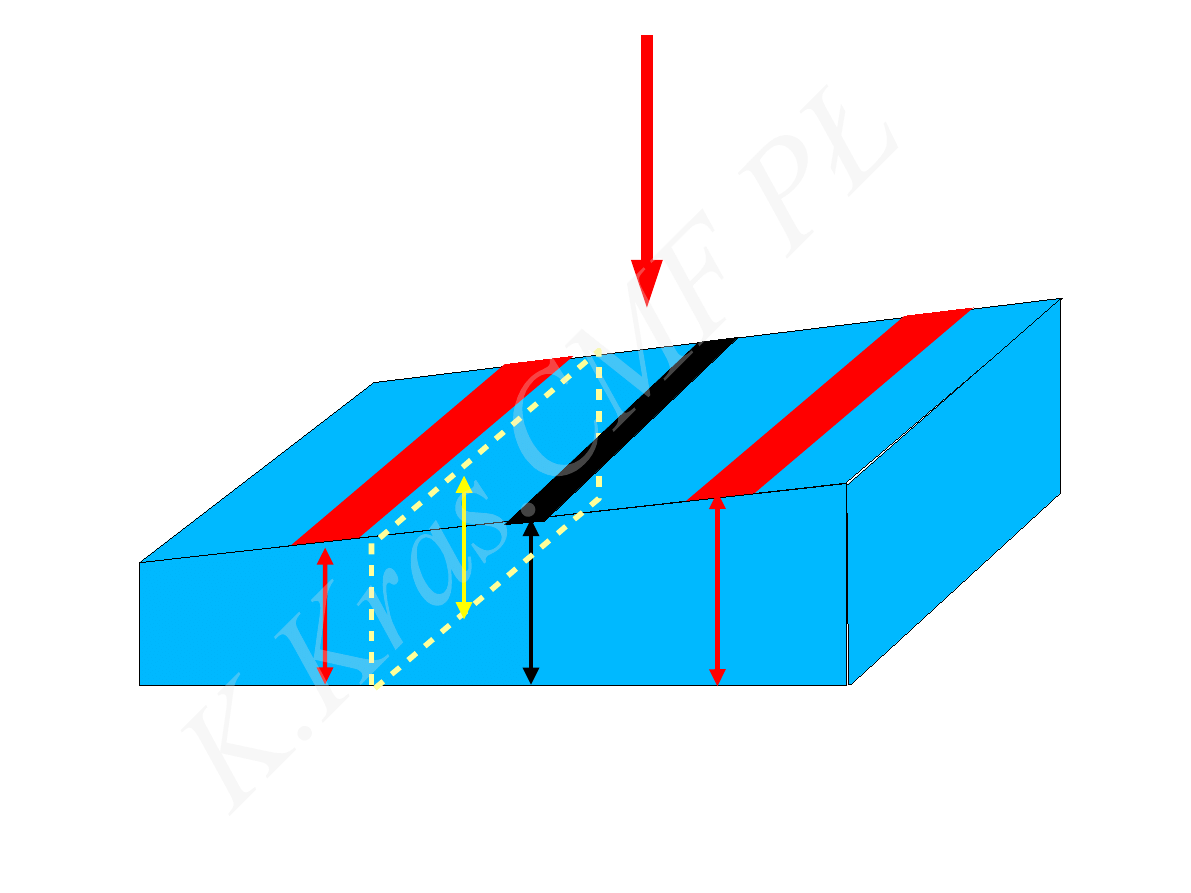
h
1
n
h
3
h
2
h
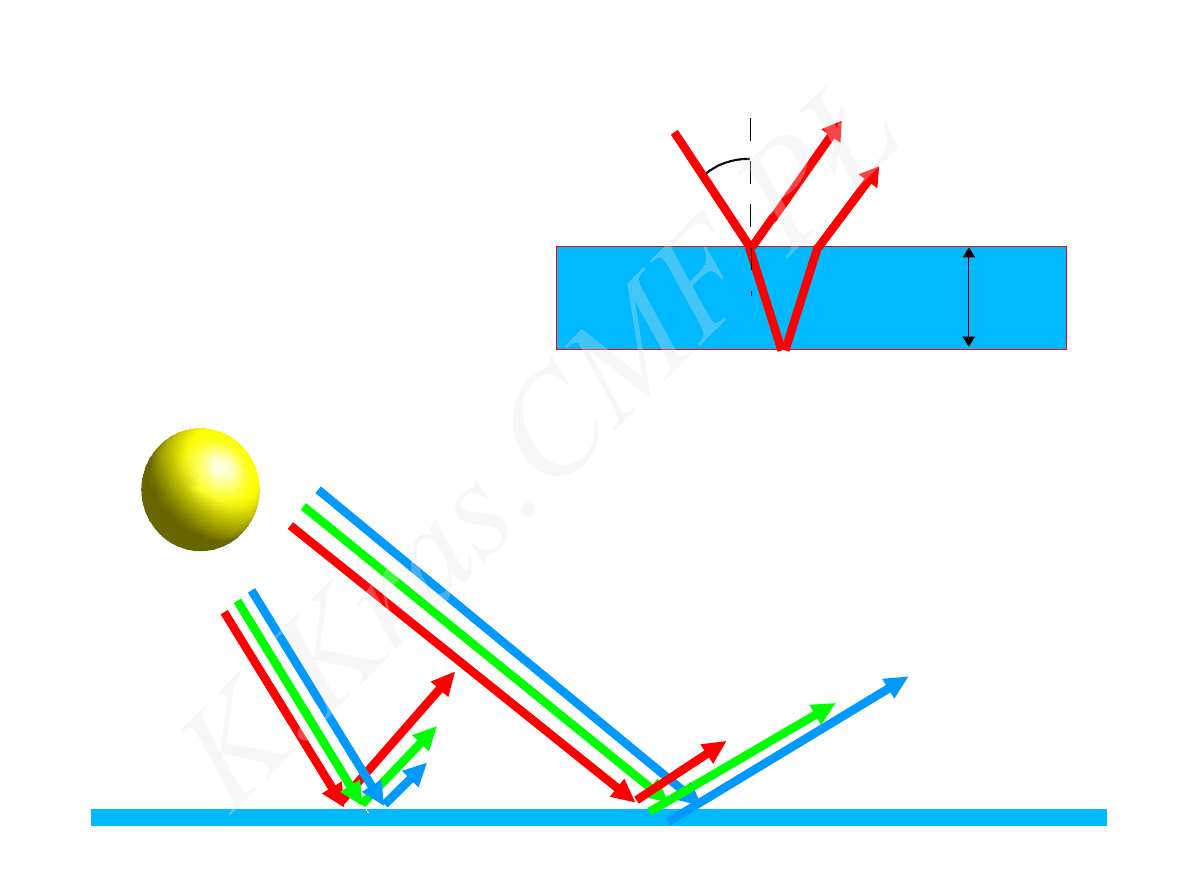
d
n
m = 0,1,2,3...
d sin = m
=
d sin
d
b
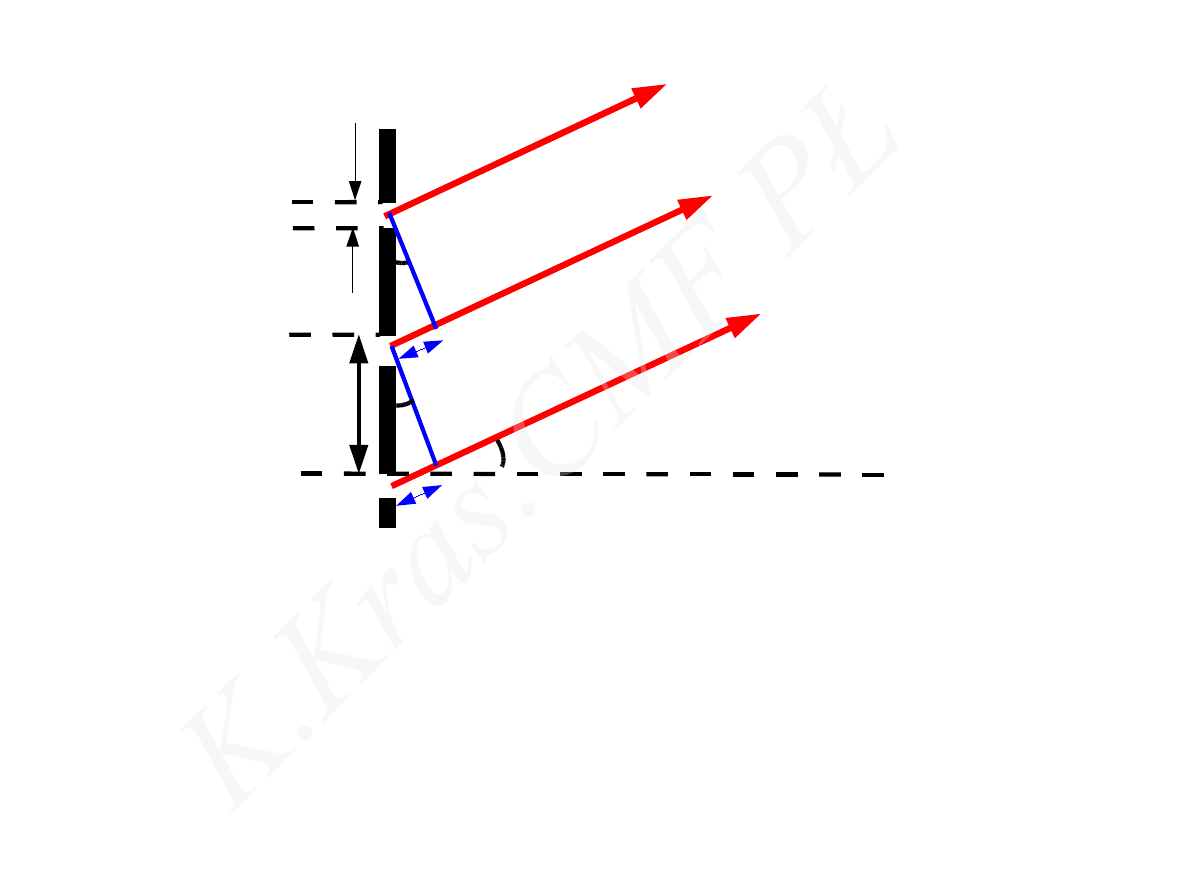
m=0
m=1
m=2
m=−1
m=−2
D =
d
d
=
m
d cos
D ~ m
10
−
10
m
10
−
14
m
ok.10
−
16
m
nukleony
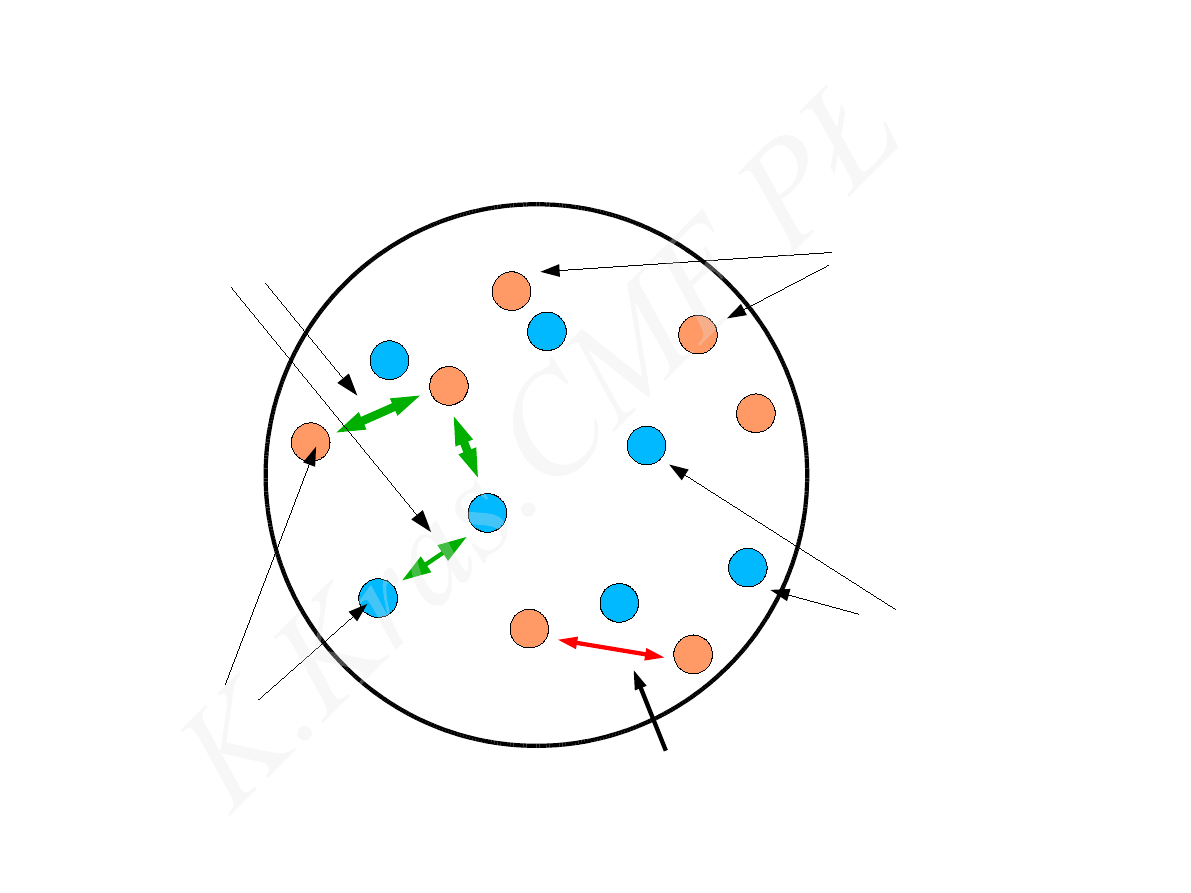
jądro atomowe
proton
neutron (0)
siły jądrowe
siły elektromagnetyczne
(+)
oddziaływania słabe
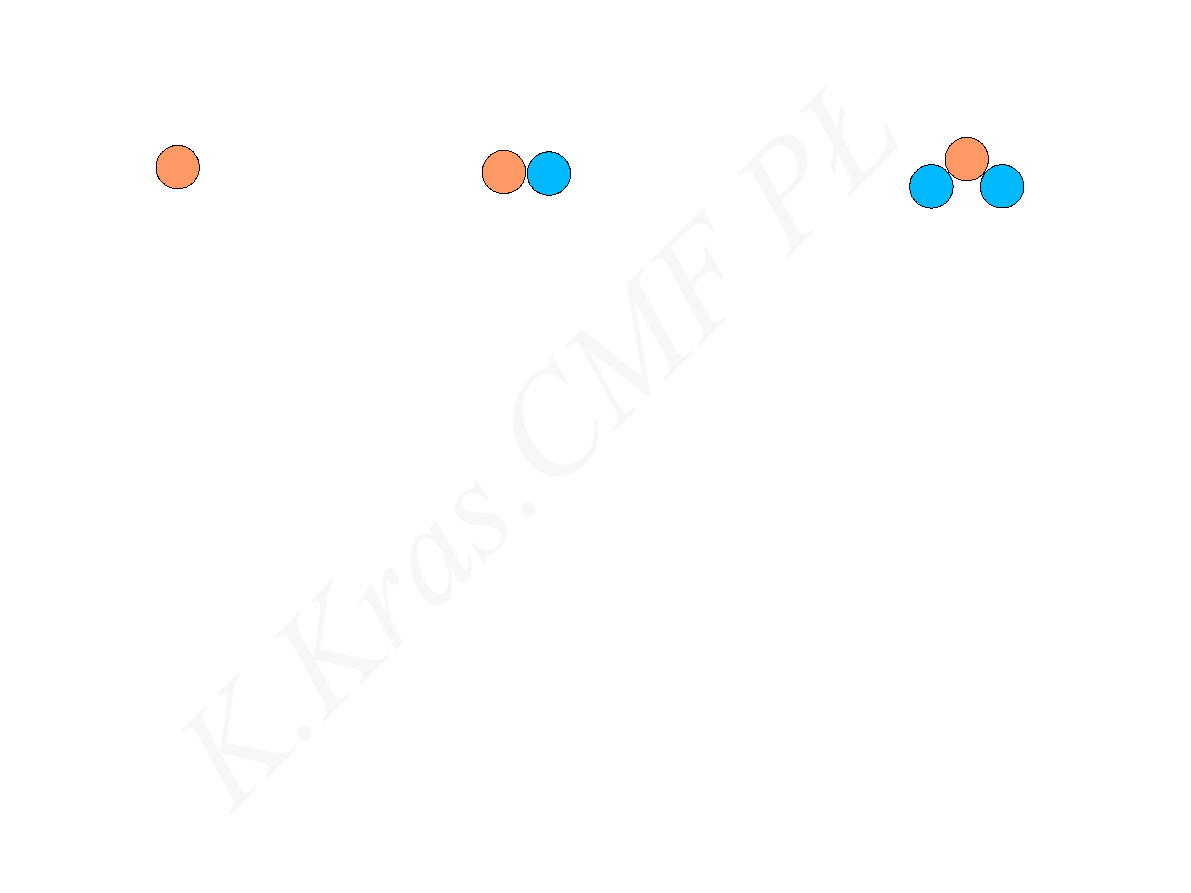
proton
neutron
X
Z
A
liczba masowa
liczba atomowa
symbol chemiczny pierwiastka
izotopy
H
1
1
H
1
3
H
1
2
C
6
12
C
6
14
C
6
13
U
92
235
U
92
238
U
92
234

M = Z m
p
A−Z m
n
−
m
j
E
w
=
M c
2
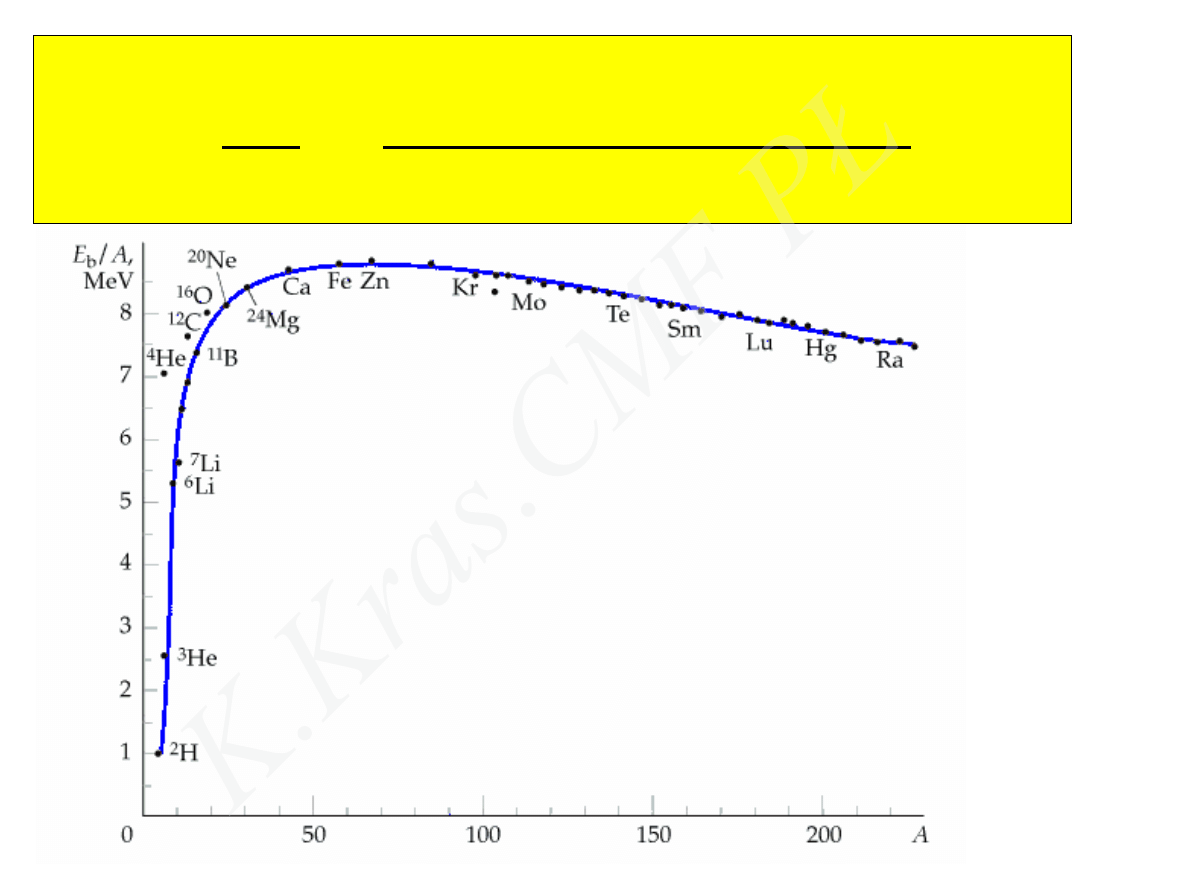
E
W /1
=
E
W
A
=
[
Z m
p
A−Z m
n
−
m
j
]
A
c
2
Z
N
Z =N
Z
N
Z
A
X
Z
A
Y
Z −2
A−4
He
2
4
X
Z
A
Y
Z −2
A−4
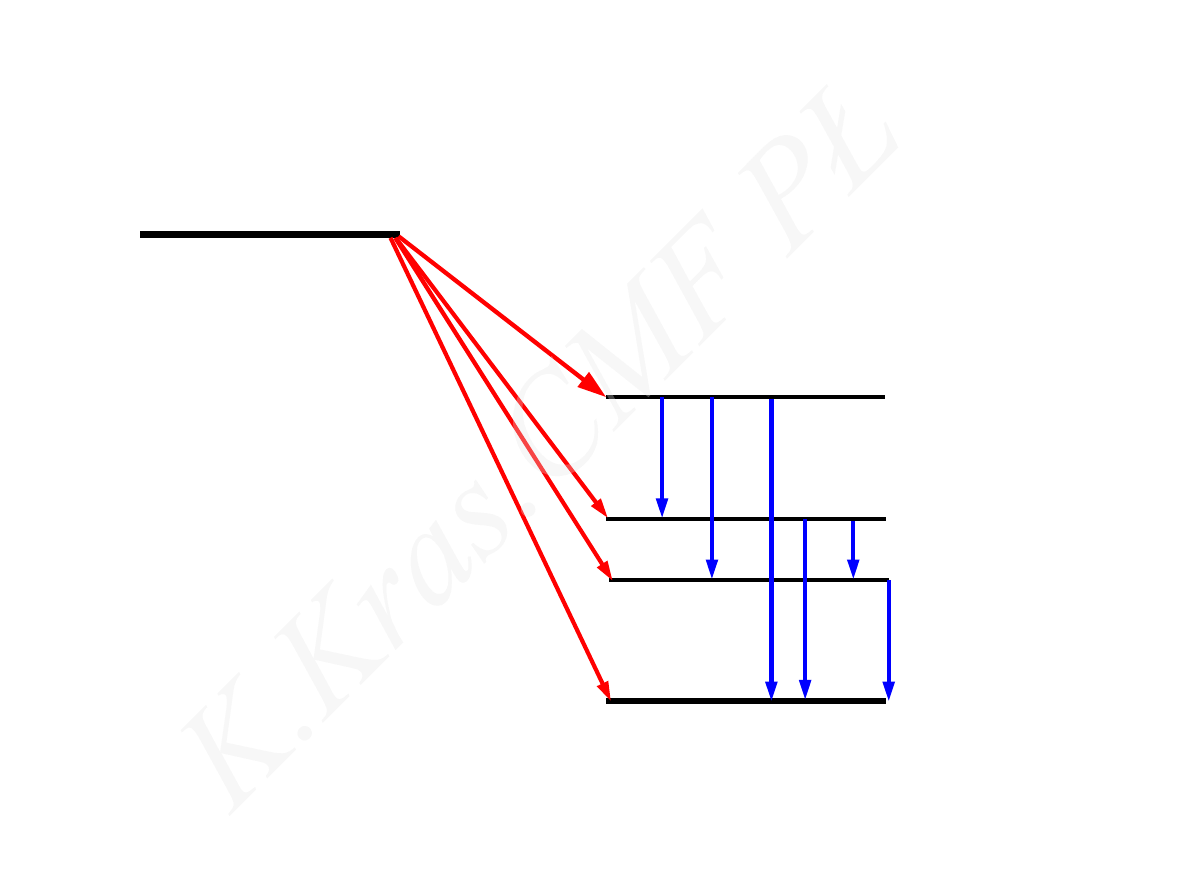
I
E
X
Z
A
Y
Z 1
A
e
-
e
X
Z
A
Y
Z −1
A
e
+
e
Z
N
+
-
Z
A
+
-
Z
N
-
+
I
E
E
max
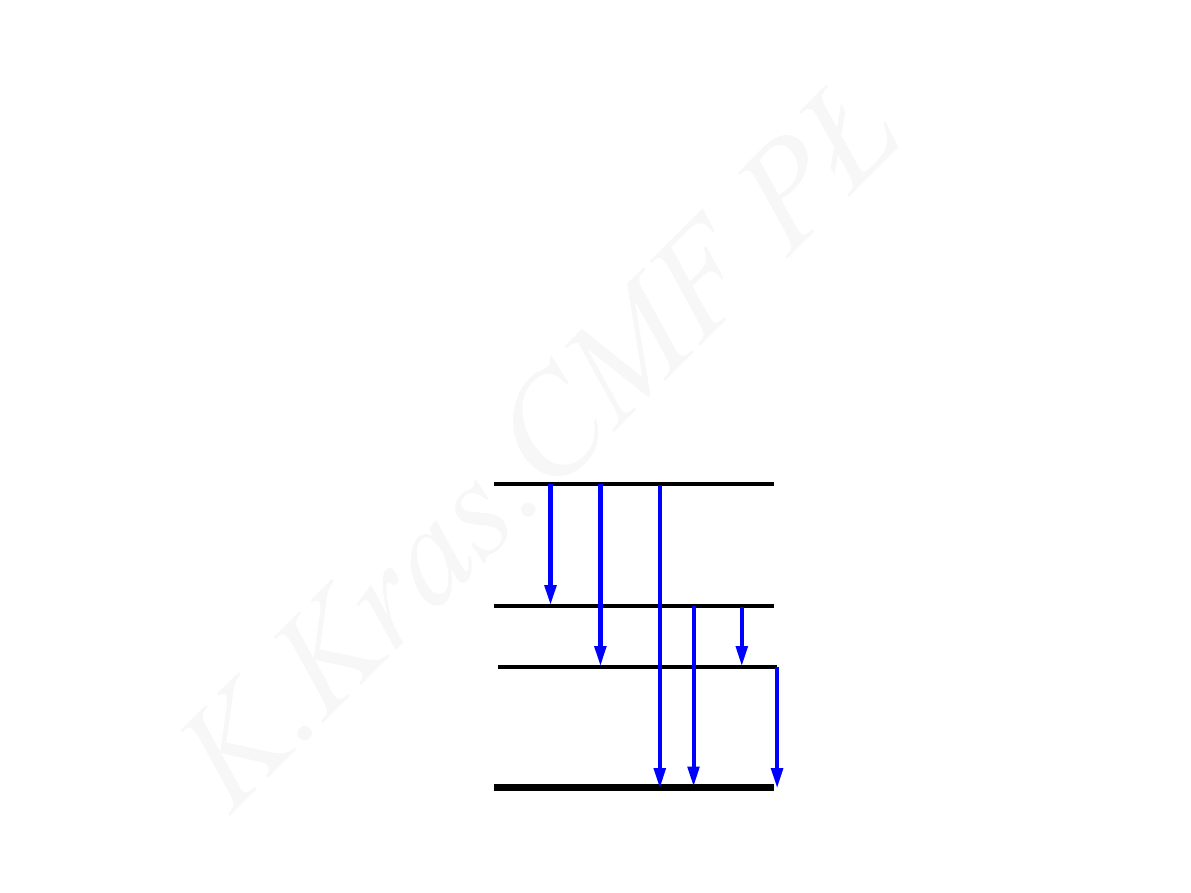
X
*
Z
A
X
Z
A
X
*
Z
A
X
Z
A
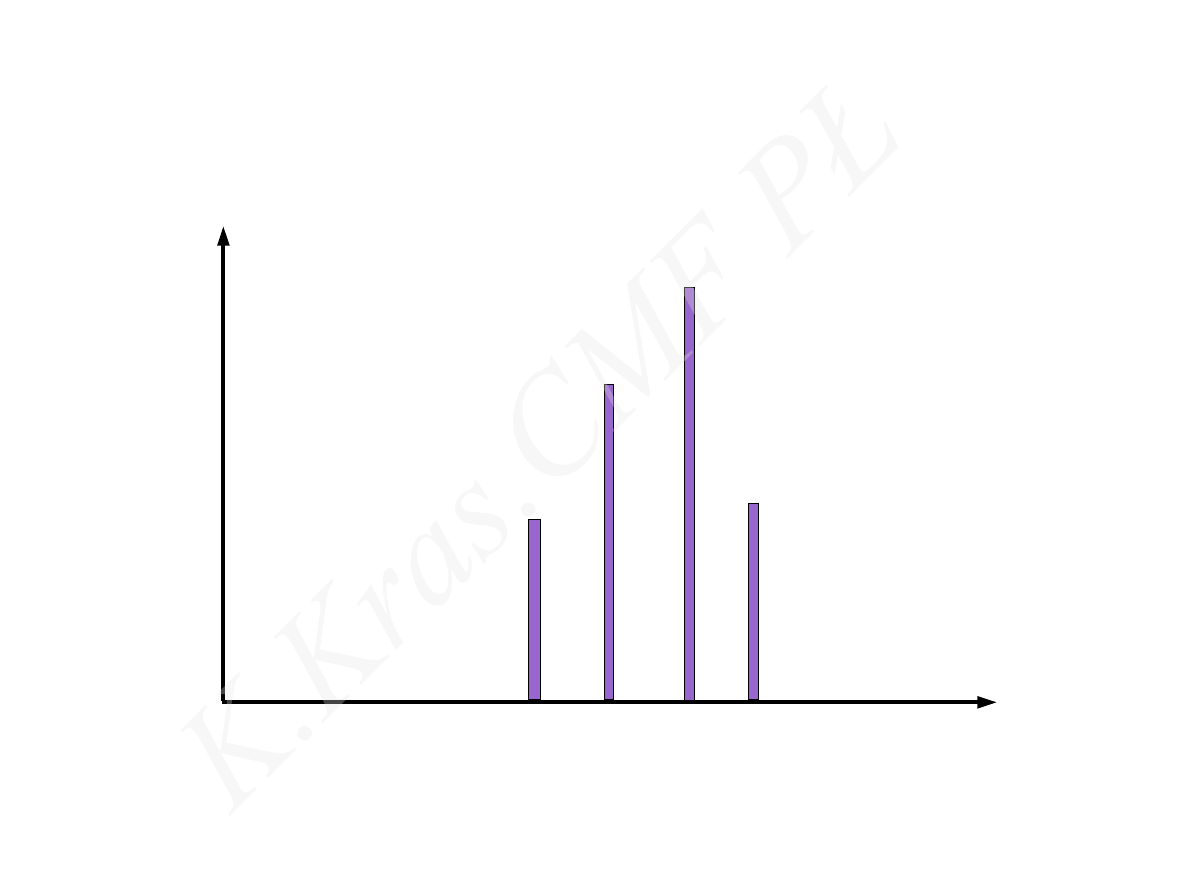
I
E
Wyszukiwarka
Podobne podstrony:
IS wyklad 14 15 01 09 MDW id 22 Nieznany
IS wyklad 14 15 01 09 MDW id 22 Nieznany
IS 2011 12 wyklad 13 12 01 2012 MDW
KPC Wykład (13) 08 01 2013
08.01.09, Teologia, ROK I, Pedagogika, wykłady semestr zimowy
IS 2011 12 wyklad 10 08 12 2011 MDW
IS 2011 12 wyklad 12 05 01 2012 MDW
AiR 11 12 wyklad 14 20 01 2012 MDW
Wyklad 13 HP 2008 09
Wykład 13 [04.01.06], Biologia UWr, II rok, Zoologia Kręgowców
Algebra Wykład 13 (11 01 11) ogarnijtemat com
wyklad 13 21.01.2008, wyklady - dr krawczyk
więcej podobnych podstron