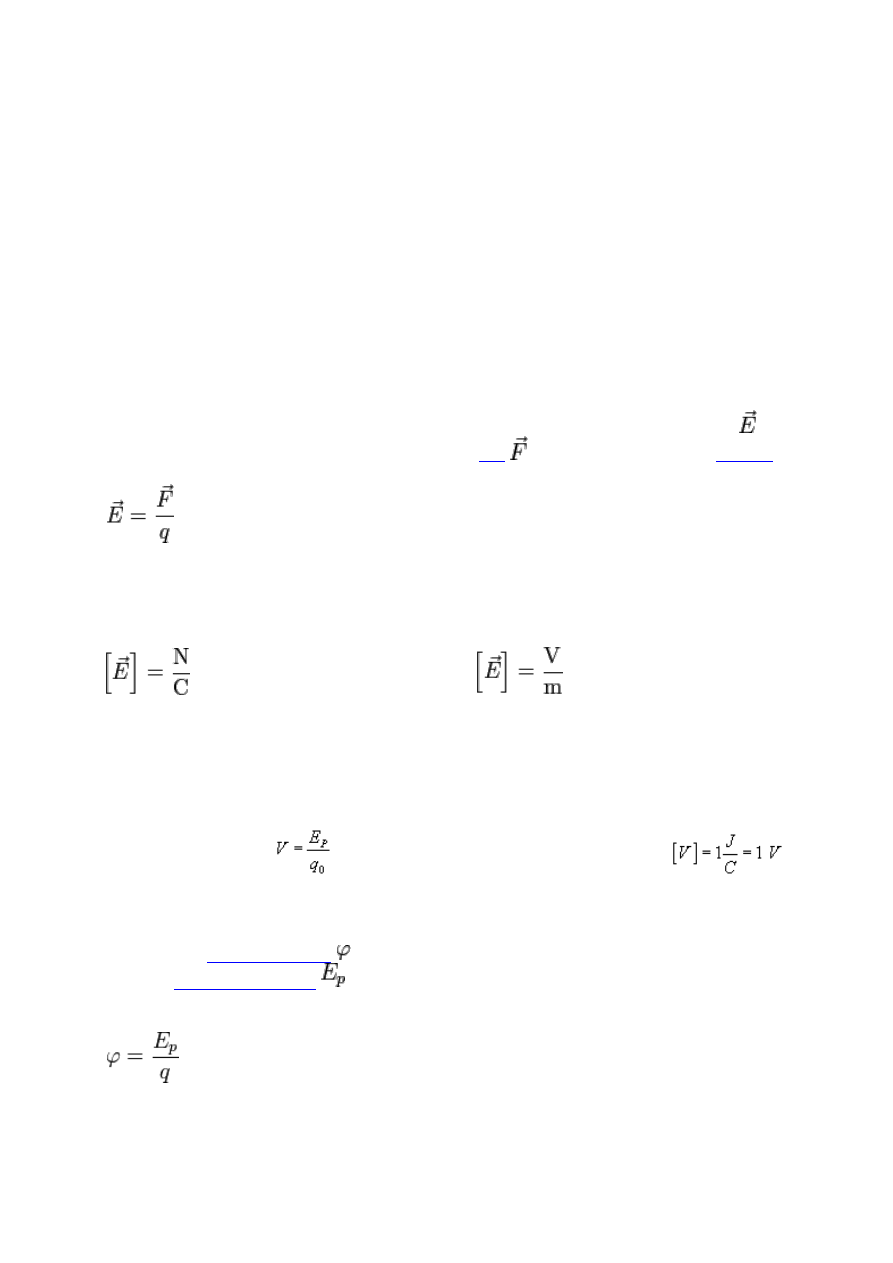
1
Omówić wielkości charakteryzujące pole elektrostatyczne. Definicje i związki między wielkościami.
2
Twierdzenie Gaussa, rozkład ładunku na powierzchni przewodnika.
3
Powierzchnie ekwipotencjalne i metoda obliczania wektora natężenia pola elektrycznego E.
4
Elektrolity, mechanizm przewodzenia prądu.
5
Narysować i omówić schemat połączeń elektrycznych. NIE MAM
1. Omówić wielkości charakteryzujące pole
elektrostatyczne. Definicje i związki między wielkościami.
Natężenie pola elektrycznego
Natężenie pola elektrostatycznego w konkretnym punkcie pola to stosunek siły, jaka wpływa
na dodatni (próbny) ładunek ulokowany w tym miejscu, do wartości tego ładunku.
LUB
Natężenie pola elektrycznego jest podstawową wielkością opisującą pole elektryczne (i
niekiedy samo jest nazywane krótko polem elektrycznym). Jest to wielkość wektorowa
,
zdefiniowana w danym punkcie pola jako stosunek
próbny q, umieszczony w tym punkcie pola, do wartości tegoż ładunku q:
E- natężenie E jest wielkością wektorową
Ładunek, za pomocą którego określa się pole, musi być na tyle mały, by nie zmieniać
rozkładu ładunków w otaczającej go przestrzeni.
Niuton na kolumb co jest równoważne
Potencjał pola elektrycznego
Potencjałem elektrostatycznym V nazywamy wielkość fizyczną, której miarą jest iloraz
energii potencjalnej, jaką posiada ładunek próbny umieszczony w danym punkcie pola do
wartości tego ładunku.
Jednostką potencjału jest wolt oznaczany literą V.
lub
Potencjał jest
, zdefiniowane w każdym punkcie pola elektrycznego jako
stosunek
ładunku próbnego q umieszczonego w tym punkcie do
wartości tegoż ładunku q:

Energia pola elektrycznego
e
P
- energia potencjalna;
k - stała elektrostatyczna;
Q - pierwszy ładunek;
q - drugi ładunek;
r - odległość ładunków od siebie;
lub
W polu elektrycznym zgromadzona jest energia. Jest ona równa pracy potrzebnej do ułożenia
układu ładunków wytwarzających dane pole elektryczne, można więc stwierdzić, że energia
potencjalna układu ładunków jest równoważna energii w wytworzonym przez nie polu
elektrycznym.
Gęstość energii pola elektrycznego (energia zawarta w jednostce objętości) wyraża się przez:
gdzie:
przenikalność elektryczna próżni
- natężenia pola
elektrycznego.
Linie sił pola elektrycznego
Do obrazowego przedstawienia pola elektrycznego używa się linii sił pola elektrycznego. Są
to linie, które w każdym punkcie przestrzeni są styczne do wektora siły działającej w tym
polu na dodatni ładunek próbny.
2. Twierdzenie Gaussa, rozkład ładunku na powierzchni
przewodnika.
Prawo Gaussa służy do obliczania natężeń pochodzących od poszczególnych ciał. Aby
posłużyć się prawem Gaussa należy wybrać dowolną powierzchnię zamkniętą wokół źródła
(np. sferę).
Prawo Gaussa :
Strumień pola elektrycznego obejmowany przez dowolną powierzchnię zamkniętą jest
proporcjonalny do sumy ładunków zawartych wewnątrz powierzchni.
LUB
Gaussa prawo, Gaussa twierdzenie, jedno z podstawowych praw
. Mówi ono, że strumień pola
elektrycznego przechodzącego przez zamkniętą powierzchnię jest równy całkowitemu ładunkowi elektrycznemu
zamkniętemu w tej powierzchni.
gdzie: ε
0
− współczynnik przenikalności elektrycznej próżni, Φ
E
- strumień pola elektrycznego, q -
ładunek elektryczny.
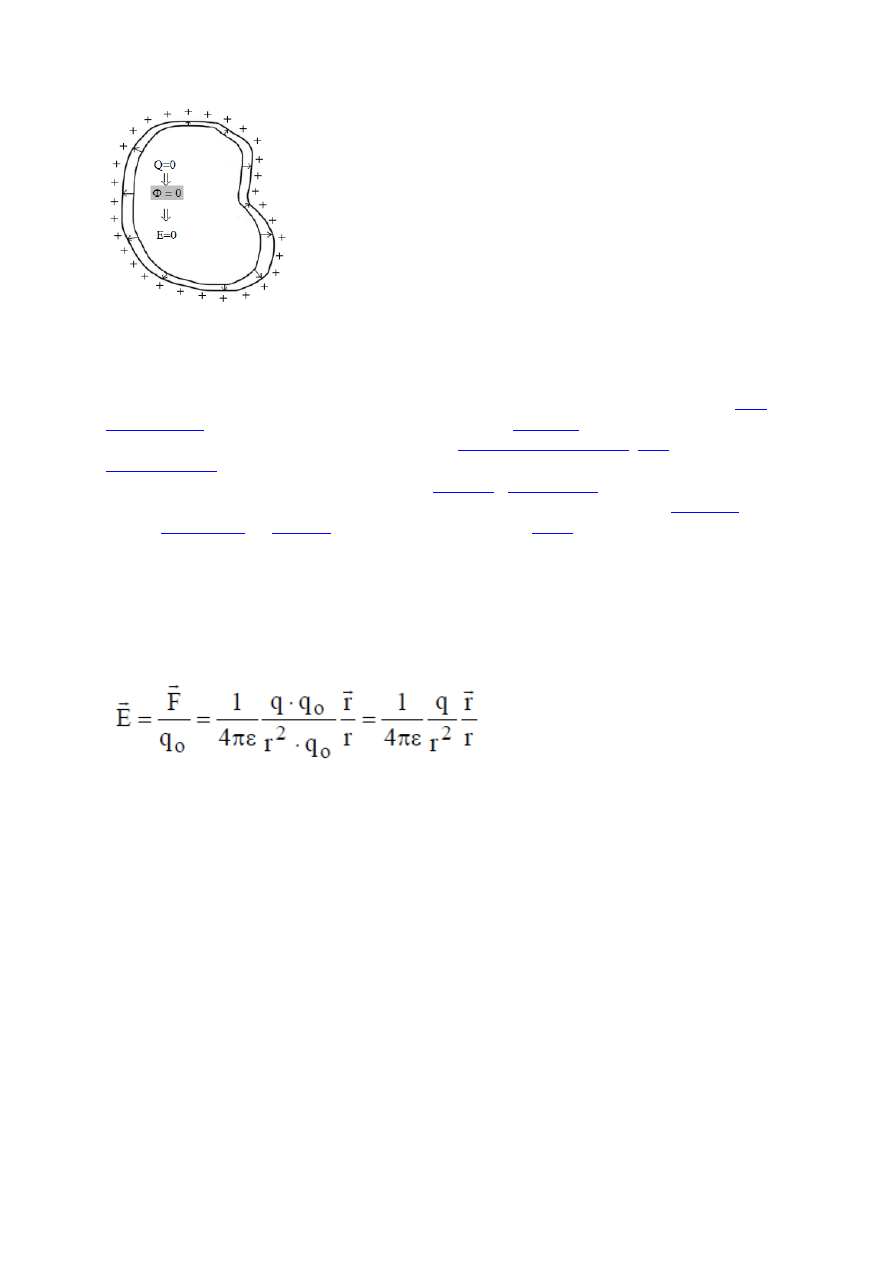
Elektryzujemy kawałek przewodnika. Ładunki jednoimienne
odpychają się, więc ładunek rozmieści się na powierzchni
przewodnika.
3. Powierzchnie ekwipotencjalne i metoda obliczania wektora
natężenia pola elektrycznego E.
Powierzchnia ekwipotencjalna (powierzchnia równego potencjału) - powierzchnia w
, której wszystkie punkty mają jednakowy
. Powierzchnie potencjalne
określa się dla wszystkich pól potencjalnych np.
. Powierzchnie ekwipotencjalne są w każdym punkcie pola prostopadłe do
wektora siły, czyli do linii natężenia pola. W
która jest wszędzie pozioma, to znaczy w każdym punkcie tej powierzchni jej
(prosta
Obliczenie natężenia pola elektrycznego w dowolnym punkcie przestrzeni jest w
zasadzie możliwe zawsze, jeżeli znamy rozkład ładunków wytwarzających to pole. Z prawa
Coulomba (7.1) i definicji pola elektrycznego (7.4) możemy wyznaczyć natężenie pola
elektrycznego wytworzonego przez ładunek punktowy q.
4. Elektrolity, mechanizm przewodzenia prądu.
Elektrolity, to związki, których roztwory przewodzą prąd elektryczny. Ich główną cechą jest
obecność wiązania jonowego, które pod wpływem polarnego rozpuszczalnika (najczęściej
wody) rozpada się, dając różnoimienne jony (dodatnie kationy i ujemne aniony). Mechanizm
przewodzenia prądu przez elektrolity jest inny niż przez przewodniki metaliczne. O ile w
metalach przewodzenie odbywa się poprzez "jednokierunkowy" ruch elektronów w polu
elektrycznym (po przyłożeniu napięcia), o tyle w elektrolitach ładunki elektryczne są
przenoszone przez jony, a w przypadku przepływu prądu następuje w roztworze reakcja
chemiczna - a dokładniej dwie grupy reakcji, inne na katodzie, inne na anodzie - w sumie
dające proces elektrolizy.
Elektrolity można podzielić na dwie grupy - elektrolity dysocjujące w roztworze całkowicie,
w 100% rozpadające się na poszczególne jony, są to tzw. elektrolity mocne, oraz elektrolity
słabe, czyli takie, których jedynie część cząsteczek rozpuszczonych ulega dysocjacji na jony.
Podział ten, jak większość podziałów dokonywanych w naukach przyrodniczych przez
człowieka, jest trochę sztuczny i zawsze może się znaleźć substancja, którą trudno
zakwalifikować jednoznacznie do którejś z tych grup. Przykładem może być tu kwas
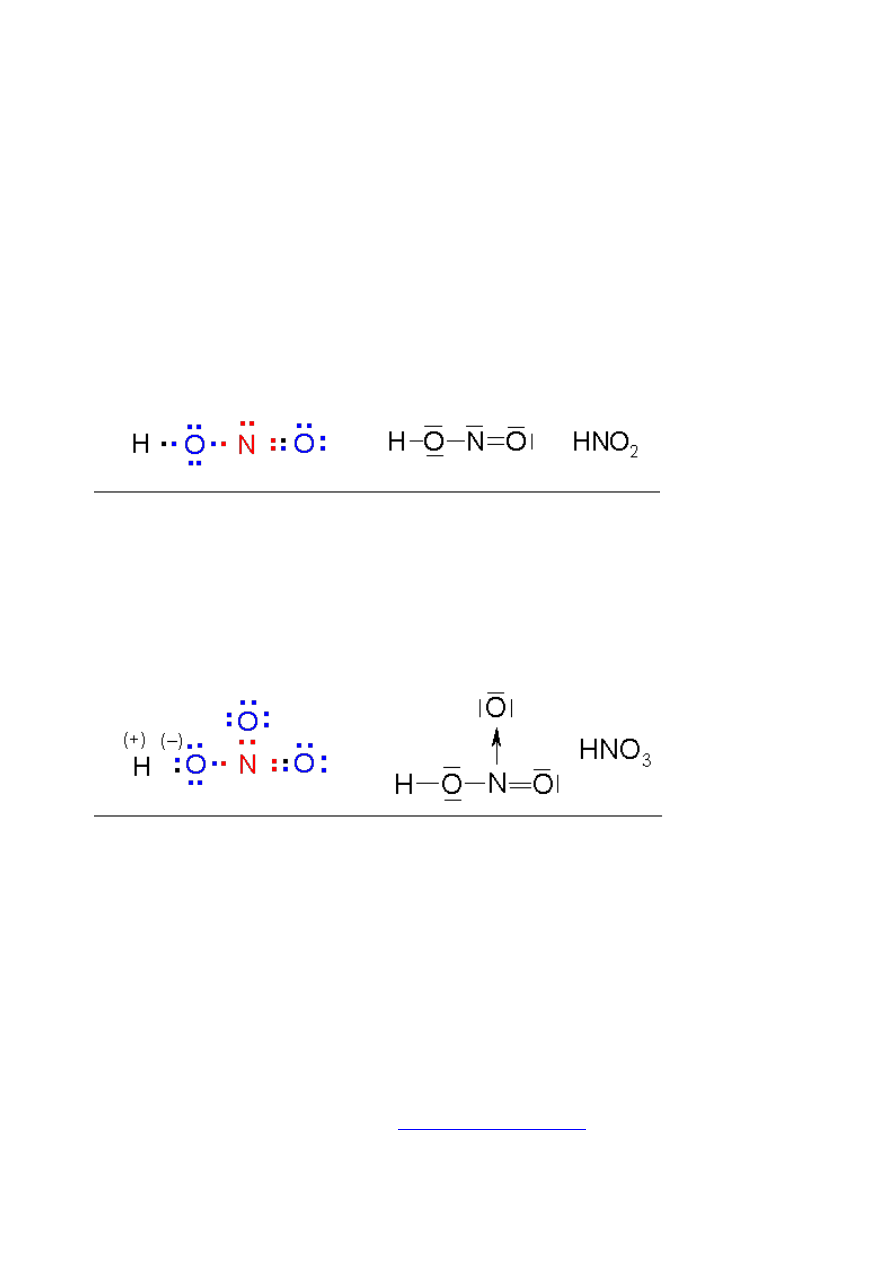
ortofosforowy H
3
PO
4
, w który pierwszy wodór dysocjuje jak w elektrolicie mocnym, drugi
jak w słabym a trzeci prawie wcale nie dysocjuje. Generalnie do pierwszej grupy należą te
związki, w których wiązanie jonowe występuje jako skutek bardzo dużej różnicy
elektroujemności (>1,7) lub indukcyjne działanie innych elektroujemnych atomów w
strukturze wzmaga dodatkowo polaryzację tego wiązania. Na przykład dysocjacja jonu H
+
w
kwasie azotowym(III) HNO
2
jest nikła (bardzo słaby kwas), zaś ta sama grupa H-O w kwasie
azotowym(V) HNO
3
dysocjuje jak silny elektrolit (silny kwas). Do takiego gwałtownego
wzrostu polaryzacji wiązania H-O przyczyniła się obecność trzeciego atomu tlenu, który
związany wiązaniem koordynacyjnym N→O indukcyjnie wpłynął na polaryzacje wiązań H-
O-N.
różnica
elektroujemności
w układzie N=O
(0,4) nieznacznie
wpływa na
polaryzację
wiązania H-O
(różnica
elektroujemności
1,3), stąd kwas
azotowy(III) jest
słabym kwasem
związanie
wolnej pary
elektronowej na
azocie w
wiązaniu
donorowo-
akceptorowym z
trzecim atomem
tlenu
spowodowało na
drodze indukcji
silną polaryzację
wiązania H-O,
kwas
azotowy(V) jest
bardzo silnym
kwasem
Takie działanie "wspomagające" proces dysocjacji może przyjść także z zewnątrz. HCl -
chlorowodór, gaz w warunkach normalnych, z formalnego punktu widzenia nie daje się nawet
zaliczyć do elektrolitów (różnica elektroujemności wodoru i chloru to zaledwie 0,6), zaś jego
wodny roztwór, pod nazwą kwasu solnego, zalicza się do silnych elektrolitów. Tu z pomocą
przyszła polarność wody i hydratacja jonów. Tak więc podziały podziałami, a przyroda i tak
sobie z nich nic nie robi ...
Silne elektrolity w stanie stałym występują zazwyczaj w postaci kryształów jonowych, tzn.
regularnych skupisk stechiometrycznych ilości kationów i anionów ułożonych w regularną
przestrzenną sieć krystaliczną. Ich cząsteczki, tak jak je symbolicznie zapisujemy np. NaCl,
CaO itp. w rzeczywistości nie istnieją. [
takiego kryształu jonowego w wodzie powoduje "uniezależnienie się" poszczególnych jonów

i występowanie w roztworze w postaci pojedynczych elementów. Reakcje między jonami
przebiegają zazwyczaj błyskawiczne, bowiem na ogół nie wymagają uprzedniego rozrywania
wiązań, a ponadto ich ładunki "wyszukują" i przyciągają przeciwjony, co też znacznie
przyspiesza reakcję.
Rozpatrując przypadek elektrolitów słabych, trzeba sobie postawić fundamentalne pytanie:
dlaczego wśród jednakowych cząsteczek, znajdzie się część, która jest zdolna do dysocjacji a
inne czasteczki jej nie ulegają? Otóż wyjaśnienia są dwa, choć tak naprawdę to tylko dwa
aspekty tego samego wyjaśnienia.
Cząsteczki w roztworze poruszają się chaotycznie, zderzając się ze sobą i przekazując tym
sposobem energię. W słabych elektrolitach polaryzacja wiązania jest na granicy jonizacji.
Wystarczy niewielka ilość energii przekazana w takim przypadkowym zderzeniu i może dojść
do dysocjacji. Ale ponieważ ilość energii w układzie jest wielkością stałą, jakiś jon musi w
tym czasie połączyć się z przeciwjonem by wyzwolić taką samą ilość energii do roztworu.
Możemy w pewnym przybliżeniu powiedzieć, że część cząsteczek wzmacnia swoje wiązania
i "rezygnuje" z dysocjacji, dzięki czemu inna część zyskuje dodatkową energię pozwalającą
na zerwanie wiązania "prawie jonowego".
Drugie tłumaczenie możemy oprzeć na zasadach termodynamiki (warto wcześniej poczytać o
roli energii w chemii). Rozpadająca się na jony cząsteczka to wzrost entropii, miary
nieuporządkowania materii, jednocześnie dwa czy więcej powstałych jonów, to większa
entalpia, bo rozerwanie nawet tak słabego wiązania, to jednak pewien konkretny wydatek
energii, czyli ogólnie entalpia rośnie. Proces dysocjacji będzie trwał tak długo, aż wzrost
entalpii zostanie zrównoważony przez wzrost entropii. Wówczas nastąpi stan równowagi -
każdy rozpad na jony będzie związany z powstaniem z innych jonów niezdysocjowanej
cząsteczki. Powstanie stan równowagi dynamicznej - w formie makroskopowej obserwować
będziemy zanik procesu (ilość jonów nie będzie ani rosła ani malała) na poziomie mikro będą
przebiegały procesy dwukierunkowo, ale z dokładnie taką samą szybkością.
I jeszcze jeden aspekt sprawy słabych elektrolitów. Wielkość dysocjacji określamy z pomocą
stopnia dysocjacji. Jest to stosunek ilości cząsteczek, które uległy dysocjacji do ogólnej
ilości cząsteczek, które zostały rozpuszczone w roztworze. Jeśli z 0,1 mola cząsteczek kwasu
octowego CH
3
COOH po rozpuszczeniu w wodzie 0,003 mola uległo dysocjacji, to stopień
dysocjacji w tych warunkach wyniósł 0,003/0,1=0,03 lub 3%. Dość istotnym jest by
pamiętać, że stopień dysocjacji określa tylko względną ilość zdysocjowanych cząsteczek.
Bezwzględna ilość zdysocjowanych cząsteczek zależy i od stopnia dysocjacji i od stężenia
roztworu (dla określonej objętości obliczamy ją mnożąc stężenie przez stopień dysocjacji i
objętość )
Wiekość stopnia dysocjacji nie jest wielkością charakterystyczną dla danej substancji. Zależy
dość silnie od temperatury roztworu i jego stężenia. To, że rośnie wraz z temperaturą jest dość
oczywiste. Skoro temperatura związana jest ze średnią energią cząsteczek tworzących
roztwór, to wyższa średnia energia cząsteczek słabego elektrolitu oznacza, że średnio mniej
energii potrzeba do rozerwania wiązania w trakcie dysocjacji, co przekłada się na większą
ilość cząsteczek dysocjujących. Nieco trudniej jest wyjaśnić spadek stopnia dysocjacji wraz
ze wzrostem stężenia. Na razie musi nam wystarczyć, że ze wzrostem stężenia rośnie
bezwzględna ilość zdysocjowanych cząsteczek, nie rośnie jednak proporcjonalnie do stężenia
lecz nieco wolniej. Stąd wartość względna zdysocjowanych cząsteczek (stopień dysocjacji)
wraz ze wzrostem stężenia roztworu maleje.
Wyszukiwarka
Podobne podstrony:
cw 16 odpowiedzi do pytan id 1 Nieznany
cw 16 odpowiedzi do pytan id 1 Nieznany
nom kol 2 odpowiedzi do pytan i Nieznany
BHP odpowiedzi do pytan rozporządzenie 2008
Klucz odpowiedzi do pytań testowych
egzamin odpowiedzi do pytan, Wykłady, Usługi w biznesie, Międzynarodowe Stosunki Gospodarcze, MSG, M
Odpowiedzi do pytan@ 52
msg odpowiedzi do pytan, MSG pytania z roku 2002, 1
odpowiedzi do pytań 1
Wstęp do Religioznawstwa - egzamin, odpowiedzi Inne odpowiedzi do pytań ze skyptu 2
Biofizyka Odpowiedzi do pytan egzamin 2009 3
ODPOWIEDZI DO PYTAN pożarowe
BHP - materiały z roku wyżej, odpowiedzi do pytan z testów
Krajoznawstwo odpowiedzi do pytań
Odpowiedzi do pytań na egzamin z przedmiotu Nauka o państwie i prawie
Odpowiedzi do pytań z KUE
więcej podobnych podstron