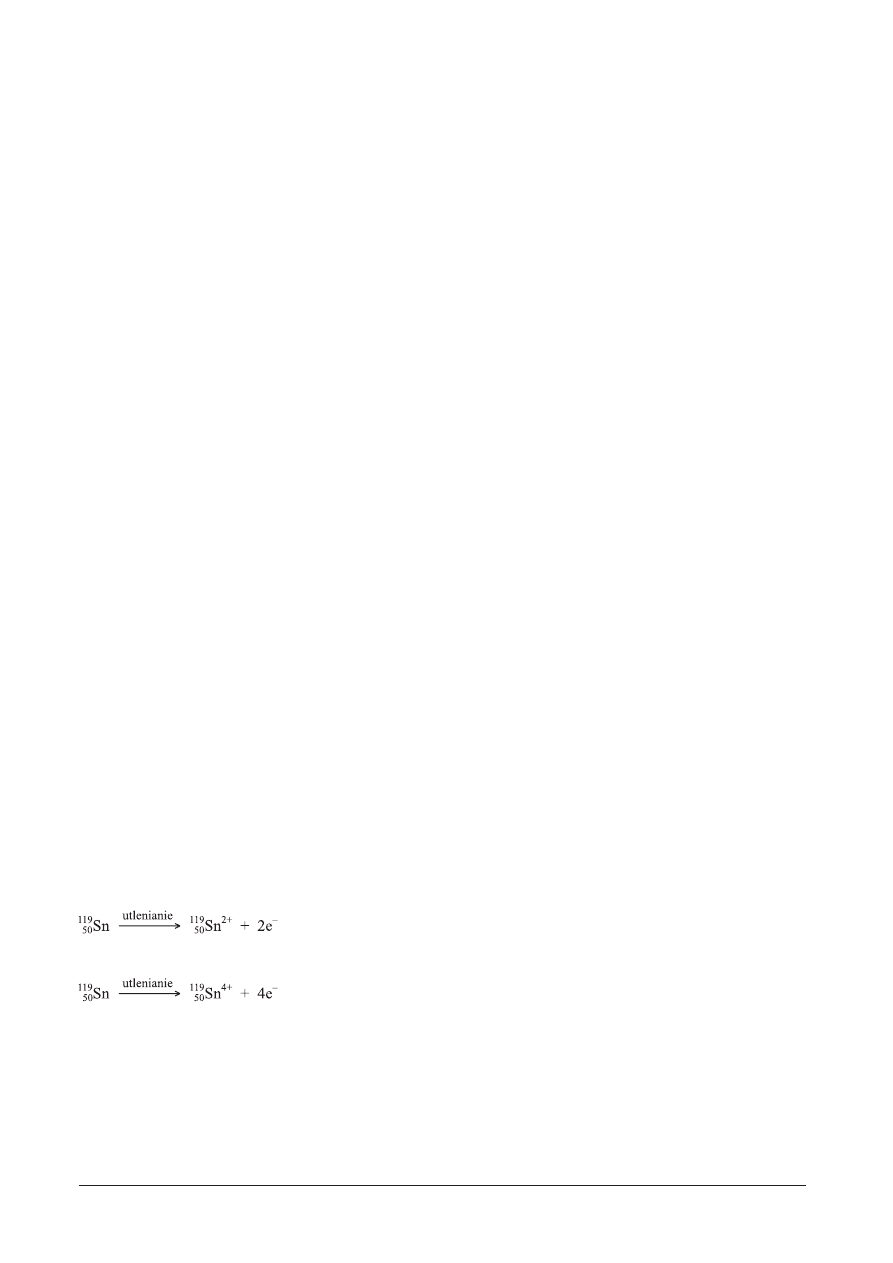
ROZWI¥ZANIA ZADAÑ (z komentarzem)
ZADANIE 1.
OdpowiedŸ:
Izotop bromu
35
81
Br zawiera: 35 elektronów, 35 protonów i 46 neutronów. Jego liczba masowa wynosi A = 81.
Ma 7 elektronów walencyjnych.
ZADANIE 2.
OdpowiedŸ:
Poszukiwanym pierwiastkiem jest wanad V.
Komentarz:
Atom tego pierwiastka zawiera 74 – 51 = 23 elektrony, zatem ma równie¿ 23 protony. Liczba atomowa pierwiastka
wynosi wiêc Z = 23.
ZADANIE 3.
OdpowiedŸ:
Liczba atomowa dwuujemnego jonu X
2–
wynosi Z = 34. Jest to anion selenkowy Se
2–
.
Komentarz:
W procesie tworzenia siê anionów z obojêtnych atomów sk³ad j¹dra atomowego pozostaje bez zmian. Nie zmienia
siê zatem ani liczba atomowa, ani liczba masowa.
Liczba masowa izotopu tworz¹cego anion X
2–
wynosi A = 78. Okreœla ona sumê protonów i neutronów w j¹drze.
Skoro jon zawiera³ 44 neutrony, to w j¹drze atomowym znajduj¹ siê 78 – 44 = 34 protony.
ZADANIE 4.
OdpowiedŸ:
Anion siarczkowy S
2–
ma 18 elektronów w pow³okach elektronowych.
Komentarz:
Atom siarki oraz anion siarczkowy S
2–
maj¹ taki sam sk³ad j¹dra atomowego. Ró¿ni¹ siê liczb¹ elektronów.
Liczba atomowa siarki wynosi Z = 16, zatem liczba protonów w j¹drze wynosi 16 i jest ona równa liczbie elektro-
nów znajduj¹cych siê w przestrzeni wokó³ j¹dra. Anion siarczkowy S
2–
ma o 2 elektrony wiêcej ni¿ atom siarki.
ZADANIE 5.
OdpowiedŸ:
Kation Sn
2+
ma 2 elektrony w ostatniej pow³oce elektronowej.
Kation Sn
4+
ma 18 elektronów w ostatniej pow³oce elektronowej.
Komentarz:
Atom cyny o konfiguracji elektronowej
Sn
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
2
nale¿y do 14 grupy uk³adu okresowego, zatem ma 4 elektrony w ostatniej (pi¹tej) pow³oce elektronowej.
W procesie utlenienia atom cyny
50
119
Sn tworzy:
l
kation cyny Sn
2+
, trac¹c 2 elektrony opisane orbitalem 5p
Kation Sn
2+
ma wiêc 2 elektrony w ostatniej, pi¹tej pow³oce elektronowej (opisane orbitalem 5s).
l
kation cyny Sn
4+
, trac¹c 4 elektrony opisane orbitalami 5s i 5p
Kation Sn
4+
ma wiêc 18 elektronów w ostatniej, czwartej pow³oce elektronowej (opisanych orbitalami 4s, 4p i 4d).
ZADANIE 6.
OdpowiedŸ:
Izotop polonu
84
218
Po, przekszta³caj¹c siê w izotop polonu
84
214
Po, wyemituje 1 cz¹stkê
a i 2 cz¹stki b
–
.
Komentarz:
Pocz¹tkowy i koñcowy izotop bior¹ce udzia³ w cyklu przemian, to izotopy tego samego pierwiastka (o liczbie ato-
mowej Z). Zatem po jednej przemianie
a (w wyniku której liczba atomowa nowego pierwiastka zmniejsza siê
www.wsip.com.pl
1
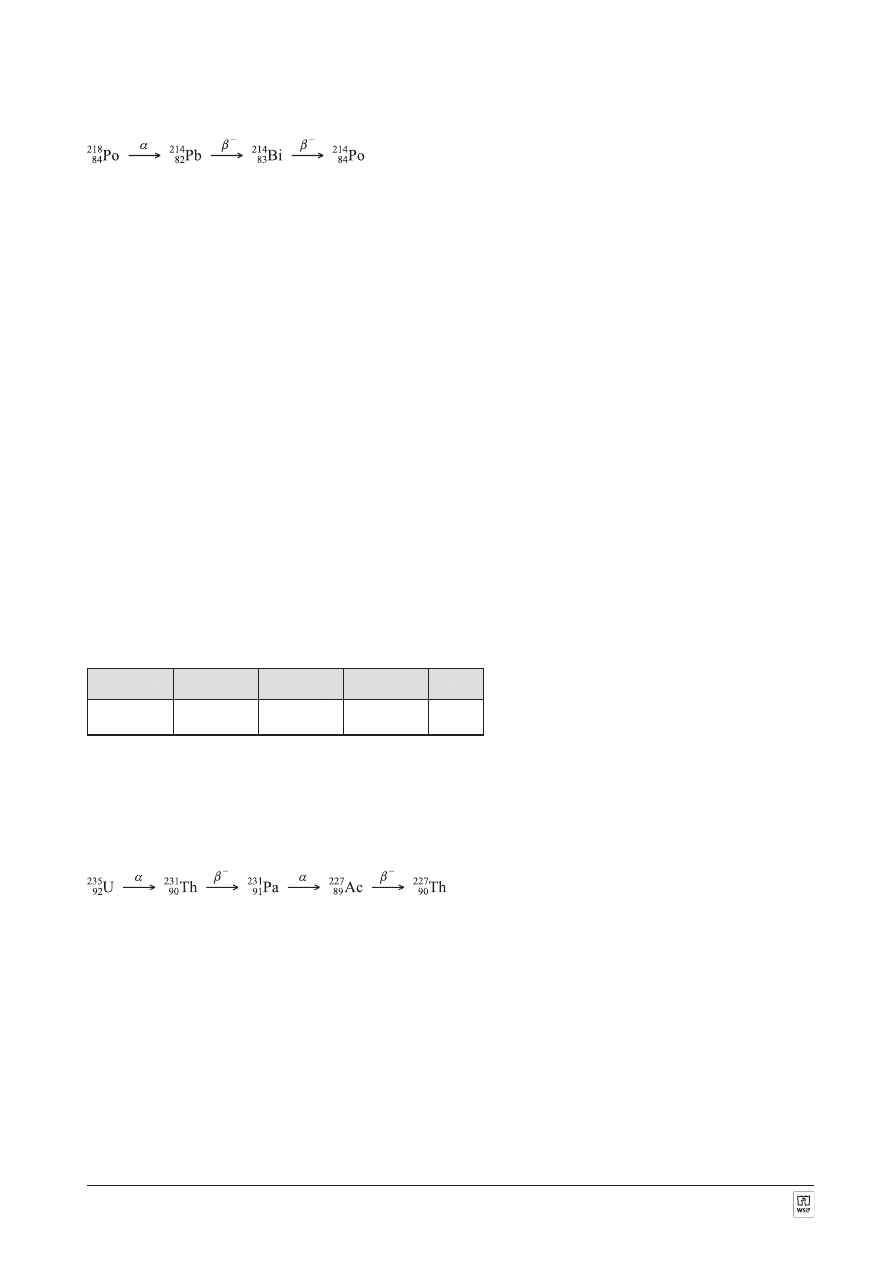
o dwie jednostki), powinny nastêpowaæ dwie przemiany
b
–
(w wyniku których liczba atomowa nowego pierwiastka
zwiêksza siê o dwie jednostki). W cyklu przemian j¹drowych zosta³y wyemitowane: jedna cz¹stka
a i dwie cz¹stki b
–
.
ZADANIE 7.
OdpowiedŸ A:
W tej przemianie powstanie nuklid
13
27
Al:
14
27
Si
Û
13
27
Al +
+1
0
e
Komentarz:
Równanie przedstawia przemianê
b
+
. W przemianie tej uzyskuje siê pierwiastek o liczbie atomowej Z – 1 i liczbie
masowej A.
OdpowiedŸ B:
W tej przemianie powstanie nuklid
83
212
Bi:
82
212
Pb
Û
83
212
Bi +
-1
0
e
Komentarz:
Równanie przedstawia przemianê
b
–
. W przemianie tej uzyskuje siê pierwiastek o liczbie atomowej Z + 1 i liczbie
masowej A.
OdpowiedŸ C:
W tej przemianie powstanie nuklid
84
216
Po:
86
220
Rn
Û
84
216
Po +
2
4
He
Komentarz:
Równanie przedstawia przemianê
a. W przemianie tej uzyskuje siê pierwiastek o liczbie atomowej Z – 2 oraz o licz-
bie masowej A – 4.
ZADANIE 8.
OdpowiedŸ:
Symbol
X
Y
Z
T
Nuklid
90
231
Th
91
231
Pa
89
227
Ac
90
227
Th
Komentarz:
Nuklid
92
235
U, ulegaj¹c przemianie
a, tworzy pierwiastek o liczbie atomowej mniejszej o 2 i liczbie masowej mniej-
szej o 4. Jest to wiêc nuklid
90
231
Th, który ulega przemianie
b
–
, tworz¹c pierwiastek o liczbie atomowej wiêkszej o 1
i niezmienionej liczbie masowej. Tym pierwiastkiem jest nuklid
91
231
Pa. Ulega on przemianie
a, tworz¹c nuklid
89
227
Ac. Nuklid ten ulega przemianie
b
–
, tworz¹c nuklid
90
227
Th.
ZADANIE 9.
OdpowiedŸ A:
5
10
B+
2
4
He
Û
7
13
N +
0
1
n
Komentarz:
W tej sztucznej przemianie promieniotwórczej substraty maj¹ w sumie 7 protonów. Nuklid
7
13
N jako produkt ma te¿
7 protonów, zatem cz¹stk¹, która tworzy siê oprócz azotu jest neutron, poniewa¿ nie jest obdarzony ³adunkiem.
OdpowiedŸ B:
7
13
N
Û
6
13
C +
+1
0
e
Komentarz:
W tej sztucznej przemianie promieniotwórczej z nuklidu
7
13
N powsta³ nuklid
6
13
C, którego liczba atomowa jest
mniejsza o 1 od liczby atomowej nuklidu
7
13
N. Jest wiêc to przemiana
b
+
, której towarzyszy emisja pozytonu.
2
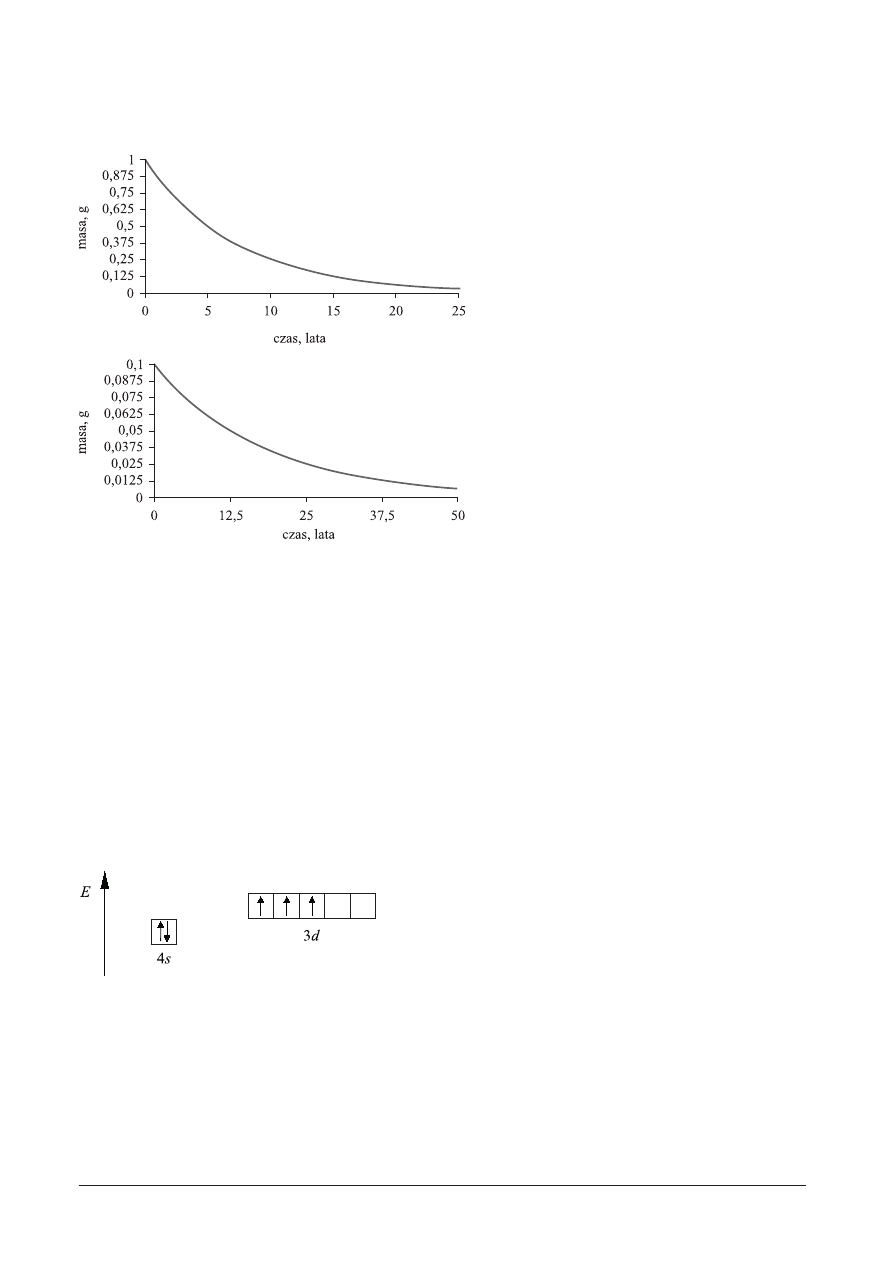
ZADANIE 10.
OdpowiedŸ:
Okres pó³trwania izotopu kobaltu
60
Co wynosi 5 lat, zatem po up³ywie 25 lat z 1 g pozostanie 0,03125 g
60
Co.
ZADANIE 11.
OdpowiedŸ A:
W wyniku emisji elektronu z j¹dra atomowego izotopu miedzi
29
64
Cu powstaje izotop cynku
30
64
Zn.
Komentarz:
Emisja elektronu z j¹dra atomowego to przemiana
b
–
, w wyniku której powstaje pierwiastek o liczbie atomowej
Z + 1 i liczbie masowej A.
OdpowiedŸ B:
W wyniku wybicia elektronu z atomu miedzi
29
65
Cu powstaje kation miedzi
29
65
Cu
+
.
Komentarz:
Proces jonizacji atomu nie jest przemian¹ promieniotwórcz¹, polega on na wybiciu elektronu z pow³oki walencyjnej
atomu. Sk³ad j¹dra atomowego nie zmienia siê w procesie jonizacji.
ZADANIE 12.
OdpowiedŸ:
Rozmieszczenie 5 elektronów opisanych orbitalami typu 4s i 3d przedstawia schemat orbitali atomowych:
ZADANIE 13.
OdpowiedŸ:
Atom ¿elaza ma nastêpuj¹c¹ konfiguracjê elektronow¹:
Fe
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
Fe
[Ar] 3d
6
4s
2
Po oddaniu trzech elektronów (dwóch opisanych orbitalem 4s oraz jednego opisanego orbitalem 3d) tworzy kation
Fe
3+
, który ma konfiguracjê:
Fe
3+
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
Fe
3+
[Ar] 3d
5
www.wsip.com.pl
3
Okres pó³trwania izotopu aktynu
227
Ac wy-
nosi 12,5 lat, zatem po up³ywie 25 lat z 0,1 g
pozostanie 0,025 g
227
Ac.
Sumaryczna masa obu izotopów w próbce
po up³ywie 25 lat wynosi³a
0,03125 g + 0,025 g = 0,05625 g.
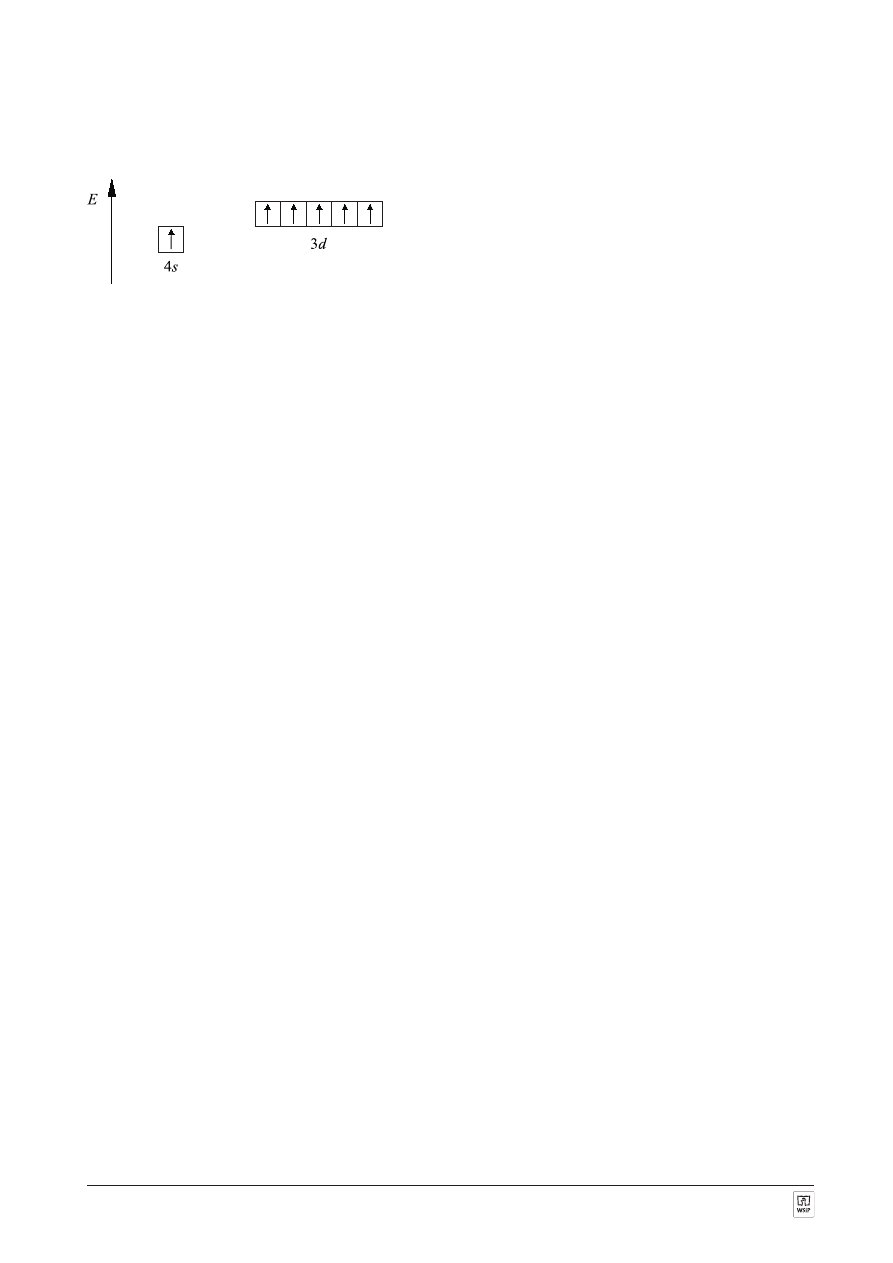
ZADANIE 14.
OdpowiedŸ:
Atom chromu w stanie podstawowym ma 6 elektronów walencyjnych. Opisane s¹ orbitalami atomowymi typu 3d
i 4s. Ich rozmieszczenie przedstawia poni¿szy schemat orbitali atomowych:
ZADANIE 15.
OdpowiedŸ A:
Jest to konfiguracja elektronowa arsenu
33
As.
OdpowiedŸ B:
Arsen ma 5 elektronów walencyjnych.
Komentarz:
Arsen jest pierwiastkiem bloku p, a wiêc jego elektrony walencyjne s¹ opisane orbitalami 4s
2
i 4p
3
.
OdpowiedŸ C:
Arsen przyjmuje w zwi¹zkach chemicznych: najni¿szy –III stopieñ utlenienia oraz najwy¿szy V stopieñ utlenienia.
Komentarz:
Arsen ma 5 elektronów walencyjnych, a wiêc ma tendencjê do:
l
przyjêcia lub uwspólnienia trzech elektronów (przyjmuje –III stopieñ utlenienia) w celu uzyskania trwa³ej konfi-
guracji elektronowej kryptonu,
l
oddania lub uwspólnienia piêciu elektronów walencyjnych (przyjmuje V stopieñ utlenienia) w celu pe³nego
zape³nienia orbitali walencyjnych typu 3s
2
, 3p
6
i 3d
10
.
OdpowiedŸ D:
Arsen (na –III stopniu utlenienia) tworzy z wodorem arsenowodór AsH
3
.
Arsen (na V stopniu utlenienia) tworzy z tlenem tlenek arsenu(V) As
4
O
10
.
ZADANIE 16.
OdpowiedŸ A:
Szukan¹ substancj¹ jest bromek rubidu RbBr.
OdpowiedŸ B:
Jest to zwi¹zek, w którym wystêpuje wi¹zanie jonowe (ró¿nica elektroujemnoœci pierwiastków – 2,0).
Komentarz:
Rubid, maj¹c konfiguracjê elektronow¹
Rb
[Kr]5s
1
oddaje elektron, tworz¹c kation rubidu Rb
+
o konfiguracji kryptonu.
Natomiast atom bromu o konfiguracji
Br
[Ar]3d
10
4s
2
4p
5
przyjmuje elektron, tworz¹c anion bromkowy Br
–
o konfiguracji kryptonu.
ZADANIE 17.
OdpowiedŸ:
Cz¹steczki, w których wszystkie atomy le¿¹ na jednej p³aszczyŸnie: H
2
O, BCl
3
, CO
2
.
Komentarz:
W cz¹steczkach NH
3
, H
2
O i CH
4
atomy centralne ulegaj¹ hybrydyzacji typu sp
3
, ale tylko cz¹steczka wody jest
p³aska (CH
4
ma budowê tetraedryczn¹, a NH
3
— piramidaln¹).
W cz¹steczce BCl
3
atom boru ulega hybrydyzacji typu sp
2
. Wszystkie wi¹zania
s skierowane s¹ w naro¿a trójk¹ta
równobocznego.
W cz¹steczce CO
2
atom wêgla ulega hybrydyzacji typu sp — tworzy tlenek wêgla(IV) o budowie liniowej.
4
ZADANIE 18.
Wzór
sumaryczny
Wi¹zanie
kowalencyjne
kowalencyjne
spolaryzowane
jonowe
NaF
+
HBr
+
N
2
+
NH
3
+
MgO
+
Br
2
+
ZADANIE 19.
Wzór
sumaryczny
Wi¹zania
tylko jonowe
tylko kowalencyjne
tylko kowalencyjne
spolaryzowane
jonowe,
kowalencyjne
spolaryzowane,
koordynacyjne
Cl
2
+
HCl
+
KCl
+
CCl
4
+
NH
4
Cl
+
Cl
2
O
+
HClO
4
+
ZADANIE 20.
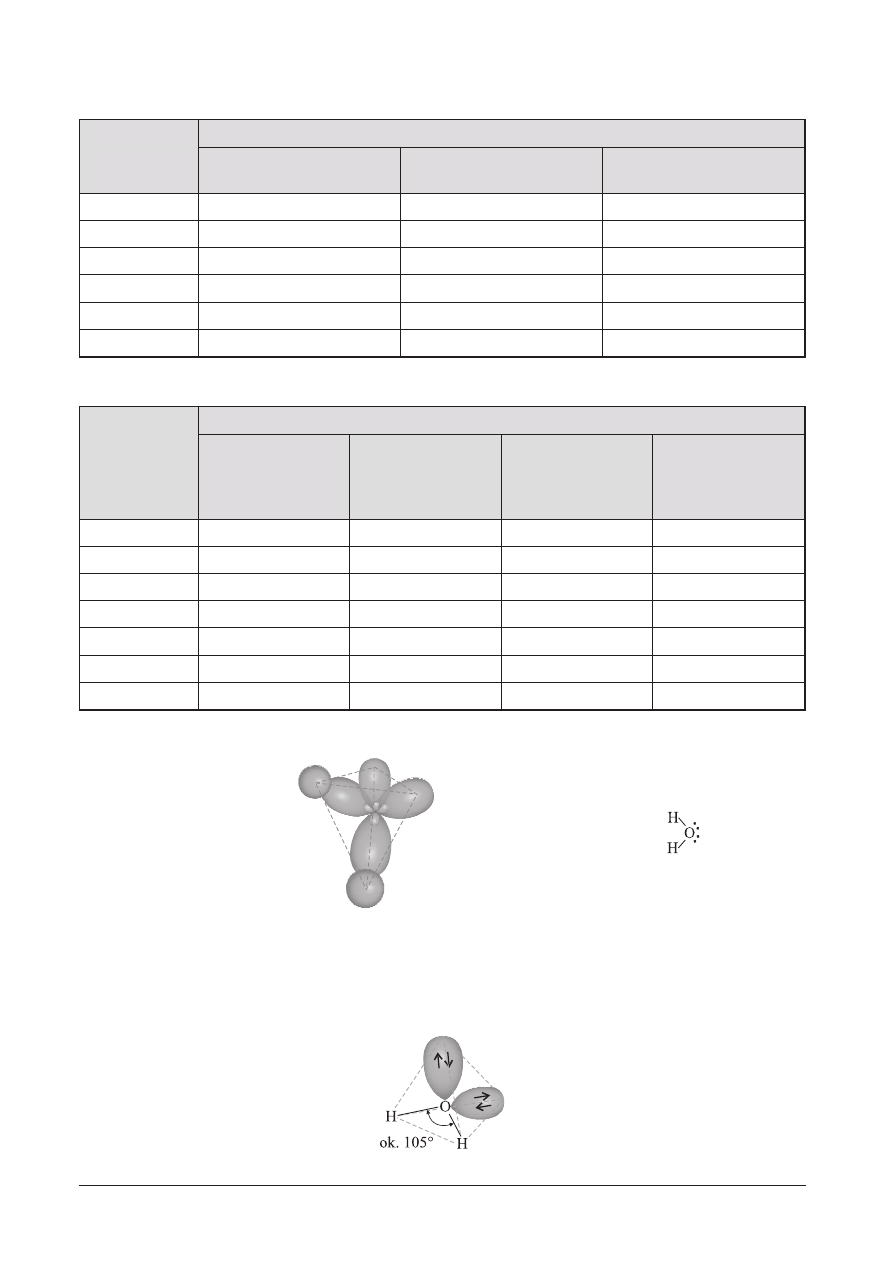
OdpowiedŸ:
Model nak³adania siê orbitali
Wzór elektronowy cz¹steczki wody:
w cz¹steczce wody:
W cz¹steczce wody wystêpuj¹ 2 wi¹zania typu
s oraz dwie niewi¹¿¹ce pary elektronowe.
Atom tlenu ulega hybrydyzacji sp
3
.
Dwa orbitale zhybrydyzowane tworz¹ dwa wi¹zania typu
s, a pozosta³e dwa — tworz¹ dwa orbitale niewi¹¿¹ce
opisuj¹ce po jednej parze elektronów.
Cz¹steczka wody ma budowê p³ask¹ (k¹tow¹). K¹t pomiêdzy wi¹zaniami H
ÔOÔH wynosi ok. 105°.
Przestrzenne rozmieszczenie wi¹zañ i wolnej pary elektronowej w cz¹steczce wody:
www.wsip.com.pl
5
Wyszukiwarka
Podobne podstrony:
arkusz 4 02
arkusz 5 02
arkusz 6 02
arkusz 2 02
arkusz 9 02
arkusz 8 02
arkusz 3 02
arkusz 7 02
02, PP, arkusz
02 Arkusz Analizy dokumentów. Mocne i słabe strony rozwoju dziecka z SPE, Oligofrenopedagogika, NIEP
312[01] 02 122 Arkusz egzaminac Nieznany (2)
21.02.2014.Ćwiczenia 1, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2, fiza
HVIa28.02-ARKUSZ KALKULACYJNY, Hospitacje dydaktyka
02, PR, arkusz
311[51] 02 122 Arkusz egzaminac Nieznany (2)
8 02 2014 arkusz AON I1
Kopia pliku Medycyna ratunkowa 12 02 14 r Arkusz1
więcej podobnych podstron