
1
MIKROBIOLOGIA
Teoria
I. Sterylizacja/Wyjaławianie.
Sterylizacja polega na pozbyciu się wszystkich żywych organizmów oraz ich przetrwalników
z dowolnych materiałów. W praktyce, w laboratorium sterylizuje się m.in. podłoża hodowlane,
końcówek do pipet, butelki oraz inne naczynia i przyrządy służące do przechowywania czy posiewu
mikroorganizmów i utrzymywania ich w takim stanie przez dłuższy czas. Jeśli taki wyjałowiony
materiał zostanie zanieczyszczony innymi mikroorganizmami, nie dodanymi tam celowo, to mówi
się wówczas o zakażeniu. Aby określić stopień uśmiercenia danej populacji w danych warunkach
używa się wartości D
10
(czas dziesięciokrotnej redukcji), określającej czas niezbędny do zabicia
90% komórek.
Sterylizację można przeprowadzić różnymi metodami, dostosowanymi do właściwości
sterylizowanego materiału.
Sterylizacja parowa, „Wilgotne gorąco” – Komórki wegetatywne większości bakterii i
grzybów giną w temperaturze ok. 60
o
C w ciągu 5-10 min., formy przetrwale drożdży i
grzybów dopiero w temp. powyżej 80
o
C, a spory bakteryjne wymagają ok. 15 min. w temp.
120
o
C. Najczęściej używanym urządzeniem do sterylizacji parowej jest autoklaw
umożliwiający ogrzewanie pod zwiększonym ciśnieniem. Służy on do sterylizacji podłoży
hodowlanych, plastików laboratoryjnych i innych materiałów wrażliwych na wysokie
temperatury. Aktualna temperatura pary wytwarzanej z wody w autoklawie zależy od
ciśnienia, ale temperatura przy danym ciśnieniu jest znacznie niższa, jeśli w komorze
znajduje się powietrze. Ponieważ efektywność sterylizacji zależy od temperatury, a nie od
ciśnienia, należy zapewnić usunięcie powietrza ze sterylizatora za pomocą zaworu.
Sterylizacja sucha, „Suche gorąco” – Wymaga wyższych temperatur i dłuższego czasu
ekspozycji nie sterylizacja wilgotnym gorącem (np. 2 godz. w 160
o
C). Stosowane do
sterylizacji szkła i innych materiałów odpornych na wysokie temperatury oraz materiałów
nieodpornych na wilgoć (proszki, gleby). Do sterylizacji suchej używa się specjalnych
suszarek lub pieców.
Filtrowanie – metoda stosowana do sterylizacji płynnych roztworów substancji
termowrażliwych, np. antybiotyki czy witaminy oraz do sterylizacji powietrza
przepływającego przez komory laminarne. Do sterylizacji płynów najczęściej
wykorzystywany jest sterylny filtr nastrzykawkowy o średnicy porów 0,2 – 0,45 µm. Nie
zapobiega on jednak przed przechodzeniem cząstek wirusowych.
Naświetlanie – najczęściej stosowane w laboratoriach jest promieniowanie UV o długości fal
ok. 260 nm, wybiórczo absorbowane przez kwasy nukleinowe. Służy do częściowej
sterylizacji pomieszczeń, komór laminarnych.
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
2
II. Podłoża mikrobiologiczne.
Podłoże mikrobiologiczne jest to sztucznie stworzone środowisko do hodowli
drobnoustrojów. Zawierają w postaci przyswajalnych związków, pierwiastki uczestniczące w
tworzeniu masy komórkowej. Mikroorganizmy do wzrostu wymagają źródła energii i węgla, siarki,
azotu, tlenu, soli mineralnych i czasem tzw. czynników wzrostowych. Czynniki wzrostowe to
substancje odżywcze, takie jak witaminy, aminokwasy czy zasady purynowe i pirymidynowe.
Substancje te wchodzą w skład komórek, ale nie wszystkie organizmy potrafią je syntetyzować.
Organizmy wymagające do wzrostu takich dodatkowych czynników nazywają się auksotrofami, w
odróżnieniu do prototrofów, które nie są uzależnione od dodatkowych substancji odżywczych.
Ze względu na skład, podłoża dzielimy na minimalne, pełne i wzbogacone. Podłoża
minimalne zawierają tylko źródło energii, węgla i sole mineralne oraz czasem pojedyncze czynniki
wzrostowe. Podłoża pełne zawierają wszystkie substancje niezbędne do dobrego wzrostu
drobnoustrojów (źródło węgla, azotu, sole mineralne, wiele czynników wzrostowych). Podłoża
wzbogacone stosuje się do hodowli drobnoustrojów słabo rosnących in vitro, wymagających
dodatkowych substancji odżywczych. Jako czynniki wzbogacające podłoża stosuje się: krew,
surowicę, płyny wysiękowe, wyciąg wątrobowy, mleko, żółtko jaj, sok z pomidorów.
Ze względu na konsystencje podłoża dzielimy na płynne, półpłynne i stałe. Najczęściej jako
czynnik zespalający pożywki mikrobiologiczne używany jest agar, w różnych proporcjach.
Większość bakterii nie ma możliwości rozkładu agaru. Otrzymuje się go z morskich krasnorostów, u
których występuje w ścianach komórkowych. Agar rozpuszcza się w temperaturze 100
o
C, krzepnie
przy temperaturze 45
o
C (stężenie 2%, w pH obojętnym). Zestalony agar przetrzymywany w
temperaturze do 100
o
C pozostaje w konsystencji stałej.
Podłoża ze względu na przeznaczenie i zastosowanie dzielimy na namnażające, wybiórcze
(zawierają dodatek substancji chemicznych hamujących wzrost konkretnej grupy drobnoustrojów),
namnażająco - wybiórcze (pozwala na namnożenie jednego typu organizmu, a hamuje wzrost
innych), oraz pożywki izolacyjne (podłoże stałe zawierające odpowiedni wskaźnik pozwalający
odróżnić od siebie kolonie bakterii).
Podłoża do hodowli mogą być przygotowane w różnej formie. Hodowle płynne w zależności
od ilości podłoża prowadzi się w probówkach, kolbach, butlach lub fermentatorach. Hodowle na
podłożu stałym wykonujemy na szalkach Petriego, słupach, lub skosach.
Przykładowe pożywki drożdżowe:
Podłoże minimalne płynne:
Zestaw soli mineralnych
6,7 g
Glukoza
20 g
Woda destylowana
1000 ml
Podłoże pełne stałe:
Bacto-Ekstrakt drożdżowy
10 g
Bacto-Pepton
20 g
Glukoza
20 g
Agar
20 g
Woda destylowana
1000 ml
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.

3
III. Przechowywanie mikroorganizmów
Mikroorganizmy przechowywane w różnych warunkach różnią się znacznie od siebie czasem
przeżywania. W celu krótkoterminowego przechowywania drobnoustrojów (tj. kilka dni do ok. dwóch
tygodni) wystarczy je włożyć do chłodziarki, 4
o
C w formie takiej jakiej są – w podłożu płynnym lub
posiane na szalce agarowej. Chcąc je przechować dłużej należy je zamrozić. Aby zamarzająca
woda nie zniszczyła komórek drobnoustrojów, zamraża się je w 15% roztworze glicerolu. W
temperaturze –20
o
C mikroorganizmy mogą być przechowywane kilka miesięcy a w temperaturze –
70
o
C mogą być przechowywane praktycznie bezterminowo.
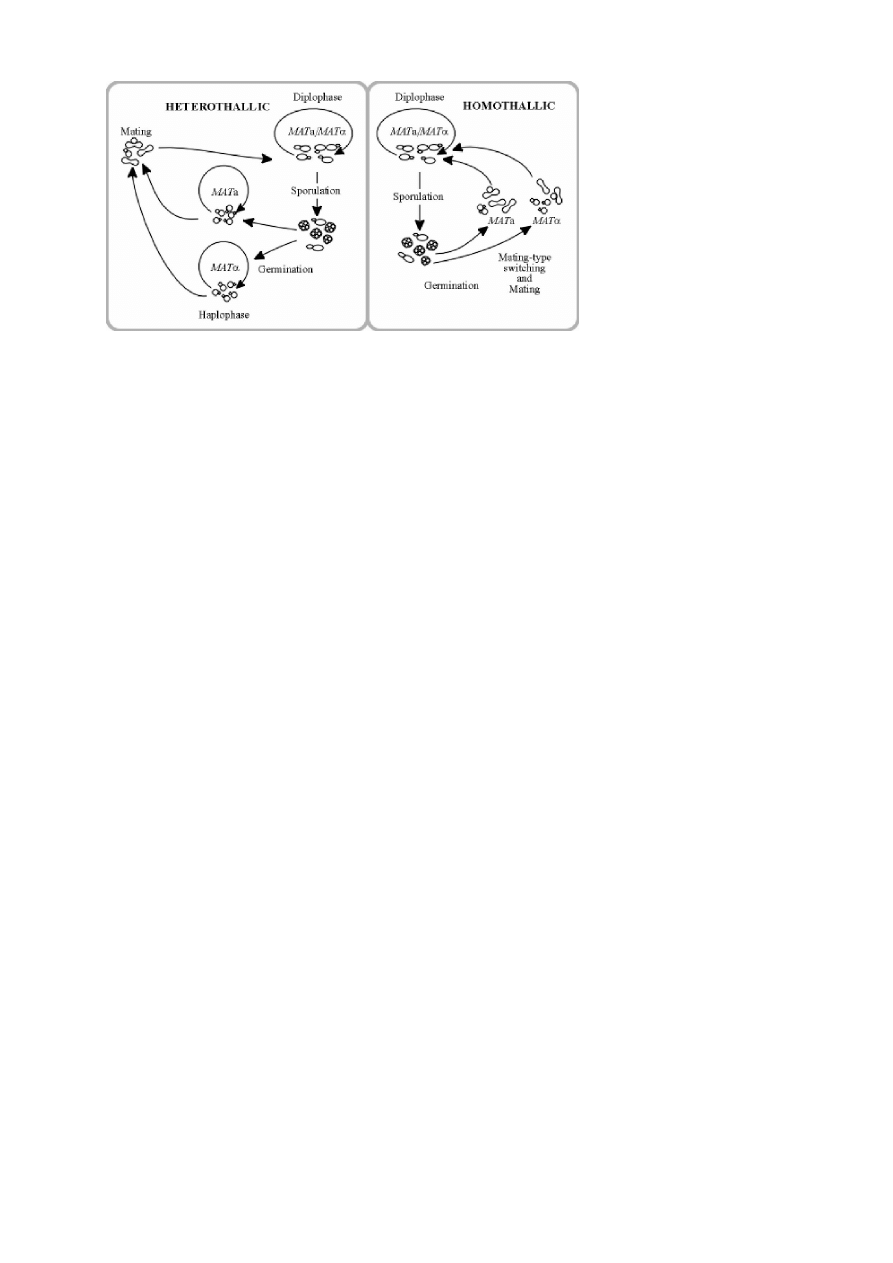
IV. Cykl życiowy drożdży Saccharomyces cerevisiae
Drożdże Saccharomyces cerevisiae są modelowym organizmem eukariotycznym. Cechują się:
niewielkim genomem (zawierającym około 6 tyś. genów), małej liczbie chromosomów, oraz krótkim
czasem podziału komórkowego (w warunkach optymalnych 90 min). Są mikroorganizmami łatwymi do
hodowli i manipulacji genetycznych. Nie formują grzybni, rozmnażają się wegetatywnie przez
pączkowanie. Ogromną zaletą drożdży jest możliwość utrzymywania ich zarówno jako haplo- bądź
diploidów. Haploidy mogą występować jako dwa typy kojarzeniowe: a lub α. Różnią się od siebie
genetycznie locus MAT, określającym typ kojarzeniowy. Występują dwa allele tego locus: MATa i
MATα. Szczep MATa kojarzy się ze szczepem MATα poprzez kompleksowy proces cytoplazmatycznej
i jądrowej fuzji dzięki czemu powstaje komórka diploidalna (a/α).
Pod względem zmienności typu kojarzeniowego wyróżnia się drożdże stabilne
(heterotalliczne) i niestabilne (homotalliczne). Jest to uzależnione od genu HO, który odpowiada za
zmianę typu kojarzeniowego przy każdym podziale mejotycznym komórki. Naturalnie występujące
szczepy drożdży są diploidalne i mają funkcjonalny allel genu HO, powodujący spontaniczną
zmianę typu kojarzeniowego co każdy podział mitotyczny. Szczepy laboratoryjne mają
zmutowany/wydeletowany gen ho i dzięki temu mogą być utrzymywane jako szczepy o
niezmiennym typie kojarzeniowym. Komórka o stabilnym typie kojarzeniowym dzieląc się
mitotycznie produkuje komórki potomne o takich samych typie kojarzeniowym. Istnienie stabilnej
fazy haploidalnej jest wyjątkowo atrakcyjne dla genetyków ze względu na możliwość izolacji i
identyfikacji szczepów niosących recesywne mutacje. Istnienie stabilnego diploida jest również
bardzo korzystne dla genetyków. Pozwala na określenie recesywności lub dominacji nowej mutacji
lub na przeprowadzenie testu komplementacji (czy szczepy niosące po jednej mutacji niosą allele
tego samego genu czy są to mutacje w różnych genach). Gdy drożdże są wystawione na stres np.
niekorzystne warunki pokarmowych, komórki diploidalne przechodzą mejozę produkując cztery
komórki potomne, zwane askosporami: dwie typu kojarzeniowego a- i dwie typu kojarzeniowego α-.
Askospory tworzą tetradę, która jest zawarta w pojedynczej strukturze zwanej ascus (worek). Gdy
przywróci się odpowiednie warunki pokarmowe, każda z tych czterech askospor wykiełkuje i
zacznie się rozmnażać jako haploid.
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
4
R
ys.1.Schemat cyklu życiowego
Sacharomyces cerevisiae.(za F. Sherman)
Literatura
1. Schlegel Hans G. „Mikrobiologia ogólna”. 1996. Wydawnictwo Naukowe PWN
2. Sherman F. An Introduction to the Genetics and Molecular Biology of the Yeast Saccharomyces
cerevisiae. 1998. Department of Biochemistry and Biophysics. University of Rochester Medical
School, Rochester, NY 14642. http://dbb.urmc.rochester.edu/labs/sherman_f/yeast/Index.html
3.
Sherman F., Getting started with yeast, Methods Enzymol. 350, 3-41 (2002).
http://dbb.urmc.rochester.edu/labs/sherman_f/startedyeast.pdf
---------------------------------------------------------------------------------------------------------------
Opracowały: mgr. Joanna Bobula, dr Dominika Włoch-Salamon
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.

5
Ćwiczenia praktyczne
Dbaj o swoje miejsce pracy. Pozostaw go tak czystym jak go zastałeś. Jednorazowe
zużyte materiały wyrzuć, a materiały wielokrotnego użytku umyj.
Zadanie nr 1: Kojarzenie drożdży
Szczepy haploidalne użyte w tym doświadczeniu są auksotrofami różnych aminokwasów i żaden z
nich nie jest w stanie rosnąć na podłożu minimalnym. Dopiero po skojarzeniu może powstać
heterozygotyczny diploid, który dzięki komplementacji markerów troficznych jest zdolny do syntezy
wszystkich aminokwasów, i tym samym wzrostu na podłozu minimalnym. Należy skojarzyć
wszystkie szczepy (na zasadzie każdy z każdym).
Materiały:
- probówki z trzema płynnymi kulturami haploidalnych drożdży:
Y55 MATα, ura2, URA 3, LEU2, tyr,
Y55 MATa, ura2, URA 3 , LEU2, tyr,
Y55 MATα, URA2, ura3, leu2, TYR
- pipeta i sterylne końcówki do pipety
- szalki Petriego ze stałym podłożem minimalnym
Przebieg doświadczenia:
Praca w grupach pod komorami laminarnymi.
SZALKI NALEŻY PODPISAĆ!!!!!! Na części z agarem (nie na pokrywce)
1. Połóż szalkę minimalną na części z agarem i ją otwórz zdejmując pokrywkę.
2. Wstrząśnij płynną kulturę haploida nr1 na worteksie.
3. Nastaw pipetę na 10 l.
4. Otwórz naczynie ze sterylnymi końcówkami do pipet i delikatnie nabij jeden na pipetę dbając, by
podczas wyciągania nie dotknąć niczego jej sterylnym końcem.
5. Włóż delikatnie pipetę do probówki i przenieś kroplę kultury drożdży na szalkę umieszczając ją
po lewej stronie szalki.
6. Dbając, by niczego po drodze nie dotknąć, przenieś drugą kroplę zawiesiny drożdży i umieść ją
na środku szalki.
7. Wstrząśnij płynną kulturę haploida nr2 na worteksie.
8. Zmień końcówkę pipety i przenieś kroplę zawiesiny na prawą stronę szalki.
9. Zmień końcówkę pipety, przenieś kroplę zawiesiny i umieść ją na kropli będącej już na środku
szalki.
10. Poczekaj, aż krople wyschną.
11. Powtórz to wszystko dla drugiego (nr1 i nr3) i trzeciego (nr2 i nr3) kojarzenia i przełóż szalkę do
inkubatora.
Kontynuacja doświadczenia tydzień później.
12. Wyjmij szalki z inkubatora i oceń wzrost poszczególnych szczepów.
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.

6
Zadanie nr 2: Test replik (stemplowanie)
Na otrzymanych szalkach z podłożem pełnym YPD (yeast peptone dextrose) wysiano prototroficzny
pod względem syntezy leucyny szczep drożdży. Istnieje jednak podejrzenie, że nastąpiło zakażenie
kultury wyjściowej innym, auksotroficznym pod tym samym względem szczepem drożdży. W celu
sprawdzenie, które kolonie wyrosłe na szalce z podłożem pełnym są auksotroficzne, należy
wykonać test replik na podłożu nie zawierającym leucyny. Założeniem tej metody jest odbicie
drożdży z powierzchni agaru na sterylny aksamit, a następnie transfer tego „wzoru” na kolejną
szalkę. Doświadczenie ma na celu oszacowanie proporcji kolonii drożdży auksotroficznych pod
względem syntezy leucyny do kolonii prototroficznych, a tym samym sprawdzenie czy doszło do
zakażenia szczepu
Materiały:
- szalki z wyrośniętymi koloniami drożdży na podłożu YPD
- sterylne szmatki aksamitne
- szalki Petriego ze stałym podłożem SC-leu
Procedura:
Praca w grupach pod komorami laminarnymi.
1. Wyjmij z naczynia sterylny aksamit i ostrożnie rozprostuj go uważając, by nie dotknąć palcami
powierzchni z włoskami w centrum szmatki.
2. Rozprostowaną szmatkę połóż na stemplu włoskami do góry i przymocuj do niego gumką
recepturką.
3. Szalkę matrycę otwórz, delikatnie przyciśnij agarem do aksamitu, zamknij.
4. Szalkę docelową otwórz, delikatnie przyciśnij do welwetu, zamknij i umieść w inkubatorze.
Kontynuacja doświadczenia tydzień później.
5. Wyjmij szalki z inkubatora i policz kolonie wyrosłe na różnych podłożach a następnie oblicz
proporcję szczepu leu do LEU.
Zadanie nr 3: Obserwacja komórek wegetatywnych i zesporulowanych
drożdży pod mikroskopem.
Rozmiar komórek drożdży jest zmienny w zależności od faz wzrostu (pączek a kom. dojrzała),
stanów metabolicznych (szybki wzrost a starzenie się), rodzaju szczepów, form ploidalności
(haploidy a diploidy). Typowa diploidalne komórka drożdża jest elipsoidalnego kształtu o wymiarach
5 x 6 µm, a haploidalna to sferoida o średnicy 4 µm. Podczas fazy wzrostu logarytmicznego
haploidy zbijają się w liczniejsze zgrupowania niż haploidy. Dodatkowo nowe komórki haploida
pączkują sąsiadująco do komórki „matki”, natomiast diploidy kiełkują na przeciwległych biegunach.
Po podziale mejotycznym 4 spory (askospory) są zamknięte w worku (askus). Komórki są niewielkie
w przestrzeni między szkiełkami preparatu nie są ułożone płasko a przestrzennie. Tetrady spor są
najczęściej widoczne jako 3 małe kuleczki (4-ta jest ukryta pod spodem) otoczone ścianą
komórkową.
Materiały:
- płynne kultury drożdży wegetatywnych (1n, 2n) i zesporulowanych
- sterylne patyczki drewniane
- szkiełka mikroskopowe i nakrywkowe
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.

7
Procedura:
1. Wymieszać dobrze płynne kultury drożdży
2. Na szkiełko podstawowe należy nanieść pipetą kroplę kultury drożdży i nakryć szkiełkiem
nakrywkowym.
3. Obserwować pod powiększeniem 40X
4. Narysuj komórki wegetatywne (1n, 2n) i spory.
Zaznacz różnice w preparatach
Zadanie nr 4: Oznaczanie genotypu drożdży wegetatywnych (1n) na
podłożach selekcyjnych
Podłoża, na których będą przeprowadzane testy to podłoża syntetyczne (Sc-), czyli w pełni
zdefiniowane o dokładnie poznanym składzie, w których brakuje pojedynczego czynnika
wzrostowego, w tym wypadku są to poszczególne aminokwasy. Na takim podłożu mogą rosnąć
tylko te drożdże, które mają sprawny szlak syntezy danego aminokwasu. Gdy szlak ten jest
uszkodzony na jakimś etapie, drożdże na takim podłożu nie rosną i nazywane są aksotrofami tego
poszczególnego nutrientu, np. szczep nie rosnący na podłożu SC-ura to auksotrof uracylu.
Materiały:
- szalki z wyrośniętymi koloniami drożdży o nieznanym genotypie na podłożu pełnym bulionowym
YPD
- szalki z wykonanymi replikami na podłożach selekcyjnych
Procedura:
Na podstawie wyników wzrostu kolonii odbitych na szalkach testowych określ genotypy
poszczególnych szczepów drożdży.
Zadanie nr 5: Oznaczanie genotypu askospor na podłożach selekcyjnych
Używając mikromanipulatora można rozdzielić askospory pochodzące z jednej tetrady. Uzyskuje się
w ten sposób haploidy będące produktem mejozy jednej komórki diploidalnej. Podczas tworzenia
spor większość genów segreguje do komórk potomnych wg. Praw genetyki mendlowskiej.
Heterozygotyczny marker będzie segregował zgodnie z wzorcem 2:2. W ten sposób można
otrzymać szczepy o nowej kombinacji cech.
Doświadczenie ma na celu określenie genotypów askospor powstałych w wyniku sporulacji
diploidalnego szczepu drożdży, hetoryzygotycznego w każdym locus markerów troficznych oraz
określenie, czy askospory rzeczywiście pochodzą z jednej tetrady.
Materiały:
- szalka z wyrośniętymi koloniami powstałymi w wyniku rozłożenia za pomocą mikromanipulatora
nadtrawionych tetrad na pełnym podłożu YPD
- szalki z wykonanymi replikami na podłożach SC-lys, SC-ade, YPD+nat
Procedura:
Na podstawie wyników wzrostu kolonii odbitych na szalkach testowych określ genotypy
poszczególnych kolonii wyrosłych z pojedynczych askospor i określ na tej podstawie czy dana
tetrada jest tetradą prawdziwą czy fałszywą.
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Wyszukiwarka
Podobne podstrony:
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 8 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
Cwiczenie 5 instrukcja wzmacnia Nieznany
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenie 3 instrukcja id 12533 Nieznany
INSTRUKCJE Cwiczenie 1 id 71952 Nieznany
instrukcja do cwiczenia t1 dla Nieznany
cwiczenie3 cwiczenie 3 instrukc Nieznany
Instrukcja cwiczenia 9 id 21649 Nieznany
cwiczenia 9 i 10 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczen
Instrukcja co cwiczenia id 2164 Nieznany
cwiczenia 7B instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
INSTRUKCJE Cwiczenie 2 id 71952 Nieznany
cwiczenieHP3 instrukcja v6 id 1 Nieznany
instrukcja do cwiczenia nr 23 i Nieznany
Instrukcja do cwiczenia id 2165 Nieznany
cwiczenie 3 instrukcja id 12533 Nieznany
cwiczenie9 id 125928 Nieznany
więcej podobnych podstron