1
RJC
Substytucje Nukleofilowe
w Pochodnych Karbonylowych
Substytucje Nukleofilowe
Substytucje Nukleofilowe
w Pochodnych Karbonylowych
w Pochodnych Karbonylowych
Slides 1 to 21
C
O
R
Nu
Y
+
C
O
R
Y
Nu
+
Nu
C
O
R
Y
2
RJC
Addycje vs Podstawienia
Addycje vs Podstawienia
Ł
Ł
adunek
adunek
δ
δ
+
+
zlokalizowany na atomie w
zlokalizowany na atomie w
ę
ę
gla grupy
gla grupy
karbonylowej powoduje,
karbonylowej powoduje,
ż
ż
e atak nukleofila mo
e atak nukleofila mo
ż
ż
e
e
doprowadzi
doprowadzi
ć
ć
do utworzenia produktu addycji lub
do utworzenia produktu addycji lub
substytucji.
substytucji.
C
O
δ
+
δ
-
Nu
X
R
C
O
Nu
R
C
OH
R
X
Nu
add
n
sub
n
3
RJC
Podstawienie (substytucja)
Podstawienie (substytucja)
Je
Je
ż
ż
eli grupa Y jest dobr
eli grupa Y jest dobr
ą
ą
grup
grup
ą
ą
odchodz
odchodz
ą
ą
c
c
ą
ą
,
,
to
to
preferowane jest powstawanie produktu substytucji.
preferowane jest powstawanie produktu substytucji.
C
O
R
Nu
Y
+
C
O
R
Y
Nu
+
Nu
C
O
R
Y
4
RJC
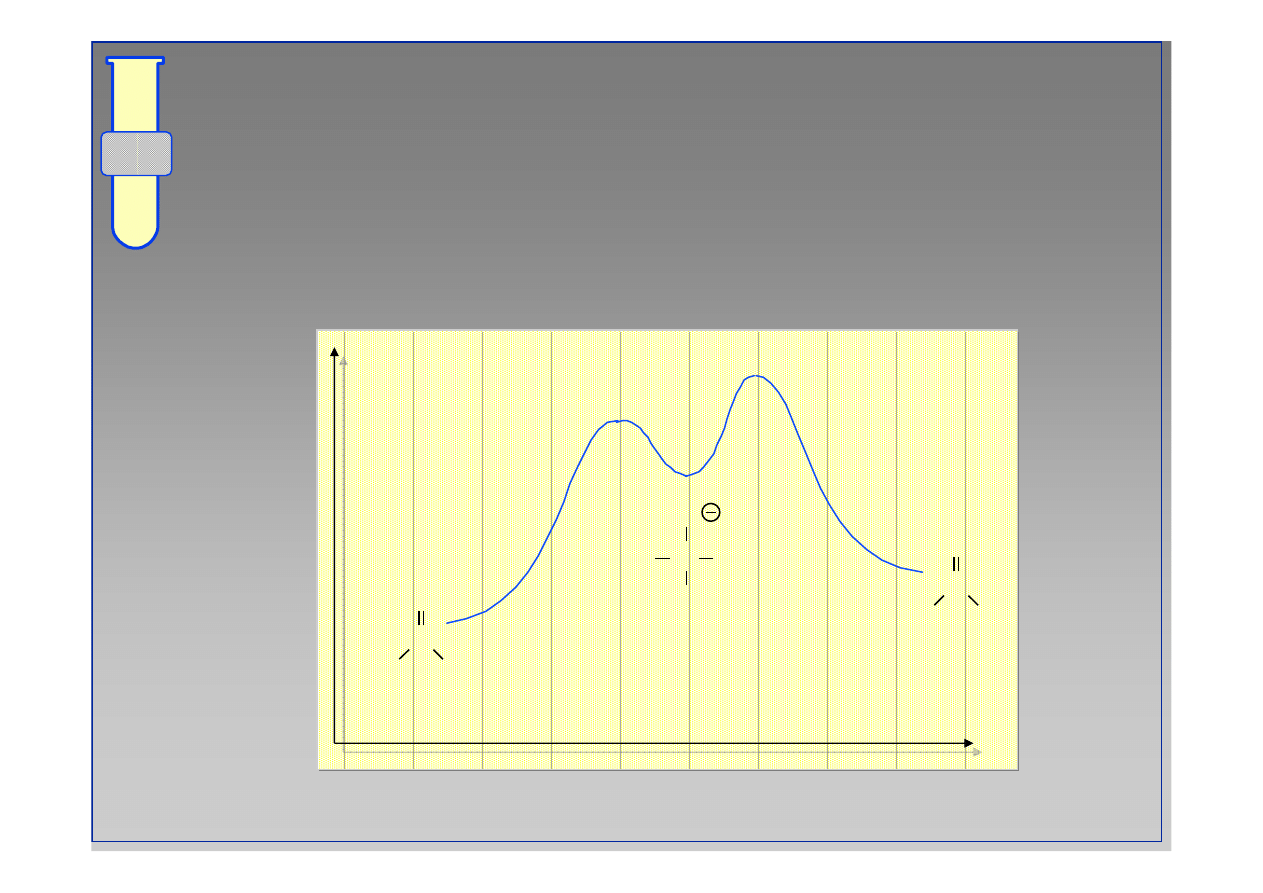
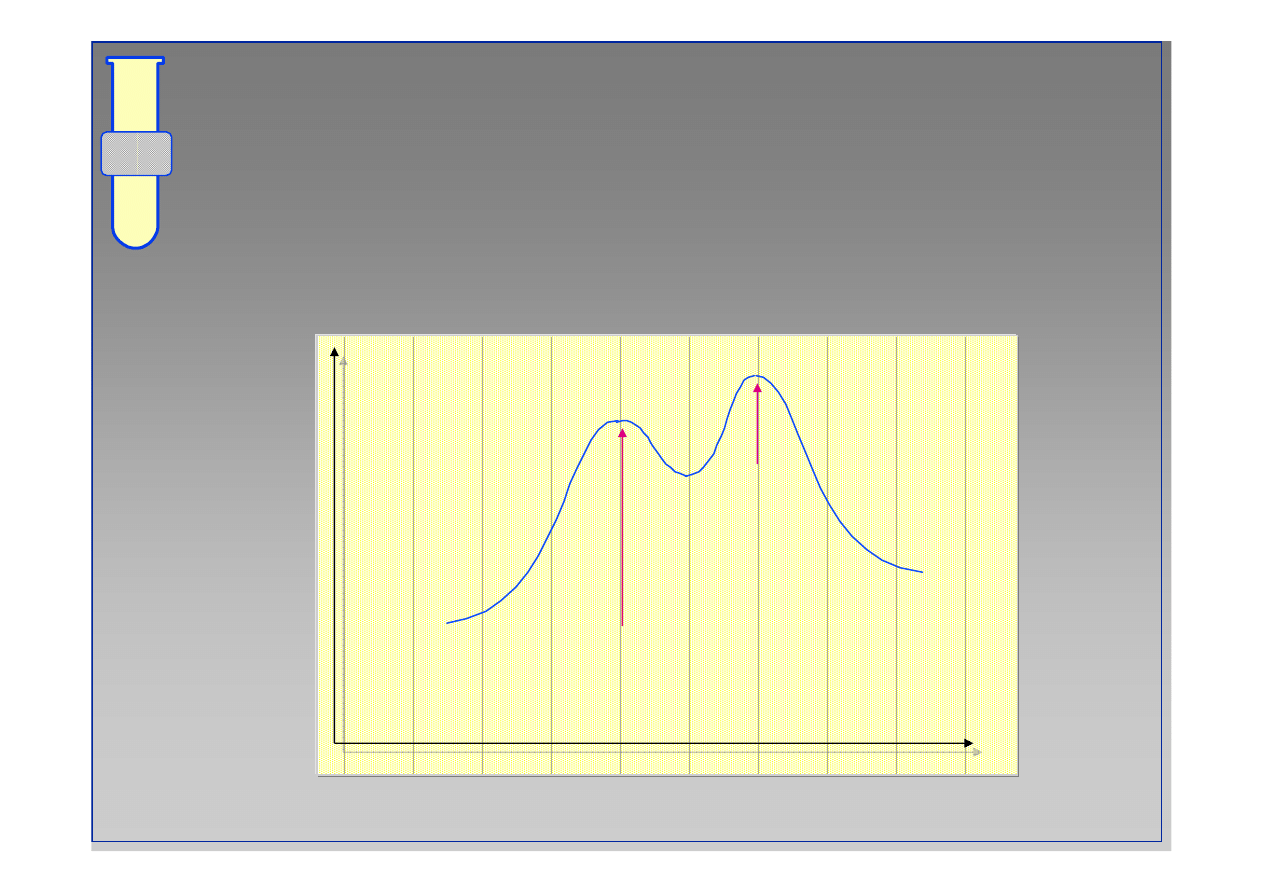
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Podstawienie przy grupie karbonylowej jest
Podstawienie przy grupie karbonylowej jest
reakcj
reakcj
ą
ą
dwuetapow
dwuetapow
ą
ą
.
.
Energia
Postęp reakcji
C
O
R
Nu
C
O
R
Y
Nu
C
O
R
Y
5
RJC
Etap okre
Etap okre
ś
ś
laj
laj
ą
ą
cy szybko
cy szybko
ść
ść
reakcji
reakcji
...addycja cz
...addycja cz
ą
ą
steczki Nu zazwyczaj okre
steczki Nu zazwyczaj okre
ś
ś
la
la
szybko
szybko
ść
ść
reakcji; niemniej, odej
reakcji; niemniej, odej
ś
ś
cie grupy Y mo
cie grupy Y mo
ż
ż
e
e
r
r
ó
ó
wnie
wnie
ż
ż
wyznacza
wyznacza
ć
ć
najwolniejszy etap reakcji.
najwolniejszy etap reakcji.
Energia
Postęp reakcji
+Nu
-Y
6
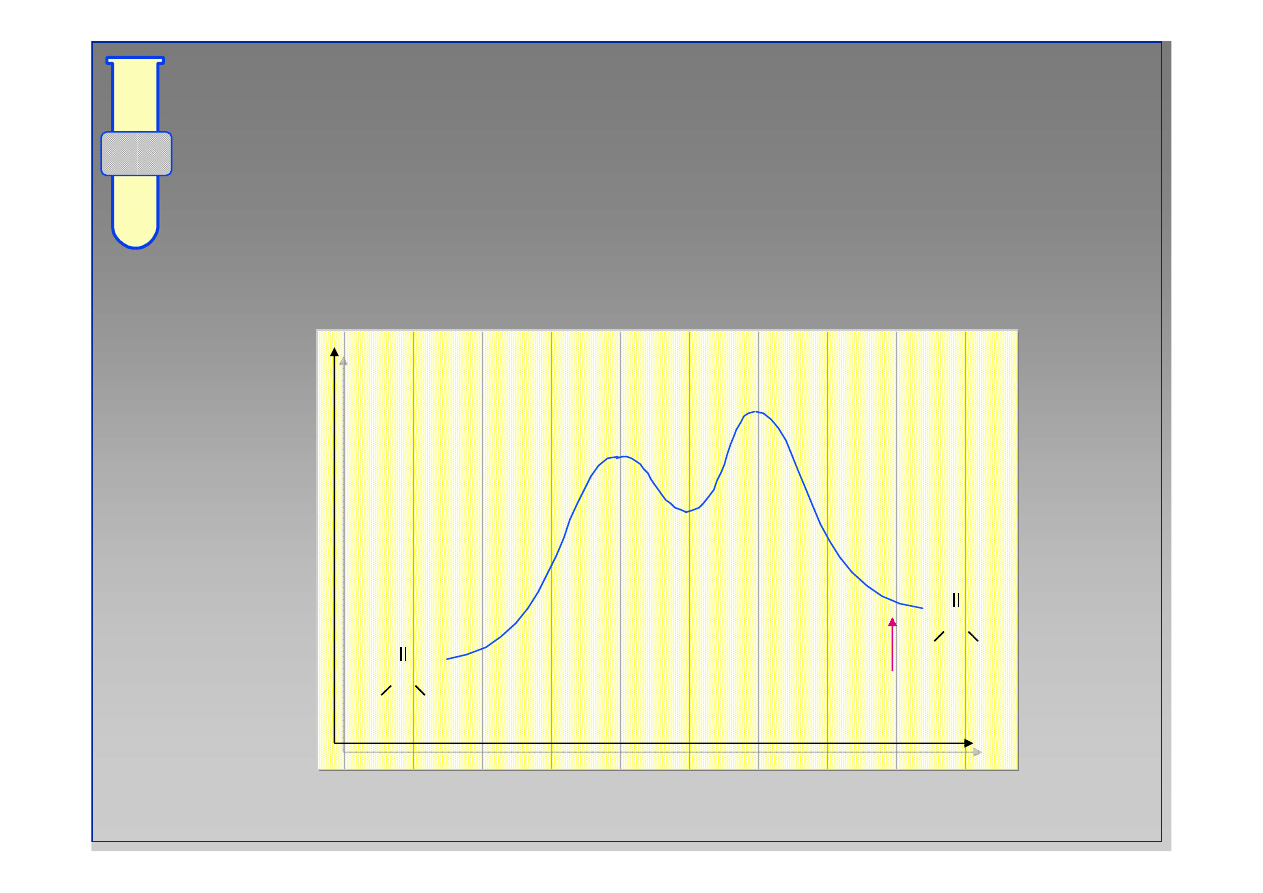
RJC
Stan r
Stan r
ó
ó
wnowagi
wnowagi
Stan r
Stan r
ó
ó
wnowagi jest okre
wnowagi jest okre
ś
ś
lony przez r
lony przez r
ó
ó
ż
ż
nic
nic
ę
ę
wzgl
wzgl
ę
ę
dnych energii produkt
dnych energii produkt
ó
ó
w oraz substrat
w oraz substrat
ó
ó
w,
w,
∆
∆
G
G
o
o
.
.
Energia
Postęp reakcji
∆
G
o
C
O
R
Nu
C
O
R
Y
7
RJC
Czynniki okre
Czynniki okre
ś
ś
laj
laj
ą
ą
ce mo
ce mo
ż
ż
liwo
liwo
ść
ść
ataku nukleofilowego
ataku nukleofilowego
Dwa czynniki maj
Dwa czynniki maj
ą
ą
ce zasadnicze znaczenie dla
ce zasadnicze znaczenie dla
ataku nukleofila Nu to
ataku nukleofila Nu to
:
:
Oddziaływania steryczne (przestrzenne)
Czynniki elektronowe (elektroujemność)
8
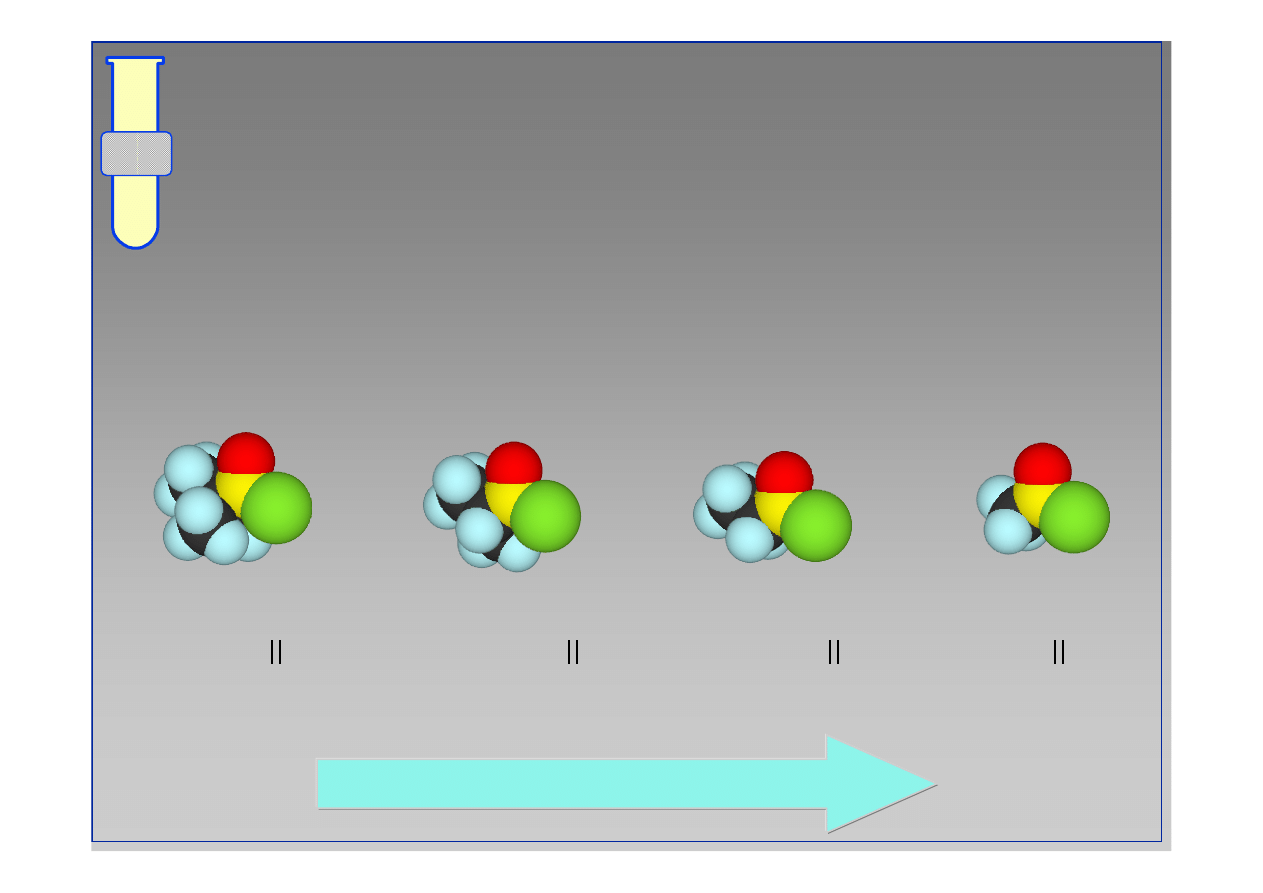
RJC
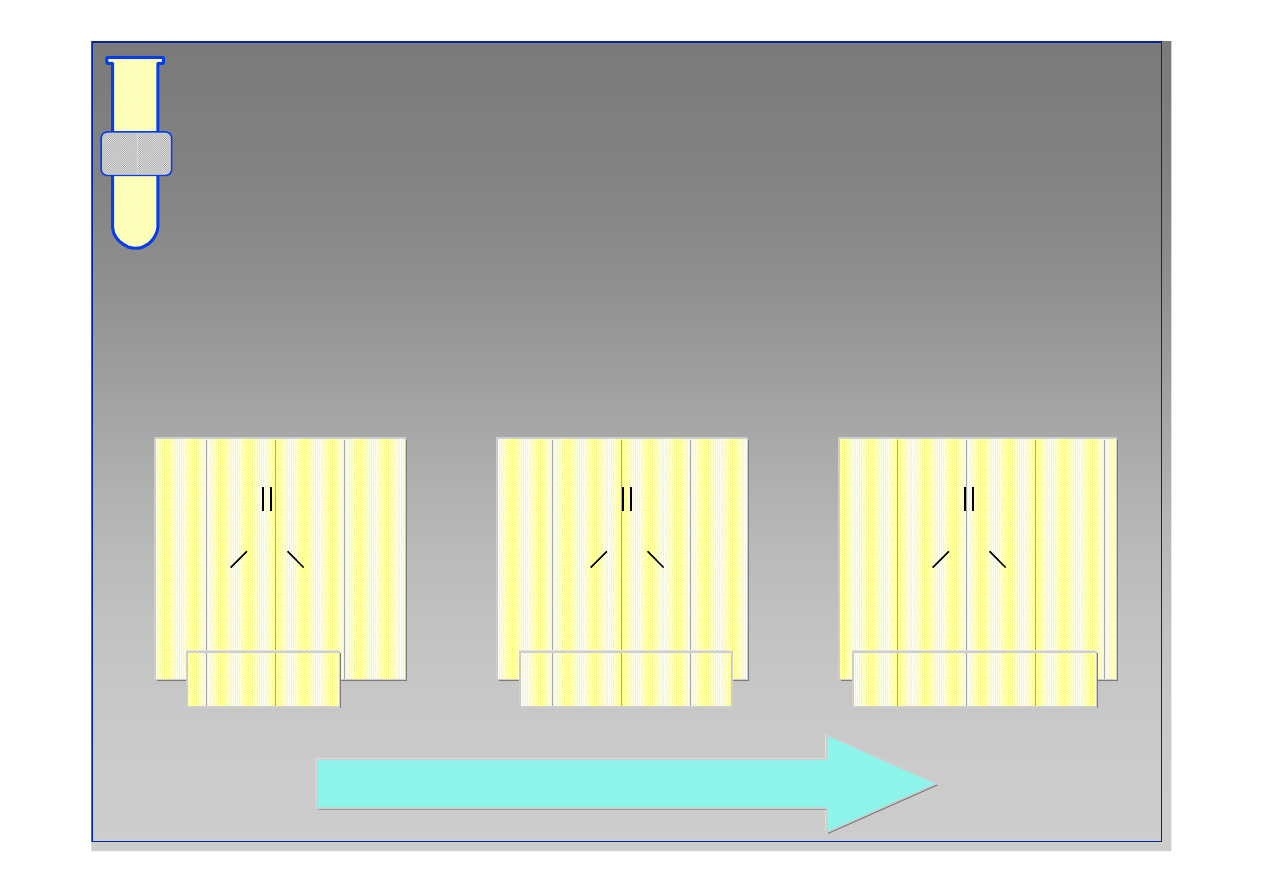
Czynniki steryczne (przestrzenne)
Czynniki steryczne (przestrzenne)
Sterycznie zat
Sterycznie zat
ł
ł
oczone (wysoce podstawione)
oczone (wysoce podstawione)
zwi
zwi
ą
ą
zki karbonylowe s
zki karbonylowe s
ą
ą
mniej podatne na atak
mniej podatne na atak
odczynnika nukleofilowego Nu.
odczynnika nukleofilowego Nu.
O
(CH
3
)
3
CCCl
(CH
3
)
2
CHCCl
O
CH
3
CH
2
CCl
O
CH
3
CCl
O
wzrastająca reaktywność
9
RJC
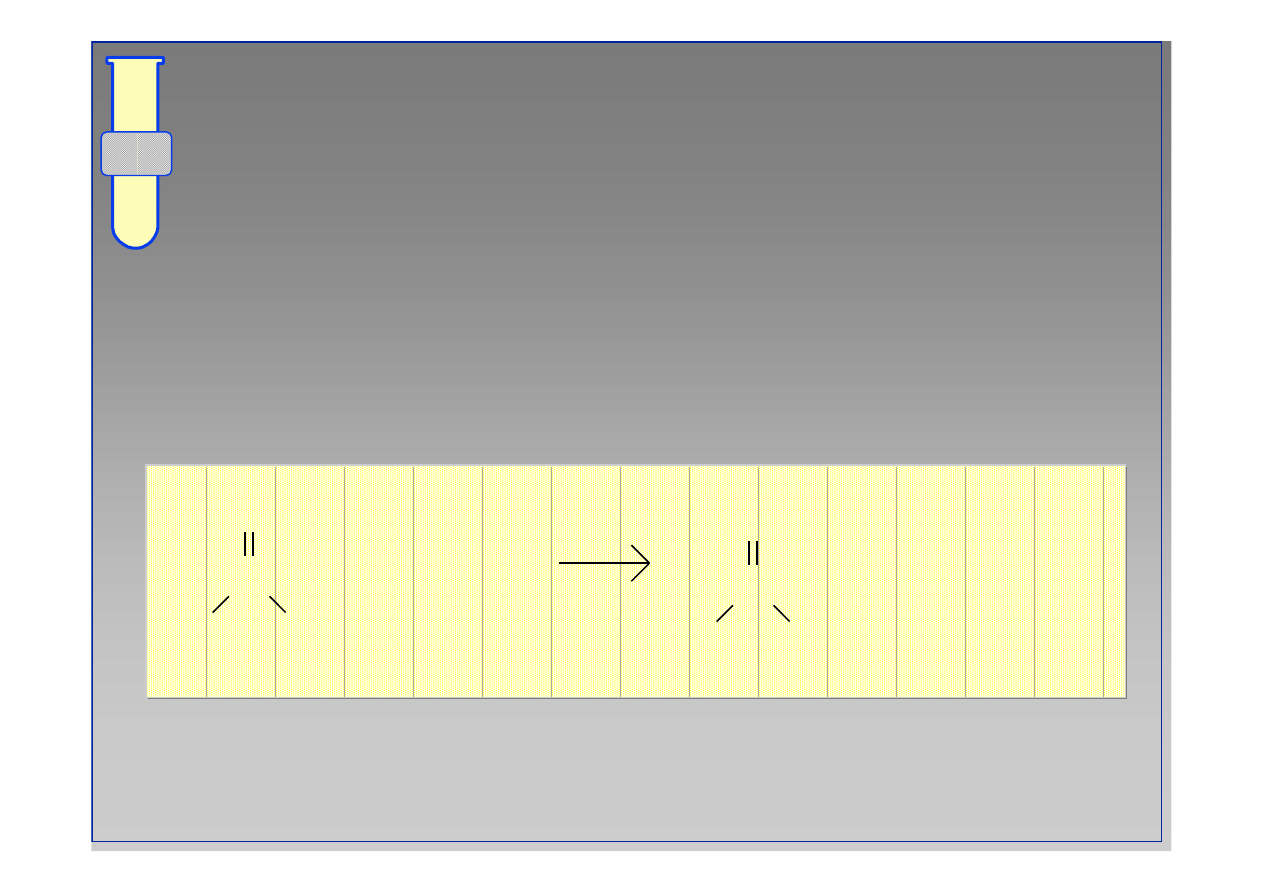
Czynniki elektronowe (elektroujemno
Czynniki elektronowe (elektroujemno
ść
ść
)
)
Im wi
Im wi
ę
ę
kszy
kszy
ł
ł
adunek
adunek
δ
δ
+
+
na karbonylowym atomie
na karbonylowym atomie
w
w
ę
ę
gla, tym bardziej jest on podatny na atak
gla, tym bardziej jest on podatny na atak
odczynnika nukleofilowego Nu.
odczynnika nukleofilowego Nu.
C
O
CH
3
NH
2
C
O
OH
CH
3
C
O
Cl
CH
3
acetamid
kwas octowy
chlorek acetylu
wzrastająca reaktywność
10
RJC
Otrzymywanie chlork
Otrzymywanie chlork
ó
ó
w kwasowych
w kwasowych
Kwasy karboksylowe reaguj
Kwasy karboksylowe reaguj
ą
ą
z chlorkiem tionylu
z chlorkiem tionylu
(SOCl
(SOCl
2
2
) daj
) daj
ą
ą
c chlorki kwasowe (COCl).
c chlorki kwasowe (COCl).
C
O
R
Cl
HCl
+ SO
2
+
C
O
R
OH
SOCl
2
+
11
RJC
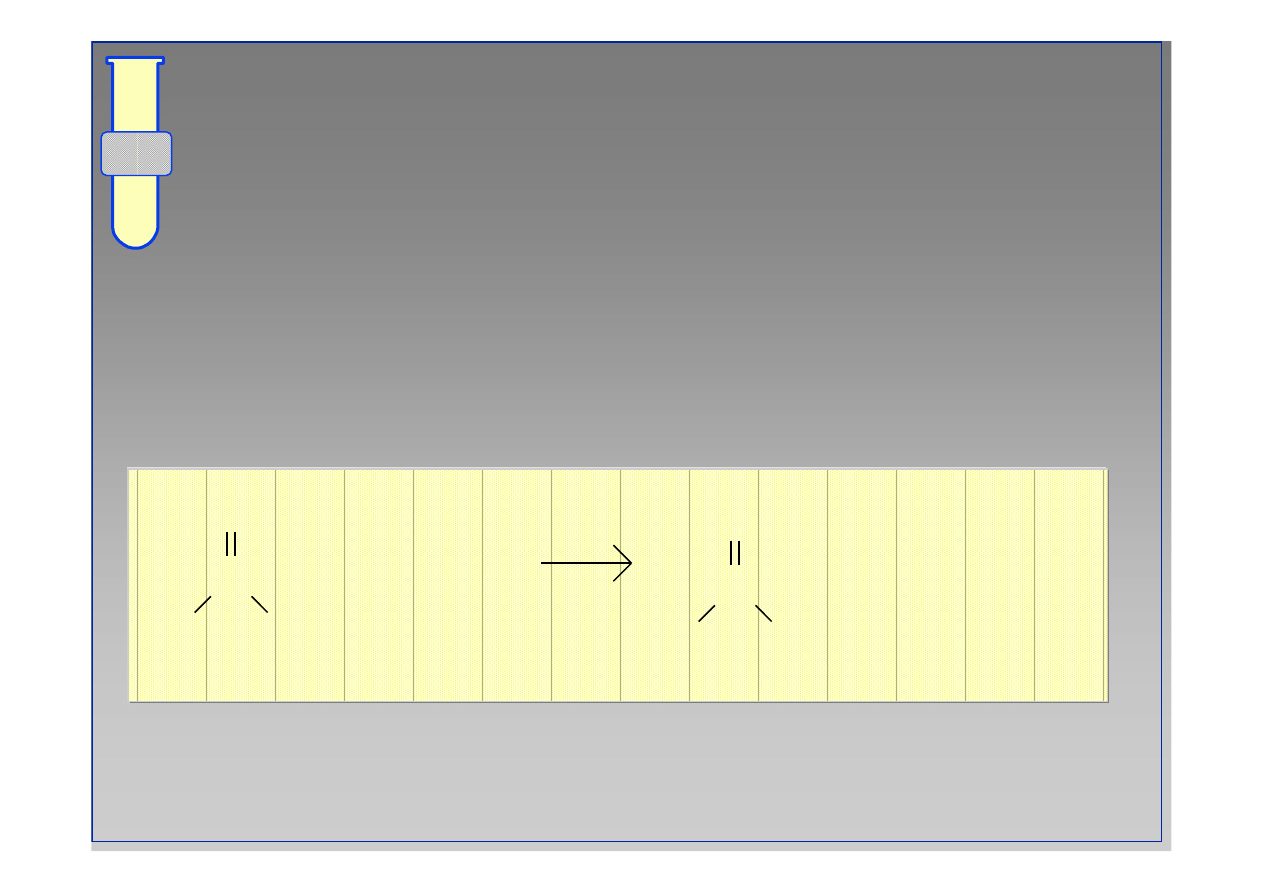
Wykorzystanie chlork
Wykorzystanie chlork
ó
ó
w kwasowych
w kwasowych
Chlorki kwasowe s
Chlorki kwasowe s
ą
ą
niezwykle u
niezwykle u
ż
ż
ytecznymi
ytecznymi
odczynnikami, kt
odczynnikami, kt
ó
ó
re
re
ł
ł
atwo ulegaj
atwo ulegaj
ą
ą
reakcjom
reakcjom
prowadz
prowadz
ą
ą
cym do...
cym do...
Kwas
Kwas
ó
ó
w
w
Estrów
Amidów
12
RJC
Otrzymywanie kwas
Otrzymywanie kwas
ó
ó
w karboksylowych
w karboksylowych
z chlork
z chlork
ó
ó
w kwasowych
w kwasowych
Hydroliza chlorku kwasowego (COCl) (przy
Hydroliza chlorku kwasowego (COCl) (przy
u
u
ż
ż
yciu wody H
yciu wody H
2
2
O) prowadzi do regeneracji kwasu
O) prowadzi do regeneracji kwasu
karboksylowego (CO
karboksylowego (CO
2
2
H).
H).
C
O
R
OH
+ HCl
C
O
R
Cl
H
2
O
+
••
••
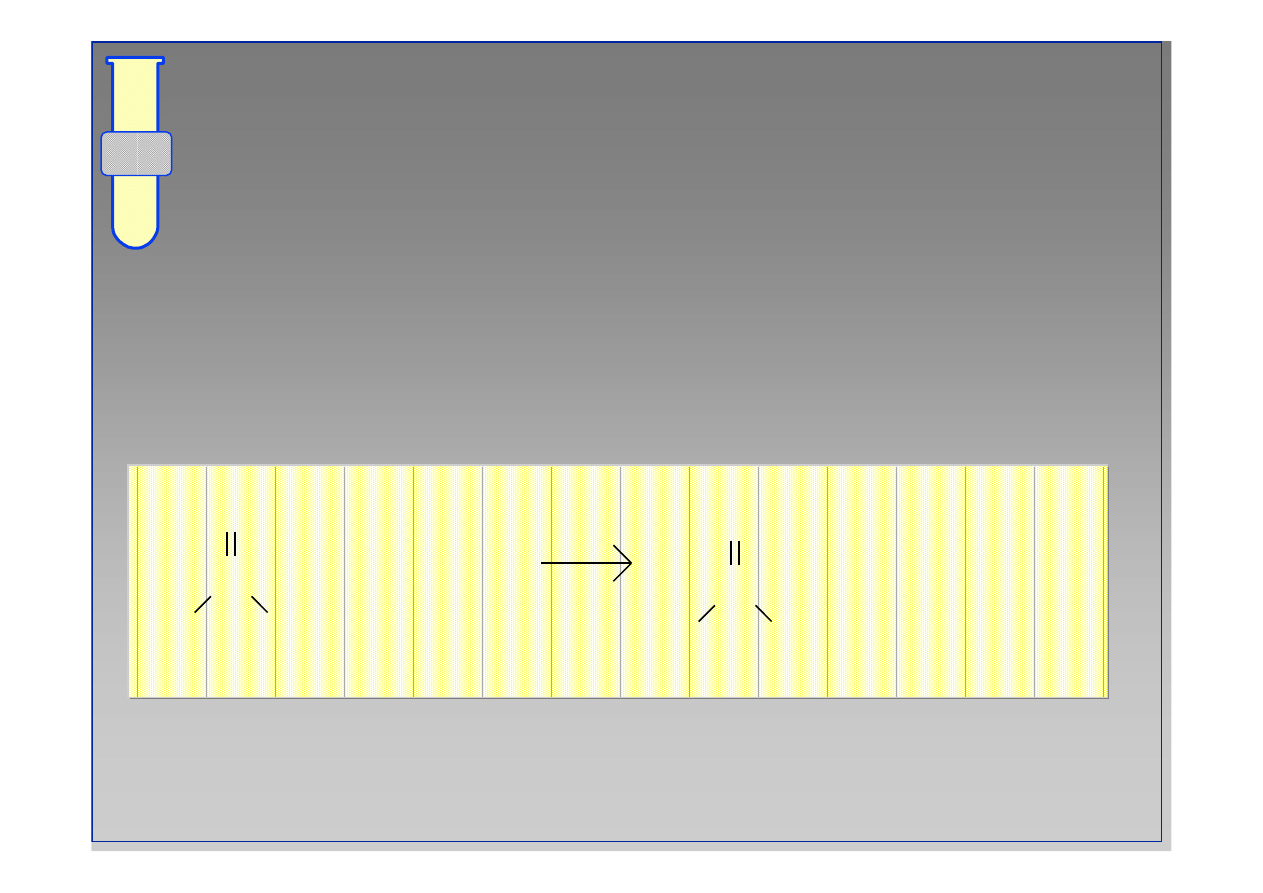
13
RJC
Otrzymywanie estr
Otrzymywanie estr
ó
ó
w z chlork
w z chlork
ó
ó
w kwasowych
w kwasowych
Reakcje chlork
Reakcje chlork
ó
ó
w kwasowych (COCl) z
w kwasowych (COCl) z
alkoholami (ROH) prowadz
alkoholami (ROH) prowadz
ą
ą
do estr
do estr
ó
ó
w (CO
w (CO
2
2
R).
R).
C
O
R
O
R
+ HCl
C
O
R
Cl
R
OH
+
••
••
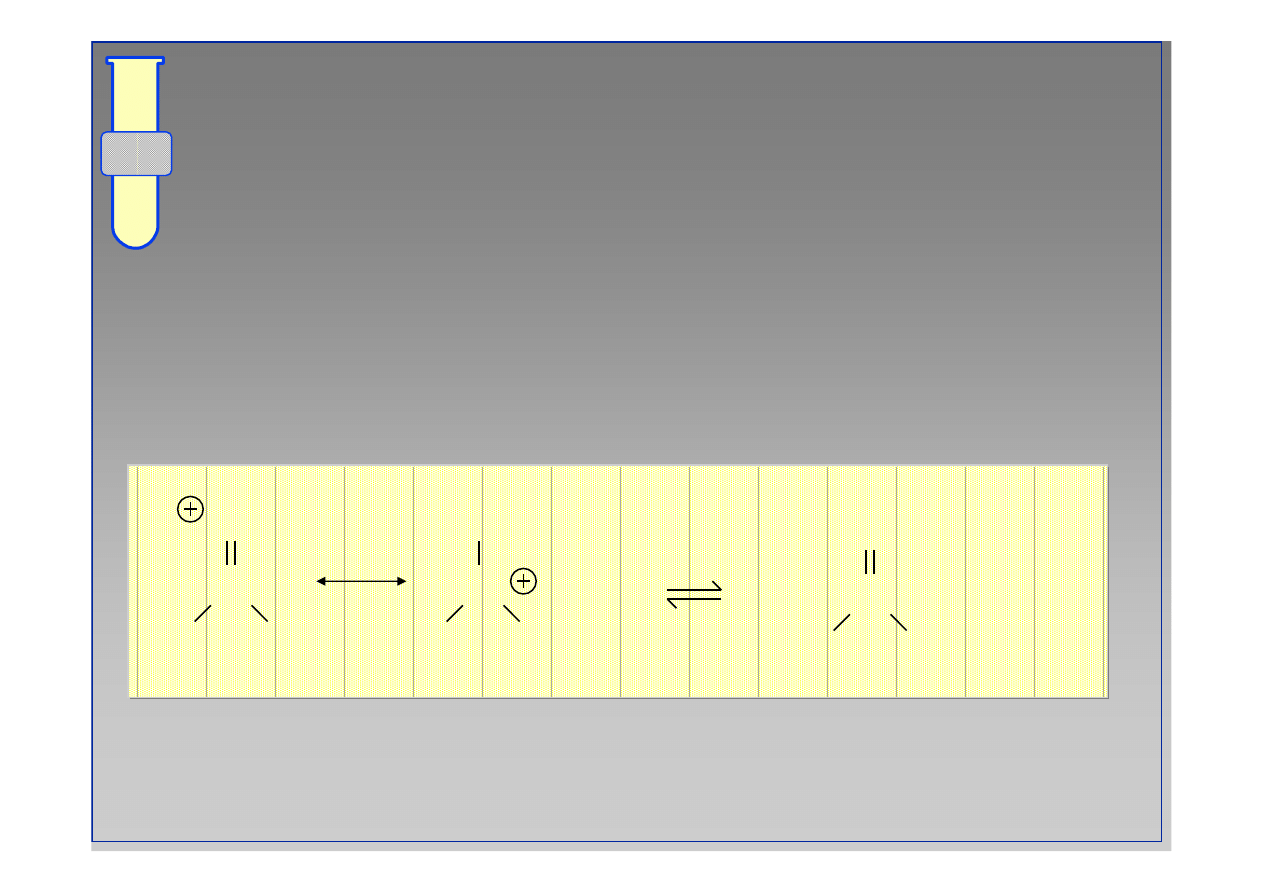
14
RJC
Niemniej ... najwa
Niemniej ... najwa
ż
ż
niejsza metoda
niejsza metoda
otrzymywania estr
otrzymywania estr
ó
ó
w to
w to
…
…
reakcje kwas
reakcje kwas
ó
ó
w karboksylowych (CO
w karboksylowych (CO
2
2
H) z alkoholami
H) z alkoholami
(ROH) w obecno
(ROH) w obecno
ś
ś
ci katalizatora kwasowego.
ci katalizatora kwasowego.
C
O
R
O
R
+ H
2
O
C
O
H
R
OH
R
OH
••
••
C
O
H
R
OH
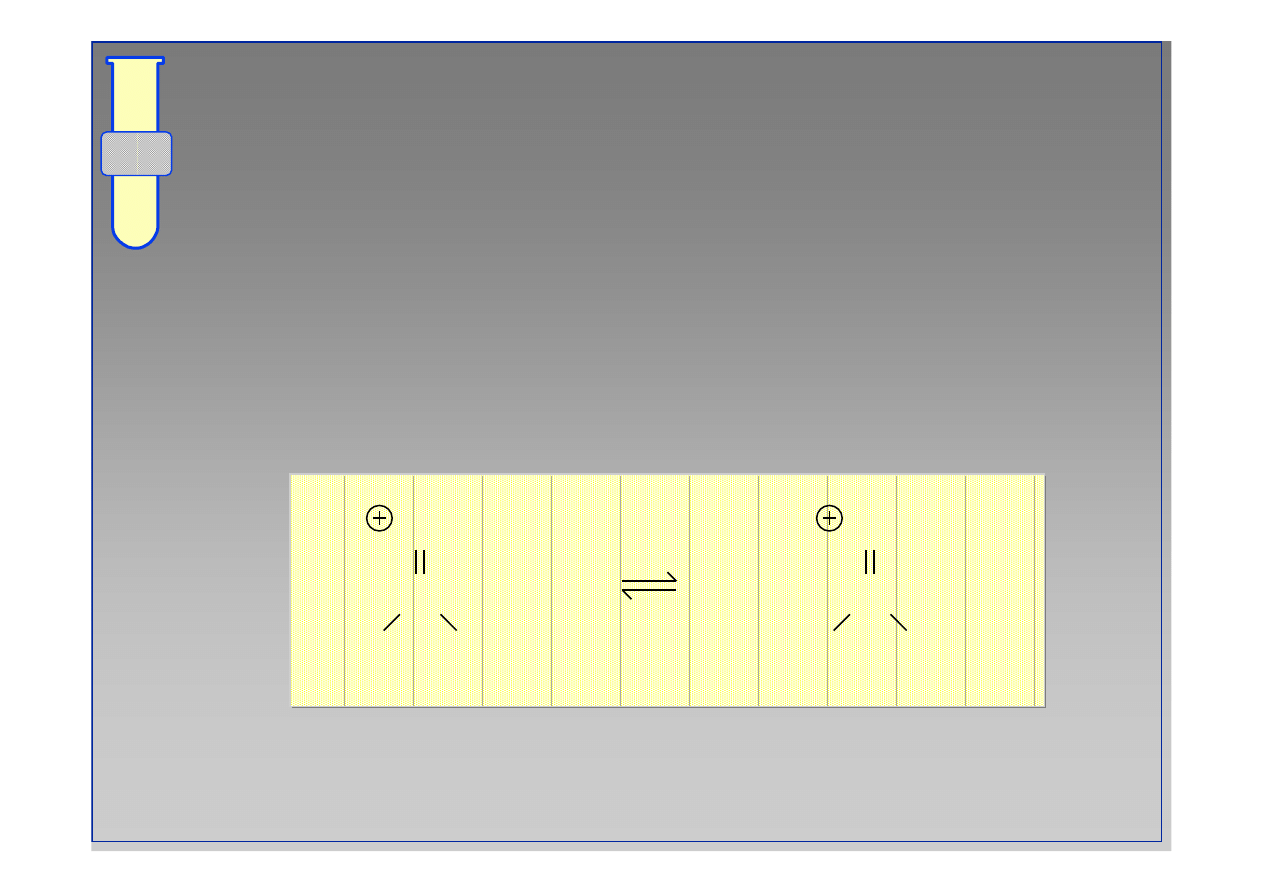
15
RJC
Stan r
Stan r
ó
ó
wnowagi w reakcji estryfikacji
wnowagi w reakcji estryfikacji
R
R
ó
ó
wnowaga pomi
wnowaga pomi
ę
ę
dzy estrem (CO
dzy estrem (CO
2
2
R) i kwasem
R) i kwasem
karboksylowym (CO
karboksylowym (CO
2
2
H), w warunkach katalizy
H), w warunkach katalizy
kwasowej, zale
kwasowej, zale
ż
ż
y od wzgl
y od wzgl
ę
ę
dnych st
dnych st
ęż
ęż
e
e
ń
ń
alkoholu
alkoholu
[ROH] oraz wody [H
[ROH] oraz wody [H
2
2
O].
O].
C
O
H
R
O
R
R
OH
••
••
C
O
H
R
OH
HOH
••
••
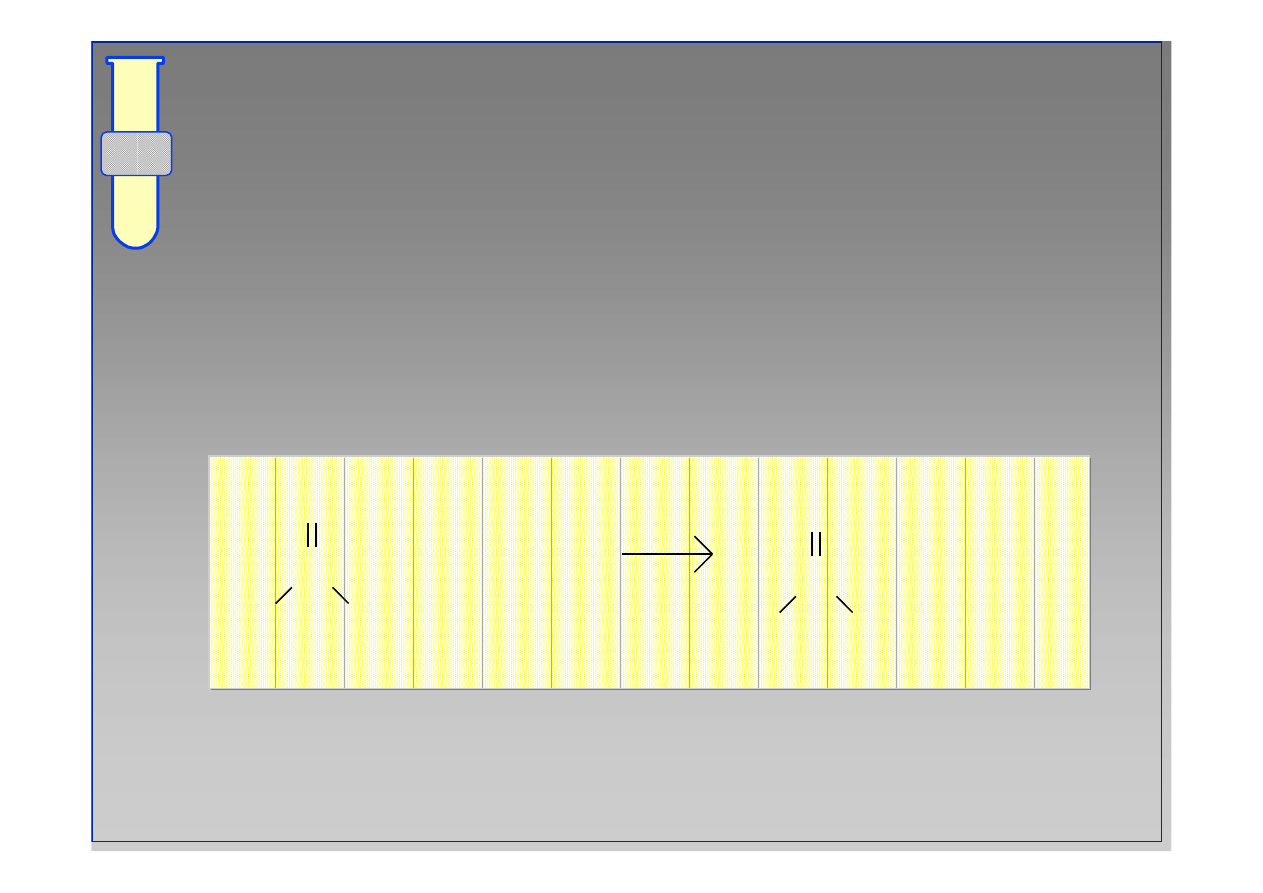
16
RJC
Otrzymywanie amid
Otrzymywanie amid
ó
ó
w z chlork
w z chlork
ó
ó
w
w
kwasowych
kwasowych
Amidy I
Amidy I
-
-
rz
rz
ę
ę
dowe (CONH
dowe (CONH
2
2
) mo
) mo
ż
ż
na
na
ł
ł
atwo otrzyma
atwo otrzyma
ć
ć
w reakcji chlork
w reakcji chlork
ó
ó
w kwasowych (COCl) z
w kwasowych (COCl) z
amoniakiem (NH
amoniakiem (NH
3
3
).
).
C
O
R
NH
2
+ HCl
C
O
R
Cl
NH
3
+
••
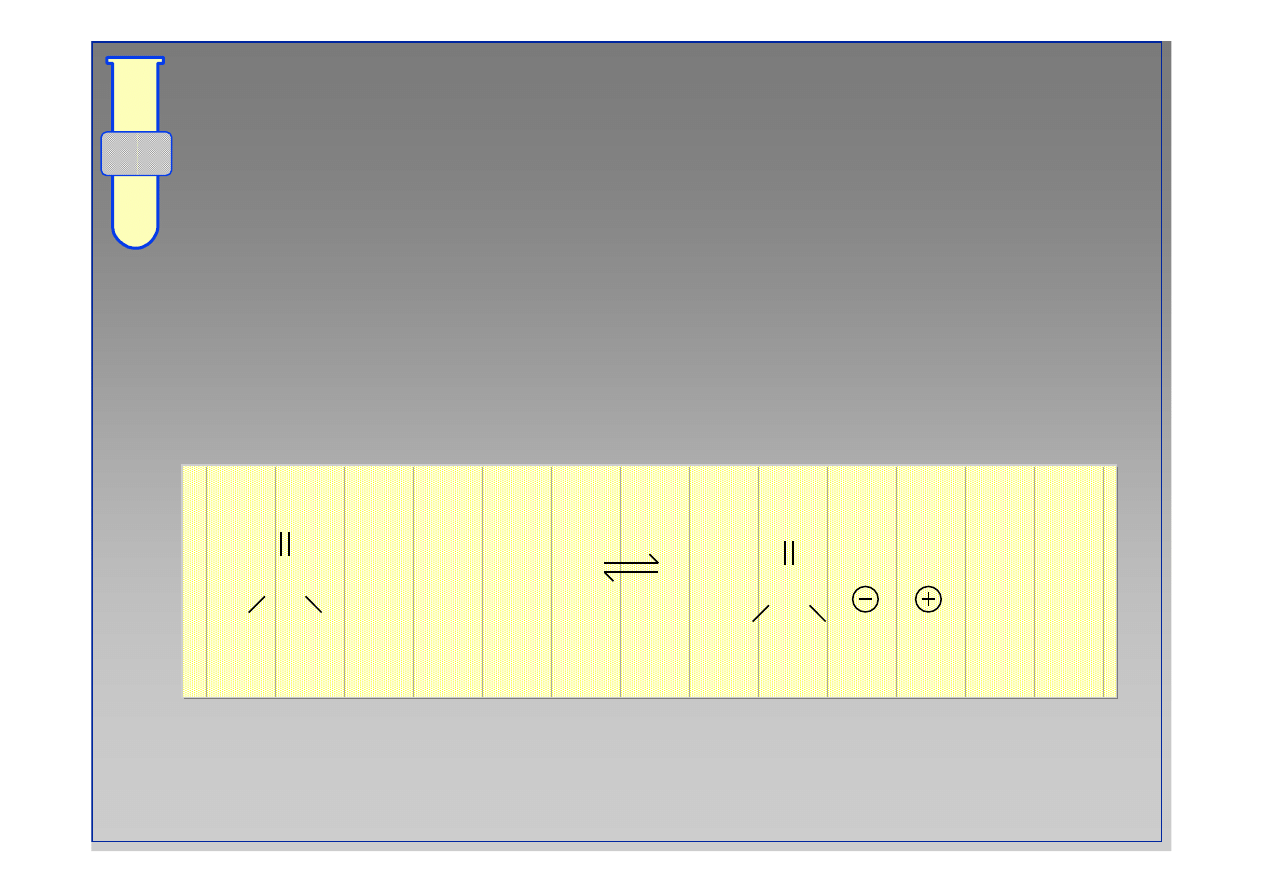
17
RJC
Otrzymywanie amid
Otrzymywanie amid
ó
ó
w bezpo
w bezpo
ś
ś
rednio z kwas
rednio z kwas
ó
ó
w
w
Reakcja kwasu karboksylowego (CO
Reakcja kwasu karboksylowego (CO
2
2
H) z
H) z
amoniakiem (NH
amoniakiem (NH
3
3
) nie prowadzi bezpo
) nie prowadzi bezpo
ś
ś
rednio do
rednio do
amidu (CONH
amidu (CONH
2
2
) z powodu konkurencyjnej reakcji
) z powodu konkurencyjnej reakcji
kwas
kwas
-
-
zasada.
zasada.
C
O
R
O
C
O
R
OH
NH
3
+
••
NH
4
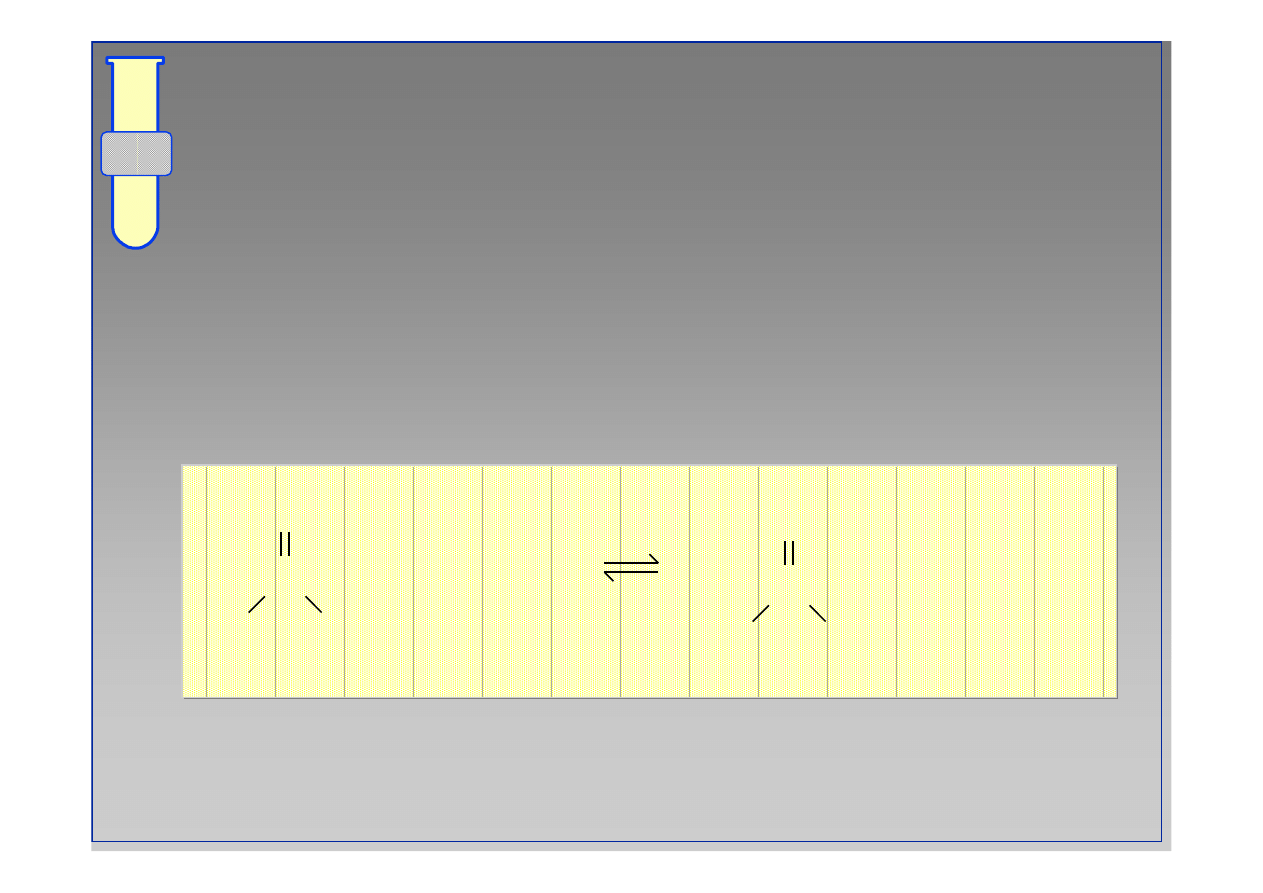
18
RJC
Otrzymywanie amid
Otrzymywanie amid
ó
ó
w z estr
w z estr
ó
ó
w
w
Amidy I
Amidy I
-
-
rz
rz
ę
ę
dowe (CONH
dowe (CONH
2
2
) mo
) mo
ż
ż
na otrzyma
na otrzyma
ć
ć
na
na
drodze reakcji estr
drodze reakcji estr
ó
ó
w (CO
w (CO
2
2
R) z amoniakiem (NH
R) z amoniakiem (NH
3
3
)
)
(tzw. aminoliza estr
(tzw. aminoliza estr
ó
ó
w).
w).
C
O
R
NH
2
C
O
R
OR
NH
3
+
••
ROH
+
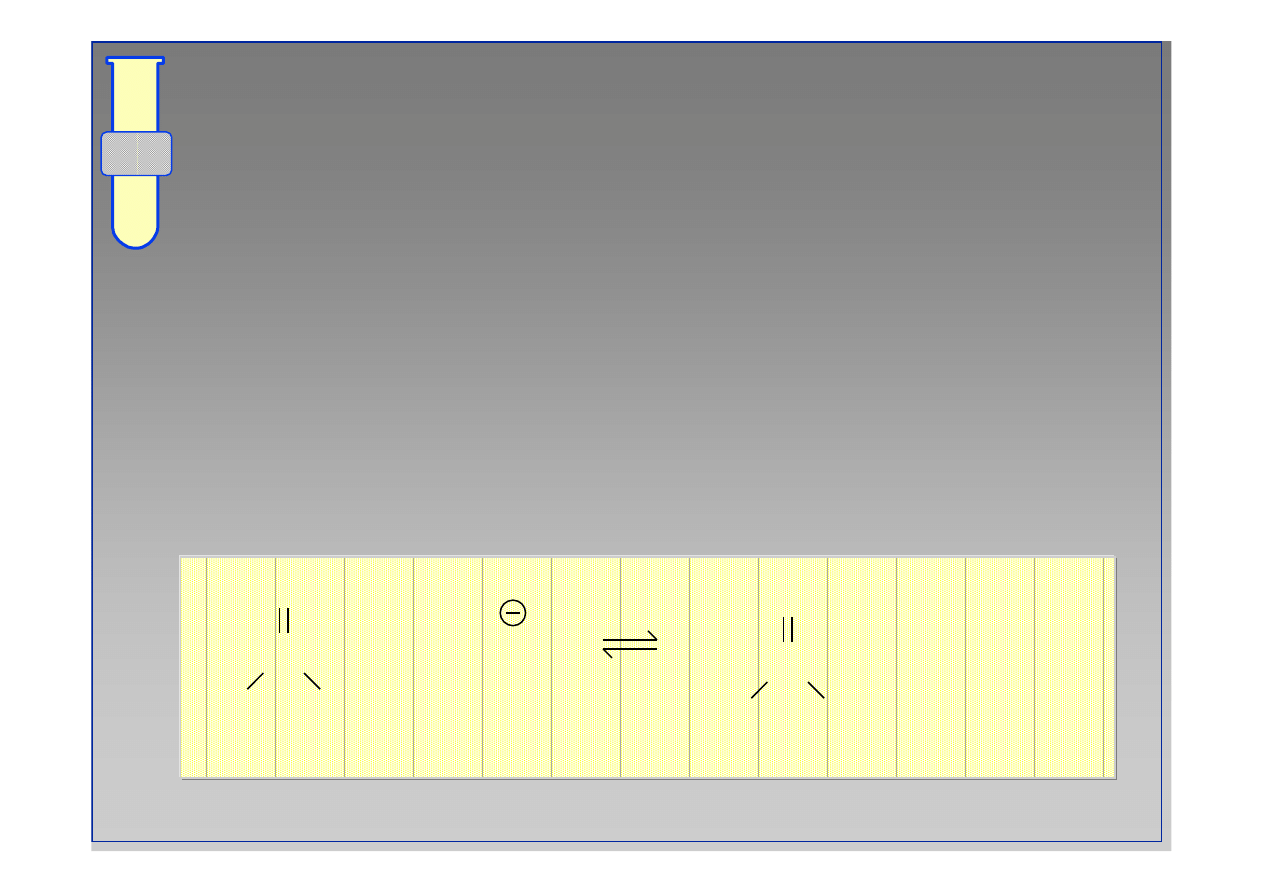
19
RJC
Zasadowa hydroliza estr
Zasadowa hydroliza estr
ó
ó
w/amid
w/amid
ó
ó
w/chlork
w/chlork
ó
ó
w
w
kwasowych
kwasowych
Hydroliza pochodnych kwasowych COX (gdzie X
Hydroliza pochodnych kwasowych COX (gdzie X
= OR, NH
= OR, NH
2
2
lub Cl) w
lub Cl) w
ś
ś
rodowisku zasadowym
rodowisku zasadowym
(zmydlanie) i nast
(zmydlanie) i nast
ę
ę
pne zakwaszenie roztworu
pne zakwaszenie roztworu
prowadz
prowadz
ą
ą
do odpowiedniego kwasu
do odpowiedniego kwasu
karboksylowego (CO
karboksylowego (CO
2
2
H). Zasadowa hydroliza
H). Zasadowa hydroliza
pochodnych kwasowych jest nieodwracalna !
pochodnych kwasowych jest nieodwracalna !
C
O
R
OH
C
O
R
X
HO
+
HX
+
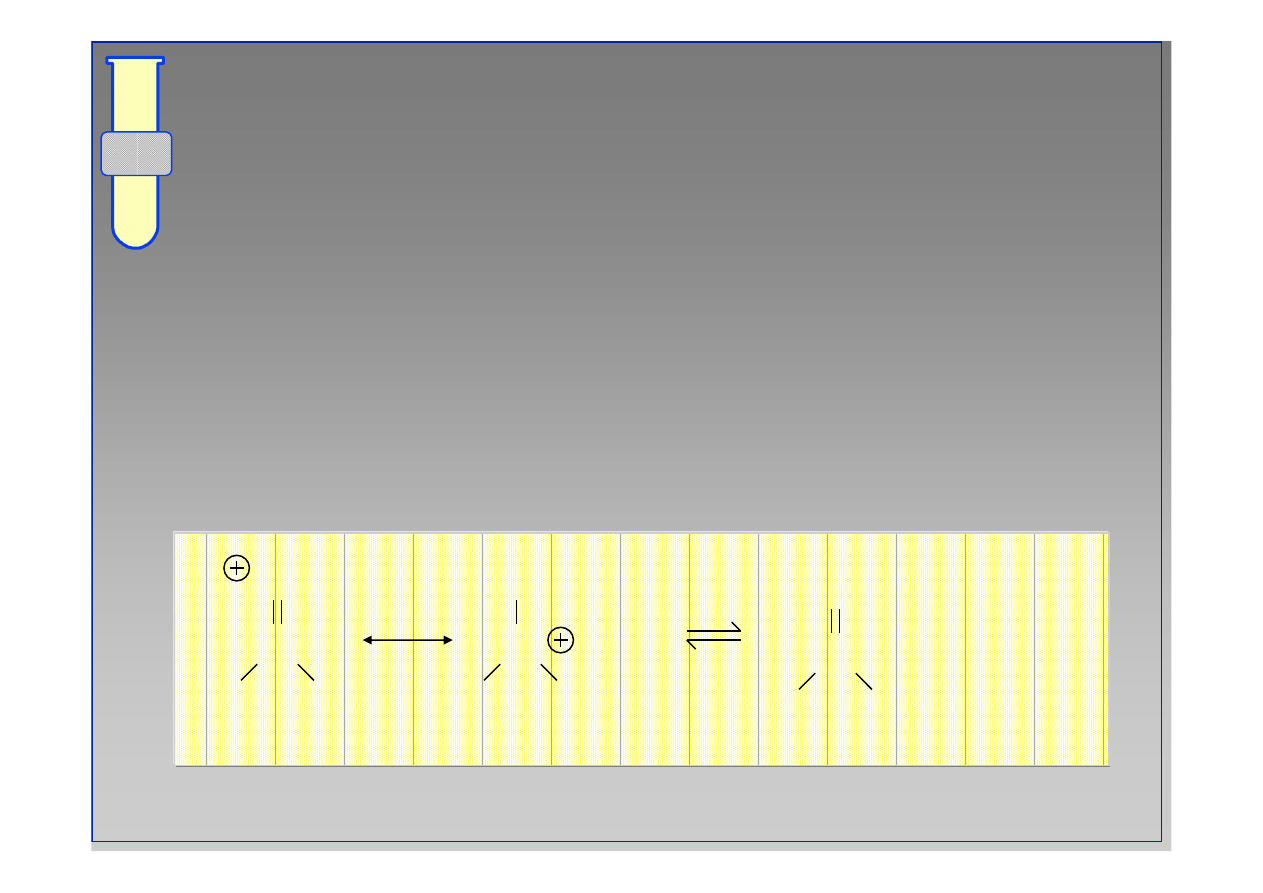
20
RJC
Kwasowa hydroliza
Kwasowa hydroliza
estr
estr
ó
ó
w/amid
w/amid
ó
ó
w/chlork
w/chlork
ó
ó
w kwasowych
w kwasowych
Hydroliza pochodnych kwasowych COX
Hydroliza pochodnych kwasowych COX
(gdzie X = OR, NH
(gdzie X = OR, NH
2
2
lub Cl) w
lub Cl) w
ś
ś
rodowisku
rodowisku
kwasowym prowadzi bezpo
kwasowym prowadzi bezpo
ś
ś
rednio do
rednio do
odpowiedniego kwasu karboksylowego (CO
odpowiedniego kwasu karboksylowego (CO
2
2
H).
H).
Jest to reakcja odwracalna !
Jest to reakcja odwracalna !
C
O
R
OH
C
O
H
R
X
H
2
O
HX
+
C
O
H
R
X
21
RJC
Podsumowanie
Podsumowanie
Podstawienie nukleofilowe przy grupie C=O
Etap określający szybkość reakcji i równowagi
Szybkość reakcji : czynniki steryczne vs czynniki
elektronowe
Chlorki kwasowe
Kwasy
Amidy
Estry
Hydroliza : zasadowa (zmydlanie) vs kwasowa
Podstawienie nukleofilowe przy grupie C=O
Etap określający szybkość reakcji i równowagi
Szybkość reakcji : czynniki steryczne vs czynniki
elektronowe
Chlorki kwasowe
Kwasy
Amidy
Estry
Hydroliza : zasadowa (zmydlanie) vs kwasowa
Wyszukiwarka
Podobne podstrony:
Prezentacja 18
podrecznik 2 18 03 05
9 1 18 Szkolenie dla KiDów
Planowanie strategiczne i operac Konferencja AWF 18 X 07
Przedmiot 18 1
18 piątek
AutomatykaII 18
18 Badanie słuchu fonemowego z uzyciem testu sylab nagłosowychid 17648 ppt
18 poniedziałek
18 10 2014 (1)
18 Prowadzenie procesów jednostkowych w technologii
18 FALA TETNAid 17717 Nieznany (2)
18 podejscie elastycznosciowe
więcej podobnych podstron