
Katedra i Zakład Chemii Medycznej
1
Ćwiczenie 11: Cukry i lipidy
I. Właściwości
redukcyjne sacharydów
1. Próba Fehlinga
Wykonanie:
Do jednej probówki wlać około 1 cm
3
roztworu glukozy, do drugiej roztworu fruktozy, do trzeciej
roztworu maltozy, a następnie do każdej dodać 1 cm
3
odczynnika Fehlinga I i 1 cm
3
odczynnika Fehlinga II.
Po wymieszaniu roztworów probówki wstawić do łaźni wodnej i ogrzewać do wrzenia. Wytrąca się czerwony
osad tlenku miedzi(I) (Cu
2
O).
Interpretacja:
Monosacharydy (aldozy, ketozy) posiadają właściwości redukcyjne - dają pozytywny wyniki reakcji
Fehlinga. Reagentami w tej reakcji są: odczynnik Fehlinga I (CuSO
4
) i odczynnik Fehlinga II (alkaliczny
roztwór winianu sodowo-potasowego). Aldozy ulegają tej reakcji ze względu na obecność grupy -CHO,
natomiast ketozy w środowisku alkalicznym ulegają izomeryzacji do odpowiedniej aldozy. Właściwości
redukcyjne wykazują także disacharydy, które posiadają wolną, niezablokowaną grupę -OH przy węglu
glikozydowym (półacetalowym).
2. Próba Benedicta
Wykonanie:
Do czterech probówek wlać po 2 cm
3
odczynnika Benedicta i dodać kolejno po 0,5 cm
3
roztworów
glukozy, fruktozy, maltozy i sacharozy. Probówki wstawić do wrzącej łaźni wodnej.
Czerwony lub
pomarańczowy osad tlenku miedzi(I) świadczy o właściwościach redukujących cukru. Tylko w przypadku
sacharozy reakcja nie zajdzie.
Interpretacja:
Odczynnik Benedicta zawiera węglan miedzi(II) w roztworze cytrynianu sodu. Cukier o właściwościach
redukujących redukuje Cu
2+
do Cu
+
. Reakcja ta należy do najbardziej czułych prób na właściwości redukcyjne
cukrów.
3. Próba &ylandera
Wykonanie:
Do probówki wlać ok. 2 cm
3
roztworu cukru redukującego (np. glukoza, fruktoza, maltoza, laktoza) i 1
cm
3
odczynnika Nylandera, a następnie ogrzewać na łaźni wodnej przez ok. 10 min. Po ogrzaniu roztwór
zmienia barwę przez żółto-brązową do czarnej.
Interpretacja:
Odczynnik Nylandera zawiera zasadowy azotan(V) bizmutu(III). W reakcji tej Bi
3+
ulega redukcji do
metalicznego Bi, który wytrąca się w postaci czarnego osadu.
4. Próba Barfoeda (odróżnianie monosacharydów od disacharydów redukujących)
Wykonanie:
Do kolejnych trzech probówek wlać po 1 cm
3
glukozy, laktozy i maltozy, a następnie po 0,5 cm
3
odczynnika Barfoeda i ogrzewać ok. 3 min. we wrzącej łaźni wodnej. W probówce zawierającej glukozę
wytrąca się ceglasty osad Cu
2
O.
Interpretacja:
Odczynnik Barfoeda zawiera octan miedzi(II) w kwasie mlekowym. W reakcji tej tylko glukoza redukuje
jony Cu
2+
do Cu
+
. Disacharydy po dłuższym ogrzewaniu (powyżej 15 min.), gdy ulegną hydrolizie do
monosacharydów, mogą dać wynik dodatni.
Reakcje barwne
1. Próba Molischa
Wykonanie:
Do probówki zawierającej 1 cm
3
roztworu monozy dodać 2 krople świeżo przygotowanego alkoholowego
roztworu α
α
α
α-naftolu (odczynnika Molischa). Następnie po wymieszaniu ostrożnie podwarstwić próbę 1-2
cm
3
stężonego H
2
SO
4
. Na granicy faz pojawiają się charakterystyczne barwne pierścienie.

Katedra i Zakład Chemii Medycznej
2
Interpretacja:
Odczynnik Molischa jest to alkoholowy roztwór α-naftolu. Odwodnione monozy pod wpływem H
2
SO
4
dają furfuralowe pochodne cukrów, które w reakcji z α-naftolem tworzą barwne połączenia zaliczane do
barwników triarylometanowych. Dodatni wynik tej reakcji mogą dawać także inne związki niecukrowe, jak
np. aldehydy, kwasy organiczne, aceton.
2. Próba Seliwanowa (odróżnianie aldoz od ketoz)
Wykonanie:
Przygotować dwie probówki a następnie do jednej dodać 1 cm
3
roztworu glukozy, do drugiej 1 cm
3
fruktozy. Do każdej dodać 1 cm
3
odczynnika Seliwanowa. Probówki umieścić w łaźni wodnej i ogrzewać do
wrzenia. W probówce zawierającej ketozę pojawia się charakterystyczna łososiowo-różowa barwa.
Interpretacja:
Odczynnikiem w tej reakcji jest roztwór rezorcyny (1,3-dihydroksybenzen) w stężonym HCl. W
środowisku stężonego HCl ketoheksozy ulegają odwodnieniu o wiele łatwiej niż aldoheksozy. Powstały
5-hydroksymetylofurfural tworzy z rezorcyną kompleks o czerwono-wiśniowej barwie.
3. Odróżnianie pentoz od heksoz (próba Biala)
Wykonanie:
Przygotować dwie probówki, do jednej wlać 1 cm
3
roztworu arabinozy, do drugiej glukozy. Do każdej
probówki dodać 1 cm
3
odczynnika orcynolowego (odczynnika Biala). Po wymieszaniu ogrzać probówki we
wrzącej łaźni wodnej. Produkty odwodnienia pentoz tworzą w tych warunkach kompleksy o barwie zielonej,
zaś w przypadku heksoz tworzą się połączenia o barwie żółtej.
Interpretacja:
Odczynnik Biala jest roztworem orcyny w stężonym kwasie solnym z dodatkiem FeCl
3
. W wysokiej
temperaturze pod wpływem odczynnika Biala pentozy przechodzą w furfural, natomiast heksozy w 5-
hydroksymetylofurfural.
4. Próba Moore′′′′a (odróżnianie cukrów redukujących od nieredukujących)
Wykonanie:
Do czterech probówek wlać kolejno po 1 cm
3
glukozy, maltozy, sacharozy i skrobi, a następnie po 1cm
3
20% roztworu KOH i wstawić na 2 min. do wrzącej łaźni wodnej. W probówkach, gdzie były cukry
redukujące, roztwór przybiera zabarwienie brunatno-czerwone, przy czym może wydzielać się zapach
przypalonego cukru (karmelu).
Interpretacja:
Stężone zasady powodują przemieszczanie się wiązania enolowego w inne pozycje łańcucha węglowego.
Wiązanie to może ulegać rozerwaniu, więc z cukrów mogą powstawać różne pochodne ulegające
polimeryzacji (powstawanie ciał żywicowatych). Roztwór cukru, początkowo bezbarwny, przybiera
zabarwienie żółte, a nawet brunatno-czerwone. Cukry nieredukujące, takie jak sacharoza i skrobia, reakcji tej
nie ulegają.
5. Próba jodowa z odczynnikiem Lugola (wykrywanie skrobi)
Wykonanie:
Do probówki wlać 1 cm
3
roztworu skrobi, 1 kroplę odczynnika Lugola i wymieszać. Pojawienie się
ciemnoniebieskiej barwy jest dowodem obecności skrobi.
Interpretacja:
Odczynnik Lugola zawiera jod w roztworze KI. Na skutek wbudowania się cząsteczek jodu w spiralne
łańcuchy amylozy skrobia tworzy barwny kompleks.
6. Hydroliza skrobi
Wykonanie:
Przygotować dwa rzędy probówek po 5 w każdym. Do probówek w pierwszym rzędzie wlać po 0,5 cm
3
1-molowego roztworu NaOH, a do drugiego rzędu po 2 krople odczynnika Lugola. Do zlewki odmierzyć 80
cm
3
1% kleiku skrobiowego i 20 cm
3
1-molowego H
2
SO
4
. Po wymieszaniu pobrać po 1 cm
3
i wlać do
pierwszej probówki z pierwszego i z drugiego rzędu. Następnie kleik w zlewce doprowadzić do wrzenia.
Od momentu wrzenia co 5 min. pobierać (ostrożnie) 2 cm
3
gorącej mieszaniny i rozlewać po 1 cm
3
do
Katedra i Zakład Chemii Medycznej
3
kolejnych probówek obu rzędów. Po zakończonej hydrolizie do probówek w pierwszym rzędzie (z roztworem
NaOH) dodać odczynnika Benedicta.
W pierwszym rzędzie w miarę ogrzewania obserwujemy coraz wyraźniejszą redukcję jonów Cu
2+
(ceglasty osad Cu
2
O), natomiast w drugim - na początku ciemnoniebieskie zabarwienie przechodzi przez
fiołkowe aż zanika.
Interpretacja:
Pod wpływem rozcieńczonych kwasów i temperatury skrobia ulega hydrolizie. W zależności od czasu
trwania początkowo następuje hydroliza do dekstryn, następnie do maltozy, a końcowym produktem jest
glukoza. Charakterystyczną właściwością skrobi jest jej barwna reakcja z odczynnikiem Lugola
(ciemnoniebieska). W miarę postępu hydrolizy barwa próby jodowej przechodzi w fiołkowo-niebieską
(amylodekstryny), brunatno-czerwoną (erytrodekstryny), jasnożółtą aż do zaniku reakcji z jodem.
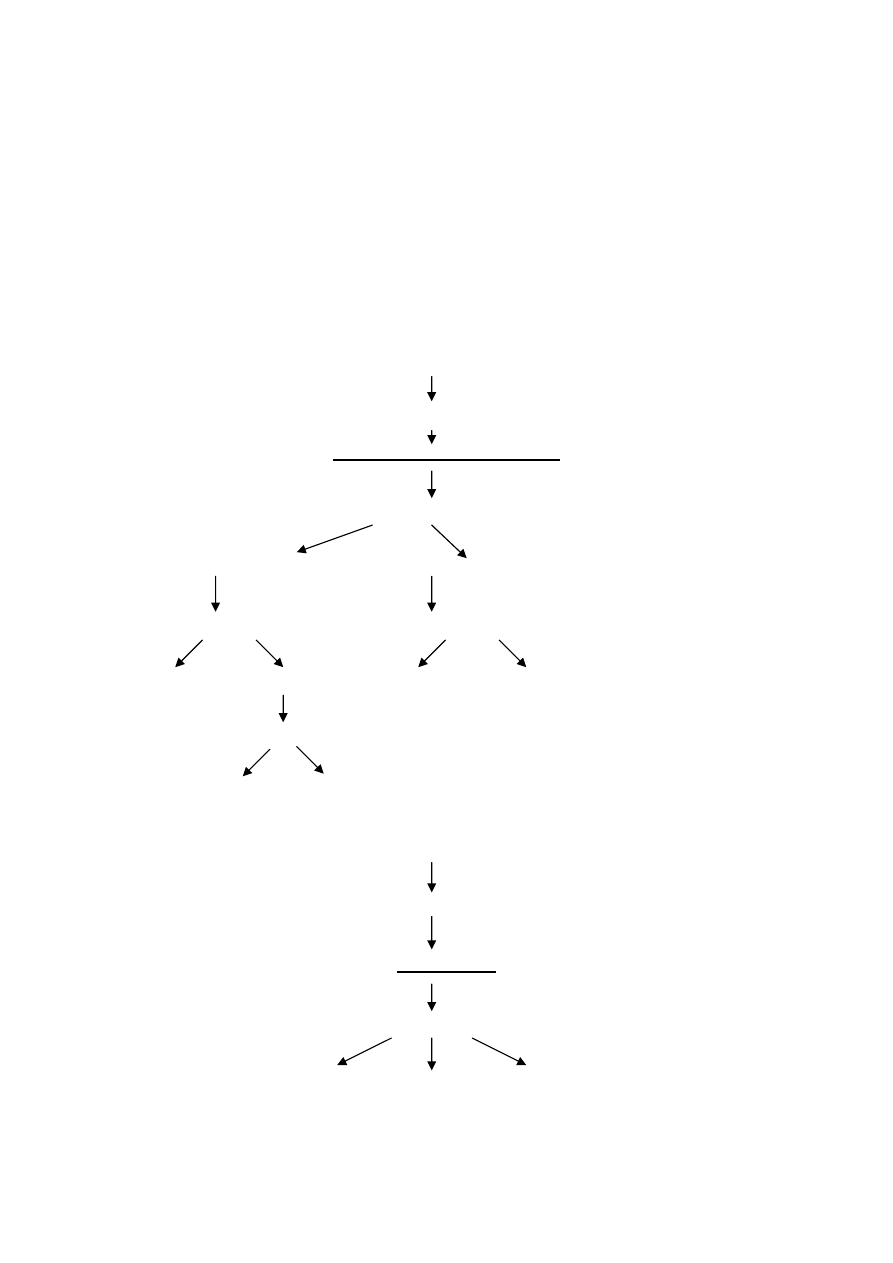
Schemat różnicowania cukrów
Próba Molischa
I. Rozpuszczalne w wodzie
monosacharydy, oligosacharydy
odczynnik Benedicta
redukujące (+) nieredukujące (-)
odczynnik Barfoeda odczynnik Seliwanowa
disacharydy (-) monosacharydy (+) sacharoza (+) trehaloza (-)
odczynnik Biala
heksozy pentozy
barwa żółta barwa zielona
Próba Molischa
II. Nierozpuszczalne w wodzie
polisacharydy
próba jodowa
skrobia glikogen celuloza, pektyny, inulina
mannany, gumy
barwa niebieska barwa czerwona bezbarwne

Katedra i Zakład Chemii Medycznej
4
II.
Lipidy
1. Rozpuszczalność tłuszczów
Wykonanie:
Przygotować cztery probówki i do każdej dać po 3-4 krople oleju. Następnie dodać do I probówki 2 cm
3
wody, do II – 2 cm
3
detergentu, do III – 2 cm
3
etanolu, a do IV – 2 cm
3
chloroformu. Probówki wstrząsać
przez kilka minut, a następnie wstawić do statywu i obserwować rozpuszczalność tłuszczu.
Interpretacja:
Tłuszcze nie rozpuszczają się w wodzie (probówka I), ulegają emulgacji przy zmniejszonym napięciu
powierzchniowym przez detergent (probówka II), w etanolu rozpuszczają się słabo (probówka III), natomiast
bardzo dobrze rozpuszczają się w chloroformie (probówka IV).
2. Próba akroleinowa na wykrywanie glicerolu
Wykonanie:
Do suchej probówki dać 2-3 krople oleju (lub glicerolu), a następnie około 1 g KHSO
4
i ogrzewać we wrzącej
łaźni wodnej. Wydzielają się dymy o drażniącej woni. U wylotu probówki umieścić pasek bibuły zwilżony
amoniakalnym roztworem AgNO
3
(odczynnik Tollensa). Obserwować zmianę barwy bibuły.
Interpretacja:
Glicerol jako składnik tłuszczu pod wpływem ogrzewania z wodorosiarczanem potasu traci 2 cząsteczki wody
i tworzy aldehyd akrylowy (akroleina), drażniący błony śluzowe. Akroleina, jako aldehyd, ma właściwości
redukujące. Pary akroleiny redukują jony Ag
+
do Ag
0
, obecne w bibule zwilżonej odczynnikiem Tollensa.
3. Redukcja nadmanganianu potasu (wykrywanie nienasyconych kwasów tłuszczowych)
Wykonanie:
W probówce rozpuścić 5 kropli oleju w 5 cm
3
1% roztworu Na
2
CO
3
. Próbę lekko ogrzać i dodać 1-2 krople
1% roztworu nadmanganianu potasu. Obserwować reakcję.
Interpretacja:
W oleju roślinnym występuje przewaga kwasów tłuszczowych nienasyconych o jednym lub kilku wiązaniach
podwójnych. Wiązania te łatwo ulegają utlenieniu, np. pod wpływem KMnO
4
. Nadmanganian odbarwia się,
ponieważ Mn
+7
redukuje się do Mn
+4
, a fioletowa barwa KMnO
4
zanika.
4. Próba Salkowskiego (wykrywanie cholesterolu)
Wykonanie:
Do suchej probówki wlać 1 cm
3
chloroformowego roztworu cholesterolu, a następnie 0,5 cm
3
stężonego
kwasu siarkowego. Próba zabarwia się na czerwono.
Interpretacja:
Pod wpływem stężonego kwasu siarkowego dochodzi do odciągnięcia cząsteczek wody i powstaje kwas
disulfonowy bicholestadienu (z 2 cząsteczek cholesterolu), który ma barwę czerwoną.
5. Próba Liebermanna-Burcharda (wykrywanie cholesterolu)
Wykonanie:
Do suchej probówki wlać 1 cm
3
chloroformowego roztworu cholesterolu i 10 kropli bezwodnika octowego
oraz 1-2 krople stężonego kwasu siarkowego. Próba zabarwia się na zielono.
Interpretacja:
W obecności bezwodnika kwasu octowego i stężonego kwasu siarkowego z cholesterolu powstaje kwas
monosulfonowy bicholestadienu, powodujący zielone zabarwienie próby.

Katedra i Zakład Chemii Medycznej
5
6. Enzymatyczne trawienie tłuszczów lipazą trzustkową
Wykonanie:
Do 2 probówek wlać po 2 cm
3
wyciągu z trzustki. Zawartość pierwszej probówki (próba kontrolna)
przegotować. Następnie do obu probówek dodać po 4 cm
3
mleka, po 1 kropli fenoloftaleiny i kroplami 1%
Na
2
CO
3
do uzyskania barwy różowej. Obie probówki wstawić na około 1 godzinę do łaźni wodnej o
temperaturze 37°C. Obserwować odbarwienie próby.
Interpretacja:
W reakcji tej mleko jest substratem dla lipazy, gdyż zawiera dobrze zemulgowany tłuszcz. Węglan sodu
alkalizuje środowisko do optimum działania lipazy (pH 8-9). W miarę działania lipazy (inkubacja)
odszczepiają się wolne kwasy tłuszczowe zakwaszające środowisko, co wykazuje odbarwienie wskaźnika
(fenoloftaleina).
Wyszukiwarka
Podobne podstrony:
Fizjologia Cwiczenia 11 id 1743 Nieznany
Biologia Cwiczenia 11 id 87709 Nieznany (2)
cwiczenie 11
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Patomorfologia cwiczenia ,11,11
MIKROEKONOMIA ĆWICZENIA 5 (11 12 2011)
cwiczenie 11 id 125145 Nieznany
Cwiczenie 11 Rozklad naprezen pod fundamentem ( )
cwiczenia 11
Ćwiczenia$ 11 OOŚ
Zachowania organizacyjne ćwiczenia( 11
Fizyka- Sprawdzenie prawa Hooke'a, !Nauka! Studia i nie tylko, Fizyka, Ćwiczenie 11 - moduł Younga
cwiczenie 11, GRUNTOZNASTWO, Gruntoznawstwo, Grunty 2 (mrr mrr)
Ćwiczenia, Instrukcja do ćwiczenia 7, Instrukcja do ćwiczenia 11:
więcej podobnych podstron